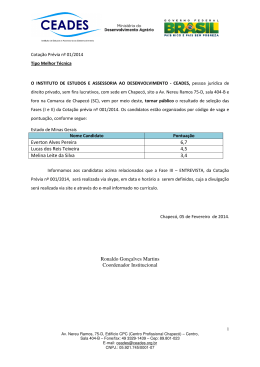
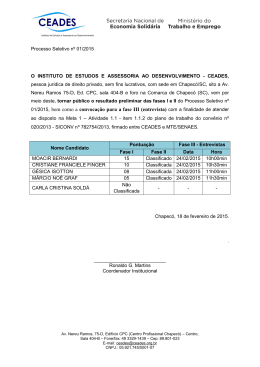
Universidade Comunitária Da Região De Chapecó Área De Ciências Exatas e Ambientais Engenharia Química – Engenharia de Alimentos Disciplina: Engenharia Bioquímica Professor: Murilo Cesar Costelli CULTIVO DE Bacillus polymyxa PARA A PRODUÇÃO DE ACETOÍNA BOTTON, ANDRESSA D1. e COSTELLI, MURILO C². 1 Acadêmico da Universidade Comunitária da Região de Chapecó - Unochapecó Professor da Universidade Comunitária da Região de Chapecó - Unochapecó E-mail para contato: [email protected] 2 RESUMO – Foi estudada a produção de 2,3-butanodiol pela bactéria Bacillus polymyxa onde foi utilizado glicose como fonte de carbono em condições aeróbias. Desenvolveu-se o processo nas condições de concentração inicial de glicose em 30 e 50 g/L e pH de 5.5 e 30 e 50 g/L com um pH de 6.5, com isso avaliou-se a influência da concentração inicial de substrato e do pH sobre a produção de 2,3-butanodiol nos ensaios em biorreator. Os efeitos principais do pH e concentração inicial de substrato mostraram-se significativos no modelo que foi proposto para uma concentração máxima de 2,3-butanodiol. Os resultados observdos indicaram que a produção de 2,3-butanodiol esteve associada ao crescimento celuolar nos ensaios em biorreator. 1. INTRODUÇÃO Por trás do gosto característico de uma bebida ou comida, há um sofisticado setor da indústria química para atrair o consumir, no qual oferece uma variedade de cheiros e sabores diferenciados (COSTELLI, 2005). Por esse motivo, as indústrias acrescentam aos alimentos aditivos, no qual são chamados de aromas, para intensificar ou mesmo mascarar o cheiro e o sabor dos seus produtos, aumentando assim o interesse dos consumidores (MARIOTTO, 2007). Os aromas podem ser produzidos por vias biotecnológicas ou por vias sintéticas, sendo que o processo biotecnológicos é o mais estudado nos dias de hoje, devido as vantagens que este processo apresenta (MARIOTTO, 2007). Diversas razões justificam a escolha dele para a produção de aromas, tais como, a complexidade estrutural que alguns compostos responsáveis por aromas de interesse comercial apresentam, inviabilizando sua produção por via sintética e assim tornando-se economicamente inviável; ou também o fato de que os aromas produzidos por vias biotecnológicas são considerados naturais, mesmo como aditivos, se forem produzidos por microrganismos GRAS (generally recognized as safe). Universidade Comunitária Da Região De Chapecó Área De Ciências Exatas e Ambientais Engenharia Química – Engenharia de Alimentos Disciplina: Engenharia Bioquímica Professor: Murilo Cesar Costelli Diversos grupos de pesquisa vêm estudando a produção de vários compostos naturais, que apresentam interesse comercial, por processos biotecnológicos. A acetoína e o 2,3butanodiol são exemplos destes compostos. Estes dois aromas são potencializadores de alguns produtos lácticos, no qual o queijo e a manteiga se destacam entre eles, além de serem produtos comuns das fermentações alcoólicas, que são componentes importantes nos vinhos (MARIOTTO, 2007). O crescimento desse setor da indústria deve-se ao fato de que os aromas sintéticos derivados da petroquímica ou de outra natureza sendo química vêm sendo substituídos gradativamente pelos de origem fermentativa ou enzimática, pelo fato, das novas exigências que o consumidor vem fazendo e também pelo fato de que os aromatizantes sintéticos são artificiais. No Japão, por exemplo, o consumo de aromas sintetizados quimicamente diminuiu em função de alguns regulamentos que vão favorecer os produtos que são fabricados com fontes naturais (COSTELLI, 2005). Tendo em vista a necessidade de novos produtos naturais na indústria alimentícia e o alto custo de extração e purificação destes, levando em conta essa época que se fala em qualidade de vida, diversos grupos de pesquisa vêm dedicando-se ao estudo de biprocessos que são capazes produzir compostos naturais de interesse comercial (COSTELLI, 2005). Na Universidade Federal de Santa Catarina, particularmente do Departamento de Engenharia Química e de Alimentos, o Laboratório de Engenharia Bioquímica possui uma linha de pesquisa relacionada com a produção de aromas onde seu início se deu com os estudos feitos por MORITZ (1998), onde a produção de acetoína foi investigada utilizando três leveduras, Hanseniaspora guilliermondii, Kloeckera apiculata e Hansenula anômala; e também por CARVALHO (1999), que estudou a produção de acetoína pela bactéria Lactobacillus lactis subsp. lactis biovar. diacetylactis. Logo após, foram desenvolvidos novos estudos por TEIXEIRA (1999), MELLO (2001) e TEIXEIRA et al. (2002) ainda referentes à produção por Hanseniaspora guilliermondii (MARIOTTO, 2007). O objetivo deste trabalho, foi estudar a produção de 2,3-butanodiol, que atua como potencializador de aromas de compostos como vinagre, café e principalmente a manteiga. Neste trabalho foi investigada a produção de 2,3-butanodiol pela bactéria Bacillus polymyxa, a partir disso foi avaliado a influência do pH inicial, o tempo de cultivo do inóculo na cinética Tem dados para avalair este objetivo? Não forneci esta informação? Por que indicar estas informaçõe s referentes a outro aroma? Qual a relação? Universidade Comunitária Da Região De Chapecó Área De Ciências Exatas e Ambientais Engenharia Química – Engenharia de Alimentos Disciplina: Engenharia Bioquímica Professor: Murilo Cesar Costelli de crescimento da bactéria e na produção de 2,3-butanodiol e a concentração inicial de substrato que é a glicose (COSTELLI, 2005). 2. RESULTADOS E DISCUSSÕES Com o objetivo de verificar características da bactéria Bacillus polymyxa levando em conta seu crescimento e produção de 2,3-butanodiol foram realizados alguns ensaios, no qual avaliou-se a influência do pH inicial e da concentração inicial de glicose. Na Tabela 2.1 são apresentados os resultados obtidos nos ensaios. Tabela 2.1 – Resultados obtidos nos ensaios. Ensaio Glicose (g/L) A B C D 30 50 30 50 pH inicial 5,5 5,5 6,5 6,5 μ(h-1) Xmáx(g/L) C 2,3- Butanodiol (g/L) 0,23 0,27 0,33 0,41 1,17 1,34 3,49 3,49 2,33 3,07 1,25 2,37 Observando-se a Tabela 2.1 percebe-se que a concentração máxima em 2,3-butanodiol foi produzida no ensaio B (concentração inicial de glicose em 50 g/L e pH 5,5), já as concentrações celulares máximas foram obtidas nos ensaios C e D (concentração inicial de glicose em 30 g/L e 50 g/L e pH de 6,5 consecutivamente). No entanto, as maiores velocidades específicas de crescimento foram obtidas nos ensaios com o pH de 6,5, conforme mostrado da Tabela 2.1. As Figuras 2.1 a 2.4 apresentam as curvas de consumo de substrato, crescimento celular e produção de 2,3-butanodiol para os ensaios. Universidade Comunitária Da Região De Chapecó Área De Ciências Exatas e Ambientais Engenharia Química – Engenharia de Alimentos Disciplina: Engenharia Bioquímica Professor: Murilo Cesar Costelli Figura 2.1- Produção de 2,3-butanodiol e células e consumo de glicose para o ensaio A ([glicose]=30 g/L; pH=5,5) Figura 2.2- Produção de 2,3-butanodiol e células e consumo de glicose para o ensaio B ([glicose]=50 g/L; pH=5,5) Universidade Comunitária Da Região De Chapecó Área De Ciências Exatas e Ambientais Engenharia Química – Engenharia de Alimentos Disciplina: Engenharia Bioquímica Professor: Murilo Cesar Costelli Figura 2.3 - Produção de 2,3-butanodiol e células e consumo de glicose para o ensaio C ([glicose]=30 g/L; pH=6,5) Figura 2.4 - Produção de 2,3-butanodiol e células e consumo de glicose para o ensaio D ([glicose]=50 g/L; pH=6,5) Universidade Comunitária Da Região De Chapecó Área De Ciências Exatas e Ambientais Engenharia Química – Engenharia de Alimentos Disciplina: Engenharia Bioquímica Professor: Murilo Cesar Costelli Conforme observado nas Figuras 2.1 a 2.4, verifica-se que a produção de 2,3butanodiol teve seu início na fase estacionária, exceto no ensaio B, no qual teores do produto começaram a ser detectados ainda na fase exponencial de crescimento. O crescimento celular foi bem lento nos ensaios com o pH 5.5 (Figuras 2.1 e 2.4), podendo-se concluir que as bactérias crescem mais lentamente quando o pH for baixo. Nos ensaios com o pH 5.5 (Figuras 2.1 e 2.2) foram finalizados após 43 horas sem que o substrato tenha sido totalmente consumido, pois acima deste valor a redução do volume do meio de cultivo passa a ser considerável, já nos ensaios com o pH de 6.5 (Figura 2.3 e 2.4) houve um consumo total de substrato. Na Tabela 2.2 são apresentados o fator de conversão substrato em células (Y X/S) e o fator de conversão substrato em produto (YP/S) para os ensaios. Em alguns experimentos não foi possível determiná-los porque houve uma grande dispersão dos pontos. Tabela 2.2 - Fator de conversão substrato em células (Y X/S), fator de conversão substrato em produto (YP/S) para os ensaios. De acordo com a Tabela 2.2, no ensaio A com pH 5,5 o fator de conversão de substrato em produto (YP/S) foi maior que o aobtido nos ensaios C e D com pH 6,5. Universidade Comunitária Da Região De Chapecó Área De Ciências Exatas e Ambientais Engenharia Química – Engenharia de Alimentos Disciplina: Engenharia Bioquímica Professor: Murilo Cesar Costelli Figura 2.5 - Gráfico de ln x vs tempo para o Ensaio A Figura 2.6 - Gráfico de ln x vs tempo para o Ensaio B Universidade Comunitária Da Região De Chapecó Área De Ciências Exatas e Ambientais Engenharia Química – Engenharia de Alimentos Disciplina: Engenharia Bioquímica Professor: Murilo Cesar Costelli Figura 2.7 - Gráfico de ln x vs tempo para o Ensaio C Figura 2.8 - Gráfico de ln x vs tempo para o Ensaio D Não é neste tipo de gráfico que se derermina Ks. Nas Figuras 2.5 a 2.8 acima pode-se observar que a partir do gráfico de ln x vs tempo obtem-se os valores de Ks com a equação da reta, onde percebe-se que o valor de Ks é maior com pH de 6.5, ou seja, um pH mais elevado. Levando em conta as concentrações iniciais, observa-se que o maior valor de Ks deuse em concentrações altas que foi na de 50 g/L de glicose. Universidade Comunitária Da Região De Chapecó Área De Ciências Exatas e Ambientais Engenharia Química – Engenharia de Alimentos Disciplina: Engenharia Bioquímica Professor: Murilo Cesar Costelli 3. CONCLUSÃO A partir dos dados obtidos, conclui-se que: A variação de pH inicial teve uma forte influência quando falamos na eficiência do processo. O pH de 6.5 se apresentou mais eficiente quando comparado com o pH de 5.5. A variação da concentração inicial não apresentou influencia tão significativa no processo quanto o pH. O substrato foi consumido por completo nos ensaios C e D, estes realizados em pH 6,5. Universidade Comunitária Da Região De Chapecó Área De Ciências Exatas e Ambientais Engenharia Química – Engenharia de Alimentos Disciplina: Engenharia Bioquímica Professor: Murilo Cesar Costelli 4. REFERÊNCIAS COSTELLI, M. C. Cultivo de Bacillus polymyxa para a produção de acetoína: influência do pH e do tempo de cultivo do inóculo. 2005. 77 f. Dissertação (Mestrado em Engenharia Química) - Universidade Federal de Santa Catarina – UFSC, Florianópolis. Apenas uma referencia? Não encontrou outras? Impossível aceitar um trabalho assim! 4. ANEXOS ?
Download