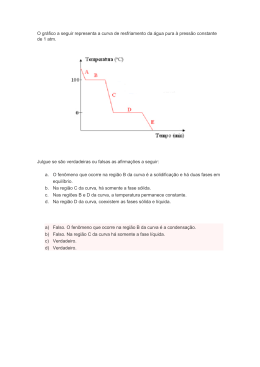
ASSOCIAÇÃO BRASILEIRA DE QUÍMICA SEÇÃO REGIONAL DE MATO GROSSO X OLIMPÍADA MATO-GROSSENSE DE QUÍMICA FASE II – 10/10/2015 PROVA – 2ª SÉRIE Prezado(a) Estudante! Você está participando da Fase II da X Olimpíada Mato-Grossense de Química. Você conquistou esse direito ao ser classificado na primeira fase. Tivemos mais de 13000 inscritos na fase I; destes, cerca de 1400 foram classificados para a Fase II. Nesta fase II, serão classificados os 50 alunos (25 da 1ª série e 25 da 2ª série) para realizarem as provas da Olimpíada Brasileira de Química de 2016, que será realizada no último sábado de agosto. Queremos parabenizá-lo pela classificação para a Fase II e, ao mesmo tempo, agradecer por ter aproveitado a oportunidade de participar do evento e desejar-lhe muito sucesso nesta fase! Esperamos que, ao resolver esta prova, possa adquirir vários conhecimentos úteis sobre a ciência Química, como ela está presente no nosso cotidiano e como ela pode contribuir para a melhoria da qualidade de vida. Esta prova é constituída de três partes. A primeira parte contém dez questões de verdadeiro ou falso, valendo 30 pontos; a segunda, cinco questões de múltipla escola com quatro alternativas, valendo 50 pontos; e a terceira, duas questões descritivas, valendo ao todo 20 pontos. Resolva as questões e depois marque no cartão resposta as questões das duas primeiras partes. As duas questões da terceira parte devem ser respondidas nas folhas timbradas, uma em cada folha, podendo usar o verso. Depois de respondidas as questões, junte as folhas timbradas e o cartão resposta e entregue para o fiscal, não esquecendo de preencher corretamente seus dados. Você tem três horas para resolver toda a prova e preencher a folha resposta. Segundo o nosso calendário, queremos divulgar os resultados até o dia 14 de novembro. A a premiação no dia 04 de dezembro no Auditório da Cultura, UFMT. Acompanhe as notícias das Olimpíadas de Química em http://matogrosso.obquimica.org/ (ou http://www.obquimica.org/ Clique em Estaduais/ Mato Grosso). A Coordenação LUZ, CIÊNCIA E VIDA “Luz, ciência e vida” é o tema da 12ª Semana Nacional de Ciência e Tecnologia - SNCT 2015 e baseia-se na decisão da Assembleia Geral das Nações Unidas, que proclamou 2015 como o Ano Internacional da Luz, com objetivo de celebrar a luz como matéria da ciência e do desenvolvimento tecnológico. A luz tem importância primordial para todos os seres vivos, como fonte de energia para a fotossíntese e para o aquecimento da Terra. São produzidas muitas fontes de luz artificial, envolvendo desde as antigas lamparinas a querosene, a energia elétrica, lâmpadas LED, fibras ópticas. A luz está relacionada ao tratamento da água, conservação de alimentos, produção de materiais de grande importância para o conforto da humanidade. A Química entra neste contexto com a missão de aprimorar e otimizar os processos, melhorando a quantidade e a qualidade dos produtos, gerando cada vez menos resíduos e, no casos desses, dar um fim apropriado para os mesmos, minimizando a poluição do ambiente. PRIMEIRA PARTE (30,0 pontos): Julgue as questões a seguir marcando Verdadeiro ou Falso Questão 1 – Observe o gráfico de solubilidade do cloreto de amônio: Em um dia quente (40 ºC) e com a intenção de prepararmos solução saturada desse uma sal devemos colocar em um balão volumétrico de 1 L, 45,8 g do NH4Cl e completar o volume, até a marca de calibração, com água destilada. ( ) Verdadeiro ( ) Falso Questão 2 – Em uma prateleira do laboratório onde estás fazendo determinada prática observas um frasco onde pode-se ler: Seu colega afirma que a concentração molar do ácido nítrico, ali contido, é de 15 mol/L. (Dados: H = 1; N = 14; O = 16) ( ) Verdadeiro ( ) Falso Questão 3 – A solubilidade do cloreto de potássio é mostrada no gráfico abaixo. À 30 ºC podem ser formadas as soluções 1, 2 e 3 desse sal, conforme especificadas no gráfico: ( . ) Verdadeiro ( ) Falso Questão 4 - O volume de etanol (C2H5OH), que deve ser adicionada a 10 L de água para que a temperatura de solidificação seja 4,05 oC inferior à temperatura da água pura, é igual a 1250 mL. Dados: Kc (constante crioscópica) da água igual a 1,863; C = 12; H = 1; O = 16; detanol = 800kg/m3. ( ) Verdadeiro ( ) Falso Questão 5 – Com base na tabela de entalpia de formação de algumas substâncias: FÓRMULA ΔH°f (kJ/mol) Dióxido de carbono CO2(g) ?? Água H2O(g) 285 Etanol C2H5OH(l) 276 SUBSTÂNCIA Sabendo que a entalpia de combustão do etanol (C2H5OH) vale 1366 kJ/mol, o valor do calor de formação do dióxido de carbono é 561 kJ/mol. ( ) Verdadeiro ( ) Falso Questão 6 – Dadas as equações termoquímicas: I - S(s) + O2(g) SO2(g) ......................H1 = 297 kJ II - SO2(g) + ½ O2(g) SO3(g) ..........H2 = ?? III - S(s) + 3/2 O2(g) SO3(g) ..........H3 = 395 kJ O calor de reação (H2) indicada pela reação II vale 98 kJ. ( ) Verdadeiro ( ) Falso Questão 7 – Seja a reação elementar, não balanceada: NO(g) + Br2(g) NOBr (g) podemos afirmar que a velocidade de desaparecimento de Br 2 é igual à metade da velocidade de aparecimento de NOBr. ( ) Verdadeiro ( ) Falso Questão 8 – Para que uma reação ocorra, uma série de condições deve ser satisfeita. Entre elas: “quanto maior o estado entrópico dos reagentes, mais rápida será a reação”. Esta condição se relaciona à fase de agregação (estado físico) dos reagentes. ( ) Verdadeiro ( ) Falso Questão 9 – A expressão da constante de equilíbrio, em termos das concentrações molares, para uma dada reação é representada por: A soma dos coeficientes estequiométricos dos reagentes e produtos da reação é igual a 6 (seis). ( ) Verdadeiro ( ) Falso Questão 10 – O zinco é o metal mais eficiente em termos de custo e do meio ambiente como proteção do aço contra corrosão. Com base na tabela abaixo poder-se-ia utilizar não só o zinco, mas todos os demais metais listados (Pb, Mg, Cu) para proteger o ferro da corrosão. Dado: Zn2+ + 2e Zno ( ) Verdadeiro ( Eo = 0,76 V Semi-reação Eo (V) Fe2+ + 2e Feo 0,44 Pb2+ + 2e Pbo 0,13 Mg2+ + 2e Mgo 2,34 Cu2+ + 2e Cuo + 0,15 ) Falso SEGUNDA PARTE (50,0 PONTOS) – MARQUE A ALTERNATIVA CORRETA (Somente uma em cada questão). Questão 11 – A decomposição do pentóxido de dinitrogênio é representada pela equação: 2 N2O5(g) 4 NO2(g) + O2(g). Ajustando as condições experimentais de modo que essa decomposição produza 6,4 g de gás oxigênio por minuto, a velocidade da decomposição nessas condições, desse óxido binário do nitrogênio, em mol/min é: (Dados: O = 16; N = 14) a) 0,4 b) 4.103 c) 0,32 d) 0,81 Questão 12 – O pH de uma solução de ácido clorídrico é 3. Adicionando-se quatro litros de água pura a um litro da solução de ácido clorídrico, qual o novo pH? Dado: log 2 = 0,3 a) 4,5 b) 4,8 c) 5,0 d) 3,7 Questão 13 – Para a reação em fase gasosa: CO + H2O ⇌ CO2 + H2, sabe-se que em um recipiente de 10 litros de capacidade, mantido a 727 ºC estão em equilíbrio 0,40 mol de CO; 0,40 mol de H2O; 0,07 mol de CO2 e 0,07 mol de H2. Os valores de Kp e Kc na temperatura mencionada para essa reação, se relacionam como: a) Kp > Kc b) Kp < Kc c) Kp = Kc d) Kp = 1/Kc Questão 14 – Para o seguinte equilíbrio heterogêneo: 2 C(s) + O2(g) ⇌ 2 CO (g) Um aumento de pressão a) Diminui a eficiência da produção do monóxido de carbono. b) Desloca o equilíbrio no sentido dos produtos. c) Não altera a posição do equilíbrio. d) Altera o valor da constante de equilíbrio do sistema. Questão 15 – Numa pilha eletrolítica os eletrodos formados pelos metais cádmio (Cd) e cobre (Cu) estão mergulhados em soluções de seus sais, conforme mostra a figura abaixo: Assinale a equação global da pilha com a respectiva ddp da mesma: a) Cd2+ + 2e → Cu2+ + 2e .................ΔE = + 0,06V b) Cd(s) + Cu2+ → Cd2+ + Cu(s) ......ΔE = + 0,74V c) Cd2+ + Cu(s) → Cu2+ + Cd(s) ........ ΔE = 0,06V d) Cd(s) + Cu(s) → Cd2+ + Cu2+ ......... ΔE = 0,74V TERCEIRA PARTE (20,0 PONTOS) – Responda as questões abaixo nas folhas timbradas. Use uma folha para cada questão. Questão 16 – Para a reação de formação de água: 2 H2(g) + O2(g) ⇌ 2 H2O(g) Se o Kc = 2,46 . 1081 na temperatura de 27 °C. a) Quanto valerá o Kp? b) Qual será o valor de Kc para a reação: H2(g) + ½ O2(g) ⇌ H2O(g) (Dado:√24,6 = 4,96 ) Questão 17 – a) Qual é a meia-vida de uma reação de primeira ordem para a qual kv = 3,465x102 min1? b) Uma certa reação é de primeira ordem em relação a A, segunda ordem em relação a B, e terceira ordem com relação a C. b.1) Escreva a Lei de velocidade dessa reação. b.2) Qual a influência sobre a velocidade da reação se duplicamos [A], mantendo todas as demais condições constantes? b.3) Qual a influência sobre a velocidade da reação se duplicamos [B], mantendo todas as demais condições constantes?
Download