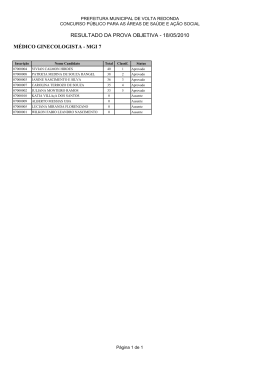
III SIMPÓSIO SOBRE A BIODIVERSIDADE DA MATA ATLÂNTICA. 2014 403 Confecção de Chaves Interativas de Identificação para as Famílias de Anisoptera e os Gêneros da Família Aeshnidae do Espírito Santo D. F. G. Pereira¹*, K. S. Furieri² & F. F. Salles³ 1 Laboratório de Sistemática e Ecologia de Insetos – Centro Universitário do Norte do Espírito Santo; ²Centro Universitário do Norte do Espírito Santo; ³Centro Universitário do Norte do Espírito Santo *Email para correspondência: [email protected] Introdução Odonata é uma ordem de insetos com cerca de 5700 espécies descritas no mundo (Clausnitzer et al. 2009), composta por animais popularmente conhecidos no Brasil como libélulas. Possuem alto apelo ao público, não somente por sua beleza, mas também por consumirem uma grande quantidade de invertebrados maléficos ao homem, como mosquitos (Brusca & Brusca 2011), e vem sendo cada vez mais utilizados como indicadores de qualidade ambiental e de biótopos (Clark & Samways 1996). Presentes em todos os continentes, exceto a Antártica (Clausnitzer et al. 2009), colonizam ambientes aquáticos diversos, quando imaturos, e suas proximidades, quando adultos, com algumas espécies colonizando ambientes fitotélmicos (Buzzi 2010). São exclusivamente carnívoros e predadores muito ativos, tanto larva quanto imago, utilizando seu lábio modificado em estrutura preênsil e protrátil, recoberta de espinhos (Odonata, do gregoodontos, dente +ata, caracterizado por), muito eficiente para captura de presas. Adultos são delgados e voadores velozes, enquanto larvas são aquáticas e vivem geralmente associadas a algum substrato (Hamada & Ferreira-Kepler 2012). O grupo possui duas subordens presentes no Brasil. A subordem Zygoptera é caracterizada por adultos com olhos compostos protuberantes muito espaçados e asas anteriores e posteriores com formato e tamanho semelhantes, e suas larvas possuem brânquias lamelares externas na extremidade posterior do corpo, que auxiliam em movimentos natatórios (Mcpeek et al. 1996). A subordem Anisoptera é caracterizada por adultos com olhos compostos que ocupam quase toda a região da cabeça e muito unidos, às vezes se tocando, e asas anteriores e posteriores com formato e tamanho diferentes, enquanto suas larvas possuem brânquias retais e se movimentam por jato propulsão - um mecanismo que consiste em expulsar rapidamente a água do reto (Buzzi 2010).Este trabalho tem como 403 404 PEREIRA ET AL.: CHAVES INTERATIVAS DE IDENTIFICAÇÃO. objetivo a produção de chaves interativas para identificação de libélulas do Espírito Santo pois para que a identificação do material coletado seja feita corretamente, faz-se necessária a disponibilidade de chaves de identificação locais, evitando confusões frequentes que ocorrem quando os indivíduos são identificados com chaves desatualizadas, genéricas ou de outras regiões geográficas. Para este trabalho, as chaves contemplam as quatro famílias de Anisoptera que ocorrem no Espírito Santo (Aeshnidae, Corduliidae, Gomphidae e Libellulidae) e os gêneros da família Aeshnidae. Materiais e Métodos Listagem de Caracteres. As listas de caracteres dos táxons incluídos na chave foram elaboradas com base na literatura, utilizando descrições dos grupos e chaves de identificação prévias. A principal fonte de informações foi o livro “Dragonfly Genera of the New World” (Garrison, Ellenrieder, Louton, 2006). Elaboração das Chaves. As chaves são do tipo interativas, confeccionadas no software package DELTA (DEscription Language for TAxonomy) com a ajuda do pacote Intkey.ink. Resultados e Discusssão Foi concluída, por meio de buscas em artigos e revistas científicos, a lista de gêneros de Aeshnidae que ocorrem no Espírito Santo, sendo eles: Anax (uma espécie), Castoraeschna (duas espécies), Coryphaeschna (três espécies), Gynacantha (nove espécies), Neuraeschna (uma espécie), Remartinia (uma espécie), Rhionaeschna (duas espécies), Staurophlebia (uma espécie) e Triacanthagyna (três espécies). A confecção das chaves interativas de identificação, no software DELTA foi iniciada através do levantamento de caracteres. Foram concluídas as chaves correspondentes à identificação de famílias de Anisoptera (com 13 caracteres levantados, anexo 1), bem como de gêneros pertencentes à família Aeshnidae (com 28 caracteres levantados, anexo 2). Conclusão A taxonomia de Anisoptera é feita quase exclusivamente em relação a machos adultos, dos quais as principais estruturas analisadas são as asas e a genitália acessória. Embora outros caracteres sejam relevantes, tais como coloração, sua identificação pode ser prejudicada III SIMPÓSIO SOBRE A BIODIVERSIDADE DA MATA ATLÂNTICA. 2014 405 em exemplares antigos ou de acordo com o tipo de fixação a que o espécime seja submetido. Em comparação com as tradicionais chaves dicotômicas, as chaves interativas possuem mecanismos que facilitam e aceleram o processo de identificação, por não ter uma ordem pré-definida a seguir, além de estarem disponíveis e acessíveis globalmente através da rede mundial de computadores. Agradecimentos Gostaríamos de agradecer à Universidade Federal do Espírito Santo (UFES) e à FAPES pela infraestrutura e logística, e aos integrantes do Laboratório de Sistemática e Ecologia de Insetos (LABSEI) do Centro Universitário do Norte do Espírito Santo (CEUNES). Literatura Citada Brusca, R. C. & Brusca, G. J. 2011. Invertebrados, 2ª Ed., p.620. Editora: Guanabara Koogan Buzzi, Z. J. 2010. Entomologia Didática, 5ª Ed. Editora da Universidade Federal do Paraná. Clausnitzer et al. Odonata enter the biodiversity crisis debate: the first global assessment of an insect group. Biological Conservation, volume 142, 2009, issue 8, PP. 1864– 1869. Clark, T. E. & Samways, M. J. Dragonflies (Odonata) as Indicators of Biotope Quality in the Kruger National Park, South Africa. The Journal of Applied Ecology, Vol. 33, 1996, No. 5, PP. 1001-1012. Costa, J. M., Machado, A. B. M., Lencioni, F. A. A. & Santos, T. C. Diversidade e distribuição de Odonata (Insecta) no estado de São Paulo, Brasil: parte I – lista de espécies e registros bibliográficos. Publicações Avulsas do Museu Nacional, 2000, n.80, PP. 1-27. Costa, J. M. & Oldrini, B. B. Diversidade e distribuição dos Odonata (Insecta) no estado do Espírito Santo, Brasil. Publicações Avulsas do Museu Nacional, 2005, n. 107. De Marco Jr, P. & Vianna, D. M. Distribuição do esforço de coleta de Odonata no Brasil – subsídios para escolha de áreas prioritárias para levantamentos faunísticos. Instituto de Ciências Biológicas – UFMG, 2005. 405 406 PEREIRA ET AL.: CHAVES INTERATIVAS DE IDENTIFICAÇÃO. Garrison, R. W., Ellenrieder, N. V. & Louton, J. A. (2006). Dragonfly genera of the New World – an illustrated and annotated key to Anisoptera. Johns Hopkins University Press. Hamada, N. & Ferreira-Kepler, R. L. (2012). Guia ilustrado de insetos aquáticos e semiaquáticos da Reserva Florestal Ducke. PP 38-39. Editora da Universidade Federal do Amazonas. Heckman, C. W. (2006). Encyclopedia of South American aquatic insects: Odonata – Anisoptera. Editora Springer. Mcpeek, M. A., Schrot, A. K. & Brown, J. M. Adaptation to predators in a new comunity: swimming performance and predator avoidance in Damselflies. Ecology, Vol. 77, No. 2, pp. 617-629, 1996. Monteiro-Júnior et al. Effect of vegetation removal for road building on richness and composition of Odonata communities in Amazonia, Brazil. International Journal of Odonatology, Vol. 16, No. 2, PP. 135-144, 2013. III SIMPÓSIO SOBRE A BIODIVERSIDADE DA MATA ATLÂNTICA. 2014 407 Apêndice 1 - Lista de Caracteres das Famílias de Anisoptera #1. Olhos compostos <distância em vista dorsal (1. em contato<contíguos>, formando uma "junção ocular", 2. separados por distância menor que a que separa os ocelos laterais, 3. separados por distância igual à que separa os ocelos laterais) #2. Convexidade mediana na margem do olho composto em vista lateral (1. presente, 2. ausente) #3. Tubérculo entre os ocelos (1. presente, 2. ausente) #4. Formato do Vertex (1. trapezoidal, 2. triangular) #5. Cume transversal postocelar (1. presente, 2. ausente) #6. Formato relativo dos triângulos das asas anteriores e posteriores (1. similar, 2. distinto; triângulo das asas anteriores transversalmente alongados, e duas vezes mais afastados do árculo que os triângulos das asas posteriores) #7. Formato do Hamule anterior (1. com processo anteriormente orientado, 2. sem processo anteriormente orientado) #8. Desenvolvimento do Hamule anterior (1. Reduzido, estando curto ou obsoleto, 2. bem desenvolvido) #9. Hamule posterior (1. bem desenvolvido, 2. pouco desenvolvido) #10. Formato da Alça anal da asa posterior (1. alongada, geralmente em forma de pé, 2. arredondada e não em forma de pé) #11. Ovopositor da fêmea (1. bem desenvolvido, formado por gonapófises em formato laminar, 2. pouco desenvolvido, não formado por gonapófises laminares) #12. Desenvolvimento da maioria das nervuras antenodais (1. incompleta; antenodais primárias indistintas, 2. completa; antenodais primárias indistinguíveis das secundárias) #13. Formato da lâmina vulvar (1. com formato de aba bífida e arqueada, 2. não bífida ou arqueada) 407 408 PEREIRA ET AL.: CHAVES INTERATIVAS DE IDENTIFICAÇÃO. Apêndice 2 - Lista de Caracteres dos Gêneros de Aeshnidae #1. Marcas pretas no frons (1. presente, 2. ausente) #2. Formato das marcas pretas no frons (1. em forma de "T", 2. não em forma de "T") #3. Marcas pretas no post-frons (1. presente, 2. ausente) #4. Listras torácicas no peterotórax (1. presente, 2. ausente) #5. Coloração das listras torácicas laterais (1. verdes, 2. claras ou escuras) #6. Coloração do Pterotórax (1. verde, 2. marrom, 3. vermelho #7. Coloração do Abdome (1. marrom avermelhado a preto, 2. marrom claro, 3. amarelo alaranjado ou vermelho) #8. Abdome com manchas (1. verdes, 2. azuis, 3. amarelas, 4. pálidas e em mosaico) #9. Formato do Triângulo das asas posteriores (1. alongado, com lado basal menor que metade do lado costal, 2. não alongado, com lado basal igual ou maior a metade do lado costal) #10. Formato do Arculus (1. com secções surgindo de sua extremidade superior, 2. sem secções surgindo de sua extremidade superior) #11. Área costal ou basal das asas com manchas escurecidas (1. presente, 2. ausente) #12. Comprimento da Nervura subcostal (1. se estende além do nodus, 2. não se estende além do nodus) #13. Triângulo anal do macho (1. com duas células, 2. com uma célula) #14. Formato da Nervura posterior do triângulo anal do macho (1. não espessada; triângulo anal ausente, 2. espessada; triângulo anal presente) #15. Comprimento do supratriângulo da asa posterior (1. maior que o do espaço mediano, 2. menor que o do espaço mediano) #16. Comprimento da Nervura Rspl (1. alcança distalmente a borda da asa, 2. não alcança distalmente a borda da asa) #17. Formato do Segmento distal da Vesica Spermalis (1. com abas latero-basais, 2. sem abas latero-basais) #18. Abertura no segmento distal da Vesica Spermalis (1. ausente, exceto por abertura anterodorsal, 2. presente) #19. Longo flagelo ventral, dorsalmente direcionado, no seguimento distal da Vesica Spermalis (1. presente, 2. ausente) #20. Estrutura tubular na superfície ventral do segmento distal da Vesica Spermalis (1. presente, 2. ausente) #21. Comprimento do Cerci da fêmea (1. tão longo quanto S10, 2. maior que S10, 3. menor que S10) #22. Esterno S10 da fêmea (1. com porção posterior esclerotinizada e portando dentículos em linha, 2. com processo posterior esclerotinizado que porta dois espinhos apicais) #23. Formato da Linha de dentículos no esterno S10 da fêmea (1. fortemente comprimida no meio, ou mais comumente, separada em dois grupos laterais, 2. não comprimida no meio, formando uma linha única contínua) #24. Formato da Nervura RP2 (1. com dobra marcadamente convexa na extremidade distal do pteroestigma, 2. sem dobra marcadamente covnexa na extremidade distal do pteroestigma) #25. Auricle do macho (1. ausente, 2. presente) #26. Tubérculo esternal em S1 (1. ausente, 2. presente) #27. Formato do tubérculo esternal em S1 (1. cilíndrico, com ângulos tergais posteroventrais formando um par de processos, 2. cônico) #28. Formato do Hamule anterior do macho (1. com excisão medial na margem externa, 2. sem excisão).
Baixar