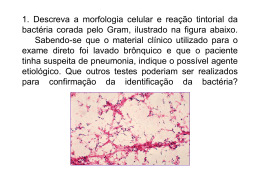
Bacilos Gram – A família Enterobacteriaceae contem a maioria dos bacilos Gram- clinicamente importantes Apesar da sua complexidade menos de 20 espécies são responsáveis por cerca de 95% das infecções Encontram-se no solo, na água, na vegetação e fazem parte da flora intestinal normal de muitos animais, incluindo os humanos São responsáveis por cerca de 30-35% de todas as septicemias, por mais de 70% das infecções do tracto urinário e por muitas das infecções intestinais Os organismos: - são sempre patogénicos (p.ex. Salmonella tiphi, Shigella, Yersinia pestis) - são comensais (p.ex. Escherihia colli, Klebsiella pneumoniae, Proteus mirabilis) - são comensais mas tornam-se patogénicos quando adquirem factores de virulência através de bacteriófagos, plasmídeos ou ilhas de patogenicidade (p. ex. E. coli associada à gastroentrite) Transmissão das infecções: - reservatório animal (ex. Salmonella, Yersinia) - portador humano (S. tiphi, Shigella) - proliferação dos agentes comensais em indivíduos imunodeprimidos (p.ex. E. coli) Características comuns: - Bacilos Gram- Antigénio comum das Enterobacteriacea - Não esporulados - Crescem rapidamente em meios não selectivos como o agar-sangue ou em meios selectivos como o MAC (excepção Kleibsiella granulomatosis, que não cresce em meios tradicionais) - Catalase positivos - Oxidase negativos (importante na sua detecção; excepção Plesiomonas shigelloides) - Requerimentos nutricionais simples - Fermentam a glicose - Reduzem os nitratos a nitritos Podem: - Móveis ou imóveis (a maioria são móveis com excepção de Klebsiella, Shigella e Yersinia; as móveis são perítricas) - Aeróbios, anaeróbios ou anaeróbios facultativos - Algumas estirpes podem fermentar a lactose (p.ex. E. coli, Klebsiellam, Enterobacter, Citrobacter e Serratia) - Os agentes comensais são inibidos pelos sais biliares, ao passo que os patogénicos oferecem resistência aos mesmos - Ter cápsula (Escherichia, a maioria das Klebsiella, e algumas Enterobacter) - Possuir fímbrias Antigénios: - LPS: polissacarídeo O (aglutinável por IGM e é especifico da espécie) + antigénio comum às Enterobacteriaceae + lipídeo A - Antigénio comum às Enterobacteriaceae aparece também como um glicolípido livre na membrana externa Classificação Serológica: - Polissacarídeo O: algutinável por IgM; reacções cruzadas entre géneros próximos (p.ex. Salmonella e Citrobacter, Escherichia e Shigella) - Antigénio capsular K: termo-lábeis; inibem a aglutinação dos Atg O e H - Proteínas flagelares H: algutináveis por IgG, termo-lábeis, podem estar ausentes ou sofrer variação antigénica de estarem presentes em duas fases Patogénese e Imunidade: - Endotoxina (partilhado pelas bactérias Gram- aeróbias e algumas anaeróbias; a sua actividade depende do lipídeo A do LPS; responsável por muitos dos efeitos sistémicos das infecções por bastérias Gram-: libertação de citoquinas, leucocitose, trombocitopenia, CID, febre, diminuição da circulação perférica, choque, morte) - Cápsula - Variação fásica de antigénios: e expressão dos antigénios K e H está sob controlo genético do organismo, podendo cada um deles ser alternadamente expresso ou mesmo não expresso, o que protege a célula da morte mediada por anticorpos) - Sistemas de secreção tipo III - O ferro é um importante factor de crescimento para a bactéria, estando ligado à proteína heme (hemoglobina ou mioglibina) ou a proteínas quelantes (p. ex. transferrina ou lactoferrina). Bactérias produzem os seus próprios sideróforos ou compostos quelantes do ferro (enterobactina, aerobactina), ou através da produção de hemolisina que liberta o ferro da célula hospedeira E. coli: Género: Escherichia 5 espécies: E. coli clinicamente a mais importante - septicemias, gastroenterites, meningite neonatal, infecções urinárias Presente no nosso tracto gasto-intestinal A maioria das infecções por ela provocadas (salvo as gastroenterites e as meningites neonatais) são endógenas E. coli responsável pela gastroenterite e pelas infecções urinárias possuem factores de virulência especializados: Adesinas: permitem que a bactéria permanecia nos tractos gastrointestinal e urinário uma vez que é capaz de aderir às células, não sendo eliminada na urina nem com a motilidade intestinal. Adesinas especializadas: antigénios factores de colonização (CFAI, CFAII, CFAIII), fímbrias agregativas de aderência (AAFI, AAF III), pilli formadores de feixes (Bfp), antigénio do plasmídeo de invasão (Ipa), fímbrias Dr, pilli P, intimina Exotoxinas: toxinas termo-lábeis (LTI, LTII), toxinas termo-estáveis (STa e STb), toxinas Shiga (Stx-1, Stx-2), hemolisinas Septicemia: - Originam-se a partir de infecções do tracto urinário e do tracto gastrointestinal, que disseminam através do sangue - Mortalidade aumentada em pacientes imunodeprimidos ou cuja infecção primária se deu no abdómen ou no SNC Infecções Urinárias: - A maioria devem-se a passagem de E. coli do cólon para a uretra, ascendendo para a bexiga, rim ou próstata - Capazes de produzir adesinas (plilsP, fímbrias Dr, e AAFI, AAFIII) e hemolisinas (lise de eritrócitos e outros tipos células com libertação de citoquinas e estimulação da resposta inflamatória) Meningite Neonatal: - S. coli e Streptococci do grupo B causam a maioria das infecções no SNC em crinaças com idade inferior a 1 mês - cerca de 75% da E. coli possui o Atg K1 (normalmente presentes no tracto gastrointestinal de mulheres grávidas e de recém-nascidos) Gastroenterites: As estirpes de E. coli que causam gastroenterites estão subdivididas em 5 grandes grupos: EPEC: - afecta sobretudo crianças em países empobrecidos - diarreia - Sistema de Secreção III; Ilha de patogenicidade LEE; bactéria adere inicialmente a um pedestal através de ligações fracas pelos seus pilli formadores de feixes, intruduz o receptor Tir das intiminas; destruição das microvilosidades no local de ligação da bactéria ETEC: - afecta crianças em países em desenvolvimento e viajantes dos mesmos (diarreia do viajante) - LTI e LTII; subunidades B de LTI ligam-se ao receptor GM1 (recptor da toxina colérica – diagnóstico diferencial da cólera), subunidade A interage com proteína Gs da membrana, estimulação da adenilcíclase, aumento do AMPc, aumento da produção de clorido e diminuição da absorção de Na+ e de clorido - Sta e STb; só a STa está associada com a doença humana, liga-se a um receptor acoplado à guanilcíclase, aumento da produção de GMPc com hipersecreção de fluidos - são também necessários factores de colonização, para além das toxinas EHEC: - Quadro clínico de diarreia que evolui colite hemorrágica, podendo originar Síndrome Hemolítico-Urémico (HUS) - Toxina Shiga (Stx1 e Stx2); ligação das subunidades B a GB3 nas vilosidades intestinais (Stx1) e nas células endoteliais renais (Stx2); subunidade A é internalizada e clivada em 2 moléculas; A1 liga-se ao rRNA 28S na subunidade ribossomal 60S, impedindo a ligação da aminoacil transferase e impedindo a síntese proteica. No endotélio renal a ligação leva à activação de plaquetas e à deposição de trombina, que perturba a filtração glomerular e leva a falência renal aguda (HUS) - As toxinas Shiga estimulam ainda a lubertação de Citoquinas inlfamatórias - Ao contrário da maioria das E. coli muitas estirpes 0157 não fermentam o sorbitol (Col sorbitol negativas) EIEC: - Diagnóstico diferencial de Shigella - Diarreia por Ulceração do cólon - Destoem as células do cólon, invandindo-as, lisando o vacúolo fagocítico e replicando no citoplasma da célula, movendo-se através de caudas de actina para invadir células vizinhas EAEC: - Diarreia em crianças de países em desenvolvimento e em viajantes para esses países - Fímbrias formadoras de feixes permitem a adesão da bactéria, levando a um aumento da secreção de muco, que encurrala a bactéria sobre o epitélio do intestino delgado, com encurtamento das microvilosidades, infiltado mononuclear e hemorragia Salmonella: Género Salmonella com duas espécies: Salmonella entérica e Shingella bongori O seu aparecimento no homem é sempre patogénico Transmissão por ingestão de água ou alimentos contaminados Os serotipos S. typhi e S. paratyphi estão altamente adaptados a humanos e não provocam doença em hospedeiros não humanos Outros serotipos só provocam doença em hospedeiros não humanos Outros serotipos não são específicos quanto ao hospedeiro - Possuem 2 sistemas de secreção SPI1 e SPI2. SPI1 insere nas células M das placas de Peyer do intestino delgado as proteínas bacterianas Sips ou Ssps, do que resulta um pregueamento da membrana celular por rearranjo da actina. Esta membrana pregueada envolve a bactéria e captura a Salmonella, que se replica no interior do fagossoma, levando a morte da célula hospedeira, e espalhando-se para invadir as células vizinhas - Medeiam a produção de prostaglandinas e estimulam a andenilciclase levando a secreção activa - Possuem um gene de tolerância ao ácido (ATR), o que lhes permite sobreviver ao pH ácido do estômago e do fagossoma - São catalase e superoxido dismutase positivas, o que lhes permite resistir à morte intracelular Geralmente são móveis Produzem ácido e gás a partir de glicose a manitol São urease negativas São lactose e sacarose negativas Geralmente produzem H2S Os seus antigénios capsulados são do tipo Vi Provas bioquímicas de exclusão: - colónias lactose negativas com H2S - Kliger + ureia (KU) ou TSI + ureia Podem provocar: - gastroenterite (geralmente por S. typhimurium e S. enteritidis, que são salmonelas adaptas aos animais mas que acidentalmente afectam o homem): hemoculturas negativas, coprocultura (sementeira em meios selectivos MAC, SS, caldo tetrationato pois as bactérias patogénicas estão em minoria no meio da flora intestinal) - septicemia (sobretudo as espécies S. typhi, S. paratyphi e S. cholerasuis, sendo este risco mais elevados em crianças, idosos e imuno-deprimidos) - colonização assintomática - febre entérica (febre tifóide, causada pela S. typhi; febre paratifóide, causada pela S. paratyphi, S. schottmuelleri, S. hirschfeldii; ao contrário das outras infecções por Salmonella, as bactérias responsáveis pela febre entérica passam através das células epiteliais do intestino e são capturadas por macrófagos, multiplicando-se após serem transportadas para o fígado, baço e medula óssea) Diagnóstico: hemocultura (durante a primeira semana, na primeira fase da doença, quando as bactérias andam em circulação antes de entrar nas placas de Peyer e no sistema mononuclear-monocítico); reacção de Widal (na segunda semana; pesquisa de anticorpos antiantigénios O, H e Vi); Coprocultura (comprovação da cura, vão sendo eliminadas pelo tracto intestinal; portador da bastéria é aquele que continua a eliminar a bactéria após um ano de ter tido a donça) Shigella Género Shigella com quatro espécies: S. dysenteria, S. flexneri, S. boydii, S. sonnei Quando presente é sempore patogénica Transmissão: água contaminada, comida, mosca, pessoa a pessoa (via oral fecal) S sonney é a causa mais comum de shigelose no mundo industrial, ao passo que S. flexneri é a causa mais comum de shigelose nos países em desenvolvimento Geralmente limitada ao tracto gasto-intestinal (raramente invade o sangue) Inicialmente invadem células M das Placas de Peyer do Intestino delgado. Sistema de secreção tipo III que introduz nas células epiteliais e nos macrófagos 4 tipos de proteínas: IpaA, IpaB, IpaC e IpaD. Estas proteínas induzem o pregueamento da membrana células, capturando a bactéria no interior da célula. A shigella lisa o vacúolo fagocítico e replica no interior do citoplasma da célula hospedeira, usando os filamentos de actina para se movimentar e passar para células vizinhas através de junções de hiato. Assim, a Shigella está protegida do sistema imunitário. A Shigella induz apoptose das células, induzindo a libertação de IL-1β, atraindo polimorfonucleados, distabilizando a integridade da parede intestinal e permitindo á bactéria atingir célula epiteliais localizadas mais profundamente. A S. dysenteria produzem a exotoxina Shiga, que actua de modo semelhante às produzidas pela EHEC: Inicialmente provoca diarreia, mediado pela enterotoxina, evoliundo para dores severas no estômago e tenesmo com abundante pus e sangue nas fezes. Diagnóstico: coprocultura, sementeira em meios selectivos (MAC, SS), kliger + ureia ou TSI + ureia Yersinia O género Yersinia contém 11 espécies, sendo que a Y. pestis, Y. enterocolitica e Y. pseudotuberculosis são as espécies patogénicas para humanos mais conhecidas. Y. pestis é altamente virulento causando doença sistémica com elevada taxa de mortalidade Y. enterocolitica e Y. pseudotuberculosis são principalmente patogénios entéricos e que raramente se isolam do sangue São intracelulares facultativas Invadem células epiteliais, macrófagos e sistema monocítico-fagocitário As espécies patogénicas do género Yersinia são resistentes á morte por fagocitose através do seu sistema de secreção do tipo III: em contacto com as células fagocíticas as bactérias secretam proteínas para o interior da célula fagocítica que desfosforilam várias proteínas necessárias à fagocitose (gene YopH), induzem citotoxicidade ao disromperem filamentos de actina (gene YopE) e iniciam a apoptose em macrófagos (gene YopJ/P). O sistema de secreção tipo III também suprime a produção de citoquinas, diminuindo assim a resposta inflamatória à infecção. Y. pestis contém dois plasmídeos adicionais que codificam genes de virulência: gene F1 que codifica uma cápsula proteica anti-fagocítica e o gene do activador do plasminogénio (Pla), que degrada os factores do complemento C3b e C5a, impedindo, deste modo, a opsonização e a migração fagocítica, respectivamente. O gene Pla também degrada a fibrina, permitindo que a Y. pestis se espalhe rapidamente. Existem ainda outros factores de virulência que conferem à Y. pestis resistência ao soro e a capacidade de absorver ferro orgânico por um mecanismo independente de sideroforos As manifestações clínicas da Y. pestis são a Peste Buvónica (por picada de mosca, originando febre alta e adenopatias) e a Peste Pneumónica (inicialmente com febre e mal estar mas posteriormente com sintomatologia pulmonar, podendo o contágio ocorrer de pessoa para pessoa através de aerossóis) Cerca de dois terços das infecções por Y. enterocolitica são enterocolites, originando febre, diarreia e dor abdominal, envolvendo sobretudo o íleo terminal e com adenopatia dos nódulos linfáticos mesentéricos, podendo mimetizar uma apendicite aguda. Y. pseudotuberculosis pode originar um quadro clínico semelhante. Os organismos Yersinia podem crescer a 4ºC, podendo, por isso, crescer em meios ricos em produtos de sangue armazenados no frigorífico. Klebsiella Os membros do género Klebsiella têm uma cápsula proeminente, pelo que as colónias isoladas ttêm um aspecto mucóide As espécies mais frequentemente isoladas são K. pneumoniae e K. oxytoca, que podem originar pneumonia lobar primária (com destruição necrótica dos espaços alveolares, formação de cavidades e hemopstises). Os alcoólicos e pessoas com função pulmonar comprometida têm risco acrescido de ter pneumonia devido á sua incapacidade de limpar as secreções orais aspiradas do seu tracto respiratório baixo. Podem ainda causar infecções do tracto urinário. K. granulomatis é o agente do granuloma inguinal, uma doença granulomatosa que afecta as áreas genitais e inguinais. O diagnóstico laboratorial de K. granulomatis faz-se através da coloração de Wright ou Giemsa. São sensíveis ás Tetraciclinas, eritromicina e trimetoprimsulfamethoxazole Proteus: P. mirabilis é um organismo comensal Responsável por infecções do tracto urinário pois produz uma grande quantidade de ureas (urease positivos) e, que transforma a ureia em dióxido de carbono e amónia. Este processo aumenta o pH urinário e facilita a fornação de pedras renais. O aumento da alcalinidade da urina é também tóxico para o epitélio urinário. São lactose negativos Certas estirpes partilhas atg específicos com algumas rickettsias Os pilli de P. mirabilis podem diminuir a sua virulência ao aumentar a fagocitose por parte das bactérias. Provocam ainda bacteremias, penumonia, infecções localizadas e infecções nosocomiais Apresentam crescimento invasor em meios sólidos Meios que impedem o crescimento invasor: - sais biliares ou detergente - menor teor de NaCl (Cled – pobre em electrólitos) - aumento da concentração de agar Enterobacter, Citrobacter; Morganella, Serratia As infecções por estes organismos são raras em indivíduos imunocompetentes, sendo mais comuns em crianças no eríodo neonatal e em imunodeprimidos. A terapêutica com antibióticos pode não ser eficaz uma vez que estes organismos são frequentemente resistentes a múltiplos antibióticos Diagnóstico laboratorial: Colheita do produto biológico: - Urina (no caso de infecções urinárias) - Fezes (em caso de gastroentrites) - Hemocultura - LCR (em caso de meningite) Técnica de Gram Exame cultural: - Crescem bem na maioria dos meios: agár-sangue, agár chocolate, brain-heart, Cled, triglicolato - Meios selectivos (sobretudo nas coproculturas): Mac Conkey, agar salmonella-shigella (SS), gelose de Hektoen (Salmonella e Shigella), gelose de xilose-lisina-desoxicolato (Salmonella e Shigella) caldo tetrationato (Salmonella), gelose CIN (selectivo para Yersinia), agar mc Conkey – sorbitol para E. coli 0157:H7 - incubação em atmosfera de aerobiose surante 18h-24h a 35ºC, Yersinia 25-30ºC durante 48H Provas bioquímicas: - Com testes geralmente comercializados (qualquer sistema comercial de identificação pode ser utilizado para a identificação das Enterobacteriaceae e podem-se obter resultados dentro de 4 a 24 horas, consoante o sistema utilizado) - Em alternativa à utilização dos testes comercializados, a maioria das Enterobacteriácias pode ser identificado presuntivamente utilizando um número reduzido de substractos Prova da Fermentação da Glicose Após incubação, a libertação de compostos ácidos, resultantes da fermentação do hidrato de carbono, faz descer o pH o que conduz à mudança da cor original do meio, pois está presente um indicador de pH (reacção positiva). Em alguns casos, a produção de ácido é acompanhada pela produção de gás (CO2) que é visível, pois o meio líquido que estava dentro do tubo de Durham é substituído por gás em forma de bolhas. As culturas que não são capazes de fermentar o hidrato de carbono não conduzem à mudança de cor do meio nem apresentam produção de gás (reacção negativa). Prova da redução dos Nitratos: A redução dos nitratos pode ser determinada semeando-se o microrganismo num caldo de nitratos. Este meio é um caldo nutritivo suplementado com 0,5% de nitrato de potássio (KNO3) como fonte de nitratos. Por outro lado, este meio pode ter 0,1% de agar o que lhe permite ser semi-sólido de modo a impedir a difusão do oxigénio para o meio e assim favorecer um ambiente anaeróbio necessário para a redução dos nitratos. Após incubação (24 a 48 h a 37º C), a cultura é examinada para a presença de iões nitrito no meio. A capacidade do microrganismo para reduzir os nitratos a nitritos é determinada pela adição de dois reagentes: solução A - ác. sulfanílico e solução B - αnaftilamina. Os nitritos presentes no meio vão reagir com esses reagentes produzindo uma mudança de cor imediata para vermelho. Prova da desaminação da fenilalanina Esta prova pode ser usada para distinguir bactérias, pois as que produzem a enzima desaminase da fenilalanina desaminam este aminoácido produzindo ácido fenilpirúvico. Quando o reagente cloreto de ferro é adicionado ao meio de cultura reage com o ácido fenilpirúvico, formando um composto verde. Nas culturas em que não ocorrer a desaminação da fenilalanina não há mudança de cor após a adição do reagente. Prova da descarboxilação da lisisna A descarboxilação da lisina pode ser detectada semeando a bactéria num meio de cultura contendo esse aminoácido, glicose e um indicador de pH (púrpura de bromocresol). Antes da incubação deve ser colocado óleo mineral no caldo para impedir o oxigénio de atingir as bactérias e inibir a reacção. Os ácidos produzidos pelas bactérias a partir da fermentação da glicose vão inicialmente baixar o pH do meio e causar a mudança de cor do indicador de pH de púrpura para amarelo. O pH ácido activa então a enzima que causa descarboxilação da lisina a aminas e a subsequente neutralização do meio que muda de amarelo para púrpura outra vez. Prova das Oxídases: A capacidade das bactérias produzirem esta enzima pode ser determinada pela adição do reagente das oxídases (dihidrocloreto de tetrametil p-fenilenodiamina). Este reagente de cor rosa age como um substrato artificial, fornecendo electrões e consequentemente ficando oxidado, tornando-se um composto escuro (castanho-negro) na presença de oxídase e de oxigénio livre. Após a adição do reagente o desenvolvimento da coloração rosa depois castanha e finalmente negra na superfície das colónias é indicativo da produção de citocromo oxídase e representa uma prova positiva. Se não houver mudança de cor ou se as colónias apresentarem uma coloração rosa ligeira é indicativo da ausência de actividade da oxídase e é uma prova negativa. Prova da Urease: A presença de urease detecta-se quando o microrganismo cresce num meio com ureia (meio de ureia de Christensen) que contém também o indicador de pH, vermelho de fenol. Quando a ureia é desdobrada pela urease, a amónia acumula-se no meio tornando-o alcalino. Este aumento de pH faz com que o indicador de pH passe de amarelo a rosa, sendo uma reacção positiva para a presença de urease. A ausência da coloração rosa indica uma reacção negativa. No entanto, basta que ocorra o aparecimento de uma zona do meio rosa para se considerar a reacção positiva; apenas os microrganismos que produzem precocemente urease têm capacidade para modificar a cor de todo o meio para rosa forte. Prova de Kligler Iron Agar ou de Triple Sugar Iron Agar Esta prova é, geralmente, usada para diferenciar os diferentes géneros das Enterobacteriaceae e para distinguir esta família de outros bacilos Gram negativo de origem intestinal. Esta diferenciação é feita atendendo às diferenças na fermentação dos hidratos de carbono presentes no meio e à produção de sulfureto de hidrogénio (H2S). Tanto o meio agar TSI (triple sugar iron) como o agar Kligler Iron contêm glicose em pequena concentração (0,1%), lactose em concentração superior (1%), o indicador de pH, vermelho de fenol, para detectar a produção de ácidos resultantes da fermentação dos hidratos de carbono, tiossulfato de sódio, substrato para a produção de H2S, e sulfato de ferro para a detecção desse produto final. A diferença entre estes dois meios diferenciais é que o TSI possui mais um açúcar, a sacarose, em concentração igual à da lactose (1%). Ambos os meios são inoculados por picada, no cilindro e por estria, na rampa. É essencial que as culturas sejam observadas após 18 a 24 h de incubação para evitar que os hidratos de carbono sejam completamente utilizados e que ocorra degradação das peptonas, formando produtos finais alcalinos. É na rampa que se faz a leitura da lactose e da sacarose, no fundo do cilindro a da glicose e no meio do cilindro a de H2S. Após incubação podem ser determinadas as actividades fermentativas, a produção de gás e a produção de H2S, podendo ocorrer vários resultados: Cilindro ácido (amarelo) e rampa alcalina (vermelha): Só a glicose foi fermentada. Os microrganismos degradam, preferencialmente, a glicose em primeiro lugar, mas como este substrato está presente em concentração mínima, a quantidade de ácido produzida é limitada e é rapidamente oxidada na superfície da rampa. Por outro lado, as peptonas do meio são também usadas na produção de substâncias alcalinas. No cilindro, a reacção ácida é mantida devido à tensão reduzida do oxigénio e ao crescimento mais lento dos microrganismos. O indicador, vermelho de fenol, muda para amarelo devido à persistência da formação de ácido no cilindro. Cilindro ácido (amarelo) e rampa ácida (amarela): Ocorreu a fermentação da lactose e/ou da sacarose, para além da glicose. Como as duas primeiras substâncias estão presentes em altas concentrações são substratos para a actividade fermentativa contínua com manutenção da reacção ácida (cor amarela) em todo o meio (rampa e cilindro). Produção de gás: Nota-se pela ocorrência de fracturas no meio de cultura. Produção de H2S: Ocorre enegrecimento, principalmente na zona intermédia do cilindro. Isto deve-se ao facto do microrganismo em estudo ser capaz de produzir sulfureto de hidrogénio (H2S), que se conjuga com um composto de ferro existente no meio, dando origem a sulfureto de ferro que, sendo insolúvel, precipita. Cilindro alcalino (vermelho) e rampa alcalina (vermelha) ou inalterado (tijolo): Não ocorreu fermentação dos hidratos de carbono presentes no meio, nem produção de gás ou de H2S. As peptonas do meio podem ser catabolizadas sob condições anaeróbias e/ou aeróbias, resultando num pH alcalino devido à produção de amónia. Se só ocorrer degradação aeróbia das peptonas, a reacção alcalina só é evidenciada na superfície da rampa. Se houver degradação aeróbia e anaeróbia das peptonas, a reacção alcalina é visível em todo o meio. Provas de sensibilidade aos antimicrobianos: - Como todos os Gram- apresentam maior resistência à penicilina, sendo mais sensíveis às quinolonas e às estreptomicinas - Enterobacter, Citrobacter; Morganella, Serratia apresentam resistência a vários antibióticos Serodiagnóstico: - Identificação antigénica (atg O, atg K ou Vi, atg H) - R. de Widal
Download