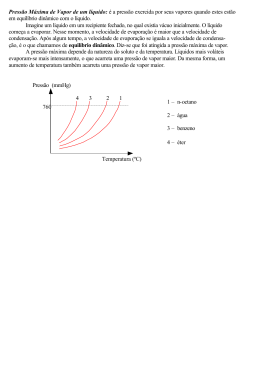
UNIVERSIDADE COMUNITÁRIA DA REGIÃO DE CHAPECÓ ÁREA DE CIÊNCIAS EXATAS E AMBIENTAIS ENGENHARIA DE ALIMENTOS/ENGENHARIA QUÍMICA DISCIPLINA: FÍSICO-QUÍMICA EXPERIMENTAL PROFESSORES: JACIR DAL MAGRO/JAQUELINE SCAPINELLO SEMESTRE: | HORAS AULA: 54 | CRÉDITOS: 03 EXPERIMENTO No 02 PRESSÃO DE VAPOR DE LÍQUIDOS 1. OBJETIVOS Efetuar a medição, na temperatura ambiente, e em temperaturas superiores, da pressão de vapor de vários líquidos. 2. MATERIAIS a) Equipamentos b) Reagentes - 1 Seringa; - 1 Suporte universal; - 1 Manômetro de tubo em U; - 1 Termômeto; - 1 Quitassato; - 1 Bequer; - 1 Tela de amianto e tripé; - 1 Bico de bunsen. - Acetona (C3H6O); - Etanol (C2H6O); - Tetracloreto de carbono (CCl4); - Água (H2O). 3. TEORIA Se uma certa quantidade de um líquido puro for colocado num recipiente evacuado, cujo volume molar é maior que o do líquido, uma porção de líquido irá evaporar de modo a preencher com vapor o volume restante do recipiente. Desde que permaneça algum líquido depois que o equilíbrio se estabeleceu, a pressão do vapor no recipiente é uma função apenas da temperatura do sistema. A pressão desenvolvida é a pressão de vapor do líquido, que é uma propriedade característica de cada líquido, aumentando rapidamente com a temperatura. A temperatura na qual a pressão de vapor é igual a 1atm e a temperatura normal de ebulição do líquido (Teb). Alguns sólidos são suficientemente voláteis para produzir pressões de vapor mensuráveis, mesmo a temperaturas comuns. Se acontecer que a pressão de vapor de um sólido atinja 1atm, a uma temperatura abaixo do ponto de fusão do sólido, o sólido sublima. Esta temperatura é chamada temperatura normal de sublimação (Ts). As temperaturas de ebulição e de sublimação dependem da pressão imposta à substância. A existência de uma pressão de vapor, e o seu aumento com a temperatura, são conseqüências da distribuição de energia de Maxwell-Boltzmann. Mesmo em temperaturas baixas, uma fração das moléculas no líquido tem, em virtude de distribuição de energia, energia em excesso além da energia de coesão do líquido. Essa fração aumenta rapidamente com o aumento da temperatura. O mesmo é verdade para sólidos voláteis. Isto significa que, numa dada temperatura, um líquido com maior energia de coesão (isto é, um grande calor de vaporização molar, Qvap), terá uma menor pressão de vapor que um líquido com uma pequena energia de coesão. A 20°C o calor de vaporização da água é 44 KJ/mol, enquanto que o do tetracloreto de carbono é 32 KJ/mol; correspondente, as pressões de vapor nesta temperatura são 2,33 KPa para água e 12,13 KPa para o tetracloreto de carbono. A Equação (1) relaciona a pressão de vapor, a temperatura e o calor de vaporização, trata-se de uma forma da Equação de Clausius-Clapeyron. P P e Qvap RT (1) onde P é uma constante, que tem as mesmas unidades de P, e pode ser avaliada em termos do calor de vaporização (Qvap), e da temperatura normal de ebulição (Teb). Na temperatura de ebulição (Teb), a pressão de vapor é 1 atmosfera, portanto: 1 P e Qvap RT (2) Logo: P 1 e Qvap RT (3) A Equação (3) é suficiente para avaliar a constante P . A Equação (1), após linearizada, pode ser escrita como: ln P Qvap RT ln P (4) A Equação (4) é útil para a representação gráfica da pressão de vapor com a temperatura. A Equação (3) é, portanto, a equação de uma reta, cujo coeficiente angular é ln P . A Figura 1 é um exemplo que mostra os dados do logP vs 1 T Qvap R . O coeficiente linear é para o benzeno. Figura 1 – Log(P) em função de 1/T para o benzeno. Conforme o exposto até o momento, um método conveniente para determinar o calor de vaporização de um liquido é medir a pressão de vapor a varias temperaturas. Depois dos dados experimentais terem sido colocados em um gráfico do tipo da Figura 1, o coeficiente angular é medido e, deste valor, determina-se Qvap. Mesmo utilizando aparelhagens simples, esse método é capaz de fornecer resultados mais precisos que uma determinação calorimétrica de Qvap, também com equipamentos simples. 4. PROCEDIMENTO EXPERIMENTAL Monte o equipamento conforme é mostrado na Figura 2. Conectar a saída do quitassato, conforme ilustrado na Figura 2, ao manômetro de tubo em U, e espere que o equilíbrio seja estabelecido. Meça a diferença de altura entre os dois ramos do manômetro. Figura 2 – Equipamento para medir a pressão de vapor de líquidos. Injetar 5 ml do líquido, cuja pressão de vapor se deseja medir, aguardar uns 5 minutos para estabelecer o equilíbrio, e meça a diferença de alturas entre os níveis de Hg. Qual é a pressão de vapor do líquido na temperatura do laboratório (ambiente)? Não esquecer de anotar a temperatura. Coloque o quitassato em um banho Maria e meça a diferença de aturas a cada 5°C até que o líquido entre em ebulição. Para que o procedimento seja bem executado não podem ocorrer vazamentos. 5. DADOS - Diferença de alturas com o quitassato vazio. - Diferença de alturas com o líquido a T ambiente. - Diferença de altura com o liquido as diversas temperaturas estudadas, conforme a Tabela 1. - Anotar todas as observações pertinentes. 6. RESULTADOS - Tabelar os dados de temperatura contra pressão para cada um dos líquidos. - Plotar os dados conforme a Equação (4), para todas as substâncias estudadas. - Encontrar o calor de vaporização para todas as substâncias estudadas. Comparar com dados da literatura. - Encontrar, a partir de dados experimentais, o valor de P dos compostos estudados. 7. PERGUNTAS a) Qual dos líquidos estudados possui maior pressão de vapor a T ambiente? b) Qual dos líquidos estudados tem maior massa molecular? Pode ser estabelecida alguma relação? c) Em qual das substancias consideradas existem maiores forças intermoleculares na fase liquida? d) Coincidem os valores encontrados com os da literatura? 8. BIBLIOGRAFIA ATKINS, Peter. Físico-química. 6. ed. Rio de Janeiro: LTC, 1999. 252 p. ATKINS, Peter; PAULA, Julio de. Physical chemistry. 7. ed. New York: Oxford, 2002. 1149 p. CASTELLAN, Gilbert. Fundamentos de físico-química. 1. ed. Rio de Janeiro: LTC, 1996-2001. 527 p. CHAGAS, Aécio Pereira. Termodinâmica química: fundamentos, métodos e aplicações. São Paulo: UNICAMP, 1999. 409 p. MACEDO, Horacio. Físico-química I. Rio de Janeiro: Guanabara Dois, 1981. 627 p. Tabela 1 – Diferença de altura para os líquidos em função da temperatura Acetona Etanol Tetracloreto de carbono Água Temperatura Zmercúrio Temperatura Zmercúrio Temperatura Zmercúrio Temperatura Zmercúrio [oC] [oC] [oC] [oC] [mm] [mm] [mm] [mm]
Download