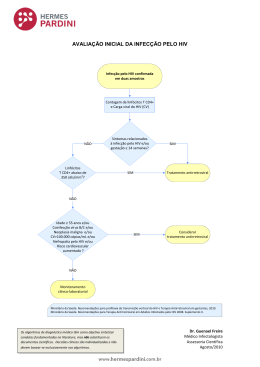
Prof. Claudia Vitral HIV e aids- Histórico 1981: 5 casos de pneumonia por Pneumocystis carinii em Los Angeles 1981: 26 casos de sarcoma de Kaposi em Nova York e São Francisco Todos pacientes homossexuais masculinos e jovens Síndrome* similar observada em IVDUs, hemofílicos, receptores de sangue e em seus parceiros sexuais Agente infeccioso transmitido por via sexual ou parenteral Principal aspecto da infecção – perda seletiva de cels CD4+ Infecção VIRAL 1983: isolamento do vírus (BarréSinousi e cols/Robert Gallo) 1986: adoção do termo HIV e identificação do HIV 2 Prêmios Nobel em 2008 Origem do HIV Dados globais da infecção pelo HIV: 33 anos da epidemia Relatório do Programa Conjunto das Nações Unidas sobre o HIV e Aids lançado em 20 julho 2014: epidemia em queda no mundo Queda (38%) nos casos novos da doença nos últimos doze anos (3,4 milhões em 2001) e nos casos novos em crianças (58%) Queda (37%) no número de mortes associadas ao HIV (2,4 milhões de mortes em 2005) Dados da infecção pelo HIV no Brasil Tendência contrária da epidemia no país: novos casos de infecção pelo HIV e de mortes associadas à doença cresceram nos últimos oito anos. Pessoas vivendo com HIV/aids: 797 mil (desconhecido por 123 mil) Casos novos em 2013 (aumento de 11% em relação a 2005): 42.000 Aumento (11%) nos casos novos da doença entre 2005/2013 Óbitos em 2013: 15.000 ( aumento de 7% em relação a 2005) Aumento (7%) no número de mortes associadas ao HIV entre 2005/2013 33 anos de aids: principais progressos obtidos • Descoberta da origem da doença • Melhor compreensão dos mecanismos virais • Desenvolvimento de tratamentos eficazes: até 90% sucesso terapêutico, com melhoria da saúde e da expectativa de vida, redução do risco da transmissão vertical e sexual • Simplificação do tratamento: aumento da adesão 33 anos de aids: desafios a serem vencidos • Apenas 1/3 pessoas que precisam do tratamento são tratadas • Muitas pessoas infectadas ignoram que sejam portadoras do vírus: progressão da epidemia • Permanece a dificuldade no desenvolvimento de vacinas • Eliminação dos reservatórios do vírus: cels T memória, outros reservatórios (?) Família Retroviridae Subfamília Oncovirinae Gênero Oncovirus HTLV-I (leucemias e linfomas de cels T) HTLV-II (não associado a patologia) Subfamília Lentivirinae Gênero Lentivirus HIV-1, HIV-2 (Aids) Representação esquemática da classificação do HIV Distribuição mundial dos subtipos do HIV Distribuição geográfica dos subtipos e formas recombinantes do HIV1, Brasil Morgado et al, 2012 HIV - A partícula viral Retrovirus Três genes estruturais GAG – POL – ENV três poliproteínas HIV - A partícula viral Retrovirus Duas glicoproteínas associadas ao envelope: gp120 and gp41 ENV gene HIV - A partícula viral Retrovirus Antígenos grupo específicos p17: proteína matriz P24: proteínas de nucleocapsídeo p9: ptn associada ao RNA GAG gene HIV - A partícula viral Retrovirus Enzimas Transcriptase reversa Integrase Protease POL gene Estrutura do HIV Gp120 (superfície) Gp41 (transmembrana) Transcriptase reversa P17 (matriz) P24 (capsídeo) Integrase e protease envelope RNA Mapa do genoma do HIV Variabilidade genética do HIV Taxa de erro de 1 em 2,000-10,000 nucleotídeos O genoma do HIV tem 9749 nucleotideos Portanto CADA vírus novo possui pelo menos uma mutação! 10 bilhões PV/dia Resultado: muitos vírus diferentes são formados a cada dia da infecção Fenótipo viral: CCR5 e CXCR4 Amostras iniciais da infecção utilizam o coreceptor CCR5. Variantes do HIV que utilizam este coreceptor têm tropismo por macrófagos (disseminação da infecção) Dominam os estágios iniciais da infecção e persistem por todo o curso da doença Fenótipo viral: CCR5 e CXCR4 A medida que o vírus vai sofrendo mutações, ele muda os subtipos das células que ele infecta e a capacidade de se ligar a diferentes coreceptores Variantes detectadas no final da infecção possuem tropismo por coreceptores CXCR4 (aumento da virulência) Associadas com rápido declínio de cels CD4+ e progressão a aids HIV eAIDS Algumas pessoas não desenvolvem AIDS Pessoas expostas não infectadas Sobreviventes de longo prazo A história dos receptores de quimiocinas HIV e AIDS Co-receptores e infecção pelo HIV Células com mutação homozigótica de moléculas de CCR5 não são infectadas pelo HIV 1 em 100 Caucasianos Nenhum Africano Pessoas com mutação heterozigótica em moléculas de CCR5 progridem para AIDS mais vagarosamente HIV and AIDS Co-receptores 25% dos sobreviventes de longo termo são mutantes de CCR5 Esta mutação CCR5 (chamada “delta 32”) deixou algumas pessoas imunes a peste negra na idade média HIV - Ciclo de multiplicação viral HIV - Ciclo de multiplicação viral Células infectadas pelo HIV Linfócitos CD4+ (T4) Destruiçao viral específica Monócitos e macrófagos (Fc ou C) Células dendríticas foliculares Células endoteliais, células epiteliais intestinais, oligodendrócitos, astrócitos, neurônios e células glia (galactocerebrosídeos) Sem lise: reservatórios Macrófagos podem ser infectados por duas vias HIV gp120 CD4 HIV gp120 se liga ao antígeno CD4 Vírus é opsonizado por Acs anti-gp120 que se ligam a receptores Fc de macrófagos Fc receptor Anti-gp120 HIV Macrófagos – O cavalo de Tróia Macrófagos formam um reservatório viral fora da corrente sanguínea, levando o vírus para tecidos extravasculares Produção viral por um longo período sem serem eliminados Não existe latência nestas células São vitais na dissseminação do HIV no organismo: Macrófagos infectados secretam quimiocinas que induzem a migração de cels T CD4+ de memória e sua ativação: atuam portanto na infecção de cels T Como o HIV entra na célula Receptor celular: antígeno CD4 Human HeLa Cell NÃO INFECTADA Célula HeLa Humana transfectada com antígeno CD4 INFECTADA HIV - Multiplicação viral HIV quimiocina CD4 CD4 CCR5 CCR5 CD4 Mutant CCR5 macrophage Receptores de quimiocinas são necessários como co-receptores junto com CD4 antigeno (CCR5 e CXCR4) HIV - Como o vírus entra na célula mudança conformacional em gp 41 independente de pH Fusão com membrana plasmática Formação de sincícios Profundo significado para progressão da AIDS: disseminação célula a célula Profundo significado para terapia: Resposta humoral não irá parar a disseminação – necessidade resposta mediada por célula CICLO DE MULTIPLICAÇÃO DO HIV Adsorção ao receptor celular via GP 120 Transcrição reversa Fusão celular (sincício) em linfonodos infectados pelo HIV Ligação Integração Penetração ssRNA (mRNA viral + RNA da progênie) Proteínas virais montagem nucleocapsídeo Proteínas do envelope viral brotamento liberação Microscopia eletrônica mostrando partículas do HIV brotando no meio extracelular Transmissão do HIV Vias de transmissão Sexual (homo ou hetero) Parenteral (transfusão, IVDU, ocupacional) Vertical (intrauterina ou perinatal) Principais fontes de infecção Sangue Secreções sexuais Leite materno Fatores de risco biológicos e comportamentais: Concentração do vírus nos fluidos biológicos (CARGA VIRAL) Estágio da infecção (primeiros 6 meses) Integridade da mucosa envolvida Co-infecções (outras DSTs) Multiplicidade de parceiros, não uso de preservativos Intercurso anal, compartilhamento de seringas Evolução natural da infecção pelo HIV • Doença crônico progressiva • Característica principal: progressão da infecção em direção a perda do controle imunológico sobre patógenos e neoplasias • Infecção preferencial: LT CD4+ ativados • Reservatório: LT em repouso, MO, monócitos, glia (mantém a população viral mesmo na TARV) Evolução natural da infecção pelo HIV • Infecção aguda: sintomática 50-90% indivíduos • Fase assintomática (fase crônico-inflamatória) • Fase sintomática/aids ~70% com aids em 10 anos ~20% evolução rápida ~5% evolução lenta (progressores de longo prazo e controladores de elite) HIV e AIDS A história natural da infecção pelo HIV: principais eventos Acompanhamento da infecção e avaliação da progressão da doença: contagem CD4, carga viral A 1. Infecção aguda Alto título viral (até 10 milhões vírus por ml sangue) Queda de células CD4+ com recuperação Sintomática 50-90% indivíduos Principais sinais e sintomas relacionados a infecção aguda pelo HIV Infecção pelo HIV 2. Uma resposta imune vigorosa Resposta imune humoral e celular essenciais no controle da infecção, porém INSUFICIENTES Os vírus quase desaparecem da circulação 3. Um estado de latência clínica Fase assintomática (Latência clínica): fase crônico inflamatória Queda da carga viral a um nível preditor da progressão da doença (set point) Produção viral constante e destruição maciça de linfócitos T Estabelecimento de um equilíbrio dinâmico durante a infecção (“turnover viral”) A infecção pelo HIV O problema das cels T4 de memória Somente cels T4 ativadas podem replicar o vírus (ativação por contato com Ags) O vírus mata a maioria das cels T4 infectadas, que são inicialmente repostas Algumas cels T4 revertem para cels de memória cells (vida-longa!) Cels T4 memória não podem replicar o vírus a não ser quando ativadas Dinâmica das cels T CD4 na infecção pelo HIV Remoção por Cels T memória apoptose Cel T não infectada ativada cronicamente infectadas com provirus Infecção Retorno ao estado de memória Vida longa! Reativação cel T memória Morte celular destruição imune Vida longa! Adapted from Saag and Kilby Nat Med 5: 609, 1999 HIV latente Antígenos Cel T4 memória Cel T4 ativada Este fato torna impossível a cura de um paciente com HIV HIVdo HIV Mesmo se a terapia parar aProdução replicação HIV e AIDS “Set point” viral estabelecido durante a latência clínica: fator preditivo para o início da doença clínica < 10.000 cópias / ml sangue: período latência > 10 anos 10.000-100.000: período latência < 10 anos HIV e AIDS Boa correlação entre a carga viral e a progressão da doença HIV e AIDS A carga viral é um bom valor preditivo do tempo de sobrevida Infecção pelo HIV 4. O início da doença Fase sintomática/aids: primeiros sintomas pela dificuldade de controle de infecções oportunistas Infecção pelo HIV 5. Doença avançada - AIDS A medida que a contagem de cels CD4+ cai abaixo de 200 cels/mm3, o título viral aumenta rapidamente Infecções oportunistas: morte em 2 anos sem intervenção Declínio inexorável das cels CD4+ T4 Porque todas as cels T4 desaparecem? Nos estágios iniciais da infecção somente 1 em 10,000 cels é infectada No fim 1 em 40 De grande importância para estratégia terapêutica Virus destroem a célula como resultado do brotamento Mas poucas cels são infectadas: Estágio inicial da infecção 1:10,000 Final 1:40 1. Ruptura da membrana Porque todas as cels T4 desaparecem? Infected CD4 cell Cells Fuse Gp120 positive Morte de cels CD4 pela formação de sincícios (2) Uninfected CD4 cell Gp120 negative Porque as cels T4 desaparecem? Cel T citotóxic a Mas: grande parte das cels não está infectada Destruição de cels CD4 por cels T citotóxicas (3) Destruição cels CD4+ (4) Ligação de antígenos Gp120 livres ao receptor CD4 deixa a cel T4 não infectada se parecer como uma cel infectada Lise mediada por complemento Pode contar pela perda de cels T4 não infectadas Porque cels T CD8+ (CD4-) desaparecem no estágios finais da doença? Cels CD8 não são infectadas pelo HIV (CD4-), entretanto são eliminadas nos estágios finais da infecção pelos fenótipos virais CXCR4 Cels CD8 (CD4-) apresentam co-receptores CXCR4 = ligação HIV (apenas subtipos tardios na infecção) Embora não ocorra infecção, a ligação ao receptor CXCR4 induz um sinal para a célula que culmina na apoptose quando macrófagos estão presentes Porque cels T CD8+ (CD4-) desaparecem no estágios finais da doença? Cel CD8 (no CD4 antigen) Macrófago gp120 HIV chemokine CXCR4 ? Ligação a CXCR4 resulta na expressão do receptor TNF-alpha G protein signal ? Ligação a CXCR4 resulta na expressão de TNF-alpha na superfície cel Indução de apoptose Cel CD8 CXCR4 Macrófago Morte CD8 T cell apoptotic bodies Doenças relacionadas a AIDS Infecções oportunistas: Vírus: Citomegalovirus, Herpes simplex, Varicela-zoster Cistos de Pneumocystis carinii no pulmão Prozoários: Pneumocystis carinii, Cryptosporidium Bacteria: Toxoplasma, Mycobacterium avium, Nocardia, Salmonella Fungos: Candida, Cryptococcus neoformans, coccidioides immitis, Histoplasma capsulatum Candidíase e herpes oral Cryptococcus no pulmão Tumores Linfomas (incluindo linfomas de cels B associados ao EBV) Sarcoma de Kaposi Carcinoma Cervical Sarcoma de Kaposi no estômago Sarcoma de Kaposi Novos conceitos sobre a infecção pelo HIV A infecção pelo HIV: Queda das células CD4 Processo de inflamação crônica com lesão tecidual sistêmica: senescência do SI Resultado: Infecções oportunistas Doenças crônico-degenerativas e neoplasias não diretamente relacionadas a infecção viral (doenças vasculares, nefropatias, neuropatias e problemas neurocognitivos) Redução tempo de vida em relação aos HIV- mesmo indivíduos tratados e “controladores de elite” Diagnóstico laboratorial da infecção pelo HIV Marcadores da infecção pelo HIV na corrente sanguínea de acordo com o período que surgem após a infecção, seu desaparecimento ou manutenção ao longo do tempo Diagnóstico laboratorial da infecção pelo HIV a. Triagem inicial: pesquisa de anticorpos anti-HIV* (4-12 semanas após infecção) - Fluxograma 1: Dois testes rápidos realizados em sequência com amostras de sangue (venoso ou capilar) Fluxograma 2: Dois testes rápidos realizados em sequência, sendo o primeiro com fluido oral e o segundo com amostra de sangue (venoso ou capilar) - * A Portaria no. 29 de 14 de dezembro de 2013 normatiza o algoritmo para o diagnóstico da infecção pelo HIV utilizando exclusivamente testes rápidos * Exceção: crianças < 18 meses, carga viral b. - Acompanhamento de pacientes Linfometria (contagem de CD4+) Carga viral (cópias de RNA/ml) Manual Técnico para o Diagnóstico da Infecção pelo HIV, MS, 2013 HAART: terapia antiretroviral altamente ativa (a partir de 1996) Número atual e projetado de pessoas recebendo TARV em países de acordo com a renda, OMS, 2003-2015 Número de pessoas recebendo TARV e porcentagem de todas as pessoas vivendo com HIV e recebendo TARV, OMS, 2013 Cobertura da TARV por país, OMS, 2013 Global AIDS Response Progress Reporting, WHO, 2013: Brasil • Tratamento gratuito desde 1996 • Um dos únicos países da AL a atingir a cobertura de tratamento universal • 2005/2013: 165 mil para 353 mil pessoas em tratamento • Maior cobertura de testagem para HIV para a população de HSH (54%) e profissionais do sexo (65%) da AL Quando iniciar a TARV ? Protocolo clínico e diretrizes terapêuticas para adultos vivendo com HIV/aids, MS, 2013 TARV: Escolha do esquema inicial Medicamentos pertencem a 3 classes: •Inibidores da transcriptase reversa análogos de nucleosídeos e nucleotídeos (ITRN/ITRNt) •Inibidores da transcriptase reversa não análogos de nucleosídeos (ITRNN) •Inibidores da protease reforçados com ritonavir (IP/r) A terapia inicial deve incluir a combinação de três antivirais: aumenta a barreira genética que o vírus deve transpor para gerar resistência TARV: Escolha dos medicamentos Escolha da dupla de ITRN/ITRNt : •associação zidovudina/lamivudina (AZT/3TC) Monitorar risco de toxicidade hematológica e lipoatrofia •associação tenofovir / lamivudina (TDF/3TC) Monitorar risco de nefrotoxicidade Escolha entre ITRNN e IP/r: Apresentam equivalência de resposta virológica, mas os ITRNN apresentam melhor perfil de toxicidade ITRNN EFV: efanvirenz NVP: nevirapina IP/r LPV: lopinavir Limitações do TARV - Efeitos adversos - Incapacidade de erradicar o vírus do hospedeiro, mesmo após anos de terapia: • Alta taxa de mutação/recombinação viral • Reservatórios virais: LT CD4+ em repouso, células dendríticas, macrófagos, células glia Novos antivirais Existem atualmente 32 novos antivirais já aprovados: • Inibidores de integrase (Raltegravir) • Inibidores de ptns não estruturais (Vif – degrada uma enzima celular que destrói DNA viral) • Bloqueadores de CCR5 (Maraviroc) • Drogas combinadas: Truvada (dois inibidores TR), Atripla (+ inib protease) e Quad pill (+ inibidor integrase) O antiviral ideal contra o HIV… “Certamente o melhor tratamento contra o HIV será aquele que não apenas suprima a replicação viral, mas que elimine a infecção do organismo – um ideal que está apenas começando a se tornar possível “. Cura a vista ? A questão da cura funcional (terapia na fase aguda) - Paciente de Berlim: indivíduo HIV+ que recebeu tx de medula de indivíduo CCR5Δa32: CURA ESTERILIZANTE - Bebe de Mississipi: criança nascida de mãe HIV+, tratada desde o nascimento por 18 meses quando o tratamento foi interrompido, 10 meses depois ao retornar não tinha sinais da infecção. Após dois anos sem tratamento, o vírus foi novamente detectado. - Pacientes de Visconti: grupo de 14/70 indivíduos que receberam TARV na fase aguda, foram tratados por 3 anos e depois a terapia foi interrompida. Permaneciam com carga viral indetectável após 7 anos. Deixaram saudades... Best wishes …. Prof. Claudia Vitral Projeto: Vacina contra Hepatite A – uso de sangue capilar como alternativa de acesso a resposta celular HAV-específica Objetivo: 1- Verificar e comparar a frequência de linfócitos T e B HAVespecíficos de memória após vacinação em amostras de sangue periférico e capilar 2- Viabilizar o acesso a um menor volume de sangue para avaliar resposta celular após vacinação 1º passo - Investigar a presença de indivíduos suscetíveis a infecção por HAV. Pesquisa de anti-HAV em amostras de DBS 2º passo – coleta de amostras de sangue capilar e venoso de 30 indivíduos voluntários a receber a vacina (pré-vacina) 3º passo – coleta de amostras de sangue capilar e venoso após 7 dias da 1ªdose 4º passo – coleta de amostras de sangue capilar e venoso após 15 dias da 1ª dose 5º passo – coleta de amostras de sangue capilar e venoso após 30 dias (1 mês) da 1ª dose 6º passo – possível coleta de amostras de sangue capilar e venoso após 6 meses da 1ª dose – Momento da 2ª dose da vacina
Baixar