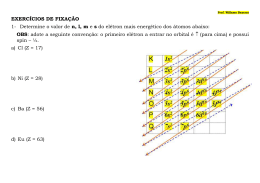
I. ESTUDO DA ELETROSFERA: Como já foi mencionado o átomo é composto por um núcleo onde estão localizados os prótons (p +) e os nêutrons (N) e pela eletrosfera onde estão localizados os elétrons girando ao redor do núcleo. Estes elétrons estão distribuídos em 7 camadas que rodeiam o núcleo, representadas pelas letras K, L, M, N, O, P e Q, sucessivamente depois do núcleo. A localização dos elétrons nas camadas depende da energia do elétron, pois à medida que as camadas se afastam do núcleo, estas vão ficando com maior energia. As camadas da eletrosfera representam um nível de energia, assim a camada K representa o 1º nível de energia, a camada L o segundo nível de energia e assim sucessivamente. Experimentalmente foi descoberta a quantidade máxima de elétrons em cada camada, representado abaixo: II. OS ESTADOS ENERGÉTICOS DOS ELÉTRONS Por meio de cálculos matemáticos, chegou-se à conclusão de que os elétrons se dispõem ao redor do núcleo atômico, de acordo com o diagrama energético abaixo: Esse diagrama nos fornece alguns dados importantes, como os chamados números quânticos (principal, secundário, magnético e spin). i. Número Quântico Principal (n): são as sete “escadas” que aparecem no diagrama anterior e onde os elétrons têm um conteúdo de energia crescente. Esses níveis correspondem às sete camadas (K, L, M, N, O, P e Q) do modelo de Rutherford-Bohr. Atualmente, são identificados pelo chamado número quântico principal (n), que é um número inteiro, variando de 1 a 7. Em cada camada ou nível de energia os elétrons se distribuem em subcamadas ou subníveis de energia representados pelas letras s, p, d e f em ordem crescente de energia, sendo o nível máximo de elétrons em cada subnível, também determinado experimentalmente, é de: OBS1: s Sharp p Principal d Diffuse f Fundamental ii. Número Quântico Secundário (l): são os “degraus” de cada escada existente no diagrama anterior. De cada degrau para o seguinte há, também, aumento no conteúdo de energia dos elétrons. Esses subníveis são identificados elo chamado número quântico secundário ou azimutal (l), que assume os valores 0, 1, 2 e 3, mas que é habitualmente designado pelas letras s, p, d, f, respectivamente. s=0 p=1 d=2 f=3 iii. Número Quântico Magnético (Ml ou m): completando o modelo atual da eletrosfera, devemos acrescentar que cada subnível comporta um número diferente de orbitais, cada orbital é representado simbolicamente por um quadradinho . Vemos que os subníveis (“degraus”) s, p, d, f, contêm sucessivamente 1, 3, 5, 7 (sequência de números ímpares) orbitais. Os orbitais são identificados pelo chamado número quântico magnético (Ml ou m). Num dado subnível, o orbital central tem o número quântico magnético igual a zero; os orbitais da direita têm m = +1, +2, +3; os da esquerda têm m = -1, -2, -3, como está exemplificado abaixo: -3 -2 -1 0 +1 +2 +3 Subnível s= p= d= f= -3 -2 -2 Orbitais 0 -1 0 +1 -1 0 +1 -1 0 +1 Assim, a ordem de entrada dos seis elétrons num orbital do tipo p será: +2 +2 +3 iv. Número Quântico de Spin (s): finalmente, cá [ns são negativos, por que não se repelem e se afastam? A explicação é a seguinte: os elétrons podem girar no mesmo sentido ou em sentidos opostos, criando campos magnéticos que os repelem ou os atraem. Essa rotação é conhecida como spin (do inglês to spin, girar): Desse modo, a atração magnética entre os dois elétrons contrabalança a repulsão elétrica entre eles. O spin é identificado pelo chamado número quântico de spin (Ms ou s), cujos valores são – e+ . Normalmente, a representação dos elétrons nos orbitais é feita por meio de uma seta: # RESUMINDO: III. DISTRIBUIÇÃO ELETRÔNICA: A distribuição de elétrons em um átomo pode ser realizada por meio de um diagrama chamado de Diagrama de Linus Pauling, pois foi idealizado por Linus Carl Pauling, cientista americano, como descrito abaixo: representa, por convenção, um elétron com spin negativo: s=– representa, por convenção, um elétron com spin positivo: s=+ No preenchimento dos orbitais, outra regra importante é a chamada regra de Hund ou da máxima multiplicidade, que diz: Em um mesmo subnível, de início, todos os orbitais devem receber seu primeiro elétron, e só depois cada orbital irá receber seu segundo elétron. # A distribuição eletrônica de um átomo deve obedecer à seguinte regra: “O elétron tem preferência pelos níveis e subníveis de mais baixa energia, um subnível de energia só recebe um elétron quando todos de menor energia estiverem completos”. # REPRESENTAÇÃO DE UM SUBNÍVEL DE ENERGIA COM SEUS ELÉTRONS: Ex1: Adotando como último subnível 4p5 dê os valores dos números quânticos: 4p5 indica nº quântico principal (n) indica nº quântico secundário (l) n=4 l=1 p= -1 0 +1 m=0 s=+ Ex2: Distribuição eletrônica dos seguintes átomos no estado fundamental Al, Fe, Na, Cl, O. # DISTRIBUIÇÃO ELETRÔNICA DOS ÍONS: Na configuração eletrônica de íons simples, ou seja, íons formados por um único elemento químico, a perda ou o recebimento de elétrons ocorre sempre na última camada eletrônica do átomo. # Regra geral: Os átomos com menos de 4 elétrons na última camada perdem todos esses elétrons quando se transformam em íons positivos (cátions). Alguns metais de transição também podem perder elétrons da penúltima camada. Os átomos com mais de 4 elétrons na última camada recebem o número de elétrons necessário para completar seu octeto, quando se transformam em íons negativos (ânions). Ex4: Átomo de Magnésio Z = 12: 1s2 2s2 2p6 3s2 Íon Magnésio (Mg2+) Z =12: 1s2 2s2 2p6 Átomo Ferro Íon Ferro III (Fe3+) Z = 26: 1s2 2s2 2p6 3s2 3p6 4s2 3d6 Z = 26: 1s2 2s2 2p6 3s2 3p6 3d5 Átomo de Flúor Íon Fluoreto (F–) Z = 9: 1s2 2s2 2p5 Z = 9: 1s2 2s2 2p6 Última camada - 13Al: 1s²; 2s²; 2p6; 3s²; 3p¹. Camada mais energética Última camada - 26Fe: 1s²; 2s²; 2p6; 3s²; 3p6; 4s²; 3d6 Camada mais energética - 11Na: - 17Cl: - 8O: OBS2: Gases Nobres Há uma forma simplificada de representar a configuração eletrônica de um elemento químico. Tomando como base a tabela periódica, pode-se escrever o símbolo do gás nobre pertencente ao período anterior e em seguida, distribui-se os elétrons que o elemento possuir a mais em relação a esse gás nobre. Veja como fica a seguir: Ex3: 7N → 1s2 2s2 2p3 7N → [He] 2s2 2p3 2 Hélio-1s : [He] P → 1s2 2s2 2p6 3s2 3p3 15 2 2 6 Neônio-1s 2s 2p : [Ne] P → [Ne] 3s2 3p3 15 EXERCÍCIOS DE FIXAÇÃO 1) (UNAMA) O nosso organismo necessita de alguns íons, que são ingeridos através dos medicamentos. Para o fortalecimento do esmalte do dente é utilizado o fluoreto de estanho II que apresenta os íons 9F¯ e 50Sn2+. Os subníveis mais energéticos destes íons são, respectivamente: a) 2p6 e 4d10 d) 2p6 e 4d8 b) 2p5 e 4p6 e) 2p4 e 5p4 5 2 c) 2p e 5p 2) (Uepa 2005) O corpo humano necessita de vários metais para o bom funcionamento de seu metabolismo, dentre eles os íons: 20Ca2+, 19K+, 11Na+ e 26Fe3+. As distribuições eletrônicas desses íons metálicos, em seus últimos níveis, são respectivamente: a)4s2, 4s1, 3s1 e 4s2 d) 3p6, 3p6, 2s6 e 4s2 2 1 1 6 b) 4s , 4s , 3s e 3d e) 3p6, 3p6, 2p6 e 3d5 1 1 2 2 c)3s , 4s , 4s e 4s 3) (Ufes 2004) A configuração eletrônica do átomo de ferro em ordem crescente de energia é 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Na formação do íon Fe2+, o átomo neutro perde 2 elétrons. A configuração eletrônica do íon formado é: a) 1s2 2s2 2p6 3s2 3p6 3d6 b) 1s2 2s2 2p6 3s2 3p6 4s2 3d4 c) 1s2 2s2 2p6 3s2 3p6 4s1 3d5 d) 1s2 2s2 2p6 3s2 3p4 4s1 3d6 e) 1s2 2s2 2p6 3s2 3p4 4s2 3d5 4) (Unesp 2004)Os agentes de cor , como o próprio nome sugere, são utilizados na indústria para a produção de cerâmicas e vidros coloridos. Tratam-se, em geral, de compostos de metais de transição e a cor final depende, entre outros fatores, do estado de oxidação do metal, conforme mostram os exemplos na tabela a seguir. Número Coloração Agente de Cor Carga atômico Verde Cr (crômio) Cr3+ 24 6+ Amarelo Cr (crômio) Cr 24 Marrom-amarelado Fe (ferro) Fe3+ 26 2+ Verde-azulado Fe (ferro) Fe 26 Azul claro Cu (cobre) Cu2+ 29 Com base nas informações fornecidas na tabela, é correto afirmar que: a) o número de prótons do cátion Fe2+ é igual a 24. b) o número de elétrons do cátion Cu2+ é 29. c) Fe2+ e Fe3+ não se referem ao mesmo elemento químico. d) o cátion Cr3+ possui 21 elétrons. e) no cátion Cr6+ o número de elétrons é igual ao número de prótons. 5) Considere as afirmações abaixo. I. em um subnível d há 7 orbitais; II. em um subnível p há 3 orbitais; III. em um orbital s cabem 2 elétrons; IV. em um orbital p cabem 6 elétrons. Quanto a tais afirmações: a) apenas a II é correta. b) apenas a I e a II são corretas. c) apenas a II e a III são corretas. d) apenas a II, a III e a IV são corretas. e) todas são corretas. 6) Um elétron localiza-se na camada “2” e subnível “p” quando apresenta os seguintes valores de números quânticos: a) n = 4 e l = 0 d) n = 3 e l = 1 b) n = 2 e l = 1 e) n = 2 e l = 0 c) n = 2 e l = 2 7) O último elétron distribuído de um átomo de um determinado elemento químico tem a ele associados os seguintes números quânticos: 4, 0, 0 e + . É correto afirmar que: a) O átomo tem os seus elétrons distribuídos em três camadas de energias. b) O átomo tem dez elétrons distribuídos em orbitais do tipo p. c) O último elétron distribuído desse átomo encontra-se em um orbital do tipo s. d) O número total de elétrons desse átomo é igual a 16. e) O valor numérico do número quântico secundário associado ao penúltimo elétron desse átomo é igual a 2. 8) Sendo o subnível 4s1 (com um elétron) o mais energético de um átomo, podemos afirmar que: I. o número total de elétrons deste átomo é igual a 19; II. este átomo apresenta 4 camadas eletrônicas; III. sua configuração eletrônica é: 1s2; 2s2; 2p6; 3s2; 3p6; 3d 10; 4s1 a) Apenas a afirmação I é correta. b) Apenas a afirmação II é correta. c) Apenas a afirmação III é correta. d) As afirmações I e II são corretas. e) As afirmações I e III são corretas. 9) Um átomo que possui, no último nível, um elétron desemparelhado com os seguintes números quânticos: n = 5; l = 0; m = 0; s = – , tem número atômico igual a: a) 31 b) 37 c) 41 d) 47 e) 51 10) A configuração eletrônica do íon Ni 2+ (Z = 28) é: a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 b) 1s2 2s2 2p6 3s2 3p6 4s2 3d8 c) 1s2 2s2 2p6 3s2 3p6 4s1 3d7 d) 1s2 2s2 2p6 3s2 3p6 4s2 3d6 e) 1s2 2s2 2p6 3s2 3p6 3d8 11) O átomo de magnésio tem número atômico 12 e número de massa 24. Qual é a alternativa correta relativa ao Mg que perdeu 2 elétrons? a) Tem 12 elétrons. b) Tem 10 nêutrons. c) Tem 10 prótons. d) Tem configuração eletrônica 1s2 2s2 2p6 3s2. e) Tem configuração idêntica à do Na (Z = 11) que perdeu 1 elétron. 12) Considere três átomos: A, B e C. Os átomos A e C são isótopos; os átomos B e C são isóbaros e os átomos A e B são isótonos. Sabendo que o átomo A tem vinte prótons e número de massa 41, e que o átomo C tem 22 nêutrons, os números quânticos do elétron mais energético do átomo B são: a) n = 3; l = 0; m = 2; s = – b) n = 3; l = 2; m = 0; s = – c) n = 3; l = 2; m = –2; s = – d) n = 3; l = 2; m = – 1; s = + e) n = 4; l = 3; m = – 1; s = +
Download