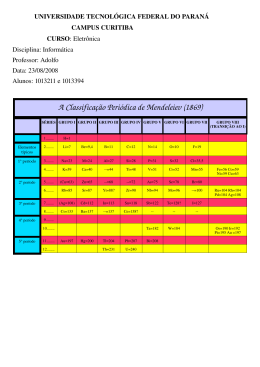
ESCOLA SECUNDÁRIA DE EMÍDIO NAVARRO Ano lectivo 2009/2010 Física Química A 10º ano Turma: _____ Os Elementos na Tabela Periódica (TPC) Lê com atenção o texto seguinte e responde às questões No século XIX, quando os químicos tinham apenas uma vaga ideia dos átomos e das moléculas, e não sabiam da existência de protões e electrões, idealizaram a Tabela Periódica utilizando os seus conhecimentos das massas atómicas. Em 1864, o químico inglês Newlands reparou que, quando os elementos conhecidos eram dispostos segundo a sua massa atómica, cada oitavo elemento tinha propriedades semelhantes. No entanto, verificou que esta relação era inadequada em elementos paraalém do cálcio. Em 1869, o químico russo Mendeleiev e o químico alemão Lothar Meyer propuseram independentemente uma disposição dos elementos numa tabela muito mais extensiva, baseada na repetição regular e periódica das suas propriedades. Apesar do seu sucesso, as primeiras versões da Tabela Periódica tinham algumas inconsistências flagrantes. Por exemplo, a massa atómica do árgon é maior do que a do potássio. Se os elementos fossem dispostos unicamente de acordo com o aumento da massa atómica, o árgon apareceria na posição ocupada pelo potássio na Tabela Periódica actual. Em 1913, Moseley descobriu que, com algumas excepções, à ordem crescente de número atómico corresponde uma ordem crescente de massa atómica. As discrepâncias mencionadas anteriormente fazem agora sentido. O número atómico do árgon é 18 e o do potássio é 19, e assim o potássio deverá seguir o árgon na Tabela Periódica.» CHANG, R. (1994). Química, 5.a edição. Lisboa: McGraw-HilI de Portugal (adaptado). 1. De acordo com o texto, selecciona a afirmação correcta. (A) A Lei das Oitavas de Newlands era baseada nas propriedades químicas dos elementos. (B) Com as descobertas de Moseley, o árgon e o potássio trocaram as suas posições na Tabela Periódica. (C) Mendeleiev deu mais importância às propriedades químicas dos elementos do que às suas massas atómicas. (D) Na Tabela Periódica de Mendeleiev, o árgon aparecia na posição actual do potássio. 2. De acordo com o texto, selecciona a afirmação incorrecta. (A) A periodicidade de propriedades verificada por Newlands deveu-se ao desconhecimento da existência dos gases nobres. (B) De uma forma geral, as massas atómicas aumentam com o número atómico. (C) Mendeleiev organizou a Tabela Periódica, respeitando integralmente a ordem crescente de massas atómicas. (D) Os químicos do século XIX desconheciam o conceito de número atómico. 3. Escolhe a opção correcta para o significado da frase do texto «Apesar do seu sucesso, as primeiras versões da Tabela Periódica tinham algumas inconsistências flagrantes.» (A) Alguns dos elementos descobertos após 1869 não podiam ser inseridos de forma satisfatória na Tabela Periódica. (B) Nas primeiras Tabelas Periódicas, a posição ocupada por alguns elementos não respeitava a ordem crescente de massas atómicas. (C) Não era possível colocar todos os elementos conhecidos na altura nas primeiras Tabelas Periódicas. (D) Verificou-se que os elementos que faltavam nas primeiras Tabelas Periódicas tinham propriedades completamente diferentes das previstas 4. Explica a relação entre o número atómico de um elemento e a sua posição na Tabela Periódica. Os elementos na TP (retirado do livro “Elementos”, Química A, 10º Ano, Santillana, Constância) Os elementos na TP
Baixar