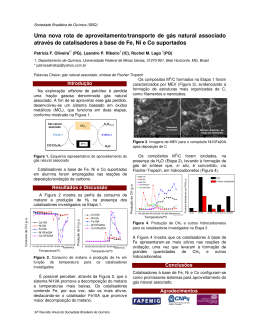
REDEMAT REDE TEMÁTICA EM ENGENHARIA DE MATERIAIS UFOP – CETEC – UEMG UFOP - CETEC - UEMG Dissertação de Mestrado “Obtenção de matrizes dopadas com metais de transição: estudo da atividade catalítica em reações de química fina" Autor: Anderson Gabriel Marques da Silva Orientadora: Profª. Drª. Patricia A. Robles-Dutenhefner Fevereiro de 2013 REDEMAT REDE TEMÁTICA EM ENGENHARIA DE MATERIAIS UFOP – CETEC – UEMG UFOP - CETEC - UEMG Anderson Gabriel Marques da Silva “Obtenção de matrizes dopadas com metais de transição: estudo da atividade catalítica em reações de química fina” Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Engenharia de Materiais da REDEMAT, como parte integrante dos requisitos para obtenção do título de Mestre em Engenharia de Materiais Área de concentração: Processos de Fabricação Orientadora: Profª. Drª. Patricia A. Robles-Dutenhefner Ouro Preto, Fevereiro de 2013 ii Agradecimentos Agradeço a Deus por ter me dado todas as oportunidades que me levaram a chegar até aqui e pela força nos momentos de desânimo. Aos meus pais, Rui e Vânia, e aos meus irmãos Isa e Alisson por sempre pregarem a educação como prioridade, pelo carinho, criação e incentivo que sempre foi me dado durante minha vida. Ao companheiro Thenner, pelo convívio e carinho durante todos esses anos e pela paciência de me aturar, principalmente, nos momentos adversos. Certamente tudo isso me incentivou a concretizar mais esse objetivo. À professora e orientadora Patrícia, por ter acreditado no meu potencial há muitos anos atrás e ter se tornado ao longo dos anos além de orientadora, uma conselheira, psicóloga e como ela costuma dizer “a mãe fora de casa” só que mais implicante. Ao professor e amigo Humberto Fajardo, pelos muitos incentivos dados, por acreditar no meu potencial e pelas inúmeras horas dedicadas a esse projeto, contribuindo muito para meu crescimento como profissional. Ao professor Anderson Dias, pelas muitas conversas que tivemos durante esse tempo, por dividir seu extenso conhecimento, sua experiência e irreverência, que certamente tiveram uma grande contribuição para minha formação. Às meninas do laboratório, Isabela, Juliana e, em especial, Débora, por ter me acompanhado nesses dois últimos anos, contribuindo para que esse trabalho fosse concluído. À Universidade Federal de Ouro Preto e ao programa de pós-graduação da REDEMAT, pela infraestrutura e oportunidade. E a todos que de alguma forma contribuíram para que esse trabalho se concretizasse. OBRIGADO! iii “A tarefa não é tanto ver aquilo que ninguém viu, mas pensar o que ninguém pensou sobre aquilo que todo mundo vê” (Arthur Schopenhauer) iv SUMÁRIO CAPÍTULO 01 .......................................................................................................................... 3 1. INTRODUÇÃO .................................................................................................................... 4 1.1. Processo sol-gel .............................................................................................................. 4 1.2. Peneiras moleculares microporosas e mesoporosas ................................................... 8 1.3. Matrizes mesoporosas ordenadas................................................................................. 9 1.4. Aplicação catalítica: reações de acoplamento Suzuki ............................................. 12 1.4.1. Acoplamentos carbono-carbono (C-C) ................................................................. 12 1.4.2. Acoplamento Suzuki : importância e aplicações .................................................. 13 1.4.3. Acoplamento Suzuki: sistemas catalíticos ............................................................. 15 1.4.4. Acoplamento Suzuki: mecanismo ......................................................................... 16 1.5. Nanociência e nanotecnologia ..................................................................................... 20 1.6. Catálise por ouro ......................................................................................................... 21 2. OBJETIVOS ....................................................................................................................... 24 3. EXPERIMENTAL ............................................................................................................. 25 3.1. Preparo dos catalisadores Pd/SiO2 e Au-Pd/SiO2 via processo sol-gel.................... 25 3.2. Preparo dos catalisadores Pd/MCM-41 e Au-Pd/MCM-41 ..................................... 25 3.3. Caracterização dos catalisadores ............................................................................... 25 3.4. Ensaios catalíticos de acoplamento Suzuki ............................................................... 26 4. RESULTADOS E DISCUSSÕES ..................................................................................... 27 4.1. Caracterização dos catalisadores ............................................................................... 27 4.2. Acoplamento Suzuki .................................................................................................... 32 4.3. Reforma a vapor do etanol ......................................................................................... 36 5. CONCLUSÕES .................................................................................................................. 37 6. REFERÊNCIAS BIBLIOGRÁFICAS ............................................................................. 38 CAPÍTULO 02 ........................................................................................................................ 48 1. INTRODUÇÃO .................................................................................................................. 49 1.1. O Foco 1: o bagaço de cana e a cadeia produtiva de etanol..................................... 49 1.2. Remediação ambiental ................................................................................................ 50 1.3. Problemas de contaminação com cromo ................................................................... 50 1.4. Materiais sólidos como catalisadores heterogêneos .................................................. 51 v 1.5. Indústria de Química Fina .......................................................................................... 52 1.6. O Foco 2: A cadeia produtiva nacional de óleos essenciais..................................... 54 2. OBJETIVOS ....................................................................................................................... 57 3. EXPERIMENTAL ............................................................................................................. 58 3.1. Preparo dos catalisadores SCB2-Co e SCB2-Cr a partir do bagaço de cana-deaçúcar modificado com anidrido succínico ...................................................................... 58 3.2. Preparo dos catalisadores EB-Cr e EB-Co a partir do bagaço de cana-de-açúcar modificado com dianidrido de EDTA ............................................................................... 58 3.3. Caracterização dos catalisadores ............................................................................... 59 3.4. Testes de oxidação catalítica ....................................................................................... 60 4. RESULTADOS E DISCUSSÕES ..................................................................................... 61 4.1. Caracterização dos catalisadores ............................................................................... 61 4.2. Testes de desempenho catalítico ................................................................................. 66 5. CONCLUSÕES .................................................................................................................. 70 6. REFERÊNCIAS BIBLIOGRÁFICAS ............................................................................. 71 ANEXO I ................................................................................................................................. 77 PRODUÇÃO CIENTÍFICA .................................................................................................. 80 vi LISTA DE FIGURAS Figura 1. Modelo esquemático do processo sol-gel ................................................................... 4 Figura 2. Esquema da obtenção de materiais pelo processo sol-gel ......................................... 6 Figura 3. Mecanismo do processo de hidrólise catalisados por (I) base e (II) ácido. ................ 7 Figura 4. Representação da polimerização da rede tridimensional de sílica ............................. 8 Figura 5. Arranjos estruturais da família M41S: a-hexagonal (MCM-41), b-cúbica (MCM-48), c-lamelar (MCM-50). ............................................................................................................... 10 Figura 6. Mecanismo LCT de formação da estrutura MCM-41 .............................................. 11 Figura 7. Principais reações de acoplamento C-C reportadas na literatura ............................. 12 Figura 8. Síntese de biarilas a partir a reação Suzuki entre haletos de arila e ácidos arilborônicos, respectivamente. ................................................................................................ 13 Figura 9. Cristais líquidos que podem ser obtidos por acoplamento Suzuki ........................... 13 Figura 10. Anti-inflamátorios que podem ser obtidos por acoplamento Suzuki ...................... 14 Figura 11. Estruturas químicas do Valsartan e Boscalid produzidos pela Novartis e BASF, respectivamente ........................................................................................................................ 14 Figura 12. Esquema simplificado do ciclo catalítico da reação Suzuki ................................... 16 Figura 13. Sistema catalítico proposto por Suzuki e colaboradores para a síntese de biarilas 17 Figura 14. Sistema catalítico proposto por Gronowitz e colaboradores para a síntese de biarilas e heterobiarilas[53] ........................................................................................................ 17 Figura 15. Sistema catalítico proposto por Lipshutz para a síntese de biarilas à temperatura ambiente[57]. .............................................................................................................................. 18 Figura 16. Sistema catalítico proposto por Sun para a síntese de biarilas utilizando cloretos de arila e Pd/C[38]........................................................................................................................... 19 Figura 17. Comparação entre a escala nanométrica e métrica. ................................................ 20 Figura 18. Influência do tamanho de partículas na coloração de soluções de ouro. ............... 22 Figura 19. Difratogramas dos catalisadores de sílica dopada com paládio e ouro tratados termicamente a 550ºC (*Au(0) /PdO)................................................................................... 28 Figura 20. Perfis de redução a temperatura programada para os catalisadores dopados com ouro e paládio ........................................................................................................................... 29 Figura 21. Isotermas de adsorção de N2 de Pd/SiO2, Au-Pd/SiO2, Pd/MCM-41 e AuPd/MCM-41 e as suas respectivas curvas de distribuição de tamanho de poros utilizando o método BJH .............................................................................................................................. 31 vii Figura 22. Padrões SAXS dos catalisadores: (a) Au-Pd/MCM-41 e (b) Pd/MCM-41 ............ 32 Figura 23. Condição de síntese de biarilas via acoplamento Suzuki-Miyaura........................ 33 Figura 24. Composição do mercado de química fina no Brasil[41] ........................................... 53 Figura 25. Estruturas químicas de monoterpenos e derivados ................................................. 54 Figura 26. Comparação da balança comercial brasileira de forma quantitativa e em termos de valor monetário para os óleos essenciais e produtos para a indústria de fragrâncias[40]. ......... 54 Figura 27. Fluxograma da cadeia produtiva de suco e óleo essencial de laranja ..................... 55 Figura 28. Interconexão entre setores industriais para a produção de insumos de química fina .................................................................................................................................................. 56 Figura 29. Proposta com as principais idéias do trabalho ........................................................ 57 Figura 30. Rota de síntese utilizada para preparo dos catalisadores SCB2-Co e SCB2-Cr. .... 58 Figura 31. Rota de síntese utilizada para preparo dos catalisadores EB-Co e EB-Cr. ............. 59 Figura 32. Espectros FTIR comparativos (a) B e SCB1; (b) B e EB ....................................... 62 Figura 33. Difratogramas das amostras Cr/BMS2 e Cr/BME .................................................. 63 Figura 34. Curvas termogravimétricas para (a) SCB2-Co, (b) SCB2-Cr, (c) EB-Co, e (d) EBCr sob atmosfera de ar. ............................................................................................................. 65 viii LISTA DE TABELAS Tabela I. Classificação de peneiras moleculares de acordo com o tamanho de poros ............... 9 Tabela II. Principais famílias de sílicas mesoporosas. ............................................................. 11 Tabela III. Características texturais obtidas por adsorção de N2 dos catalisadores de sílica ... 30 Tabela IV. Reações de Suzuki-Miyaura catalisadas por Pd/SiO2 e Au-Pd/SiO2 (sol-gel)a ...... 34 Tabela V. Reações de Suzuki-Miyaura catalisadas por Pd/MCM-41 e Au-Pd/MCM-41a ...... 35 Tabela VI. Características texturais dos materiais SCB2 e EB ................................................ 62 Tabela VII. Dados termogravimétricos para a decomposição térmica SCB2-Co, SCB2-Cr, EB-Co e EB-Cr......................................................................................................................... 64 Tabela VIII. Oxidação de -citronelol (1), limoneno (2) e -pineno (3) catalisados por adsorventes de Co e Cr em condições solvent-free a. ............................................................... 68 ix LISTA DE NOTAÇÕES Al-Alumínio Au-Ouro BET-Brunauer-Emmett-Teller BJH-Barret-Joyner-Halenda CMC-Concentração micelar crítica Co-Cobalto CO-Monóxido de carbono CoCl2.6H2O-Cloreto de cobalto (II) hexahidratado Cr-Cromo CrCl3.6H2O-Cloreto de cromo (III) hexahidratado CTAB-Brometo de cetiltrimetilamônio CTAC-Cloreto de cetiltrimetilamônio Cu-Cobre DMF-Dimetilformamida DRX-Difração de raios X EB-Bagaço modificado com EDTA EDTA-Ácido etilenodiamino-N, N, N’,N’-tetraacético EtOH-Etanol FTIR-Espectroscopia infravermelho com transformada de Fourier H2-Gás hidrogênio HAuCl4-Ácido cloroáurico HCl-Ácido clorídrico HF-Ácido fluorídrico HMS-Hexagonal mesoporous solids ICP-AES-Espectrometria de emissão atômica com plasma indutivamente acoplado IUPAC-International union of pure and applied chemistry LCT-Liquid crystal templating M41S-Móbil 41 Synthesis MCM-41-Mobil crystalline material No. 41 MCM-48-Mobil crystalline material No. 48 MCM-50-Mobil crystalline material No. 50 x N2-Nitrogênio molecular O2-Oxigênio molecular Pd-Paládio Pd(OAc)2-Acetato de paládio II PdO-Oxido de paládio PdCl2-Cloreto de paládio II PNSB-Pesquisa nacional de saneamento básico RTP-Redução à temperatura programada SAXS-Espalhamento de raios X a baixo ângulo SBA-15-Santa Bárbara Amorfous No15 SCB-Bagaço succinilado SiCl4-Tetracloreto de silício SiO2-Sílica TEOS-Tetraetilortosilicato TGA-Análise temogravimétrica TlOH-Hidróxido de tálio TMOS-Tetrametilortosilicato Zn-Zinco xi Resumo Este trabalho foi dividido em duas partes independentes. No capítulo 1, foram preparados catalisadores heterogêneos via processo sol-gel e via MCM-41 utilizando sílica como matriz e os metais transição Pd e Au-Pd como dopantes. Os compósitos de Pd e AuPd foram caracterizados por difração de raios X (DRX), análise de adsorção-dessorção de N2 através da equação BET e do método BJH, redução à temperatura programada (RTP), espectrometria de emissão atômica com plasma indutivamente acoplado (ICP-AES) e espalhamento de raios X a baixo ângulo (SAXS). O desempenho catalítico dos compósitos foi avaliado em reações de acoplamento Suzuki através de um sistema catalítico no qual uma série de haletos de arila e o ácido fenilborônico foram utilizados como substratos. Os resultados dos testes indicaram a obtenção de biarilas em rendimentos entre 50 e 99%. Nos testes de reciclo, os catalisadores não mostraram perda significativa da atividade (< 5%). A presença do metal ouro em catalisadores de paládio provocou um aumento na atividade catalítica. Além disso, os catalisadores preparados por MCM-41 também se mostraram mais ativos que os catalisadores preparados por sol-gel. No capítulo 2, foi desenvolvido um processo sustentável que abrange as cadeias produtivas da indústria sucroalcooeira e da química fina interconectado com o desenvolvimento sustentável das mesmas através da valorização de resíduos como o bagaço de cana. Este material orgânico foi utilizado como adsorvente na remoção de contaminantes ambientais e como matriz de catalisadores heterogêneos na valorização de matéria-prima nacional, via oxidação seletiva de componentes dos óleos essenciais, gerando produtos de alto valor agregado. O esquema abaixo representa o resumo gráfico do trabalho. Resumo gráfico do trabalho Abstract This work was divided into two independent parts. In the chapter 1, heterogeneous catalysts were prepared by sol-gel and MCM-41 using silica as matrix and the Pd and AuPd as dopants. The Pd and Au-Pd composites were characterized by X-ray diffraction (XRD), adsorption of N2 through the BET equation and the BJH method, temperature programmed reduction (TPR), inductively coupled plasma-atomic emission spectroscopy (ICP-AES) and small-angle X-ray scattering (SAXS).The catalytic performance of the catalysts was evaluated in Suzuki coupling reactions using a catalytic system in which several aryl halides and phenylboronic acid were used as substrates. The Biaryls were obtained in yields between 50-99%. In recycle tests, the catalysts did not show significant loss of activity (<5%). The presence of gold metal on the palladium catalysts showed an increase in the catalytic activity as compared to the palladium monometallic catalysts. Furthermore, the catalysts prepared by MCM-41 were more active than the catalysts prepared by sol-gel. In the chapter 2, we have developed a process that relates the productive chains of the ethanol and Fine Chemicals industries interconnected with the sustainable development of them through the valorization of waste such as sugarcane bagasse. This organic material was used as adsorbents for the removal of environmental contaminants and as heterogeneous catalysts for adds value to national biodiversity raw materials. The catalytic application selected was the selective oxidation of essential oils, obtaining products of high added value. The diagram below represents the abstract Graphical Abstract Waste: Sugarcane bagasse Use of bagasse as adsorbent for environmental remediation of heavy metals Removal of chromium in effluent using a sugarcane bagasse adsorbent Application of Cr-containing adsorbent as heterogeneous catalyst Adding value to essential oils through the use of adsorbents as heterogeneous catalysts Obtaining compounds of interest to the fragrance and food companies 2 Capítulo 01 Preparo e caracterização de materiais mesoporosos: obtenção de matrizes de sílica à base de Pd e Au-Pd para utilização como catalisadores heterogêneos em reações de acoplamento Suzuki 3 1. Introdução Catalisadores heterogêneos têm numerosas aplicações industriais, sendo utilizados na indústria química, petroquímica, farmacêutica, agroquímica e outras[1-5]. Um catalisador heterogêneo é composto de sítios ativos que irão catalisar a reação (normalmente metais de transição) na superfície de um sólido inerte, que é conhecido como suporte ou matriz[6-7]. Usualmente, possuem áreas superficiais elevadas (até 1600m2g-1) e são desejáveis para maximizar o número de sítios ativos por unidade de volume do reator[8]. Dessa forma, a busca por rotas de síntese eficientes para obtenção destes materiais é um desafio para químicos, físicos, engenheiros de materiais e outros profissionais afins. 1.1. Processo sol-gel A polimerização inorgânica, mais conhecida como "processo sol-gel", é um método geral para a preparação de óxidos inorgânicos à temperatura ambiente e via úmida (ou seja, em solução), sendo descoberto por Ebelmann em 1846[9]. Em seu trabalho pioneiro, ele descreveu a preparação da sílica a partir de SiCl4 e álcool após observar a ocorrência de um processo de gelatinização, obtendo assim, um sólido transparente e no formato do recipiente. O termo sol é utilizado para definir uma dispersão estável de partículas coloidais (de 1 a 100nm) em um fluido, e gel o resultado estrutural rígido dessas partículas coloidais (gel coloidal). Dessa forma, o processo sol-gel (Figura 1) consiste na formação de uma rede inorgânica a partir da gelação de uma suspensão coloidal (sol). Figura 1. Modelo esquemático do processo sol-gel 4 O processo sol-gel ganhou notoriedade em 1932, quando Kistler[10] demonstrou em seus estudos que a estrutura do gel não era desfeita em algumas condições específicas de secagem, permitindo comprovar a existência do esqueleto da estrutura do sólido no interior do gel. Além disso, também demonstrou que era possível ter o controle da porosidade destes materiais, viabilizando a obtenção de sólidos de interesse industrial com elevadas, médias e baixas áreas superficiais. Em 1939, este processo foi utilizado pela primeira vez em escala industrial, quando os pesquisadores Geffcken e Bergen[11] (da empresa Schott Glass) desenvolveram um processo de síntese e deposição de filmes finos de óxidos metálicos sobre vidros. No final da década de 60 e início de 70, a indústria cerâmica começou a se interessar pela química do sol-gel, uma vez que este processo possibilita o controle das taxas de hidrólise e condensação de alcóxidos durante a preparação de vidros multicomponentes[11]. No entanto, somente após demonstrarem que compostos sólidos podiam ser produzidos pela secagem desses géis, que se verificou uma grande expansão na aplicação deste processo para as inúmeras áreas da indústria. Desde então, ocorreu uma explosão do uso do processo sol-gel em diversos campos da tecnologia, tais como a fabricação de materiais para isolamento térmico e acústico, catalisadores, materiais vítreos avançados e materiais com propriedades ópticas[12-16]. A síntese destes colóides[17,18] utiliza precursores de um metal ou elemento metalóide cercado por vários ligantes reativos, água e um catalisador (ácido ou base). A sílica (SiO2) é a matriz inorgânica mais utilizada pelo processo sol-gel, por ser versátil e inerte, possibilitando a fabricação de materiais com inúmeras propriedades. Além disso, possui menor custo associado quando comparado a outras matrizes como titânia, zircônia e céria. Os precursores de sílica mais utilizados são o tetrametilortosilicato (TMOS) e o tetraetilortosilicato (TEOS). A Equação (1.1) evidência o resultado global da hidrólise de um precursor de sílica Si(OR)4(R=Me, Et, iPr) em presença de um catalisador. Cat Si(OR)4(l) + 2H2O(l) SiO2(s) + EtOH(l) (1.1) A tecnologia sol-gel é extremamente versátil devido à possibilidade de se manipular de forma simples a textura, a estrutura, a configuração, a composição e até as características químicas das matrizes obtidas[10,18]. Além disso, os géis úmidos advindos do processo de polimerização têm a capacidade de assumir a forma e o volume do recipiente 5 que o originou, podendo ser submetidos a distintos tratamentos térmicos para a obtenção de géis secos com diferentes propriedades. O processo ainda permite a produção de cerâmicas com variadas formas e configurações geométricas: filmes, pós, monolitos, placas e fibras[17,18]. A Figura 2 ilustra as principais etapas para a obtenção de materiais pelo processo sol-gel. Figura 2. Esquema da obtenção de materiais pelo processo sol-gel A polimerização inorgânica é um processo bastante semelhante à polimerização orgânica. O mecanismo de propagação dessa reação[17,18] é bastante complexo, uma vez que o crescimento da cadeia polimérica pode ocorrer em todas as extremidades em que sejam possíveis ocorrer reações de hidrólise. A fase inicial de uma síntese sol-gel envolve a reação de hidrólise do precursor metálico/metalóide na qual, moléculas de água “atacam” o elemento central eletrofílico do alcóxido formando a espécie intermediária contendo o grupo funcional silanol. Estas espécies intermediárias reagem entre si ou com outras moléculas de precursor em reações de homocondensação e heterocondensação, gerando assim, a rede polimérica tridimensional. As equações de hidrólise (1.2), homocondensação (1.3) e heterocondensação (1.4) evidenciam as principais reações intermediárias envolvidas na polimerização inorgânica. 6 Si-OR + H2O Si-OH + Si-OH Si-OH + Si-OR Si-OH + ROH Si-O-Si Si-O-Si + H2O + ROH (1.2) (1.3) (1.4) A formação das espécies intermediárias é termodinamicamente favorável. No entanto, cineticamente pode demandar dias ou semanas para que ocorra o término da polimerização[18]. Dessa forma, o processo pode ser acelerado com a utilização de ácidos ou bases inorgânicas, de modo que a reação ocorra com catálise básica ou ácida, gerando produtos com propriedades finais diferentes. Estas reações intermediárias foram estudadas por Zerda e Hoang’s[19] e esquematizaram o mecanismo de hidrólise do precursor alcóxido conforme a Figura 3. Figura 3. Mecanismo do processo de hidrólise catalisados por (I) base e (II) ácido. À medida que as reações de hidrólise, homocondensação e heterocondensação evoluem, cadeias poliméricas cada vez maiores e/ou mais ramificadas são formadas através de ligações em ponte do tipo oxo, hidroxo e alcóxidos residuais, dando origem à formação de oxopolímeros (polímeros ramificados) e, em seguida, aos óxidos hidratados (Figura 4). Este processo é conhecido como gelificação. A etapa posterior à formação do gel é a secagem, que envolve a remoção da fase líquida intersticial do gel, constituída por solventes e subprodutos de baixo peso molecular e originadas pelas reações de hidrólise e condensação. De acordo com o método de secagem selecionado e da forma como a amostra se encontra no pré-secagem (Figura 2), pode-se obter materiais com diferentes estruturas e propriedades. 7 OR OR OR RO Si OR OR OR RO Si O Si OR OR OR OR OR RO Si O Si OR OR O RO Si OR OR OR RO Si O Si OR O O OR RO Si O Si O Si OR OR O OR RO Si OR OR Partícula sólida composta por uma rede tridimensional feita de ligações Si-O-Si Figura 4. Representação da polimerização da rede tridimensional de sílica 1.2. Peneiras moleculares microporosas e mesoporosas Em 1932, Mcbain[20] utilizou o termo “peneiras moleculares” para definir um conjunto de zeólitas naturais que exibem capacidade adsortiva seletiva em função do seu diâmetro de poros e/ou geometria, polaridade, etc. Dessa forma, para que um material fosse considerado uma peneira molecular, deveria ter a capacidade de separar componentes de uma mistura com base nos parâmetros de diferença de tamanho ou funcionalidade química. Naquela época, somente duas classes de peneiras moleculares eram conhecidas: as zeólitas e os carvões, sendo ambos microporosos. As cavidades e canais de dimensões bem definidas das peneiras moleculares e suas propriedades intrínsecas tais como, a capacidade de realizar adsorção seletiva de moléculas entre poros, troca-iônica, possuírem estabilidade térmica e alta área superficial, conferem a esses materiais um grande campo de aplicação tecnológica tal como, fotosensores, semicondutores, catalisadores, adsorventes e o uso em liberação controlada de fármacos[2126] . Com o avanço da ciência e engenharia de materiais, ocorreu o surgimento de diversos materiais com as mesmas propriedades, sendo o conceito estendido também para silicatos, aluminofosfatos, silicoaluminofosfatos, metaloaluminatos, metalosilicatos, além das zeólitas e carvões já pertencentes a esta categoria de materiais. 8 De acordo com a IUPAC[27], as peneiras moleculares podem ser classificadas em três grupos específicos de acordo com a faixa de distribuição de tamanho de poros. A Tabela I apresenta a classificação das peneiras moleculares. Tabela I. Classificação de peneiras moleculares de acordo com o tamanho de poros Classificação Tamanho de poros (nm) Exemplos de materiais Microporoso <2 ZSM-5, Cloverita Mesoporoso 2-50 MCM-41, SBA-15 Macroporoso >50 Resinas poliméricas 1.3. Matrizes mesoporosas ordenadas A primeira síntese de um material mesoporoso ordenado foi descrita em uma patente em 1969. Entretanto, devido à falta de dados analíticos, suas principais características não foram reconhecidas[28]. Em 1992, pesquisadores da Mobil Oil Corporation sintetizaram em meio alcalino uma nova classe de materiais mesoporosos baseados em silicatos com estrutura de poros ordenados, com tamanho e formato de poros bem definidos e ajustáveis, na faixa de 1,6 a 10nm[29]. Esta família foi denominada de M41S (Móbil 41: Synthesis). A inovação desses materiais foi a utilização de surfactantes como direcionadores ou template de arranjo estrutural, no lugar de espécies catiônicas ou aniônicas largamente utilizadas. Após a divulgação da síntese das peneiras moleculares mesoporosas pela Mobil, um grande interesse foi despertado na comunidade científica nas áreas de mecanismos de formação[30], [34] morfologia caracterização[31-32], síntese de novos materiais[33] e controle da . De acordo com os pesquisadores da Móbil[29], a família M41S é composta basicamente por três arranjos estruturais (Figura 5). As condições de síntese irão determinar se a estrutura da sílica mesoporosa terá a fase cúbica (MCM-48), a fase hexagonal e mais conhecida (MCM-41) ou a estrutura lamelar e termicamente instável conhecida como MCM-50. 9 Figura 5. Arranjos estruturais da família M41S: a-hexagonal (MCM-41), b-cúbica (MCM48), c-lamelar (MCM-50). A sílica mesoporosa MCM-41 é a membro da família M41S mais pesquisada e apresenta uma distribuição estreita de tamanho de poros entre 1,0 e 2,0nm, arranjo hexagonal de poros monodimensionais, excelente estabilidade térmica até 700ºC, altos valores de área superficiais (até 1200m2/g) e acessibilidade de moléculas grandes no interior dos poros[29,33,35]. A síntese desses materiais é realizada por policondensação hidrolítica (processo solgel modificado) de um alcóxido de silicato como o TEOS. A reação é realizada em água e na presença de um surfactante que atua como um modelador da geometria e do tamanho do poro. A interação de estruturas organizadas de surfactantes com as espécies de silicatos em solução cumpre um papel muito importante na formação da estrutura mesoporosa [29,35]. Muitos estudos foram realizados com o intuito de explicar o mecanismo de formação das estruturas da família MS41. Uma proposta bastante aceita na literatura é o mecanismo LCT (Liquid Crystal Templating) de Beck e colaboradores[35] e se baseia na semelhança entre as estruturas da família MS41 (Figura 6) . A molécula de surfactante é composta por uma parte polar e outra apolar e tem como característica a tendência de formar agregados relativamente estáveis chamados de micelas. A menor concentração em que as moléculas de surfactante se agregam em micelas isotrópicas esféricas é denominada de concentração micelar crítica (CMC1). Um acréscimo de surfactante inicia a agregação das micelas para formar micelas tubulares, até atingir a concentração CMC2. A fase hexagonal característica do MCM-41 é resultante do empacotamento das micelas tubulares. Após adição do precursor de silicato sobre esta estrutura empacotada, inicia-se a etapa de polimerização sobre a superfície desses agregados hexagonais e, em seguida, em uma etapa de calcinação, ocorre a remoção das moléculas de surfactantes de modo a preservar a estrutura altamente 10 ordenada. . Figura 6. Mecanismo LCT de formação da estrutura MCM-41 Após a divulgação e repercussão da síntese da peneiras moleculares da família M41S, muitos pesquisadores concentraram seus estudos no desenvolvimento de novos sólidos mesoporosos a base de silicatos. Dessa forma, outras famílias de materiais mesoporosos se consolidaram, expandindo significativamente seus potenciais de aplicação nos mais diversos campos. Entre eles, destaca-se a sílica mesoporosa com estrutura hexagonal altamente ordenada, SBA-15[36], que é sintetizada utilizando surfactantes comerciais em forte meio ácido, resultando em uma rede hexagonal de mesoporos apresentando diâmetros de poros de aproximadamente 6,0nm, o qual é significativamente maior que o valor de 1,52,0nm característico da estrutura do MCM-41. A faixa de tamanho de poros desses novos materiais depende significativamente do surfactante utilizado e das condições de síntese. A Tabela II expõe as principais famílias de materiais mesoporosos a base de silicatos. Tabela II. Principais famílias de sílicas mesoporosas Tipo MCM Surfactante Geometria Diâmetro de Área Específica de poros poro (nm) (m2/g) CTABa Hexagonal 1,5-20 Até 1400 CTACb Canais 2-3 Até 1200 5-10 até 800 (Mobil Crystalline Material) HMS (Hexagonal Mesoporous Solids) SBA tridimensionais P123c hexagonal (Santa Bárbara) a Brometo de cetiltrimetilamônio (CTAB) b Cloreto de cetiltrimtilamônio (CTAC) c P123 (PEO)20(PPO)70(PEO)20 11 1.4. Aplicação catalítica: reações de acoplamento Suzuki 1.4.1. Acoplamentos carbono-carbono (C-C) As reações de acoplamento C-C têm ganhado grande notoriedade na comunidade científica nos últimos 30 anos[37,38] por possibilitar a construção de moléculas complexas, de grande interesse industrial através de uma ou poucas etapas reacionais. Antes da descoberta destas reações, demandavam-se inúmeras etapas com rendimentos globais inferiores e tempos de reação muito superiores. A reação de acoplamento C-C[37] é um termo genérico para definir uma classe de reações em que dois fragmentos de hidrocarbonetos se ligam com o auxílio de um catalisador de um metal de transição. Embora cada reação de acoplamento C-C tenha sua característica intrínseca, algumas etapas são comuns para todas[39-40], como a utilização de um metal de transição como catalisador e a ocorrência de adição oxidativa de haleto ou triflato orgânico ao respectivo metal. Outra característica é a utilização de compostos organometálicos (-Zn, -Cu, -Al, organo-boro). Algumas reações de acoplamento C-C ganharam tanta evidência que ficaram intituladas pelo nome do pesquisador que a desenvolveu (Figura 7). De maneira geral, a reação ocorre entre compostos orgânicos ou organometálicos (nucleófilos) e haletos orgânicos (eletrófilos). R1 Cl + R R1 Cl + R2 R1 Cl + R1 Cat base 2 R2 (Heck) R1 BR3 Cat base R1 R2 Cat base R1 Cl + R2 ZnX Cat R1 base R2 (Negishi) R1 Cl + R2 SnR3 Cat base R1 R2 (Stille) R1 Cl + R2 MgX Cat R1 base R2 R2 (Suzuki) R2 (Sonogashira) (Kumada-Corriu) Figura 7. Principais reações de acoplamento C-C reportadas na literatura 12 1.4.2. Acoplamento Suzuki : importância e aplicações A reação de Suzuki [39,41-42] é um tipo de acoplamento C-C em que um composto organometálico do tipo organoboro reage com um haleto orgânico, catalisados por complexos de Pd(0), para formar ligações entre carbonos de diferentes tipos de hibridização. Suzuki e seus coautores[39,41-42] deram início a um grande avanço para a ciência, reportando a possibilidade da formação de ligações aril-aril, vini-vinil e alquilalquil e dessa forma, possibilitou a construção de moléculas complexas e de grande importância industrial, como fármacos, corantes, polímeros, herbicidas e novos materiais[43,44]. A Figura 8 ilustra a formação da ligação aril-aril a partir de um haleto de arila e um ácido arilborônico. X B(OH)2 R' R + R' Cat R Figura 8. Síntese de biarilas a partir a reação Suzuki entre haletos de arila e ácidos arilborônicos, respectivamente Em relação ao desenvolvimento de novos materiais a partir da reação Suzuki, existem relatos do desenvolvimento de cristais líquidos[45], oximas[46] , polímeros[47] e drogas [48]. A Figura 9 ilustra alguns cristais líquidos que podem ser sintetizados por acoplamento Suzuki. Figura 9. Cristais líquidos que podem ser obtidos por acoplamento Suzuki 13 Uma das aplicações mais importantes é a síntese de fármacos. A utilização da reação Suzuki é um elemento chave para o desenvolvimento de um processo simples e com poucas etapas de processo. Existem relatos da síntese de anti-inflamatórios importantes como o ibuprofeno e naproxeno[49] (Figura 10), drogas para o combate da malária, antibióticos, fármacos para o tratamento de tumores na mama e anti-virais. CH3 O CHCOOH OH Ibuprofeno H3CO Naproxeno Figura 10. Anti-inflamátorios que podem ser obtidos por acoplamento Suzuki Em relação a processos que atualmente utilizam a reação de acoplamento Suzuki em escala industrial, pode-se citar os caso da síntese do fungicida Boscalid (fabricado pela BASF de São Paulo[50]) e o anti-hipertensivo Valsartan[51] (produzido pela Novartis). A Figura 11 ilustra as estruturas do Valsartan e do Boscalid. Figura 11. Estruturas químicas do Valsartan e Boscalid produzidos pela Novartis e BASF, respectivamente A relevância dessa reação é tão grande que em 2010, Akira Suzuki, Richard Heck e Ei-Ichi Neguishi receberam o prêmio Nobel da Química[52] pelo desenvolvimento de técnicas capazes de sintetizar moléculas orgânicas complexas utilizadas na fabricação corantes, cosméticos e diversos fármacos entre eles os utilizados no tratamento de câncer. 14 1.4.3. Acoplamento Suzuki: sistemas catalíticos Em relação aos substratos utilizados em sistemas catalíticos capazes de realizar o acoplamento Suzuki é importante ressaltar alguns pontos[38,39]. Na literatura, é relatada a utilização da reação para a formação de ligações entre grupos arila, vinila e alquila. Contudo, o acoplamento C-C entre anéis aromáticos é o mais utilizado devido à sua grande aplicação industrial. Embora existam várias opções disponíveis de compostos organometálicos à base de boro, os ácidos borônicos são os mais utilizados por apresentarem características importantes como baixa toxicidade, serem inertes em água e resistentes à oxidação ao ar. Para os haletos de arila, a ordem de reatividade para a adição oxidativa é I > OTf > Br > Cl, sendo um comportamento coerente, uma vez que é inversamente proporcional à energia de ligação carbono-halogênio[39,41]. Os cloretos de arila são os substratos mais promissores para serem utilizados em escala industrial por serem os de menores custos, de fácil obtenção e com grande disponibilidade no mercado. Contudo, são os menos reativos da classe de haletos para a reação Suzuki. Em relação aos grupos substituintes em haletos de arila, é necessário ressaltar que, tal como na substituição nucleofílica, a presença de grupos eletrorretiradores aumenta a reatividade do substrato, uma vez que o anel se torna ainda mais eletrodeficiente. A presença de grupos eletrodoadores promove o efeito contrário ao citado. Quanto ao catalisador para reação Suzuki[38-40,42], a maiorias dos sistemas catalíticos utilizam complexos de paládio em fase homogênea. Inúmeros trabalhos têm sido publicados nas últimas décadas com o intuito de desenvolver catalisadores ativos e recicláveis à base de complexos de paládio. No entanto, a reação em fase homogênea representa um gargalo quando se transpõe para a escala industrial, pois muitas etapas de purificação de produtos e recuperação do catalisador são necessárias para este tipo de processo. Trabalhos recentes têm relatado o desenvolvimento de catalisadores heterogêneos à base de paládio que são ativos para a reação Suzuki, embora problemas relativos à lixiviação da fase metálica, baixa conversão e rendimentos de produtos têm sido relatados. Outro desafio é a utilização de solventes mais “limpos” como a água[38,40,42]. No entanto, a baixa solubilidade dos substratos diminui a eficiência catalítica dos sistemas e a alta polaridade dos solventes contribui para a lixiviação da fase ativa quando utilizados 15 catalisadores heterogêneos. A maioria dos trabalhos relatados na literatura utiliza solventes organoclorados ou hidrocarbonetos como diclorometano, triclorometano, n-hexano, cicloexano, etc. Dessa forma, esforços têm sido direcionados para alcançar melhorias na reação de Suzuki, projetando materiais sólidos com propriedades catalíticas à base de paládio, de modo a realizar um acoplamento seletivo, de menor custo e com etapas de purificação mais simplificadas. 1.4.4. Acoplamento Suzuki: mecanismo O ciclo catalítico da reação Suzuki[39,41,42] ocorre de maneira similar aos outros mecanismos de acoplamento C-C. Na primeira etapa, ocorre a adição oxidativa do haleto de arila para a esfera de coordenação do metal de transição (normalmente Pd para a reação Suzuki) ou complexo de metal de transição. Dessa forma, o metal M é oxidado de MM2+. Em seguida, ocorre a etapa de transmetalação, em que o nucleófilo (organoboro para a reação Suzuki) transfere a fração carbônica para o metal e captura o haleto formando um acido de Lewis, o qual é neutralizado por uma base que normalmente é adicionada no inicio da reação. A última etapa é a eliminação redutiva, na qual o metal é reduzido para seu estado de oxidação inicial após ocorrer a formação da ligação C-C e a saída da nova molécula da esfera de coordenação do metal. A Figura 12 ilustra o ciclo catalítico da reação Suzuki. Este ciclo é bem aceito na literatura pela maioria dos autores e é extendido para os tipos de acoplamento tais como Negishi, Stille, Sonogashira e outros. Figura 12. Esquema simplificado do ciclo catalítico da reação Suzuki 16 1.4.5. Acoplamento Suzuki: evolução da síntese de biarilas No início da década de 80, Suzuki e seus colaboradores[39,41,42] avançaram os estudos de reações de acoplamento reportando a descoberta da formação de ligações aril-aril catalisadas por paládio e utilizando ácidos borônicos como nucleófilo. Neste trabalho, uma série de brometos de arila substituídos foi utilizada para reagir com o ácido fenilborônico em presença de um complexo de paládio coordenado com fosfinas (Figura 13). A dificuldade reportada por Suzuki neste trabalho inicial é que o sistema não funcionava para substratos ortossubstituidos. Somente após 11 anos, em 1992, o mesmo grupo de pesquisadores propôs um novo sistema em que obtiveram biarilas ortossubstituidas em rendimentos entre 50-94%. X B(OH)2 + R R' X=Br R= -Me, -OMe,Cl... R' Pd(PPh3)4 Benzeno,80ºC K2CO3 R 66-94% R'=H Figura 13. Sistema catalítico proposto por Suzuki e colaboradores para a síntese de biarilas Com os primeiros trabalhos publicados sobre a reação Suzuki e a grande repercussão causada na comunidade científica, muitos pesquisadores investiram no estudo da reação e contribuíram para a evolução da reação. Em 1984, Gronowitz[53] reportou a reação entre tiofenos para a síntese de anéis condensados via reação Suzuki (Figura 14). R (HO)2B R R Br 3% Pd(PPh3)4 + S R DME,H2O, K2CO3 S S 57-70% S Figura 14. Sistema catalítico proposto por Gronowitz e colaboradores para a síntese de biarilas e heterobiarilas[53] Em 1994, Smith[54] e colaboradores realizaram estudos mecanísticos na reação Suzuki. Eles estudaram a síntese de derivados do Losartan que pertence a uma classe de drogas desenvolvidas para o tratamento da pressão sanguínea elevada. No mesmo ano, Wallow e Novak[55] mostraram que a inibição dos ligantes fosfina podia ser um elemento 17 chave na eficiência catalítica de acoplamento de arilas. Eles mostraram que o mesmo processo pode acontecer na ausência de fosfinas através de um processo eficiente e mais limpo[55]. Outra contribuição relevante é a realização das reações de acoplamento Suzuki a temperatura ambiente. Anderson e coautores[56] foram um dos primeiros a propor um sistema ativo, obtendo biarilas substituídas com rendimentos de até 90%. No entanto, o sistema demandava 18 horas de reação e utilizava TlOH, uma base com alta toxicidade (Figura 15). Muitos outros trabalhos posteriores ao de Anderson foram publicados aprimorando o estudo da reação Suzuki a temperatura ambiente. Lipshutz e coautores[57-58] obtiveram biarilas ortosubstituídas com rendimentos entre 80 e 100%. No entanto, a dependência de elevados tempos de reação ainda é um fator limitante para alguns substratos. X R B(OH)2 + X I Br I Br I Br Figura 15. R' TlOH 10% DMA,20ºC,18h Pd(PPh3)4 R 2-NO2 4-NO2 2-OMe 2-OMe 4-OMe 4-OMe R Rend.(%) 78 77 49 10 71 90 Sistema catalítico proposto por Lipshutz para a síntese de biarilas à temperatura ambiente[57] Uma das etapas fundamentais da reação Suzuki é a utilização do catalisador de paládio. A partir do trabalho inicial de Suzuki, em que se utilizava um complexo de paládio com ligantes fosfinas como catalisadores, muitas contribuições foram reportadas relatando o desenvolvimento de catalisadores de paládio com vários tipos de ligantes, tais como nitrogenados[59] e carbenos N-heterocíclicos[60], sempre com o intuito de melhorar a atividade e a estabilidade dos catalisadores. No entanto, a possibilidade da utilização de catalisadores ativos e livres de ligantes auxiliares era uma estratégia promissora. 18 Um dos primeiros estudos de catalisadores Suzuki sem o uso de ligantes auxiliares foi realizado ainda em 1994[61]. Neste estudo, os pesquisadores utilizaram um brometo de arila e um ácido fenilborônico substituído, catalisados por Pd(OAc)2, para produzir uma estrutura antifúngica, com rendimentos de até 96% para o produto de acoplamento. Em outro trabalho, Bussolari e coautores[62] desenvolveram um outro sistema em que utilizava catalisadores livre de ligantes. Com a necessidade do desenvolvimento de processos mais eficientes e com minimização de etapas de processo, impulsionaram-se os estudos para a utilização de catalisadores heterogêneos na década de 90. Marck e colaboradores[63], reportaram o desenvolvimento de um sistema para síntese de biarilas utilizando iodetos, brometos e cloretos de arila e ácido fenilborônico catalisado por Pd/C. No entanto, problemas de lixiviação de paládio foram evidenciados. Em outro trabalho, Jang[64] descreveu um sistema utilizando paládio suportado em poliestireno funcionalizado com anéis aromáticos, reportando rendimentos entre 68-99% e em até 11 horas de reação. No mesmo, trabalho é citado a reutilização do catalisador até 10 vezes sem perda da atividade. No entanto, não discute se houve lixiviação de conteúdo metálico durante a reação. Sun[38] desenvolveu um sistema utilizando Pd/C como catalisador e utilizou o ácido fenilborônico e uma série de cloretos de arila substituídos para realizar o acoplamento. Rendimentos de até 95% foram obtidos após 24 horas (Figura 16). Cl B(OH)2 + R R Pd/C 5% K2CO3 DMA,H2O 5mL,80ºC,24h R 4-NO2 4-CN 4-CF3 4-OMe 4-OMe Rend.(%) 93 95 83 32 36 (48h) Figura 16. Sistema catalítico proposto por Sun para a síntese de biarilas utilizando cloretos de arila e Pd/C[38] A partir de então, inúmeros trabalhos foram publicados reportando o desenvolvimento de catalisadores heterogêneos para a reação Suzuki[38,42]. Tem sido 19 reportada a utilização de inúmeras matrizes como sílica, alumina, titânia, polímeros orgânicos, etc. A utilização de outros metais de transição como catalisadores na reação Suzuki é reportada na literatura. Muitos estudos foram realizados com o metal níquel obtendo bons resultados para as reações de acoplamento[37,65]. Recentemente, tem sido reportado a utilização de catalisadores de ouro em reações de acoplamento Suzuki apresentando excelentes atividades catalíticas[66-67]. Ainda assim, outros estudos utilizando catalisadores bimetálicos Au-Pd demonstraram excelentes atividades catalíticas para reações de acoplamento C-C. No entanto, nenhum estudo foi encontrado visando estudar a influência do metal ouro em reações de acoplamento catalisadas por paládio. 1.5. Nanociência e nanotecnologia A nanociência e a nanotecnologia[68] são áreas da ciência que estudam a aplicação de materiais com dimensões muito reduzidas, entre 1 e 100 nanômetros, e visa principalmente, o desenvolvimento de novos materiais e dispositivos. Um nanômetro corresponde a 10-9m ou um milionésimo de um milímetro e, em ordem de grandeza, corresponde a comparar o tamanho da lua com uma pequena moeda (Figura 17). Figura 17. Comparação entre a escala nanométrica e métrica No inicio da década de 60, a nanociência começou a ser proposta pelo físico Richard Feynman[69] (Prêmio Nobel da Física 1965), que causou grande repercussão na comunidade científica ao sinalizar a possibilidade do desenvolvimento de estruturas “construídas” átomo por átomo. Afirmou ainda que esse fenômeno não violaria as leis da física e indicou que, em um futuro próximo, seria possível produzir materiais em escala tão 20 pequena que ocasionaria a redução do tamanho de máquinas, provocando o aumento da velocidade de processamento das informações, entre outras aplicações. No entanto, devido à falta de tecnologia para o desenvolvimento de novos equipamentos que permitissem a visualização e manipulação dos átomos, poucos progressos foram alcançados até os anos 80. As maiores contribuições até então foram as pesquisas pioneiras em biologia molecular bioquímica e nanotecnologia realizadas por Eric Drexler[70], popularizando o termo nanociência em seus artigos. No final dos anos 80, os pesquisadores da IBM criaram o primeiro microscópio de varredura por tunelamento (STM) possibilitando a manipulação e a geração de imagens reais de materiais na escala nanométrica e atômica, impulsionando os estudos em nanotecnologia[71]. Desde então, a nanotecnologia tem despertado um grande interesse nas diversas áreas da ciência por apresentar materiais com características químicas e físicas peculiares e distintas dos materiais convencionais[72,73]. Em catálise, muitas aplicações têm sido baseadas no uso de nanopartículas, especialmente utilizando metais nobres como ouro, paládio, rutênio e platina[69]. A catálise realizada por nanoestruturas é chamada de nanocatálise e se tornou uma das mais promissoras subáreas da nanociência[69]. O alvo central da nanocatálise é o controle de reações químicas através da mudança do tamanho, composição química e morfologia dos catalisadores e, pela mudança na cinética, usando nanopartículas como centros reacionais. A preparação de catalisadores usando os princípios da nanociência abre novas perspectivas para a melhoria e o aumento de atividade de catalisadores já conhecidos em catálise heterogênea, a heterogeneização de catalisadores homogêneos ou mesmo a descoberta de novas propriedades catalíticas desconhecidas no material maciço e, portanto, a fabricação de novos catalisadores. 1.6. Catálise por ouro Embora a síntese de nanopartículas de metais de transição tenha sido reportada nas últimas décadas, essa tecnologia pode ser vista ainda em 440a.C. através da taça de Licurgo[74] contendo nanopartículas de ouro e prata. Mesmo o ouro tendo fascinado a humanidade desde a sua descoberta, o mesmo não despertou grande interesse dos cientistas durante muito tempo. A evidência sobre a química do metal ouro ocorreu, especialmente, no contexto das emergentes nanociência e 21 nanotecnologia, através do estudo de nanopartículas de ouro, ou mesmo o emprego deste metal em catalisadores homogêneos[75,76]. As nanopartículas de ouro são as mais estáveis devido ao fato desse metal não apresentar tendência a formar óxidos como a grande maioria dos outros elementos da tabela periódica. Além disso, essas partículas apresentam fascinantes propriedades, relacionadas com a grande variedade de ligantes usados para síntese e as propriedades dependentes do tamanho das partículas como: eletrônicas, magnéticas e ópticas. Devido a essas propriedades, essas partículas vêm sendo estudadas com possibilidades de aplicação em áreas da biologia[77], catálise[78], eletrônica[79] e outros. Embora o ouro na forma maciça seja amarelo, nanopartículas de ouro podem exibir diferentes cores dependendo do tamanho das partículas, variando entre azul, vermelho e violeta (Figura 18). Com dimensões entre 2 e 10nm, as nanopartículas de ouro apresentam coloração vermelha bastante intensa, devido a transições entre as bandas eletrônicas que acomodam os elétrons superficiais (bandas de plasmons superficiais)[83]. Entretanto, em tamanhos maiores as nanopartículas passam a exibir uma coloração tendendo ao violeta, devido ao aumento na densidade de estados eletrônicos e, consequentemente, diminuição da energia de transição entre as bandas. Desse modo, as nanopartículas com diâmetros médio iguais a 9, 15, 22, 48 e 99nm apresentam máximos de absorção em 517, 520, 521, 533, 575nm, respectivamente, em meio aquoso[80]. Figura 18. Influência do tamanho de partículas na coloração de soluções de ouro. 22 O ouro maciço foi considerado um metal pouco interessante do ponto de vista catalítico por muito tempo, devido ao fato de não adsorver moléculas como hidrogênio e oxigênio em sua superfície[81]. Entretanto, as propriedades catalíticas do ouro mudam quando seu tamanho passa para poucos nanômetros, particularmente com dimensões menores do que 10 nm[82-84]. O fascínio pela catálise por ouro surgiu por volta de 1985, depois que Haruta[85] e Hutchings[86] simultâneo e independentemente prognosticaram que nanopartículas de subseqüentemente, ouro apresentam demonstraram uma extraordinária experimentalmente. atividade Haruta e catalítica e, colaboradores investigaram a oxidação do CO em baixas temperaturas[85] e Hutchings[86], a hidrocloração do etileno para cloreto de vinila. A partir daí, um grande número de artigos e patentes foram desenvolvidos e o ouro se tornou um dos metais mais versáteis do ponto de vista catalítico. 23 2. Objetivos Preparar matrizes de sílica mesoporosa ordenada MCM-41 dopadas com os metais Pd e Au-Pd bimetálico. Obter matrizes de sílica via processo sol-gel dopadas com metais de transição Pd e Au-Pd. Caracterizar os compósitos através das técnicas difração de raios X (DRX), análise de adsorção-dessorção de nitrogênio através da equação BET e do método BJH, redução à temperatura programada (RTP), espectrometria de emissão atômica com plasma indutivamente acoplado (ICP-AES) e espalhamento de raios X a baixo ângulo (SAXS). Avaliar a atividade catalítica dos compósitos em reações de acoplamento Suzuki. Avaliar a influência do método de preparo no desempenho catalítico dos compósitos preparados. Avaliar a influência do metal ouro em reações de acoplamento Suzuki tipicamente catalisadas pelo metal paládio. 24 3. Experimental 3.1. Preparo dos catalisadores Pd/SiO2 e Au-Pd/SiO2 via processo sol-gel Os catalisadores 5,0%p/p Pd/SiO2 e 3,0%Au-3,0%Pd/SiO2 foram preparados via processo sol-gel através da hidrólise de 16,0mL de tretaetilortosilicato (TEOS, SigmaAldrich) em solução aquosa contendo etanol, na presença dos precursores metálicos de ouro e paládio (HAuCl4 e PdCl2, Sigma-Aldrich). Durante a hidrólise do TEOS, adicionouse 0,5mL de HClconc. e 50L de HFconc. A hidrólise do TEOS foi feita utilizando razão molar de H2O/TEOS igual a 5mol/mol e de EtOH/TEOS foi de 2,7mol/mol. O géis resultantes foram secos a 110oC e calcinados na temperatura de 550oC. 3.2. Preparo dos catalisadores Pd/MCM-41 e Au-Pd/MCM-41 Os catalisadores foram preparados na porcentagem de 5%p/p para o monometálico e 3%p/p de cada metal para o bimetálico. Os metais foram inseridos por incorporação direta de Pd e Au na estrutura da sílica mesoporosa MCM-41. TEOS, PdCl2 e HAuCl4 (SigmaAldrich) foram utilizados como precursores e brometo de cetiltrimetilamônio (CTAB, Sigma-Aldrich) como surfactante. A solução contendo o CTAB em água deionizada foi adicionada à solução de TEOS (10% do volume total) em água e hidróxido de tetrametilamônio (TMAOH, Sigma-Aldrich). A mistura foi agitada por 30 minutos e a seguir, adicionou-se o precursor metálico e o restante de TEOS. A mistura permaneceu em autoclave a 40oC por 24 horas e então filtrou-se o sólido formado, que em seguida foi calcinado a 550oC para a retirada do surfactante. A proporção molar utilizada de TEOS/CTAB/TMAOH/água foi de 1/12/28/26. 3.3. Caracterização dos catalisadores A determinação do teor total de ouro e paládio contido nos catalisadores foi realizada através da técnica de espectrometria de emissão atômica por plasma indutivamente acoplado (ICP-AES) em um instrumento Spectro Ciros CCD. As características estruturais dos catalisadores foram avaliadas por difração de raios X de pó (DRX) utilizando um difratômetro Shimadtzu 6000 com radiação CuK(40kV, 25 40mA, λ = 0,15418nm). A faixa de varredura utilizada foi de 2θ = 12-50° com velocidade de 5°/min. A redutibilidade da superfície metálica dos catalisadores foi determinado através da técnica de redução à temperatura programada (RTP) em um equipamento de Quantachrome ChemBET-300 equipado com um detector de condutividade térmica. Antes da análise, 150mg da amostra foram colocadas em uma célula de quartzo, aquecido durante 2 horas a 200ºC sob uma corrente de He e, em seguida, resfriada até a temperatura ambiente. As medidas foram realizadas entre 30 e 800oC em fluxo de 5% H2/N2, aumentando a temperatura linearmente a uma taxa de 10°C.min-1. As características texturais das matrizes foram determinadas a partir das isotermas de adsorção de nitrogênio a -196ºC utilizando um Autosorb-Quantachrome-IQ. As amostras (200mg) foram degaseificadas por 2 horas a 300ºC antes da análise. As áreas superficiais específicas foram determinadas pela equação de Brunauer-Emmett-Teller (método BET) a partir das isotermas de adsorção na faixa de pressão relativa de 0,07<P/Po<0,3. O volume total de poros foi obtido a partir da quantidade de N2 adsorvido à pressão relativa próxima da unidade. O diâmetro médio de poros foi determinado pelo método Barrett-JoynerHalenda (BJH). As análises de espalhamento de raios X a baixo ângulo (SAXS) foram realizadas no laboratório nacional de Luz síncrotron (LNLS, Campinas, Brasil), utilizando um difratômetro Huber-423 de três círculos. A configuração do SAXS foi equipada com um monocromador Si(111) , gerando um feixe horizontalmente concentrado. O comprimento de onda incidente de raios X, o foi de 1,488nm a faixa de varredura foi de, aproximadamente, 2 = 0-10°. 3.4. Ensaios catalíticos de acoplamento Suzuki Em um experimento típico da reação Suzuki de acoplamento cruzado, uma suspensão aquosa (20mL de água deionizada) contendo o haleto de arila correspondente (1,0mmol), ácido fenilborônico (1,2mmol), KOH (4mmol), catalisador (130mg) e tetradecano (padrão interno, 120mg) foi agitada durante um período 4 horas em um reator de vidro com agitação magnética a 80°C. O acompanhamento das reações foi feito por cromatografia gasosa (cromatógrafo Shimadzu 17A, coluna capilar CarboWAX 20M e detector FID) e as estruturas dos produtos confirmadas por cromatografia gasosa acoplada à espectrometria de massas 26 (instrumento Shimadzu QP5000, coluna capilar DB5, 70eV) por meio da comparação com espectros de massas de padrões dos mesmos. Nos experimentos de reciclagem, após a extração dos produtos, os reagentes foram adicionados à fase líquida contendo o catalisador, haleto de arila (1,0mmol), ácido fenilborônico (1,2mmol), KOH (2,0mmol), tetradecano (120mg), sendo seguido o mesmo procedimento dos testes catalíticos descritos acima. 4. Resultados e Discussões 4.1. Caracterização dos catalisadores Os difratogramas das amostras de sílica sol-gel e MCM-41 dopadas com paládio e ouro estão apresentados na Figura 19. O difratograma das amostras de Pd/SiO2 evidencia a presença de um pico de baixa intensidade em 233,7º referente à fase cristalina de paladinita PdO(101)[87] formada pela decomposição térmica do precursor PdCl2 sob atmosfera de ar. O padrão de DRX da amostra de Pd/MCM-41 indicou presença de dois picos em 233,7º e 42,0 º referentes à presença de paladinita PdO(101) e PdO(110). A baixa intensidade da fase paladinita no catalisador Pd/SiO2 em comparação ao catalisador Pd/MCM-41 indica que grande parte do precursor PdCl2 reduziu durante o preparo do compósito e não foi reoxidado após a etapa de calcinação. A análise dos difratogramas dos catalisadores bimetálicos Au-Pd/SiO2 e Au-Pd/MCM-41 indicou dois picos de difração em 237,9º e 44,6º atribuídas presença de ouro metálico Au(111) e Au(200)[88] e um pico referente a fase paladinita em ângulos coincidentes aos observados para as amostras monometálicas de paládio. A baixa intensidade da fase paladinita no compósito Pd/SiO2 preparado via sol-gel também foi observada para o análogo bimetálico. A banda observada em 2θ = 18º corresponde ao padrão de SiO2 amorfa que foi formada durante a calcinação dos catalisadores[89]. 27 Au-Pd/MCM-41 * * Au-Pd/SiO2 * Intesidade (u.a.) * Pd/MCM-41 Pd/SiO2 15 20 25 30 35 40 45 50 2 Figura 19. Difratogramas dos catalisadores de sílica dopada com paládio e ouro tratados termicamente a 550ºC (*Au(0) /PdO) Os perfis de redução à temperatura programada dos catalisadores estão apresentados na Figura 20.Os resultados das análises de RTP para as amostras Pd/SiO2 e Au-Pd/SiO2 indicaram ausência de picos de redução relativos às fases de óxidos de ouro e/ou paládio. Já os perfis de RTP dos catalisadores Pd/MCM-41 e Au-Pd/MCM-41, indicaram a redução da fase de PdO para Pd(0) (100-240ºC e 120-225ºC, respectivamente). Estes resultados estão de acordo com as análises de DRX, que indicaram predominância de Au(0) para todas a amostras, predominância de Pd(0) para as amostras preparadas via sol-gel e Pd(II) para as amostras via MCM-41. Adicionalmente, para os catalisadores contendo paládio, observou-se nos perfis de RTP um intenso e negativo pico próximo de 100°C característico da decomposição da fase -hidreto de paládio formada durante a análise de RTP[90-91]. A formação de hidretos está relacionada ao fato de que partículas de Pd(0) podem adsorver H2 à temperatura ambiente para formar PdHx em valores de pressão parcial acima de 0,013atm[92,93]. Na literatura, tem sido relatada a decomposição de PdHx na faixa de 28 temperatura entre 323-373K[94,97], o que está de acordo com o observado para os compósitos preparados. Consumo de H2 (u.a.) Au-Pd/MCM-41 Au-Pd/SiO2 Pd/MCM-41 Pd/SiO2 0 100 200 300 400 500 600 700 800 Temperatura (ºC) Figura 20. Perfis de redução a temperatura programada para os catalisadores dopados com ouro e paládio A Tabela III apresenta os valores das características texturais dos catalisadores obtidos por fisiossorção de N2. A Figura 21 apresenta as isotermas adsorção-dessorção de N2 dos catalisadores e suas respectivas distribuições BJH de tamanho de poros. Os catalisadores apresentaram valores de área de superfície específica entre 259580m2g-1 e estão dentro da faixa esperada para a preparação de compósitos de sílica sol-gel e MCM-41. A área de superfície específica dos catalisadores diminui na seguinte ordem: Au-Pd/MCM-41> Pd/MCM-41> Au-Pd/SiO2> Pd/SiO2. Observa-se que o catalisador bimetálico apresenta um pequeno acréscimo de área quando comparado ao monometálico de paládio para ambos os métodos de preparo. A presença do metal ouro pode ter influenciado o aumento da área superficial dos compósitos bimetálicos, uma vez que os compósitos preparados apenas com ouro metálico apresentaram áreas superficiais de 292m2g-1 para Au/SiO2 e 620m2g-1 para Au/MCM-41 (não estão abordados neste trabalho). 29 Observa-se que entre os catalisadores utilizando os suportes de sílica sol-gel e sílica MCM-41 há um aumento bastante significativo na área superficial, favorecido pelo alto ordenamento na distribuição do tamanho de poros da sílica MCM-41. As isotermas dos catalisadores Pd/SiO2 e Au-Pd/SiO2 são correspondentes ao tipo IV (na classificação IUPAC), o que é típico de materiais mesoporosos[96,97]. A aparência da histerese é atribuída ao tipo H1 em que é apresentada em altas pressões relativas (P/Po≈0,7-0,9) e pode estar relacionado com a formação de mesoporosidade textural. As curvas de distribuição de tamanho de poro (Figura 21) para os catalisadores apresentaram perfil monomodal com um intervalo estreito de variação do tamanho dos poros entre 26nm. Os catalisadores Pd/MCM-41 e Au-Pd/MCM-41 apresentaram isotermas também do tipo IV (na classificação IUPAC) (Figura 21)[96,97]. As histereses observadas são atribuídas ao tipo H3 contendo loops bem definidos e que não exibem qualquer adsorção limite em altas pressões relativas. Conforme tem sido relatado, materiais com histerese H3 apresentam os poros em formatos de cunhas, cones e/ou placas. As curvas de distribuição de tamanho de poros para os compósitos obtidos por MCM-41 apresentaram uma distribuição ainda mais estreita do que os catalisadores preparados através do método solgel, apresentando um intervalo entre 1,8-2,1nm com máximo em 2,0nm. Tabela III. Características texturais obtidas por adsorção de N2 dos catalisadores de sílica Catalisador Conteúdo Metálico Pd (%) Au (%) Área superficial BET (m2/g) Volume total Diâmetro médio de poros de poros BJH (cm3/g) (Å) Pd/SiO2 4,9 - 259 0,90 33 Pd/MCM-41 4,8 - 552 1,35 19 Au-Pd/SiO2 2,9 2,8 268 0,61 47 Au-Pd/MCM-41 2,9 2,7 580 1,58 20 30 1200 0,07 0,06 1000 Pd/SiO2 Au-Pd/SiO2 Pd/MCM-41 Au-Pd/MCM-41 -1 -1 dV/dD/cm .g Å 0,04 3 800 3 -1 Volume adsorvido (cm .g ) 0,05 0,03 600 0,02 0,01 400 0,00 0 20 40 60 80 100 120 140 160 180 Pore Diameter/D,Å 200 0 0,0 0,2 0,4 0,6 0,8 1,0 Pressão relativa (P/Po) Figura 21. Isotermas de adsorção de N2 de Pd/SiO2, Au-Pd/SiO2, Pd/MCM-41 e AuPd/MCM-41 e as suas respectivas curvas de distribuição de tamanho de poros utilizando o método BJH O padrão de SAXS da amostra de Au-Pd/MCM-41 (Figura 22 (a)) apresentou reflexões a 2 = 1,67, 2,91, 3,33º referentes aos planos (100), (110) e (200), respectivamente. O padrão de espalhamento da radiação síncrotron a baixo ângulo para o catalisador Pd/MCM-41 indicou duas reflexões em 2 = 1,62 e 2,85º referentes aos planos (100) e (110), respectivamente (Figura 22 (b)). Os picos podem ser atribuídos à simetria hexagonal 2D[98], que indica a formação de uma estrutura altamente ordenada hexagonal. Isto confirma que a sílica contendo Pd e Au-Pd tem a estrutura típica da sílica MCM-41, o que está de acordo com as curvas de distribuição de tamanhos de poros e a área superficial BET. 31 (a) Intensity(u.a) (100) Pd-Au/MCM-41 (110) (200) 2 3 4 2 5 6 7 8 (b) Intensity (u.a) (100) (110) 2 3 Pd/MCM-41 4 2 5 6 7 8 Figura 22. Padrões SAXS dos catalisadores: (a) Au-Pd/MCM-41 e (b) Pd/MCM-41 4.2. Acoplamento Suzuki Nesta epata, o desempenho dos catalisadores de Pd e Au-Pd em reações de acoplamento Suzuki cruzado foi avaliado. Com a finalidade de verificar a influência do método de preparo na atividade catalítica dos compósitos, o desempenho do metal-MCM41 (metal = Pd ou Au-Pd) foi comparado aos análogos metal-SiO2 preparados pelo processo sol-gel convencional. Também foi verificada a influência do metal ouro no desempenho de catalisadores para a reação Suzuki. Além disso, este estudo teve como objetivo aplicar catalisadores heterogêneos de Pd e Au-Pd em sistema utilizando água 32 como solvente, sob uma atmosfera de ar e sem o uso de ligantes auxiliares aos metais Pd e Au. Os catalisadores Pd e Au-Pd/SiO2 e Pd e Au-Pd/MCM-41 foram avaliados na reação de acoplamento de diferentes haletos de arila com ácido fenilborônico (Figura 23), obtendo-se os produtos de acoplamento correspondentes (Tabelas IV e V). Como mostrado na Tabela IV, tanto para Pd como Au-Pd/SiO2, a reação de acoplamento de Suzuki entre pbromotolueno e ácido feniborônico resultaram nos produtos acoplados correspondentes em rendimento quase quantitativo (Tabela IV, exp. 3 e 4). Além disso, altos valores de rendimentos foram obtidos utilizando haletos com grupos substituintes eletrodoadores tais como –OMe (Tabela IV, exp. 1 e 2). Considerando que a etapa limitante da reação Suzuki é a adição oxidativa, a presença de haletos contendo grupos substituintes fortermente eletrodoadores (grupos desativantes frente à sustituição nucleofílica) deveria diminuir a taxa da adição oxidativa e a atividade global dos catalisadores. Neste contexto, os rendimentos mais baixos obtidos para o acoplamento utilizando haletos com grupos subtituintes eletrorretiradores tais como o p-bromonitrobenzeno ou p-bromobenzaldeído foram inesperados (Tabela IV, exp. 5-8). Mais estudos são necessários para explicar estes resultados, que poderiam estar associados a efeitos de superfície subtrato-catalisador durante a etapa da adição oxidativa. O substrato cloreto de benzila foi acoplado apenas em rendimentos moderados (Tabela IV, exp. 9 e 10). Uma vez que este é um substrato ativo para a reação de acoplamento Suzuki em sistemas homogêneos, como por exemplo Pd(OAc)2/PPh3[99], os resultados também indicam a presença de efeitos de superfície e, como consequência, que o sistema catalítico funcione efetivamente como um catalisador heterogêneo. R´ catalyst NaOH (4 equiv.) (HO)2B Br + R'' R'' tetradecane, H2O 80oC, 2-4 h R´ Figura 23. Condição de síntese de biarilas via acoplamento Suzuki-Miyaura 33 Tabela IV. Reações de Suzuki-Miyaura catalisadas por Pd/SiO2 e Au-Pd/SiO2 (sol-gel)a Exp. Haleto de arila 2 MeO H3C H3C OCH OCH Ph Br O 2N 9 O 2N CH2Cl 10 a Ph Br 7 8 Ph Br 5 6 MeO CH2Ph Rendimentob,c (%) (M/SiO2) 2h 4h Pd 57 69(65d) Au-Pd 68 81(78d) Pd 90 96 Au-Pd 92 99 Pd 41 53 Au-Pd 44 60 Pd- 26 48 Au-Pd 40 61 Pd 34 50 Au-Pd 39 59 Ph Br 3 4 Produto (R’=H) 1 Catalisador condições de reação: [ácido arilborônico]=1,2mmol, [haleto de arila]=1,0mmol, catalisador=0,130g, H2O (20mL), T=80oC. b rendimentos determinados por GC utilizando tetradecano como padrão interno e baseados no consumo de haleto de arila consumido c Como coprodutos foram detectados produtos de homoacoplamento e de redução de haletos em quantidades mínimas d reciclo do catalisador 34 Tabela V. Reações de Suzuki-Miyaura catalisadas por Pd/MCM-41 e Au-Pd/MCM-41a Exp. Haleto de arila 2 MeO H3C H3C OCH Ph OCH Ph Br O 2N 9 O 2N CH2Cl 10 a Ph Br 7 8 MeO Br 5 6 Ph Br 3 4 Produto (R’=H) 1 Catalisador Rendimentob,c (%) CH2Ph (M/SiO2) 2h 4h Pd 70 85(83d) Au-Pd 76 88(87d) Pd 95 99 Au-Pd 94 99 Pd 55 70 Au-Pd 58 84 Pd 36 72 Au-Pd 50 79 Pd 55 72 Au-Pd 62 88 condições de reação: [ácido arilborônico]=1,2mmol, [haleto de arila]=1,0mmol, catalisador=0,130g, H2O (20mL), T=80oC b rendimentos determinados por GC utilizando tetradecano como padrão interno e baseados no consumo de haleto de arila consumido c Como coprodutos foram detectados produtos de homoacoplamento e de redução de haletos em quantidades mínimas d reciclo do catalisador Em relação à influência do método de preparo na atividade catalítica dos compósitos de Pd e Au-Pd, a avaliação realizada através de diferentes haletos de arila demonstraram uma tendência similar para os catalisadores (Tabela V). Sob as mesmas condições, os catalisadores suportados em MCM-41 apresentaram rendimentos mais elevados do que os catalisadores preparados por sol-gel. As análises de DRX e RTP indicaram uma predominância maior de Pd(0) e Au(0) nos materiais à base de sílica sol-gel do que nos de MCM-41. Uma vez que as espécies de valência zero são os sítios ativos para o ciclo catalítico, uma maior atividade deveria ser esperada para os compósitos de sol-gel, caso a 35 redução dos compósitos de MCM-41 não fosse realizada antes dos ensaios catalíticos. Os catalisadores de Pd e Au-Pd/MCM-41 apresentaram melhores desempenhos do que Pd e Au-Pd/sol-gel, provavelmente devido à maior área superfícial e volume de poros, o que pode melhorar a dispersão dos metais e a acessibilidade de substratos orgânicos aos centros metálicos. A influência do metal ouro foi verificada em cada experimento das Tabelas IV e V. Para ambos os suportes, o aumento relativo no rendimento foi verificado através de todos os experimentos, não importando se o grupo substituinte no haleto de arila foi eletrodoador ou eletrorretirador (Tabelas IV e V). Alguns relatos na literatura têm mostrado o aumento da atividade de um catalisador adicionando o ouro em materiais dopados com paládio. Esse aumento no desempenho catalítico tem sido atribuído a formação de nanoparticulas de ouro abaixo de 10nm, mudanças estruturais do catalisador pela adição de ouro ou ainda possiveis modificações na estrutura eletrônica dos centros metálicos cataliticamente ativos[100-102]. Os testes de reciclo dos catalisadores de Pd e Au-Pd foram avaliados utilizando-se a reação entre p-bromoanisol e ácido fenilborônico. Após o primeiro ciclo catalítico, os catalisadores foram filtrados, lavados com água destilada e etanol e secos a 100ºC por 2 horas. Em seguida, os catalisadores foram avaliados em um novo lote de reagentes. Todos os catalisadores, incluindo Pd e Au-Pd em sílica (Tabela IV, exp. 1 e 2) ou de MCM-41 (Tabela V, exp. 1 e 2), foram reutilizados obtendo rendimentos de até 80% para o produto de acoplamento após três vezes de reuso e sem uma alteração significativa na atividade catalítica (Tabelas IV e V, exp. 1 e 2). A utilização de um sistema sem ligantes, a capacidade de reciclagem do catalisador, a realização de reações em condições amenas e estáveis, bem como a utilização de água como solvente são condizentes com os princípios da química verde para a produção de produtos químicos menos poluentes e fazem deste sistema catalítico, uma alternativa promissora para a obtenção de biarilas substituidas em elevados rendimentos. 4.3. Reforma a vapor do etanol Os catalisadores de Pd e Au-Pd também foram testados na reforma à vapor do etanol em colaboração com o professor Humberto Fajardo do Departamento de Química da UFOP. O resumo do artigo submetido à revista FUEL se encontra no Anexo I. 36 5. Conclusões Foram desenvolvidos catalisadores heterogênos à base de Pd e Au-Pd dopados em sílica sol-gel e MCM-41. Os compósitos foram caracterizados por DRX, RTP, adsorção de N2, ICP-AES e SAXS. O desempenho dos catalisadores foi avaliado em reações de acoplamento Suzuki em um sistema livre de ligantes, resistente ao ar e utilizando água como solvente. O sistema se mostrou eficiente, permitindo realizar a reação de acoplamento cruzado Suzuki-Miyaura entre haletos de arila e o ácido fenillborônico, catalisados por Pd ou Au-Pd. Os catalisadores utilizando MCM-41 como suporte foram mais ativos que os compósitos preparados por sol-gel. Além disso, o notável efeito benéfico do metal ouro em catalisadores de paládio foi reportado observando aumentos nos rendimentos dos produtos de até cerca de 50%. Além disso, as reações prosseguiram sob condições brandas, utilizando um catalisador recuperável, reciclável e livre de ligantes. 37 6. Referências bibliográficas [1] LIMA, S.M.; SILVA, A.M.; COSTA, L.O.O.; GRAHAM, U.M.; JACOBS, G.; DAVIS, B.H.; MATTOS, L.V.; NORONHA, F.B. Study of catalyst deactivation and reaction mechanism of steam reforming, partial oxidation, and oxidative steam reforming of ethanol over Co/CeO2 catalyst. Journal of Catalysis, v.268, p.268-28, 2009. [2] HUANG, J.; REMPEL, G.L. Ziegler-Natta catalysts for olefin polymerization: Mechanistic insights from metallocene systems. Progress in Polymer Science, v.20, n.3, p.459-526, 1995. [3] ROBLES-DUTENHEFNER, P.A.; ROCHA, K.A.S.; SOUZA, E.M.B.; GUSEVSKAYA, E.V. Cobalt-catalyzed oxidation of terpenes: Co-MCM-41 as an efficient shape-selective heterogeneous catalyst for aerobic oxidation of isolongifolene under solvent-free conditions. Journal of Catalysis, v.265, n.1, p.72-79, 2009. [4] INOUE, S.; NAKAJIMA, T.; KIKUCHI, Y. Synthesis of single-wall carbon nanotubes from alcohol using Fe/Co, Mo/Co, Rh/Pd catalysts. Chemical and Physical Letters, v.406, n.1-3, p.184, 2005. [5] SEKER, E.; GULARI, E. Single step sol–gel made gold on alumina catalyst for selective reduction of NOx under oxidizing conditions: effect of gold precursor and reaction conditions. Applied Catalysis A, v.232, p.203-217, 2002. [6] ERTL, G.; KNOZINGER, H.; SCHUTH, F.; WEITKAMP, J. Handbook of Heterogeneous Catalysis, Second edition, EUA, Wiley, 1997. [7] SHELDON, R.A.; KOCHI, J.K. Metal-catalyzed oxidations of organic compounds: mechanistic principles and synthetic methodology including biochemical processes, First edition, London, Academic Press, 1981. [8] HOLDERICH, W.F.; BARNISCK, B.; SHELDON, S.A.; BEKKUM, H. Fine Chemicals through Heteregeneous Catalysis, First edition, Weinheim, Wiley-VCH, 2001. [9] EBELMANN, M.C.R. Acad. Sci. Paris, v.25, p.854, 1847. EBELMANN, J. J. Ann. v.57, p.331, 1846. [10] KISTLER, S.S. Cohent expanded aerogels. Journal of Physical Chemistry, v.36, p.52-64, 1932. 38 [11] HENCH, L.L.; Ulrich, D.R. Science of ceramic chemical processing, First Editon, EUA, Wiley, 1986. [12] DUNN, B.; ZINK, J.I. Optical properties of sol–gel glasses doped with organic molecules. Journal of Materials Chemistry, v.1, n.6, p.903-913, 1991. [13] LEE, J.H.; KO K.H.; PARK, B.O. Electrical and optical properties of ZnO transparent conducting films by the sol–gel method. Journal of Crystal Growth, v.247, n.1– 2, p.119–125, 2003. [14] NAJAFI, S.I.; TOUAM, T.; SARA, R.; ANDREWS, M. P.; FARDAD, M.A. Sol- Gel Glass Waveguide and Grating on Silicon. Journal of Lightwave Technology, v.16, n.9, p.1640, 1998. [15] YANTASEE, W.; RUTLEDGE, R. D.; CHOUYYOK, W.; SUKWAROTWAT, V.; ORR, G.; WARNER, C. L.; WARNER, M. G.; FRYXELL, G. E.; WIACEK, R. J.; TIMCHALK, C.; ADDLEMAN, R.S. Functionalized Nanoporous Silica for the removal of heavy metals from biological systems: adsorption and application. Applied Materials and Interfaces, v.2, p.2749-2758, 2010. [16] PARK, Y. M.; LEE, J. Y.; CHUNG, S. H.; PARK, I. S. LEE, S. Y.; Esterification of used vegetables oils using the heterogeneous WO3/ZrO2 catalyst for production of biodiesel. Bioresource Technology, vol.101, p.559-561, 2010. [17] BRINKER, C.J.; SHERER, G.W. Sol-gel Science, First Edition, New York, Academic Press Inc, 1990. [18] CORRIU, R.; ANH, N.T. Molecular Chemistry of Sol-gel Derived Nanomaterials, First Edition, EUA, Wiley, 2009. [19] ZERDA, T. W.; HOANG, G. Journal of Non-Crystaline Solids, v.109, n.1, p.9, 1989. [20] MCBAIN, J.M. The Sorption of Gases and Vapors by Solids, First Edition, Madinson, 1932. [21] ØYE, G.; SJÖBLOM, J.; STÖCKER, M. Synthesis, characterization and potential applications of new materials in the mesoporous range. Advances in colloid and interface science, v.89, p.439-466, 2001. 39 [22] YANG, S.M.; YANG, H.; COOMBS, N.; SOKOLOV, L.; KRESGE, C. T.; OZIN, G. A. Morphokinetics growth of mesoporous silica curved shapes. Advanced materials, v.11, p.52, 1999. [23] SUN, Y.; ZHU, L.; LU, H.; WANG, E.; LIN, S.; JIANG, D.; XIAO, F. Sulfated zirconia supported in mesoporous materials. Applied Catalysis A: General, v.237, p.21–31, 2002. [24] MA, Y.; TONG, W.; ZHOU, H.; SUIB, S.L. A review of zeolite-like porous materials. Microporous and Mesoporous Materials, v.37, p.243-252, 2000. [25] SHEN, H.; JUDEH, Z.M.A.; CHING, C.B.; XIA, Q. Comparative studies on alkylation of phenol with tert-butyl alcohol in the presence of liquid or solid acid catalysts in ionic liquids. Journal of molecular catalysis A, v.212, p.301-308, 2004. [26] BECK, J.S.; VARTULI, J.C.; ROYH, W.J.; LEONOWICZ, M.E.; KRESGE, C.T.; SCHMITT, K.D. ; CHU, C.T.W.; OLSON, D.H.; SHEPPARD, E.W.; McCullen, S.B.; HIGGINS, J.B.; SCHLENKER, J.L. A new family of mesoporous molecular sieves prepared with liquid crystal templates A. Journal of American Chemical Society. V.114, p.108-134, 1992. [27] SING, K.S.W.; EVERETT, D.H.; HAUL, R.A.W. MOSCOU, L.; PIEROTTI, R.A.; ROUQUEROL, J.; SIEMIENIEWSKA, T. Reporting physisorption data for gas-solid systems with special reference to the determination of surface area and porosity. Pure & Applied Chemistry, v.57, n.4, p.603-619. [28] CHIOLA, V.; RITSKO, J.E.; VANDERPOOL, C.D. US Patent, 3556725, 1971. [29] KRESGE, C. T.; LEONOWICZ, M. E., MICHAEL, E.; ROTH, W. J.; VARTULI, J. C. Synthetic mesoporous crystalline material. US Patent, 5098684, 1992. [30] GÖLTNER, C.G.; ANTONIETTI, M. Mesoporous materials by templating of liquid crystalline phases. Advanced materials, v.9, p.431-436, 1997. [31] RENZO, F.D.; TESTA, F.; CHEN, J. D; CAMBON, H.; GALAMEAU, A.; PLEE, D.; FAJULA, F. Textural control of micelle-template mesoporous effects of co-surfactants and alkalinity. Microporous Mesoporous Materials, v.28, p.437-446, 1999. [32] ROSER, S.J.; PATEL, H.M.; LOVELL, M.R.; MUIR, J.E.; MANN, S. X-ray reflection studies on the monolayer mediated growth of mesostructured MCM41 silica at the air/water interface. Chemical Communication, v.7, p.829-830, 1998. 40 [33] MA, Y.; TONG, W.; ZHOU, H.; SUIB, S.L. A review of zeolite-like porous materials. Microporous and Mesoporous Materials, v.37, p.243-252, 2000. [34] YANG, S.M.; YANG, H.; COOMBS, N.; SOKOLOV, L.; KRESGE, C.T.; OZIN, G.A. Morphokinetics growth of mesoporous silica curved shapes. Advanced materials, v.11, p.52, 1999. [35] BECK, J.S.; VARLUTI, J.C.; ROTH, W.J.; LEONOWICZ, M.E.; KRESGE, C.T; SCHIMITT, K.D.; CHU, C.T.W.; OLSON, D.H.; SHEPPARD, E.W.; McCULLEN, S.B.; HIGGINS, J. B.; SCHLENKER, J. A new family of mesoporous molecular sieves prepared with liquid crystal templates. Journal American Chemical Society, v.114, p.10834-10843, 1992. [36] WANG, Y. NOGUCHI, M.; TAKAHASHI, Y.; OHTSUKA, Y. Synthesis of SBA- 15 with different pore sizes and the utilization as supports of high loading of cobalt catalysts. Catalysis Today, v.68, n.1–3, p.3–9, 2001. [37] NEGISHI, E. Palladium- or nickel-catalyzed cross coupling. A new selective method for carbon-carbon bond formation. Accounts of Chemical Research, v.15, n.11, p.340–348, 1982. [38] PHAN, N.T.S.; SLUYS, M.V.D.; JONES, C.W. On the Nature of the Active Species in Palladium Catalyzed Mizoroki–Heck and Suzuki–Miyaura Couplings – Homogeneous or Heterogeneous Catalysis, A Critical Review. Advanced Synthesis and Catalysis, v.348, n.6, p.609–679, 2006. [39] MIYAURA, N.; Suzuki, A. Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds. Chemical Reviews, v.95, n.7, p.2457–2483, 1995. [40] YIN, L.; LIEBSCHER J. Carbon−Carbon Coupling Reactions Catalyzed by Heterogeneous Palladium Catalysts. Chemical Reviews, v.107, p.133−173, 2007. [41] SUZUKI, A. Recent advances in the cross-coupling reactions of organoboron derivatives with organic electrophiles, 1995–1998. Journal of Organometallic Chemistry, v.576, n.1–2, p.147–168, 1999. [42] SUZUKI, A. Cross-coupling reactions via organoboranes. Journal of Organometallic Chemistry, v.653, n.1–2, p.83–90, 2002. 41 [43] TORBORG, C.; BELLER, M. Recent Applications of Palladium-Catalyzed Coupling Reactions in the Pharmaceutical, Agrochemical, and Fine Chemical Industries. Advanced Synthesis and Catalysis, v.351, n.18, p.3027–3043, 2009. [44] BUSACCA, C.A.; FANDRICK, D.R.; SONG, J.J. SENANAYAKE, C.H. The Growing Impact of Catalysis in the Pharmaceutical Industry. Advanced Synthesis and Catalysis, v.353, n.11-12, p.1825–1864, 2011. [45] HIRDA, M.; GRAYA, G.W.; TOYNEA, K.J. Cross-Coupling Reactions in the Synthesis of Liquid Crystals. Molecular Crystals and Liquid Crystals, v.206, n.1, p.187204, 2001. [46] ALONSO, D.A.; NÁJERA, C.; Pacheco, M.C. Highly Active Oxime-Derived Palladacycle Complexes for Suzuki−Miyaura and Ullmann-Type Coupling Reactions. Journal of Organic Chemistry, v.67, n.16, p.5588–5594, 2002. [47] LIM, E.; Jung, B.J.; Shim, H.K. Synthesis and Characterization of a New Light- Emitting Fluorene−Thieno[3,2-b]thiophene-Based Conjugated Copolymer. Macromolecules, v.36, n.12, p4288-4293, 2003. [48] SAKAMURIA, S.; GEORGEB, C.; FLIPPEN-ANDERSON, J.; KOZIKOWSKIA, A.P. Synthesis of novel spirocyclic cocaine analogs using the Suzuki coupling. Tetrahedron Letters, v.41, n.13, p.2055-2058, 2000. [49] RIVERAL, I.; COLBERG, J.C.; SODERQUIST, J.A. Ibuprofen and naproxen via organoboranes. Tetrahedron Letters, v.33, n.46, p.6919–6922, 1992. [50] TECNOLOGIA DO PRÊMIO NOBEL DA QUÍMICA PRESENTE NAS SOLUÇÕES BASF, Disponível em: <http://www.basf.com.br/?id=6215> Acesso em: Janeiro de 2013. [51] CHEN, C.Y.; SENANAYAKE, C.H.; BILL, T.J.; LARSEN, R.D.; VERHOEVEN, T.R.; REIDER, P.J. Improved Fischer Indole Reaction for the Preparation of N,N- Dimethyltryptamines: Synthesis of L-695,894, a Potent 5-HT1D Receptor Agonist. Journal of Organic Chemitry, v.59, n.13, p.3738–3741, 1994. [52] PRÊMIO NOBEL DA QUÍMICA 2010, Disponível em: http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2010/ Acesso em: Janeiro de 2013. 42 [53] GRONOWITZ, S.; BJORK, P.; MALM, J.; HORNFELDT, A.B. The effect of some additives on the Stille PdO-catalyzed cross-coupling reaction. Journal of Organometallic Chemistry. V.460, n.1,p.127–129, 1993. [54] SMITH, G.B.; DEZENY, G.C.; HUGHES, D.L.; KING, A.O.; VERHOEVEN, T.R. Mechanistic Studies of the Suzuki Cross-Coupling Reaction Journal of Organic Chemistry, v.59, p.8151–8156, 1994. [55] Wallow, T.I.; NOVAK, B.M. Highly Efficient and Accelerated Suzuki Aryl Couplings Mediated by Phosphine-Free Palladium Sources. Journal of Organic Chemistry v.59, n.17, p.5034–5037, 1994. [56] ANDERSON, J.C.; NAMLI, H.; ROBERTS, C.A. Investigations into ambient temperature biaryl coupling reactions. Tetrahedron, v.53, n.44, p.15123–15134, 1997. [57] LIPSHUTZ, B.H.; PETERSEN, T.B.; ABELA, A.R. Room-Temperature Suzuki−Miyaura Couplings in Water Facilitated by Nonionic Amphiphiles. Organic Letters, v.10, n.7, p.1333–1336, 2008. [58] NISHIKATA, T. Abela, A.R.; HUANG, S.; LIPSHUTZ, B.H. Palladium(II) Catalysis: C−H Activation/Suzuki−Miyaura Couplings Cationic at Room Temperature. Journal of American Chemical Society, v.132, n.14, p.4978–4979, 2010. [59] ZHANG, C.; HUANG, J.; TRUDELL, M.L.; NOLAN, S.P. Palladium— Imidazol‐2‐ylidene Complexes as Catalysts for Facile and Efficient Suzuki Cross‐Coupling Reactions of Aryl Chlorides with Arylboronic Acids. Journal of Organic Chemistry, v.64, p.3804, 1999. [60] WESKAMP, T.; BOHM, V.P.W.; HERRMANN, W.A. Combining N-heterocyclic carbenes and phosphines: improved palladium(II) catalysts for aryl coupling reactions. Journal of Organometallic Chemistry, v.585, n.2, p.348–352, 1999. [61] JAKSON, W.R.; MARCUCCIO, SM.; NAESLUND, C.G.M. High Yields of Unsymmetrical Biaryls via Cross Coupling of Arylboronic Acids with Haloarenes Using a Modified Suzuki‐Beletskaya Procedure. Journal of American Chemical Society, v.20, p.2395-2395, 1994. [62] BUSSOLARI, J.C.; REHBORN, D.C. Preparation of 5-Aryl Furfurals and Aryl Thiophene-2-carboxaldehydes via Palladium-Catalyzed C−C Bond Formation in Aqueous Media1. Organic Letters, v.1, n.7, p.965–967, 1999. 43 [63] MARCK, A.V.; RICHARD, B. Aryl couplings with heterogeneous palladium catalysts. Tetrahedron Letters, v.35, n.20, p.3277–3280, 1994. [64] JANG, SU-BUM. Polymer-bound palladium-catalyzed cross-coupling of organoboron compounds with organic halides and organic triflates. Tetrahedron Letters v.38, n.10, p.1793–1796, 1997. [65] INDOLESE, A.F. Suzuki-type coupling of chloroarenes with arylboronic acids catalysed by nickel complexes. Tetrahedron Letters, v.38, n.20, p.3513–3516, 1997. [66] HAN, J.; Liu, Y.; Guo, R. Facile Synthesis of Highly Stable Gold Nanoparticles and Their Unexpected Excellent Catalytic Activity for Suzuki−Miyaura Cross-Coupling Reaction in Water. Journal of American Chemical Society, v.131, n.6, p.2060–2061, 2009. [67] GARCIA, P.; MALACRIA, M.; AUBERT, C. GANDON, V., FENSTERBANK, L. Gold-Catalyzed Cross-Couplings: New Opportunities for CC Bond Formation. ChemCatChem, v.2, n.5, p.493–497, 2010. [68] HEIZ, U.; LANDMAN, U. Nanocatalysis,1º ed., Heideberg, Springer, 2007. [69] Discurso pronunciado na reunião da Sociedade Americana de Física no Caltech (California Institute of Technology) e publicado sob o título “There´s plenty of room at the bottom: na invitation to enter a new Field of Physics”, Engineering and Science, 22 fev. 1960. [70] DREXLER, K.; Molecular engineering: An approach to the development of general capabilities for molecular manipulation, Proc. Natl. Acad. Sci. v.78, p.5275-5278, 1981. [71] MULLER, D.A.; KOURKOUTIS, L.F.; MURFITT, M.; SONG, J.H.; HWANG H.Y.; SILCOX, J.; DELLBY, N.; KRIVANEK, O.L. Atomic-scale chemical imaging of composition and bonding by aberration-corrected microscopy, Science, v.319, p.10731076, 2008. [72] BUHRO, W.E.; COLVIN, V.L. Semiconductor nanocrystals: shape matters, Nature Materials, v.2, p.38-139, 2003. [73] LOEF, R.; HOUTEPEN, A.J.; TALGON, E.; SCHOONMAN, J.; GOOSSENS, A. Study of electronic defects in CdSe quantum dots and their involvement in quantum dot solar cells, Nano Letters, v.9, p.856-859, 2009. 44 [74] TAÇA DE LICURGO, THE BRITISH MUSEUM, Disponível em: http://www.britishmuseum.org/explore/highlights/highlight_image.aspx?image=k741.jpg& retpage=220 82, acessado em Janeiro de 2013. [75] ARCADI, A. Alternative synthetic methods through new developments in catalysis by gold. Chemical Reviews. v.108, p.3266-3325, 2008. [76] MUZART, J. Gold-catalysed reactions of alcohols: isomerisation, inter- and intramolecular reactions leading to C–C and C–heteroatom bonds. Tetrahedron, v.64, p.5815-5849, 2008. [77] SPERLING, R.A.; GIL, R.P.; ZHANG, F.; ZANELLA, M.; PARAK, W.J. Biological applications of gold nanoparticles. Chemical Society Reviews, v.37, p.18961908, 2008. [78] PINA, C.D.; FALLETA, E.; PATRI L.; ROSSI, M. Selective oxidation using gold, , Chemical Society Reviews. v.37, p.2077-2095, 2008. [79] SCHMID, G.; SIMON, U. Gold nanoparticles: assembly and electrical properties in 1-3 dimensions. Chemical Communication, v.72, p.697-710, 2005. [80] TOMA, H.E.; BONIFÁCIO, LS.; ANAISSI, F.J. Da cor à cor inexistente: uma reflexão sobre espectros eletrônicos e efeitos cromáticos, Química Nova, v.28, p.897-900, 2005. [81] 24.WANG. J.; KOEL, B.E. studies of NO2, N2O3, and N2O4 adsorbed on Au(111) surfaces and reactions with coadsorbed H2O, Journal of Physical Chemical A, v.102, p.8573-8579, 1998. [82] CHOUDHARY, T.V.; GOODMAN, D.W. Oxidation catalysis by supported gold nano-clusters, Topics in Catalysis, v.21, p.25-34, 2002. [83] BOND, G.C.; THOMPSON, D.T. Catalysis by gold, Catalysis. Review.-Science. Engineering, v.41, p.319-388, 1999. [84] HASHMI, A.S.K.; HUTCHINGS, G.J. Gold catalysis, Angew. Chem. Int. Ed. v.45, p.7896-7936, 2005. [85] HARUTA, M.; KOBAYASHI, T.; SANO, H.; YAMANDA, N. Novel gold catalysts for the oxidation of carbon monoxide at a temperature far below 0°C, Chemical Letters, v.4, p.405-408, 1987. 45 [86] HUTCHINGS, G.J. Vapor phase hydrochlorination of acetylene: correlation of catalytic activity of supported metal chloride catalysts. Journal of Catalysis, v.96, p.292295, 1985. [87] ZHANG, Y.; WANG, Y.; JI, J.; WANG, J. Electro-oxidation of methanol based on electrospun PdO–Co3O4 nanofiber modified electrode. International Journal of Hydrogen Energy, v.37, p.17947-17953, 2012. [88] YIN, H.; MA, Z.; ZHU H.; CHI, M.; DAI, S. Evidence for and mitigation of the encapsulation of gold nanoparticles within silica supports upon high-temperature treatment of Au/SiO2 catalysts: Implication to catalyst deactivation. Applied Catalysis A, v.386, p.147–156, 2010. [89] LI, Z.; SHI, T.; GUO, L. Preparation and morphology of porous SiO2 ceramics derived from fir flour templates. Journal of the Serbian Chemical Society, v.75, p.385-394, 2010. [90] KONOPNY, L.W.; JUAN, A.; DAMIANI, D.E. Preparation and characterization of γ-Al2O3-supported Pd-Mo catalysts. Applied Catalysis B, v.15, p.115-127, 1998. [91] TONETTO, G.M.; FERREIRA, M.L.; DAMIANI, D.E.; Performance of Pd-Mo/γ- Al< sub> 2</sub> O< sub> 3</sub> catalysts for the selective reduction of NO by methane. Journal of Molecular Catalysis A, v.193, p.121-137, 2003. [92] GOMEZ-SAINERO, X.L.; SEOANE, J.L.G.; FIERRO, A.; ARCOYA, D. Liquid- Phase Hydrodechlorination of CCl< sub> 4</sub> to CHCl< sub> 3</sub> on Pd/Carbon Catalysts: Nature and Role of Pd Active Species. Journal of Catalysis, v.209, p.279, 2002. [93] PALCZEWSKA, W. Catalytic reactivity of hydrogen on palladium and nickel hydride phases. Advances in Catalysis, v.24, p.245, 1975. [94] SHEKAR, S.C.; MURTHY, RAO, P.K.;. RAO, K.S.R. Pd supported on fluorinated carbon covered alumina (FCCA) a high performance catalyst in the hydrodechlorination of dichlorodifluoromethane. Catalysis Communication, v.4, 2003. [95] NERY, G.; MUSOLINO, M.G.; MILONE, C.;. PIETROPAOLO, D.; GALVAGNO, S. Particle size effect in the catalytic hydrogenation of 2,4-dinitrotoluene over Pd/C catalysts. Applied Catalysis A, v.208, p.307, 2001. 46 [96] KRUK, M.; JARONIEC, M. Gas Adsorption Characterization of Ordered Organic−Inorganic Nanocomposite Materials. Chemical Materials, v.13, p.3169-3183, 2001. [97] CORMA, A. From microporous to mesoporous molecular sieve materials and their use in catalysis. Chemical Reviews, v.97, p.2373-2420, 1997. [98] ROBLES-DUTENHEFNER, P.A.; BRANDÃO, B.B.N.; SOUSA, L.F.; GUSEVSKAYA, E.V. Solvent-free chromium catalyzed aerobic oxidation of biomassbased alkenes as a route to valuable fragrance compounds. Applied Catalysis A, v.47, n.1-2 p.20-28, 2011. [99] NOBRE, S.M.; MONTEIRO, A.L. Synthesis of diarylmethane derivatives from Pd-catalyzed cross-coupling reactions of benzylic halides with arylboronic acids. Tetrahedron Letters, v.45, p.8225-8228, 2004. [100] ZHENG, Z.L.; LI, H.F.; LIU, T.F.; CAO, R.; CAO, Z.; Monodisperse noble metal nanoparticles stabilized in SBA-15: Synthesis, characterization and application in microwave-assisted Suzuki–Miyaura coupling reaction. Jornal of Catalysis, v.270, p.268274, 2010. [101] PRATI, L.; VILLA, A.; PORTA, F.; WANG, D. SU, D. Single-phase gold/palladium catalyst: The nature of synergistic effect. Catalysis Today, v.122, n.3–4, p.386–390, 2007 [102] CHEN, M.; KUMAR, D.; YI, C.W.; GOODMAN, D.W. The Promotional Effect of Gold in Catalysis by Palladium-Gold. Science, v.310, p.291-293, 2005. 47 Capítulo 02 Valorização econômica de óleos essenciais: uma interconexão sustentável entre a cadeia produtiva sucroalcooeira, a minimização de impactos ambientais e a indústria de química fina 48 1. Introdução 1.1. O Foco 1: o bagaço de cana e a cadeia produtiva de etanol Obtenção de um bom adsorvente para remediação ambiental Nos últimos anos, a utilização de materiais orgânicos como suportes para adsorção de cátions metálicos têm recebido muita atenção, uma vez que esta é uma alternativa promissora por apresentar baixo valor econômico associado[1,2]. Desde então, diversos grupos de pesquisa têm desenvolvido materiais à base de compostos orgânicos que apresentam afinidade química por cátions metálicos. Em destaque, está a biomassa proveniente de resíduos agrícolas, como bagaço da cana-de-açúcar, madeira e serragem que podem ser utilizados para essa finalidade[1,3-7]. No mercado brasileiro, esta rota se mostra ainda mais promissora devido aos grandes investimentos nos últimos anos na produção de combustíveis renováveis. Segundo o Ministério da Agricultura, a produção brasileira de cana-de-açúcar foi de 558 milhões de toneladas em 2008/2009, o que resulta em aproximadamente 407 milhões de toneladas de bagaço de cana[8,9]. O bagaço de cana é composto por cerca de 50% de celulose, 27% polioses e 23% de lignina[10]. Tais componentes possuem em suas estruturas grupos hidroxila que viabilizam a incorporação de funções químicas que potencialmente possam adsorver cátions metálicos com alta seletividade. Um exemplo de grupamento que pode ser inserido é o ácido etilenodiamino-N,N,N’,N’-tetraacético (EDTA), um agente complexante eficiente após sua incorporação na matriz de lignocelulose[1,9]. Outros compostos como os anidridos succínico, maleico e ftálico são utilizados na modificação da superfície destes materiais para formar uma superfície contendo grupos funcionais do tipo ácido carboxílico e, consequentemente, ocorrendo aumento da sua capacidade adsortiva[10-14]. Destaca-se que, inicialmente o bagaço de cana modificado pode adsorver eficientemente cátions metálicos presentes em corpos hídricos[2,3,8,9], tornando esta estratégia de adsorção bastante interessante dos pontos de vista econômico e ambiental. No entanto, após a utilização na remediação ambiental, o mesmo se torna sem aplicação. Inúmeros estudos têm sido reportados utilizando adsorventes orgânicos de metais pesados 49 como catalisadores em diversas reações, destacando-se as aplicações em fotocatálise para degradação de poluentes e processos de oxidação de moléculas modelo[15,16]. No entanto, não foram encontrados trabalhos reportando a utilização de materiais lignocelulósicos à base de bagaço de cana como adsorvente/catalisador. 1.2. Remediação ambiental Indústria do Etanol Remediação Ambiental Cromo Catálise Heterogênea Indústria da Química Fina Valor agregado aos Oleos Essenciais A situação do Brasil no setor de coleta e tratamento de esgoto sanitário é bastante desfavorável. De acordo com a PNSB (Pesquisa Nacional de Saneamento Básico) de 2008, contendo o mais recente levantamento de dados realizado pelo governo brasileiro, somente 55,2% dos municípios brasileiros mantêm coleta de esgoto pela rede geral e somente 1/3 fazem o tratamento dos esgotos[17]. Dessa forma, a grande parte dos esgotos é despejada em rios, lagos ou mares contribuindo para o crescimento da poluição dos recursos hídricos nacionais. Além disso, tornou-se expressiva a quantidade de áreas contaminadas identificadas nos centros urbanos, sendo que metais pesados e solventes orgânicos são os poluentes mais comuns[18,19]. As fontes de contaminação são oriundas de diversas fontes, desde despejos industriais e domésticos em rios, até vazamento de tanques subterrâneos em postos de combustível. Os metais pesados possuem características de reatividade e bioacumulação impedindo que os organismos sejam capazes de eliminá-los. Dessa forma, a necessidade do desenvolvimento de processos industriais que causem menores impactos ambientais ou que utilizem no processo produtivo, resíduos e/ou efluentes contribuindo para redução da poluição ambiental se faz cada vez mais necessária. 1.3. Problemas de contaminação com cromo Indústria do Etanol Remediação Ambiental Cromo Catálise Heterogênea Indústria da Química Fina Valor agregado aos Oleos Essenciais Os compostos de cromo (VI) ocorrem naturalmente em concentrações mínimas na crosta terrestre e, dessa forma, é através das práticas industriais que o mesmo pode ocorrer em teores maiores, originando-se de emissões das fabricações de cimento, indústrias 50 galvânicas, fundições, soldagem, mineração, lixos urbanos e industriais, incineração, fertilizantes e especialmente da sua utilização em curtumes, entre outros[20-25]. O curtimento de couro[23] é uma atividade intensiva com uma metodologia estabelecida, sendo que o tratamento dos efluentes gerados por esta indústria acarreta a formação de um resíduo sólido denominado de lodo e que contém concentrações significativas de cromo. O lodo é disposto em recipientes, podendo ser incinerado ou guardado indefinidamente em condições ótimas. Porém, os altos custos decorrentes do armazenamento e/ou da incineração induzem muitas indústrias a comportamentos inadequados, como o descarte de resíduos em locais inapropriados. A toxicidade do metal cromo varia com o estado de oxidação do mesmo e seus efeitos estão associados à forma química e à exposição. No entanto, todas as formas de cromo podem ser tóxicas em concentrações elevadas. Os compostos de cromo (VI) são os mais tóxicos e quando ingeridos podem ser letais com doses de alguns miligramas. Além disso, em concentrações relativamente baixas, o cromo (VI) é altamente carcinógeno[26-28]. Dessa forma, um dos grandes desafios para as indústrias e agentes governamentais está na busca de alternativas de menor custo associado a processos de tratamento de efluentes e resíduos contaminados por cromo. Como utilizar o adsorvente à base de bagaço de cana após o seu papel na remediação ambiental? Neste contexto, esta alternativa se mostra, em princípio, bastante promissora para aplicação na remoção de metais pesados em efluentes e águas contaminadas. Entretanto, após a remoção metálica em um efluente, mesmo resolvendo o problema de contaminação com este metal, o material sólido resultante da adsorção não possui uma aplicação definida, o que inviabiliza a sustentabilidade de um possível processo. 1.4. Materiais sólidos como catalisadores heterogêneos Indústria do Etanol Remediação Ambiental Cromo Catálise Heterogênea Indústria da Química Fina Valor agregado aos Oleos Essenciais Materiais sólidos contendo metais de transição tais como cobalto, cromo e níquel são amplamente utilizados como catalisadores heterogêneos em diversas reações de interesse 51 da indústria de química fina, petroquímica, farmacêutica, cosméticos e outras[29-31]. Um exemplo é a funcionalização de monoterpenos para obtenção de compostos de interesse da indústria de química fina, buscando a valorização da cadeia produtiva de óleos essenciais[32,33]. Estima-se que 90% de todos os processos químicos industriais utilizem catalisadores heterogêneos em alguma etapa da produção, o que demonstra seu papel de grande importância na indústria[34]. Um catalisador é um material que converte reagentes em produtos, através de uma série de etapas elementares, nas quais o catalisador participa, mas sendo regenerado à sua forma original no final de cada ciclo reacional[34,35]. As justificativas de se empregar um processo catalítico na indústria são diversas. A primeira razão é, talvez, a mais importante, uma vez que muitas reações químicas termodinamicamente favoráveis não estabelecem o equilíbrio da reação em intervalos de tempo pequenos na ausência de catalisadores. A reação pode ocorrer em um intervalo de tempo tão grande que sua aplicação industrial se torna inviável. Porém, na presença de um catalisador, uma mesma reação que demanda horas pode ocorrer em poucos minutos. Um segundo incentivo é que, mediante o emprego de catalisadores, as reações podem ocorrer em condições mais amenas de temperatura e pressão, viabilizando o custo de construção e manutenção de plantas industriais[36-37]. Outra vantagem do emprego de catalisadores está relacionada com a economia atômica[38], pois ele diminui ou até mesmo elimina a formação de produtos indesejados. 1.5. Indústria de Química Fina Indústria do Etanol Remediação Ambiental Cromo Catálise Heterogênea Indústria da Química Fina Valor agregado aos Oleos Essenciais Os produtos químicos obtidos industrialmente podem ser divididos em três grupos, sendo que os critérios principais para o enquadramento dos mesmos em cada grupo são os custos de produção, a complexidade das operações e o grau de sofisticação necessária para a sua produção[39]. Dessa forma, podem ser classificados como commodities (substâncias básicas para a indústria e, em geral, produzidas em larga escala e vendidas a preços baixos), especialidades químicas (produtos produzidos em baixa escala para uma aplicação muito específica e comercializados a preços mais elevados) e produtos de química fina 52 (possuem um maior valor agregado, requerem várias etapas para sua produção e têm elevado conteúdo tecnológico incorporado)[39-41]. Como exemplos de produtos de química fina estão os defensivos agrícolas, os defensivos animais, os fármacos, os catalisadores e aditivos, as fragrâncias, os flavorizantes, os intermediários de síntese, os corantes, etc. Pelo fato do processamento de produtos de química fina requerer um grande número de etapas durante a obtenção, torna-se necessária a aplicação de catalisadores nestas indústrias com o intuito de diminuir ou até mesmo eliminar a formação de substâncias indesejadas, aumentando a seletividade e diminuindo os custos do processo. A indústria química brasileira ocupa uma posição de destaque no ranking mundial, se apresentando atualmente na nona posição e sendo superado pelos Estados Unidos, Japão, China, Alemanha, França, Coréia do Sul, Reino Unido e Itália. A química fina é o segundo principal setor na indústria química brasileira e fatura anualmente cerca 15,5 bilhões de dólares[41]. Considerando apenas o mercado brasileiro, as indústrias de aromas e fragrâncias representam cerca de 3% da indústria de química fina (Figura 24), ou seja, o subsetor de aromas e fragrâncias têm um faturamento anual de aproximadamente 500 milhões de dólares[40,41]. Figura 24. Composição do mercado de química fina no Brasil[41] 53 1.6. O Foco 2: A cadeia produtiva nacional de óleos essenciais Indústria do Etanol Remediação Ambiental Cromo Catálise Heterogênea Indústria da Química Fina Valor agregado aos Óleos Essenciais O Brasil é um dos maiores exportadores de terpenos, principais componentes dos óleos essenciais. Essas substâncias constituem um dos mais importantes grupos de matérias-primas para as indústrias de fragrâncias, alimentos e farmacêutica[42,43]. A Figura 25 ilustra as estruturas químicas de alguns monoterpenos e derivados. OH OH terpineol -pineno limoneno citronelol linalol Figura 25. Estruturas químicas de monoterpenos e derivados A balança comercial brasileira de óleos essenciais e perfumes possui um superávit quantitativo de exportação em relação à quantidade importada. Entretanto, quando o parâmetro é o valor monetário, a mesma balança se apresenta em déficit de acordo com a Figura 26[40,41]. Figura 26. Comparação da balança comercial brasileira de forma quantitativa e em termos de valor monetário para os óleos essenciais e produtos para a indústria de fragrâncias[40]. 54 A situação está se agravando por causa da valorização do real na última década e a intensificação da concorrência internacional, vindo principalmente da China e dos EUA. Por exemplo, em 2010 o Brasil exportou 130 toneladas de limoneno (um dos monoterpenos mais vendidos no Brasil) a um preço médio de US$ 3,09 por quilograma. Todavia, a carvona (produto da oxidação do limoneno) foi importada, também em 2010, a um preço médio de US$ 14,37 por quilograma. Apenas em 2010, a comercialização dessas substâncias gerou para o Brasil um déficit em torno de US$ 900.000,00[41]. Ou seja, os países desenvolvidos importam estes óleos como matérias-primas baratas e lhes agregam valor através de processos químicos como purificação, destilação, preparação de derivados, isolamento de constituintes e modificações químicas, utilizando os produtos no mercado interno e exportando-os mais tarde. O Brasil tem lugar de relevância na produção de óleos essenciais e ao lado da Índia, China e Indonésia são considerados os grandes produtores mundiais. A posição do Brasil deve-se aos óleos essenciais cítricos, tais como o de laranja rico no monoterpeno limoneno. A Figura 27 ilustra um fluxograma simplificado da produção de suco e óleo essencial de laranja[44]. Laranja Higienização Óleo essencial Extratora Casca, bagaço Clarificação Pasteurização Suco de laranja Figura 27. Fluxograma da cadeia produtiva de suco e óleo essencial de laranja Além disso, o Brasil têm posições de destaque na produção de óleo essencial de Citronela e no óleo de terebentina que são ricos nos monoterpenos citronelol e -pineno, respectivamente[45-46]. Monoterpenos como limoneno, -pineno e citronelol são precursores baratos para obtenção de derivados oxigenados de interesse industrial. No entanto, a transformação 55 química desses compostos através de processos catalíticos possibilita a obtenção de intermediários de alto valor agregado tais como o mentol, a carvona e o mirtenol que são de grande interesse de indústrias como a de flavorizantes, perfumes e alimentos. Aplicação para adsorvente a base de bagaço de cana Portanto, uma possível utilização de um material adsorvente produzido a partir do bagaço de cana e um efluente contendo cromo é a aplicação como catalisador na transformação química de monoterpenos, tornando eficiente o ciclo de sustentabilidade deste possível processo proposto e ainda tornando-o atrativo, uma vez que envolve a cadeia nacional de produção de combustíveis aproveitando os rejeitos de bagaço de cana-deaçúcar desta indústria. Este aproveitamento tem a finalidade de utilizá-los para minimizar os problemas de contaminação de metais pesados em corpos d’água ou efluentes contaminados. E por fim, aplicar o adsorvente resultante na valorização da cadeia nacional de óleos essenciais, que como já foi discutido, é um campo que pode ser amplamente explorado no país, pois a balança comercial dos derivados dos terpenos de alto valor agregado apresenta um grande déficit monetário. A Figura 28 resume a interconexão entre as cadeias produtivas de combustíveis e de óleos essenciais, a indústria de cromo e a catálise heterogênea. Adsorventes Cromo: problema ambiental Resíduo do bagaço de cana Cadeia produtiva de etanol Produção de Insumos para fragrâncias, flavorizantes Valorização Comercial dos óleos Essenciais Aplicação: Catálise Heterogênea Cadeia produtiva de Óleos essenciais Figura 28. Interconexão entre setores industriais para a produção de insumos de química fina 56 2. Objetivos O foco desta etapa é o desenvolvimento de um processo que visa o aproveitamento de resíduos agroindustriais como bagaço da cana-de-açúcar proveniente da indústria sucroalcooeira e, que tem por finalidade, utilizá-los como adsorventes para os metais cromo e cobalto presentes em efluentes sintéticos. Em seguida, pretende-se utilizar o material resultante como catalisador heterogêneo na valorização econômica de óleos essenciais que fazem parte da cadeia produtiva nacional para a produção de compostos de interesse da indústria de fragrâncias e flavorizantes. Dessa forma, o trabalho foi dividido nas seguintes etapas: 1. Modificação química do bagaço de cana para o aumento da capacidade adsortiva da matriz. 2. Adsorção química do cromo presente em solução de um efluente sintético. 3. Caracterização textural, estrutural e química dos materiais obtidos. 4. Avaliação de desempenho catalítico dos catalisadores heterogêneos na oxidação seletiva do citronelol, limoneno e -pineno. A Figura 29 resume as idéias principais do trabalho proposto. Cadeia produtiva de etanol Indústrias dependentes de cromo Cadeia produtiva de óleos essenciais Efluentes contendo cromo Catalisadores heterogêneos Insumos para fragrâncias, flavorizantes. Figura 29. Proposta com as principais idéias do trabalho 57 3. Experimental 3.1. Preparo dos catalisadores SCB2-Co e SCB2-Cr a partir do bagaço de cana-de-açúcar modificado com anidrido succínico Os adsorventes utilizados neste trabalho foram preparados através da colaboração com o professor Laurent Frèdèric Gil da Universidade Federal de Ouro Preto que preparou os materiais utilizados. A modificação do bagaço (B) foi realizada a partir da rota sintética proposta na Figura 30, na qual o bagaço da cana-de-açúcar, B, foi modificado com anidrido succínico sob refluxo de piridina. Ao término da reação o material foi filtrado e lavado sucessivamente, com as soluções de ácido acético em diclorometano, a seguir com etanol, depois com solução de 0,01mol/L de ácido clorídrico. O bagaço succilinado, denominado SCB1, foi seco a 80°C por 30 minutos. Em seguida, foi tratado com solução de bicarbonato de sódio, filtrado, lavado com água e com etanol, e seco a 80°C, gerando o adsorvente SCB2. Posteriormente, este adsorvente foi colocado em contado com um efluente preparado de forma sintética contendo Cr3+(aq) (0,2mol/L) ou Co2+(aq) (0,2mol/L) durante uma hora, e em seguida foi filtrado e lavado com água destilada e etanol. Figura 30. Rota de síntese utilizada para preparo dos catalisadores SCB2-Co e SCB2-Cr. 3.2. Preparo dos catalisadores EB-Cr e EB-Co a partir do bagaço de cana-deaçúcar modificado com dianidrido de EDTA Esta modificação foi realizada a partir da rota sintética proposta na Figura 31, em que o bagaço de cana pré-tratado, B, é modificado com o dianidrido do EDTA em 58 dimetilformamida (DMF). O bagaço modificado, denominado EB, foi seco a 100°C por 1 hora. O adsorvente EB foi colocado em contato com um efluente sintético contendo Cr3+(aq) (0,2mol/L) ou Co2+(aq) (0,2mol/L), durante uma hora, e em seguida foi filtrado e lavado com água destilada e etanol. Figura 31. Rota de síntese utilizada para preparo dos catalisadores EB-Co e EB-Cr. 3.3. Caracterização dos catalisadores O bagaço de cana B e as matrizes SCB1 e EB foram caracterizados por espectroscopia de absorção na região do infravermelho com transformada de Fourier (FTIR) em espectrômetro Nicolet modelo Impact 410. Em forma de pastilha, 1mg de amostra foi prensada com 100mg de KBr. A quantidade de cromo e cobalto adsorvidos pelos materiais SCB2 e EB foi determinada por espectrometria de emissão atômica com plasma indutivamente acoplado (ICP-AES). As análises foram feitas após a digestão ácida das amostras, nas quais 100,0mg 59 dos catalisadores foram tratados com 10,0mL de “água régia” (solução 3:1v/v de HClconc./HNO3conc) durante 15 minutos em uma chapa aquecida a 80ºC. As características texturais das matrizes foram determinadas a partir das isotermas de adsorção de nitrogênio a -196ºC utilizando um Autosorb-Quantachrome-IQ. As amostras (100mg) foram degaseificadas por 10 horas a 100ºC antes da análise. As áreas superficiais específicas foram determinadas pela equação de Brunauer-Emmett-Teller (método BET) a partir das isotermas de adsorção na faixa de pressão relativa de 0,07<P/Po<0,3. O volume total de poros foi obtido da quantidade de N2 adsorvido a pressão relativa próxima da unidade. O diâmetro médio de poros foi determinado pelo método Barrett-Joyner-Halenda (BJH). As características estruturais dos catalisadores foram avaliadas por difração de raios X de pó (DRX) utilizando um difratômetro Shimadtzu 6000 com radiação CuK (40kV, 40mA, λ = 0,15418nm). A faixa de varredura utilizada foi de 2θ = 10-70° com velocidade angular de 5°/min. O comportamento termogravimétrico (TGA) das amostras foi verificado em um equipamento Mettler-TG50 STARE. Os ensaios foram realizados por aquecimento das amostras da temperatura ambiente até 900ºC a uma taxa de 10ºC/min e atmosfera de ar sintético. 3.4. Testes de oxidação catalítica Nos testes de oxidação catalítica, foram utilizados os monoterpenos -citronelol (1), limoneno (2), -pineno (3) que fazem parte da cadeia produtiva nacional de óleos essenciais. Os testes foram conduzidos a 80ºC em um sistema fechado contendo um reator de vidro acoplado a uma bureta para o monitoramento do consumo de O2. Em um teste típico, utilizou-se um volume de 5,0mL de substrato comercial (fornecedor Citral) e 100 mg do catalisador, sob agitação magnética. O acompanhamento das reações foi feito por cromatografia gasosa (cromatógrafo Shimadzu 17A, coluna capilar CarboWAX 20M e detector FID) e as estruturas dos produtos confirmadas por cromatografia gasosa acoplada à espectrometria de massas (instrumento Shimadzu QP5000, coluna capilar DB5, 70eV) por meio da comparação com espectros de massas de padrões dos mesmos. A seguir são apresentadas as principais fragmentações dos produtos de oxidação identificados por CG/MS derivados dos monoterpenos nos citronelol, limoneno e -pineno. 60 MS(m/z/int.rel.) citronelal: 154/2; 139/16; 81/20; 71/25; 69/52; 67/29; 59/37; 57/23; 55/58; 43/100;41/89 MS(m/z/int.rel.) epóxido de citronelol: 172/3; 85/24; 83/40; 81/28; 72/44;71/63; 69/100; 59/95; 57/50; 55/8543/85; 41/72;31/22; 29/26 MS(m/z/int.rel.) de carveol: 134/19; 119/33; 109/82; 91/76; 84/61; 79/27; 77/44; 69/37; 67/29; 65/32; 56/40; 55/51; 53/37; 44/27; 43/44; 41/100; 40/27 MS(m/z/int.rel.) de carvona:150/5; 108/16; 107/16; 93/27; 91/15; 82/100; 79/20; 77/16; 67/14; 58/14; 54/71; 53/34; 41/52; 40/16 MS(m/z/int.rel.) de pinocarveol: 119/16; 109/10; 92/63; 91/49; 83/33; 81/20; 79/22 77/19; 70/51; 69/27; 67/21; 55/87; 53/30; 44/33; 43/49; 42/17; 41/100; 40/24 MS(m/z/int.rel.) de mirtenol: 152/2; 108/20; 93/15; 91/42; 79/100; 77/22; 67/17; 55/16; 53/12; 43/29; 41/42 MS(m/z/int.rel.) de mirtenal: 135/6; 108/20; 107/51; 106/19; 105/23; 105/23 91/38; 79/100; 77/52; 67/14; 66/17; 53/25; 51/18; 44/20; 43/29; 41/60 4. Resultados e Discussões 4.1. Caracterização dos catalisadores Os catalisadores heterogêneos preparados através do bagaço de cana modificado quimicamente e utilizados como adsorventes de cromo e cobalto em efluentes sintéticos, foram caracterizados por FTIR, BET, ICP-AES, DRX e TGA para avaliar as propriedades estruturais, texturais e a composição química dos materiais. A Figura 32a e b apresentam os espectros FTIR da matéria-prima bagaço de cana (B), do bagaço de cana succinilado (SCB1) e do bagaço de cana modificado com dianidrido de EDTA (EB). Na Figura 32a, nota-se que as principais evidências da funcionalização da superfície do bagaço de cana é o aparecimento de bandas de 2970, 2929, e 2852cm-1, correspondendo aos estiramentos simétrico e assimétrico de grupos metileno (γCH) presentes no grupo succinil[2]. As bandas em 1653 e 1655cm-1 correspondem aos estiramentos de grupos carbonila (γC=O) também presentes no succinil. Na Figura 32b, pode-se notar nos espectros comparativos de B e EB o aparecimento de uma banda forte em 1743cm-1 atribuída à deformação axial de grupos éster (–O–C=O) e em 1631cm-1 atribuída à deformação axial simétrica de grupos carboxilato presentes na molécula de 61 EDTA introduzido no bagaço de cana. Estas bandas confirmam a funcionalização com anidrido succínico e dianidrido EDTA no suportes sólidos. Figura 32. Espectros FTIR comparativos (a) B e SCB1; (b) B e EB A Tabela VI sumariza os resultados de área superficial, tamanho médio dos poros e volume de poros dos adsorventes SCB2 e EB obtidos pela equação BET e método BJH. Tabela VI. Características texturais dos materiais SCB2 e EB Área Material superficial BET (m2/g) Volume total de poros (x10-3 cm3.g-1) Diâmetro médio de poros (nm) SCB2 2,7 10,0 15.5 EB 1,5 4,0 10.8 62 Observa-se que os sólidos adsorventes apresentam baixas áreas superficiais e, portanto, deve-se esperar que apenas uma pequena fração do metal em solução aquosa possa sofrer adsorção física, o que constata que a funcionalização da superfície do bagaço de cana deve ser eficaz para que possa ocorrer adsorção química entre o íon selecionado e a superfície funcionalizada. Os difratogramas dos catalisadores de cromo e cobalto adsorvidos nas matrizes SCB2 e EB apresentados na Figura 33 não indicaram a presença de fases cristalinas de cromo e cobalto para nenhuma das amostras, o que reforça a hipótese de que todo o metal está adsorvido quimicamente pelas funções orgânicas que compõem as matrizes, e que implica na não formação da estrutura cristalina do metal. Além disso, os padrões de difração para as amostras apresentaram bandas intensas relativas a estrutura cristalina de Celulose I mantida mesmo após a modificação química do bagaço de cana[2,3,7]. EB-Cr Intesidade (u.a) EB-Co SCB2-Cr SCB2-Co 10 20 30 40 50 60 70 2 Figura 33. Difratogramas das amostras Cr/BMS2 e Cr/BME 63 As curvas termogravimétricas para SCB2-Co, EB-Co, SCB2-Cr, e EB-Cr estão apresentadas na Figura 34. Como pode ser observado na Tabela VII e pela Figura 34 a,b,c e d, a perda inicial de massa (ocorrendo entre 49-60 °C e representando aproximadamente 10-14% do total de perda de massa) foi atribuído a vaporização de água nas amostras. Para todas as amostras, a perda de massa devido à degradação da matéria lignocelulósica seguiu um perfil semelhante totalizando perdas de massa em torno de 70-83%. A degradação da estrutura ocorre em cerca de 320°C-380ºC[53,54]. Como pode ser visto na Tabela VII, a segunda temperatura de decomposição (TD,2) para as amostras SCB2-Co, EB-Co, e EB-Cr está próximo de 320°C, valores que estão em concordância com as observações feitas por Ouajai e Shanks[53] e Bilba e Ouensanga[54]. Tabela VII. Dados termogravimétricos para a decomposição térmica SCB2-Co, SCB2-Cr, EB-Co e EB-Cr Bagaço de cana SCB2-Co SCB2-Cr EB-Co TD,1 (°C) 70 55 53 60 49 M1 (%) 6.3 14 10 12 10 TD,2 (°C) 320 324 318 310 284 TD,3 (°C) 376 366 349 349 334 TD,4 (°C) - 392 366 371 359 83 70 79 80 83 (MxOy%) 10.7 16 11 8 7.0 Co (%)1 - 12.6 - 6.3 - Cr (%)1 - - 7.5 M2,3,4 (%) 1 EB -Cr - 4.8 Nos cálculos de porcentagem de Co e Cr em SCB2 e EB foram considerados a formação de CoO e Cr 2O3. 64 Figura 34. Curvas termogravimétricas para (a) SCB2-Co, (b) SCB2-Cr, (c) EB-Co, e (d) EB-Cr sob atmosfera de ar. A quantificação do conteúdo de cromo e cobalto em SCB2-Cr, EB-Cr, SCB2-Co, e EB-Co por ICP-AES indicou os valores de 6,5%, 5,0%, 12,0% e 9,0%p/p, respectivamente. Estes valores estão de acordo com os valores de conteúdo metálico indicados por TGA (Tabela VII), apresentando uma variação entre os métodos que está dentro da margem de erro aceitável para o desvio absoluto em métodos analíticos (<5%). Ressalta-se, que os teores dos metais contidos nas matrizes lignocelulósicas podem variar de acordo com o experimento de adsorção realizado no procedimento experimental. Fatores tais como o tempo de contato efluente-matriz, pH da solução metálica, concentração metálica do efluente e outros, podem influenciar significativamente o aumento/diminuição do processo de adsorção. Além disso, estudos podem ser realizados com a finalidade de adsorver outras espécies de cromo tais como, dicromatos e cromatos e que não foram abordados neste trabalho. Ainda sim, em um estudo mais minucioso, pode- 65 se controlar o teor de cada metal a ser adsorvido pelas matrizes. No entanto, este não é o foco deste trabalho. Visa-se, principalmente, estudar a viabilidade da aplicação de materiais adsorventes, após a sua utilização na remediação ambiental de metais, como catalisadores heterogêneos na valorização econômica de óleos essenciais advindos da cadeia produtiva nacional. Dessa forma, uma possível aplicação promissora para estes adsorventes contendo íons metálicos e utilizados como catalisadores é o foco principal. 4.2. Testes de desempenho catalítico Os adsorventes contendo íons metálicos foram utilizados como catalisadores heterogêneos na oxidação do citronelol (1), limoneno (2) e -pineno (3). Os testes catalíticos foram realizados na ausência de solvente, o que incrementa ao processo ações ambientalmente corretas visando à minimização da formação de resíduos e efluentes e que se alinham à química verde. A oxidação catalítica do substrato terpênico -citronelol (1) resultou na formação de citronelal (4) e epóxido de citronelol (5) como produtos principais. Para o monoterpeno limoneno (2), os principais produtos de oxidação foram o carveol (6), a carvona (7) e o epóxido limoneno (8). E para o monoterpeno cíclico -pineno (3), os produtos majoritários foram o pinocarveol (9), o mirtenal (10) e o mirtenol (11). Os resultados obtidos são mostrados em detalhe na Tabela VIII. A análise da distribuição dos produtos indica a formação, principalmente, de derivados de reação de epoxidação e oxidação alílica. No entanto, de acordo com a literatura[55], o mecanismo principal a ser observado para este tipo de reação é de oxidação alílica dos monoterpenos. Nestas reações, um mecanismo de formação radicais livres é geralmente sugerido. É esperado que ocorra a competição entre a abstração do hidrogênio alílico para resultar os produtos de oxidação alílica e a adição dos radicais alquil peróxido à dupla ligação, formando os produtos epoxidação[56]. No entanto, citronelal (4) é o produto de oxidação principal do citronelol (1), correspondendo a oxidação da função álcool. Como esperado[33], há um forte efeito da estrutura do monoterpeno sobre a natureza do produto como pode ser visto na Tabela VIII. Na oxidação de limoneno e -citronelol, ambos apresentaram produtos de epoxidação, enquanto que os produtos de oxidação de -pineno foram formados somente por oxidação alílica, que também ocorre com limoneno. 66 A reação em branco para todos os substratos, em que nenhum catalisador foi adicionado, não mostrou praticamente nenhuma atividade catalítica (conversão <5% após 24 horas). Estas reações não são mostradas na Tabela VIII. O efeito da modificação do bagaço de cana foi estudado neste trabalho para os materiais de cobalto e cromo adsorvidos no bagaço succinilado (SCB2) e o bagaço de cana modificado com dianidrido EDTA (EB). Os resultados da oxidação de -citronelol (1), limoneno (2) e -pineno (3) mostraram que os catalisadores testados foram promissores para serem utilizados em reações de oxidação dos monoterpenos estudados, com resultados de conversão entre 49 e 78% e seletividade combinada para produtos de até 59%. Cromo e cobalto promoveram os maiores valores de conversão e seletividade na matriz de bagaço de succinilado (SCB2). Os adsorventes contendo cobalto foram mais ativos do que os contendo cromo quando comparados os resultados utilizando a mesma matriz. Essa diferença na atividade catalítica pode ser atribuída a vários fatores, como a natureza química dos metais, uma vez que o metal cromo tem propriedades diferentes de cobalto e promove o processo catalítico por mecanismos diferentes entre si. No entanto, os maiores valores de TON foram obtidos para catalisadores em EB como um resultado de menor teor de metal adsorvido por esta matriz. Uma análise preliminar das diferenças nos resultados obtidos pelas matrizes estudadas indicaram que SCB2 favorece que os metais cobalto e cromo promovam conversões e seletividades mais elevadas do que em EB. Os menores valores de conversão e seletividade obtidos utilizando os catalisadores em EB pode ser atribuída ao EDTA, devido a fato de que o mesmo é um ligante hexadentado e forma um complexo de coordenação estável em que o metal é encapsulado e, portanto, está menos disponível para o processo catalítico. Os catalisadores de Co e Cr podem se removidos a partir da mistura reacional por simples centrifugação ou filtração e lavagem após a reação com uma mistura de etanol/água. O catalisador recuperado após a lavagem pode ser reutilizado várias vezes sem uma perda significativa de atividade e seletividade. Não foi observada lixiviação significativa. Sugere-se que, a ausência de lixiviação dos metais é devido à forte interação entre a matriz e íon metálico, uma vez que, o processo de adsorção ocorre por complexação de um cátions por grupos carboxila (-COO-) e amino (-NR1R2) resultando na formação de quelatos com elevada estabilidade. Assim, com ausência de lixiviação dos 67 metais, o catalisador pode ser facilmente recuperado através de centrifugação ou filtração e então reutilizado. Tabela VIII. Oxidação de -citronelol (1), limoneno (2) e (-)--pineno (3) catalisados por adsorventes de Co e Cr em condições solvent-free a. Substrato Catalisador Conversãob (%) Seletividadeb (%) OH TONc OH O (1) SCB2-Cr EB-Cr SCB2-Co EB-Co 58 49 67 61 O (4) Oxidação de OH 23 19 32 28 (5) Epoxidação 21 18 14 13 125 137 104 108 O O OH (2) SCB2-Cr EB-Cr SCB2-Co EB-Co 75 60 78 73 (6) (7) Oxidação alílica 15 19 12 14 27 22 21 17 (8) Epoxidação 13 5 10 8 CHO 180 185 115 143 OH OH (3) SCB2-Cr EB-Cr SCB2-Co EB-Co 70 58 76 69 (9) (10) 9 7 9 8 Oxidação alílica 19 16 22 19 a Condições de reação: 0,100 g de catalisador,80ºC, substrato= 5mL, O2 1atm ; 12h b Determinados por cromatografia a gás c TON – mol de substrato/mol de Cr ou Co d Reação sem catalisador realizada durante 24h (11) 21 19 27 22 180 192 119 144 68 A utilização de compostos baseados em biomassa contendo cromo e cobalto imobilizados numa matriz sólida como catalisador, o uso de oxigênio molecular como o oxidante final e o emprego de sistemas livres de solventes são vantagens práticas do presente processo ambientalmente correto e adiciona valor para os adsorventes após a sua utilização. Uma análise global dos resultados demonstra que o processo aqui proposto é bastante atrativo, uma vez que os adsorventes preparados foram capazes de converter os monoterpenos advindos da cadeia nacional de óleos essenciais, com seletividades satisfatórias, em produtos de maior valor agregado e de grande interesse tecnológico tais como a carvona, carveol e citronelal, que são aplicados nas indústrias de fragrâncias, cosméticos e limpeza. 69 5. Conclusões O trabalho desenvolvido propõe uma aplicação para adsorventes após o seu uso na remediação ambiental, especificamente na retirada de metais presentes em efluentes. Para isso, foram feitas modificações químicas na superfície deste material com a finalidade de melhorar sua capacidade adsortiva. Os testes de adsorção foram realizados para o metal cromo e cobalto. Os dados de quantificação do conteúdo metálico via ICP-AES comprovam que foi possível adsorver até 6,5 e 12% em peso dos metais cromo e cobalto presentes em um efluente preparado em laboratório, o que pode ser considerado uma quantidade bastante significativa. Dessa forma, os adsorventes contendo cromo ou cobalto denominado em uma segunda etapa de catalisadores heterogêneos, foram utilizados na oxidação do citronelol, limoneno e -pineno. Atingiram-se seletividades combinadas com valores satisfatórios de 33 até 58% para os produtos de oxidação com conversões entre 49 a 78%. Também foi demonstrado que não ocorre lixiviação do metal sugerindo que a metodologia de adsorção é realmente eficiente para este caso. A metodologia utilizada para obtenção dos adsorventes é bastante eficiente e versátil podendo ser estendida a outros íons metálicos e espécies diferentes de cromo que possam estar presentes em ambientes hídricos ou efluentes. 70 6. Referências bibliográficas [1] SUD, D.; MAHAJAN, G.; KAUR; M.P. Agricultural waste material as potential adsorbent for sequestering heavy metal ions from aqueous solutions-A review. Bioresource Technology, v.99, n.14, p.6017-6027, 2008. [2] GURGEL, L.V.A.; de FREITAS, R.P.; GIL, L.F. Adsorption of Cu(II), Cd(II), and Pb(II) from aqueous single metal solutions by sugarcane bagasse and mercerized sugarcane bagasse chemically modified with succinic anhydride. Carbohydrate Polymers, v.74, n.4, p. 922-929,2008. [3] KARNITZ, O.; GURGEL, L.V.A.; de FREITAS, R.P.; GIL, L.F. Adsorption of Cu(II), Cd(II), and Pb(II) from aqueous single metal solutions by mercerized cellulose and mercerized sugarcane bagasse chemically modified with EDTA dianhydride (EDTAD). Carbohydrate Polymers, v.77, n.3, p.643-650, 2009. [4] CARASCHI, J.C.; FILHO, S.P.C.; CURVELO, A.A.S. Preparação e caracterização de polpas para dissolução obtidas a partir de bagaço de cana-de-açúcar. Polímeros Ciência e Tecnologia, v.6, n.3, p.24-29, 1996. [5] YU, J. X.; TONG, M.; SUN, X.M.; LI, B.H. Enhanced and selective adsorption of Pb2+ and Cu2+ by EDTAD-modified biomass of baker's yeast. Bioresource Technology, v.99, n.7, p.2588-2593, 2008. [6] PEREIRA, F.V.; GURGEL, L.V.A.; de AQUINO, S.F.; GIL, L.F. Removal of Zn2+ from Electroplating Wastewater Using Modified Wood Sawdust and Sugarcane Bagasse. Journal of Environmental Engineering-Asce, v.135, n.5, 341-350, 2009. [7] GURGEL, L.V.A.; JUNIOR, O.K.; GIL, R.P.D.F.; GIL, L.F. Adsorption of Cu(II), Cd(II), and Pb(II) from aqueous single metal solutions by cellulose and mercerized cellulose chemically modified with succinic anhydride. Bioresource Technology, v.99, n.8, p.3077-3083, 2008. [8] AJAMAL, M.; KHAN, A.H.; AHMAD, S.; AHMAD, A. Role of sawdust in the removal of copper(II) from industrial wastes. Water Research, v.32, n.10, p.3085-3091, 1998. [9] NAIYA, T.K.; CHOWDHURY, P.; BHATTACHARYA, A.K.; DAS, S.K. Saw dust and neem bark as low-cost natural biosorbent for adsorptive removal of Zn(II) and 71 Cd(II) ions from aqueous solutions. Chemical Engineering Journal, v.148, n.1, p.68-79, 2009. [10] GARG, U.; KAUR, M.P.; JAWA, G.K. SUD, D.; GARG, V.K. Removal of cadmium (II) from aqueous solutions by adsorption on agricultural waste biomass. Journal of hazardous materials, v.154, n.1-3, p.149–1157, 2008. [11] SRIVASTAVA, V.C.; MALL, I.D.; MISHRA, I.M. Equilibrium modelling of single and binary adsorption of cadmium and nickel onto bagasse fly ash. Chemical Engineering Journal, v.117, n.1, p.79-91, 2006. [12] LIU, C.F.; SUN, R.C.; ZHANG, A.P.; REN, J.L.; WANG, X.A.; QIN, M.H.; CHAO, Z.N.; LUO, W. Homogeneous modification of sugarcane bagasse cellulose with succinic anhydride using a ionic liquid as reaction medium. Carbohydrate Research, v.342, n.7, p.919-926, 2007. [13] XIAO, B.; SUN, X.F.; SUN, R.C. The chemical modification of lignins with succinic anhydride in aqueous systems. Polymer Degradation and Stability, v.71,n.2, p.223-231, 2001. [14] KARNITZ, O.; GURGEL, L.V.A.; MELO, J.C.P., BOTARO, V.R., MELO, T.M.S., GIL, R P.D.F.; GIL, L.F. Adsorption of heavy metal ion from aqueous single metal solution by chemically modified sugarcane bagasse. Bioresource Technology, v.98, n.6, p.1291-1297, 2007. [15] MCKEOWN, N.B.; BUDD, P.M. Polymers of intrinsic microporosity (PIMs): organic materials for membrane separations, heterogeneous catalysis and hydrogen storage. Chemical Society Reviews, v.35, p.675–683, 2006. [16] LEE, J.Y.; FARHA,O.K.; ROBERTS, J.; SHEIDT, K.A.; NGUYEN, S.T.; HUPP, J.T. Metal–organic framework materials as catalysts. Chemical Society Reviews, v.38, p.1450-1459, 2009. [17] INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA (IBGE), Pesquisa Nacional de Saneamento Básico de 2008, Rio de Janeiro, 2010, Disponível em: <http://www.ibge.gov.br/home/estatistica/populacao/condicaodevida/pnsb2008/PNSB_200 8.pdf>, Acesso em: Janeiro de 2013. [18] OLIVEIRA, M.R. Investigação da contaminação por metais pesados da água e do sedimento de corrente nas margens do rio São Francisco e tributários, a jusante da represa 72 da CEMIG, no município de Três Marias, Minas Gerais. Tese de Doutorado. Instituto de Geociências, Universidade Federal de Minas Gerais, Belo Horizonte, 2007. [19] GÜNTHER, W. M. R. Contaminação ambiental por disposição inadequada de resíduos industriais contendo metais pesados: estudo de caso. Tese de Doutorado. Faculdade de Saúde Pública da Universidade de São Paulo, São Paulo, 1998. [20] COMPANHIA DE TECNOLOGIA DE SANEAMENTO AMBIENTAL (CETESB), Brasil, Área contaminadas em, São Paulo, Dezembro de 2011, Disponível em: <http://www.cetesb.sp.gov.br/userfiles/file/areas-contaminadas/2011/textoexplicativo.pdf>, Acesso em: Janeiro de 2013. [21] GURGEL, L.V.A.; DE MELO, J.C.P.; DE LENA, J.C.; GIL, L.F. Adsorption of chromium (VI) ion from aqueous solution by succinylated mercerized cellulose functionalized with quaternary ammonium groups. Bioresource Technology, v.100 ,n.13, p.3214-3220, 2009. [22] PAPP, J.F. Chromium: Industrial Minerals and Rocks, 6th Edition, Colorado Society of Mining, Metallurgy, and Exploration, Inc. Littleton, 1994. [23] JORDÃO C.P.; DA SILVA, A.C.; PEREIRA, J.L.; BRUNE, W. Contaminação por cromo de águas de rios provenientes de curtumes em Minas Gerais. Química Nova, v.22, n.47, 1999. [24] GUERTIN, J.; JACOBS J.A.; AVAKIAN, C.P. Chromium (VI) Handbook. First Edition, EUA, CRC Press, 2004, p. 6–20. [25] RICHARD, F.C.; BOURG, A.C.M. Aqueous Geochemistry of Chromium. Water Research, v.25, n.7, p.807-816, 1991. [26] KLARKSON, P.M. Effects of exercise on chromium levels. Is supplementation required, Sports Medicine, v.23, n.6, p.341-349, 1997. [27] BARUTHIO, F. Toxic effects of chromium and its compounds, Biological Trace Element Research, v.32, n.1-3, p.145-153, 1992. [28] KATZL, S.A.; SALEM, H. The toxicology of chromium with respect to its chemical speciation: A review, Journal of Applied Toxicology, v.13, n.3, p.217–224, 1993. [29] ALMEIDA, R.M.; FAJARDO, H.V.; MEZALIRA, D.Z.; NUERNBERG, G.B.; NODA, L.K.; PROBST, L.F.D.; CARREÑO, N.L.V. Preparation and evaluation of porous 73 nickelalumina spheres as catalyst in the production of hydrogen from decomposition of methane. Journal of Molecular Catalysis A, v.259, n.1-3, p.328-335, 2006. [30] HUANG, J.; REMPEL, G.L. Ziegler-Natta catalysts for olefin polymerization: Mechanistic insights from metallocene systems. Progress in Polymer Science, v.20, n.3, p.459-526, 1995. [31] ROBLES-DUTENHEFNER, P.A.; BRANDÃO, B.B.N.; SOUSA, L.F.; GUSEVSKAYA, E.V. Solvent-free chromium catalyzed aerobic oxidation of biomassbased alkenes as a route to valuable fragrance compounds. Applied Catalysis A: General, v.47, n.1-2 p.20-28, 2011. [32] ROBLES-DUTENHEFNER, P.A.; ROCHA, K.A.S.; SOUZA, E.M.B.; GUSEVSKAYA, E.V. Cobalt-catalyzed oxidation of terpenes: Co-MCM-41 as an efficient shape-selective heterogeneous catalyst for aerobic oxidation of isolongifolene under solvent-free conditions. Journal of Catalysis, v.265, n.1, p.72-79, 2009. [33] DA SILVA, K.A.; ROBLES-DUTENHEFNER, P.A.; SOUSA, E.M.B.; KOZHEVNIKOVA, E.F.; KOZHEVNIKOV, I.V.; GUSEVSKAYA, E.V. Cyclization of (+)-citronellal to (−)-isopulegol catalyzed by H3PW12O40/SiO2. Catalysis Communications, v.5, n.8, p.25–429, 2004. [34] ERTL, G.; KNOZINGER, H.; SCHUTH, F.; WEITKAMP, J. Handbook of Heterogeneous Catalysis, Second edition, EUA, Wiley, 1997, p5-9. [35] HOLDERICH, W.F.; BARSNICK, B.; SHELDON, S.A.; BEKKUM H. Fine Chemicals through Heterogeneous Catalysis, First Edition, Weinheim, Wiley-VCH, 2001. [36] ORO, L.A.; SOLA, E. Fundamentos y Aplicaciones de la Catálisis Homogénea, Ed.1, Zaragoza; 2000, p.208. [37] CHAPUIS, C.; JACOBY, D. Catalysis in the preparation of fragrances and flavours. Applied Catalysis A: General, v.221, n.1-2, p. 93-117, 2001. [38] TROST, B.M. Atom Economy—A Challenge for Organic Synthesis: Homogeneous Catalysis Leads the Way, Angewandte Chemie International Edition in English, v.34, n.3, p. 259-281, 1995. [39] WONGTSCHOWSKI, P. Indústria Química: Risco e Oportunidades. 2a ed., São Paulo, Edgard Blucher, 2002, p.12-20. 74 [40] SPEZIALLI, M.G. De aromas e perfumes, o mercado da indústria do "cheiro". Química nova, v.35, nº.4, 2012. [41] MINISTÉRIO DO DESENVOLVIMENTO, INDUSTRIA E COMÉRCIO EXTERIOR, EXPLANADA DOS MINISTERIOS, BRASÍLIA/DF, Disponível em: <http://aliceweb.desenvolvimento.gov.br/> acesso em Janeiro de 2013. [42] ERMAN, W.E. Chemistry of the Monoterpenes: An Encyclopedic Handbook, First Edition, New York, Marcel Dekker Inc, 1985. [43] SELL, C.; BASER, K.H.C.; BUCJBAUER, G. Handbook of essential oils: science, technology, and applications, First Edition, London, CRC Press, 2010. [44] EXPORTAÇÕES BRASILEIRAS DO COMPLEXO CITRÍCOLA, Disponível em: <http://www.citrusbr.com/exportadores-citricos/setor/exportacoes-brasileiras-docomplexo-citricola-193132-1.asp > Acesso em: janeiro de 2013. [45] Lawrence, B.M. A planning scheme to evaluate new aromatic plants for the flavor and fragrance industries, First Edition, New York. 1993, Wiley, p.620-627. [46] RESINA DE PINUS NO SUL DO BRASIL: CARACTERIZAÇÃO E PERSPECTIVAS,REVISTA DA MADEIRA DE 2008, Disponível em: <http://www.remade.com.br/br/revistadamadeira_materia.php?num=1317&subject=Resina %20Pinus&title=Resina%20de%20Pinus%20no%20Sul%20do%20Brasil> Acesso em: Janeiro de 2013. [47] SKOOG, D.; HOLLER, J.; NIEMAN, T. Princípios de Análise Instrumental, 5ª edição, Brasil, Bookman, 2002. [48] SKOOG, D.; WEST, D.; HOLLER, J.; CROUCH, S. Fundamentos de Química Analítica, 8ª edição, Brasil, Thomson, 2005. [49] BRUNAUER, S.; EMMET, T.H.; TELLER, F., Adsorption of gases in multimolecular layers. American Chemistry Society, v. 60, n. 2, p. 309-319, 1938. [50] BARRET, E.P.; Joyner, L.G.; Halenda, P.P.; The determination of pore volume and area distributions in porous substances. I. Computations from nitrogen isotherms. Journal of American Chemical Society, v.73, n.1, p.373–380, 1951. [51] CHRISTIAN, G.; O’REILLY J.; Instrumental Analysis, Second edition, Singapura, Allyn and Baccon Inc, 1987. 75 [52] COLLINS, C.H.; BRAGA, G.L.; BONATO, P.S. Fundamentos de Cromatografia, 1ª edição, Brasil, Ed.Unicamp, 2006. [53] OUAJAI, S.; SHANKS, R.A. Composition, structure and thermal degradation of hemp cellulose after chemical treatments. Polymer Degradation and Stability, v.89, n.2, p.327-335, 2005. [54] BILBA, K.; OUENSANGA, A. Fourier transform infrared spectroscopic study of thermal degradation of sugar cane bagasse. Journal of Analytical and Applied Pyrolysis, v.38, p.61-73, 1996. [55] SALES, L.S.; ROBLES-DUTENHEFNER, P.A.; NUNES, D.L.; MOHALLEM, N.D.S.; GUSEVSKAYA, E.V.; SOUSA, E.M.B. Characterization and catalytic activity studies of sol-gel Co-SiO2 nanocomposites. Materials Characterization, v.50, n.2-3, p.9599, 2003. [56] SHELDON, R.A.; KOCHI, J.K. Metal-catalyzed oxidations of organic compounds: mechanistic principles and synthetic methodology including biochemical processes, First edition, London, Academic Press, 1981. 76 ANEXO I Resumos dos artigos submetidos até o momento. FUEL Steam reforming of ethanol for hydrogen production over Au, Pd and Au-Pd/SiO2 catalysts synthesized by sol-gel method Anderson G. M. da Silva1, Patricia A. Robles-Dutenhefner1, Anderson Dias1, Humberto V. Fajardo1, Adriana S. P. Lovón2, Juan J. Lovón-Quintana2, Gustavo P. Valença2 1 Departamento de Química – Universidade Federal de Ouro Preto, 35400-00, Ouro Preto – MG, Brasil. 2 Faculdade de Engenharia Química – Universidade Estadual de Campinas, 13083-970, Campinas – SP, Brasil. Abstract Noble-metal-based catalysts supported on silica (Au/SiO2, Pd/SiO2 and Au- Pd/SiO2) were prepared by the sol-gel method and were evaluated in the steam reforming of ethanol for hydrogen production. The catalysts were characterized by N2 physisorption (BET/BJH methods), X-ray diffraction, temperature programmed reduction analysis, H2 chemisorption, atomic absorption spectrophotometry and Raman spectroscopy. The structural characterization of the Au- and Pd-containing catalysts after calcination showed that the solids are predominantly formed by AuO, PdO and PdO species, respectively. It was observed that the metallic Pd dispersion is diminished in presence of AuO. However, it was not found any interaction between Au and Pd species or with the SiO2 support. The results revealed that the catalytic behavior could be influenced by the experimental conditions and the nature of the catalyst employed. The Pd/SiO2 catalyst showed the best performance among the catalysts tested, exhibiting complete ethanol conversion, hydrogen selectivity close to 63% and good stability at the highest reaction temperature (600°C). This may be related to the more effective action of the metallic active phase, which covers a greater area (higher metal surface dispersion) in this sample. At this same reaction temperature, the Au-Pd/SiO2 catalyst showed a significant deactivation due to the deposition of amorphous carbon species on the active phase of the catalyst, probably due to the lower Pd dispersion presented by this catalyst comparatively to Pd/SiO2. 77 GREEN CHEMISTRY A new use for modified sugarcane bagasse containing adsorbed Co2+ and Cr3+: catalytic oxidation of terpenes Anderson Gabriel Marques da Silva, Thenner Silva Rodrigues, Leandro Vinícius Alves Gurgel, Patrícia Aparecida de Assis, Laurent Frédéric Gil*, Patricia Alejandra RoblesDutenhefner* Departamento de Química, Instituto de Ciências Exatas e Biológicas, Universidade Federal de Ouro Preto, Campus Universitário Morro do Cruzeiro, 35400-000 Ouro Preto, Minas Gerais, Brazil Abstract This study describes the applicability of two chemically modified sugarcane bagasse containing either adsorbed Co2+ or Cr3+ ions as heterogeneous catalysis for the autooxidation of monoterpenes. The main objective was to investigate new uses for these adsorbent materials which had previously been employed for treatment of aqueous solutions or effluents containing metals such as Co2+ and Cr3+. The adsorption efficiency of Co2+ and Cr3+ on SCB2 and EB was evaluated by adsorption isotherms and other techniques such as XRD, ICP-OES and TGA. Catalytic activity of the four new catalysts, SCB2-Co, SCB2-Cr, EB-Co, and EBCr, were assessed in the oxidation reaction of -citronellol(1), (+)-limonene(2), and (-)-pinene(3) in a free solvent system. Results obtained demonstrated that these materials were promising catalysts for the oxidation of monoterpenes. Reactant conversion ranged from 49 to 78% as determined by GC analysis and a combined selectivity up to 59% for the oxidation products was achieved. 78 APPLIED CATALYSIS Air Stable Ligandless Heterogeneous Catalyst Systems Based on Pd and Au Supported in SiO2 and MCM-41 for Suzuki-Miyaura Cross-Coupling in Aqueous Medium Marcelo Gomes Spezialia, Anderson Gabriel Marques da Silvab, Débora Michelini Vaz de Mirandab, Adriano Lisboa Monteiroa, Patricia Alejandra Robles-Dutenhefnerb* a Instituto de Química, Universidade Federal do Rio Grande do Sul, Porto Alegre-RS, Brazil b Departamento de Química, Universidade Federal de Ouro Preto, Ouro Preto, MG, Brazil Abstract Palladium and palladium-gold containing siliceous-MCM-41 and sol-gel palladium and palladium-gold silica composites have been prepared. The catalytic performance of incorporated Pd/MCM-41, Au-Pd/MCM-41 and Pd and Au-Pd/SiO2 sol-gel catalysts for the Suzuki-Miyaura cross-coupling reaction was determined, and the influence of the matrix and the catalyst composition on the catalytic activity were also studied. The catalysts were characterized by N2 physisorption (BET/BJH methods), X-ray diffraction, temperature programmed reduction analysis, H2 chemisorption, atomic absorption spectrophotometry and Raman spectroscopy. The silica-containing palladium and palladium-gold catalysts prepared using the MCM-41 matrix showed greater catalytic activity than using the conventional sol-gel method; however, gold had a significant influence on this reaction. The catalyst did not undergo metal leaching and could be easily recovered and re-used. 79 PRODUÇÃO CIENTÍFICA ARTIGOS EM PERIÓDIOCOS 1- APPLIED CATALYSIS (SUBMETIDO) Marcelo Gomes Speziali, Anderson Gabriel Marques da Silva, Débora Michelini Vaz de Miranda, Adriano Lisboa Monteiro, Patricia Alejandra Robles-Dutenhefner. Air StableLigandless Heterogeneous Catalysts Systems Based on Pd and Au supported in SiO 2 and MCM-41 for Suzuki-Miyaura Cross Coupling in Aqueous Medium. 2- GREEN CHEMISTRY (SUBMETIDO) Anderson Gabriel Marques da Silva, Thenner Silva Rodrigues, Leandro Vinícius Alves Gurgel, Patrícia Aparecida de Assis, Laurent Frédéric Gil, Patricia Alejandra RoblesDutenhefner. A new use for modified sugarcane bagasse containing adsorbed Co2+ and Cr3+: catalytic oxidation of terpenes. 3- FUEL (SUBMETIDO) Anderson Gabriel Marques da Silva, Patrícia A. Robles-Dutenhefner, Anderson Dias, Humberto V. Fajardo, Adriana S. P. Lovón, Juan J. Lovón-Quintana, Gustavo P.Valença. Steam reforming of ethanol for hydrogen production over Au, Pd and Au-Pd/SiO2 catalysts synthesized by sol-gel method. TRABALHOS COMPLETOS PUBLICADOS EM ANAIS DE EVENTOS 16º Congresso Brasileiro de Catálise, 2011, Campos do Jordão Anderson Gabriel Marques da Silva, Thenner Silva Rodrigues, Gustavo Mapa de Souza, Karla Aparecida Guimarães Gusmão, Laurent Frèdèric Gil, Patricia Alejandra RoblesDutenhefner. Estudo da atividade catalítica de cobalto adsorvido em bagaço de cana succínilado na autoxidação do citronelol: uma aplicação para adsorventes. 80 Vinícius V. Costa, Kelly A. da Silva Rocha, Liniker Fabrício de Souza, Anderson Gabriel Marques da Silva, Patricia Alejandra Robles-Dutenhefner, Elena V. Gusevskaya. Isomerização do óxido de α-pineno utilizando catalisadores de cério e estanho: síntese seletiva do trans-carveol e trans-sobrerol. RESUMOS EXPANDIDOS PUBLICADOS EM ANAIS DE EVENTOS 15th International Congress on Catalysis 2012, Munique 1- Anderson Gabriel Marques da Silva, Thenner Silva Rodrigues, Laurent Frèdèric Gil, Patricia Alejandra Robles-Dutenhefner. Catalytic activity of Co and Cr adsorbed on succinylated sugarcane bagasse in the autoxidation of citronellol: an application of used adsorbents. 2- Anderson Gabriel Marques da Silva, Débora Micheline Vaz de Miranda, Marcelo Gomes Spezialli, Adriano Lisboa Monteiro, Anderson Dias, Patricia Alejandra Robles-Dutenhefner. Synthesis and characterization of catalysts Pd/sol-gel Pd/MCM-41 applied in Suzuki coupling reactions. IX Encontro Norte, Nordeste e Centro-Oeste de Catálise, 2012, Maceió 1-Anderson Gabriel Marques da Silva, Débora Micheline Vaz de Miranda, Patricia Alejandra Robles-Dutenhefner. Características texturais e estruturais de matrizes de sílica dopadas com cério obtidas por duas rotas de preparo: oxidação catalítica do cicloexano. 2-Anderson Gabriel Marques da Silva, Débora Micheline Vaz de Miranda , Patricia Alejandra Robles-Dutenhefner. Preparo e caracterização de catalisadores de ouro suportado em sílica obtidos por duas rotas de preparo: oxidação seletiva do álcool benzílico. 81 RESUMOS PUBLICADOS EM ANAIS DE EVENTOS XXVI Encontro Regional da Sociedade Brasileira de Química, 2012, Ouro Preto 1- Anderson Gabriel Marques da Silva, Débora Micheline Vaz de Miranda, Patricia Alejandra Robles-Dutenhefner. Reações de Acoplamento Suzuki: Atividade catalítica de catalisadores heterogêneos à base de ouro e paládio. 2- Anderson Gabriel Marques da Silva, Débora Micheline Vaz de Miranda, Patricia Alejandra Robles-Dutenhefner. Preparo e caracterização dos catalisadores dopados com o metal Cério obtidos via processo sol-gel e via MCM-41: avaliação catalítica em reações de oxidação do cicloexano. XX Seminário de Iniciação Científica da UFOP, 2012, Ouro Preto Anderson Gabriel Marques da Silva, Débora Micheline Vaz de Miranda, Patricia Alejandra Robles-Dutenhefner, Reações de acoplamento Suzuki: Atividade catalítica de catalisadores heterogêneos à base de paládio. XIX Seminário de Iniciação Científica da UFOP, 2011, Ouro Preto Débora Micheline Vaz de Miranda, Anderson Gabriel Marques da Silva, Marcelo Gomes Speziali ; Adriano Lisboa Monteiro, Patricia Alejandra Robles-Dutenhefner . Influência da presença do metal ouro nas reações de acoplamento Suzuki: avaliação catalítica de Pd/SiO2 e Au-Pd/SiO2. XXV Encontro Regional da Sociedade Brasileira de Química, 2011, Lavras Débora Micheline Vaz de Miranda, Anderson Gabriel Marques da Silva, Marcelo Gomes Speziali, Adriano Lisboa Monteiro, Patricia Alejandra Robles-Dutenhefner. Preparo e caracterização de Pd/SiO2 e Au-Pd/SiO2 obtidos via processo sol-gel: Avaliação catalítica frente a reações de acoplamento Suzuki. 82 PATENTE DEPOSITADA Patricia Alejandra Robles-Dutenhefner, Anderson Gabriel Marques da Silva, Thenner Silva Rodrigues. Obtenção dos óxidos de bisabolol pela oxidação catalítica do alfa-bisabolol utilizando óxidos metálicos sólidos, INPI 221105495250. 2011. 2011. PRÊMIOS E TÍTULOS 2012- PRÊMIO MELHOR TRABALHO, na modalidade ORAL da área de CIÊNCIAS EXATAS E DA TERRA - XIX Seminários de Iniciação Científica da UFOP, Universidade Federal de Ouro Preto. 2012- Idea to Product Latin America, Centro de Empreendedorismo e Novos Negócios da Fundação Getulio Vargas (FGV). 2012-Grupo Boticário Challenge Winner - Idea to Product Latin America, Centro de Empreendedorismo e Novos Negócios da Fundação Getulio Vargas (FGV). 2012-Best Outstanding Presentation - Idea to Product Latin America, Centro de Empreendedorismo e Novos Negócios da Fundação Getulio Vargas (FGV). 2011- Prêmio Santander de Empreendedorismo - Categoria Biotecnologia e Saúde. 83
Download