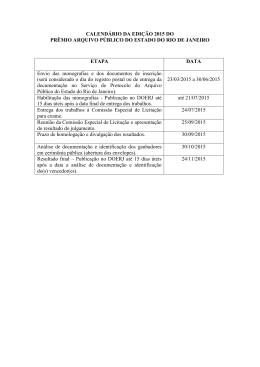
PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA Projeto Básico Revisão das Monografias da Farmacopéia Brasileira Diretoria Maria Cecília Martins Brito - DIMCB Brasília, 09 de novembro de 2007 LSD 1 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA Diretor-Presidente Dirceu Raposo de Mello Adjunto de Diretor-Presidente Norberto Rech Diretores Cláudio Maierovitch Peçanha Henriques Maria Cecília Martins Brito José Agenor Álvares da Silva Chefe de Gabinete Alúdima de Fátima Oliveira Mendes Área técnica Farmacopéia Brasileira Diretoria Maria Cecília Martins Brito Elaboração: Jaimara Azevedo Oliveira Especialista em Regulação e Vigilância Sanitária Lais Santana Dantas Assessora DIMCB/Especialista em Regulação e Vigilância Sanitária Luiz Armando Erthal Adjunto de Diretor Nélio de Bastos Morais Assessor DIMCB/Especialista em Regulação e Vigilância Sanitária Colaboradores: Comissão Permanente de Revisão da Farmacopéia Brasileira - CPRFB LSD 2 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA I. INTRODUÇÃO O desenvolvimento científico e tecnológico, como diretriz da Política Nacional de Medicamentos (Portaria/MS n°. 39l6/88), ressalta a importância de o país dispor de instrumento estratégico para a divulgação dos avanços científicos que estabeleça requisitos de qualidade para as matérias-primas e especialidades farmacêuticas, e remete ao Ministério da Saúde a promoção do processo de revisão permanente da Farmacopéia Brasileira – F. Bras. A Lei Nº. 9782/99, que cria a Agência Nacional de Vigilância Sanitária – ANVISA dispõe em seu artigo 7º, inciso XIX, sua competência para "promover a revisão e atualização periódica da farmacopéia". A fim de atender a atribuições legais e regimentares, a ANVISA vem desenvolvendo trabalhos com a Comissão Permanente de Revisão da Farmacopéia Brasileira – CPRFB, em parceria com instituições de ensino e pesquisa, no sentido de fortalecer a F. Bras, instrumento considerado de importância nacional. É competência da CPRFB, conforme descrito em seu Regimento (RDC nº. 97/2005), elaborar e publicar as edições da F. Bras, mantendo-a atualizada mediante publicação periódica, estabelecer seus prazos de vigência e sistemática de apresentação, revisar, atualizar, inserir, substituir ou anular monografias e textos dessas edições e harmonizar os trabalhos da F. Bras com as principais farmacopéias internacionais, em conformidade com a Organização Mundial da Saúde – OMS, International Conference Harmonization – ICH, práticas internacionais de instituições similares e Guias da Farmacopéia Brasileira com suas atualizações. Além das competências regimentais citadas, a Portaria/ANVISA nº. 144, de 1º de março de 2007 nomeou a CPRFB para, dentre outras atribuições, participar do processo de transferência da gestão administrativa das atividades inerentes à Farmacopéia Brasileira para a Sede da ANVISA, em Brasília/DF e propor, juntamente com o Grupo de Trabalho instituído pela ANVISA, novo Regimento Interno da Comissão Permanente de Revisão da Farmacopéia Brasileira. LSD 3 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA II. REFERÊNCIA GERAL O elemento norteador principal deste Projeto é que as ações e atividades propostas ofereçam diretrizes condizentes com os diplomas técnico-científicos e legais existentes para a revisão de MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA. III. ABRANGÊNCIA O que se pretende é promover a revisão de monografias constantes nas quatro edições da Farmacopéia Brasileira e de novas monografias em fase de conclusão, para consolidar em compêndio único, uma edição da F. Brás atualizada. A pesquisa a ser desenvolvida envolve critérios que serão definidos durante a execução do projeto, sendo possível não abranger todas as monografias necessárias à revisão completa da F. Bras. IV. PROPÓSITO Proporcionar aos profissionais da área farmacêutica monografias revisadas e atualizadas das matérias-primas, especialidades farmacêuticas, de forma prática, ágil e sem equívocos. Contribuir para o desenvolvimento da pesquisa nas universidades brasileiras e outros centros de pesquisa, de modo a ampliar a capacitação e a qualificação de profissionais para atuação na área pertinente a farmacopéia. V. JUSTIFICATIVA O papel de uma farmacopéia é estabelecer as especificações de qualidade dos produtos Farmacêuticos, como potência, pureza e outros, desde os insumos farmacêuticos utilizados na fabricação de todos os medicamentos até sua embalagem final. As especificações farmacopéicas estabelecem os requisitos mínimos para o controle de qualidade dos insumos e das especialidades farmacêuticas produzidas ou usadas em nosso País, bem como regulam as relações com o comércio exterior (importação e exportação), servindo ainda como LSD 4 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA parâmetro para as ações da vigilância sanitária incluindo o registro de medicamentos, fiscalização e análise fiscal, dentre outras. A 1ª Edição da Farmacopéia Brasileira foi publicada em 1926, a 2ª Edição - Farmacopéia dos Estados Unidos do Brasil em 1959, a 3ª Edição em 1976; a Parte I da 4ª Edição em 1988, e a Parte II em fascículos do 1° ao 6°, respectivamente em 1996, 2000, 2001, 2002, 2003 e 2005. O sexto fascículo da quarta edição da Farmacopéia Brasileira marcou o fim do trabalho da 4ª edição iniciada em 1988. As monografias publicadas nas edições da F. Bras estão em vigor, carecendo de revisão e atualização para que, em um único compêndio, se apresente de forma ao uso prático e ágil de seus produtos, eliminando inclusive monografias obsoletas. Vê-se a importância de consolidar as versões das edições da F. Bras, com a inclusão de novas monografias resultantes dos últimos estudos desenvolvidos, ainda não publicadas e revisão das monografias constantes nas edições anteriores. Para tanto se ressalta a necessidade de dispor de laboratórios qualificados para a execução de trabalhos de revisão da F. Bras, baseados na colaboração das universidades, centros colaboradores de excelência, com histórica participação nos trabalhos desenvolvidos pela F. Bras. Este projeto contempla os trabalhos de revisão e atualização das edições da Farmacopéia Brasileira em sintonia com as diretrizes estabelecidas pela CPRFB. Os produtos deste trabalho irão compor a próxima Edição da Farmacopéia Brasileira. VI. OBJETIVOS 1. Objetivo Geral Subsidiar a ANVISA e a CPRFB na elaboração, revisão e atualização de monografias para a edição de uma Farmacopéia Brasileira consolidada, por meio de Contratação através do procedimento de Credenciamento, de institutos de ensino e pesquisa de ciências farmacêuticas, quais sejam de direito público ou privado. Em se tratando de instituições oficiais de ensino superior o credenciamento/contratação poderá recair sobre suas fundações de apoio, na forma da lei. LSD 5 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA 2. Objetivos Específicos 9 Promover a revisão e atualização de monografias constantes nas quatro Edições da F. Bras; 9 Promover a revisão e atualização de monografias já elaboradas e não publicadas nas edições anteriores. VII. METODOLOGIA As atividades para a revisão das edições da F. Bras se desenvolverão nas Fases A e B. A Fase A corresponde à revisão bibliográfica das monografias farmacopéicas enquanto que a Fase B corresponde à avaliação laboratorial (validação e certificação interlaboratorial). A Fase B inicia-se a partir da conclusão da Fase A. Para cada fase do trabalho serão definidos pela CPRFB Blocos de Estudos a serem realizados pelas instituições credenciadas, sendo denominados Bloco de Estudos A e Bloco de Estudos B, referentes às fases A e B, respectivamente. Os trabalhos serão realizados sob a supervisão da CPRFB, em conformidade com as diretrizes da OMS, ICH, demais farmacopéias legalmente reconhecidas pela ANVISA e Guias da F. Bras, de acordo com o produto a ser elaborado, conforme descrito a seguir. FASE A 1. Apresentação de Plano de Trabalho Inicial, conforme Bloco de Estudos A, para avaliação e aprovação pela CPRFB; 2. Levantamento bibliográfico sobre todas as matérias-primas, especialidades farmacêuticas contidas nas edições da F. Bras e das monografias resultantes dos últimos estudos desenvolvidos ainda não publicadas; 3. Compatibilização das monografias da Farmacopéia Brasileira com as Denominações Comuns Brasileiras (DCB) e na ausência desta pela Denominação Comum Internacional (DCI), quando aplicável; 4. Avaliação da necessidade de testes laboratoriais para a revisão das monografias; 5. Elaboração de relatório relativo aos estudos da Fase A – Relatório da Revisão Bibliográfica de monografias constantes nas edições da F. Bras.; LSD 6 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA 6. Elaboração de tabela simplificada do resultado da revisão bibliográfica, citando para cada monografia, edição (ões) da F. Bras e respectiva (s) página (s), DCB/DCI quando aplicável, condição sugerida (manutenção, exclusão, alteração no texto e/ou avaliação laboratorial); Compete a CPRFB/ANVISA na FASE A • Avaliação e aprovação dos estudos preliminares decorrentes do levantamento bibliográfico após a entrega do Relatório da Revisão Bibliográfica de monografias constantes nas edições da F. Bras. • Identificação das monografias que serão submetidas á avaliação em laboratórios, compreendida pela validação metodológica e certificação interlaboratorial. • Priorização dos estudos que serão desenvolvidos na Fase B e definição do Bloco de Estudos B. FASE B 1. Apresentação de Plano de Trabalho da Avaliação Laboratorial, conforme Bloco de Estudos B, para avaliação e aprovação pela CPRFB; 2. Aquisição das matérias-primas ou medicamentos; 3. Pesquisa, desenvolvimento e validação de métodos e técnicas a serem utilizadas; 4. Avaliação interlaboratorial/certificação das monografias propostos, de acordo com as diretrizes nacionais e internacionais; 5. Elaboração de relatório contendo as minutas de monografias para avaliação da CPRFB/ANVISA e posterior submissão à Consulta Pública; 6. Reavaliação das monografias de acordo com as contribuições procedentes do Fórum Farmacopéico e orientações da CPRFB/ANVISA (retornar aos itens pertinentes, quando necessário); 7. Elaboração de tabela simplificada do resultado dos estudos, citando cada monografia, edição (ões) da F. Bras e respectiva (s) página (s), DCB/DCI, condição sugerida (manutenção, exclusão, alteração, inclusão); 8. Elaboração de relatório final, dossiê de cada estudo e minuta final de monografias para aprovação pela CPRFB e providências de publicação. Compete a CPRFB/ANVISA na FASE B • LSD Avaliação da minuta de monografia e posterior submissão à Consulta Pública; 7 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA • Divulgação, no site da ANVISA, das monografias em forma de CP no Fórum Farmacopéico; • Avaliação das contribuições do Fórum Farmacopéico. As monografias revisadas deverão ser submetidas à CPRFB e em CP no Fórum farmacopéico, inclusive as que os estudos sugerem exclusão, não alteração, ou outras situações. O resultado das avaliações dos produtos pela CPRFB será registrado em atas de reuniões, definindo a continuidade do desenvolvimento do projeto. Toda documentação entregue deverá estar identificada e assinada pelo coordenador do projeto, e pelo profissional responsável pela pesquisa. Toda a documentação relativa aos resultados esperados será arquivada na ANVISA e as demais permanecerão sob a responsabilidade do executor do estudo por um período mínimo de 5 (cinco) anos. Os produtos deverão ser entregues por meio eletrônico e físico. Avaliação Laboratorial Cada centro realizará estudos laboratoriais dos produtos, objeto do contrato, por ele desenvolvidos, somados às análises de certificação provenientes de outros centros colaboradores, na proporção de 1 para 2, isto é, para cada validação realizada o centro se comprometerá a executar duas certificações. Para os estudos laboratoriais de revisão de matérias-primas devem ser utilizadas matériasprimas provenientes de dois fabricantes diferentes, para os estudos de especialidades farmacêuticas devem medicamentos de três fabricantes distintos (um para medicamento de referencia, outro para genérico e outro para similar, quando houver). Para a revisão laboratorial de plantas, quando possível, deve ser adotado critério semelhante, estudos de plantas coletadas de diferentes regiões brasileiras. Para cada revisão de monografia, o contratado assumirá, quando for o caso, o compromisso de: • Encaminhar amostras, para a certificação de seus estudos, a outros dois centros credenciados, conforme determinado pela CPRFB/ANVISA. • Proceder à certificação interlaboratorial de outros dois estudos que lhe serão submetidos por outra instituição, conforme determinado pela CPRFB/ANVISA. LSD 8 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA Validação Demonstra que o método é apropriado para a finalidade pretendida, devendo garantir, por meio de estudos experimentais, que o método atenda às exigências das aplicações analíticas, assegurando a segurança, impessoalidade, credibilidade e a confiabilidade dos estudos contratados. Para tanto, deve apresentar especificidade, linearidade, intervalo, precisão, sensibilidade, limite de quantificação e exatidão adequadas aos estudos, conforme o caso. Certificação Interlaboratorial Demonstra a reprodutibilidade da metodologia desenvolvida pelos diferentes laboratórios. A certificação interlaboratorial de monografias para a F. Brás., de acordo com as diretrizes nacionais e internacionais, requer que cada estudo laboratorial seja reavaliado por mais dois centros. VIII. RESULTADOS ESPERADOS Revisão das monografias para publicação pela ANVISA em um compêndio único da F. Bras. Todas as monografias serão submetidas à Fase A, e aquelas que necessitem de avaliação laboratorial para a revisão deverão ser submetidas à Fase B. O projeto será viabilizado pelo credenciamento de instituições devidamente qualificadas para pesquisa, desenvolvimento, validação e certificação de estudos de revisão das monografias das edições da Farmacopéia Brasileira, inclusive, produtos já elaborados e não publicados. Neste projeto estima-se a realização da Fase A para todas as monografias existentes nas edições da F. Bras. e a realização da Fase B para aproximadamente 500 estudos de revisão de monografias. FASE A • Plano de Trabalho Inicial, conforme Bloco de Estudos A, para avaliação e aprovação pela CPRFB; LSD 9 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA • Relatório da Revisão Bibliográfica (relativo à Fase A) para cada uma das monografias pactuadas, identificando necessidade de avaliação laboratorial, para encaminhamento a CPRFB. FASE B • Plano de Trabalho da Avaliação Laboratorial, conforme Bloco de Estudos B, para avaliação e aprovação pela CPRFB; • Relatório contendo as minutas de monografias dos estudos laboratoriais, para avaliação da CPRFB/ANVISA e posterior submissão à Consulta Pública; • Dossiê individual, por monografia, do estudo realizado; • Tabela simplificada do resultado dos estudos, citando cada monografia, edição (ões) da F. Bras e respectiva (s) página (s), DCB/DCI, condição sugerida (manutenção, exclusão, alteração, inclusão); • Relatório final contendo as minutas finais de monografias dos estudos laboratoriais, após avaliação das considerações da Consulta Pública, para avaliação da CPRFB/ANVISA e providências de publicação; IX. HABILITAÇÃO Para a habilitação das instituições serão exigidas documentações referentes à: (i) habilitação jurídica, (ii) qualificação econômico-financeira, (iii) regularidade fiscal e (iv) qualificação técnica, (v) cumprimento do disposto no Inciso XXXIII do Art. 7º da Constituição Federal. Poderão se habilitar neste Projeto, as instituições brasileiras de pesquisa, ensino e extensão em ciências farmacêuticas, dotada de curso de pós-graduação na área de farmácia reconhecido pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – CAPES/Ministério da Educação e/ou que tenham participado na elaboração, revisão ou certificação de estudos para a 4ª Edição da Farmacopéia Brasileira. I. Habilitação Jurídica Para habilitação jurídica deverão ser apresentados os seguintes documentos: (i) cédula de identidade e CPF do responsável pela instituição credenciada; (ii) ato constitutivo, estatuto ou contrato social em vigor, devidamente registrado, em se tratando de sociedades comerciais, e, no LSD 10 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA caso de sociedades por ações, acompanhado de documentos de eleição de seus administradores; (iii) inscrição do ato constitutivo, no caso de sociedades civis, acompanhada de prova de diretoria em exercício. II. Qualificação Econômico-Financeira Para comprovação da qualificação econômico-financeira a instituição deverá apresentar certidão negativa de falência, expedida no domicílio da licitante, dentro de seu período de validade, na data da apresentação de sua proposta de credenciamento. Na hipótese de não constar prazo de validade na certidão apresentada, considerar-se-á válida até 60 (sessenta) dias após a data de sua emissão. Deverá apresentar ainda o balanço patrimonial e demonstrações contábeis do último exercício social (ano 2006), já exigíveis e apresentados na forma da lei, que comprovem a boa situação financeira da instituição, vedada a sua substituição por balancetes ou balanços provisórios, podendo ser atualizados, quando encerrados há mais de 3 (três) meses da data de apresentação da proposta, tomando-se por base quaisquer dos índices oficiais divulgados. A boa situação financeira da licitante será avaliada pelos Índices de Liquidez Geral (LG), Solvência Geral (SG) e Liquidez Corrente (LC), maiores que 1 (um), resultantes da aplicação das fórmulas abaixo, com os valores extraídos de seu balanço patrimonial ou apurados mediante consulta on-line no caso de instituição inscrita no SICAF: LG = ATIVO CIRCULANTE + REALIZÁVEL A LONGO PRAZO PASSIVO CIRCULANTE + EXIGÍVEL A LONGO PRAZO SG = ATIVO TOTAL_____________________ PASSIVO CIRCULANTE + EXIGÍVEL A LONGO PRAZO LC= ATIVO CIRCULANTE PASSIVO CIRCULANTE LSD 11 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA A instituição que apresentar índice econômico igual ou inferior a 1 (um) em qualquer dos índices de Liquidez Geral, Solvência Geral e Liquidez Corrente, deverá comprovar que possui Patrimônio Líquido ou Capital Social mínimo de R$ 50.000,00 (cinqüenta mil reais), em conformidade com o § 3º do art. 31 da Lei nº 8.666/93, demonstrado por meio de apresentação do Balanço Patrimonial e demonstrações contábeis do último exercício social, já exigíveis e apresentados na forma da lei. As fórmulas adotadas deverão estar devidamente aplicadas em memorial de cálculos juntado ao balanço, e os valores dos índices serão calculados com 02 (duas) casas decimais e com arredondamento simples; Se necessária a atualização do balanço, deverá ser apresentado, juntamente com os documentos em apreço, o memorial de cálculo correspondente. III. Regularidade Fiscal Para comprovação de regularidade fiscal deverão ser apresentados: (i) prova de inscrição no Cadastro Nacional de Pessoa Jurídica (CNPJ); (ii) prova de inscrição no cadastro de contribuintes estadual ou municipal, se houver relativo ao domicílio ou sede, pertinente ao seu ramo de atividade e compatível com o objeto contratual; (iii) prova de regularidade para com a Fazenda Federal, Estadual e Municipal do domicílio ou sede, ou outra equivalente, na forma da lei; (iv) prova de regularidade relativa à Seguridade Social e ao Fundo de Garantia por Tempo de Serviço (FGTS), demonstrando situação regular no cumprimento dos encargos sociais instituídos por lei. IV. Qualificação Técnica Da Instituição de Ensino Superior Para qualificação técnica as instituições deverão apresentar: (i) Estatuto/Regimento com comprovação de que se trata de instituição brasileira incumbida regimental ou estatutariamente de pesquisa, ensino e extensão em ciências farmacêuticas, (ii) comprovação de existência de curso de pós-graduação na área de farmácia, devidamente reconhecido pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – CAPES/Ministério da Educação e/ou LSD 12 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA comprovação de participação na elaboração, revisão ou certificação de estudos para a 4ª Edição da Farmacopéia Brasileira. Obs.: A participação nos estudos da F. Bras. poderá ser da instituição e/ou de profissionais que constituem seu corpo de pesquisadores. A comprovação de participação em trabalhos da F. Bras. poderá ser feita com declaração fornecida pela CPRFB, ou ainda mediante cópia de página da 4ª Edição da F. Bras., constando o nome do centro colaborador. Deverá possuir laboratório analítico devidamente equipado para o desenvolvimento dos estudos objeto deste projeto, no que couber, além de um sistema de qualidade implementado. Para qualificação técnica dos laboratórios deverão ser apresentados: (i) comprovação de aptidão para desempenho de atividade pertinente e compatível em características, quantidades e prazos com o objeto do credenciamento, por meio de apresentação de Formulário Descritivo dos Laboratórios (Anexo III), (ii) comprovação de existência de sistema de qualidade implementado no laboratório, por meio de certificação ou protocolo de certificação do laboratório pelo INMETRO; e/ou habitação ou em processo de habilitação na Rede Brasileira de Laboratórios de Saúde (REBLAS); e/ou participação em ensaios de proficiência com resultados satisfatórios; e/ou comprovação de capacidade técnico – cientifica por meio de publicações cientificas, dissertações de mestrado, teses de doutorado. Será exigida publicação mínima média de um trabalho por ano nos últimos cinco anos. A qualificação técnica do laboratório poderá ensejar vistorias por parte da contratante. Do Pessoal Para a execução das atividades contratadas, considera-se de extrema importância a qualificação do pessoal. O trabalho técnico será coordenado e supervisionado por profissional farmacêutico com título de doutor ou de mestre com experiência de 10 (dez) anos na área objeto do contrato. Todos os profissionais colaboradores deverão possuir experiência na área específica objeto deste projeto. Caberá ao Coordenador identificar e integrar o contingente de recursos humanos necessários para o desenvolvimento do projeto, como pesquisadores, colaboradores em graduação ou pósgraduação, técnicos de laboratório, que não comprometam a qualificação do projeto os LSD 13 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA aspectos gerais. Para qualificação técnica do Coordenador do projeto em cada um dos centros colaboradores deverão ser apresentados: (i) currículo na Plataforma LATTES (CNPQ) atualizado; (ii) cópia do Diploma ou equivalente de Doutorado e Mestrado. X. CUSTOS A obtenção de monografias farmacopéicas, por ser bastante peculiar, é resultado de trabalhos científicos e de pesquisa em laboratórios especializados, não sendo, em qualquer lugar do mundo, produtos disponibilizados no mercado, não existindo ainda um estudo que detalhe o custo das diferentes modalidades pesquisadas e publicadas até a presente data. Justificativa para definição dos preços Os trabalhos realizados pela ANVISA, em função da Farmacopéia Brasileira, se deram até o presente momento mediante convênios com instituições colaboradoras. A Tabela 1 demonstra os valores praticados pela Fundação de Apoio à Tecnologia e Ciência – FATEC, através do Convênio 16/2005, com as instituições por ela contratadas, para elaboração de monografias. Desta forma obteve-se o custo médio para cada um dos estudos especificados. Tabela 1: Valor de Monografias – Convênio 16/2005 - ANVISA/FATEC. Fundações de Apoio Contratas/Produtos Contratados Fundação de Apoio da Universidade Federal do Rio Grande do Sul (UFRGS) Fundação Universitária José Bonifácio (UFRJ) Fundação de Apoio ao desenvolvimento da Universidade Federal do Pernambuco (UFPE) Fundação de Desenvolvimento da Pesquisa (UFMG) Valor Médio por Produto Monografia de MatériaPrima Monografia de Produto Acabado Monografia de Plantas Medicinais R$ 5.545,37 R$ 7.952,59 R$ 7.821,67 R$ 4.386,27 R$ 7.688,17 - R$ 5.250,01 R$ 8.464,00 - R$ 4.006,53 R$ 7.410,45 - R$ 4.797,05 R$ 7.878,80 R$ 7.821,67 Fonte: FATEC - Planos de Trabalhos de Contratos celebrados via convênio ANVISA/FATEC. A contrapartida da convenente, requisito legal para o citado convênio, foi de 20% do valor total do Convênio nº. 16/2005. Uma vez que esta relação de parceria/contrapartida não se LSD 14 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA estabelece no contrato, somou-se 20% aos valores médios obtidos por produto, resultando nos valores de monografias propostos na Tabela 2. Para verificar a razoabilidade de se praticar os valores obtidos na Tabela 2 (Convênio 16/2005 + 20%), buscou-se, junto a instituições colaboradoras da Farmacopéia Brasileira, preços de testes laboratoriais (Anexo I) necessários ao desenvolvimento de monografias para os diversos produtos objetos deste projeto. Vale salientar que a sugestão de apropriação de custos, apresentada pelas instituições, foi elaborada em função dos preços unitários dos testes e do quantitativo de testes para cada estudo, sendo, portanto um preço estimado. Os cálculos dos valores médios para as diferentes estimativas de preços de monografias, apresentadas pelas instituições consultadas, estão descritos no Anexo I. Tabela 2: Valor de monografias acrescido de 20% (contrapartida do Convênio) Monografia de Matéria-Prima Monografia de Produto Acabado Monografia de Plantas Medicinais Convênio16/2005 R$ 4.797,05 R$ 7.878,80 R$ 7.821,67 Convênio 16/2005 + 20% R$ 5.756,45 R$ 9.454,56 R$ 9.386,00 Instituições R$ 8.009,67 R$ 12.911,48 R$ 11.733,33 Preços Médios A média dos preços praticados no Convênio (acrescidos dos 20%), comparada à média dos preços estimados de monografias, apresentados pelas instituições, demonstraram que os preços estimados são superiores aos preços sugeridos, em 39% para matéria-prima, 37% para produto acabado e 25% para plantas medicinais, o que permite concluir que o preço médio acrescido de 20% sugerido, conforme demonstrado na Tabela 2, é exeqüível. Para definição de preço de Revisão Bibliográfica consideramos os valores da hora de trabalho do pesquisador com titulação de Doutor, que varia de R$45,00 (Anexo II) a R$70,00 (Anexo I) e o tempo médio de 10 horas para efetuar esta fase do projeto. Portanto, para este produto, definiu-se o valor de R$570,00 considerando um valor médio de hora de trabalho de R$57,00. LSD 15 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA Definição do Preço Considerando a relevância do Projeto de Revisão das Monografias da Farmacopéia Brasileira; Considerando a importância do cumprimento da atribuição da Comissão Permanente de Revisão da Farmacopéia/ANVISA de revisar e atualizar as suas monografias; Considerando os valores do Convênio 16/05, o percentual de contrapartida do convenente e os valores informados pelas instituições, foram estipulados valores a serem praticados - Convênio 16/2005 + 20% (Tabela 2) de forma a financiar os estudos pretendidos, por produto contratado (monografias de matérias-primas, especialidades farmacêuticas e plantas medicinais); Considerando o levantamento de preços realizado junto às instituições; Considerando que os preços levantados englobam custos com pessoal e encargos trabalhistas decorrentes, diferentemente dos envolvidos no pagamento de bolsistas de graduação e pósgraduação; Considerando que os recursos deste projeto além de produzirem os produtos esperados, fomentam instituições de ensino e pesquisa do país quanto ao tema especifico da Farmacopéia Brasileira; Considerando que os preços sugeridos neste projeto são aproxidamente os mesmos praticados ao longo dos anos para a realização dos trabalhos da Farmacopéia Brasileira, com participação de diversas instituições colaboradoras, o que nos permite concluir o aceite dos valores; Propõe-se que os produtos sejam remunerados de acordo o estabelecido na Tabela 3, garantindo desta forma, que os recursos orçamentários destinados a Farmacopéia Brasileira sejam suficientes para garantir a execução do projeto. LSD 16 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA Tabela 3: Planilha de preços por produto Descrição/Categoria de Produto Quant. Custo Unitário (R$) Custo Total (R$) Revisão bibliográfica 2000 R$ 570,00 R$ 1.140.000,00 Avaliação Laboratorial de Matéria Prima 180 R$ 5.756,45 R$ 1.036.161,00 Avaliação Laboratorial de Especialidade Farmacêutica 258 R$ 9.454,56 R$ 2.439.276,48 Avaliação Laboratorial de Plantas Medicinais 63 R$ 9.386,00 TOTAL R$ 591.318,00 R$ 5.206.755,48 O quantitativo previsto na Tabela 3 (Planilha de Preços) refere-se aos serviços que se pretende realizar no primeiro período do credenciamento, no entanto não exaustivo, podendo variar para mais ou para menos de acordo com a necessidade dos estudos para a revisão e atualização da F. Bras. e especificidade dos credenciados, o que enseja, em princípio, um custo total do projeto de R$ 5.206.755,48 (cinco milhões, duzentos e seis mil, setecentos e cinqüenta e cinco reais e quarenta e oito centavos). XI. EXECUÇÃO O projeto será viabilizado por meio de credenciamento e contratação dos interessados (instituição de ensino superior, suas fundações ou equivalente) qualificados, com capacidade legal, técnica e operacional declarada no Formulário Descritivo dos Laboratórios (Anexo III). Para a celebração da contratação observar-se-á a vocação técnico - cientifica de cada credenciado e a capacidade técnico-operacional declarada, sendo os estudos divididos em blocos constituídos da seguinte forma: 9 Revisão Bibliográfica de monografias; 9 Avaliação Laboratorial de monografia de matéria-prima; 9 Avaliação Laboratorial de monografia de especialidades farmacêuticas; 9 Avaliação Laboratorial de monografia de plantas medicinais (com desenho botânico, se necessário). LSD 17 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA A Fase A de execução do projeto, conforme descrito na metodologia, se refere à revisão bibliográfica e será realizada por todos os credenciados, conforme Bloco de Estudos A definido pela CPRFB, de forma equânime. A conclusão desta etapa resultará em relatório preliminar composto de monografias a serem revisados, com avaliação laboratorial. A Fase B descrita na Metodologia se refere à avaliação laboratorial. Será executada pelas instituições credenciadas. Os Blocos de Estudo B serão definidos pela CPRFB baseados em: • Relatórios resultantes da Fase A, que apresentam os indicativos sobre monografias que necessitam de avaliação laboratorial; • Vocação tecnico-cientifica e capacidade técnico-operacional declarada pelas instituições quando do credenciamento. A conclusão desta etapa resultará em relatório final, dossiê de cada produto e minuta final da monografia. XII. CELEBRAÇÃO DOS CONTRATOS A ANVISA, após o encerramento do prazo de credenciamento, que será de 15 dias, improrrogável, considerando a necessidade da execução dos serviços e sua disponibilidade orçamentária, convocará os credenciados para assinatura do contrato, que será formalizado em instrumento particular de contrato, regulado pelas cláusulas nele especificadas e as disposições legais e regulamentares concernentes. A ANVISA ficará responsável pela distribuição dos produtos a serem contratos entre as instituições credenciadas, o que será feita de forma equânime, sendo observadas a capacidade técnico-operacional declarada e a vocação técnico - cientifica de cada uma, conforme Formulário Descritivo (Anexo IIII). Os serviços serão contratados com as instituições colaboradoras conforme os Blocos de Estudos A e B e de acordo com a capacidade operacional declarada por cada credenciado, levando-se em conta, contudo, a estimativa total do quantitativo estabelecido na Planilha 3. LSD 18 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA Distribuição dos produtos para o Contrato: O Projeto prevê uma estimativa de 2000 monografias para a revisão bibliográfica – FASE A e 500 monografias para avaliação laboratorial – FASE B, distribuídas entre as categorias de produtos (matérias-primas, especialidade farmacêutica e plantas medicinais), conforme previsto na Tabela 3, quantitativos esses, que servirão de base de cálculo para a estipulação dos serviços contratados na feitura dos contratos. FASE A: A distribuição das monografias para revisão bibliográfica será feita de maneira equânime entre os credenciados, respeitando-se: 1º - Número total de monografias a serem revisadas, distribuído em igual quantidade, entre todos os credenciados; agrupados em Blocos, por ordem alfabética da listagem geral de monografias a serem revisadas, sempre em quantidade igual, sendo que sua destinação ao credenciado dar-se-á mediante sorteio. 2º - Se declarada capacidade operacional menor do que quantidade a ser distribuída igualitariamente, será demandada ao credenciado a quantidade por ele prevista e o excedente será distribuído por sorteio entre os demais credenciados com capacidade declarada para tanto. 3º - Em observância ao princípio da impessoalidade na distribuição dos serviços, os estudos excedentes de que trata o item anterior, serão agrupados em Blocos, por ordem alfabética da listagem geral de monografias a serem revisadas, sempre em quantidade igual, sendo que sua destinação ao credenciado dar-se-á mediante sorteio. FASE B: Uma vez que a execução da FASE B dependerá dos resultados da FASE A e da priorização pela CPRFB definida na metodologia, a distribuição inicial, no momento da contratação será estimada da seguinte maneira: 1º - O número total de monografias a serem avaliadas em laboratório será distribuído em igual quantidade, para cada categoria de produto, entre todos os credenciados, observado sua vocação; 2º - Se declarada, para cada categoria de produto, capacidade operacional menor do que quantidade a ser distribuída igualitariamente, será demandada ao credenciado a quantidade LSD 19 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA por ele prevista e o excedente será sorteado entre os demais credenciados com capacidade declarada para tanto, situação em que qualquer dos credenciado poderá abdicar do direito de participar da distribuição dessas monografias excedentes. Para a realização de sorteios de distribuição de Blocos de monografias, que ocorrerá em sessões abertas nas dependências da ANVISA, será constituída uma comissão composta por representantes da ANVISA na Secretaria Executiva da CPRFB e por servidores da GGGAF, atendendo aos itens abaixo: 1. Inicialmente todos os credenciados participarão deste sorteio; 2. Havendo vários blocos de monografias a serem sorteadas em uma sessão, o credenciado já sorteado com um bloco, não participará do sorteio dos blocos seguintes, e assim sucessivamente, até que todos os participantes tenham sido sorteados; 3. Na hipótese de todos os participantes terem sido sorteados e ainda restarem blocos para distribuir, novamente todos participarão, mas na medida em que o credenciado for sorteado, o mesmo não participará do sorteio dos blocos seguintes, se houver; 4. Os credenciados poderão participar das sessões de sorteio. Faculta-se à ANVISA, nas monografias de características específicas e relevantes, em prol de seus interesses, indicar determinado credenciado, sem obedecer a ordem de sorteio, devendo-se, neste caso, a opção estar devidamente justificada com a apresentação da motivação que lhe deu causa. O credenciado que se recusar a assinar o respectivo contrato, bem como descumprir qualquer dos termos, cláusulas ou condições nele estabelecidos ou cometer faltas durante a execução dos serviços, estará sujeito às penalidades cabíveis, na forma da legislação vigente. XIII. CRONOGRAMA DE EXECUÇÃO/PAGAMENTO Para efeito de pagamento dos produtos contratados foram estabelecidos subprodutos nas Fases A e B, e para cada subproduto foi atribuído um valor corresponde, em percentual, relativo ao valor total de cada Fase. O pagamento será realizado em parcelas para cada subproduto definido quando entregue, conforme prazos estabelecidos. LSD 20 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA A Tabela 4 apresenta os produtos e subprodutos referentes a cada Fase, os valores em percentuais definidos para cada um deles, a parcela de pagamento correspondente e os prazos de execução. Necessidades de alterações no cronograma, devidamente justificadas, serão submetidas à autorização prévia pela ANVISA, ressalvado que os prazos para entrega dos subprodutos correspondentes às 1ª, 3ª, 4ª e 8ª parcelas são improrrogáveis, devido ao fato de serem necessários à adequada continuidade dos estudos e ao cumprimento da legislação vigente quanto aos prazos de execução de contratos. Os quantitativos sugeridos de estudos referentes às parcelas intermediárias poderão sofrer variações, sendo que o pagamento da parcela correspondente se dará proporcionalmente ao número de estudos entregues e, ao final de cada fase, o total desses produtos deverá ser o equivalente ao total contratado para a fase. Os relatórios intermediários deverão ser entregues com as minutas de monografias. Para calcular o valor de cada contrato, serão considerados os quantitativos de produtos/monografias previstos em cada Bloco de Estudos A e B, distribuído pela CPRFB, pelo valor unitário de cada um dos produtos contratados definidos na Tabela 5. Os valores a serem pagos em cada parcela para cada produto/monografia, será o percentual correspondente ao subproduto obtido a partir da multiplicação do quantitativo pactuado pelo seu valor unitário. Caso o centro colaborador, por motivo justificado e acatado pela ANVISA, não realizar a totalidade dos estudos pactuados no contrato, o valor a ser pago será o correspondente ao que for entregue. O valor a ser pago na 3ª parcela será o equivalente ao quantitativo de revisões bibliográficas dos estudos concluídos e entregues, deduzidos dos valores das parcelas pagas anteriormente na Fase A. O valor a ser pago na 7ª e 8ª parcelas serão os equivalentes aos estudos laboratoriais concluídos e entregues, deduzidos dos valores das parcelas pagas anteriormente na Fase B. O relatório final da Fase B deverá conter os dossiês individuais das monografias revisadas, LSD 21 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA conforme formulário definido pela CPRFB e as minutas de monografias devidamente formatadas para publicação no DOU e livro. A CPRFB/ANVISA terá o prazo de 30 dias para dar ciência ao contratado, no que couber, conforme descrito na metodologia, respeitado o prazo de execução previsto, a fim de que as atividades do contratado não sejam prejudicadas. LSD 22 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA Tabela 4: Cronograma de Execução/Fase A – Revisão Bibliográfica Fase A B LSD Produto Revisão Bibliográfica Avaliação Laboratorial Parcela Subproduto Valor 1ª Plano de Trabalho referente ao Bloco de Estudos A - Fase A. 2ª Relatório - 50% dos estudos/monografias revisados – Fase A. 3ª Relatório - 50% dos estudos/monografias revisados – Fase A. 4ª Plano de Trabalho referente ao Bloco de Estudos B - Fase B. 20% do valor total da Fase B 5ª Relatório - 30% das Minutas de Monografias. 25% do valor total da Fase B 6ª Relatório - 30% das Minutas de Monografias. 25% do valor total da Fase B 7ª Relatório - 40% das Minutas de Monografias. 25% do valor total da Fase B 8ª Relatório com Tabela Simplificada, Dossiês Individuais e Minutas Finais de Monografia. 5% do valor total da Fase B 30% do Valor Total da Fase A 35% do Valor Total da Fase A 35% do Valor Total da Fase A Prazo de Execução 10 dias após assinatura do contrato 40 dias após assinatura do contrato 70 dias após assinatura do contrato 110 dias após assinatura do contrato 170 dias após assinatura do contrato 230 dias após assinatura do contrato 290 dias após assinatura do contrato 365 dias após assinatura do contrato Observação sobre Prazo de Execução Prazo Improrrogável Prazo Improrrogável Prazo Improrrogável - Prazo Improrrogável 23 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA A Tabela 5 apresenta a fórmula para o cálculo dos valores referentes ao pagamento das Fases A e B (Valor Total da Fase A e Valor Total da Fase B) e consequentemente os percentuais relativos às parcelas, em função dos Blocos de Estudos A e B (quantitativo de estudos pactuados) definidos pela CPRFB/ANVISA. Tabela 5: Cálculo dos valores referentes ao Valor Total da Fase A e B em função dos Blocos de Estudos A e B, definidos pela CPRFB/ANVISA. Fase Produto Valor Unitário R$ (Vu) Quant. (N) Valor total (Vt) A Revisão Bibliográfica (RB) 570,00 NRB VtRB = NRB x VuRB Valor Total Fase A = VtRB B Avaliação Laboratorial de Matéria Prima (MP) 5756,45 NMP VtMP = NMP x VuMP B Avaliação Laboratorial de Especialidade Farmacêutica (EF) 9454,56 NEF VtEF = NEF x VuEF B Avaliação Laboratorial de Plantas Medicinais (PM) 9386,00 NPM VtPM = NPM x VuPM Valor Total da Fase B = VtMG + VtMP + VtEF + VtC + VtPM + VtPMD XV. FISCALIZAÇÃO A fiscalização financeiro-orçamentária do presente Contrato será exercida por um representante da CONTRATANTE, designado pela Gerência de Logística da ANVISA, ao qual competirá dirimir as dúvidas que surgirem no curso da prestação dos serviços e de tudo dará ciência à Administração, conforme art. 67 da Lei nº. 8.666, de 1993. A fiscalização do desenvolvimento técnico dos trabalhos será exercida pela CPRFB/ANVISA ao qual competirá dirimir as dúvidas técnicas que surgirem no curso do Projeto. O descumprimento das obrigações da contratada e dos prazos estabelecidos para execução do Projeto para as etapas ditas improrrogáveis na Tabela 4 ensejara penalidades como advertência, multa, rescisão contratual e/ou suspensão do direito de licitar. LSD 24 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA XVI. OBRIGAÇÕES DA CONTRATANTE a) Prestar as informações e os esclarecimentos à contratada que forem necessários à condução do processo, no que couber; b) Fazer os encaminhamentos à CPRFB dos relatórios e documentos remetidos pela contratada conforme estabelecido no cronograma de execução; c) Rejeitar o material entregue pela instituição contratada fora das especificações deste Projeto; d) Comunicar a instituição contratada todas e quaisquer ocorrências relacionadas à prestação do serviço; e) Divulgar o material preliminar no Fórum Farmacopéico CP e apresentar relatório resultante à CPRFB e contratada para definição da necessidade de novos estudos pela contratada; f) Efetuar o pagamento à Instituição contratada, após apresentação da Nota Fiscal/Fatura e o aceite da área solicitante, dos serviços executados, de acordo com o cronograma de pagamento definido, conforme legislação vigente; g) Fiscalizar a entrega dos serviços podendo sustar, recusar, mandar fazer ou desfazer qualquer entrega que não esteja de acordo com as condições e exigências estabelecidas no Projeto Básico. XVII. OBRIGAÇÕES DA CONTRATADA a) Prestar os serviços constantes no presente projeto, em restrita obediência às especificações técnico-científicas descritas nas condições estabelecidas e na legislação vigente; b) Prestar as informações e os esclarecimentos que venham a ser solicitados pela instituição contratante e CPRFB; c) Comunicar a instituição contratante todas e quaisquer ocorrências relacionadas à pesquisa; d) Realizar a coordenação e supervisão técnica de todos os trabalhos contratados; e) Realizar todos os trabalhados administrativos inerentes aos produtos contratados; f) Entregar os produtos contratados de acordo com as condições e exigências estabelecidas no Projeto Básico. g) Atender ao cronograma de execução pré-estabelecido; LSD 25 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA h) Garantir a manutenção das especificações de qualificação institucional (contratada) e de pessoal, descritas no item IX. XVIII. DA VIGÊNCIA DO CREDENCIAMENTO O Termo de Credenciamento terá sua vigência pelo prazo de 12 (doze) meses, contados de sua assinatura, podendo esta ser prorrogada por igual período, independente da realização de novo credenciamento. XIX. GLOSSÁRIO Para fins deste projeto se aplicam as definições a seguir: Centro colaborador - instituição incumbida regimental ou estatutariamente ao ensino e pesquisa na área de ciências farmacêuticas e vigilância sanitária qualificado para desenvolver atividades relacionadas à Farmacopéia Brasileira. Controle de Qualidade - Conjunto de medidas destinadas a garantir, a qualquer momento, a produção de lotes de medicamentos e demais produtos abrangidos por esta Lei, que satisfaçam às normas de atividade, pureza, eficácia e inocuidade (Lei nº. 6360/1976). Denominação Comum Brasileira (DCB) - denominação do fármaco ou princípio farmacologicamente ativo aprovada pelo órgão federal responsável pela vigilância sanitária. Denominação Comum Internacional (DCI) - denominação do fármaco ou princípio farmacologicamente ativo recomendada pela Organização Mundial de Saúde. Planta medicinal - planta que contém um ou mais substâncias bio-ativas que lhe confere atividade terapêutica, profiláticas ou paliativas. Especialidade farmacêutica - Produto oriundo da indústria farmacêutica com registro na Agência Nacional de Vigilância Sanitária e disponível no mercado. Especificação - Documento descrevendo em detalhes os requisitos a que devem atender os produtos ou materiais usados ou obtidos durante a fabricação. As especificações servem como base da avaliação da qualidade. LSD 26 PROJETO BÁSICO REVISÃO DAS MONOGRAFIAS DA FARMACOPÉIA BRASILEIRA Insumo Farmacêutico - droga ou matéria-prima aditiva ou complementar de qualquer natureza, destinada a emprego em medicamentos, quando for o caso, e seus recipientes. Matérias-Primas - Qualquer substância ativa ou inativa, com especificação definida, utilizada na produção de medicamentos. Medicamento/Especialidade Farmacêutica - produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico; Monografias farmacopéicas - especificações de qualidade dos insumos farmacêuticos ativos ou não, da especialidade farmacêutica e da planta medicinal, considerando nomenclatura, caracterização, identificação, pesquisa de impurezas e contaminantes e determinação quantitativa, descrita por testes, ensaios específicos e métodos aplicáveis, quando for o caso. Substância ativa - Qualquer substância que apresente atividade farmacológica ou outro efeito direto no diagnóstico, cura, alívio, tratamento ou prevenção de doenças, ou afete qualquer função do organismo humano. Formulário Descritivo dos Laboratórios - descritivo da estrutura física, capacidade técnicooperacional, equipamentos disponíveis e sistema de qualidade dos laboratórios analíticos das instituições credenciadas. Brasília, 29 de outubro de 2007. Jaimara Azevedo Oliveira Lais Santana Dantas Luiz Armando Erthal Nélio de Bastos Morais De acordo, MARIA CECÍLIA MARTINS BRITO Diretora/ANVISA LSD 27 ANEXO I – LEVANTAMENTO DE PREÇOS Para verificação da razoabilidade dos preços sugeridos para serem praticados neste projeto foi feito um levantamento de preços junto a algumas instituições de ensino que prestam serviços para realização de testes laboratoriais que são necessários ao desenvolvimento de monografias. Neste Anexo estão apresentados levantamento de preços feitos junto a Universidade Federal de Minas Gerais – UFMG (Anexo IA), Universidade Federal de Pernambuco – UFPE (Anexo IB), Centro Universitário Franciscano – UNIFRA (Anexo IC), que forneceram preços para os testes necessários à realização de estudo para monografias de especialidades farmacêuticas e de revisão bibliográfica de monografias. Os dados resumidos constam na Tabela I. Foram feitos também levantamentos de preços junto à Universidade Estadual de Maringá – UEM (Anexo ID), que forneceu preços para os testes necessários à realização de estudos para as monografias de plantas medicinais com desenho botânico e de revisão bibliográfica de monografias. Os dados resumidos constam na Tabela II. Os Anexos IA, IB, IC e ID contêm respectivamente os documentos apresentados pela UFMG, UFPE, UNIFRA e UEM. ANEXO I – LEVANTAMENTO DE PREÇOS 1 Tabela I: Preços de testes necessários para o desenvolvimento de monografias de Especialidades Farmacêuticas, levantado junto a instituições que são colaboradoras da Farmacopéia Brasileira. Produtos 1 2 3 4 5 6 7 8 Monografia de Forma Farmacêutica – Líquidos Estéreis (Técnica: CLAE) Monografia de Forma Farmacêutica – Líquidos não Estéreis (Técnica: CLAE) Monografia de Forma Farmacêutica – Líquidos Estéreis (Técnica: Meio Microbiológico) Monografia de Forma Farmacêutica – Semi- Sólido (Técnica: CLAE) Monografia de Forma Farmacêutica – Sólido Oral (Técnica: Espectrofotometria UV ou VIS) Monografia de Forma Farmacêutica – Sólido Oral (Técnica: CLAE) Monografia de Forma Farmacêutica – Sólido Oral (Técnica: Meio Microbiológico) Média dos Levantamentos de Preço - Especialidades Farmacêuticas UFMG UNIFRA UFPE R$ 14.166,00 R$ 13.521,00 R$ 14.158,00 R$ 12.606,00 R$ 11.815,00 R$ 12.748,00 R$ 13.544,00 R$ 12.031,00 R$ 12.798,00 R$ 12.393,00 R$ 11.905,00 R$ 12.377,00 R$ 11.046,00 R$ 10.702,00 R$ 11.093,00 R$ 15.510,00 R$ 15.001,00 R$ 15.509,00 R$ 12.901,00 R$ 12.464,00 R$ 12.853,00 R$ 13.166,57 R$ 12.491,29 R$ 13.076,57 9 Monografia de Matéria-Prima (Técnica: CLAE) R$ 8.210,00 R$ 7.609,00 R$ 8.210,00 10 Revisão Bibliográfica de Monografias R$ 700,00 R$ 700,00 R$ 700,00 Observação: O preço médio estimado por estes levantamentos para as especialidades farmacêuticas e matérias-primas é a media dos custos médios apresentados pelas três instituições pesquisadas, no valor de R$ R$ 12.911,48 e R$ 8.009,67, respectivamente. Tabela II: Preços de testes necessários para o desenvolvimento de monografias de plantas medicinais com desenho botânico, levantado junto a instituição colaboradora da Farmacopéia Brasileira. ANEXO I – LEVANTAMENTO DE PREÇOS 2 5 Produtos Monografia de planta medicinal: técnica botânica, testes físico-químicos, cromatografia liquida de alta eficiência, cromatografia gasosa e titulação. Monografia de planta medicinal: técnica botânica, testes físico-químicos, cromatografia liquida de alta eficiência e cromatografia gasosa. Monografia de planta medicinal: técnica botânica, testes físico-químicos, cromatografia liquida de alta eficiência e técnica ultravioleta e visível (UV-VIS). Monografia de planta medicinal: técnica botânica, testes físico-químicos, cromatografia liquida de alta eficiência e titulação. Monografia de planta medicinal: técnica botânica, testes físico-químicos, cromatografia liquida de alta eficiência. R$ 15.530,00 6 Monografia de planta medicinal: técnica botânica, testes físico-químicos e cromatografia gasosa. R$ 13.930,00 7 Monografia de planta medicinal: técnica botânica, testes físico-químicos e técnica ultravioleta e visível (UV-VIS). R$ 12.730,00 8 Monografia de planta medicinal: técnica botânica, testes físico-químicos e titulação. R$ 11.930,00 9 Monografia de planta medicinal: técnica botânica e testes físico-químicos. R$ 10.730,00 1 2 3 4 UEM R$ 19.930,00 R$ 18.730,00 R$ 17.530,00 R$ 16.730,00 10 Monografia de planta medicinal: testes físico-químicos e cromatografia gasosa. R$ 7.380,00 11 Monografia de planta medicinal: técnica botânica. R$ 6.930,00 12 Monografia de planta medicinal: testes físico-químicos R$ 3.980,00 13 Monografia de planta medicinal: testes físico-químicos e técnica ultravioleta e visível (UV-VIS). R$ 5.980,00 14 Monografia de planta medicinal: testes físico-químicos e titulação. R$ 5.180,00 15 Monografia de planta medicinal: testes físico-químicos e cromatografia líquida de alta eficiência. R$ 8.780,00 16 R$ Preços Médios de testes necessários para o desenvolvimento de monografias de plantas medicinais. ANEXO I – LEVANTAMENTO DE PREÇOS 11.733,33 3 O CUSTO DA HORA DE TRABALHO DO PROFESSOR NA UNIVERSIDADE FEDERAL DE SANTA CATARINA Altair Borgert, Dr. Rodrigo Costa Cidade, Mestrando RESUMO Este artigo apresenta o levantamento do custo da hora de trabalho de um professor Adjunto 4 com doutorado, em regime de dedicação exclusiva e tempo médio no emprego de 10 anos, da Universidade Federal de Santa Catarina. Para tanto, consulta-se a legislação vigente no sentido de ressaltar os benefícios e os valores reais incidentes diretamente sobre o referido cargo. Verifica-se que para um total de 2.433,3455 horas à disposição da instituição, no caso em destaque, o professor trabalha efetivamente 1.603,0563 horas em média por ano, descontandose os principais eventos relacionados com a vida funcional do professor como: repouso semanal remunerado, férias, feriados, licença prêmio e afastamentos diversos. Os cálculos complementares utilizam estes parâmetros para a identificação e definição do custo da hora de trabalho. Como conclusão do estudo apura-se um custo para a Universidade de R$ 48,62 (quarenta e oito reais e sessenta e dois centavos) por hora de trabalho, destacando-se, conseqüentemente, o valor do seu trabalho como um benefício para a sociedade e uma medida de eficácia para a gestão da Instituição. 1 INTRODUÇÃO No contexto sócio-político e econômico brasileiro, as Instituições Federais de Ensino Superiores, mantidas pela União, têm grande representatividade no cenário empresarial nacional e mundial. Com o objetivo de formar mão-de-obra qualificada para atender às necessidades do mercado nacional, empregam e qualificam profissionais preparados para atender as demandas e formação da massa crítica que, como conseqüência, define a posição do país no mundo globalizado e transformado pelas mais recentes revoluções políticas, econômicas e tecnológicas. Ao empregar esses profissionais, ampara-se no regime jurídico dos servidores públicos da União (Lei Nº 8.112, de 11 de dezembro de 1990) que, por meio de concurso público de provas ou provas e títulos tornam-se servidores com atribuições e responsabilidades previstas e devem cumprir jornada de trabalho fixada em razão dos seus respectivos cargos, respeitando-se a duração máxima do trabalho semanal de quarenta horas (Lei no 8.270, de 17 de dezembro de 1991). 1 Como servidores, os seus vencimentos são pagos pelos cofres públicos mediante a ocupação do cargo e o regime de trabalho, ou seja, o custo da mão-deobra desses profissionais se restringe ao cargo e a jornada de trabalho legal. Assim, as Instituições Federais de Ensino geram um custo para a União, ao empregarem e qualificarem tais profissionais. Dada a relevância do assunto, o presente estudo aborda a questão, no sentido de levantar o custo da hora de trabalho de um Professor na Instituição Federal de Ensino de Santa Catarina, que em princípio tem um certo ônus para a União, mas que no longo prazo traz retornos relevantes para a formação superior do país, além de contribuir para o aperfeiçoamento do controle e da tomada de decisão, necessários para o desenvolvimento das organizações públicas e privadas. Assim, para a realização da pesquisa, selecionou-se um professor com determinadas características para servir como base de comparação. 2 CARACTERIZAÇÃO DAS INSTITUIÇÕES FEDERAIS DE ENSINO SUPERIOR IFES As Instituições Federais de Ensino Superior – IFES, como qualquer tipo de organização, desenvolvem atividades que consomem recursos de produção, que por sua vez possuem valores econômicos correspondentes. Qualquer atividade empresarial, em essência, pode ser classificada como uma atividade econômica. Assim, o caráter econômico de uma atividade decorre de recursos que, por serem escassos, possuem valor econômico, e da geração de produtos/serviços, que também o possuem, por causa da satisfação que proporcionam aos seus clientes. As IFES se inserem neste ambiente, pois os produtos de suas atividades de ensino, pesquisa e extensão são um bem econômico tão valioso quanto qualquer outro que se negocie no mercado. O resultado econômico positivo deve ser a meta objetivada pela Instituição, pois esse é responsável pela garantia da sua continuidade operacional. Portanto, à sua viabilidade econômica pode-se associar decisões de investimentos em suas próprias atividades ou em outras correlatas que apresentem algum tipo de benefício para a sociedade. Para Santos (2002), pode-se entender o resultado econômico como aquele que reflete a variação do patrimônio da empresa em um determinado período e que tenha sido corretamente mensurado sob a luz dos conceitos econômicos. O produto global da empresa é caracterizado pelos resultados analíticos das diversas negociações que correspondem à materialização dos gestores, em que o parâmetro de qualidade da atuação do gestor é fator preponderante para o nível de otimização do resultado. O modelo e gestão das IFES, que compreende o conjunto de normas, princípios e conceitos, cuja finalidade é orientar o seu processo administrativo para que possa cumprir a sua missão, deve estar livre das amarras burocráticas e legais que tornam o serviço público ineficiente e inábil à implementação de ações gerenciais que visam otimizar o resultado econômico dos serviços gerados traduzidos pelos benefícios sociais disponibilizados às comunidades. 2 2.1 A Universidade Federal de Santa Catarina O ensino superior do Estado de Santa Catarina se iniciou com a criação da Faculdade de Direito, em 11 de fevereiro de 1932. Organizada inicialmente como instituto livre, foi oficializada por decreto Estadual em 1935. Na Faculdade de Direito nasceu a idéia da criação de uma Universidade que reunisse todas as Faculdades existentes na capital do estado. Assim, pela Lei no 3.849 de 18 de dezembro de 1960, foi criada a Universidade Federal de Santa Catarina. A construção do “campus”, localizado no bairro Trindade, foi uma doação à União pelo governo do estado. Atualmente, a UFSC possui 56 departamentos e 2 coordenadorias especiais, os quais integram 11 Unidades Universitárias. São oferecidos 28 cursos de Graduação com 51 Habilitações nos quais estão matriculados 15.875 alunos. Além destes, a UFSC oferece, também, cursos de pós-graduação, dos quais 11 são de Doutorado e 31 de Mestrado. Em termos de professores, em dezembro/2003, segundo dados do Departamento de Recursos Humanos o quadro de docentes integrava 1.878 profissionais. A Universidade Federal de Santa Catarina, ao instaurar uma revolução cultural na sociedade, é também instituída por esta mesma sociedade. Pelos dados expostos, tem-se demonstrada a importância quantitativa e a densidade formativa significativa de seus quadros. Pode-se destacar, dentre suas ações, a oferta de serviços vitais e estratégicos para a sociedade através de suas atividades de ensino, pesquisa e extensão. As atividades desenvolvidas pela UFSC não consomem recursos somente, como qualquer outra atividade econômica, mas geram receitas – benefícios – e conseqüentemente resultado. Este resultado está em consonância com os objetivos sociais dessa entidade na medida em que possa ser traduzido em benefícios para a sociedade. 2.2 Da terminologia e conceituação Para o presente estudo de caso, apresenta-se, a seguir, a terminologia e conceituação utilizada para melhor entendimento e clareza das informações. Assim, para cada termo tem-se uma interpretação específica. Aula - unidade de tempo dedicada à ministração do ensino em aulas teóricas, práticas, de laboratório ou de campo. Cargo ou emprego - conjunto de atribuições substancialmente idênticas quanto à natureza do trabalho e aos graus de complexidade e responsabilidade. Categoria funcional - conjunto de cargos ou empregos da mesma denominação. Classificação de categorias funcionais - processo de identificação e tematização das diferentes Categorias Funcionais existentes na Instituição Federal de Ensino, tendo em vista a natureza de suas atribuições e o grau de responsabilidade exigido para o seu desempenho, para efeito de agrupamentos em subgrupos. 3 3 LEVANTAMENTO DE DADOS Para a realização do estudo de caso, tornou-se necessário a obtenção de alguns dados a respeito da instituição objeto da pesquisa. As informações referentes ao departamento de pessoal foram coletadas por meio de entrevista informal junto ao Departamento de Recursos Humanos da Universidade Federal de Santa Catarina. Ainda, dados secundários foram coletados, também, no Núcleo de Processamento de Dados e dizem respeito ao período dos anos de 1998 a 2003. Vale ressaltar, ainda, que no presente estudo de caso, no que se refere aos direitos e vantagens dos funcionários públicos federais, baseou-se na Lei no 8.112/90, Decreto Lei no 94.664/87, Portaria no 475/87, Lei no 8.640/92 e Lei no 9.678/98. 3.1 Parâmetros Básicos Inicialmente, identificou-se o número de professores, por categoria, ao longo dos anos de 1998 a 2003, no sentido de identificar aquela mais representativa. Assim, de acordo com a Tabela 1, verifica-se que o maior número de professores, separados por cargos, é representado pelo Adjunto 4 DE (28,5%). Tabela 1: Número de professores por classe e sexo, período 1998 a 2003. Ano Dez/98 Dez/99 Dez/00 Dez/01 Dez/02 Dez/03 Cargo / Sexo M F M F M F M F M M F Substituto 66 109 73 98 96 114 101 127 155 187 60 75 Adjunto 1 Adjunto 2 114 82 71 37 93 98 77 35 85 106 84 51 77 106 73 64 101 73 86 60 101 74 82 66 Adjunto 3 66 32 75 47 76 41 86 46 110 57 94 68 Adjunto 4 103 9 96 10 94 9 95 8 88 8 87 5 Adjunto 4 314 DE Assistente 35 1 Assistente 59 2 163 320 158 357 180 364 191 384 188 413 187 41 30 39 21 28 18 14 13 12 37 47 64 61 57 48 42 36 42 23 28 18 22 Assistente 3 35 39 34 38 32 37 32 27 23 30 18 23 Assistente 4 53 56 51 56 49 51 45 52 44 47 42 47 Auxiliar 1 8 7 5 5 - 1 - 1 - 1 26 55 Auxiliar 2 Auxiliar 3 21 10 17 4 18 8 11 9 12 8 7 10 7 6 4 9 3 3 2 5 1 2 2 6 F 4 Auxiliar 4 Titular 16 179 4 46 12 175 4 45 12 174 4 46 11 174 5 44 13 165 4 42 11 163 3 40 Visitante 9 - 10 - 6 - 3 1 3 1 2 1 Subtotal 1.170 699 1.159 689 1.176 705 1.161 708 1.201 758 1.149 729 Total/Ano 1.869 1.848 1.881 1.869 1.95 9 1.87 8 M=Masculi F=Feminino no Fonte: NPD/SEI/UFSC Conforme se demonstra na Tabela 1, o maior número de professores é representado pelo Adjunto 4, em regime de Dedicação Exclusiva. A seguir, na Tabela 2, de forma resumida, pode-se verificar o percentual do cargo que foi escolhido para estudo de caso, pelo fato de ser o mais freqüente. Tabela 2: Resumo da classe de professor Adjunto 4 DE. Professores Dez/98 Dez/99 Dez/00 Dez/01 Dez/02 Dez/03 Adjunto 4 DE (M) 314 320 357 364 384 413 Adjunto 4 DE (F) 163 158 180 191 188 187 477 478 537 555 572 600 Total Professores 1.869 1.848 1.881 1.869 1.959 1.878 % Adjunto 4 DE 25,5% 25,9% 28,5% 29,7% 29,2% 31,9% Média 28,5% Total DE Adjunto 4 (M) Masculino (F) Feminino Fonte: NPD/SEI/UFSC Assim, para o presente caso, utilizam-se os seguintes parâmetros da classe de professor objeto de estudo, para o cálculo das horas efetivamente trabalhadas: Período do estudo: Ano de 1998 a 2003 (base: mês de dezembro) Cargo: Professor Adjunto 4 DE; Admitido após 02/01/1994; Professor Doutor; 40 horas semanais; e Dedicação Exclusiva. 3.1.1 Tempo à disposição da Instituição A estimação dos parâmetros e coeficientes adotados, bem como os reflexos dos encargos sociais dos professores seguem a legislação vigente. Assim, as 5 principais variáveis de tempo à disposição da Universidade Federal de Santa Catarina são: a) Horas de trabalho por semana: 40 horas b) Semanas por mês = (365/12) / 7 = 4,3452 semanas c) Horas de trabalho por dia: 40 / 6 = 6,6667 horas d) Horas por semana, incluindo repouso = 6,6667 x 7 = 46,6667 horas e) Horas por mês = 46,6667 x 4,3452 = 202,7778 horas f) Total de horas por ano: 365 x 6,6667 = 2.433,3455 horas 3.1.2 Horas não trabalhadas Com o objetivo de se identificar o número total de horas efetivamente trabalhadas no ano, deve-se subtrair as horas não trabalhadas, como a seguir se descrimina: a) Repouso semanal remunerado – Segundo a CF (art. 7º, XV), os empregados têm direito ao repouso semanal remunerado, de preferência aos domingos e também nos feriados (nacionais e locais). Os 45 (quarenta e cinco) dias representados no cálculo abaixo se referem ao período de férias e os 18 (dezoito) dias se referem a Licença Prêmio proporcional, que é concedida a cada 5 (cinco) anos de trabalho. Assim, os principais dados são: Dias no ano: 365 Férias: 45 dias Licença Prêmio proporcional: 18 dias/ano (90 dias a cada 5 anos) Dias na semana: 7 Horas por dia: 6,6667 hs Portanto: (365 – 45 – 18) x 6,6667 horas/dia = 287,6205 horas 7 b) Feriados (considerou-se 13) incluindo o dia do Servidor Público, 28 de outubro, conforme é demonstra-se na Tabela 3, a seguir. Tabela 3: Identificação dos feriados no período de 1998 a 2003. Feriados no ano Dia Comemoração Dia da semana 1998 1999 2000 2001 Sábado segunda 2002 2003 Terça quarta 01/Jan Confraternizaçã Quinta o sexta 24/Fev Carnaval Terça terça Terça terça Terça terça 09/Abr Paixão de Cristo Quinta quinta Quinta quinta Quinta quinta 6 21/Abr Tiradentes Terça quarta 01/Mai Trabalhador Sexta 10/Jun Corpus Christi Quinta Sexta Sábado Doming segunda o Sábado Segunda terça Quarta quinta Quinta quinta quinta Quinta quinta 07/Set Independência Segunda Terça Quinta sexta Sábado Doming o 12/Out N. Sra. Aparecida Segunda Terça Quinta sexta Sábado Doming o 15/Out Professor Quinta Sexta Doming segunda o 28/Out Servidor Público Quarta Quinta Sábado Doming Segunda o 02/Nov Finados Segunda Terça Quinta sexta 15/Nov Proclamação Doming Segunda Quarta o quinta Sexta Sábado terça Quarta quinta 11 9 9 25/Dez Natal 13 Total no ano Sexta Sábado Segunda 12 11 10 Terça quarta terça Sábado Doming o Média 10,3333 Fonte: Elaborado pelos autores Portanto: 10,3333 feriados/ano x 6,6667 horas/dia = 68,8890 horas c) Férias – Independentemente de solicitação, paga-se ao servidor, por ocasião das férias, um adicional correspondente a 1/3 (um terço) da remuneração do período das férias. As férias podem ser parceladas em até três etapas, desde que assim requeridas pelo servidor, e no interesse da administração pública. Em caso de parcelamento, o servidor recebe o valor adicional previsto no inciso XVII do art. 7o da Constituição Federal quando da utilização do primeiro período. O professor não possui o direito de venda dos dias de férias como regulamenta a CLT. Ao docente em efetivo exercício são concedidos 45 (quarenta e cinco) dias de férias anuais, que podem ser gozados em um ou dois períodos. Portanto: 45 dias x 6,6667 horas/dia = 300,0015 horas d) Afastamentos: Enfermidade – consideraram-se as faltas remuneradas dos professores que tiveram problemas com saúde conforme se demonstra na Tabela 4, a seguir. Tabela 4: Identificação das faltas por enfermidade no período de 1998 a 2003. Cód. Enfermidade 1998 1999 2000 2001 2002 2003 AT Atestado Médico 15 40 197 246 324 242 DF Doença Pessoa Família 376 155 278 209 218 147 7 TS Licença Tratamento Saúde 3.938 4.749 5.196 6.906 7.389 7.611 Total de dias 4.329 4.944 5.671 7.361 7.931 8.000 Total de professores 1.869 1.848 1.881 1.869 1.959 1.878 Média por ano 2,32 2,68 3,01 3,94 4,05 4,26 Média do período 3,3755 Fonte: NPD/SEI/UFSC Portanto: 3,3755 faltas x 6,6667 horas/dia = 22,5035 horas e) Afastamentos: Faltas legais – conforme Lei no 8.112 (11/12/90), sem qualquer prejuízo, pode o servidor ausentar-se do serviço para as seguintes finalidades descritas na Tabela 5. Tabela 5: Identificação das faltas legais no período de 1998 a 2003. Cód. Faltas Legais 1998 1999 2000 2001 2002 2003 - 394 837 1.154 482 - ADO Licença para adoção Art. 210 - - - - 30 30 CAS Licença Casamento Art. 97 - - - 8 8 - LP Licença Paternidade - - - 5 5 - MT Licença Maternidade 1.298 2.798 1.656 1.500 943 1.510 NJ Licença Nojo Art. 97 (luto) - 8 - - - 16 Total de dias 1.298 3.200 2.493 2.667 1.468 1.556 Total de professores 1.869 1.848 1.881 1.869 1.959 1.878 Média por ano 0,69 1,73 1,33 1,43 0,75 0,83 AC Acompanhar Cônjuge Média do período 1,1261 Fonte: NPD/SEI/UFSC Portanto: 1,1261 faltas x 6,6667 horas/dia = 7,5074 horas f) Afastamentos: Ensino e Capacitação – conforme Lei no 8.112 (11/12/90), é concedida licença aos servidores que se ausentarem para a capacitação profissional. A Tabela 6 identifica tais ocorrências. Tabela 6: Identificação das faltas por Ensino e Capacitação no período de 1998 a 2003. 8 Cód. Ensino e Capacitação 1998 1999 2000 2001 2002 2003 4.157 3.328 4.069 5.144 2.935 4.390 Colabor. Inst. Ensino c/ônus - - - - - 153 LIC Licença Capacitação - - 517 795 5.368 2.899 Total de dias 4.157 3.328 4.586 5.939 8.303 7.442 Total de professores 1.869 1.848 1.881 1.869 1.959 1.878 Média por ano 2,22 1,80 2,44 3,18 4,24 3,96 DC Disposição Cedencia c/ônus IE Média do período 2,9736 Fonte: NPD/SEI/UFSC Portanto: 2,9736 faltas x 6,6667 horas/dia = 19,8241 horas g) Afastamentos: Atividades Políticas – conforme Lei no 8.112 (11/12/90), concede-se auxílio aos servidores, quando assim optarem pelo recebimento, em cumprimento as questões de nível eleitoral/político, conforme resumo na Tabela 7. Tabela 7: Identificação das faltas para Atividades Políticas no período de 1998 a 2003. Cód. Atividades Políticas 1998 1999 2000 2001 2002 2003 LAP Licença Atividade Política 737 639 825 638 823 639 MV Mandato Vereador Rem. Cargo - - - 497 638 639 MVS Mandato Vereador Rem. Cargo - 256 365 - - - - - - - 6 - 737 895 1.190 1.135 1.467 1.278 Total de professores 1.869 1.848 1.881 1.869 1.959 1.878 Média por ano 0,39 0,48 0,63 0,61 0,75 0,68 SE Serviço Eleitoral Total de dias Média do período 0,5913 Fonte: NPD/SEI/UFSC Portanto: 0,5913 faltas x 6,6667 horas/dia = 3,9420 horas h) Licença Prêmio – os servidores públicos federais possuem o benefício de 90 (noventa) dias de descanso remunerado após completarem 5 (cinco) anos de 9 trabalho. Assim, listam-se os principais dados, a seguir, para o cálculo desta variável. Dias no ano: 365 Anos p/ Licença: 5 Prêmio: 90 dias Portanto: (90 / 5) x 6,6667 horas/dia = 120,0006 horas Como resultado das variáveis apresentadas, tem-se que as horas não trabalhadas somam 830,2886 horas, cujo Quadro 1, a seguir, apresenta um resumo das mesmas. Quadro 1: Resumo das variáveis que compõem as horas não trabalhas. HORAS NÃO TRABALHADAS Detalhamento Repouso semanal remunerado Feriados Férias Horas 287,6205 68,8890 300,0015 Afastamentos – Enfermidade 22,5035 Afastamentos - Faltas Legais Afastamentos - Ensino e Capacitação 7,5074 19,8241 Afastamentos – Atividades Políticas 3,9420 Licença Prêmio 120,0006 Total 830,2886 Fonte: Dados da pesquisa 3.1.3 Horas efetivamente trabalhadas Para o cálculo do número total de horas efetivamente trabalhadas (HET) no ano, deve-se subtrair do tempo à disposição da instituição as horas não trabalhadas, conforme se demonstra a seguir: HET/Ano = tempo à disposição da instituição ( - ) horas não trabalhadas HET/Ano = 2.433,3455 hs – 830,2886 hs HET/Ano = 1.603,0569 horas 3.2 Vencimentos e vantagens do cargo em estudo (R$/mês) Para completar a pesquisa, identificam-se as remunerações que contemplam o salário do professor objeto do estudo, com base nos valores de dezembro de 10 2003. Assim, apresentam-se as diversas variáveis (rubricas) que compõem o referido salário mensal. a) Vencimento básico – conforme Lei no 8112/90, art. 41, remuneração é o vencimento do cargo efetivo, acrescido das vantagens pecuniárias permanentes estabelecidas em lei. Vencimento básico 1 R$ 1.179,51 b) Adicional tempo de serviço – o adicional por tempo de serviço é devido à razão de 1% por ano de serviço efetivo prestado à União, Autarquias Federais e Fundações Públicas Federais (incluídas as Instituições Federais de Ensino autárquicas e fundacionais). O pagamento do Adicional por Tempo de Serviço é feito juntamente com a remuneração do mês, e tem por base de cálculo o Vencimento Básico do cargo efetivo ainda que investido, o servidor, em função ou cargo de confiança. (Art. 67 da Lei no 8.112/90 - revogado pela MP no 2.08836/2001). Adicional tempo de serviço 1 7 anos) R$ 82,57 - 7% s/ salário (após 1996 - c) Auxílio alimentação – é o auxílio concedido aos servidores civis das administrações diretas, autárquicas e fundacionais sujeito à jornada de trabalho de 40 (quarenta) horas semanais. O artigo 3o da Lei no 9.527/97 cita: “O art. 22 da Lei no 8.640, de 17 de setembro de 1992, passa a vigorar com a seguinte redação: Art. 22. O Poder Executivo disporá sobre a concessão mensal do auxílio-alimentação por dia trabalhado, aos servidores públicos federais civis ativos da Administração Pública Federal direta, autárquica e fundacional”. Auxílio Alimentação R$ 126,00 d) Gratificação de Atividade Executiva (GAE) – a Gratificação de Atividade Executiva (GAE) é devida a servidores ativos e inativos. A base de cálculo da GAE é somente sobre o vencimento básico do cargo efetivo, não considerado outros rendimentos, mesmo que integrantes da remuneração do servidor, como por exemplo, incorporação de chefia (décimos) e horas extras incorporadas. Os percentuais da Gratificação de Atividade Executiva são fixados em lei, tendo sido instituída no percentual de 80% (oitenta por cento) e atingido o total de 160% (cento e sessenta por cento) em 1º de junho de 1994. (Art. 4, da Lei no 8676/93). GAE 160% vencimento básico R$ 1.887,22 e) Gratificação de Estímulo à Docência no Magistério Superior (GED) – é devida aos ocupantes dos cargos efetivos de Professor de 3o grau lotados e em exercício nas Instituições Federais de Ensino Superior, vinculadas ao Ministério da Educação e do Desporto – MEC e aos ocupantes dos cargos efetivos de 1 Tabela de remunerações dos servidores públicos federais 11 Professor do Magistério Superior das Instituições Federais de Ensino Superior – Militares. Conforme Art. 2o da Lei no 9.678/98, a GED é devida em conjunto, de forma não cumulativa com a GAE. GED 140 pontos x R$ 16,75 1 R$ 2.345,00 f) Vantagem Pessoal Nominalmente Identificada (VPNI) – de acordo com o Art. 62 da Lei no 8112/90, fica transformada em Vantagem Pessoal Nominalmente Identificada – VPNI a incorporação da retribuição pelo exercício de função de direção, chefia ou assessoramento, cargo de provimento em comissão ou de Natureza Especial a que se referem os arts. 3o e 10 da Lei no 8.911, de 11 de julho de 1994, e o art. 3o da Lei no 9.624, de 2 de abril de 1998. VPNI R$ 107,16 g) Vantagem Pecuniária Individual (VPI) – a Lei n no 10.698, de 2 de julho de 2003, dispõe sobre a instituição de vantagem pecuniária individual devida aos servidores públicos civis da Administração Federal direta, autárquica e fundacional. Assim, de acordo com o seu Art. 1o, fica instituída, a partir de 1º de maio de 2003, vantagem pecuniária individual devida aos servidores públicos federais dos Poderes Executivo, Legislativo e Judiciário da União, das autarquias e fundações públicas federais, ocupantes de cargos efetivos ou empregos públicos, no valor de R$ 59,87 (cinqüenta e nove reais e oitenta e sete centavos). VPN R$ 59,87 h) Adicional de Férias – de acordo com o Decreto no 94.664, de 23 de julho de 1987, Art. 38, ao docente em efetivo exercício são concedidos quarenta e cinco dias de férias anuais, que podem ser gozados em um ou dois períodos. Independentemente de solicitação, é pago ao servidor, por ocasião das férias, um adicional correspondente a 1/3 (um terço) da remuneração do período das férias. Assim, parte-se de alguns dados: Vencimento básico Adicional tempo de serviço Grat. Ativ. Exec. (GAE) Grat. Est. Docência (GRD) Vant. Pessoal Nom. Id. (VPNI) R$ 107,16 Vant. Pec. Individual (VPI) R$ 59,87 Total R$ 5.661,33 R$ 1.179,51 R$ 82,57 R$ 1.887,22 R$ 2.345,00 Para se calcular o adicional de férias, tem-se o seguinte: Férias de 45 dias, ou 1,5 do total R$ 8.491,99 Adicional 1/3 férias, ou 33% Valor por mês (dividir por 12) R$ 2.830,66 R$ 235,89 12 Adicional de férias R$ 235,89 i) Gratificação Natalina – A gratificação natalina corresponde a 1/12 (um doze avos) da remuneração a que o servidor faz jus no mês de dezembro, por mês de exercício no respectivo ano. A gratificação é paga até o dia 20 (vinte) do mês de dezembro de cada ano. Assim, com base nos dados: Vencimento básico R$ 1.179,51 Adicional tempo de serviço Grat. Ativ. Exec. (GAE) R$ R$ 1.887,22 Grat. Est. Docência (GRD) R$ 2.345,00 Vant. Pessoal Nom. Id. (VPNI) R$ 107,16 Vant. Pec. Individual (VPI) R$ 59,87 Total 82,57 R$ 5.661,33 Para se calcular a gratificação natalina, deve-se dividir por mês (dividir por 12). Gratificação Natalina R$ 471,78 Assim, com base na remuneração de dezembro de 2003, tem-se um total por ano, conforme a seguir, para o professor em questão, cujo resumo apresenta-se no Quadro 2. TOTAL R$ 6.495,00 / mês x 12 meses = R$ 77.940,00 / ano Quadro 2: Resumo da remuneração do professor. VENCIMENTOS E VANTAGENS R$ Vencimento básico 1.179,51 Adicional tempo de serviço 82,57 Auxílio alimentação 126,00 Gratificação de Atividade Executiva - GAE 1.887,22 Gratificação de Estímulo à Docência no Mag. Superior GED 2.345,00 Vantagem Pessoal Nominalmente Identificada - VPNI 107,16 Vantagem Pecuniária Individual - VPI 59,87 Adicional de Férias 235,89 13 Gratificação Natalina 471,78 Total de vencimentos e vantagens / Mês 6.495,00 Total de vencimentos e vantagens / Ano 77.940,00 Fonte: Dados da pesquisa 4 CONCLUSÃO Com as informações apresentadas de horas efetivamente trabalhadas e total das remunerações por ano, pode-se calcular o custo da hora efetivamente trabalhada do cargo em estudo pela simples divisão da segunda variável pela primeira. Assim: R$ 77.940,00 / 1.603,0563 horas = R$ 48,62 / hora efetivamente trabalhada. Portanto, identifica-se neste estudo o custo do trabalho de um Professor Adjunto 4, em regime de dedicação exclusiva, com 10 anos de serviço em média, que percebe dos cofres públicos o valor de R$ 48,62 (quarenta e oito reais e sessenta e dois centavos) por hora efetivamente trabalhada, destacando-se o resultado do seu trabalho profissional como um benefício para a sociedade e uma medida de eficácia para a gestão da Instituição. A Universidade Federal de Santa Catarina, criada em 11 de fevereiro de 1932, tem grande representatividade no cenário empresarial uma vez que emprega e forma mão-de-obra qualificada para atender às necessidades do mercado nacional. Trata-se de uma Instituição de Ensino Superior mantida pela União e amparada pelo regime jurídico dos servidores públicos da União, conforme Lei no 8.112 de 11 de dezembro de 1990. Como qualquer tipo de organização, a instituição desenvolve atividades que consomem fatores de produção, que por sua vez possuem valores econômicos correspondentes. Do seu trabalho resultam atividades de ensino pesquisa e extensão como um bem econômico tão valioso quanto qualquer outro que se negocie no mercado. Assim, as atividades desenvolvidas pela UFSC não apenas consomem recursos, mas também geram receitas e conseqüentemente resultado, que podem ser avaliados por meio de comparações com outras instituições de ensino superior do Brasil. Além disso, o resultado do estudo permite que a sociedade avalie os resultados (benefícios) em relação ao custo social de manter a instituição em funcionamento, já que os recursos investidos são públicos e, portanto, da própria sociedade. 5 REFERÊNCIAS BIBLIOGRÁFICAS BASTOS, R.C. Sistemas de custos para Universidades Federais Autárquicas. Revista de Administração Pública, n. 3, jul/set, FGV, 1987. 14 BRASIL. Decreto no 94.664, de 23 de julho de 1987. Aprova o Plano Único de Classificação e Retribuição de Cargos e Empregos de que trata a Lei no 7.596, de 10 de abril de 1987. _______. Emenda Constitucional no 19, de 4 de junho1998. _______. Lei no 9.678 de 03 de julho de 1998. Institui a Gratificação de Estímulo à Docência no Magistério Superior e dá outras providências. _______. Lei no 8.112, de 11 de dezembro de 1990. Dispõe sobre o regime jurídico dos servidores públicos civis da União, das autarquias e das fundações públicas federais. _______. Lei no 9.527, de 10 de dezembro de 1997. Altera dispositivos das Leis no s 8.112, de 11 de dezembro de 1990, 8.460, de 17 de setembro de 1992, e 2.180 de 5 de fevereiro de 1954 e dá outras providências. _______. Lei no 9.640, de 25 de maio de 1998. Dispõe sobre o número de Cargos de Direção Funções Gratificadas das Instituições Federais de Ensino Superior, dos Centros Federais de Educação Tecnológica, das Escolas Agrotécnicas Federais, das Escolas Técnicas Federais, das Instituições Federais de Ensino Militar, e dá outras providências. _______. Portaria no 475, de 26 de agosto de 1987. Expede Normas Complementares para a execução do Decreto no 94.664, de 23 de julho de 1987. FURTADO, Renata. Custo da mão-de-obra na construção civil: um estudo comparativo do contrato de trabalho por prazo determinado X indeterminado. Monografia. Trabalho de Conclusão de Curso de Graduação em Ciências Contábeis, Universidade Federal de Santa Catarina, 2001. MARTINS, Eliseu. Contabilidade de Custos. 9. ed. São Paulo: Atlas, 2003. SANTOS, Luís P. G. Uma contribuição sobre a avaliação de desempenho das instituições federais de ensino superior: uma abordagem da gestão econômica. In: Revista de Contabilidade & Finanças, USP: São Paulo. 2002. VOGT, Carlos. O drama das Universidades Federais. In: Folha de São Paulo, São Paulo: 2003. 15 ANEXO III - FORMULÁRIO DESCRITIVO LABORATÓRIO Orientações para preenchimento: as informações do item 1 são da instituição de ensino superior e para o coordenador do projeto nesta instituição. O item 2 solicita declaração objetiva, dentre os objetos de contratação, dos produtos que a instituição considera-se apta para desenvolver. No item 3 relacionar quais laboratórios serão informados no Anexo 1ª. No item 4 devem ser prestadas informações descritivas sucintas das condições dos laboratórios, preenchendo, a partir deste, um formulário (Anexo III A) para cada laboratório . 1. INSTITUICAO DE ENSINO SUPERIOR Nome: C.N.P.J.: Endereço: Cidade: UF: CEP: Fone/Fax E- mail: Nome do Coordenador do Projeto: C.P.F. do Coordenador: C.I/Órgão Expedidor/Data Titulação: Endereço: Cidade: UF: CEP: Fone/Fax: E- mail: 2. LINHAS DE TRABALHO – Áreas que a instituição se considera apta para desenvolver estudos. Tipo de Monografia ( ) Revisão bibliográfica ( ) Monografia de matéria-prima ( ) Monografias de especialidades farmacêuticas ( ) Monografias de plantas medicinais Capacidade operacional de produtos/ano ANEXO III - FORMULÁRIO DESCRITIVO DO LABORATÓRIO 1 3. LABORATÓRIOS – Informe os laboratórios que serão descritos no anexo IIIA. ANEXO III - FORMULÁRIO DESCRITIVO DO LABORATÓRIO 2 ANEXO III A - INFORMACOES SOBRE OS LABORATORIOS Observação: Para cada laboratório, preencher a partir deste campo. 1. DENOMINACAO DO LABORATORIO 1.1. ESCOPO DE ATUAÇÃO Descrição Capacidade operacional de produtos/ano Revisão bibliográfica Métodos Gerais Monografia de matéria-prima Monografia de produto acabado Sólidos Líquidos Semi-sólidos Semi-sólidos Estéreis Fitoterápicos Gases Perfil de dissolução Estudos de estabilidade Ensaios microbiológicos Ensaios biológicos Ensaios físico-químicos Ensaios físicos Pirogênios Endotoxinas bacterianas Esterilidade Monografia de plantas medicinais (grupos químicos) Alcalóides Fenólicos Saponinas Anexo III A – Formulário Descritivo por Laboratório 1 Cumarinas Flavonóides Taninos Derivados Antracênicos Óleos Essenciais Terpenos (di, sesqui, tri, tetra) Monografia de Plantas Medicinais com desenho botânico Outro (s) – especificar 1.2. Pessoal (disponível ao projeto) Descrição Quantidade Pesquisador/Professor Farmacêutico Outra formação de nível superior (especificar) Técnico de Laboratório Técnico Administrativo Bolsista Graduação Bolsista Pós - Graduação 1.2.1. Qualificação/experiência (descrição sucinta) Qualificação do pessoal citado e sua formação/titulação. Participação em estudos da farmacopéia brasileira ou envolvimento com outros projetos/estudos similares. 1.3. Instalações disponíveis para o projeto - Descrição sucinta, no que couber. Área física (piso, parede, teto, revestimentos, etc.) Anexo III A – Formulário Descritivo por Laboratório 2 Área para análises microbiológicas Instalações de água, gás, energia elétrica (informar sinalização) 1.4. Equipamentos Item Equipamento 1 Item Equipamento Agitador (es) 29 Espectrofotômetros - VIS 2 Aparelho - Ponto de fusão 30 Estufa a vácuo 3 Aparelho Karl Fischer 31 Estufa bacteriológica 4 Autoclave 32 Estufa de secagem 5 Balança para animais 33 Fotômetro - IR 6 Balança analítica 34 Fotômetro de chama 7 Balança com lâmpada IV 35 Freezer 8 Banho ultra-sônico 36 Friabilômetro 9 Banho-maria 37 Lupa 10 Capela de fluxo laminar 38 Medidor do tamanho das partículas 39 Micrômetro 40 Microscópio Mufla 11 12 Quant. Cabine de segurança biológica Cabine de segurança química 13 Centrífuga 41 14 Condutivímetro 42 15 Conjunto para filtração 43 16 Contador de colônia 44 Potenciômetro 17 Cromatógrafo a gás 45 Purificador de água 18 Cromatógrafo a líquido 46 Purificador de água por osmose reversa 19 Deionizador de água 47 Refrigerador Quant. Pipeta manual monocanal volume ajustável Pipeta manual monocanal volume fixo Anexo III A – Formulário Descritivo por Laboratório 3 20 Densitômetro 48 Termômetro 21 Desintegrador 49 Viscosímetro 22 Destilador 50 23 Dinamômetro (Medidor de dureza) 51 24 Dispensador de cilindro 52 25 Dissolutor 53 26 Espectrofotômetro - UV 54 27 Espectrofotômetro – UV;VIS 55 28 Polarímetro 56 1.5. Sistema da Qualidade Sistema de Qualidade (Manual de Qualidade, Boas Práticas de Laboratório, Fluxos etc.) Procedimentos operacionais padrão (utilização de equipamentos, amostragem, descarte, armazenamento, manutenção, limpeza/higienização etc.) Calibração, verificação, certificação dos equipamentos utilizados no seu laboratório e controle de uso. Monitoramento ambiental de temperatura e umidade Vidraria utilizada no laboratório, classificação e calibração etc. Armazenamento e identificação dos materiais dos estudos farmacopeicos (amostras, colunas, padrões) Arquivamento da documentação referente à elaboração das monografias Anexo III A – Formulário Descritivo por Laboratório 4 Acesso à Farmacopéia Brasileira (1ª, 2ª, 3ª e 4ª Edição) e farmacopéias internacionais (nome e edição) Acesso a banco de dados 1.6. Biossegurança Descarte de resíduos (produtos químicos, produtos contaminados, vidraria quebrada etc.) Equipamento de proteção coletiva: chuveiro de emergência, lava-olhos, extintores de incêndio, etc. Equipamentos de proteção individual: óculos, máscaras, luvas etc. Armazenamento de Inflamáveis Anexo III A – Formulário Descritivo por Laboratório 5
Download