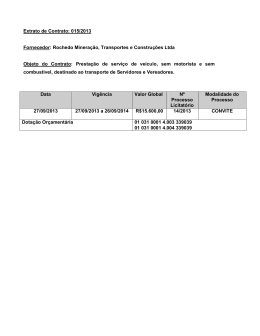
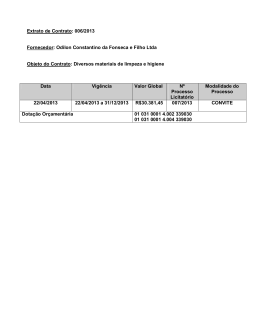
UNIVERSIDADE DO VALE DO ITAJAÍ JUARANA DAL MAS NANOEMULSÃO CONTENDO EXTRATO DA CASCA DE Rapanea ferruginea COM ATIVIDADE ANTI-INFLAMATÓRIA TÓPICA Itajaí (SC) 2015 UNIVERSIDADE DO VALE DO ITAJAÍ PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS ÁREA DE CONCENTRAÇÃO EM PRODUTOS NATURAIS E SUBSTÂNCIAS SINTÉTICAS BIOATIVAS JUARANA DAL MAS NANOEMULSÃO CONTENDO EXTRATO DA CASCA DE Rapanea ferruginea COM ATIVIDADE ANTI-INFLAMATÓRIA TÓPICA Dissertação submetida à Universidade do Vale do Itajaí como parte dos requisitos para a obtenção do grau de Mestre em Ciências Farmacêuticas. Orientadora: Prof. Dra. Ruth Meri Lucinda da Silva Co-orientadora: Prof. Dra. Tania Mari Bellé Bresolin Itajaí (SC) Março de 2015 FICHA CATALOGRÁFICA D15n Dal Mas, Juarana, 1981Nanoemulsão contendo extrato da casca de Rapanea ferruginea com atividade anti-inflamatória tópica / Juarana Dal Mas, 2015. 167f. ; il., tab. ; fig.; quad. Anexos Cópia de computador (Printout(s)). Dissertação (Mestrado) Universidade do Vale do Itajaí, Mestrado em Ciências Farmacêuticas. “Orientadora : Profª . Dra. Ruth Meri Lucinda da Silva ” Bibliografia : p. 153-166 1. Química farmacêutica. 2. Extratos vegetais – Uso terapêutico. 3. Nanoemulsão. 4. Myrsinaceae (Rapanea ferruginea). I. Título. CDU: 615.32 Josete de Almeida Burg – CRB 14.ª 293 CDU: 612.78 AGRADECIMENTOS Agradeço primeiramente a Deus, por me permitir seguir em frente e iluminar mais esta conquista profissional. Aos meus pais, Janaina e Wladimir, pelo apoio e incentivo para que eu alcançasse meus objetivos. Ao meu irmão Samuel, pelos conselhos e incentivo nos momentos de insegurança e dúvida. À minha orientadora e co-orientadora, Ruth M. Lucinda da Silva e Tania M. B. Bresolin, que com as suas experiências souberam me guiar durante o meu trabalho, com paciência e competência. À professora Ângela Malheiros, que forneceu as cascas da R. ferruginea e também me orientou em algumas dúvidas sobre a planta e seus marcadores, sempre solícita e paciente. À professora Márcia M. de Souza, que se dispôs à nos auxiliar, realizando o primeiro ensaio farmacológico do trabalho. À professora Kathryn A. B. S. da Silva, que com sua paciência e experiência, me orientou e auxiliou durante a realização dos ensaios farmacológicos. Agradeço também a amizade, conselhos e risadas. Aos professores Angélica Couto, Clóvis Rodrigues e Daisy Netz pelas sugestões realizadas ao longo do trabalho. À professora Dra. Joana Lea Meira Silveira que permitiu o acesso ao Centro de Microscopia Eletrônica na UFPR, para realização da análise morfológica das amostras. Gostaria de agradecer a todos os técnicos do laboratório que me auxiliaram na execução das análises. Às colegas Liliani e Bruna que me auxiliaram na execução do teste de irritação cutânea. Muito obrigada! Aos colegas e amigos, Tailyn, Roseni, Adriana, Marcel, Ângela, Fabile, Bruna, Thamiris, Gislaine, Silmara, Viviane pelas conversas animadas, pelos almoços, pelos jantares, pelas comemorações, pelos desabafos, pelos conselhos, pelas risadas, pelos momentos de filosofar sobre a origem de tudo. Espero que consigamos construir uma amizade cada vez mais sólida. Adoro todos vocês! À colega e amiga Tailyn Zermiani, por todo auxílio e paciência durante as análises por CLAE e em desvendar os mistérios da R. ferruginea! À Helenize Heyse Moreira e Juliano dos Santos da secretaria do Programa de Mestrado em Ciências Farmacêuticas, por todo auxílio todas as vezes em que precisei. Aos colaboradores da UNIVALI, Carla, Núbia, Joel, Viviane e Pedro por todo auxílio nos laboratórios. Aos auxílios prestados pelos técnicos do Biotério Central da UNIVALI. À empresa Gattefossé pela doação dos tensoativos Labrafil® M 1944 CS, Labrasol® e Capryol® 90, e à empresa Oxiteno pela doação do tensoativo Alkest® CSO 400.. Ao apoio financeiro do CNPQ, CAPES, FAPESC. Enfim, agradeço a todos que direta ou indiretamente contribuíram e me acompanharam durante a realização deste trabalho. Muito obrigada! “Sempre permaneça aventureiro. Por nenhum momento se esqueça de que a vida pertence aos que investigam. Ela não pertence ao estático. Ela pertence ao que flui. Nunca se torne um reservatório, sempre permaneça um rio.” (OSHO) NANOEMULSÃO CONTENDO EXTRATO DA CASCA DE Rapanea ferruginea COM ATIVIDADE ANTI-INFLAMATÓRIA TÓPICA Juarana Dal Mas Março/2015 Orientadora: Ruth Meri Lucinda da Silva, Doutora. Co-orientadora: Tania Mari Bellé Bresolin, Doutora. Área de concentração: Produtos Naturais e Substâncias Sintéticas Bioativas. Número de Páginas: 167. Nanoemulsões são dispersões com tamanho de gota em escala nanométrica, as quais vêm sendo empregadas como veículo tópico para fármacos com o objetivo de potencializar a atividade farmacológica. Estudos prévios com a casca da Rapanea ferruginea, demonstraram a atividade anti-inflamatória do extrato bruto quando administrado por via oral e endovenosa. O presente estudo teve por objetivo desenvolver uma nanoemulsão contendo extrato da casca de R. ferruginea e avaliar a atividade anti-inflamatória tópica. O extrato mole das cascas de R. ferruginea foi obtido e caracterizado. A partir da seleção do miristato de isopropila como fase oleosa, dos tensoativos Alkest® CSO400 e Span® 80 e da construção de diagramas de fases pseudoternários, foi desenvolvida uma nanoemulsão pelo método de inversão de fases por baixa energia. As nanoemulsões foram inicialmente caracterizadas quanto ao tamanho da fase interna, polidispesibilidade, homogeneidade, morfologia, potencial zeta, pH e comportamento reológico. As análises de teor dos marcadores do extrato (AMA e AMB) por CLAE, estabilidade acelerada, liberação in vitro, permeação cutânea empregando pele de porco em modelo de célula de Franz, irritação cutânea pelo método agarose overlay e ensaio pré-clínico da atividade anti-inflamatória em modelo de edema de orelha induzido pelo óleo de cróton em camundongos foram realizadas com as nanoemulsões contendo o extrato incorporado na fase oleosa. A obtenção da nanoemulsão foi confirmada pelo tamanho médio da fase interna de 47,88 ± 8,20 nm, com índice de polidispersibilidade de 0,228, potencial zeta de -34,7 ± 1,15 mV e forma esférica das gotículas, observada por microscopia eletrônica de transmissão. O pH foi adequado para aplicação tópica (5,25 ± 0,02) e o teor de AMA e AMB foi de 54,10 ± 0,08 µg/g (103,87%) e 53,03 ± 0,03 µg/g (109,25%) de formulação, respectivamente. O sistema apresentou comportamento pseudoplástico tixotrópico. O estudo de estabilidade acelerada demonstrou a influência do extrato diminuindo a estabilidade da nanoemulsão, havendo a necessidade de futuras adequações na formulação. Os marcadores do extrato apresentaram liberação in vitro mais retardada quando o extrato foi incorporado na nanoemulsão, demonstrando controle na sua cedência para o meio. Os marcadores do extrato não permearam a pele de porco, sendo detectados somente na formulação remanescente. O teste de irritação cutânea in vitro demonstrou grau moderado de irritação. O ensaio farmacológico in vivo evidenciou atividade anti-inflamatória tópica, sendo que a nanoemulsão apresentou um efeito 1,6 vezes superior ao do creme convencional contendo 0,13% do extrato incorporado. O mecanismo de ação anti-inflamatória envolveu a redução da liberação das citocinas TNF e MPO. Este trabalho demonstrou que a nanoemulsão desenvolvida é um veículo adequado à aplicação tópica do extrato de R. ferruginea potencializando a sua atividade anti-inflamatória tópica em modelo animal in vivo, requerendo a necessidade de futuras melhorias farmacotécnicas com o objetivo de melhorar a sua estabilidade e melhor compreensão acerca da permeação cutânea dos compostos ativos. Palavras-chave: Nanoemulsão. Rapanea ferruginea. Anti-inflamatório tópico. NANOEMULSION CONTAINING STEAM BARK EXTRACT OF Rapanea ferruginea WITH TOPICAL ANTI-INFLAMMATORY ACTIVITY Juarana Dal Mas March 2015 Supervisor: Ruth Meri Lucinda da Silva, Dr. Co-supervisor: Tania Mari Bellé Bresolin, Dr. Area of Concentration: Natural Products and Bioactive Synthetic Substances. Number of Pages: 167. Nanoemulsions are dispersed systems with droplet size in nanometric scale, that have been used as topical carrier for drugs with the aim of improving the pharmacological activity. Previous studies with the steam bark of the Rapanea ferruginea showed anti-inflammatory activity of the extract when administered orally and intravenously. This study aimed to develop a nanoemulsion containing R. ferruginea steam bark extract, and to evaluate the topical anti-inflammatory activity. The soft extract of stem bark of R. ferruginea was obtained and characterized. After selection of isopropyl myristate as oil phase and the surfactants Span 80 and Alkest® CSO400, and construction of pseudo ternary phase diagrams, the nanoemulsion was developed using the low-energy phase inversion method. The nanoemulsions were characterized initially by droplet size, polydispersity, homogeneity, morphology, zeta potential, pH and rheological behavior. The content analysis of the extract markers (MAA and MAB) by HPLC, accelerated stability, in vitro release, cutaneous permeation using porcine skin by the Franz cell model, skin irritation by the agarose overlay method, and preclinical assay of anti-inflammatory activity using the croton oil-induced ear oedema model were conducted with the nanoemulsions containing the extract incorporated in the oil phase. The nanoemulsion obtained was confirmed by the average droplet size of 47.88 ± 8.20 nm, with a polydispersity index of 0.228, zeta potential of -34.7 ± 1.15 mV, and spherical shape of the droplets, observed by microscopy electronic transmission. The pH was suitable for topical use (5.25 ± 0.02) and the content of the MAA and MAB was 54.10 ± 0.08 µg/g (103.87%) and 53.03 ± 0.03 µg/g (109.25%) of the formulation, respectively. The system showed pseudoplastic and thixotropic rheological behavior. The accelerated stability study shows that the extract decreases the nanoemulsion stability, requiring further adjustments in the formulation. The extract markers showed slower in vitro release when the extract was incorporated in the nanoemulsion, demonstrating control in its diffusion to the medium. The extract markers did not permeate the porcine skin, being detected only in the remaining formulation. The in vitro skin irritation assay showed a moderate degree of irritation. The in vivo pharmacological analysis showed topical anti-inflammatory activity. The nanoemulsion was 1.6 times more efficient than the conventional cream containing 0.13% of the extract. The mechanism of anti-inflammatory activity evolved a reduction in the release of the cytokines TNF and MPO. This work showed that the nanoemulsion developed is a suitable carrier for topical use of R. ferruginea extract, improving its topical anti-inflammatory activity in the animal model. Further technological improvements are needed, to adjust the stability and acquire a better understanding of the skin permeation of the active compounds. Keywords: Nanoemulsion. Rapanea ferruginea. Topical Anti-inflammatory. LISTA DE FIGURAS Figura 1 - Aspecto visual de uma nanoemulsão O/A e a estrutura das gotas........... 34 Figura 2 - Representação esquemática demonstrando o método de emulsificação por baixa energia, em que a quantidade de água adicionada à emulsão A/O é aumentada progressivamente até que a inversão de fase ocorra e a emulsão O/A seja formada. .................................................................................................................. 37 Figura 3 - Esquema demonstrando as diferentes formas de desestabilização de uma nanoemulsão. ................................................................................................................. 42 Figura 4 - Foto da árvore Rapanea ferruginea................................................................ 46 Figura 5 - Estruturas químicas dos ácidos mirsinoicos A, B e C. ................................ 47 Figura 6 - Foto demonstrativa da montagem da célula de Franz com nanoemulsão. ........................................................................................................................................... 79 Figura 7 - Foto demonstrativa do detalhe do sistema das células de difusão de Franz fechado e da coleta das amostras. ............................................................................. 79 Figura 8 - Perfil cromatográfico da solução extrativa e do extrato mole das cascas de R. ferruginea por CCD................................................................................................... 91 Figura 9 - Perfis cromatográficos por CLAE dos padrões de ácidos mirsinoicos A (a) e B (b); 260 nm para o AMA e 270 nm para o AMB................................................. 92 Figura 10 - Perfil cromatográfico por CLAE da solução extrativa das cascas de R. ferruginea. ....................................................................................................................... 92 Figura 11 - Perfil cromatográfico por CLAE do extrato mole das cascas de R. ferruginea. ....................................................................................................................... 93 Figura 12 - Aspecto das misturas no teste de solubilidade do extrato mole de R. ferruginea em diferentes óleos: (1) e (2) Poly: triglicérides de ácido cáprico e caprílico (TCC); (3) e (4) MI: miristato isopropila; (5) e (6) Cap 90: Capryol 90; (7) e (8) CeV: Cetiol V; (9) e (10) Ce868: Cetiol 868. .................................................... 95 Figura 13 - Aspecto das misturas no teste de solubilidade do extrato mole de R. ferruginea com óleo miristato de isopropila com diferentes tensoativos: (1) e (2) óleo + Labrafil® M 1944 CS; (3) e (4) óleo + Labrasol®; (5) e (6) óleo + Alkest® CSO 400; (7) e (8) óleo + Tween® 80; (9) e (10) óleo + Span® 80; (11) e (12) óleo + Tween® 20; (13) e (14) óleo + Capryol® 90. ............................................................... 97 Figura 14 - Aspecto das misturas no teste de solubilidade do extrato mole de R. ferruginea com o óleo triglicérides cáprico caprílico com diferentes tensoativos: (1) e (2) óleo + Labrafil® M 1944 CS; (3) e (4) óleo + Labrasol®; (5) e (6) óleo + Alkest® CSO 400; (7) e (8) óleo + Tween® 80; (9) e (10) óleo + Span® 80; (11) e (12) óleo + Tween® 20; (13) e (14) óleo + Capryol® 90. ............................................................ 97 Figura 15 - Diagrama de fases pseudoternários obtidos na otimização das nanoemulsões de miristato de isopropila, Capryol 90 e Alkest CSO 400, usando métodos diferentes: titulação e ponto a ponto......................................................... 101 Figura 16 - Diagrama de fases pseudoternários obtidos na otimização das nanoemulsões de miristato de isopropila, Alkest CSO 400 e Span 80, usando métodos diferentes: titulação e ponto a ponto......................................................... 103 Figura 17 - Diagrama de fases pseudoternários obtidos na otimização das nanoemulsões de miristato de isopropila, Capryol 90 e Tween 80, usando métodos diferentes: titulação e ponto a ponto. ........................................................................ 105 Figura 18 - Gráficos representativos da distribuição do tamanho da fase interna da nanoemulsão sem extrato (A) e da nanoemulsão com extrato (B), com seus respectivos gráficos de taxa de correlação correspondentes (A1 e B1). ............ 119 Figura 19 - Micrografias eletrônicas obtidas após coloração negativa da nanoemulsão sem extrato (A) e da nanoemulsão com extrato (B). Aumento de 15.000x........ 120 Figura 20 - Perfil de viscosidade da nanoemulsão veículo (imagem à esquerda) e da nanoemulsão contendo 0,13% de extrato mole das cascas de R. ferruginea (imagem à direita)......................................................................................................... 121 Figura 21 - Perfis cromatográficos por CLAE do extrato mole de R. ferruginea, da nanoemulsão contendo 0,13% de extrato mole de R. ferruginea e da nanoemulsão veículo, em 270 nm. ..................................................................................................... 122 Figura 22 - Fotografia demonstrando o aspecto visual das nanoemulsões branco e com extrato após o término do estudo de estabilidade acelerada, expostas a temperatura ambiente e a 40 °C. ............................................................................... 125 Figura 23 - Perfis de viscosidade das nanoemulsões com (NE 0,13%) e sem extrato (NE branco) durante o estudo de estabilidade acelerada no tempo zero, e após exposição a temperatura ambiente nos tempos 30, 90 e 180 dias...................... 126 Figura 24 - Perfis de viscosidade das nanoemulsões com (NE 0,13%) e sem extrato (NE branco) durante o estudo de estabilidade acelerada no tempo zero e após exposição a temperatura de 40 °C nos tempos 30, 90 e 180 dias. ..................... 127 Figura 25 - Fotografia de placa de cultivo celular do teste de irritação cutânea in vitro para as nanoemulsões e cremes contendo extrato de R. ferruginea.................. 132 Figura 26 - Fotografia de placa de cultivo celular do teste de irritação cutânea in vitro para o extrato mole da casca de R. ferruginea a 0,25% em DMSO.................... 132 Figura 27 - Perfil de liberação in vitro dos marcadores AMA e AMB do extrato mole de R. ferruginea 0,13% em propilenoglicol. n= 6 células. ..................................... 134 Figura 28 - Perfil de liberação in vitro dos marcadores AMA e AMB da nanoemulsão com 0,13% de extrato mole de R. ferruginea. n= 6 células. ................................. 135 Figura 29 - Perfil de liberação in vitro dos marcadores AMA e AMB do creme com 0,13% de extrato mole de R. ferruginea. n= 6 células. .......................................... 135 Figura 30 - Efeito dos cremes contendo extrato mole de R. ferruginea (RF 0,25%, 0,5% e 1,0%) e AMB (0,5% e 0,1%) administrados topicamente sobre edema de orelha induzido pelo óleo de cróton. ......................................................................... 142 Figura 31 - Efeito das nanoemulsões e cremes contendo extrato mole de R. ferruginea e dexametasona administrados topicamente sobre edema de orelha induzido por óleo de cróton. O edema de orelha foi mensurado após 6 h da indução com óleo de cróton. ....................................................................................................................... 143 Figura 32 - Fotomicrografias dos cortes histológicos das orelhas dos camundongos, corados em hematoxilina-eosina (HE), 6 horas após a indução do edema com óleo de cróton 2,5% (4x e 10x). (A) naive, (B) controle negativo, (C) controle positivo tratado com dexametasona 0,1%, (D) tratamento com veículo-creme, (E) tratamento com creme 0,13% extrato de R. ferruginea, (F) tratamento com veículonanoemulsão, (G) tratamento com nanoemulsão 0,13% extrato de R. ferruginea. As setas indicam a presença de infiltrado celular e as barras vermelhas indicam a espessura dérmica....................................................................................................... 146 Figura 33 - Efeito da nanoemulsão e creme contendo 0,13% de extrato de R. ferruginea sobre a atividade da mieloperoxidase no sobrenadante de homogeneizados das orelhas tratadas com óleo de cróton 2,5%. A atividade da MPO foi mensurada após 6 h da indução pelo óleo de cróton............................. 148 Figura 34 - Efeito da nanoemulsão e creme contendo 0,13% de extrato de R. ferruginea sobre a inibição da quimiocina derivada de queratinócitos (KC) induzida por óleo de cróton 2,5% em orelhas de camundongos. ........................................ 149 Figura 35 - Efeito da nanoemulsão e do creme contendo 0,13% de extrato de R. ferruginea sobre a produção de IL-1β e TNF, induzida por óleo de cróton 2,5% em orelhas de camundongos. ........................................................................................... 150 LISTA DE TABELAS Tabela 1 - Teor de marcadores AMA e AMB nas soluções extrativas das cascas de R. ferruginea. ....................................................................................................................... 89 Tabela 2 - Resultados das análises realizadas nos derivados vegetais das cascas da R. ferruginea. .................................................................................................................. 90 Tabela 3 - Valores de transmitância e absorbância da mistura de óleo e extrato mole de R. ferruginea no teste de solubilidade................................................................... 95 Tabela 4 - Resultados da análise de transmitância das amostras do teste de solubilidade do extrato mole de R. ferruginea em miristato de isopropila e diferentes tensoativos.................................................................................................... 98 Tabela 5 - Resultados da análise de transmitância das amostras do teste de solubilidade do extrato mole de R. ferruginea em triglicérides de ácido cáprico e caprílico e diferentes tensoativos. ............................................................................... 99 Tabela 6 - Formulações e características dos sistemas nanoemulsionados selecionados para o estudo de estabilidade preliminar. ........................................ 107 Tabela 7 - Resultados das análises no tempo inicial (ti) e final (tf) das nanoemulsões sem extrato submetidas aoestudo de estabilidade preliminar.............................. 108 Tabela 8 - Resultados do estudo de estabilidade preliminar para as amostras com e sem extrato mole de R. ferruginea, incorporado na fase aquosa, com e sem Sepigel®. ........................................................................................................................ 113 Tabela 9 - Tabela comparativa dos resultados da estabilidade preliminar para as formulações com o extrato de R. ferruginea incorporado na fase aquosa (linhas em cinza) e na fase oleosa com diferentes concentrações de propilenoglicol (linhas em branco). ................................................................................................................... 114 Tabela 10 - Tabela comparativa dos resultados da estabilidade preliminar para as nanoemulsões com 0,25% e 0,13% de extrato de R. ferruginea, incorporados na fase oleosa (linhas cinzas) e na fase aquosa (linhas brancas). ........................... 116 Tabela 11 - Análise da constante de Ostwald-de-Waele (K) e do índice de comportamento de fluxo (n) para a nanoemulsão veículo e para a nanoemulsão com extrato de R. ferruginea. ..................................................................................... 121 Tabela 12 – Resultado do estudo de estabilidade acelerada das nanoemulsões nas temperaturas ambiente e 40 ºC. ................................................................................ 124 Tabela 13 - Análise dos dados obtidos com o ensaio de liberação in vitro do AMB e AMA a partir do extrato mole em propilenoglicol, do creme e da nanoemulsão contendo extrato. .......................................................................................................... 138 Tabela 14 - Resultados do estudo de permeação cutânea para a nanoemulsão e creme contendo extrato de R. ferruginea e para o extrato de R. ferruginea em propilenoglicol, em modelo de célula de Franz, usando pele de porco. ............. 139 Tabela 15 - Porcentagem de inibição e média da espessura do edema de orelha induzido pelo óleo de cróton 2,5% nos grupos tratados com as nanoemulsões e cremes contendo extrato mole de R. ferruginea. .................................................... 144 LISTA DE QUADROS Quadro 1 - Condições cromatográficas para análise dos derivados vegetais de R. ferruginea por CLAE. ..................................................................................................... 68 Quadro 2 - Combinações de tensoativos e suas respectivas proporções empregadas no desenvolvimento das nanoemulsões. ................................................................... 70 Quadro 3 - Formulações dos sistemas nanoemulsionados selecionados para o estudo de estabilidade preliminar. ............................................................................................ 71 Quadro 4 - Composição do creme convencional utilizado nos ensaios farmacológicos, liberação in vitro e permeação cutânea in vitro......................................................... 73 Quadro 5 - Composição das nanoemulsões com e sem extrato mole de R. ferruginea e com e sem Sepigel® testadas no estudo de estabilidade preliminar.................. 74 Quadro 6 - Composição da nanoemulsão selecionada para incorporação do extrato mole de R. ferruginea. ................................................................................................... 75 Quadro 7 - Grau de reatividade para teste de difusão em ágar................................... 78 LISTA DE ABREVIATURAS AA – Ácido Araquidônico AAPH – 2,2’ – azobis (2-amidinopropano) dicloridrato ABTS+ - 2,2’-azino-bis (3-etilbenzotiazolin) 6-ácido sulfônico AFM – Atomic Force Microscopy AMA – Ácido mirsinoico A AMB – Ácido mirsinoico B AMC – Ácido mirsinoico C ANVISA – Agência Nacional de Vigilância Sanitária CCD – Cromatografia em Camada Delgada CLAE – Cromatografia Líquida de Alta Eficiência COX-2 – Ciclooxigenase 2 DLS – Dynamic Light Scattering ou Espalhamento Dinâmico de Luz DMEM – Dulbecco’s modified Eagle’s médium DMSO - Dimetilsulfóxido DPPH – 2,2 difenil-1-picrilhidrazil EHL – Equilíbrio Hidrófilo-lipófilo ELISA – Enzyme-linked Immuno-sorbent Assay ESEM – Environmental Scanning Eletron Microscopy FDA – Food and Drug Administration GRAS – Generally Recognized as Safe HE – Hematoxilina-eosina HELA – Adenocarcinoma de colo de útero HPLC – High-performance Liquid Chromatography HRP – Horseradish peroxidase IFN – Interferon IFN-γ – Interferon γ IL-1 – Interleucina 1 IL-1α – Interleucina 1α IL-1β – Interleucina 1β IL-2 – Interleucina 2 IL-8 – Interleucina 8 K562 – Leucemia mieloide/eritroleucemia Ph+ KC – Quimiocina derivada dos queratinócitos L929 – Linhagem de fibroblastos murino MET – Microscopia Eletrônica de Transmissão MEV – Microscopia Eletrônica de Varredura MFA – Microscopia de Força Atômica MIP-2 – Proteína inflamatória dos macrófagos-2 MPO - Mieloperoxidase NF-kB – Fator de Transcrição Nuclear kB NK – Células Natural Killer NO – Óxido Nítrico OECD – Organization for Economic Co-operation and Development OMS – Organização Mundial da Saúde ORAC – Oxygen Radical Absorbance Capacity PAF – Fator de Ativação Plaquetária PBS – Tampão salina fosfato PFA - Paraformaldeído PDI – Índice de Polidispersibilidade PIC – Phase Inversion Composition Methods ou Método de Inversão por Composição PIT – Phase Inversion Temperature Methods ou Método de Inversão por Temperatura PMSF – Phenylmethanesulfonylfluoride PTFE - Politetrafluoretileno ROS – Espécies Reativas de Oxigênio SEM – Scanning Eletron Microscopy TCC – Triglicérides de ácido cáprico e caprílico TEM – Transmission Eletron Microscopy TNF – Fator de Necrose Tumoral TPA – 12-O-tetradecanoilforbol acetato TSEM – Transmission Scanning Eletron Microscopy UV - Ultravioleta SUMÁRIO 1 INTRODUÇÃO ................................................................................................................... 27 2 OBJETIVOS ....................................................................................................................... 29 2.1 Objetivo Geral....................................................................................... 29 2.2 Objetivos Específicos: ......................................................................... 29 3 REVISÃO BIBLIOGRÁFICA ........................................................................................... 31 3.1 Nanoemulsões...................................................................................... 31 3.1.1 Desenvolvimento de Nanoemulsões ................................................................... 35 3.1.2 Caracterização das Nanoemulsões ..................................................................... 37 3.1.3 Estabilidade de Nanoemulsões ............................................................................ 41 3.2 Plantas Medicinais de Uso Tópico ...................................................... 43 3.3 Rapanea ferruginea Mez. (Myrsinaceae) ............................................. 45 3.4 Resposta Inflamatória .......................................................................... 50 3.4.1 Inflamação cutânea .................................................................................................. 54 3.4.2 Tratamento da Inflamação cutânea...................................................................... 56 4 MATERIAL E MÉTODOS ................................................................................................ 61 4.1 Material ................................................................................................. 61 4.2 Análise das cascas pulverizadas de R. ferruginea ............................. 65 4.3 Obtenção e caracterização dos derivados vegetais das cascas de R. ferruginea ................................................................................................... 65 4.3.1 Obtenção ..................................................................................................................... 65 4.3.2 Caracterização ........................................................................................................... 66 4.4 Estudos de pré-formulação das nanoemulsões ................................. 68 4.4.1 Determinação da solubilidade do extrato .......................................................... 68 4.4.2 Determinação do coeficiente de partição do extrato ...................................... 69 4.5 Desenvolvimento das nanoemulsões ................................................. 69 4.5.1 Construção do diagrama de fases pseudoternário ......................................... 69 4.5.2 Estudo de estabilidade preliminar e estabilidade termodinâmica das nanoemulsões sem extrato .............................................................................................. 71 4.5.3 Obtenção e estudo de estabilidade preliminar das nanoemulsões contendo extrato .................................................................................................................................... 72 4.6 Caracterização das nanoemulsões ...................................................... 75 4.6.1 Aspecto visual e estabilidade física .................................................................... 75 4.6.2 Análise morfológica ................................................................................................. 76 4.6.3 Análise da distribuição de tamanho de gota e potencial zeta ...................... 76 4.6.4 Comportamento reológico ...................................................................................... 76 4.6.5 Quantificação dos marcadores da R. ferruginea por Cromatografia Líquida de Alta Eficiência (CLAE) .................................................................................................. 76 4.7 Estudo de estabilidade acelerada da nanoemulsão............................ 77 4.8 Avaliação do potencial irritante das nanoemulsões contendo R. ferruginea ................................................................................................... 77 4.9 Análise de liberação in vitro da nanoemulsão contendo extrato da R. ferruginea ................................................................................................... 78 4.10 Estudo de permeação cutânea in vitro das nanoemulsões contendo extrato de R. ferruginea ............................................................................. 80 4.11 Ensaios farmacológicos da atividade anti-inflamatória .................... 82 4.11.1 Animais ...................................................................................................................... 82 4.11.2 Avaliação da atividade anti-inflamatória in vivo da R. ferruginea e do AMB incorporados em creme convencional e nanoemulsão ........................................... 83 4.11.3 Dosagem de citocinas em pele inflamada tratada com creme e nanoemulsões contendo R. ferruginea......................................................................... 84 4.11.4 Determinação da atividade da mieloperoxidase (MPO) em pele inflamada tratada com creme e nanoemulsões contendo R. ferruginea................................. 85 4.11.5 Análise histológica em pele inflamada tratada com creme e nanoemulsões contendo R. ferruginea ...................................................................................................... 86 5 RESULTADOS E DISCUSSÃO ...................................................................................... 87 5.1 Material vegetal..................................................................................... 87 5.1.1 Determinação de cinzas totais e cinzas insolúveis em ácido ...................... 87 5.1.2 Perda por dessecação ............................................................................................. 87 5.2 Obtenção e Caracterização dos derivados vegetais das cascas de R. ferruginea ................................................................................................... 88 5.3 Estudos de pré-formulação .................................................................. 93 5.3.1 Determinação da solubilidade do extrato .......................................................... 93 5.3.2 Determinação do coeficiente de partição do extrato mole............................ 99 5.4 Desenvolvimento das nanoemulsões ................................................100 5.4.1 Construção do diagrama de fases pseudoternário ....................................... 100 5.4.2 Estudo de estabilidade preliminar e estabilidade termodinâmica das nanoemulsões ................................................................................................................... 107 5.5 Obtenção e estudo de estabilidade preliminar das nanoemulsões contendo extrato de R. ferruginea .................................................................................................. 111 5.6 Caracterização das nanoemulsões contendo extrato de R. ferruginea ...... 117 5.7 Estudo de estabilidade acelerada da nanoemulsão ..........................122 5.8 Avaliação do potencial irritante das nanoemulsões contendo R. ferruginea ..................................................................................................131 5.9 Análise de liberação in vitro da nanoemulsão contendo extrato da R. ferruginea ..................................................................................................133 5.10 Estudo de permeação cutânea in vitro das nanoemulsões contendo extrato de R. ferruginea ............................................................................139 5.11 Ensaios farmacológicos ...................................................................141 6 CONCLUSÕES ................................................................................................................ 151 REFERÊNCIAS................................................................................................................... 153 ANEXO A – PARECER COMISSÃO DE ÉTICA NO USO DE ANIMAIS – CEUAUNIVALI ............................................................................................................................... 167 27 1 INTRODUÇÃO O desenvolvimento de novos veículos emulsionados para carrear ativos para aplicação tópica, visando solucionar problemas de biodisponibilidade ou ainda de estabilidade, é uma constante na indústria farmacêutica. Sistemas nanoestruturados, como lipossomas, microemulsões, nanoemulsões, nanopartículas lipídicas e poliméricas, são exemplos de carreadores para a liberação de ativos na pele, com o objetivo de modificar os perfis de liberação, permeação ou oclusão da pele (STRÖHER; ARMIJO; RAFFIN, 2010). As formulações lipossomadas apresentam certas limitações de aplicação, quanto à capacidade de incorporação do fármaco e à estabilidade. Já as microemulsões, exibem baixa capacidade relativa de concentração de ativos para a alta concentração de tensoativos, o que tem sido geralmente reconhecido como indutor de irritações cutâneas. Recentemente, por apresentarem vantagens como controle do tamanho da fase interna da emulsão, menor concentração de tensoativos e capacidade de dissolução de fármacos lipofílicos, as nanoemulsões têm sido muito estudadas como veículos para fármacos para diferentes vias de administração (endovenosa, tópica, oral ou ocular) e aplicações terapêuticas (ZHOU et al., 2010). A nanoemulsão se apresenta como uma emulsão transparente ou translúcida (TADROS et al., 2004) com tamanho de gota em escala nanométrica. Como as emulsões convencionais, as nanoemulsões, estão termodinamicamente em estado de não equilíbrio, no entanto, a cinética de desestabilização das nanoemulsões é lenta, aproximadamente meses, sendo consideradas cineticamente estáveis (ANTON; VANDAMME, 2011). Isto se deve ao tamanho reduzido das gotas que confere estabilidade frente à sedimentação ou cremeação, além de prevenir a floculação e a coalescência (ANTON; VANDAMME, 2011; SOLANS; SOLÈ, 2012). As características físico-químicas das nanoemulsões irão depender do tamanho da gota, viscosidade, densidade, inversão de fase, turbidez, índice de refração, sendo estas características mensuradas por várias técnicas, tais como: espectrofotômetro de luz dispersa, potencial Zeta, microscopia de transmissão eletrônica, concentração do fármaco, medida da viscosidade, entre outras (THAKUR et al., 2012). 28 Considerando as inúmeras aplicabilidades das nanoemulsões e suas vantagens, diversos estudos investigam a incorporação de ativos para aplicação tópica (ALAM et al., 2013; ALI et al., 2012; BERNARDI, 2011; BIDONE et al., 2014; FERNÁNDEZ-CAMPOS et al., 2013; HARWANSH et al., 2011; KHURANA; JAIN; BEDI, 2013; MÜLLER, 2013; PATHAN; SETTY, 2011; QUINTÃO et al., 2013; SAKEENA et al., 2010; SANDIG et al., 2013; SHAKEEL et al., 2010; ZHOU et al., 2010). Várias espécies vegetais têm sido estudadas como fonte de novos fármacos e seus extratos incorporados em sistemas nanométricos com o objetivo de aumentar seu potencial terapêutico (ALI et al., 2012; BERNARDI, 2011; BIDONE et al., 2014; FASOLO, 2007; HARWANSH et al., 2011; LIANG et al., 2012; OLIVEIRA, 2008; QUINTÃO et al., 2013; SAKULKU et al., 2009; WANG et al., 2008), havendo pouca literatura quanto à incorporação de extratos vegetais em nanoemulsões para uso tópico. A Rapanea ferruginea é uma espécie vegetal da família Mirsinaceae, conhecida popularmente como capororoca. Em algumas espécies foram isolados compostos chamados ácidos mirsinoicos A, B e C (BLUNT; CHEN; WIEMER, 1998; FRONZA; GIURADELLI, 2009; HIROTA et al., 2002; JANUÁRIO et al., 1992). Estudos realizados por pesquisadores no Núcleo de Investigações Químico-Farmacêuticas (NIQFAR) da Universidade do Vale do Itajaí (UNIVALI), isolaram o ácido mirsinoico B (AMB) do extrato clorofórmico das cascas de R. ferruginea (TURMINA, 2005) e o ácido mirsinoico A (AMA) do extrato etanólico dos frutos da R. ferruginea. Os extratos mole e seco da R. ferruginea apresentaram ação antinociceptiva, via oral e intraperitoneal, em dor de origem inflamatória, assim como o composto isolado AMB que apresentou ação anti-hipernociceptiva em modelos animais de dor persistente de origem inflamatória (ANTONIALLI et al., 2012). Estudos também demonstram a ação antiinflamatória tópica do AMA e AMB em edema de orelha induzido por TPA (DONG et al., 1999; HIROTA et al., 2002). Não havendo estudos a respeito da ação anti inflamatória tópica do extrato das cascas de R. ferruginea. Considerando o efeito antinociceptivo de origem inflamatória dos extratos da casca de R. ferruginea e o potencial das nanoemulsões como veículos para uso tópico, no presente estudo foi realizado o desenvolvimento de nanoemulsão contendo o extrato mole de R. ferruginea e avaliada a atividade anti-inflamatória tópica in vivo. 29 2 OBJETIVOS 2.1 Objetivo Geral Desenvolver nanoemulsão contendo extrato mole da casca de Rapanea ferruginea e avaliar a atividade anti-inflamatória tópica em modelo farmacológico in vivo. 2.2 Objetivos Específicos: Preparar e caracterizar quali e quantitativamente o extrato mole da casca de Rapanea ferruginea; Desenvolver a nanoemulsão contendo o extrato mole da casca de Rapanea ferruginea; Caracterizar a nanoemulsão com e sem extrato quanto aos aspectos físicos e físico-químicos; Avaliar in vitro a liberação e a permeação cutânea dos marcadores químicos do extrato incorporados na nanoemulsão; Avaliar a irritação cutânea da formulação usando modelo celular in vitro; Avaliar a atividade anti-inflamatória tópica da nanoemulsão e do creme contendo extrato da casca de R. ferruginea através do modelo de edema de orelha em camundongos, análise histológica dos tecidos inflamados e quantificação das citocinas (TNF, IL-1β, KC e MPO) nos tecidos inflamados. 30 31 3 REVISÃO BIBLIOGRÁFICA 3.1 Nanoemulsões A nanotecnologia tem desempenhado importante papel no desenvolvimento de novas alternativas para potencializar a ação de fármacos já presentes no mercado ou inovadores. A possibilidade que a nanotecnologia oferece de manipular fármacos e outros materiais em escala nanométrica pode alterar suas propriedades básicas e sua bioatividade. No caso dos veículos para fármacos, as características que podem ser manipuladas são a solubilidade, aumento da área superficial, controle de liberação e direcionamento para o sítio de ação (ESCOBAR-CHÁVEZ et al., 2012). Isso é de grande aplicabilidade para o desenvolvimento de medicamentos fitoterápicos, já que os extratos vegetais e fitoconstituintes apesar de demonstrarem grande potencial in vitro, possuem pouca ou nenhuma ação in vivo, devido à pobre solubilidade lipídica ou tamanho molecular impróprio ou ambos e, portanto são menos absorvidas e biodisponíveis (KESARWANI; GUPTA, 2013). A efetividade de qualquer medicamento fitoterápico depende da liberação de uma quantidade efetiva dos seus compostos ativos. Os extratos vegetais, em que existem vários componentes que favorecem sua ação sinérgica, os quais, em sua maioria, são solúveis em água, característica que reduz a biodisponibilidade dos extratos, podem ser incorporados em diferentes sistemas de liberação que aumentam o seu fluxo de liberação, assim como a capacidade de atravessar membranas biológicas ricas em lipídeos, melhorando a biodisponibilidade (KESARWANI; GUPTA, 2013). Como sistemas nanométricos empregados para melhorar a biodisponibilidade dos derivados vegetais podem ser citados os lipossomas, as microesferas, as nanopartículas, as transferossomas, os etossomas, as nanoemulsões e as microemulsões. Os sistemas de liberação baseado em fosfolipídeos, como os lipossomas, tem sido promissor para a efetividade e eficácia de plantas medicinais (KESARWANI; GUPTA, 2013). Na literatura são encontradas poucas referências às nanoemulsões como veículo para a incorporação de extratos vegetais. Os sistemas nanométricos possuem grande aplicabilidade quando se quer administrar medicamentos por via tópica. Embora a pele seja uma excelente via para 32 administração de medicamentos com ação tópica, local ou sistêmica, esta constitui uma importante barreira que dificulta a penetração de ativos, já que muitos não apresentam características que facilitam a sua penetração na pele (ESCOBARCHÁVEZ et al., 2012). As nanoemulsões são emulsões com tamanho das gotas da fase dispersa em escala nanométrica, encontrando-se na literatura variações entre 20, 100, 200, 300 nm e até acima de 500 nm, sendo estabelecido como critério a propriedade óptica e a aplicação, sendo as nanoemulsões do tipo óleo em água (O/A) mais estudadas que as nanoemulsões água em óleo (A/O) (SOLANS; SOLÈ, 2012). As nanoemulsões têm recebido enorme atenção nos últimos anos para aplicação em produtos de cuidados pessoais assim como veículo para administração de vacinas, antibióticos, anticonvulsivantes, anti-hipertensivos, anti-inflamatórios, cosméticos e preparações tópicas, podendo ser administrada por diferentes vias (GUGLIELMINI, 2008; GUTIÉRREZ et al., 2008; THAKUR et al., 2012). Extensas pesquisas têm surgido para o desenvolvimento, caracterização e aplicação de nanoemulsões já que são consideradas excelentes veículos para dissolução e transporte de ativos hidrofóbicos e/ou hidrofílicos, derivados vegetais e fitofármacos, proteinas e peptídeos (LU; QI; WU, 2012). O aumento do interesse na escolha das nanoemulsões como veículo na área farmacêutica se deve as suas vantagens como (SOLANS et al., 2005; TADROS et al., 2004; THAKUR et al., 2012): - possuem estabilidade frente a sedimentação ou cremeação, floculação e coalescência; - não são tóxicas nem irritantes quando comparadas às microemulsões, possibilitando a administração de fármacos por diferentes vias; - podem veicular fármacos hidrofílicos e lipofílicos; - como o tamanho das gotas é na escala nanométrica, a sua grande área interfacial aumenta a taxa de absorção ou permeação e reduz a variabilidade, aumentando a biodisponibilidade dos fármacos; - são adequadas para uso humano e animal; - protegem os fármacos da hidrólise e oxidação devido a sua encapsulação em gotas de óleo e pode também mascarar o sabor no caso da administração oral; - aumentam a permeação de ativos através da pele; 33 - o aspecto transparente, a fluidez e a ausência de pegajosidade fornecem às nanoemulsões características sensoriais mais agradáveis para aplicação em cosméticos; - empregam, relativamente, baixa concentração de tensoativos; - podem ser aplicadas como substitutas para lipossomas, os quais são muito mais instáveis. Na literatura o termo nanoemulsão pode aparecer referenciado como miniemulsões, emulsões ultrafinas, emulsões submicrométricas, etc. O termo nanoemulsão é preferível pois dá uma ideia de tamanho de nanoescala para as gotas, embora provoque erros de interpretação com o termo microemulsão (SOLANS et al., 2005). Os dois sistemas, nanoemulsão e microemulsão, são basicamente diferentes em termos de estabilidade termodinâmica. As microemulsões apresentam-se como um sistema termodinamicamente estável, já as nanoemulsões são instáveis termodinamicamente, porém estáveis cineticamente pois sua cinética de desestabilização é lenta, em torno de meses. As gotículas das microemulsões são fortemente afetadas, se rompendo mediante mudanças na temperatura e/ou diluições, enquanto as gotas das nanoemulsões se mantém estáveis nestas condições. Estas diferenças trazem consequências para as aplicações de um ou outro sistema, já que variando a via de administração poderão ocorrer mudanças termodinâmicas que interferem na estabilidade do sistema escolhido (ANTON; VANDAMME, 2011). Outro ponto que deve ser observado na diferenciação entre nanoemulsão e microemulsão é a ordem de adição dos componentes durante a sua formação. Na formulação de uma nanoemulsão esta ordem é muito importante, já que a mesma é formada somente se os tensoativos são misturados primeiro com a fase oleosa. Se eles forem misturados primeiramente com a água antes da adição da fase oleosa, irá formar somente uma macroemulsão. Já as microemulsões independem da ordem de adição dos componentes, após o período de equilíbrio (ANTON; VANDAMME, 2011). Visualmente a nanoemulsão apresenta-se com aspecto transparente ou translúcido, devido a característica do tamanho das gotas, conforme observado na Figura 1 (SOLANS et al., 2005). Burguera e Burguera (2012) relatam aspecto transparente com tamanho de gota entre 50 e 200 nm e translúcido ou turvo com tamanho de gota acima de 500 nm, sendo este aspecto visual dependente do raio da gota e da diferença no índice de refração entre as gotas e a fase contínua . 34 Contradizendo estes dados, diversos autores relatam que gotículas com tamanho acima de 100 nm apresentam coloração branca perdendo a transparência (KLANG et al., 2012), confirmado em diversos trabalhos que demonstram aspecto leitoso com gotas de tamanho variando entre 200 e 220 nm (SCHALBART; KAWAJI; FUMOTO, 2010), entre 150 e 212 nm (KELMANN et al., 2007) e entre 112 e 196 nm (ARAÚJO et al., 2011) e com aspecto transparente ou translúcido com tamanho de gota abaixo de 30 nm (MCCLEMENTS, 2012), azulada e transparente com tamanho de gota de aproximadamente 20 nm (PENG et al., 2010; SANDIG et al., 2013). Figura 1 - Aspecto visual de uma nanoemulsão O/A e a estrutura das gotas. Fonte: Gutiérrez et al., 2008. Segundo a definição de sistemas nanométricos da Agência Européia de Medicamentos (EMA – European Medicines Agency), estes deverão estar na faixa próximo de 0,2 nm até em torno de 100 nm (EMA, 2006). Já de acordo com as recomendações da Comissão Européia (EU Commission), um nanomaterial deve possuir pelo menos um dos seguintes critérios: uma ou mais das dimensões externas das partículas deverão estar na faixa entre 1-100 nm para mais que 1% do número de partículas; suas estruturas superficiais ou internas deverão ter suas dimensões na faixa de tamanho entre 1 e 100 nm; ou ter uma área superficial específica por volume maior que 60 m²/cm³, excluindo materiais que possuem partículas menores que 1 nm (MIHRANYAN; FERRAZ; STROMME, 2012). Considerando também que o aspecto visual de uma nanoemulsão é transparente ou translúcido e, os trabalhos que 35 demonstram que o tamanho de gotículas maior que 100 nm caracteriza uma nanoemulsão leitosa (MASON et al., 2006; MCCLEMENTS, 2012; SANDIG et al., 2013; SONNEVILLE-AUBRUN; SIMONNET; L'ALLORET, 2004), o tamanho das gotas de uma nanoemulsão terá que ser menor que 100 nm. O tamanho dos nanosistemas também podem caracterízá-los toxicologicamente. Baseado no tamanho dos sistemas nanométricos e a sua biodegradabilidade, Keck e Müller (2013) propõem um sistema de classificação, dividindo estes sistemas em quatro classes. Nanosistemas com tamanho acima de 100 nm e pouco abaixo de 1000 nm, biodegradáveis, pertencem à classe I, indicando nenhum ou menor risco toxicológico. Alguns podendo ser considerados sem nenhum risco em princípio, pois podem possuir baixo risco ao provocar efeitos adversos quando interagem com o sistema imune. À classe II pertencem os nanosistemas com tamanho maior que 100 nm, porém não-biodegradáveis. Nanosistemas com tamanho menor que 100 nm biodegradáveis, fazem parte da classe III. Sistemas pertencentes a classe II e III possuem médio risco toxicológico. Já sistemas com alto risco toxicológico, estão classificados na classe IV, com tamanho menor que 100 nm, podendo acessar todas as células, e não são biodegradáveis (KECK; MÜLLER, 2013). De acordo com esta proposta de classificação, nanoemulsões com tamanho da fase interna menor que 100 nm possuindo componentes biodegradáveis, são consideradas de médio risco toxicológico, pertencendo a classe III de risco. 3.1.1 Desenvolvimento de Nanoemulsões A composição básica das nanoemulsões utiliza óleo, tensoativo e fase aquosa (THAKUR et al., 2012), sendo a concentração do tensoativo menor do que o necessário para a formulação de microemulsões (cerca de 20-25% de tensoativo), ou seja, 5-10% de tensoativo para uma nanoemulsão (TADROS et al., 2004; THAKUR et al., 2012; ZHOU et al., 2010). Existem dois métodos principais que podem ser usados para a formação de uma nanoemulsão, métodos que empregam baixa energia e métodos de alta energia. Os métodos de alta energia são comumentes empregados para a geração de nanoemulsões. Eles empregam equipamentos como agitadores com alto poder de cisalhamento, homogeneizadores de alta pressão e métodos de sonicação, para a geração de pequeníssimas gotículas, no entanto, o alto custo devido a grande 36 quantidade de energia necessária para a formação das nanogotículas, tornam estes métodos não atrativos (SOLANS; SOLÈ, 2012). No método de baixa energia há formação espontânea de gotículas minúsculas em misturas de tensoativo-óleo-água quando as condições da formulação ou do ambiente são alteradas, ou por mudança da composição ou alteração de temperatura, isto é, inversão de fase e métodos de emulsificação espontânea (MCCLEMENTS, 2012). A grande vantagem do método de baixa energia é que não exige fornecimento de energia, ou seja, as propriedades fisico-químicas intrínsecas dos componentes geram pequenas gotículas, sendo apenas necessário uma simples agitação (ANTON; VANDAMME, 2011; SOLANS; SOLÈ, 2012). Em um estudo com três modelos de sistema ternário, água/tensoativo não iônico/óleo, Anton e Vandamme (2009) indicaram que os métodos de baixa energia seguem um simples mecanismo universal controlado pelo rápido deslocamento dos tensoativos do óleo para a fase aquosa, dando origem a nano-emulsificação espontânea. Isto é, a porção hidrofílica do tensoativo contido na fase oleosa é rapidamente dissolvida na porção aquosa, em temperatura ambiente, ocasionando a ruptura do óleo em nanogotículas, as quais são estabilizadas pelos tensoativos. O tamanho das gotas formadas é dependente da relação de peso óleo/tensoativo (ANTON; VANDAMME, 2011). A inversão de fase pode ser causada por mudanças na temperatura ou na composição. O método de inversão por temperatura (PIT – Phase Inversion Temperature Methods) é útil na preparação de nanoemulsão usando tensoativos não iônicos polietoxilados, sensíveis a alteração de temperatura que induz a mudanças na hidratação das cadeias polietoxiladas alterando a curvatura do tensoativo (SOLAN; SOLÈ, 2012). As cadeias polietoxiladas tornam-se desidratadas com o aumento da temperatura, tornando-se mais lipofílico, invertendo a fase da nanoemulsão O/A para A/O. Neste método o tamanho das gotas e a tensão interfacial tendem ao mínimo (LU; QI; WU, 2012). No método de inversão por mudanças na composição (PIC – Phase Inversion Composition Methods), a transição de fase é induzida por mudanças na composição durante a emulsificação, em temperatura constante. O método consiste na adição progressiva de um dos componentes (água) sobre a mistura dos outros componentes (óleo-tensoativo) e se aplica para utilização de outros tensoativos além daqueles do tipo etoxilado. Inicialmente, quando a água é adicionada progressivamente à fase oleosa, geralmente é uma microemulsão A/O; com o 37 aumento da proporção de água, o grau de hidratação das cadeias polietoxiladas do tensoativo aumenta progressivamente, alterando a curvatura espontânea do tensoativo de negativa para zero, equilibrando as propriedades hidrofílicas-lipofílicas do tensoativo (Figura 2). É um método considerado com grande potencial para a produção industrial, por ser de fácil execução, além de possibilitar o emprego de substâncias sensíveis à temperatura (SOLANS; SOLÈ, 2012). Figura 2 - Representação esquemática demonstrando o método de emulsificação por baixa energia, em que a quantidade de água adicionada à emulsão A/O é aumentada progressivament e até que a inversão de fase ocorra e a emulsão O/A seja formada. Fonte: Mcclements e Rao, 2011. 3.1.2 Caracterização das Nanoemulsões Para a caracterização das nanoemulsões são utilizadas diversas técnicas em que são avaliadas a aparência visual, pH, tamanho de partícula, carga da superfície da partícula, estabilidade química dos excipientes usados e localização do fármaco veiculado no sistema (KLANG et al., 2012). As nanoemulsões podem ser caracterizadas pela especificidade molecular dos constituintes, quantidade destes constituintes, e os tamanhos das estruturas de gotas após a formação da emulsão por agitação (MASON et al., 2006). Métodos espectrométricos são normalmente usados para monitorar a distribuição do tamanho 38 das gotas das nanoemulsões, dando informação sobre o tamanho de gota da população em tamanho nanométrico (BURGUERA; BURGUERA, 2012). O tamanho e a distribuição de tamanho das gotas são frequentemente analisados para caracterizar a estabilidade das nanoemulsões. Estes parâmetros podem ser determinados pela técnica de espalhamento dinâmico da luz (dynamic light scattering – DLS) ou também denominado espectroscopia de correlação de fótons. Como resultado, obtém-se a média do tamanho das gotas e o índice de polidispersibilidade (PDI). A distribuição do tamanho das gotas representa a homogeneidade do sistema nanoemulsionado, sendo um pequeno PDI, inferior a 0,2, indicativo de uma distribuição estreita no tamanho das gotículas e maior estabilidade (KLANG et al., 2012). Na análise por DLS, a dinâmica numa dispersão, como o movimento browniano das moléculas, provoca alterações na intensidade da difusão da luz com o tempo da análise, sendo que estas alterações aumentam com a diminuição do tamanho das gotas pelo fato de haver maior movimento browniano. Assim uma correlação entre as diferentes intensidades é possível em curtos intervalos de tempo. Com isso esta técnica traz algumas particularidades para uma análise completa, exigindo a forma esférica da gota em análise, diluição suficiente da amostra e grande diferença no índice de refração entre as fases (MÜLLER-GOYMANN, 2004). Estas particularidades trazem algumas limitações para a técnica, de acordo com Klang et al. (2012), como: - falha no reconhecimento de pequenas concentrações de grandes gotículas presentes em nanoemulsões, assim como a não detecção de outros agregados de tensoativos (vesículas lipossomais e estruturas lamelares); - variações na forma das gotas em análise não são inteiramente representadas; - podem ocorrer problemas de desestabilização do sistema como floculação ou a aparência de grandes agregados, em função da necessidade da diluição do sistema para suficiente transparência necessária à precisa determinação do tamanho das gotículas. As análises por microscopia eletrônica também são empregadas para estudar o tamanho das gotículas, além de identificar características morfológicas, como a estrutura interna. As técnicas de microscopia eletrônica comumente utilizadas na caracterização de nanoemulsões são microscopia eletrônica de transmissão – MET (transmission eletron microscopy - TEM), microscopia eletrônica de varredura – MEV 39 (scanning eletron microscopy - SEM) e microscopia de força atômica - MFA (atomic force microscopy - AFM) (KLANG et al., 2012). Pode-se, também, associar mais de uma técnica, como usar a MEV com um detector de transmisão de elétrons, microscopia eletrônica de varredura e transmissão (transmission scanning eletron microscopy - TSEM), assim como MET equipado com uma unidade de scanner (KLANG; VALENTA; MATSKO, 2013). Na MEV a imagem é formada ponto a ponto pelo escaneamento de uma emissão de elétrons concentrados sobre uma amostra sólida. A grande vantagem desta técnica é a profundidade do foco combinada ao método de formação da imagem, projetando áreas sombreadas e áreas recuadas mais escuras, tornando a imagem melhor interpretada pelo olho humano. As desvantagens são o tempo de exposição da amostra à emissão de elétrons para a geração da imagem, o que pode levar a danos, falta de detalhes internos da amostra e resolução limitada (KLANG et al., 2012; KLANG; VALENTA; MATSKO, 2013). O preparo das amostras consiste na secagem ou desidratação, podendo empregar álcool e congelamento, além do revestimento com partículas de ouro. Uma alternativa para análise de nanoveículos hidratados usando MEV é a microscopia eletrônica de varredura ambiental – MEVambiental (environmental scanning eletron microscopy, ESEM). Esta técnica se baseia no uso de um sistema a vácuo graduado de múltiplas aberturas, mantendo a pressão em torno de 5000 Pa. As amostras podem ser vistas sob vapor de água ou outros gases auxiliares. Porém a resolução não é suficiente para visualizar estruturas em nanoescalas (KLANG et al., 2012). A MET é análoga à microscopia óptica, porém não utiliza a luz para visualizar a amostra e, sim, emissão de elétrons. Esta técnica emprega o vácuo e a imagem obtida é resultado da interação da amostra com os elétrons, ou seja, dispersão de elétrons. A resolução na MET é proporcional à aceleração da voltagem dos elétrons, sendo que para sistemas coloidais são usadas voltagens entre 80 e 200 kV, e resolução entre 0,3 e 1,0 nm. Na análise de nanoemulsões, o preparo da amostra através do congelamento é mais adequado para a obtenção das imagens. Porém, se este método não está disponível, a técnica convencional empregando um contraste negativo pode ser uma opção (KLANG et al., 2012). A técnica de contraste negativo é frequentemente empregada para obter imagens de sistemas coloidais por MET, em que se pode visualizar o tamanho, a forma e a estrutura interna da amostra (KLANG et al., 2012). São usados como 40 agentes de contraste sais de metais pesados como tungstênio, molibdênio ou urânio, sendo que para nanoemulsões são frequentemente usados ácido fosfotúngstico ou suas soluções salinas ou acetato de uranila (ARAÚJO et al., 2011; BALI; ALI; ALI, 2010; DESAI; VYAS; AMIJI, 2008; GANTA; AMIJI, 2009; HATANAKA et al., 2010; KLANG et al., 2012; PATHAN; SETTY, 2011). Os metais pesados como constraste não devem interferir na secagem da amostra e formarem uma fina camada transparente e resistente aos danos da emissão de elétrons, ou seja, além de criarem um contraste, criam um suporte físico protetor para a amostra. Para a preparação da amostra, uma gota de nanoemulsão é colocada sobre uma grade de cobre revestida com carbono, em que é rapidamente adsorvida e, posteriormente, a solução aquosa do sal de metal pesado é aplicada para contrastar. A amostra é então secada e observada por MET a temperatura ambiente. A forte dispersão dos íons metálicos formam um escudo amorfo que envolve as gotas de óleo fracamente dispersas para melhorar o contraste na microscopia eletrônica, assim um grande contraste é visto nas imagens por MET, ou seja, as gotículas claras contrastam com o fundo mais escuro (KLANG et al., 2012). Na análise de nanoemulsões, os fatores que podem afetar a integridade estrutural da amostra são os mesmos tanto para MEV quanto para MET. Ambas as técnicas empregam etapas de secagem e fixação que afetam a estrutura e a morfologia, provocam encolhimento e agregação dos componentes do sistema, devendo-se, portanto, ter cuidado ao interpretar as imagens obtidas. Na MET o uso do vácuo pode provocar a evaporação dos componentes hidratados da nanoemulsão. O emprego de metais pesados como contraste pode levar a uma aparência seletiva da amostra dependendo do alcance ou reação deles com a amostra para ser detectado, podendo algumas partes do sistema ficarem invisíveis. O contraste aumentado na interface das gotas de óleo está relacionado a afinidade do agente contrastante com os componentes interfaciais. Deve-se otimizar a melhor técnica para o uso do contraste, como tipo e quantidade (KLANG et al., 2012). Estas técnicas podem resultar em imagens de um sistema alterado que não tem semelhança alguma com o sistema realmente formado. Em análises com MET em temperatura ambiente, a qualidade das imagens obtidas depende da eficácia do tensoativo em estabilizar as gotas de óleo. Destaca-se que o uso do congelamento na preparação de amostras para as técnicas MET e MEV (crio-MET e crio-MEV) proporciona uma visualização exata da morfologia das gotículas de óleo. O tratamento 41 criogênico de nanoemulsões antes da análise por MEV e MET resulta no estudo do seu estado morfológico inicial e imagens livres de artefatos (KLANG et al., 2012). Outras avaliações que podem ser realizadas para as nanoemulsões são potencial zeta, para mensurar a carga da superfície, e comportamento reológico (THAKUR et al., 2012). O potencial zeta está relacionado à estabilidade das dispersões coloidais, indicando a força de repulsão entre as partículas adjacentes igualmente carregadas. Um alto potencial zeta confere estabilidade quando o tamanho das gotículas é pequeno, indicando que o sistema será resistente à agregação das partículas. O valor alto para potencial zeta pode ser alto no sentido positivo (+30 mV) e negativo (-30 mV). Valores negativos para potencial zeta indicam que a formulação está negativamente carregada (BALI; ALI; ALI, 2010). Uma emulsão alcança o máximo de estabilidade quando o potencial zeta é maior que ± 30 mV (ARAÚJO et al., 2011). Vários fatores como tamanho médio, estrutura das gotículas, polidispersibilidade e viscosidade de cada fase da emulsão afetam sua estabilidade e propriedades, e os efeitos provocados por estes fatores são estudados pela reologia (EL-DIN et al., 2013; GILBERT et al., 2013). As emulsões e nanoemulsões podem variar em sua consistência de aspecto fluido para aspecto semissólido, exigindo medições sob várias deformações (ou tensões), sendo três diferentes medidas reológicas aplicadas: agitação em estado estacionário, estresse constante (deformação) e dinâmico (oscilatório). É muito importante realizar estas medições em função da temperatura para obter informações sobre a estabilidade física e consistência do produto. Estas medições reológicas empregadas para predizer a estabilidade de emulsões, relacionam-se com o estudo de estabilidade a longo prazo (6-12 meses) (TADROS, 2004). As propriedades do filme interfacial também podem ser estudadas a partir da reologia do filme interfacial, tais como a sua viscosidade e elasticidade. Estes estudos resultam em um entendimento sobre os vários processos de quebra ou separação de fases em emulsões (TADROS, 1994). 3.1.3 Estabilidade de Nanoemulsões Embora o tamanho pequeno das gotículas em uma nanoemulsão a torne resistente a desestabilização física, a perda de estabilidade das nanoemulsões pode ocorrer de muitas maneiras (figura 3), como separação gravitacional 42 (cremeação/sedimentação), floculação, coalescência e maturação de Ostwald (MCCLEMENTS, 2012; WOOSTER; GOLDING; facilmente visível SANGUANSRI, 2008) sendo qualquer indício de instabilidade por serem transparentes (SONNEVILLE-AUBRUN; SIMONNET; L'ALLORET, 2004). Figura 3 - Esquema demonstrando as diferentes formas de desestabilização de uma nanoemulsão. Fonte: McClements e Rao, 2011. As nanoemulsões podem perder a transparência com o tempo, devido ao aumento do tamanho da gota. Esta alteração pode estar relacionada com a preparação não adequada do sistema na análise de distribuição das gotas, e se não for estabilizada quanto à maturação de Ostwald, sendo este talvez o problema de instabilidade mais sério nas nanoemulsões (TADROS et al., 2004). A taxa de maturação de Ostwald se dá pela coalescência das gotas, com aumento no tamanho das nanogotículas como consequência da difusão molecular do óleo entre as gotículas através da fase contínua, levando a sua desestabilização com consequente sedimentação das mesmas (AMANI et al., 2010; WOOSTER; GOLDING; SANGUANSRI, 2008). A maturação de Ostwald segue o efeito de Kevin, em que emulsões com pequenas gotas tem maior solubilidade local do óleo que gotas grandes, devido à diferença nas pressões de Laplace provocada pela quebra do tamanho das gotículas pela intensa agitação durante o processo de formação da nanoemulsão (WOOSTER; GOLDING; SANGUANSRI, 2008). Esta desestabilização é proporcional à solubilidade do óleo na fase aquosa em emulsões O/A (SOLANS et 43 al., 2005). A adição de um segundo óleo ao sistema que tenha baixa solubilidade na fase aquosa (TADROS et al., 2004) e/ou o uso de um segundo tensoativo com o mesmo tamanho de cadeia alquil e maior grau de etoxilação que o primeiro (IZQUIERDO et al., 2005) podem ser soluções para a prevenção da maturação de Ostwald. Para a determinação da estabilidade das nanoemulsões leva-se em conta alguns fatores como a carga de superfície das gotículas (potencial Zeta), estrutura molecular dos tensoativos, proporção dos componentes hidrofílicos e lipofílicos, proporção de tensoativos e proporção na combinação dos mesmos, e estrutura molecular do óleo (AMANI et al., 2010). Em estudos para verificação de fatores que influenciam na estabilidade e que controlam o tamanho das gotículas em uma nanoemulsão contendo budesonida, triglicerídeos de cadeia média como óleo, polissorbato 80 como tensoativo e etanol como co-tensoativo, foi constatado que a energia total empregada durante a formação do sistema é um fator dominante no controle do tamanho das gotículas finais em uma nanoemulsão e a concentração do álcool controla o crescimento do tamanho das gotículas, neste sistema desenvolvido (AMANI et al., 2008; AMANI et al., 2010). A nanoemulsão inicial deve apresentar tamanho pequeno de gotículas, o que irá assegurar uma longa estabilidade cinética. Controlando a distribuição do tamanho das gotas e adicionando estabilizadores na formulação, como tensoativos, modificadores reológicos, ou retardatores de maturação de Ostwald, aumenta-se a estabilidade cinética das nanoemulsões (MCCLEMENTS, 2012). 3.2 Plantas Medicinais de Uso Tópico O uso de plantas para tratamento de doenças é milenar e teve origem na Índia e China. Segundo estimativa da OMS, o mercado mundial de medicamentos fitoterápicos e produtos naturais vale 62 bilhões de dólares e vai chegar aos 5 trilhões em 2050, com crescimento de cerca de 7% ao ano (PINTO, 2013). No Brasil, país com maior biodiversidade do planeta, tem-se importante conhecimento tradicional sobre o uso de plantas medicinais e potencial para pesquisas para o desenvolvimento de tecnologias e terapêuticas adequadas para o seu uso. Por meio da Política Nacional de Plantas Medicinais e Fitoterápicos, aprovada pelo Decreto Nº 5.813, de 22 de junho de 2006, o governo brasileiro 44 estabeleceu as diretrizes para atuar na área de plantas medicinais e fitoterápicos (BRASIL, 2006). O uso de plantas medicinais pela população tem aumentado na busca por terapias alternativas. Nos EUA estima-se que 50% da população utilize alguma forma de medicina alternativa, e muitos desses sem informar ao seu médico (BEDI;SHENEFELT, 2002). Na Alemanha, país onde se consome metade dos extratos vegetais comercializados na Europa, a auto-medicação com esta classe de medicamentos é muito comum também, embora 70% dos clínicos gerais alemães prescrevem ervas licenciadas (VEIGA JUNIOR; PINTO; MACIEL, 2005). Esta busca pela medicina alternativa vem de alguma falha da medicina tradicional ou porque os efeitos adversos são pouco percebidos pelos usuários quando os produtos são naturais (BEDI; SHENEFELT, 2002). Produtos a base de plantas são frequentemente usados na composição de produtos de uso tópico, na Alemanha 15% das plantas medicinais utilizadas pela população são para tratar doenças de pele (VEIGA JUNIOR; PINTO; MACIEL, 2005). Plantas usadas na área da dermatologia vem sendo testadas e pesquisadas, demonstrando significativa evidência científica para tratamento de patologias como psoríase, acne, dermatite atópica e outros problemas dermatológicos. No entanto, são poucos os dados científicos de estudos clínicos sobre o uso de plantas para tratamento dermatológico , pois o seu uso é grandemente baseado no conhecimento tradicional (BEDI; SHENEFELT, 2002; PINTO, 2013; REUTER; MERFORT; SCHEMPP, 2010). As plantas indicadas no tratamento de doenças cutâneas podem ter atividades antioxidante, anti-inflamatória, antibacteriana, antifúngica, anti-histamínica, estimulante da imunidade e fotoprotetora, além de reduzirem inflamação e prurido, acelerar a cicatrização de feridas, fortalecer os cabelos e agir como promotores antitumorais. Apesar do grande uso popular de plantas medicinais, existem numerosos casos de potenciais efeitos adversos em particular reações adversas cutâneas como dermatite alérgica de contato, dermatite de contato irritante, reações de fototoxicidade e urticária de contato (CORAZZA et al., 2009). Medicamentos à base de plantas geralmente contém diversos compostos ativos farmacologicamente exigindo um teste de eficácia muito mais complexo do que para medicamentos que empregam drogas sintéticas. Uma proposta para avaliação destes medicamentos é considerar o extrato da planta como um princípio ativo, no entanto, o extrato deve 45 estar suficientemente caracterizado. Esta caracterização é frequentemente realizada através da padronização do extrato através de um dos seus componentes chave, que pode ser a substância farmacologicamente ativa ou, quando não conhecida, um marcador desta substância. A padronização, no entanto, traz como incoveniente a consideração somente de uma ou duas substâncias, ficando os diversos outros componentes em segundo plano, e isto pode influenciar na eficácia e segurança do fitoterápico (ERNST, 2005). Isso demonstra a importância de mais pesquisas empregando plantas medicinais com o objetivo de evidenciar cientificamente suas propriedades terapêuticas e sua segurança. 3.3 Rapanea ferruginea Mez. (Myrsinaceae) A planta Rapanea ferruginea é uma das espécies da família Myrsinaceae, conhecida popularmente como canela-azeitona, camará, capororocaçu, capororoca-vermelha, capororoca, azeitona-do-mato, pororoca e capororoca-mirim (BACCARIN, 2010; PASCOTTO, 2007). R. ferruginea é uma espécie pantropical, encontrada no Brasil especialmente nas regiões litorâneas, como Bahia, Espírito Santo, Rio de Janeiro, Minas Gerais, São Paulo, Paraná, Rio Grande do Sul e Santa Catarina (COSTA, 2011). É uma árvore de porte médio com 6-12 m de altura e tronco de 30-40 cm de diâmetro (FRONZA; GIURADELLI, 2009), apresenta frutos pequenos 3-5 mm de diâmetro, globosos e de cor negro-arroxeadas quando estão maduros servindo de alimento para aves (PASCOTTO, 2007). As folhas são simples, alternadas no caule (FREITAS; CARRIJO, 2008), a casca externa é áspera de cor cinzento-rosada com a parte interna vermelha (LORENZI, 1992). Na medicina popular as folhas e as cascas da R. ferruginea são preparadas na forma de chás e indicada como diurética, no combate a doenças do trato urinário, pruridos, eczemas, erupções, urticária, reumatismo e doenças do fígado, no tratamento de processos inflamatórios e dolorosos, estes dois últimos confirmados por estudos biológicos (ANTONIALLI et al., 2012; CECHINEL FILHO et al., 2013; HESS et al., 2010). 46 Figura 4 - Foto da árvore Rapanea ferruginea. Fonte: Fronza e Giuradelli, 2009. Existem aproximadamente 100 espécies da família Myrsinaceae, que apresentam ácidos terpeno-p-hidroxibenzoicos e triterpenoides (HARDEN, 1990). Todas as espécies de Rapanea possuem como princípios ativos os derivados dos ácidos benzoico prenilados, os ácidos mirsinoicos. Há relatos de três espécies estudadas no Brasil, R. umbellata, R. lancifolia, R. guyanensis, das quais foram isolados os compostos ácidos mirsinoicos A (AMA), B (AMB) e C (AMC), figura 5 (HIROTA et al., 2002; JANUÁRIO et al., 1992), além de outros metabólitos secundários, como as benzoquinonas, entre elas a bis-(2,5-diidroxi-4-undecil-3,6benzoquinona) (FRONZA; GIURADELLI, 2009). Ácidos benzoicos prenilados foram isolados também da espécie R. myricoides Schltdl. (Myrsinaceae), incluindo o AMB (BLUNT; CHEN; WIEMER, 1998). 47 Figura 5 - Estruturas químicas dos ácidos mirsinoicos A, B e C. Fonte: Fronza e Giuradelli, 2009. Em estudos fitoquímicos das cascas da R. ferruginea foram isolados os ácidos benzoicos prenilados AMA, AMB e AMC (FRONZA; GIURADELLI, 2009). O AMB é um ácido benzoico prenilado de nome químico 5-carboxi-7-(3”, 3”dimetilalil)-2-(1-hidroxi-1, 5 dimetilex-4-enil) 2,3-dihidrobenzeno-furano encontrado em grandes concentrações nos extratos da raiz e cascas de R. ferruginea (BACCARIN, 2010; SILVA, 2013; TESTONI, 2004) e que pode ser quantificado por técnica cromatográfica líquida de alta eficiência (CLAE) (BACCARIN et al., 2011). Demonstrou-se que o AMB isolado da R. ferruginea apresenta efeito antinociceptivo tanto em relação à dor induzida quimicamente quanto por estímulo térmico, além da ação na reversão de processos hiperalgésicos (HESS, 2006), em modelos de hiperalgesia em animais com neuropatia diabética (GALVAN, 2007) e em modelos animais de dor persistente de origem inflamatória neuropática (ANTONIALLI, 2009; ANTONIALLI et al., 2012). Também evidenciou-se a ação anti-hiperglicemiante do AMB em animais diabéticos induzidos com aloxano (MATTOS, 2006), atividade antitumoral em Tumor Ascítico de Ehrlich (TESTONI, 2004) e ação anticolinesterásica (FILIPPIN, 2010). Esta última, inferior ao efeito do AMA em todos os tecidos cerebrais em ratos (FILIPPIN, 2010). Constatou-se sua atividade antileishmaniose (CECHINEL FILHO et al., 2013) e, juntamente com o AMA, apresentou atividade antibacteriana 48 contra bactérias gram-positivas (CRUZ et al., 2013). O AMB isolado a partir do extrato etanólico das cascas de R. ferruginea, apresentou citotoxicidade frente às linhagens K562 (33,38 ± 5,28 µg/mL) e NALM6 (44,77 ± 33,32 µg/mL) (TOMIO, 2011). Trabalhos realizados com o AMB isolado da espécie Myrsine seguinii, demonstraram atividade inibidora da produção de sulfeto de hidrogênio por patógenos periodontais in vitro e metilmercaptano envolvidos em problemas de halitose (ITO; NARISE; SHIMURA, 2008; ITO et al., 2010). Em extratos metanólicos desta mesma espécie, foram isolados os ácidos mirsinoicos A, B, C e F, os quais apresentaram atividade anti-inflamatória pela supressão do edema de orelha em ratos induzidos por TPA (12-O-tetradecanoilforbol-13-acetato). A porcentagem de inibição do edema para a dose de 1,4 µmol aplicado topicamente foi de 65% para o AMA, 83% para o AMB, 68% para o AMC e na dose de 0,56 µmol, 77% para o ácido mirsinoico F (HIROTA et al., 2002). O AMA isolado a partir do extrato etanólico dos frutos da R. ferruginea, segundo estudos realizados por Gazoni (2009), apresenta atividade anticolinesterásica in vitro através de ensaio bioautográfico em placas cromatográficas e em tecido cerebral de ratos (FILIPPIN, 2010), sendo estes resultados comprovados em estudo in vivo com melhora da cognição em modelo animal (COSTA, 2011). O AMA, do extrato etanólico das cascas da R. ferruginea, foi citotóxico frente à linhagem K562 (170,13 ± 32,67 µg/mL) (TOMIO, 2011). Estudo realizado para confirmar se o efeito anti-inflamatório do AMA suprime a proliferação celular usando o modelo do edema de orelha em ratos induzido por TPA, demonstrou, in vitro, que o AMA é um inibidor seletivo da DNA polimerase em mamíferos, sendo seu efeito maior frente a polimerase β em comparação com a polimerase α. In vivo, uma solução metanólica do AMA a 500 µg/40 µL, apresentou 65% de efeito inibitório sobre a inflamação induzida em orelhas de ratos, com forte ação inibitória sobre ambas as polimerases. Este estudo demonstrou que os efeitos inibitórios sobre as polimerases mostram relação com a supressão do efeito inflamatório induzido pelo TPA (MIZUSHINA et al., 2000). A aplicação de 500 µg de AMA isolado de um extrato metanólico de folhas e caules de Myrsine seguinii, topicamente em orelhas de ratos, também resultou em 65% de efeito inibitório à inflamação induzida pelo TPA, em estudo realizado por Dong et al. (1999). Esta atividade anti-inflamatória foi semelhante a do ácido glicirrízico (77% de efeito inibitório), já a aspirina com 1% de efeito inibitório demonstrou menor atividade 49 inibitória que o AMA, mesmo sendo também um derivado do ácido hidroxibenzoico como o AMA. Provavelmente este efeito deve-se as porções lipofílicas dos terpenos as quais podem influenciar na maior atividade anti-inflamatória observada para o AMA (DONG et al., 1999). Baccarin (2010) desenvolveu e padronizou o extrato seco de R. ferruginea por spray drying, empregando cascas secas da planta, as quais foram caracterizadas através de métodos farmacopeicos. Definiu-se como melhor condição de extração das cascas, solução hidroalcoólica 90 °GL por um período de 2 h por maceração dinâmica (aproximadamente 300 rpm), pois resultou em maior quantidade de resíduo seco (BACCARIN et al., 2014). Para a obtenção do extrato seco por spray dryer as melhores condições encontradas foram teor de sólidos de 5%, com 30% de Aerosil®, um fluxo de alimentação de 4 mL/min e temperatura de entrada de 170 °C. Ainda neste estudo, avaliou-se a atividade antinociceptiva dos extratos mole e seco por via oral e intraperitoneal usando como fármaco de referência a indometacina. Constatouse que as maiores doses aplicadas dos dois extratos resultaram em melhor inibição de resposta dolorosa envolvida na dor inflamatória do que na dor neurogênica, sendo esta resposta maior na administração oral. Outro dado importante, deste estudo, é que o resultado do estudo farmacológico foi maior no lote de extrato seco que não obteve maior concentração de AMB, sugerindo sinergia entre os componentes do extrato (BACCARIN, 2010). Estudo realizado por Tomio (2011) evidenciou atividade citotóxica do extrato etanólico das cascas da R. ferruginea frente às células HELA (28,30 ± 13,09 µg/mL), L929 (56,04 ± 14,24 µg/mL), K562 (mais que 100 µg/mL) e NALM-6 (98,90 ± 0,00 µg/mL). Barretta (2011) analisou a atividade antioxidante dos extratos etanólico e clorofórmico das cascas, galhos, folhas e frutos da R. ferruginea. Neste trabalho o extrato clorofórmico da casca e dos frutos, o extrato etanólico dos galhos e os compostos isolados AMA e AMB da R. ferruginea, apresentaram maior atividade antioxidante pelo método antioxidante direto, ORAC (Oxygen Radical Absorbance Capacity, ou capacidade de absorção do radical oxigênio), assemelhando-se ao controle positivo Trolox®. Os extratos etanólicos dos frutos e casca na concentração de 10 µg/mL, apresentaram atividade antioxidante superior aos demais extratos avaliados quanto à capacidade de sequestrar os radicais livres DPPH e ABTS +. Neste estudo ainda observou-se maior conteúdo de compostos fenólicos no extrato etanólico das cascas (43,74%) e nos frutos (33,63%), os quais demonstraram ainda relação 50 direta com a porcentagem da atividade antioxidante nos métodos DPPH e ABTS +, foi concluído também que todos os extratos obtidos foram capazes de quelar o metal ferro, tendo proteção adicional contra o estresse oxidativo. A avaliação da citotoxicidade dos extratos etanólico de frutos e folhas demonstrou ausência de toxicidade nas concentrações de 0,01, 1 e 10 µg/mL, apresentando redução da viabilidade celular somente a 100 µg/mL. O AMA apresentou possível efeito citotóxico na concentração de 10 µg/mL. Os extratos etanólico dos frutos e folhas e o composto AMA demonstraram ação protetora contra a formação de espécies reativas na avaliação da atividade citoprotetora contra o agente estressor AAPH. O extrato dos frutos em concentrações inferiores a 100 µg/mL apresentou maior proteção gênica que os demais extratos avaliados, na análise da atividade antigenotóxica. Com base nos dados da atividade anti-inflamatória dos ácidos mirsinoicos por via tópica e ação antinociceptiva de origem inflamatória do extrato mole da R. ferruginea por via oral, convém investigar a ação do extrato mole da casca da R. ferruginea veiculado em nanoemulsão, quanto à atividade de supressão da inflamação tópica induzida in vivo, a fim de verificar se há atividade tópica anti-inflamatória do extrato e se a nanoemulsão favorece a absorção dos marcadores na pele, potencializando sua ação. 3.4 Resposta Inflamatória A inflamação é uma resposta patofisiológica dos tecidos frente a uma agressão que leva ao acúmulo local de fluídos e células, tendo como principal objetivo a resolução da infecção ou reparação ao dano tecidual e estabelecimento do estado de homeostasia (BARTON, 2008; SOSA et al., 2002). Mesmo sendo um meio de defesa do organismo, a inflamação pode induzir, manter ou agravar muitas doenças devido a sua complexidade e o envolvimento de mediadores inflamatórios (SOSA et al., 2002). Quanto ao tempo de duração, a inflamação pode ser dividida em duas categorias, aguda e crônica. A inflamação aguda é relativamente de curta duração, caracterizando-se por vasodilatação, exudação plasmática e migração de células primariamente realizada por neutrófilos, sendo estas fases parte da resposta imune inata. A inflamação crônica, por sua vez, é caracterizada por um tempo de resolução prolongado e até mesmo sem resolução, onde a inflamação está ativa e a destruição e a reparação tecidual ocorrem simultaneamente, apresentando histologicamente 51 infiltração de células mononucleares (macrófagos, linfócitos e plasmócitos) e fibrose tecidual (SHERWOOD; TOLIVER-KINSKY, 2004). A vasodilatação, como um aspecto clássico da inflamação aguda, caracteriza se clinicamente por vermelhidão e calor no local da lesão, e facilita a liberação local de mediadores solúveis e células inflamatórias, sendo mediada primeiramente pelo óxido nítrico (NO) e prostaglandinas vasodilatadoras. A vasodilatação envolve, inicialmente, arteríolas seguido pelo surgimento de novos microvasos. A formação de edema, como outro clássico sinal de inflamação, é causada por alterações nas funções de barreira dos pequenos vasos sanguíneos, aumentando a permeabilidade dos capilares a um fluido rico em proteínas e água como consequência da ação de histaminas, bradicinina, leucotrienos, componentes do sistema complemento, substância P e fator de ativação plaquetária (PAF) (SHERWOOD; TOLIVER-KINSK Y, 2004). Os eventos da vasodilatação e edema são acompanhados pela marginação, adesão e migração leucocitária, sendo os neutrófilos os primeiros e mais abundantes leucócitos a serem liberados no local da inflamação (SHERWOOD; TOLIVERKINSKY, 2004). O extravasamento leucocitário é controlado por proteínas que incluem moléculas de adesão, proteases, citocinas e quimiocinas. Para garantir a migração adequada dos leucócitos aos locais de inflamação, existem mecanismos que controlam este movimento como a regulação das quimiocinas ou expressão dos genes dos receptores das quimiocinas. Estes mecanismos regulatórios podem aumentar ou diminuir a resposta inflamatória em relação a função e disponibilidade das quimiocinas (MORTIER; DAMME; PROOST, 2012). Durante a migração, os leucócitos podem encontrar, em sequência ou simultaneamente, várias quimiocinas. O extravasamento leucocitário é influenciado, também, pela cooperação entre as quimiocinas e as citocinas, que levam ao acúmulo e ativação dos leucócitos nos locais da inflamação (GOUWYA et al., 2012). As quimiocinas fazem parte de uma família de citocinas quimiotáticas indispensáveis no tráfego de leucócitos, guiando-os ou retirando-os do local da inflamação e coordenando a recirculação de linfócitos, além de influenciar na sobrevivência dos leucócitos e funções como degranulação. Estas citocinas quimiotáticas são induzíveis, portanto expressas em resposta a infecção, lesão tecidual ou estresse. Estruturalmente as quimiocinas são divididas em 4 subgrupos (CXC, CC, CX3C e C), em função da localização dos resíduos de cisteína NH 2- 52 terminal (MORTIER; DAMME; PROOST, 2012). As quimiocinas murinas, quimiocina derivada dos queratinócitos (KC) e proteína inflamatória dos macrófagos 2 (MIP-2), são as maiores quimioatraentes responsáveis por recrutarem neutrófilos (FILIPPO et al., 2008) e estão relacionadas com a interleucina-8 (IL-8) de humanos e a CINC1/CXCL-1 de ratos (PIRES, 2009). Citocinas são polipeptídeos produzidos por vários tipos de células que regulam as respostas imunes e inflamatórias (SHERWOOD; TOLIVER-KINSKY, 2004). As citocinas são multifuncionais e o bloqueio de uma única citocina terá efeitos limitantes sobre a resposta inflamatória global. As citocinas atuam como indutoras e reguladoras do crescimento, divisão e diferenciação celular, como estimulantes da migração celular e controladoras da função celular e da interação entre a expressão de moléculas de adesão e receptoras de citocinas (CORSINI; GALLI, 2000). Exemplos clássicos de citocinas são o fator de necrose tumoral (TNF) e interleucina-1 (IL-1), ambas induzem a febre, estimulam a produção de proteínas de fase aguda pelo fígado e promovem a ativação de células endoteliais (SHERWOOD; TOLIVER-KINSK Y, 2004). A expressão da IL-1 é regulada a nível transcricional pelo NF-κB, que também é responsável pela expressão da TNF (FELDMEYER et al., 2010). Além disso, TNF e IL-1β atuam sinergicamente no aumento do rolamento leucocitário durante a infiltração celular (ZHANG et al., 2001). O TNF é liberado primeiramente por macrófagos presentes no sítio da lesão e modula uma variedade de eventos imunológicos e metabólicos. No local da infecção ou inflamação, o TNF inicia uma resposta imune que ativa mecanismos de defesa antimicrobiano e, após a erradicação da infecção, ele repara o tecido. Esta citocina atua como um potente ativador de neutrófilos e fagócitos mononucleares, servindo também como um fator de crescimento para fibroblastos e angiogênico (SHERWWOD; TOLIVER-KINSKY, 2004). O TNF é um regulador importante das moléculas de adesão e quimiocinas, que juntas coordenam a resposta inflamatória. Embora o TNF seja um potente indutor da infiltração de neutrófilos, ele é um fraco quimioatraente e o seu efeito sobre o tráfego de leucócitos no tecido, parece ser dependente da indução e secreção de quimiocinas. Estudos demonstram que o TNF regula a expressão de MIP-2 e KC na pele e pulmões (ZHANG et al., 2001). No entanto, a liberação sistêmica de TNF pode ativar uma cascata destrutiva de eventos que pode resultar em dano tecidual, disfunção do orgão afetado e morte (SHERWOOD; TOLIVER-KINSKY, 2004). 53 IL-1β é uma citocina altamente inflamatória, secretada por macrófagos, monócitos e células dendriticas, linfócitos B e células natural killer (NK) (JOOSTEN; NETEA; DINARELLO, 2013). Esta citocina estimula a expressão de ciclo-oxigenase2 (COX-2) que leva a formação e liberação de prostanoides importantes na sensibilização do nociceptor, ou seja, a IL-1β atua como um mediador hipernociceptivo (PIRES, 2009). A IL-1β tem um papel central na defesa contra patógenos, no entanto, a sua expressão pode ser desencadeada por fatores causadores de estresse do hospedeiro ou do ambiente celular e irritantes cutâneos. É um mediador das respostas inflamatórias, corroborando para a sobrevivência de células T, super regulação do receptor dos linfócitos para IL-2, aumento da produção de anticorpos das células B além da sua proliferação, e promoção da diferenciação das células T-helper 17 (ABRAMOVITS; BEJARANO; VALDECANTOS, 2013). Outro componente que regula o extravasamento leucocitário é a mieloperoxidase (MPO), uma enzima presente nos grânulos azurófilos dos neutrófilos onde se expressam em maior proporção, também está ativa nos monócitos, porém em menor extensão. Quando há a diferenciação dos monócitos em macrófagos, a expressão da MPO é geralmente perdida, podendo ser reiniciada sob certas condições. A MPO está diretamente envolvida na homeostasia celular e é um fator importante na iniciação e progressão de várias doenças inflamatórias. Quando ativa, a MPO em associação ao peróxido de hidrogênio e cloro, produz um potente oxidante, o ácido hipocloroso (HOCl), que é a chave para atividade microbicida dependente de oxigênio dos neutrófilos. Além desta função, estudos tem demonstrado que o HOCl pode ativar o fator de transcrição nuclear-κB (NF-κB) e a fosfoliração da tirosina em células T e B, levando ao aumento da sinalização de cálcio e a produção do TNF. A atuação do oxidante formado a partir da ação da MPO inclui ainda, a modulação da resposta imune das reações inflamatórias, afetando interações célula-célula e a adesão celular dos leucócitos, desempenhando papel importante na migração e infiltração leucocitária (VEEN; WINTHER; HEERINGA, 2009). A MPO, através da produção do HOCl e radicais livres, promove danos teciduais, ativa NF-kB e outros fatores de transcrição, modula o tônus vascular pelo óxido nítrico (NO), sendo seus níveis representativos da progressão da doenças inflamatórias crônicas (MEOTTI et al., 2008). A MPO através da sua função sinalizadora da sobrevivência dos neutrófilos pode influenciar na duração de uma resposta inflamatória (VEEN; WINTHER; HEERINGA, 2009). 54 3.4.1 Inflamação cutânea A pele agindo como primeira linha de defesa do corpo frente a grandes lesões, invasão por micro-organismos e traumas, possui muitos mecanismos de defesa. Desequilíbrios nos mecanismos de defesa da pele, seja por atividade imunológica inadequada ou por agressão através de agentes, leva a alterações na estrutura e função cutânea ocasionando o aparecimento de doenças de pele de origem inflamatória, que também podem estar relacionadas à diversas doenças sistêmicas. A inflamação cutânea é um problema comum de pele que apresenta diversas modificações morfológicas e fisiológicas neste tecido (ABDEL-MOTTALEB et al., 2012; BICKERS; ATHAR, 2006; LEE et al., 2009). Estímulos externos como alérgenos por contato e radiação UV são indutores da inflamação cutânea, que é provocada e mantida pela interação de várias populações de células (BARKER et al., 1991; LEE et al., 2009). A pele é imunológicamente ativa e é capaz de reagir frente a estímulos antigênicos (KIMBER et al., 1999). Após o contato com substâncias irritantes ou alérgenas, em menos de 2 h, mecanismos celulares são ativados na pele humana para aumentar a infiltração de linfócitos T, independente da sensibilidade imune específica, refletindo a capacidade da pele em responder a irritação química (FUCHS et al., 2001), a atividade das citocinas e outros mediadores da inflamação determinam a magnitude da resposta imune inata (SHERWOOD; TOLIVER-KINSKY, 2004). Os componentes celulares primários do sistema imune inato são macrófagos, células dendríticas, células natural killer (NK) e neutrófilos (SHERWOOD; TOLIVER-KINSKY, 2004). Em relação a sensibilização de contato, as células dendríticas, especialmente as células de Langerhans epidérmica, são os mais importantes componentes do sistema imune cutâneo, além das citocinas que regulam seus movimentos, maturação e função. As células de Langerhans, células imunocompetentes, se encontram na epiderme e formam uma contínua rede que captura os antígenos que se encontram na pele, sendo então responsável pela interação, internalização, processamento e transporte de antígenos. Durante o transporte dos antígenos, as células de Langerhans adquirem a habilidade de apresentar o antígeno para os linfócitos T, reguladas e estimuladas pelas citocinas epidérmicas, as quais são induzidas ou mantidas pela sensibilização 55 da pele. A partir disso os linfócitos T se dividem e se diferenciam, representando a base da sensibilização cutânea (KIMBER et al., 1999). As células da epiderme e derme são conhecidas como produtoras de uma grande variedade de citocinas, e o queratinócito é o principal produtor de muitas das citocinas identificadas e moléculas de adesão, seja esta expressão constitutiva ou por indução de vários estímulos (GRÖNE, 2002; KIMBER et al., 1999). Queratinócitos são ativados através da indução por agentes alérgenos e irritantes, sintetizando e secretando citocinas (FUCHS et al., 2001). Algumas citocinas são produtos exclusivos das células de Langerhans, enquanto outras são produzidas por queratinócitos e somente algumas citocinas são expressas por estas duas células (KIMBER et al., 1999). As citocinas produzidas pelos queratinócitos incluem as interleucinas -1, -6, -7, -8, -10, -12, -15, -18, e -20, o TNF e interferons (IFN) alfa, beta e gama (GRÖNE, 2002). Das citocinas produzidas pelos queratinócitos, somente as citocinas IL-1α, IL1β e TNF ativam um número suficiente de mecanismos efetores de forma independente para provocar a inflamação cutânea (CORSINI; GALLI, 2000). A produção de citocinas pelos queratinócitos tem como consequências a ativação de células endoteliais microvasculares da derme, acúmulo seletivo de células mononucleares específicas da derme e epiderme, podendo, ainda, ter efeito sistêmico sobre o sistema imune, sobre a proliferação de queratinócitos e processos de diferenciação, além de afetar a produção de outras citocinas pelos queratinócitos (BARKER et al., 1991; GRÖNE, 2002). Os queratinócitos também são responsivos às citocinas derivadas das células T e das células dendríticas (FELDMEYER et al., 2010). Estudos sugerem que os queratinócitos são a maior fonte de IL-1 na pele, citocina que tem importante papel em doenças inflamatórias e alérgicas da pele, como a psoríase ou dermatite de contato (FELDMEYER et al., 2010). A IL-1 existe em duas formas, IL-1α e IL-1β, sendo a primeira predominantemente produzida e armazenada nos queratinócitos, enquanto a segunda é essencialmente sintetizada por macrófagos e monócitos (FUCHS et al., 2001). A IL-1, de maneira geral, induz a expressão de moléculas de adesão sobre as células endoteliais que juntamente com a indução de quimiocinas, estimula a infliltração de células inflamatória e imunocompetentes (FELDMEYER et al., 2010) tais como monócitos, linfócitos e leucócitos polimorfonucleares, assim como estimula a produção de outras citocinas (FUCHS et al., 2001). 56 O TNF está armazenado nos monócitos da derme da pele e influenciado por um estímulo, esta citocina pode ser produzida por queratinócitos e células de Langerhans, atuando através da induçãoda expressão de moléculas de adesão cutânea e endoteliais (CORSINI; GALLI, 2000) e da habilidade em aumentar a permeabilidade vascular (MURAKAWA et al., 2006). Níveis aumentados de citocinas pró-inflamatórias e espécies reativas de oxigênio (ROS) contribuem para os mecanismos patofisiológicos associados a várias patologias inflamatórias da pele (LEE et al., 2009), como psoríase, dermatite atópica e dermatite de contato (FUCHS et al., 2001). Muitos agentes externos ou são por si oxidantes ou catalisam a produção de ROS, direta ou indiretamente (BICKERS; ATHAR, 2006). ROS podem ser liberadas durante a infiltração dérmica com células inflamatórias ou podem ser produzidas pelos queratinócitos em resposta a alguma exposição química. A produção constitutiva de ROS pelos queratinócitos se dá por processos específicos e pode ser induzida por várias citocinas, fatores de crescimento e outros estímulos fisiológicos. Já a exposição dos queratinócitos à substâncias químicas irritantes, que tem ROS como mediadores, levam ao aumento da síntese de citocinas (FUCHS et al., 2001) formando um ciclo. As citocinas IL-1 e TNF induzem a produção celular de ROS, perpetuando sua própria formação e ação (FUCHS et al., 2001). 3.4.2 Tratamento da Inflamação cutânea O tratamento tópico de doenças cutâneas é muito interessante devido a redução da ação sistêmica e dos efeitos colaterais sistêmicos das substâncias ativas, quando comparadas a adminsitração oral ou parenteral. Além disso, a aplicação tópica de medicamentos permite maior flutuação dos níveis plasmáticos típicos da administração repetida de substâncias rapidamente eliminadas, e evita eliminação pela primeira passagem através do fígado (SCHÄFER-KORTING; MEHNERT; KORTING, 2007). Os tratamentos atuais para reações inflamatórias cutâneas se concentram no alívio dos sintomas da doença cutânea, reparando a função de barreira, reduzindo o prurido, as infecções secundárias e a inflamação. Para tratar inflamações cutâneas , os veículos atualmente usados para a administração dos fármacos, empregam formulações clássicas como pomadas e cremes, e muitos destes medicamentos são 57 uma combinação de hidratantes, anti-histamínicos, antibióticos e glucocorticoides, alguns trazendo reações não desejáveis (ABDEL-MOTTALEB et al., 2012; LEE et al., 2009). Os glucocorticoides representam a terapia padrão para a redução da inflamação e da ativação da resposta imune em doenças dermatológicas, sendo a terapia mais amplamente usada na dermatologia (SCHÄCKE; DÖCKE; ASADULLAH, 2002). A atuação dos glucocorticoides é através da redução da transcrição gênica para IL-2, interferindo também na transcrição de TNF, IFN-γ, IL-1 (RAUH, 2008). No entanto, esta terapia traz inúmeros efeitos adversos na pele como atrofia da epiderme e derme, hipertricose, acne, dermatite perioral, distúrbios na pigmentação da pele, eritema e telangiectasias (SCHÄCKE; DÖCKE; ASADULLAH, 2002). Por outro lado, aproximadamente 50% dos medicamentos utilizados são obtidos a partir de fontes naturais. O uso de medicamentos fitoterápicos aumentou devido a melhor atividade terapêutica e menores efeitos colaterais quando comparado ao medicamentos sintéticos (GUNASEKARAN et al., 2014). As plantas medicinais são amplamente empregadas na medicina popular para tratar doenças inflamatórias cutâneas. Estudo realizado por Sosa (2002) demonstrou que a maioria dos extratos de algumas plantas selecionadas em Belize, na América Central, são empregadas tradicionalmente pela população local em desordens cutâneas, demonstraram atividade anti-inflamatória tópica em modelo de edema de orelha induzido pelo óleo de cróton. Terapias empregando plantas tem obtido êxito no tratamento de doenças dermatológicas por milhares de anos na Europa e Ásia, sendo usadas ainda nos dias de hoje pela sua eficácia e algumas possuem comprovação ciêntífica para o seu uso (BEDI; SHENEFELT, 2002). Embora os fitoterápicos demonstrem admirável atividade terapêutica in vitro, possuem menor eficácia in vivo por consequência de várias características como pobre solubilidade lipídica, ocasionando baixa absorção e consequentemente, pobre biodisponibilidade (KESARWANI; GUPTA, 2013). Além disso, deve ser considerada a grande complexidade da composição dos derivados vegetais, como os extratos, em que a presença de componentes com diversas características químicas e o sinergismo que exite entre os mesmos influenciando na sua ação terapêutica, é um desafio tanto relacionado à tecnologica farmacêutica como à avaliação da eficácia do fitoterápico desenvolvido (KESARWANI; GUPTA, 2013). O uso de veículos convencionais, como cremes e pomadas, para substâncias ativas tem alguns inconvenientes como a baixa porcentagem do fármaco absorvida 58 associada a alta taxa de variações na absorção entre indivíduos, gerando doses subterapêuticas do medicamento na pele de alguns indivíduos e indução de efeitos colaterais locais ou sistêmicos indesejáveis em outros. A pele possui uma função de barreira muito eficiente devido a camada córnea da pele, que dificulta a absorção de ativos, sendo um grande desafio no desenvolvimento de medicamentos tópicos garantir uma adequada penetração cutânea, mesmo considerando que a penetração de ativos é facilitada nas desordens cutâneas como psoríase e dermatite (SCHÄFERKORTING; MEHNERT; KORTING, 2007). Desta forma, veículos que facilitam a penetração na barreira formada pelo estrato córneo cutâneo (SCHÄFER-KORTING; MEHNERT; KORTING, 2007), melhoram a atividade e superam os problemas relacionados às plantas medicinais que podem comprometer a sua absorção e eficácia (GUNASEKARAN et al., 2014) é uma alternativa promissora. Nas últimas décadas tem-se intensificado o estudo de novos veículos para a administração de derivados vegetais, que devem liberar o princípio ativo em uma concentração adequada às necessidades do corpo durante o período de tratamento e direcioná-lo para o local de ação. O uso de nanocarreadores tem inúmeras vantagens para a administração de derivados vegetais e fitofármacos, como o aumento da solubilidade e biodisponibilidade, proteção à toxicidade, aumento da atividade farmacológica, aumento da estabilidade, manutenção da liberação do princípio ativo e proteção da degradação física e química (GUNASEKARAN et al., 2014). Na literatura encontram-se poucos trabalhos que trazem a incorporação de extratos vegetais em nanoemulsões para aplicação tópica. Em trabalho recentemente publicado, verificou-se que a nanoemulsão é um veículo adequado para incorporação de extratos etanólicos líquido e seco da planta macela (Achyrocline satureioides), para tratamento tópico de desordens cutâneas (BIDONE et al., 2014). Nanoemulsões também se mostraram promissoras para veicular topicamente extratos hidroalcoólicos de folhas e cascas de Vellozia squamata, demonstrando a mesma ação antioxidante que os extratos (QUINTÃO et al., 2013). Sugumar e colaboradores (2014) verificaram que o óleo de eucalipto incorporado em nanoemulsão para aplicação tópica, demonstrou atividade antibacteriana para Stafilococos aureus e cicatrizante sem causar irritação cutânea em ratos. 59 No entanto, para os fármacos classicamente empregados no tratamento da inflamação cutânea, existem diversos trabalhos estudando nanocarreadores como veículos tópicos. Um estudo experimental empregando nanopartículas com tamanho entre 50 e 1000 nm, com e sem incorporação de betametasona, em orelhas de ratos saudáveis, demonstrou a influência do tamanho das partículas. As partículas menores que 100 nm tiveram uma deposição seletiva nos folículos pilosos e glândulas sebáceas na pele inflamada, sugerindo uma estratégia quando se quer veículos cujo alvo sejam locais específicos da pele inflamada, redução dos efeitos adversos locais e da exposição da pele saudável. Quando investigadas as nanopartículas contendo betametasona, verificou-se aumento do efeito terapêutico com a redução do tamanho das partículas (ABDEL-MOTTALEB et al., 2012). Sandig et al. (2013), avaliou o efeito analgésico tópico in vivo de nanoemulsões com imipramina e doxepina, em ratos. O efeito analgésico foi maior com a doxepina, sugerindo uma alternativa para terapia analgésica tópica. Subramanian et al. (2008), em estudo incorporando aspirina em nanoemulsões para administração tópica com o objetivo de reduzir os efeitos adversos do fármaco, comparou a atividade anti-inflamatória da aspirina em nanoemulsão e em suspensões pela aplicação tópica em orelhas inflamadas de camundongos, no modelo de edema de orelha induzido por óleo de cróton. A veiculação da aspirina em nanoemulsão aumentou sua atividade anti-inflamatória no modelo testado quando comparado com a veiculação em suspensão. A redução da inflamação, neste estudo, está associada com alterações no acúmulo de citocinas pró-inflamatórias na orelha, sugerindo uma alternativa para redução dos efeitos adversos associados à altas dosagens de aspirina administradas oralmente. Os nanocarreadores apresentando-se como alternativas para administração de fármacos através do estrato córneo (ESCOBAR-CHÁVEZ et al., 2012), e reconhecendo as inúmeras vantagens que estes veículos possibilitam aos derivados vegetais, torna este trabalho de desenvolvimento de uma nanoemulsão contendo extrato vegetal com ação anti-inflamatória, uma promissora alternativa na terapia antiinflamatória cutânea. 60 61 4 MATERIAL E MÉTODOS 4.1 Material 4.1.1 Material vegetal As cascas de R. ferruginea foram coletadas em Blumenau (SC), em parceria com a Profa. Dra. Angela Malheiros, em outubro de 2013 de uma árvore com 35 cm de diêmetro de tronco e a uma altura de 20 cm do solo. As cascas foram secas em estufa de ar circulante a 45 ºC por 3 dias. A droga vegetal foi pulverizada em moinho de facas e posteriormente tamisada manualmente em tamis de malha de 2 mm, selecionando as partículas menores que 2 mm para a preparação da solução extrativa conforme item 4.3, de acordo com os dados da análise granulométrica para otimização da extração de AMB das cascas de R. ferruginea obtida por Baccarin e colaboradores (2014). 4.1.2 Materiais e reagentes 3,3’,5,5’-tetrametilbenzidina, Sigma®, lote: #0001432567-V Acetato de etila P.A., Vetec®, lote: 1203375 Acetonitrila, grau HPLC, Tedia ®, lote: 1202016 Ácido fosfórico, Merck®, lote: K36616573641 Ácido mirsinoico A (AMA) Ácido mirsinoico B (AMB) Ácido sulfúrico, Merck®, lote: K37546331 729 Água purificada, obtido por destilação Água ultrapura grau I, obtido pelo sistema Milli-Q® – sistema de obtenção de água Albumina, Applichem®, lote: 8M006877 Álcool etílico absoluto, Synth®, lote: 165608 Alkest® CSO 400, Oxiteno®, lote: 130501C114759 Aprotinina, Applichem®, lote: 7V003064 Capryol® 90, Gattefossé®, lote: 134950 Células NCTC clone 929, fibroblastos L-929 provenientes do Banco de Células do Rio de Janeiro BCRJ: 0188, lote: 001163 62 Cetiol® 868, Audaz®, lote 1204889 Cetiol® V Cloreto benzetônio, Fluka Biochemika ®, lote: 1144892 Cloreto de potássio, Merck®, K37429936745 Cloreto de sódio PA, Merck®, lote: K38447104 807 Cromatoplaca sílica gel 60 F254, Merck ®, lote: HX066874 D-Glicose, Nuclear®, lote: 02040651 Dimetilsulfóxido, Dinâmica®, lote: 35574 EDTA dissódico, Merck®, lote: K37886918 743 Eosina amarelada CI 4538, Vetec®, lote: 1100662 Fluoreto de fenildimetilsulfonil (PMSF), Sigma ®, lote: 028K0766 Fosfato de potássio monobásico PA, Vetec ®, lote: 0604392 Fosfato de sódio PA, Nuclear®, lote: 08061008 Fosfato de sódio dibásico PA, Nuclear®, lote: 08071042 Grades de cobre 400 mesh com filme FormVar/carbono para microscopia eletrônica de transmissão Hexadeciltrimetilamônio brometo, Fluka ®, lote: 1312661 Hexano P.A., Lafan®, lote: 13280 Hidróxido de sódio PA, Merck®, lote: B0183698 749 Labrafil® M1944CS, Gattefossé®, lote: 136228 Labrasol®, Gattefossé®, lote: 139960 Membrana de diálise, Sigma-Aldrich®, lote 07796ME Metanol, grau HPLC, J.T. Baker®, lote: M04CO2 Metanol P.A., Vetec®, lote: 1204283 Miristato de Isopropila, Casa das Essências®, lote: R3G121051214 Nitrogênio líquido Óleo de cróton, Sigma®, lote: 065K1429 Pele de orelha de porco provenientes do Frigorífico Antônio Carlos (Antônio Carlos – SC) Peróxido de hidrogênio, Vetec ®, lote: 0805129 Phenonip®, Pharma Special®, lote: GBG0007304 Placa para cultura de células de 96 poços 3599, Costar® Placa para cultura de tecidos de 6 poços 92006, TPP ® 63 Propilenoglicol, Via Farma, lote: 3252*ZL2731A003 Sepigel® 305, Fagron®, lote: 13125101ª Solução de hematoxilina de Harris, Dinâmica®, lote: 40277 Span® 80, Sigma®, lote: 33706125 Streptavidina-HRP kit mouse IL-1β, R&D Systems, lote: AEM 4907031 Streptavidina-HRP kit mouse CXCL1/KC, R&D Systems, lote: AEM 6309021 Streptavidina-HRP kit mouse TNF-α, R&D Systems, lote: AEM 6409042 Tamis, abertura 2 mm/µm, Bertel® Triglicérides Cáprico Capril, Embrafarma ®, lote: 14038 (FI) Triton® X-100, Sigma®, lote: 29085 Tween® 20, Vetec®, lote: 022911 Tween® 80, Dinâmica Química®, lote: 36668 Xileno PA, Cromato Produtos Químicos LTDA, lote: 0604.05/10 4.1.3 Equipamentos Agitador magnético Mg-Multi Marte® Agitador mecânico Fisatom® 713D Aparato de permeação cutânea Microette Q-PakTM, composto por: células de Franz Hanson Research, placa de agitação magnética MIXdrive com controle MIXcontrol 2Mag Magnetic e Motion, banho de circulação programável Hanson Research. Autoclave Quimis® modelo 190.22 Balança analítica Bel® UMark 250ª Balança Infravermelho Mettler-Toledo® LJ 16 Banho maria com circulação Marconi ® MA 159 Banho ultrassônico Ultracleaner 800A Unique® Câmara de ultravioleta Dist® Capela de exaustão Permution® modelo CE0701 Centrífuga Hermle® Z300 Centrífuga Micro Fanem® Mod. 243 Chapa de aquecimento Fisatom® Cromatógrafo Shimadzu® LC 20-AC com uma bomba quaternária LC-20AT Shimadzu®, detector de varredura de espectro ao ultravioleta por arranjo de 64 fotodiodos (diodo array) SPD-M20A Shimadzu®, injetor automático SIL-20AHT Shimadzu®, software LC Solution® Espectrofotômetro de UV/VIS Shimadzu® modelo UV-1601 Estufa com 5% de CO2, 85% de umidade relativa e 37 ± 1 °C, Ultrasafe ® , modelo HF 212UV Estufa de ar circulante Quimis® Estufa de cultura Quimis® modelo 316.22 Estufa de secagem Fanem® modelo 315 SE Estufa Fanem® 502C Fluxo laminar Veco® modelo VLFS-12 série 8195 Freezer -80°C Lâminas para microscopia 26,0x76,0 mm, Precision® Glass Line Lamínula 24,0x32,0 mm Glasscyto® Leitor de microplaca Spectro Star Nano, BMG Labtech Microcentrífuga de velocidade refrigerada Vision® modelo VS-15000CFNII Micrômetro digital Mitutoyo® modelo APB-2D Microscópio eletrônico de transmissão Jeol modelo JEM-1200EXII Microscópio óptico Olympus® CBA Microscópio Olympus modelo CKX41 com sistema digital de imagem Q colors 3 Micropipeta automática Labmate® 100 µL e 50 µL Micropipeta de precisão Microman Gilson® 250 µL Micropipeta multicanal (12 canais 30-300 µL) Eppendorf® Research pHmetro AJMicronal® AJX-512 Potenciômetro Digimed® modelo DM20 Triturador de tecidos Tissue TearorTM modelo 985370 Biospec® Products Viscosímetro rotacional Haake ® modelo VT 550, K10, DC30, tipo cone placa, acoplado a um banho de água termostatizado e software Rheowin® 4 Data Manager 430.0013 e Rheowin® 4 Job Manager Vortex Biomixer® QL-901 Zetasizer Nano ZS Modelo ZEN3600 Malvern® 65 4.2 Análise das cascas pulverizadas de R. ferruginea As cascas da R. ferruginea foram analisadas quanto ao do teor de cinzas totais, cinzas insolúveis em ácido e perda por dessecação. Para a determinação dos teores de cinzas totais e cinzas insolúveis em ácido das cascas pulverizadas, foi empregado método farmacopeico (ANVISA, 2010), em triplicata. Para cinzas totais, foi pesado 3 g da planta pulverizada, em triplicata, e transferida para cadinho previamente tarado e seco, ficando a droga uniformemente distribuída. A droga contida no cadinho foi incinerada a temperatura máxima de 600 °C, até a eliminação de todo carvão. Após, foi resfriada em dessecador e pesada. Este procedimento foi repetido até que a amostra atingisse peso constante. A porcentagem de cinzas foi calculada em relação a droga seca e o resultado expresso em média ± desvio padrão. Para a determinação das cinzas insolúveis em ácido, o resíduo obtido na determinação de cinzas totais foi fervido por 5 minutos com 25 mL de ácido clorídrico a 7% (p/V) em cadinho coberto com vidro de relógio. Após, o vidro de relógio foi lavado com água quente, juntando a água de lavagem ao cadinho. O resíduo insolúvel em ácido foi recolhido sobre papel filtro isento de cinzas, lavando-o com água quente até que o filtrado se tornasse neutro. O papel filtro contendo o resíduo foi transferido para o cadinho original e secado em chapa quente, após foi incinerado a cerca de 500 °C até peso constante. A porcentagem de cinzas insolúveis em ácido foi calculada em relação a droga seca e expressa em média ± desvio padrão. Para avaliação da perda por dessecação, foi empregado cerca de 1 g das cascas pulverizadas e tamisadas em balança de infravermelho a 105 °C. A droga foi uniformemente distribuída sobre o prato da balança, em triplicata. A perda por dessecação foi expressa em porcentagem, sendo calculada a média e desvio padrão. 4.3 Obtenção e caracterização dos derivados vegetais das cascas de R. ferruginea 4.3.1 Obtenção A solução extrativa das cascas de R. ferruginea foi obtida pelo método de maceração dinâmica. A droga vegetal na proporção planta/solvente 10% (p/V) foi 66 macerada empregando-se solvente hidroalcoólico 90 °GL, à temperatura ambiente, sob agitação em agitador mecânico (800 ± 30 rpm), sem renovação do líquido extrator, por 2 h, conforme padronizado por Baccarin e colaboradores (2014). Posteriormente a solução foi filtrada em três camadas de tecido Sontara®. A solução extrativa obtida foi filtrada novamente a vácuo em filtro de papel. Após este processo foi calculado o rendimento da solução extrativa obtida e expresso em porcentagem. Para obtenção do extrato mole, o volume da solução extrativa foi reduzido até cerca de 50% em banho-maria a 45 °C. Após, foi concentrado em estufa de ar circulante a 45 °C até apresentar aspecto xaroposo. Ao término deste processo foi calculado o rendimento, que foi expresso em porcentagem. 4.3.2 Caracterização 4.3.2.1 Aspectos organolépticos Para análise dos aspectos organolépticos foi observado a cor e odor dos derivados vegetais. 4.3.2.2 Determinação do pH O pH da solução extrativa foi determinado por leitura direta em potenciômetro calibrado a 25 °C. O resultado foi calculado pela média de três determinações. Para a determinação do pH do extrato mole, foi realizado a diluição do mesmo em água destilada na proporção de 1:10 (p/V), e o valor de pH determinado em triplicata, calculando-se a média ± desvio padrão. 4.3.2.3 Determinação do resíduo seco (BRASIL, 2010) O resíduo seco para derivados vegetais obtidos foi determinado em triplicata empregando 2 mL da solução extrativa e aproximadamente 0,5 g do extrato mole. As amostras foram transferidas para pesa-filtros e evaporadas até secura em chapa de aquecimento. Depois foram dessecadas em estufa a 100-105 °C, por 3 h, resfriadas em dessecador e pesadas. O procedimento foi repetido até peso constante. O resíduo seco foi calculado em porcentagem sobre a massa pesada e sobre o volume de 2 mL, sendo calculado a média e o desvio padrão. 67 4.3.2.4 Perfil qualitativo dos derivados vegetais de R. ferruginea por Cromatografia em Camada Delgada (CCD) Na análise do perfil qualitativo por CCD, a solução extrativa foi analisada sem prévia diluição ou concentração e o extrato mole foi diluído para obtenção de uma solução a 5 mg/mL em metanol. Os ácidos mirsinoicos AMA e AMB foram empregados como marcadores sendo dissolvidos em acetona. Foram utilizadas cromatoplacas de sílica gel e como sistema de eluição, uma mistura de hexano e acetato de etila (1:1) (BACCARIN et al., 2014). As soluções dos padrões de AMA e AMB e dos extratos foram aplicados com capilares na forma de manchas circulares. Os cromatogramas foram desenvolvidos de forma ascendente, em cubas saturadas com o sistema eluente até a altura de aproximadamente 10 cm. Após a secagem, à temperatura ambiente, a cromatoplaca foi visualizada em câmara de UV em 254 nm, e posteriormente realizada a revelação com anisaldeído sulfúrico com posterior aquecimento da placa cromatográfica (BACCARIN et al., 2014). 4.3.2.5 Determinação do teor de AMA e AMB O teor de AMA e AMB (mg/g) nos derivados vegetais foi determinado empregando Cromatografia Líquida de Alta Eficiência (CLAE) usando metodologia desenvolvida e validada por Zermiani et al. (2014). As análises foram realizadas em parceria com a mestranda Tailyn Zermiani. A detecção por varredura de espectro foi realizada na faixa de comprimentos de onda entre 190 nm até 400 nm e os comprimentos de onda de 260 e 270 nm foram selecionados para quantificação dos marcadores AMA e AMB, respectivamente. A fase estacionária empregada foi uma coluna de fase reversa Kinetex XB® C18, 150 x 4,6 mm, com partículas core-shell com tamanho de 2,6 µm. A fase móvel utilizada foi uma mistura de acetonitrila (ACN), metanol e água acidificada com ácido fosfórico a pH 2,5 (Quadro 1). Todos os solventes usados foram de grau HPLC e os componentes da fase móvel foram filtrados a vácuo com membrana de celulose regenerada com 47 mm de diâmetro e 0,45 μm de porosidade e degaseificados em banho de ultrassom. Foi usado o método gradiente apresentado no Quadro 1, com fluxo de 0,9 mL/min, volume de injeção de 20 L e temperatura de 35 °C. 68 Quadro 1 - Condições cromatográficas para análise dos derivados vegetais de R. ferruginea por CLAE. Tempo Acetonitrila *Água Metanol (min) (%) (%) (%) 0 5 70 25 2 5 70 25 5 30 45 25 10 60 15 25 12 70 5 15 15 84 1 15 25 84 1 15 30 5 70 25 35 5 70 25 *Água acidificada com ácido fosfórico pH 2,5. Para a análise da solução extrativa das cascas de R. ferruginea, diluiu-se a amostra na proporção de 1:5 com metanol. Posteriormente as soluções foram filtradas com membrana de PTFE modificada de 0,45 μm, colocadas em frasco do tipo vials (1,5 mL), e injetadas em triplicata. Para análise do extrato mole, foi pesado 1 mg do extrato e dissolvido em 1 mL de metanol, filtrado em membrana de PTFE modificada de 0,45 μm, colocadas em frasco do tipo vials e injetado em triplicata. Os padrões AMA e AMB foram injetados na concentração de 50 µg/mL em metanol. A determinação do teor de AMB e AMA nos extratos foi determinada pelo cálculo da área dos seus picos encontradas no cromatograma obtido pela análise das soluções amostra, em comparação com a área dos mesmos nas soluções padrão. 4.4 Estudos de pré-formulação das nanoemulsões 4.4.1 Determinação da solubilidade do extrato A partir dos óleos e tensoativos selecionados com base na literatura pesquisada, que podem ser empregados no desenvolvimento da nanoemulsão, a solubilidade do extrato mole na concentração de 10 mg/mL foi testada em 5 mL de cada óleo e na mistura de óleo:tensoativo na proporção de 1:2 em um frasco com tampa. Os frascos foram agitados em agitador vortex e mantidos por 24 h sob agitação magnética a 25 ± 2 °C. A mistura obtida teve a absorbância analisada em 69 espectrofotômetro UV/Visível com varredura nos comprimentos de onda entre 190 nm a 800 nm para seleção da melhor absorbância. Como branco foi usado o óleo ou óleo:tensoativo correspondente. A partir do resultado encontrado para a absorbância, foram selecionados os óleos e tensoativos para o desenvolvimento da nanoemulsão. 4.4.2 Determinação do coeficiente de partição do extrato O coeficiente de partição do extrato mole foi determinado usando o método de agitação do frasco, conforme De Carli (2007). O coeficiente de partição (P) é definido como a razão das concentrações em equilíbrio de uma substância dissolvida em um sistema de duas fases, composto de dois solventes imiscíveis, n-octanol e água, usando a equação 1. 𝑃= 𝐶𝑛−𝑜𝑐𝑡𝑎𝑛𝑜𝑙 𝐶á𝑔𝑢𝑎 (1) O n-octanol foi saturado com uma quantidade idêntica de água, para isso, a mistura dos dois solventes foi agitada por aproximadamente 12 h, em agitador magnético a 400 rpm. A fase aquosa foi separada em funil de separação e centrifugada 1400 rpm por 10 minutos. Após a saturação, 10 mL de uma solução aquosa contendo 100 µg/mL do extrato mole de R. ferruginea foi adicionado em 10 mL do n-octanol saturado. Esta mistura sofreu agitação por 30 min, em banho-maria a 37 ± 0,5 °C, foi transferida para um funil de separação e mantida em repouso por 5 minutos. Após o repouso, a fase aquosa foi retirada e centrifugada por 5 minutos a 2500 rpm. O sobrenadante foi analisado em triplicata por CLAE. 4.5 Desenvolvimento das nanoemulsões 4.5.1 Construção do diagrama de fases pseudoternário O processo de obtenção das nanoemulsões foi otimizado utilizando o diagrama de fases pseudoternário a fim de determinar a melhor combinação e proporção entre os componentes (fase oleosa, fase aquosa e sistema tensoativo). Antes de dar início à construção do diagrama de fases, foi necessário determinar a combinação de tensoativos selecionados com base no teste de solubilidade e as suas proporções para que o valor de EHL (equilíbrio hidrófilo-lipófilo) 70 fosse semelhante ao EHL do óleo selecionado, miristato de isopropila (EHL 11,5) (CONVERGENT COSMETICS, 2013). Foram realizadas três misturas contendo dois tensoativos cada, sendo que a combinação considerou a mistura de um tensoativo com valor de EHL alto e outro tensoativo com EHL baixo, conforme apresentado no Quadro 2. Quadro 2 - Combinações de tensoativos desenvolvimento das nanoemulsões. Combinação de Tensoativos Capryol® 90 (EHL= 6) + Alkest® CSO 400 (EHL= 13) Capryol® 90 (EHL= 6) + Tween® 80 (EHL= 15) Alkest® CSO 400 (EHL= 13) + Span® 80 (EHL= 4,3) e suas respectivas proporções empregadas no Proporção 1,5:5,5 3,5:5,5 7,2:1,5 Para a mistura dos componentes na combinação de Capryol® 90 e Tween® 80 a temperatura foi a ambiente, já para as outras duas combinações a temperatura foi de 45 °C para uma perfeita homogeneização dos tensoativos. O diagrama foi estudado empregando dois métodos distintos, o método da titulação e o método ponto a ponto. No método da titulação, baseado nos trabalhos realizados por Shafiq-un-Nabi e colaboradores (2007) e Li e colaboradores (2005), as misturas de óleo:tensoativo foram fixadas em diferentes proporções, como segue: (1:9), (2:8), (3:7), (4:6), (5:5), (6:4), (7:3), (8:2), (9:1). Estas misturas receberam concentrações adicionais de água em intervalo de 24 h, para que o volume total diário em mL fosse: 1,1; 1,2; 1,25; 1,3; 1,35; 1,4; 1,45; 1,5; 1,55; 1,6; 1,65; 1,7; 1,8; 1,9; 2,0; 2,2; 2,3; 2,5; 2,7; 3,0; 3,2; 3,5; 4,0; 5,0; 6,0; 7,0; 8,0; 9,0 e 10,0. A água foi adicionada com o auxílio de uma micropipeta, sob agitação, em vortex, mantendo-se a agitação por 2-3 minutos após a sua completa adição. A cada adição de água, os sistemas foram armazenados em estufa a 25 ± 2 °C por 24 h e após tiveram o seu aspecto visual analisado a olho nu. Os sistemas foram visualmente classificados como: FU – Fluido Turvo; FT – Fluido Transparente; FL – Fluido Translúcido; FB: Fluido Branco, leitoso; SF: Separação de Fases; GT: Gelificado Transparente; GL – Gelificado Translúcido; GU: 71 Gelificado Turvo; GR: Gelificado com Ressonância; EG: Emulsão Gelificada; E: Emulsão. O diagrama foi plotado usando software Sigma Plot® 12.0. Partindo dos resultados obtidos pelo diagrama de fases por titulação, excluíramse os pontos com separação de fases e com formação de emulsão e os demais pontos foram preparados individualmente. Baseando-se no trabalho realizado por Peng et al. (2010), ou seja, cada proporção dos componentes, óleo, mistura de tensoativos e água, foram preparadas individualmente, misturando-se a proporção de óleo e mistura de tensoativos primeiramente e após adicionando-se a quantidade total de água gota a gota, sob agitação em vortex. O sistema foi mantido em agitação por 2-3 minutos seguido de repouso por 24 h. O aspecto físico foi analisado visualmente a olho nu e mensurada a distribuição do tamanho das gotículas por DLS após diluição em água. A partir dos resultados encontrados foram selecionadas as formulações para estudo de estabilidade preliminar e estabilidade termodinâmica. 4.5.2 Estudo de estabilidade preliminar e estabilidade termodinâmica das nanoemulsões sem extrato A partir do resultado obtido no diagrama de fases usando miristato de isopropila como fase oleosa e a mistura de Alkest® CSO 400 e Span® 80 como tensoativos, foram selecionadas 3 formulações que apresentaram tamanho médio de gotas menor que 100 nm, com baixo índice de polidispersibilidade, com aspecto fluido e com baixa concentração de tensoativo. As formulações escolhidas estão detalhadas no Quadro 3. As formulações selecionadas foram preparadas em duplicata para verificar a reprodutibilidade do método de preparo, na quantidade total de 30 g. Quadro 3 - Formulações dos sistemas nanoemulsionados selecionados para o estudo de estabilidade preliminar. Fórmula Óleo (% ) Tensoativos* (% ) Água (% ) 4:6:20 13,3 20,0 66,7 5:5:70 6,3 6,3 87,5 6:4:20 20,0 13,3 66,7 *Alkest ® CSO 400 e Span® 80 (7,2:1,5). O método de preparo consistiu na pesagem de todos os componentes e da mistura do óleo com a combinação de tensoativos Alkest® CSO 400: Span® 80 na proporção de 7,2:1,5, respectivamente. Os recipientes contendo a água e a mistura 72 de óleo e tensoativos foram mantidas em banho-maria até atingirem a temperatura de 80 °C. Após aquecimento, a água foi gotejada lentamente na fase oleosa contendo tensoativos, sob agitação em agitador mecânico com velocidade constante de 600 rpm. Após o término da adição de água, o sistema foi mantido sob agitação por mais 5 minutos com aquecimento, e, posteriormente, mais 3 minutos sem aquecimento. As amostras ficaram em repouso por 24 h e, após este período, foram analisadas quanto ao aspecto físico, diâmetro médio das gotas por DLS, índice de polidispersibilidade, pH e separação de fases após centrifugação a 3000 rpm por 15 min, para visualização de qualquer sinal de instabilidade física. Após estas análises, as amostras foram submetidas ao estudo de estabilidade preliminar em 6 ciclos de 24 h a 40 ± 2 °C e 4 ± 2 °C. Ao término do período, as amostras foram analisadas novamente quanto aos aspectos verificados no tempo inicial. As formulações que não apresentaram sinais de instabilidade, após o teste de centrifugação no término do ciclo, foram encaminhadas para o ciclo gelo/degelo para verificação da estabilidade termodinâmica. Este teste foi adaptado da metodologia empregada por Shafiq-Un-Nabi e colaboradores (2007). As amostras passaram por 3 ciclos de 48 h a temperaturas de -4 ± 2 °C e 25 ± 2 °C. 4.5.3 Obtenção e estudo de estabilidade preliminar das nanoemulsões contendo extrato A partir dos resultados encontrados, o extrato mole das cascas da R. ferruginea foi incorporado na concentração de 0,5% nas formulações 5:5:70 e 6:4:20 para averiguar a compatibilidade entre as formulações e o extrato. A escolha da concentração de 0,5% do extrato baseou-se no resultado obtido em estudo farmacológico preliminar de atividade anti-inflamatória tópica no modelo de edema de orelha induzido por óleo de cróton, Figura 30 do item 5.11, realizado em parceria com a Profa. Dra. Marcia Maria de Souza do Laboratório de Farmacologia in vivo da UNIVALI, descrito no item 4.11.2. Neste estudo o extrato foi incorporado nas concentrações de 0,25%, 0,5% e 1,0% em creme convencional. A formulação do creme é apresentada no Quadro 4. Para a incorporação do extrato na formulação do creme, o mesmo foi previamente dissolvido em propilenoglicol em quantidade suficiente, e adicionado à formulação pronta do creme. 73 Quadro 4 - Composição do creme convencional utilizado nos ensaios farmacológicos, liberação in vitro e permeação cutânea in vitro. Fase Oleosa Aquosa Agente de consistência Componente/Função Concentração Vaselina líquida/emoliente 1,0% Crodalan®/emoliente 13,3% Miristato de isopropila/emoliente 2,0% Álcool cetoestearílico/emulsionante 3,0% BHT/antioxidante 0,1% Phenonip®/conservante 0,7% Água destilada/veículo Qsp EDTA/sequestrante 0,1% Sepigel®/polímero 7,5% Para a incorporação do extrato nas nanoemulsões, inicialmente o extrato foi adicionado na fase oleosa composta por tensoativos e óleo. As fases oleosa e aquosa (água q.s.p.) foram levadas ao aquecimento em banho-maria até a temperatura de 80 °C. Devido à ocorrência de precipitação do extrato com aderência no fundo do recipiente, foram realizados diversos testes para a dispersão do extrato na fase oleosa (dispersão somente na mistura de tensoativos e depois adição de óleo; dissolução em propilenoglicol com posterior adição da mistura de tensoativos seguida pela adição do óleo). Por não ter sido possível adicionar diretamente o extrato na fase oleosa, optouse pela prévia dissolução do extrato mole em propilenoglicol e posterior adição da água, com homogeneização sob aquecimento em banho-maria, método este que permitiu a completa dispersão do extrato. Assim o extrato mole da casca da R. ferruginea foi incorporado nas formulações dissolvido na fase aquosa, a qual foi gotejada sob agitação a 600 rpm e sob aquecimento a 80 °C sobre a fase oleosa da formulação acrescida de 0,75% de preservante Phenonip® (composto por butilparabeno, etilparabeno, metilparabeno, fenoxietanol e propilparabeno). A mistura permaneceu sob agitação a 600 rpm por mais 5 min, sob aquecimento e posteriormente mais 3 min sem aquecimento. Este procedimento foi repetido para cada uma das formulações (5:5:70 e 6:4:20) em duplicata, para estudo da estabilidade preliminar das nanoemulsões contendo extrato. Para aumento da viscosidade das nanoemulsões, nas formulações com e sem extrato foi incorporado Sepigel® 305, um espessante polimérico pré-neutralizado em 74 emulsão inversa. A adição do Sepigel® 305 foi progressiva até a obtenção de uma formulação com consistência adequada para aplicação tópica, por isso para cada formulação a quantidade adicionada do agente de consistência variou de acordo com as características individuais de cada formulação. Além disso a incorporação do Sepige® foi após o esfriamento da nanoemulsão. A formulação de cada amostra contendo ou não Sepigel® está representada no quadro 5. Quadro 5 - Composição das nanoemulsões com e sem extrato mole de R. ferruginea e com e sem Sepigel® testadas no estudo de estabilidade preliminar. Amostra Óleo Tensoativo Água Extrato Propilenoglicol Sepigel® % % % % % % 5:5:70 6,3 6,3 87,5 - - - 5:5:70 S 6,3 6,3 87,5 - - 0,96 5:5:70 RF 6,3 6,3 85,4 0,5 1,0 - 5:5:70 RFS 6,3 6,3 85,4 0,5 1,0 1,50 6:4:20 20,0 13,3 66,7 - - - 6:4:20 S 20,0 13,3 66,7 - - 0,85 6:4:20 RF 20,0 13,3 64,7 0,5 1,0 - 6:4:20 RFS 20,0 13,3 64,7 0,5 1,0 0,85 Nota: S: com Sepigel®; RF: com extrato mole de R. ferruginea; RFS: com extrato mole de R. ferruginea e Sepigel®, somente números: sem extrato e sem Sepigel ® Após o preparo de cada uma das amostras, as mesmas permaneceram 24 h em repouso, e foram avaliadas quanto ao aspecto físico, pH, teste de centrifugação, tamanho das gotículas e índice de polidispersibilidade (PDI). As análises foram realizadas no tempo inicial (t0) e no tempo final (tf ) do estudo. Devido à instabilidade observada no estudo preliminar com as nanoemulsões contendo extrato incorporado na fase aquosa com concentração de 0,5%, foram realizados estudos com a incorporação do extrato na fase oleosa, usando 2 ou 5% de propilenoglicol para prévia dissolução do extrato. Novamente as formulações demonstraram perda de estabilidade. Decidiu-se realizar novo estudo de estabilidade preliminar, reduzindo a concentração do extrato para 0,25% e 0,13%, usando 2% de propilenoglicol para sua prévia dissolução e incorporação na fase oleosa. 75 4.6 Caracterização das nanoemulsões Partindo dos resultados obtidos no estudo de estabilidade preliminar, a formulação escolhida para a continuidade dos estudos para etapa de caracterização foi a 6:4:20, representada no Quadro 6. Quadro 6 - Composição da nanoemulsão selecionada para incorporação do extrato mole de R. ferruginea. Fase Oleosa Componente/Função Concentração Miristato de Isopropila/emoliente 20% Alkest® CSO 400 + Span® 80 (7,2:1,5)/tensoativos 13,3% Phenonip®/conservante 0,75% Água destilada/veículo 65,95% Sepigel®/polímero 0,85% Aquosa Agente de consistência O extrato foi incorporado na fase oleosa na concentração de 0,25% e 0,13% e, após estudo de eficácia em modelo farmacológico, conforme metodologia descrita no item 4.11.2, os estudos de caracterização foram conduzidos com a formulação contendo 0,13% de extrato. O extrato foi incorporado na nanoemulsão na fase oleosa após prévia dissolução em 2% de propilenoglicol, sob aquecimento. Esta solução foi adicionada à fase oleosa contendo os tensoativos e conservantes. A fase aquosa foi adicionada gota a gota, sob agitação a 600 rpm e 85 °C. Após o término da adição da fase aquosa, o sistema permaneceu sob agitação por 5 min, foi retirado do aquecimento e agitado por mais 3 min. O Sepigel® foi adicionado ao sistema após o resfriamento do mesmo. As nanoemulsões obtidas, com e sem extrato, foram caracterizadas usando os métodos descritos a seguir. 4.6.1 Aspecto visual e estabilidade física Após 24 h de preparo, as nanoemulsões foram analisadas quanto aos aspectos visuais: cor, separação de fases e cremeação. A estabilidade física foi verificada por percepção direta de cor e separação de fases das nanoemulsões após centrifugação a 3000 rpm por 30 min (ANVISA, 2004). 76 4.6.2 Análise morfológica O aspecto morfológico das nanoemulsões foi analisado usando microscopia eletrônica de transmissão (MET). A nanoemulsão foi diluída na proporção de 1:100, em água destilada, e uma gota desta solução foi depositada sobre uma grade de cobre de 400 mesh coberta com filme FormVar/Carbono, e deixado em repouso por 1 h para permitir a secagem. Sobre a grade com a nanoemulsão, foi adicionado 1 gota de contraste negativo à base de acetato de uranila a 2% e deixado em contato por 10 minutos. O excesso de contraste foi retirado com papel filtro e a grade foi analisada diretamente no MET a temperatura ambiente e 80 kV. A análise foi feita no Centro de Microscopia Eletrônica da Universidade Federal do Paraná (UFPR) em parceria com a Profa. Dra. Joana Lea Meira Silveira. 4.6.3 Análise da distribuição de tamanho de gota e potencial zeta O tamanho médio da fase interna, a distribuição de tamanho e o potencial zeta das nanoemulsões desenvolvidas foram determinados por espectroscopia de correlação de fótons (DLS) no Laboratório de Pesquisa em Tecnologia Farmacêutica da UNIVALI. Para a análise do tamanho das gotículas a amostra foi diluída na proporção 1:100 em água ultrapura. O resultado foi expresso como média de 3 aferições. As análises foram realizadas a 25 ± 2 ºC. 4.6.4 Comportamento reológico A análise do comportamento reológico das nanoemulsões com e sem extrato de R. ferruginea foi realizada em viscosímetro rotacional tipo cone-placa a 25 °C. A amostra foi analisada em 3 etapas: rotação de 0-80 1/s por 180 segundos; rotação constante de 80 1/s por 180 segundos e rotação de 80-0 1/s por 180 segundos, retornando ao ponto estático (CZEPULA, 2006). Em cada etapa foram coletados 100 dados. 4.6.5 Quantificação dos marcadores da R. ferruginea por Cromatografia Líquida de Alta Eficiência (CLAE) Para análise quantitativa das formulações por CLAE foi usada metodologia analítica desenvolvida e validada por Zermiani et al. (2014). Foi pesado 0,5 g da 77 formulação dissolvido em 5 mL de acetonitrila e submetido ao banho de ultrassom por 20 minutos. A solução foi então centrifugada a 3000 rpm por 10 minutos e o sobrenadante filtrado e analisado em triplicata. A partir do resultado da triplicata das áreas obtidas nas análises dos padrões de AMA e AMB, foi calculado o teor médio e o desvio padrão nas amostras. 4.7 Estudo de estabilidade acelerada da nanoemulsão Amostras de nanoemulsões com e sem extrato foram avaliadas quanto à estabilidade acelerada. As amostras foram mantidas à temperatura ambiente (23 ± 2 °C) e a 40 ± 2 °C por 6 meses e foram avaliados aspectos como aparência (cor, separação de fases), tamanho de gota por DLS, potencial zeta, reologia, pH e quantificação dos marcadores do extrato por CLAE. As avaliações foram realizadas no tempo zero, 30, 90 e 180 dias. 4.8 Avaliação do potencial irritante das nanoemulsões contendo R. ferruginea As nanoemulsões e cremes contendo ou não o extrato de R. ferruginea tiveram o seu potencial de irritação cutânea avaliados em duplicata pelo método da difusão em gel de agarose (Agarose overlay) de acordo com o Guia para Avaliação de Segurança de Produtos Cosméticos (ANVISA, 2003) e a Farmacopeia Americana (UNITED STATES PHARMACOPEIA, 2007), seguindo o método desenvolvido pelo Laboratório de Farmacologia In Vitro da Univali. O ensaio foi feito em parceria com a doutoranda Liliani Thiesen. A suspensão celular de fibroblastos (L929) a 300.000 células/mL foi tripsinizada e transferida na concentração de 2 mL/poço em placa de 6 poços. Após 24 h, o meio de cultura foi substituído por DMEM contendo 0,01% de vermelho neutro como corante vital e mantido por 1 h no escuro até aparecimento de coloração vermelha celular. Após este período, o excesso de corante vital foi removido e cada poço lavado com PBS. Em cada poço foi adicionado 3 mL de uma mistura na proporção 1:1,2 de meio agarose:meio DMEM (mistura overlay). As placas permaneceram por 15 minutos em temperatura ambiente para secagem. As amostras das nanoemulsões e cremes foram incorporadas em discos de papel (0,54 cm), previamente lavados com PBS e secos, com posterior autoclavação 78 (121 °C/20 min). Como controle positivo foi usada a solução de Triton X-100 e como controle negativo o meio DMEM. As placas foram incubadas por 24 h em estufa a 37 °C com 5% de CO2. O grau de irritação foi avaliado pela zona de lise (zona com ausência de incorporação do corante vital), usando um paquímetro e a avaliação seguiu a classificação descrita pela Farmacopéia Americana (UNITED STATES PHARMACOPEIA, 2007), conforme quadro 7. Quadro 7 - Grau de reatividade para teste de difusão em ágar. Grau Reatividade Descrição da Zona de Reatividade 0 Nenhuma 1 Leve 2 Médio Zona limitada a área embaixo da amostra 3 Moderado A zona se estende de 0,5 a 1,0 cm além da amostra 4 Severo A zona se estende mais que 1,0 cm além da amostra Nenhuma zona detectável em torno ou embaixo da amostra Algumas células malformadas ou degeneradas embaixo da amostra Fonte: United States Pharmacopeia, 2007. 4.9 Análise de liberação in vitro da nanoemulsão contendo extrato da R. ferruginea O estudo de liberação dos marcadores do extrato de R. ferruginea incorporados na nanoemulsão e creme e do extrato mole a 0,13% em propilenoglicol, foi conduzido em células de difusão de Franz (n=6), com área de difusão de 1,53 cm² e com volume do compartimento receptor de 6,5 mL, interligadas a um banho termostatizado estabilizado a 32 °C e dispostas sobre uma placa magnética para promover agitação constante do meio receptor a 600 rpm. A escolha do meio receptor foi realizada mediante ensaio de solubilidade do extrato mole na concentração de 3,482 mg/mL, ou seja, 10 vezes a concentração dos marcadores no extrato usado na formulação, para garantir a condição sink do ensaio. Foram testadas diversas soluções para garantir a solubilidade, como álcool 25%, 50% e 70% e tampão fosfato pH 7,2 com 30% de PEG 400. Como melhor meio receptor, foi selecionado o sistema solvente álcool 70%. 79 O compartimento receptor de cada célula de Franz foi preenchido com o meio receptor. Sobre este compartimento, a membrana de acetato de celulose (membrana de diálise), previamente hidratada por 12 h em água destilada, foi disposta de maneira a evitar a formação de bolhas. Acima da membrana, foi disposto um disco de teflon que teve seu orifício completamente preenchido com 300 mg de cada formulação e do extrato mole em solução. A oclusão da formulação e da solução de extrato foi feita com disco de acrílico, demonstrado na Figura 6. Cada célula foi selada com anel metálico e fechada com trava de metal, conforme demonstrado na Figura 7. Só então a placa magnética foi acionada para que a agitação ocorresse. A agitação foi cessada a cada coleta das amostras. Figura 6 - Foto demonstrativa da montagem da célula de Franz com nanoemulsão. Figura 7 - Foto demonstrativa do detalhe do sistema das células de difusão de Franz fechado e da coleta das amostras. 80 A coleta das amostras foi realizada adicionando 1 mL de meio receptor fresco, armazenado em béquer com circulação externa de água a temperatura constante de 32 °C, com auxílio de seringa, através da válvula localizada no braço inferior da célula. Assim igual volume do meio receptor contido no compartimento receptor da célula, foi coletado através da cânula de amostragem localizada no braço superior da célula, demonstrado na Figura 7. As amostras foram coletadas nos tempos de 1, 2, 4, 6, 8, 12 e 24 h. As amostras foram analisadas por CLAE para quantificação dos marcadores AMA e AMB, após filtração. A massa dos marcadores acumulada no compartimento receptor em cada tempo foi calculada considerando a área efetiva para a liberação na célula. Para avaliação da cinética de liberação, os perfis de liberação obtidos a partir das formulações foram ajustados aos modelos matemáticos de ordem zero, primeira ordem, modelo de Higuchi e equação geral de liberação (BIDONE et al., 2014; BRUSCHI et al., 2007). 4.10 Estudo de permeação cutânea in vitro das nanoemulsões contendo extrato de R. ferruginea O ensaio de permeação cutânea também foi realizado em células de difusão de Franz (n=6) empregando nanoemulsão e creme convencional contendo 0,13% de extrato de R. ferruginea e extrato mole a 0,13% em propilenoglicol. A solução receptora foi composta de solução hidroalcoólica a 70% garantindo a condição sink, determinado em ensaio de solubilidade do extrato descrito no item 4.9. O procedimento da análise foi realizado nas mesmas condições dos estudos de liberação in vitro (item 4.9). Como membrana foi utilizada pele de orelha de porco. As orelhas foram obtidas no Frigorífico Antônio Carlos (Antônio Carlos-SC). Antes do ensaio, as orelhas foram limpas em água corrente, secas com papel toalha e embrulhadas em papel alumínio. As orelhas limpas foram armazenadas em congelador até o momento do uso. Antes do uso, as orelhas foram descongeladas à temperatura ambiente. A pele da face anterior da orelha foi depilada com lâmina e seccionada em círculos em áreas sem a presença de lesões, vasos sanguíneos e manchas. Os cortes foram realizados com auxílio de bisturi e pinça, evitando a retirada do tecido adiposo. Os cortes de pele foram hidratados por 12 h em solução tampão fosfato pH 7,2. 81 Os cortes circulares de pele foram dispostos sobre cada célula de Franz preenchida com o meio receptor, evitando a formação de bolhas. Acima da membrana, foi colocado um disco de teflon que teve seu orifício completamente preenchido com 300 mg de cada formulação e do extrato mole em solução. O procedimento de oclusão, fechamento e condução do ensaio foi semelhante ao realizado para o ensaio de liberação in vitro (item 4.9). Amostras da solução receptora (1 mL) foram coletadas em diferentes intervalos de tempo (1, 2, 4, 6, 8, 12 e 24 h), com reposição simultânea, como descrito no item 4.9, filtradas e quantificadas por CLAE, empregando metodologia descrita no item 4.6.5. Além da análise de quantificação dos marcadores AMA e AMB na solução receptora, foi realizada análise da formulação remanescente na pele ao final do ensaio (tempo de 24 h), no estrato córneo e na pele. Para análise da formulação remanescente, foi retirado o seu excesso sobre a pele com o auxílio de uma gaze umedecida em água destilada e com 2 fitas adesivas que foram aderidas sobre a pele e retiradas em sequência. A formulação em excesso juntamente com a gaze e as fitas foram colocadas em um tubo tipo Falcon contendo 5 mL de acetonitrila para extração em banho de ultrassom por 1 h. O estrato córneo da área da pele que ficou em contato com a formulação foi retirado por tape stripping e a pele viável coletada. As amostras foram analisadas quanto à retenção dos marcadores AMA e AMB. Para o tape stripping foram utilizadas 10 fitas adesivas. As fitas foram aderidas sobre a pele, permanecendo em contato por 30 segundos, realizando uma pressão com um peso padrão de 200 g, e então retiradas e colocadas, todas juntas, em um tubo tipo Falcon contendo 5 mL de acetonitrila para extração, conforme descrito anteriormente. A pele viável foi cortada em pequenos pedaços com um bisturi e colocados em um tubo tipo Falcon com 5 mL de acetonitrila para extração, conforme descrito anteriormente. Após a extração, o líquido foi transferido para outro tubo tipo Falcon e centrifugado a 3000 rpm por 10 minutos. O sobrenadante foi analisado por CLAE conforme metodologia descrita no item 4.6.5. Os resultados foram expressos em concentração do marcador em função do tempo (OECD, 2004). 82 4.11 Ensaios farmacológicos da atividade anti-inflamatória Os ensaios farmacológicos para avaliação da atividade anti-inflamatória tópica do extrato, das nanoemulsões e do creme contendo o extrato, bem como a quantificação de mediadores químicos e análise histológica foram realizados nos laboratórios de Farmacologia in vivo e Farmacologia in vitro do Programa de PósGraduação em Ciências Farmacêuticas da UNIVALI com auxílio da Pós-doutoranda Kathryn A. B. S. da Silva. 4.11.1 Animais Para os ensaios farmacológicos foram utilizados camundongos Swiss fêmeas entre 2 a 3 meses de idade (25 a 30 g), oriundos do Biotério Central da Univali. Os animais foram mantidos no biotério setorial em caixas com maravalha, com no máximo 20 animais/caixa com ciclo claro/escuro de 12 h, aclimatados a temperatura de 22 ± 2 °C e tratados com água e ração ad libitum, inclusive durante os experimentos. As caixas foram trocadas em dias alternados por técnico responsável conforme rotina interna do biotério. Os animais permaneceram no biotério por no máximo 3 dias. Durante os experimentos, os mesmos foram conduzidos para a sala experimental e permaneceram em ambientação por um período mínimo de 1 h. Água e comida foram oferecidas, livremente, inclusive durante os experimentos. Os experimentos foram aprovados pela Comissão de Ética no Uso de Animais – CEUA/UNIVALI sob Nº de Parecer: 03/2014 (ANEXO A). Para a avaliação da atividade anti-inflamatória do extrato incorporado em creme para definição da concentração de extrato a ser incorporado nas nanoemulsões, conforme item 4.5.3, cada grupo experimental teve 8 animais, os quais integraram os seguintes grupos experimentais: G1 – controle negativo (animais sem tratamento); G2 – grupo tratado com o creme veículo sem o extrato; G3 – grupo tratado com o creme contendo 1,0% do extrato; G4 – grupo tratado com o creme contendo 0,5% do extrato; G5 – grupo tratado com o creme contendo 0,25% do extrato; G6 – grupo tratado com o creme contendo AMB 0,5%; G7 – grupo tratado com o creme contendo AMB 0,1%; G8 – grupo tratado com o creme contendo 0,1% de dexametasona. Para a avaliação da atividade anti-inflamatória do extrato incorporado nas nanoemulsões, cada grupo experimental teve um número de 6 animais, os quais integraram os seguintes grupos experimentais: G1- controle negativo (animais sem 83 tratamento); G2-grupo tratado com nanoemulsão sem extrato da planta; G3-grupo tratado com nanoemulsão contendo 0,13% do extrato da planta; G4 –grupo tratado com nanoemulsão contendo 0,25% do extrato da planta; G5 - grupo tratado com creme sem extrato da planta; G6 – grupo tratado com creme contendo 0,13% do extrato da planta; G7 – grupo tratado com creme contendo 0,25% do extrato da planta; G8 – grupo tratado com creme contendo 0,50% do extrato da planta; G9 - (controle positivo) grupo tratado com creme contendo 0,1% de dexametasona. Foram portanto, 9 grupos de 6 animais para cada experimento. 4.11.2 Avaliação da atividade anti-inflamatória in vivo da R. ferruginea e do AMB incorporados em creme convencional e nanoemulsão A avaliação com o creme convencional contendo o extrato e o AMB, foi realizada previamente ao desenvolvimento da nanoemulsão, com o objetivo de definir a concentração do extrato para incorporação na nanoemulsão, conforme item 4.5.3. Os cremes e as nanoemulsões contendo extrato de R. ferruginea e o composto isolado AMB foram avaliados quanto a ação anti-inflamatória de acordo com o método de edema de orelha induzido pelo óleo de cróton em camundongos, descrito por Carlson e colaboradores (1985) com algumas modificações. Foi empregado como controle negativo a formulação sem extrato e como controle positivo creme contendo 0,1% de dexametasona. As orelhas (esquerda e direita) tiveram suas espessuras medidas com o auxílio de um micrômetro digital 6 h após a aplicação do óleo de cróton. Os animais foram tratados com os cremes através da aplicação direta de 50 µL da formulação na superfície interna do pavilhão de cada orelha direita. O óleo de cróton a 2,5% (v/v) foi dissolvido em acetona PA e, 20 µL desta solução foi aplicado na superfície externa da orelha direita, após 30 minutos dos respectivos tratamentos. Os animais foram eutanasiados por decapitação para a medida das espessuras das orelhas. A medida da espessura das orelhas foi realizada utilizando um micrômetro digital, aplicado no centro do lóbulo de cada orelha. A diferença de espessura das orelhas esquerda e direita foi calculada para cada tratamento para posterior análise do efeito anti edematogênico e os valores foram expressos em µm. Os dados obtidos foram analisados estatisticamente usando análise de variância e o Teste de Comparação Múltipla Newman-Keuls usando GraphPad Prism software versão 5. O nível de significância foi p < 0.05. 84 4.11.3 Dosagem de citocinas em pele inflamada tratada com creme e nanoemulsões contendo R. ferruginea Nova indução do processo inflamatório foi realizada conforme descrito no item 4.11.2. Após os respectivos tratamentos e 6 h após a indução do edema de orelha pela aplicação do óleo de cróton, fragmentos com 6 mm2 de diâmetro foram coletados, com o auxílio de um perfurador de metal, das orelhas direita de cada animal e imersos em nitrogênio líquido e armazenados a - 80 °C. Os tecidos foram preparados seguindo metodologia descrita por Otuki e colaboradores (2005), com algumas adaptações. Os tecidos removidos das orelhas foram homogeneizados em tampão fosfato salina (PBS) contendo 0,05% de Tween® 20, fluoreto de fenilmetilsulfonila 0,1 mM, cloreto de benzometônio 0,1 mM, EDTA sódico 10 mM, e aprotinina A 2 ng/mL. Em seguida, o homogeneizado foi centrifugado a 3.000 g por 10 minutos a 4 ºC, e o sobrenadante armazenado a -80 ºC até o momento da análise. Os níveis teciduais das citocinas interleucina 1β (IL-1β), quimiocina derivada de queratinócitos (KC) e fator de necrose tumoral (TNF), foram determinados usando um kit de ensaio imunoenzimático ELISA (enzyme-linked immuno-sorbent assay) seguindo as recomendações do fabricante. Resumidamente, uma placa de 96 poços foi incubada por aproximadamente 16 h com anticorpo de captura. Posteriormente, a placa passou por 3 lavagens com wash buffer (tampão fosfato salina (PBS) contendo 0,05% de Tween® 20) e incubada por 1 h com 300 µL de tampão de bloqueio em cada poço da placa. Após 3 lavagens, 100 µL de diluições seriadas da citocina em estudo e das amostras foram adicionadas a cada poço da placa e incubada por 2 h. Após 3 lavagens foi adicionado 100 µL de anticorpo de detecção em cada poço, e a placa foi novamente incubada por 2 h. A placa foi lavada por 3 vezes e foi adicionado 100 µL de streptavidina em cada poço, seguido da incubação da placa por 20 minutos ao abrigo da luz. Após 3 lavagens foi adicionado 100 µL de solução de substrato em cada poço seguido da incubação da placa por 20 minutos ao abrigo da luz. Ao término deste tempo, a reação foi interrompida com a adição de 50 µL da solução de bloqueio (H2SO4 à 2N), com posterior leitura dos resultados em leitor de microplaca em dois comprimentos de onda, 450 nm e 550 nm. Os resultados foram expressos como pg de citocina/mg de tecido. Os dados obtidos foram analisados estatisticamente usando análise de variância e o Teste de Comparação Múltipla Newman-Keuls usando GraphPad Prism software versão 5. O nível de significância foi p < 0.05. 85 4.11.4 Determinação da atividade da mieloperoxidase (MPO) em pele inflamada tratada com creme e nanoemulsões contendo R. ferruginea Nova indução do processo inflamatório foi realizada conforme descrito no item 4.11.2. Após os respectivos tratamentos e 6 h após a indução do edema de orelha pela aplicação do óleo de cróton, fragmentos com 6 mm2 de diâmetro foram coletados, com o auxílio de um perfurador de metal, das orelhas direita de cada animal 6 h após a aplicação do óleo de cróton e imersos em nitrogênio líquido e armazenados a -80 °C. Os fragmentos congelados do tecido removido das orelhas foram preparados de acordo com metodologia descrita por Otuki e colaboradores (2005), com algumas modificações. Inicialmente, os tecidos foram homogeneizados com tampão I pH 4,7 (contendo 0,58% de cloreto de sódio, 0,56% de EDTA, 0,3% de fosfato de sódio (NaH2PO4) e 0,28% de fosfato dissódico (Na 2HPO4), na proporção de 100 mL de tampão I para cada 5 g de pele. O homogeneizado foi centrifugado a 10.000 g por 15 minutos a 4 °C. O sobrenadante foi descartado e a amostra foi ressuspendida com 111 µL de tampão I, utilizando um vortex. A cada amostra foi adicionado 333 µL de solução de NaCl 0,2% com agitação em vortex. Após 30 segundos, foi adicionado à amostra, 333 µL de solução de glicose a 5% contendo NaCl 1,6%, como posterior agitação em vortex. As amostras foram centrifugadas a 10.000 g por 15 minutos a 4 °C. O sobrenadante foi desprezado e a amostra foi ressuspendida com adição tampão II pH 5,4 (contendo 0,5% de brometo de hexadeciltrimetilamônio, 0,78% de NaH2PO4 e 0,71% de Na2HPO4), na proporção de 100 mL de tampão II para cada 5 g de amostra. As amostras ressuspendidas passaram por 3 ciclos de congelamento em nitrogênio líquido e descongelamento em banho-maria a 37 °C, sendo posteriormente centrifugadas a 10.000 g por 15 minutos a 4 °C. Duplicatas de 25 µL de amostra do sobrenadante resultante foram adicionadas a uma placa com 96 poços, seguido de uma duplicata do branco (solução de NaPO 4 0,08 M). A reação teve início com a adição de 25 µL de solução a 3,8 mg/mL de brometo de hexadeciltrimetilamônio em dimetilsufóxido (DMSO) em todos os poços ao abrigo da luz, com incubação a 37 °C por 5 minutos. Posteriormente foi adicionado 100 µL de peróxido de hidrogênio diluído em NaPO4 0,08 M, em todos poços com incubação da placa a 37 °C por 5 minutos. A atividade enzimática foi determinada colorimetricamente usando leitor de microplaca em 650 nm. Os resultados foram 86 expressos em densidade óptica/mg de tecido. Os dados obtidos foram analisados estatisticamente usando análise de variância e o Teste de Comparação Múltipla Newman-Keuls usando GraphPad Prism software versão 5. O nível de significância foi p < 0.05. 4.11.5 Análise histológica em pele inflamada tratada com creme e nanoemulsões contendo R. ferruginea Após os respectivos tratamentos e 6 h após a indução do edema de orelha pela aplicação do óleo de cróton, descrito no item 4.11.2, foram coletados fragmentos de 6 mm2 das orelhas direitas, seccionados longitudinalmente e mantidos em paraformaldeído 4% (PFA) por 24 h. O processamento dos tecidos foi realizado através da desidratação por passagens sucessivas em etanol de concentrações crescentes (etanol 70%, etanol 80%, etanol 90% e, finalmente, etanol absoluto) e em seguida dois banhos de xilol por 30 minutos, com a finalidade de tornar os tecidos translúcidos (etapa de clareamento ou diafanização). Quando os tecidos tornaram-se translúcidos, foram colocados na parafina, na qual passaram por três banhos de 1 h até o processo de inclusão (montagem do bloco e posicionamento do tecido). Foram realizados cortes com espessura de 4 µm em micrótomo disponibilizado pelo LAFEX (Laboratório de Farmacologia Experimental – UFSC), e posteriormente foram corados em coloração de hematoxilina e eosina (HE) para avaliação dos sinais de inflamação, como por exemplo infiltrado celular e edema (espessura dérmica). Um corte foi selecionado como representativo para análise qualitativa da resposta inflamatória mediada por células. Para este experimento foi incluído um naive para comparação com os demais grupos do experimento. 87 5 RESULTADOS E DISCUSSÃO 5.1 Material vegetal A coleta das cascas de R. ferruginea foi realizada em árvores com 35 cm de diâmetro e na porção inferior do tronco, a 20 cm do solo, baseado nos resultados encontrados para o teor de marcadores nas soluções extrativas (item 5.2). As cascas coletadas foram analisadas quanto ao teor de cinzas totais e insolúveis em ácido e quanto à perda por dessecação, como segue. 5.1.1 Determinação de cinzas totais e cinzas insolúveis em ácido A determinação do teor de cinzas totais permite a verificação de impurezas inorgânicas não-voláteis que podem estar presentes, como contaminantes (FARIAS, 2004). As cinzas insolúveis em ácido compreendem o resíduo obtido das cinzas totais com ácido clorídrico diluído após filtragem, lavagem e incineração. O método destinase à determinação de sílica e constituintes silícicos da droga. As cascas coletadas apresentaram teor de cinzas de 7,25% ± 0,12 para cinzas totais e de 1,78% ± 0,11 para cinzas insolúveis em ácido. Em estudo realizado por Baccarin e colaboradores (2014), o valor de cinzas totais encontrado foi de 7,95% e para cinzas insolúveis em ácido foi de 0,51%. Comparando os resultados obtidos na análise realizada neste estudo com os dados já descritos, o valor para cinzas totais ficou próximo do encontrado anteriormente e o valor para cinzas insolúveis em ácido ficou acima do encontrado anteriormente. Porém como não existe monografia específica na literatura para as cascas da R. ferruginea, esses dados são importantes para, juntamente com a realização de mais determinações, estabelecer os parâmetros de qualidade para a droga vegetal. 5.1.2 Perda por dessecação A perda por dessecação das cascas de R. ferruginea foi de 8,2% ± 0,17%, em trabalho anterior realizado por Baccarin e colaboradores (2014), a perda por dessecação foi de 7,82% ± 0,40. Os dois resultados se mostram próximos e a inexistência de monografia que estabeleça os parâmetros de qualidade para as 88 cascas da R. ferruginea, coloca o resultado dentro das variações farmacopéicas, de 8-14% (FARIAS, 2004). 5.2 Obtenção e Caracterização dos derivados vegetais das cascas de R. ferruginea Na obtenção da solução extrativa das cascas de R. ferruginea, nomeado neste estudo como abril/2013, foi usado o material vegetal coletado em Blumenau (SC) em outubro de 2009, o qual estava armazenado em embalagens lacradas ao abrigo da luz em sala climatizada, sem referência ao diâmetro da árvore em que foi realizada a coleta. Na quantificação por CLAE do teor de AMB na solução extrativa obtida (7,93 mg/g) foi obtido um teor menor do que o obtido no estudo de Baccarin e colaboradores (2014), 70 mg/g, no qual foram usadas cascas de árvore com diâmetro de 20-25 cm. A partir deste resultado, foi realizado um estudo para verificação da variação do teor de marcadores em diferentes diâmetros da árvore da R. ferruginea (15, 21, 25, 35, 38, 59 cm) e também em diferentes condições da árvore como diâmetro com 38 cm na região de calo, em uma árvore caída e em uma árvore morta. Conforme apresentado na Tabela 1, os resultados demonstraram que o maior teor de marcador encontrado foi na casca coletada da árvore com 35 cm de diâmetro de tronco (78,28 mg/g), cujo valor foi semelhante ao obtido por Baccarin et al. (2014).. Portanto, foram coletadas cascas da parte mais superior do tronco, onde se inicia a formação de galhos, de uma árvore com diâmetro de 35 cm. O resultado encontrado para o teor de AMB foi muito baixo novamente (0,79 mg/g), motivando a realização de pesquisa da variação do teor de AMB na casca da árvore com 35 cm de diâmetro com coleta em 3 regiões diferentes do tronco: próxima ao solo (20 cm), superior (próxima dos galhos) e região intermediária entre estas duas. Os resultados encontrados demonstraram que a região mais próxima ao solo possui maior teor de AMB e AMA (21,21 e 22,41 mg/g, respectivamente). Esta foi então a região especificada para a coleta das cascas: árvore com tronco de 35 cm de diâmetro e altura entre 20 e 100 cm do solo. Os resultados das análises foram comparados ao resultado encontrado por Baccarin e colaboradores (2014). Inicialmente, foi considerado somente o teor de AMB, pois de acordo com estudo anterior, este era o marcador majoritário nas cascas de R. ferruginea (TURMINA, 2005). No entanto, com os resultados obtidos no presente 89 estudo, observou-se que a concentração de AMA se assemelha a do AMB nas cascas da R. ferruginea e, conforme revisão bibliográfica, o AMA apresenta igualmente efeito anti-inflamatório (DONG et al., 1999; HIROTA et al., 2002; MIZUSHINA et al., 2000), assim sendo, foram considerados como marcadores para este estudo o AMA e o AMB. A média dos resultados encontrados para o teor de marcadores AMB e AMA em todas as soluções extrativas preparadas encontram-se na Tabela 1. Em algumas amostras de cascas analisadas, foi encontrada maior concentração do marcador AMA do que do AMB. Tabela 1 - Teor de marcadores AMA e AMB nas soluções extrativas das cascas de R. ferruginea. Teor* AMA Teor* AMB Resíduo Seco (mg/g) (mg/g) (%) Abril/2013 12,00 ± 0,05 7,93 ± 0,14 0,791 ± 0,008 15 cm 12,11 ± 0,07 8,09 ± 0,08 0,356 ± 0,362 21 cm 7,97 ± 0,26 6,75 ± 0,06 0,407 ± 0,003 25 cm 48,22 ± 0,87 48,03 ± 0,24 0,580 ± 0,014 35 cm 44,53 ± 0,56 78,28 ± 0,38 0,560 ± 0,040 38 cm 20,65 ± 0,17 12,51 ± 0,06 1,110 ± 0,021 38 cm – calo 261,27 ± 1,78 153,68 ± 0,28 1,110 ± 0,092 59 cm 39,05 ± 0,27 23,91 ± 0,10 1,320 ± 0,030 Árvore Caída 9,06 ± 0,10 19,57 ± 0,08 0,156 ± 0,014 Árvore Morta 11,74 ± 0,27 13,54 ± 0,03 0,115 ± 0,007 0,21 ± 0,03 0,79 ± 0,01 0,900 ± 0,021 3,35 ± 0,09 4,46 ± 0,01 0,575 ± 0,018 11,64 ± 0,05 15,18 ± 0,13 0,520 ± 0,014 22,41 ± 0,10 21,21 ± 0,16 0,753 ± 0,005 Droga vegetal 35 cm – Próximo dos galhos 35 cm – Parte Superior 35 cm – Parte Intermediária 35 cm – Parte Inferior 20 cm do solo *Teor de marcadores expressos em mg/g de resíduo seco. De acordo com estes achados, há grande variabilidade no teor de marcadores AMA e AMB nas cascas da R. ferruginea. Esta variabilidade aparenta estar relacionada à idade da planta (diâmetro do tronco) e da região do tronco. Isso traz embasamento para estudos mais aprofundados a respeito da padronização na coleta das cascas de R. ferruginea. Os resultados encontrados neste trabalho abrem 90 caminho para novas investigações para padronização da região de coleta das cascas de R. ferruginea com o objetivo de extração de maior concentração de marcadores. A partir dos resultados obtidos (Tabela 1), a solução extrativa foi preparada usando 475 g de cascas pulverizadas da R. ferruginea coletadas da árvore com 35 cm de diâmetro e da região próxima ao solo (20 cm de altura). O rendimento da solução após filtração foi de 75,78% (V/V). O processo de maceração dinâmica com possível evaporação do líquido extrator e os processos de filtração (tecido e papel) podem ter influenciado na redução do rendimento da solução extrativa. Após concentração da solução extrativa em estufa de ar circulante, obteve-se o extrato mole com um rendimento de 6,60% (p/p), em relação a droga vegetal seca. Os derivados vegetais obtidos foram analisados quanto aos aspectos organolépticos como cor e odor, pH, resíduo seco, perfil qualitativo em CCD e teor dos marcadores AMA e AMB por CLAE. Os resultados obtidos são apresentados na Tabela 2 e Figura 8. Tabela 2 - Resultados das análises realizadas nos derivados vegetais das cascas da R. ferruginea. Derivado Aspectos organolépticos Resíduo pH (%) Solução Avermelhado, 5,83 ± Extrativa odor alcoólico 0,03 Vinho escuro, 4,21 ± odor adocicado 0,01 Extrato Mole Seco 0,48 ± 0,02 51,17 ± 0,53 Teor AMA* Teor AMB* (mg/g) (mg/g) 42,14 ± 36,88 ± 0,04 0,06 40,06 ± 37,34 ± 0,02 0,09 *Teor dos marcadores expressos em mg/g de resíduo seco obtido. Os resultados demonstram a presença dos ácidos mirsinoicos nos derivados obtidos a partir das cascas da R. ferruginea, com redução do pH no extrato mole, devido a concentração do mesmo e a presença dos ácidos mirsinoicos. O processo de concentração praticamente não provocou alteração no teor de marcadores analisados, demonstrando a estabilidade do extrato frente à temperatura. 91 Figura 8 - Perfil cromatográfico da solução extrativa e do extrato mole das cascas de R. ferruginea por CCD. Nota: AMA - padrão ácido mirsinoico A; AMB -padrão ácido mirsinoico B -; sistema eluente: hexano:acetato de etila (1:1); revelador anisaldeído sulfúrico. Nos estudos realizados por Baccarin e colaboradores (2014), os extratos das cascas de R. ferruginea foram quantificados usando somente o AMB como marcador, e este apresentava maior área do que o pico correspondente ao AMA, o que foi deduzido como tendo o extrato maior concentração de AMB do que AMA. No presente trabalho, além do AMB, usou-se também o AMA como marcador (Figura 9). Conforme apresentado no cromatograma da solução extrativa (Figura 10), embora a área do pico correspondente ao AMA seja menor do que a do AMB, a concentração deste é maior. Esta diferença provavelmente está relacionada com a absortividade desta substância no comprimento de onda usado na análise. O ácido mirsinoico A foi detectado com tempo de retenção de 16,22 minutos (Figura 9a), confirmando sua presença na solução extrativa e no extrato mole das cascas de R. ferruginea no pico 3 (Figura 10 e Figura 11), bem como a do ácido mirsinoico B, detectado com tempo de retenção de 15,79 minutos (Figura 9b), correspondendo ao pico 1 (Figura 10 e Figura 11). 92 Figura 9 - Perfis cromatográficos por CLAE dos padrões de ácidos mirsinoicos A (a) e B (b); 260 nm para o AMA e 270 nm para o AMB. Pureza: 76,2% Pureza: 98,9% Figura 10 - Perfil cromatográfico por CLAE da solução extrativa das cascas de R. ferruginea. 93 Para o extrato mole obteve-se a concentração dos marcadores AMA e AMB, igualmente a partir da determinação do tempo de retenção e do cálculo das áreas dos picos para os marcadores, conforme Tabela 2. O perfil cromatográfico do extrato mole está representado na Figura 11. Figura 11 - Perfil cromatográfico por CLAE do extrato mole das cascas de R. ferruginea. 5.3 Estudos de pré-formulação 5.3.1 Determinação da solubilidade do extrato Uma seleção adequada dos óleos e tensoativos e as suas concentrações ótimas é de extrema importância para se obter nanoemulsões estáveis e clinicamente aceitáveis. O teste de solubilidade do ativo em óleo é tido como um critério de seleção do melhor óleo. A solubilidade do extrato no óleo influencia na manutenção do extrato na forma de solução na fase interna da nanoemulsão (AZEEM et al., 2009). Para a determinação da solubilidade do extrato mole da casca da R. ferruginea em óleo foram selecionados 4 tipos de óleos. A seleção foi baseada na biocompatibilidade, não toxicidade e aceitação clínica dos componentes para uso tópico. Os óleos selecionados estão descritos abaixo: - Triglicérides de ácido cáprico e caprílico (TCC), que são triglicerídes de cadeia média, constituídos principalmente por ésteres de ácidos caprílicos e cápricos derivados do óleo de coco. O que influenciou sua escolha foi a sua alta compatibilidade com a pele, sendo bastante permeável e considerado 94 toxicologicamente e dermatologicamente inócuo e é classificado como GRAS (Generally Recognized As Safe) pelo FDA (EMBRAFARMA). - Miristato de isopropila, é um éster de origem sintética, obtido a partir da reação de esterificação do ácido mirístico com o álcool isopropílico. Com baixo ponto de turvação, é muito usado na formulação de cosméticos, tem excelente emoliência e é um ótimo diluente para óleos vegetais. - Capryol® 90 (monocaprilato de propilenoglicol), tensoativo água/óleo (EHL= 6), solubilizante. Usado em muitos trabalhos como fase oleosa em nanoemulsões. - Cetiol® V (oleato de isodecila), éter emoliente com baixo espalhamento, no entanto, possui composição semelhante aos lipídios da pele. - Cetiol® 868 (estearato de octila), éster emoliente com excelente espalhamento , lubricidade e sobre-engorduramento para a pele. Dá sensação de emoliência sem toque de oleosidade. O teste de solubilidade foi realizado em duplicata para cada tipo de óleo selecionado. Após 24 h do teste, as amostras apresentaram diferenças visuais características (Figura 12). Os tubos contendo os óleos Capryol® (amostras 5 e 6), miristato de isopropila (amostras 3 e 4) e triglicérides cáprico e caprílico (amostras 1 e 2) apresentaram coloração avermelhada homogênea, cor esta característica do extrato mole, demonstrando que o mesmo dispersou nestes óleos. Para confirmar esta informação, as amostras foram analisadas quanto a porcentagem de transmitância e absorbância em espectrofotômetro UV/Visível. Inicialmente foi encontrado o comprimento de onda de maior absorbância da amostra por meio da varredura nos comprimentos de onda entre 190 nm e 800 nm. A transmitância e a absorbância foram analisadas no comprimento de onda selecionado para cada amostra, desconsiderando a absorbância do óleo puro. Os resultados para transmitância e absorbância das amostras são apresentados na Tabela 3. 95 Figura 12 - Aspecto das misturas no teste de solubilidade do extrato mole de R. ferruginea em diferentes óleos: (1) e (2) Poly: triglicérides de ácido cáprico e caprílico (TCC); (3) e (4) MI: miristato isopropila; (5) e (6) Cap 90: Capryol 90; (7) e (8) CeV: Cetiol V; (9) e (10) Ce868: Cetiol 868. Tabela 3 - Valores de transmitância e absorbância da mistura de óleo e extrato mole de R. ferruginea no teste de solubilidade. Amostra Comprimento de Onda (nm) Absorbância Transmitância (T%) Poly (1) 320,5 0,590 25,6 Poly (2) 320,5 0,757 17,5 MI (3) 320,5 0,667 21,7 MI (4) 320,5 0,807 15,6 Cap 90 (5) 320,5 0,877 13,3 Cap 90 (6) 320,5 0,978 10,5 Ce V (7) 356,5 0,261 55,1 Ce V (8) 356,5 0,127 74,3 Ce 868 (9) 320,5 0,246 56,5 Ce 868 (10) 320,5 0,039 91,6 Nota: Poly 1 e 2: extrato mole + triglicérides do ácido cáprico e caprílico; MI 3 e 4: extrato mole + miristato de isopropila; Cap 90 5 e 6: extrato mole + Capryol 90 ®; Ce V 7 e 8: extrato mole + Cetiol V®; Ce 868 9 e 10: extrato + Cetiol 868®. Analisando os resultados para a transmitância e absorbância, foi observado que os menores valores de transmitância e os maiores valores de absorbância foram para as amostras que se apresentaram visualmente com coloração avermelhada homogênea, ou seja, as amostras 1, 2, 3, 4, 5 e 6, onde a luz teve menor penetração e maior absorção devido a coloração, indicando melhor dispersão do extrato. Confirmando que os óleos triglicérides de ácido cáprico e caprílico, miristato de 96 isopropila e Capryol® 90 dispersaram melhor o extrato mole da R. ferruginea. As amostras 5 e 6 contendo o Capryol® 90 apresentaram a menor transmitância e a maior absorbância entre todas as amostras, isto provavelmente se deve a sua função tensoativa, com valor baixo de EHL, o que confirma o seu maior poder de dissolução do extrato. Com isso, este composto foi testado como tensoativo para a análise seguinte de solubilidade. Seguindo estas considerações, os óleos selecionados foram os triglicérides de ácido cáprico e caprílico e o miristato de isopropila. A segunda etapa dos testes de solubilidade do extrato mole de R. ferruginea foi realizada com a mistura de cada um dos dois óleos escolhidos com diferentes tensoativos na proporção de 1:2. A seleção dos tensoativos foi feita baseada em revisão bibliográfica e em estudos anteriores sobre o desenvolvimento de nanoemulsões, levando em conta a biocompatibilidade e não-toxicidade. Baseado nestes critérios foram selecionados 7 tensoativos, sendo 6 não-iônicos devido a capacidade desta classe de tensoativos sofrerem menor influência do pH e alterações na força iônica (AZEEM et al., 2009). Desta forma, foram usados 7 tensoativos diferentes para cada óleo selecionado, realizando-se o teste em duplicata para cada uma das misturas. Os tensoativos escolhidos foram: Labrafil® M 1944 CS, Labrasol®, Alkest® CSO 400, Tween® 80, Span® 80, Tween® 20, Capryol® 90. Após 24 h de teste, observou-se que a temperatura de 25 °C não foi adequada para a realização da análise com os tensoativos Alkest® CSO 400, Tween® 80, Tween® 20, e Span® 80, devido a consistência muito viscosa dos mesmos não permitir a adequada homogeneização das amostras. Assim o teste foi realizado por mais 24 h a uma temperatura de 30 °C para as amostras que empregavam estes tensoativos. As misturas na proporção de 1:2, em duplicata, foram identificadas usando números da seguinte forma: (1) e (2) óleo + Labrafil® M 1944 CS; (3) e (4) óleo + Labrasol®; (5) e (6) óleo + Alkest® CSO 400; (7) e (8) óleo + Tween® 80; (9) e (10) óleo + Span® 80; (11) e (12) óleo + Tween® 20 e (13) e (14) óleo + Capryol® 90. A análise visual das amostras após o teste demonstrou que as misturas de miristato de isopropila (MI) com os tensoativos, amostras 6, 7, 8, 13 e 14 apresentaram coloração mais avermelhada e homogênea, evidenciando que o extrato ficou melhor disperso nestas misturas (Figura 13). A diferença de coloração entre as amostras 5 e 6, e 13 e 14 pode estar relacionada com a ineficiência da agitação durante o teste nas amostras 5 e 13 por causa da aderência do extrato à barra magnética e o vidro do frasco, dificultando a agitação. 97 Figura 13 - Aspecto das misturas no teste de solubilidade do extrato mole de R. ferruginea com óleo miristato de isopropila com diferentes tensoativos: (1) e (2) óleo + Labrafil® M 1944 CS; (3) e (4) óleo + Labrasol®; (5) e (6) óleo + Alkest ® CSO 400; (7) e (8) óleo + Tween® 80; (9) e (10) óleo + Span® 80; (11) e (12) óleo + Tween® 20; (13) e (14) óleo + Capryol ® 90. Já no teste realizado com triglicérides de ácido cáprico e caprílico, as amostras 7, 8, 13 e 14 apresentaram, visualmente, maior dispersão do extrato, quando o óleo foi misturado ao Tween® 80 (amostras 7 e 8) e ao Capryol® 90 (amostras 13 e 14), conforme mostrado na Figura 14. Figura 14 - Aspecto das misturas no teste de solubilidade do extrato mole de R. ferruginea com o óleo triglicérides cáprico caprílico com diferentes tensoativos : (1) e (2) óleo + Labrafil ® M 1944 CS; (3) e (4) óleo + Labrasol®; (5) e (6) óleo + Alkest ® CSO 400; (7) e (8) óleo + Tween® 80; (9) e (10) óleo + Span® 80; (11) e (12) óleo + Tween® 20; (13) e (14) óleo + Capryol ® 90. Para confirmar os resultados encontrados na análise visual das amostras, as mesmas tiveram a transmitância e absorbância medidas por espectrofotometria. Os resultados encontrados são apresentados nas Tabelas 4 e 5 e, confirmaram os resultados da análise visual. Os valores de absorbância para as misturas com miristato de isopropila em ordem decrescente foi Capryol® 90 > Tween® 80 > Alkest® CSO 400 > Labrafil® M 1944 CS > Tween® 20 > Labrasol® > Span® 80. 98 Tabela 4 - Resultados da análise de transmitância das amostras do teste de solubilidade do extrato mole de R. ferruginea em miristato de isopropila e diferentes tensoativos. Amostra Comprimento de Absorbância Transmitância (T%) 350 2,039 0,9 350 1,665 2,2 MI Sol (3) 350 0,592 25,6 MI1 Sol3 (4) 350 0,536 29,2 MI1 Alk4 (5) 350 1,699 2,4 350 2,408 0,8 MI Tw80 (7) 395,5 2,635 0,5 MI1 Tw805 (8) 395,5 2,150 0,7 MI1 Sp806 (9) 671 - 286 193,6 MI1 Sp806 (10) 671 - 324 211,4 MI Tw20 (11) 369 1,317 4,8 MI1 Tw207 (12) 369 1,521 3,1 MI1 Cap908 (13) 350 1,702 2 MI1 Cap908 (14) 350 4,000 0 MI1 Fil2 (1) 1 2 MI Fil (2) 1 1 3 4 MI Alk (6) 1 1 5 7 Onda (nm) Nota: 1Miristato de isopropila; 2Labrafil® M 1944 CS; 3Labrasol®; 4Alkest ® CSO 400; 5Tween® 80; 6Span® 80; 7Tween® 20; 8Capryol® 90. 99 Tabela 5 - Resultados da análise de transmitância das amostras do teste de solubilidade do extrato mole de R. ferruginea em triglicérides de ácido cáprico e caprílico e diferentes tensoativos. Amostra Comprimento de Absorbância Transmitância (T%) 350 0,813 15,6 350 0,726 18,7 Poly Sol (3) 350 0,416 38,4 Poly1 Sol3 (4) 350 0,547 28,4 Poly1 Alk4 (5) 350 1,473 3,4 350 1,355 4,9 Poly Tw80 (7) 384,5 1,597 2,5 Poly1 Tw805 (8) 384,5 1,601 3,0 Poly1 Sp806 (9) 395,2 - 208 161,3 Poly1 Sp806 (10) 395,2 - 0,099 125,7 Poly Tw20 (11) 369 1,147 7,1 Poly1 Tw207 (12) 369 1,171 6,7 Poly1 Cap908 (13) 350 4,000 0 Poly1 Cap908 (14) 350 4,000 0 Poly1 Fil2 (1) 1 2 Poly Fil (2) 1 1 3 4 Poly Alk (6) 1 1 5 7 Onda (nm) Nota: 1Triglicérides de ácido cáprico e caprílico; 2Labrafil® M 1944 CS; 3Labrasol®; 4Alkest ® CSO 400; 5Tween® 80; 6Span® 80; 7Tween® 20; 8Capryol® 90. Avaliando os resultados encontrados, foi selecionado como óleo o miristato de isopropila e os tensoativos Capryol® 90, Tween® 80 e Alkest® CSO 400 para o desenvolvimento das nanoemulsões. 5.3.2 Determinação do coeficiente de partição do extrato mole O coeficiente de partição (log de P) de uma substância em n-octanol/água é um parâmetro matemático que prediz o transporte desta substância através das membranas biológicas, uma delas a sua penetração percutânea, descrevendo a distribuição de uma substância entre a fase aquosa, o veículo, e a fase lipídica, o estrato córneo (GOMBAR; ENSLEIN, 1996; KORINTH et al., 2012). O octanol simula de modo simplificado a barreira lipídica do estrato córneo auxiliando na predição da penetração de substâncias químicas na pele, sendo a permeabilidade dessas substâncias diretamente proporcional aos seus coeficientes de partição (KORINTH et al., 2012). O coeficiente de partição n-octanol/água para o extrato mole de R. ferruginea foi realizado através da adição de uma solução aquosa contendo o extrato ao octanol 100 saturado pela água. A análise dos marcadores AMA e AMB em CLAE das fases aquosas do teste de partição não detectou a presença dos mesmos, o que indica que a partição é de 100% dos marcadores para o octanol, ou seja, estes compostos migram da fase aquosa para a fase lipídica simulada. Em ensaio de determinação do coeficiente de partição para os marcadores AMA e AMB usando o método de CLAE de fase reversa, Zermiani (2014) encontrou o log de P de 3,30 e 3,21, respectivamente. Estes valores indicam que os marcadores AMA e AMB do extrato das cascas de R. ferruginea possuem alta lipofilicidade, sugerindo que quando aplicados na pele irão migrar do veículo aquoso para o estrato córneo, aumentando a penetração percutânea dos mesmos (KORINTH et al., 2012). 5.4 Desenvolvimento das nanoemulsões 5.4.1 Construção do diagrama de fases pseudoternário Sabe-se que a mistura de tensoativos tem uma eficiência melhor na formação de nanoemulsões, do que o uso de tensoativos puros, dispersando-se e dissolvendose mais rapidamente dentro da fase contínua (PENG et al., 2010). A otimização dos sistemas, neste estudo, foi realizada usando o diagrama de fases pseudoternário obtido pelos métodos de titulação e ponto a ponto e com três diferentes misturas de tensoativos considerando o valor de EHL do miristato de isopropila (EHL 11,50), fase oleosa: Capryol® 90 (EHL= 6) + Alkest® CSO 400 (EHL= 13); Capryol® 90 (EHL= 6) + Tween® 80 (EHL= 15) e Alkest® CSO 400 (EHL= 13) + Span® 80 (EHL= 4,3), conforme apresentado no Quadro 2. O diagrama de fase pseudoternário é um triângulo equilátero em que se representa a mistura de 4 componentes (óleo, água e a mistura de tensoativos) onde os vértices deste triângulo representam os componentes puros. Podem ser construídos a partir de dados obtidos por titulação ou ponto a ponto de diferentes composições de amostras, sendo uma ferramenta ideal para caracterizar regiões que apresentam o aspecto desejável para a incorporação da substância ativa (DAMASCENO et al., 2011). Os diagramas pseudoternários formados pelo método ponto a ponto para a combinação dos tensoativos Capryol® 90:Alkest® CSO 400 (1,5:5,5), apresentaram visualmente a formação de maior número de diferentes sistemas, os quais não foram observados no diagrama formado pelo método da titulação (Figura 15). 101 Figura 15 - Diagrama de fases pseudoternários obtidos na otimização das nanoemulsões de miristato de isopropila, Capryol 90 e Alkest CSO 400, usando métodos diferentes: titulação e ponto a ponto. Nota: FT: fluido transparente; FL: fluido translúcido; FB: fluido branco; GT: gelificado transparente; GU: gelificado turvo; GL: gelificado translúcido; GR: gelificado com ressonância; EG: emulsão gelificada; SF: separação de fases. No método da titulação, a adição de água nos sistemas fluidos transparentes (FT) contendo concentrações semelhantes de óleo e tensoativo resultou na turvação destes, ou seja, a formação de sistemas fluidos translúcidos (FL). Com a contínua adição de água, houve a formação de sistemas fluidos brancos, quando a concentração de tensoativo foi menor que a do óleo. Na região com concentrações semelhantes dos três componentes, houve a formação de sistemas gelificados viscosos. Este aspecto foi alterado para visualmente emulsionado quando a concentração de óleo foi maior que a de tensoativos. Este resultado evidencia que no método da titulação ocorrem alterações físicas e físico-químicas dos sistemas promovidas pela diluição dos sistemas formados com a adição de água, enquanto no método da ponto a ponto há a formação clara e bem distinta dos sistemas. Comparando os dois diagramas para a combinação dos tensoativos Capryol® 90:Alkest® CSO 400, a maior diferença é encontrada na região central do diagrama cujas condições resultaram em sistemas fluidos ou gelificados. No diagrama obtido por titulação foi observado maior área com formulações com aspecto de fluídos translúcidos enquanto pelo método direto, as mesmas proporções dos componentes resultaram em sistemas gelificados. Tais resultados apontam que a diluição dos sistemas fluidos com água pode levar a diluição da fase aquosa externa, sem promover alteração ou reestruturação do sistema, comportamento este comum às nanoemulsões (ANTON; VANDAMME, 2011). Sistemas com características de 102 cristais líquidos (GR) com maior grau de organização foram obtidos somente pelo método ponto a ponto. O tamanho da fase interna dos sistemas preparados pelo método direto usando os tensoativos Capryol® 90 e Alkest® CSO 400, foi de 9,33 ± 0,41 nm e 16,23 ± 0,66 nm para os sistemas fluidos transparentes com concentração de tensoativo maior que 50%. O aumento de água na formulação resultou em sistemas com aspecto gelificado e turvo, com tamanho entre 13,25 ± 0,35 nm e 20,30 ± 0,72 nm. Os sistemas gelificados com ressonância (GR), provavelmente com formação de cristais líquidos, foram obtidos na região do diagrama com concentração semelhante dos três componentes e/ou proporção de água levemente inferior aos demais. Tais sistemas apresentaram tamanho entre 24,28 ± 1,02 nm e 100,24 ± 11,38 nm. Sistemas gelificados translúcidos com tamanho entre 17,03 ± 5,71 nm e 80,50 ± 1,42 nm foram formados com o aumento progressivo da água, nas regiões com proporções semelhantes de tensoativo e água. Não foi observada uma relação direta entre o tamanho da fase interna e o aspecto físico observado. Os sistemas contendo mais de 50% de água e cerca de 20% de tensoativo apresentaram aspecto fluido transparente e translúcido no diagrama por ponto a ponto, com tamanho de gotículas entre 8,01 ± 0,39 nm e 26,76 ± 20,34 nm. Com o aumento da proporção de água, os sistemas apresentaram aspecto branco e maior tamanho (entre 20,86 ± 5,77 nm e 62,19 ± 19,72 nm). O aumento da concentração de água, com tensoativos inferior a 20% e óleo entre 0 e 50%, resultou em sistemas fluidos translúcidos ou branco, sendo que o aumento da concentração de óleo levou a formação de sistemas com maior tamanho (entre 57,21 ± 27,94 nm e 205,9 ± 61,98 nm) e branco, característicos de emulsões. Com o uso da mistura de Alkest® CSO 400 e Span® 80 foi obtida uma maior área do diagrama com formulações com aspecto gelificado (Figura 16) quando comparado ao uso do Capryol® como tensoativo lipofílico. Empregando o método da titulação, a formação de sistemas com aspecto fluido translúcido ocorreu conforme se foi procedendo a diluição do sistema fluido transparente, reduzindo a concentração de tensoativo e aumentando a proporção de óleo, elevando a turbidez do sistema. Nestas mesmas proporções, pelo método ponto a ponto, foi observada a definição de uma maior área gelificada translúcida. No método de titulação, o sistema formado sofreu diluição pela adição da água, transformando a emulsão gelificada (EG) em fluido branco (FB), e este em sistemas 103 de fases separadas com a continuidade da adição de água. Já, o sistema gelificado turvo (GT), com a diluição, passou a gelificado transparente (GT) e, posteriormente fluido transparente (FT) e fluido translúcido (FL). Esta interferência da diluição do sistema com o acréscimo de água não se observa quando o método utilizado para o preparo do diagrama é o do ponto a ponto, proporcionado a obtenção de sistemas bem definidos. Figura 16 - Diagrama de fases pseudoternários obtidos na otimização das nanoemulsões de miristato de isopropila, Alkest CSO 400 e Span 80, usando métodos diferentes: titulação e ponto a ponto. Nota: FU: fluído turvo; FT: fluído transparente; FL: fluído translúcido; FB: fluído branco; GT: gelificado transparente; GU: gelificado turvo; GL: gelificado translúcido; GR: gelificado com ressonância; EG: emulsão gelificada; SF: separação de fases. A análise de tamanho das gotículas dos sistemas obtidos com a combinação de Alkest® CSO400 e Span® 80 revelou que os sistemas formados com a concentração de tensoativo maior que 50% e baixa concentração de óleo e água, com aspecto fluido transparente e translúcido, apresentaram tamanho entre 6,13 ± 0,47 nm e 14,92 ± 2,04 nm. Este tamanho de gotículas aumentou quando a concentração de tensoativo foi reduzida, ficando entre 18,2 ± 3,53 nm e 62,97 ± 29,02 nm. A formação de uma maior região com sistemas de aspecto gelificado, quando a concentração de água foi aumentada, com concentrações cada vez menores de óleo e tensoativo, resultou em tamanhos de gotículas entre 6,54 ± 0,26 nm e 100,5 ± 2,15 nm, tendendo ao aumento do tamanho com o aumento da concentração de óleo. Novas regiões com sistemas fluidos translúcidos e transparentes e uma região fluida com aspecto turvo foram identificadas com a concentração de tensoativos na faixa de 25% a 40%, com concentrações elevadas de água e óleo, apresentando tamanho das gotículas entre 4,85 ± 1,34 nm e 16 ± 5,34 nm. Os fluidos brancos 104 formaram-se com as concentrações mais altas de óleo juntamente com a mistura de tensoativos e cerca de 50% de fase aquosa, com tamanho de gotícula entre 7,3 ± 2,14 nm e 73,49 ± 25,11 nm. Nos diagramas de fase obtidos usando a combinação miristato de isopropila e Capryol® 90:Tween® 80 (Figura 17), a proporção entre os tensoativos (3,5:5,5) não foi adequada para a emulsificação do óleo. Conforme observado no diagrama, houve formação de grandes regiões com separação de fases em ambos os métodos de preparo empregados. Este comportamento pode estar relacionado com o baixo EHL do Capryol® 90. Alguns trabalhos relatam o uso do Capryol® 90 como fase oleosa no desenvolvimento de nanoemulsões, assim como a avaliação da sua eficiência com várias combinações de tensoativos não iônicos (SHAKEEL et al., 2013). A desestabilização dos sistemas foi observada principalmente nas regiões com maior concentração de óleo, mas também nas regiões com maior proporção de tensoativos e quantidades semelhantes de água e óleo. A formação de fluidos transparentes foi observada na região diagrama em que a concentração de tensoativo era maior que de óleo. Nestas proporções houve a emulsificação do óleo devido à molhabilidade do mesmo pela água através da ação tensoativa. Comparando-se os sistemas formados entre os dois métodos usados, observase que no método da titulação houve formação de maior número de diferentes sistemas, demonstrando menor estabilização. Já no método ponto a ponto, os sistemas formados apresentaram regiões melhor definidas. Este comportamento está relacionado com a constante diluição dos sistemas pela adição diária e contínua de água no método da titulação, com consequente transformação dos sistemas ou desestabilização dos sistemas formados. 105 Figura 17 - Diagrama de fases pseudoternários obtidos na otimização das nanoemulsões de miristato de isopropila, Capryol 90 e Tween 80, usando métodos diferentes: titulação e ponto a ponto. Nota: FU: fluido turvo; FT: fluido transparente; FL: fluido translúcido; FB: fluido branco; GU: gelificado turvo; EG: emulsão gelificada; SF: separação de fases. Na avaliação da distribuição de tamanho das gotículas nos sistemas formados pelo método ponto a ponto, observou-se que os sistemas com concentração da mistura de tensoativo acima de 70% e água menor que 30% da composição total, apresentaram tamanho das gotículas entre 12,42 ± 1,09 nm e 30,64 ± 2,90 nm, ou seja, tamanhos em escala nanométrica, com aspectos fluídos transparentes ou turvos, sem a formação de um sistema emulsionado. Provavelmente houve apenas a formação de micelas de tensoativo. Nas composições com concentração de tensoativos entre 55% e 70%, com a quantidade de óleo igual ou maior que a de água, o tamanho das gotículas aumentou, ficando entre 99,29 ± 81,28 nm e 240,5 ± 77,10 nm, com aspecto fluido turvo ou transparente. Estas diferenças de tamanho demonstram a influência da concentração de tensoativo. Com a redução progressiva da concentração da mistura de tensoativos houve uma redução do tamanho das gotículas dos sistemas. Os sistemas com aspecto gelificado turvo apresentaram tamanho de 18,2 ± 0,36 nm quando a proporção de tensoativo e água superou a de óleo, sendo este menor que 20%. Tamanhos entre 86,90 ± 1,87 nm e 219,06 ± 2,72 nm ocorreram nas formulações com concentrações semelhantes entre os três componentes com ligeiro aumento da proporção de água. Sistemas com concentração de óleo e tensoativo semelhantes e baixa concentração de água, apresentaram aspecto fluido transparente com tamanho das gotículas entre 14,36 ± 2,04 nm e 21,90 ± 15,58 nm. Com o aumento da concentração de água, os sistemas apresentaram aumento do tamanho das gotículas tendendo a formação de sistemas com aspecto fluido turvo a branco e tamanho entre 21,25 ± 1,47 nm e 164,75 106 ± 65,27 nm. Sistemas translúcidos com tamanho entre 12,73 ± 0,76 nm e 16,92 ± 0,39 nm foram obtidos com concentração de água e tensoativos semelhantes e menor concentração de óleo. O aumento da proporção de água em relação ao óleo, com tensoativo entre 10% e 40%, resultou em aumento de tamanho, ficando entre 77,54 ± 51,21 nm e 197,3 ± 100,7 nm, com sistemas de aspecto turvo e tendendo ao branqueamento. Analisando os resultados encontrados em todos os diagramas formados independente da combinação de componentes, percebeu-se diferenças nos sistemas formados de acordo com o método empregado para sua formação. Segundo Anton e Vandamme (2011) o método da titulação empregado para construção de diagrama de fases para obtenção de nanoemulsão, pode gerar erros de interpretação. Esta diferença pode estar relacionada com a lenta alteração e/ou organização do sistema emulsionado quando a água é titulada em pequenos volumes. Embora o método da titulação seja o método empregado no desenvolvimento de nanoemulsões, em que o óleo e o tensoativo são misturados previamente e a água é adicionada posteriormente, a adição de água continuamente em um sistema nanoemulsionado já formado, dilui a fase externa, sem alterar o tamanho das gotículas (ANTON; VANDAMME, 2011). Assim, percebe-se como melhor método para o desenvolvimento do diagrama de fases pseudoternário para o desenvolvimento de nanoemulsões, o método ponto a ponto, pois apresenta resultados mais reprodutíveis e confiáveis dos sistemas formados. No presente trabalho os sistemas formados foram classificados de acordo com as características visuais observadas a olho nu, pois a classificação entre nanoemulsões e microemulsões não é segura baseada somente na observação visual do aspecto do sistema e aferição do tamanho das gotículas. São sistemas muito semelhantes entre si quanto às características físicas e ao tamanho das gotículas, apenas diferenciando-se quanto à estabilidade. Tanto nanoemulsões como microemulsões se apresentam nas formas fluida translúcida ou transparente e com tamanho de gotículas menor de 100 nm (ANTON; VANDAMME, 2011; MCCLEMENTS; RAO, 2011; MCCLEMENTS, 2012). Nos resultados encontrados ficou evidente que os diagramas desenvolvidos utilizando como um dos tensoativos o Alkest® CSO 400, tiveram maior formação de sistemas com aspecto gelificado. Isto porque o caráter não-iônico deste tensoativo, com a parte hidrofóbica proveniente do óleo de mamona e a porção hidrofílica 107 proveniente da cadeia de óxido de eteno (óleo de mamona 40 EO), apresentando alto grau de etoxilação elevando o seu valor de EHL, tem seu caráter hidrofílico mais acentuado. Quanto maior for o grau de etoxilação do tensoativo maior é a cadeia polar da molécula, o que estabiliza estericamente a gotícula de óleo no sistema, formando sistemas com aspecto gelificado (DALTIN, 2011). A combinação de Capryol® 90 e Tween® 80 não foi adequada para a formação de sistemas estáveis na sua maioria e, embora a combinação de Capryol® 90 e Alkest® CSO 400 apresentou conformidade para a formação de sistemas mais estáveis, esta teve a continuidade dos seus testes inviabilizado pelo alto custo do tensoativo Capryol® 90. Portanto para dar continuidade a otimização da nanoemulsão foram selecionados 3 sistemas a partir do diagrama com a combinação dos tensoativos Alkest® CSO400 e Span® 80. Conforme apresentado na Tabela 6, estes sistemas apresentaram tamanho de fase interna menor que 100 nm, aspecto fluido branco e PDI próximo a 0,2. Tabela 6 - Formulações e características dos sistemas nanoemulsionados selecionados para o estudo de estabilidade preliminar. 1– 4- Tensoativos2 Fórmula Óleo1 (%) 4:6:20 13,3 20,0 66,7 5:5:70 6,3 6,3 87,5 6:4:20 20,0 13,3 66,7 (%) Água (%) Aspecto Fluído Branco Fluído Branco Fluído Branco Tamanho d (nm)3 PDI 4 66,98 0,283 23,09 0,216 73,49 0,153 Miristato de isorpropila. 2- *Alkest® CSO 400 e Span ® 80 (7,2:1,5). 3- Tamanho expresso como média em número. PDI: índice de polidispersibilidade. As formulações selecionadas foram submetidas aos estudos de estabilidade preliminar e estabilidade termodinâmica, a fim de proceder a escolha da formulação. 5.4.2 Estudo de estabilidade preliminar e estabilidade termodinâmica das nanoemulsões O teste de estabilidade preliminar foi realizado com o objetivo de escolher a formulação mais estável para posterior incorporação do extrato da R. ferruginea. Para esta análise foram preparados lotes de 30 g em duplicata. 108 Das três formulações analisadas, a 4:6:20 durante o processo de resfriamento , após a emulsificação, formou um sobrenadante com aspecto gelificado diferente do sistema formado na porção inferior do frasco, com aspecto fluido. Foi então verificado a influência de alteração no processo de emulsificação, elevando-se o período de agitação sem aquecimento de 3 minutos para 5 minutos. Esta alteração não provocou mudanças no sistema formado, permanecendo heterogêneo. Assim, esta formulação não foi submetida ao teste de estabilidade preliminar e excluída do estudo. Os resultados da estabilidade preliminar para as formulações 5:5:70 e 6:4:20 estão expostos na Tabela 7. Tabela 7 - Resultados das análises no tempo inicial (ti) e final (tf) das nanoemulsões sem extrato submetidas aoestudo de estabilidade preliminar. Amostra (réplica) 5:5:70 (1) 5:5:70 Aspecto1 Tamanho Centrifugação2 pH (nm) ti tf ti tf ti tf ti FL FL 6,65 7,08 + + 7,90 ± 6,4 FL FL 6,49 6,94 + + 10,84 ± 6,1 FLL FLL 6,60 6,72 + + 62,14 ± 3,5 FLL FLL 6,61 6,70 + + 56,17 ± 1,4 (2) 6:4:20 (1) 6:4:20 (2) PDI4 3 tf 11,89 ± 7,2 13,76 ± 6,3 58,99 ± 0,6 57,26 ± 1,4 ti tf 0,291 0,264 0,290 0,266 0,087 0,095 0,068 0,065 Nota: 1FL: fluido translúcido; FLL: fluido leitoso levemente translúcido. 2(+) em conformidade; (-) em não conformidade. 3Tamanho expresso como média do número ± SD. 4PDI: índice de polidispersibilidade. Comparando o aspecto físico das amostras escolhidas pelo diagrama de fases (Tabela 6) e o aspecto destas mesmas formulações preparadas para o estudo da estabilidade preliminar (tinicial – Tabela 7), percebe-se a alteração do aspecto, de fluido branco para fluido translúcido. Isto se deve, provavelmente à influência da temperatura sobre o tensoativo polietoxilado Alkest® CSO 400. Para o desenvolvimento do diagrama de fases foi utilizada a temperatura de 45 °C, no entanto esta temperatura não foi adequada para reproduzir o mesmo sistema para o teste de estabilidade preliminar. A temperatura de 45 °C gerou sistemas gelificados e não fluidos, quando houve o aumento na quantidade do lote, para 30 g. 109 Então, foi necessário o aumento da temperatura para 80 °C obtendo-se assim sistemas fluidos porém não mais de cor branca, e sim sistemas translúcidos. Esta alteração se deve ao tensoativo Alkest® CSO 400, um tensoativo não iônico etoxilado, que não apresenta em sua molécula cargas verdadeiras de sais dissociados e, que seriam responsáveis pela sua alta solubilidade em água. Neste tensoativo as cargas que atraem moléculas de água, estão distribuídas por todos os átomos de oxigênio na cadeia polimérica da molécula. Assim a força de atração para as moléculas de água é fraca. Porém a agitação molecular provocada pelo aquecimento de uma solução com tensoativo não iônico etoxilado rompe esta força de atração, consequentemente, menos moléculas de água se estabilizam ao longo da cadeia do tensoativo, fazendo com que o tensoativo sofra precipitação e resulte em uma solução com aspecto de névoa ou turvo (DALTIN, 2011). Mudanças na temperatura levam às modificações na hidratação das cadeias polietoxiladas deste tensoativo (SOLANS; SOLÈ, 2012). Por isso a temperatura de 45 °C para a formação da nanoemulsão e a agitação através do agitador mecânico não foram suficientes para romper a força de atração entre as moléculas de água e o tensoativo etoxilado Alkest® CSO 400, sendo necessário o aumento da temperatura de aquecimento. Comparando os resultados encontrados no estudo de estabilidade preliminar (Tabela 7) com os resultados obtidos na etapa de otimização (Tabela 6), o tamanho das gotículas diminuiu significativamente na formulação 5:5:70, e na formulação 6:4:20 houve grande redução no índice de polidispersibilidade. Devido à alta concentração de tensoativo na formulação 5:5:70 e a temperatura maior durante o processo de emulsificação, a quebra das gotículas provocada pela agitação foi mais efetiva, gerando tamanhos mais reduzidos. Segundo Amani e colaboradores (2008), a energia total empregada durante a formação do sistema é um fator dominante no controle do tamanho das gotículas finais em uma nanoemulsão. A agitação somada a maior concentração da mistura de tensoativos e a alta temperatura durante a emulsificação aumentaram a energia interfacial das gotículas, reduzindo seus tamanhos (FERNANDEZ et al., 2004; IZQUIERDO et al., 2005). Na proporção 6:4:20, com concentração de tensoativo menor que a de óleo, as condições de preparo não alteraram significativamente o tamanho das gotículas, porém tornou o sistema mais homogêneo, percebido pela redução do índice de polidispersibilidade. Este resultado demonstra a influência da temperatura e da concentração de tensoativos na formação de nanogotículas, provocada pela 110 capacidade dos tensoativos não iônicos com cadeia polietoxiladas realizar a transição de fases com variações de temperatura, modificando a sua solubilidade nas diferentes fases do sistema com consequente formação de nanoemulsões (SOLANS et al., 2005). Analisando os resultados no tempo inicial e final da estabilidade preliminar (Tabela 7), percebe-se que o aspecto físico das formulações permaneceu inalterado, sem evidência de qualquer instabilidade, assim como o teste de centrifugação não revelou qualquer separação de fases nos sistemas. Como principal alteração observase o aumento do pH na formulação 5:5:70, porém não representativa para degradação química. Prosseguindo nos testes de estabilidade preliminar, foi realizado ciclo gelo/degelo, com adaptação da temperatura para -4 ± 2°C e 25 ± 2°C, para verificação da estabilidade termodinâmica. Todas as formulações apresentaram alteração de aspecto, com separação de fases, aumento da fluidez e cremeação demonstrando instabilidade frente a variações críticas de temperatura, o que é esperado para uma nanoemulsão. As nanoemulsões têm por definição serem um sistema não estável termodinamicamente, ou seja, o ciclo gelo/degelo apenas acelerou a desestabilização. Uma nanoemulsão sempre terá quebra do sistema em determinado tempo, sendo a proporção desta separação dependente da barreira de energia livre entre a nanoemulsão (sistema disperso) e a energia livre das fases separadas deste mesmo sistema, e do processo de transporte de moléculas envolvido. Nas nanoemulsões, a energia livre do sistema disperso é maior do que a energia livre das fases separadas, sendo que esta barreira de energia formada entre o sistema disperso e o sistema separado, deve ser suficientemente grande para assegurar a estabilidade do sistema por um período de tempo (MCCLEMENTS, 2012). Neste estudo, o emprego de alterações críticas das temperaturas acelerou a redução desta barreira de energia, provocando a desestabilização dos sistemas. A partir dos resultados de estabilidade preliminar, as duas formulações 5:5:70 e 6:4:20 foram mantidas no estudo para a etapa posterior de incorporação do extrato de R. ferruginea. 111 5.5 Obtenção e estudo de estabilidade preliminar das nanoemulsões contendo extrato de R. ferruginea A concentração de extrato mole incorporada nas nanoemulsões selecionadas (5:5:70 e 6:4:20) baseou-se no resultado encontrado em ensaio farmacológico empregando modelo de edema de orelha induzido por óleo de cróton para cremes convencionais contendo 0,25%, 0,5% e 1,0% de extrato mole de R. ferruginea, juntamente com creme convencional contendo 0,5% e 0,1% do marcador AMB, representado na figura 30 no item 5.11. Embora a inibição do edema proporcionada pelas diferentes concentrações não tenha diferenças significativas entre si, a concentração de 0,5% do extrato mole de R. ferruginea foi escolhida para incorporação nas nanoemulsões por ser esta concentração intermediária. O extrato mole foi primeiramente incorporado na fase aquosa da nanoemulsão , após prévia dissolução em propilenoglicol devido à dificuldade de dissolução deste na fase oleosa, conforme procedimento descrito no item 4.5.3. Nesta etapa do estudo foi adicionado o agente de consistência Sepigel® com o objetivo de aumentar a consistência da fase externa das nanoemulsões, adequando-as para aplicação tópica, conforme realizado em alguns trabalhos que também empregaram modificadores reológicos com este objetivo (MOU et al., 2008; SONNEVILLE-AUBRUN; SIMONNET; L’ALLORET, 2004; YILMAZ; BORCHERT, 2006). Os resultados do estudo de estabilidade preliminar para as formulações contendo extrato mole de R. ferruginea, incorporado na fase aquosa, estão expressos na Tabela 8. Na amostra 5:5:70 S a adição do agente de consistência promoveu leve aumento do tamanho das gotículas e diminuição do PDI, indicando maior estabilização do sistema com a homogeneização do tamanho das gotículas. No caso da amostra 6:4:20 S, ocorreu o contrário, a adição do Sepigel® levou a diminuição do tamanho das gotas com elevação do valor de PDI. Isso ocorreu provavelmente em função da proporção de água na amostra 5:5:70 ser maior (87,5%) que na amostra 6:4:20 (66,7%), o que pode ter levado ao maior intumescimento do polímero, levando a formação de uma rede polimérica com maior estabilidade para o sistema. A adição do extrato mole da R. ferruginea provocou claramente a desestabilização dos sistemas, evidenciada pela separação de fases na amostra 6:4:20 RF no teste de centrifugação no tempo zero e na amostra 5:5:70 RF no teste 112 de centrifugação no tempo final. Esta desestabilização provocada pelo extrato é percebida nos valores do índice de polidispersibilidade, os quais se elevaram, principalmente na amostra 6:4:20 RF. Isso se deve, provavelmente, a característica complexa do extrato com componentes solúveis e insolúveis, formando diversos tamanhos de gotículas. O acréscimo do Sepigel® na amostra 6:4:20 RFS contendo o extrato provocou uma melhor estabilização, com redução do PDI, embora tenha apresentado valor elevado, com redução do tamanho. Já na amostra 5:5:70 RFS contendo o extrato, o Sepigel® elevou o valor de PDI. A adição do extrato também provocou redução do pH, por este possuir característica levemente ácida (pH do extrato = 4,21). O aumento dos valores de PDI nas amostras contendo extrato e Sepigel ®, observado nas análises após o estudo de estabilidade preliminar, indica a desestabilização do sistema ao término do ensaio. Foi possível observar que a adição do extrato foi a causa da desestabilização das amostras, e que a adição do Sepigel ® como agente de consistência, formou uma rede polimérica estabilizando os sistemas, sem alteração significativa no tamanho das gotas. Em uma nanoemulsão a sua elevada estabilidade intrínseca leva em consideração a estabilização estérica causada pelo o uso de tensoativos não-iônicos e polímeros (TADROS et al., 2004), o que foi percebido nas formulações desenvolvidas. As formulações sem extrato apresentaram uma maior estabilidade considerando o aspecto físico após o teste de estabilidade, sem qualquer alteração visual, e os seus baixos índices de polidispersibilidade. Uma vez que os resultados do estudo preliminar de estabilidade das nanoemulsões com extrato incorporado na fase aquosa mostraram instabilidades físico-químicas, foi testada a incorporação de 0,5% de extrato na fase oleosa da formulação, com prévia dissolução em propilenoglicol nas concentrações de 2% e 5%. Este novo método de preparo demonstrou melhor estabilização quanto ao pH e ao tamanho de fase interna e valores de PDI, conforme observado na Tabela 9. No entanto, demonstrou resultados não adequados para uma nanoemulsão e desestabilização dos sistemas no término do estudo, com separação de fases. Na formulação 6:4:20 RFS, como possível consequência da menor proporção de água, o extrato não se dispersou totalmente na fase oleosa, mesmo com a dissolução prévia em propilenoglicol, apresentando separação de fases no término do estudo. 113 Tabela 8 - Resultados do estudo de estabilidade preliminar para as amostras com e sem extrato mole de R. ferruginea, incorporado na fase aquosa, com e sem Sepigel®. Teste de Tamanho Aspecto1 pH PDI 4 Amostra 2 Centrifugação (nm)3 (réplica) tinicial tfinal tinicial tfinal tinicial tfinal tinicial tfinal tinicial tfinal 5:5:70 (1) FL FL ND ND + + 23,99 ± 11,03 17,50 ± 8,28 0,196 0,246 5:5:70 (2) FL FL ND ND + + 14,31 ± 9,59 18,43 ± 5,54 0,214 0,271 5:5:70 S(1) CBF CBF 6,32 6,08 + + 34,47 ± 1,81 33,15 ± 0,26 0,173 0,186 5:5:70 S(2) CBF CBF 5,68 6,43 + + 34,55 ± 1,31 34,72 ± 3,01 0,182 0,173 5:5:70 RF (1) FOMC SF ND ND + - 41,03 ± 4,28 37,34 ± 4,60 0,336 0,474 5:5:70 RF (2) FOMC SF ND ND + - 38,31 ± 5,68 34,38 ± 6,31 0,299 0,495 5:5:70 RFS (1) CMCF CMCF 4,81 4,96 + + 43,18 ± 9,23 79,54 ± 37,94 0,554 0,842 5:5:70 RFS (2) CMCF CMCF 4,71 5,04 + + 34,71 ± 21,48 88,85 ± 50,73 0,546 0,874 6:4:20 (1) FLL FLL ND ND + + 66,08 ± 0,23 61,23 ± 1,24 0,065 0,097 6:4:20 (2) FLL FLL ND ND + + 56,44 ± 2,80 57,02 ± 1,33 0,074 0,075 6:4:20 S (1) GCBC GCBC 7,35 6,71 + + 53,19 ± 1,22 52,18 ± 0,98 0,144 0,178 6:4:20 S(2) GCBC GCBC 7,17 6,59 + + 45,64 ± 1,41 34,57 ± 14,94 0,163 0,196 6:4:20 RF (1) FOM SF ND ND - - 49,97 ± 2,74 ND 0,633 ND 6:4:20 RF (2) FOM SF ND ND - - 46,90 ± 3,66 ND 0,763 ND 6:4:20 RFS (1) CCME CME 4,99 4,06 + + 47,16 ± 3,61 30,92 ± 20,82 0,591 0,997 6:4:20 RFS (2) CCME CME 4,93 4,04 + + 40,80 ± 14,36 36,20 ± 6,90 0,657 0,986 Nota: ND: não determinado; 1 CBF: creme branco levemente fluido; CCME: creme consistente marrom escuro; CME: creme marrom escuro; CMCF: creme marrom claro levemente fluido; FLL: fluido leitoso levemente translúcido; FOMC: fluido opaco marrom claro; FOME: fluido opaco marrom; FL: fluido translúcido; GCBC:gel-creme branco consistente; SF: separação de fases. 2(+): em conformidade; (-): em não conformidade. 3tamanho expresso como média em número ± SD. 4índice de polidispersibilidade. 114 Tabela 9 - Tabela comparativa dos resultados da estabilidade preliminar para as formulações com o extrato de R. ferruginea incorporado na fase aquosa (linhas em cinza) e na fase oleosa com diferentes concentrações de propilenoglicol (linhas em branco). Teste de Tamanho Amostra Aspecto1 pH PDI 4 2 Centrifugação (nm)3 (réplica) t inicial tf inal tinicial t f inal tinicial tf inal t inicial tf inal tinicial tf inal 5:5:70 RFS (1) CMCF CMCF 4,81 4,96 + + 5:5:70 RFS (2) CMCF CMCF 4,71 5,04 + + CFBE CFBE 5,00 4,53 + - CFBE CFBE 5,11 4,68 + - CFBE CFBE 5,25 4,60 + - CFBE CFBE 5,11 4,61 + - 6:4:20 RFS (1) CCME CME 4,99 4,06 + + 6:4:20 RFS (2) CCME CME 4,93 4,04 + + CCBE SF 5,00 ND + - CCBE SF 5,00 ND + - CCBE SF 5,14 ND + - CCBE SF 5,18 ND + - 5:5:70 (1) 43,18 ± 79,54 ± 9,23 37,94 34,71 ± 88,85 ± 21,48 50,73 26,27 ± 32,64 ± 15,98 20,05 27,78 ± 48,03 ± 15,22 11,29 34,32 ± 32,14 ± 18,57 25,86 19,76 ± 42,57 ± 18,43 26,33 47,16 ± 30,92 ± 3,61 20,82 40,80 ± 36,20 ± 14,36 6,90 RFS 2% 5:5:70 (2) RFS 2% 5:5:70 (1) RFS 5% 5:5:70 (2) RFS 5% 6:4:20 (1) RFS 2% 6:4:20 (2) RFS 2% 6:4:20 (1) 35,52 ± 17,28 27,60 ± 7,64 52,53 ± 3,34 RFS 5% 6:4:20 (2) RFS 5% 60,58 ± 54,75 0,554 0,842 0,546 0,874 0,698 0,677 0,533 0,929 0,613 0,576 0,668 0,835 0,591 0,997 0,657 0,986 ND 0,428 ND ND 0,441 ND ND 0,519 ND ND 0,503 ND Nota: ND: não determinado; 1CCBE: creme consistente bege escuro; CCME: creme consistente marrom escuro; CFBE: creme fluído bege escuro; CME: creme marrom escuro; CMCF: creme marrom claro levemente fluido; SF: separação de fases. 2(+): em conformidade; (-): em não conformidade. 3Tamanho expresso como média em número ± SD. 4Índice de polidispersibilidade. Com base nestes resultados, um novo teste foi realizado, com redução da concentração do extrato para 0,25% e 0,13% com incorporação na fase oleosa e aquosa com prévia dissolução em 2% de propilenoglicol. Nestes resultados, apresentados na Tabela 10, foi verificado que a redução da concentração do extrato de 0,5% para 0,25% e 0,13% propiciou a incorporação do mesmo nas formulações selecionadas, as quais permaneceram homogêneas durante o estudo sem evidências de separação de fases, mesmo após o teste de centrifugação. Exceto para uma réplica da formulação 6:4:20 com 0,13% de extrato incorporado na fase oleosa do sistema (6:4:20 FO 0,13% (2)), que apresentou leve 115 separação de fases após a centrifugação, apresentando aumento do tamanho das gotículas e confirmando a desestabilização. As formulações 5:5:70 apresentaram-se mais instáveis com aumento relevante no tamanho das gotículas e na distribuição do tamanho. O pH apresentou leve redução. As formulações 6:4:20 apresentaram acentuada redução do pH e redução do tamanho das gotículas com pouca elevação na distribuição de tamanho, no tempo final do estudo. Esta formulação apresenta maior concentração de óleo e o dobro da concentração de tensoativo em relação a formulação 5:5:70, o que possivelmente favoreceu a dissolução dos ácidos mirsinoicos na formulação com as alterações bruscas de temperatura, ocasionando a redução no valor de pH. A partir dos resultados encontrados, a formulação 6:4:20 contendo 0,25% e 0,13% do extrato incorporado na fase oleosa do sistema, foi selecionada para continuidade dos estudos. 116 Tabela 10 - Tabela comparativa dos resultados da estabilidade preliminar para as nanoemulsões com 0,25% e 0,13% de extrato de R. ferruginea, incorporados na fase oleosa (linhas cinzas) e na fase aquosa (linhas brancas). Aspecto1 Amostra pH Teste de Tamanho Centrifugação2 d (nm)3 PDI4 tinicial tfinal tinicial tfinal tinicial tfinal tinicial tfinal tinicial tfinal 5:5:70 FO 0,25% (1) CFB CFB 5,0 4,81 + + 24,93 ± 7,77 2660 ± 2402 0,461 0,201 5:5:70 FO 0,25% (2) CFB CFB 5,19 4,90 + + 42,54 ± 1,96 1532 ± 2622 0,702 0,527 5:5:70 FA 0,25% (1) CFB CFB 5,39 5,10 + + 39,77 ± 1,94 1618 ± 2766 0,376 0,567 5:5:70 FA 0,25% (2) CFB CFB 5,40 5,29 + + 29,84 ± 8,95 20,28 ± 8,84 0,388 0,231 5:5:70 FO 0,13% (1) CFBC CFBC 5,18 5,02 + + 30,28 ± 10,62 24,61 ± 11,64 0,325 1,0 5:5:70 FO 0,13% (2) CFBC CFBC 5,25 5,28 + + 33,01 ± 7,76 33,08 ± 13,33 0,262 1,0 5:5:70 FA 0,13% (1) CFBC CFBC 5,63 5,32 + + 45,72 ± 19,10 23,26 ± 11,92 0,204 0,899 5:5:70 FA 0,13% (2) CFBC CFBC 5,42 5,40 + + 33,80 ± 0,78 22,29 ± 1,08 0,255 1,0 6:4:20 FO 0,25% (1) CCBE CCBE 5,13 3,50 + + 65,39 ± 33,28 16,76 ± 1,49 0,171 0,414 6:4:20 FO 0,25% (2) CCBE CCBE 5,07 3,54 + + 80,92 ± 9,44 46,04 ± 28,14 0,166 0,459 6:4:20 FA 0,25% (1) CCBE CCBE 5,82 3,80 + + 70,56 ± 6,96 25,58 ± 15,02 0,151 0,481 6:4:20 FA 0,25% (2) CCBE CCBE 5,61 3,94 + + 69,20 ± 5,76 26,35 ± 7,35 0,171 0,275 6:4:20 FO 0,13% (1) CCBC CCBC 5,31 3,57 + + 70,72 ± 7,2 39,03 ± 35,09 0,127 0,250 6:4:20 FO 0,13% (2) CCBC CCBC 5,42 3,56 + - 72,85 ± 1,80 90,02 ± 0,31 0,149 0,175 6:4:20 FA 0,13% (1) CCBC CFBC 5,70 3,64 + + 63,04 ± 5,68 49,36 ± 21,81 0,146 0,214 6:4:20 FA 0,13% (2) CCBC CFBC 6,20 3,74 + + 56,84 ± 23,44 35,33 ± 24,63 0,209 1CCBE: Nota: creme consistente bege escuro; CCBC: creme consistente bege claro; CFB: creme fluído bege; CFBC: creme fluido bege claro. conformidade; (-): em não conformidade. 3Tamanho expresso como média em número ± SD. 4Índice de polidispersibilidade. 0,282 2(+) em 117 5.6 Caracterização das nanoemulsões contendo extrato de R. ferruginea Partindo dos resultados obtidos no estudo de estabilidade preliminar, a formulação escolhida para continuidade dos estudos foi a 6:4:20 contendo 0,13% e 0,25% de extrato das cascas de R. ferruginea. A fim de selecionar uma única concentração do extrato nas nanoemulsões, antes da caracterização completa do sistema, foi realizado estudo in vivo da atividade anti-inflamatória em modelo de edema de orelha induzido por óleo de cróton, conforme metodologia descrita no item 4.11.2, com o objetivo de avaliar qual a concentração mais efetiva do extrato incorporado na nanoemulsão e em uma base de creme convencional. O teste foi realizado com a nanoemulsão sem extrato, nanoemulsão com extrato a 0,13% e 0,25%, creme sem extrato, creme com extrato a 0,13%, 0,25% e 0,5%. A nanoemulsão com 0,13% de extrato apresentou atividade anti-inflamatória mais efetiva com significativa diferença em relação a nanoemulsão com 0,25% de extrato, conforme figura 31 do item 5.11. Em relação ao creme, não houve diferença estatística na inibição do edema de orelha entre as diferentes concentrações. Como um dos objetivos deste estudo é averiguar a diferença de ação entre os veículos creme e nanoemulsão, optou-se pelo emprego da mesma concentração de extrato em ambos veículos, 0,13% de extrato em nanoemulsão e creme. O extrato foi incorporado nas formulações após prévia dispersão em propilenoglicol. A caracterização das nanoemulsões desenvolvidas requer o emprego de diferentes técnicas de análise para garantir que o sistema desenvolvido apresente as características desejadas para uma nanoemulsão. Após 24 h de preparo, a nanoemulsão sem adição de extrato apresentou aspecto semissólido consistente, homogêneo, na cor branca, com toque aveludado. A adição do extrato desenvolveu cor caramelo na nanoemulsão, que apresentou aspecto semissólido com menor consistência em relação ao veículo branco, homogêneo, com toque aveludado. Após o teste de centrifugação, as formulações demonstraram adequada estabilidade física, não apresentando qualquer indício de instabilidade como separação de fases, cremeação ou sinais de precipitação. Para a análise da distribuição de tamanho de gota e potencial zeta, as formulações foram diluídas em água ultrapura na proporção de 1:100, e analisadas por DLS, a temperatura de 25 °C. O tamanho das gotículas foi expresso como média de 3 aferições. Todas as formulações apresentaram-se monodispersas. Para a 118 nanoemulsão com 0,13% de extrato, a média de tamanho foi de 47,88 ± 8,20 nm com 0,228 ± 0,004 de PDI, representado na figura 18(B). Para a nanoemulsão sem extrato a média de tamanho das gotas foi de 57,43 ± 3,37 nm com 0,114 ± 0,016 de PDI, representado na figura 18(A). As figuras 18A1 e 18B1 representam a taxa de correlação das nanoemulsões sem e com extrato, respectivamente. A taxa de correlação informa sobre a correlação entre o tempo e o movimento provocado pelo espalhamento de luz das gotículas (SCHÄTZEL, 1987), representando a taxa de decaimento das gotas em suspensão, influenciada pelo tamanho das mesmas, durante o tempo de incidência da luz. A taxa de correlação de ambas formulações analisadas representa a homogeneidade dos sistemas quanto ao tamanho. A incorporação do extrato no sistema provocou redução do tamanho das gotas, o que também foi encontrado em outros trabalhos incorporando substâncias ativas (OKUR et al., 2011; SANDIG et al., 2013), havendo a hipótese de que as moléculas de um ativo incorporado no sistema participam da sua microestrutura podendo causar influências devido a interações moleculares (SANDIG et al., 2013). Possivelmente devido a estas interações moleculares houve elevação do PDI quando da incorporação do extrato, indicativo da diminuição da homogeneidade do tamanho das gotas do sistema, pois o PDI é um índice que indica o desvio da média de tamanho das gotas (KELMANN et al., 2007). A caracterização de nanoemulsões por DLS possui algumas limitações como, não reconhecimento de pequenas populações de gotículas grandes dentro do sistema, além da técnica reconhecer somente formas esféricas perfeitas e necessitar, algumas vezes, da amostra diluída para promover maior transparência para a análise. O emprego da microscopia eletrônica de transmissão (MET) como técnica complementar a técnica por DLS, é uma ferramenta confiável e informativa para caracterizar as nanoemulsões (KLANG et al., 2012). 119 Figura 18 - Gráficos representativos da distribuição do tamanho da fase interna da nanoemulsão sem extrato (A) e da nanoemulsão com extrato (B), com seus respectivos gráficos de taxa de correlação correspondentes (A1 e B1). Sendo assim, para verificar a morfologia da fase interna, as nanoemulsões com e sem extrato de R. ferruginea foram analisadas por MET. Na MET a amostra é iluminada por um feixe de elétrons que interage com o material provocando um espalhamento de elétrons, obtendo-se uma imagem contrastada. A resolução na MET é proporcional a aceleração na voltagem dos elétrons, que para sistemas coloidais, pode ser entre 80 e 200 kV (KLANG et al., 2012). No presente estudo foi utilizada a voltagem de 80 kV para visualizar as nanoemulsões diluídas. A diluição foi necessária devido ao aspecto semissólido dos sistemas. As imagens obtidas pela MET das nanoemulsões com e sem extrato, figura 19, demonstram as gotículas da fase interna esféricas envolvidas por um sistema estruturado formado pelo polímero Sepigel® e pelo tensoativo polietoxilado Alkest® CSO 400, sem a formação de agregados. Em função da “rede” formada pelo polímero e pelo tensoativo, a imagem das gotículas aparece com as bordas com pouca nitidez. Na imagem da nanoemulsão com extrato algumas gotículas apresentam menor 120 intensidade de cor, comportamento este que pode estar relacionado com a evaporação da amostra provocada pelo feixe de elétrons (KLANG et al., 2012). Figura 19 - Micrografias eletrônicas obtidas após coloração negativa da nanoemulsão sem extrato (A) e da nanoemulsão com extrato (B). Aumento de 15.000x. O potencial zeta representa a força de repulsão entre as gotículas e possui relação com a estabilidade da dispersão (BALI; ALI; ALI, 2010), sendo o valor maior que +/- 30 mV indicativo de máxima estabilidade (ARAÚJO et al., 2011). O valor encontrado para a nanoemulsão com extrato foi de -34,7 ± 1,15 mV e para a nanoemulsão sem extrato foi de -19,95 ± 0,21 mV. Os resultados indicam que a característica ácida do extrato (pKa de 4,5 para o AMA e de 4,8 para o AMB, de acordo com Zermiani (2015)) aumentou o potencial zeta da nanoemulsão, o que pode levar a maior estabilidade do sistema em relação a ausência do extrato devido ao aumento da força de repulsão entre as gotículas. 121 O pH da nanoemulsão com extrato foi de 5,25 ± 0,02 e para o sistema sem extrato foi de 5,19 ± 0,01, indicando que para aplicação tópica, os nanossistemas possuem valor de pH próximo ao pH fisiológico da pele, mostrando-se adequados. Para a avaliação reológica das nanoemulsões foi utilizado o viscosímetro rotacional Haake® VT 550, em que o fluido é cisalhado entre duas superfícies, uma estática e outra em movimento, e as tensões de cisalhamento geradas são determinadas através de medições de torque. O comportamento reológico demonstrado pelas nanoemulsões com e sem extrato, representado na Figura 20, foi do tipo pseudoplástico com índice de comportamento de fluxo inferior a 1, calculado pelo modelo de Ostwald-de-Waele (Tabela 11), e tixotrópico. A viscosidade aparente média da nanoemulsão com extrato foi de 5773,28 ± 950,85 mPa.s, inferior ao valor encontrado para a nanoemulsão sem extrato que foi de 7356,34 ± 303,59 mPa.s, indicando que a incorporação do extrato no sistema provocou redução da viscosidade. A adição do extrato também reduziu o valor de tixotropia de 2,99.107 Pa-1 para 1,90.107 Pa-1. Figura 20 - Perfil de viscosidade da nanoemulsão veículo (imagem à esquerda) e da nanoemuls ão contendo 0,13% de extrato mole das cascas de R. ferruginea (imagem à direita). Tabela 11 - Análise da constante de Ostwald-de-Waele (K) e do índice de comportamento de fluxo (n) para a nanoemulsão veículo e para a nanoemulsão com extrato de R. ferruginea. Formulação Nanoemulsão veículo Nanoemulsão 0,13% extrato R. ferruginea K (mPa.sn ) n R 5,20.105 0,0230 0,8122 4,51.105 0,0061 0,8739 Conforme apresentado na Figura 21, a nanoemulsão com 0,13% de extrato mole de R. ferruginea apresentou perfil cromatográfico semelhante ao do extrato mole 122 e os componentes da formulação não interferem na integração dos picos dos marcadores AMA e AMB. O teor dos marcadores AMA e AMB foi 54,10 ± 0,08 µg/g e 53,03 ± 0,03 µg/g, respectivamente, representando 103,87% e 109,25% em relação a concentração teórica de marcadores na formulação (52,08 µg/g e 48,54 µg/g de formulação para AMA e AMB, respectivamente). Figura 21 - Perfis cromatográficos por CLAE do extrato mole de R. ferruginea, da nanoemuls ão contendo 0,13% de extrato mole de R. ferruginea e da nanoemulsão veículo, em 270 nm. 5.7 Estudo de estabilidade acelerada da nanoemulsão O estudo de estabilidade de um produto prevê o seu comportamento em determinado intervalo de tempo, sob certas condições ambientais, com o objetivo de avaliar o seu desempenho, segurança e eficácia (ANVISA, 2004). As nanoemulsões com extrato, em triplicata, e sem extrato, em duplicata, foram submetidas ao estudo de estabilidade acelerada, por um período de 180 dias em temperatura ambiente (23 ± 2 °C) e à 40 °C. As avaliações foram realizadas nos 123 tempos zero (24 h), 30, 90 e 180 dias. Os resultados das análises estão expostos na Tabela 12. Observando os resultados das análises da nanoemulsão branco (veículo), não houve alterações importantes em suas características físico-químicas ao longo do estudo, demonstrando a sua provável estabilidade. A presença do extrato provocou a desestabilização do sistema ao longo do estudo realizado, tendo as amostras expostas a 40 °C alterações aceleradas em relação a temperatura ambiente. Possivelmente, esta alteração tenha sido provocada pelas interações moleculares entre o veículo com o extrato mole de R. ferruginea. A nanoemulsão com extrato apresentou perda da homogeneidade, com a presença de duas fases distintas, uma mais translúcida e outra mais opaca, a partir do 30° dia exposta a 40 °C e a partir do 90º dia exposta a temperatura ambiente. Até o período de 90 dias, estas amostras recuperaram o aspecto homogêneo inicial após o teste de centrifugação realizado ao término de cada período de tempo, somente após 180 dias de estudos, as amostras não recuperaram a homogeneidade (Figura 22). As amostras de nanoemulsões com extrato expostas a temperatura ambiente, tiveram redução gradual do tamanho médio da fase interna com aumento gradual no valor de PDI e do potencial zeta, com pouca redução na concentração dos marcadores AMA e AMB e poucas alterações nos valores de pH, em comparação a nanoemulsão exposta a temperatura de 40 °C. As amostras de nanoemulsão com extrato expostas a temperatura de 40 °C, apresentaram aumento no tamanho médio da fase interna ao longo do tempo do estudo, com poucas modificações no valor de PDI, grande redução do potencial zeta e pH, com maior redução da concentração de AMA em relação ao AMB. 124 Tabela 12 – Resultado do estudo de estabilidade acelerada das nanoemulsões nas temperaturas ambiente e 40 ºC. Formulações Parâmetros (média ± desvio padrão) Nanoemulsão 0,13% Extrato Mole R. ferruginea t0 t30d t30d t90d t90d amb 40 ºC amb 40 ºC Nanoemulsão Branco t180d amb t180d 40ºC t0 t30d t 30d t90d t 90d amb 40 ºC amb 40 ºC t180 d amb t180 d 40 ºC Cor C C C C CE C CE B B B B B B B Homogeneidade + + - - - - - + + + + + + + Odor + + - + - + - + + + + + + + SC SF LF LF LF LF LF SC SC SC SC SC SC SC + + + + + - - + + + + + + + 5,24 ± 0,02 5,7 ± 0,09 5,13 ± 0,14 5,25 ± 0,07 4,87 ± 0,10 5,46 ± 0,43 4,64 ± 0,26 5,19 ± 0,01 6,2 ± 0,10 5,9 ± 0,24 5,7 ± 0,14 5,65 ± 0,05 6,22 ± 0,03 6,14 ± 0,17 Viscosidade média (mPa.s) 5,77.103 ± 9,51.102 2,42.103 ± 7,59.102 1,35.102 ± 3,02.101 2,54.102 ± 4,48.101 1,15.102 ± 2,45.101 9,92.101 ± 1,88.101 8,64.101 ± 5,71.101 Tixotropia (Pa -1) 1,90.107 ±2,25.106 -5,49.105 ±1,83.105 5,28.104 ±3,92.104 -2,52.105 ±1,15.105 -1,35.105 ±9,03.104 -1,72.105 ±5,46.104 -6,85.104 ±1,18.105 61,30 ± 1,32 57,6 ± 0,23 47,88 ± 8,20 0,228 ± 0,004 -34,7 ± 1,15 59,33 ± 0,80 56,07 ± 0,50 31,09 ± 13,26 0,277 ± 0,02 -31,3 ± 5,03 51,4 ± 0,54 53,77 ± 0,72 36,63 ± 19,63 0,447 ± 0,02 -38,56 ± 1,85 45,9 ± 6,99 55,28 ± 3,77 18,68 ± 7,28 0,331 ± 0,03 -36,73 ± 2,44 41,34 ± 4,65 57,51 ± 2,86 65,91 ± 5,13 0,224 ± 0,02 -25,83 ± 1,46 53,38 ± 2,09 51,91 ± 1,15 12,41 ± 1,70 0,363 ± 0,03 -37,63 ± 1,45 29,96 ± 2,97 48,48 ± 2,03 74,13 ± 2,50 0,204 ± 0,01 -17,46 ± 3,03 Consistência Centrifugação pH Teor AMA (µg/g) Teor AMB (µg/g) Tamanho médio fase interna (nm) Polidispersibilidade (PDI) Potencial Zeta (mV) 7,36.103 ± 3,03.102 2,99.107 ± 9,12.105 8,26.103 ± 1,23.103 3,06.107 ± 4,58.106 5,85.103 ± 2,06.103 2,58.107 ± 5,30.106 NA NA NA 7,16.103 ± 1,07.102 2,93.107 ±2,43.106 NA 7,84.103 ± 7,64.102 1,44.107 ± 2,12.106 NA 7,10.103 ± 8,34.102 2,85.107± 5,59.106 NA 6,15.103 ± 1,60.103 2,09.107 ± 5,66.106 NA NA NA NA NA NA NA NA 57,43 ± 3,37 0,114 ± 0,01 -19,95 ± 0,21 55,63 ± 0,28 0,144 ± 0,009 -17,7 ± 2,96 58,06 ± 1,81 0,114 ± 0,01 -16,25 ± 0,07 51,75 ± 9,79 0,131 ± 0,01 -16,7 ± 3,67 60,52 ± 0,84 0,123 ± 0,004 -15,7 ± 0,56 53,91 ± 2,96 0,142 ± 0,009 -15,65 ± 3,74 55,66 ± 4,38 0,132 ± 0,02 -13,15 ± 0,91 Nota: B: branco; C: caramelo; CE: caramelo escuro; LF: líquido fluido; S: semi-sólido; SC: semi-sólido consistente; SF: semi-sólido fluido; t: tempo; d: dias; amb: temperatura ambiente; +: em conformidade; -: não conformidade; NA: não se aplica. 125 Figura 22 - Fotografia demonstrando o aspecto visual das nanoemulsões branco e com extrato após o término do estudo de estabilidade acelerada, expostas a temperatura ambiente e a 40 °C. Os resultados encontrados indicam também alterações no comportamento reológico das nanoemulsões com a adição do extrato de R. ferruginea. As oscilações observadas no perfil da tensão de cisalhamento indicam alterações de força para alcançar o gradiente ou a velocidade de cisalhamento previsto, representando a heterogeneidade das amostras (Figuras 23 e 24). A exposição das amostras a 40 °C agravou e acelerou as alterações reológicas. O índice de comportamento de fluxo inicial da nanoemulsão com extrato, calculado pelo modelo matemático de Ostwaldde-Waelle, foi menor que a unidade indicando um comportamento pseudoplástico, sem limiar de tensão de cisalhamento. Este comportamento permaneceu ao longo do estudo em temperatura ambiente, ocorrendo redução gradual da viscosidade aparente e antitixotropia. A 40 °C estes comportamentos foram acelerados porém de modo diferenciado. Em 30 dias o comportamento reológico demonstra alteração, com índice de comportamento de fluxo pouco superior a unidade, com a viscosidade aparente muito reduzida e elevação da tixotropia. A partir do período de 90 dias em estufa, a nanoemulsão teve o valor de n próximo de 1, com presença de antitixotropia e maior redução da viscosidade aparente. 126 Figura 23 - Perfis de viscosidade das nanoemulsões com (NE 0,13%) e sem extrato (NE branco) durante o estudo de estabilidade acelerada no tempo zero, e após exposição a temperatura ambient e nos tempos 30, 90 e 180 dias. Nota: As cores diferentes representam a réplica de cada análise da amostra. 127 Figura 24 - Perfis de viscosidade das nanoemulsões com (NE 0,13%) e sem extrato (NE branco) durante o estudo de estabilidade acelerada no tempo zero e após exposição a temperatura de 40 °C nos tempos 30, 90 e 180 dias. Nota: As cores diferentes representam a réplica de cada análise da amostra. 128 Conceitualmente as nanoemulsões são sistemas termodinamicamente instáveis, ou seja, a energia livre da dispersão coloidal formada é maior que a energia livre da sua fase separada (óleo e água), sendo possível proporcionar estabilidade cinética, garantindo uma grande barreira energética entre os dois estados e controlando a transferência de massa entre os componentes. Portanto, uma nanoemulsão tende a se desestabilizar em um dado tempo, dependendo da energia de barreira formada entre a nanoemulsão e as suas fases separadas e o transporte de massas envolvido. A força da energia de barreira é determinada principalmente pela prevenção da aproximação entre as gotas da fase interna como interações repulsivas hidrodinâmicas e coloidais (estérica e eletrostática). A taxa de desestabilização das nanoemulsões depende da sua composição e das condições ambientais (MCCLEMENTS, 2012). Neste estudo foi verificado que a presença do extrato mole das cascas de R. ferruginea acelerou a desestabilização do sistema, quando comparado com o veículo, sendo que a exposição a temperatura de 40 °C colaborou para este processo. Um sistema tende sempre a se reverter a um estado de baixa energia livre, que para as nanoemulsões implica na separação de fases, sob a influência da temperatura (MCCLEMENTS, 2012). Durante a exposição a temperatura ambiente foi observado que as gotículas da fase interna sofreram redução de tamanho com potencial zeta elevado. O tamanho da fase interna depende da energia livre interfacial, a qual é grande para a formação de tamanhos reduzidos de fase interna, que se reduz a um valor mínimo quando o tamanho diminuiu até um certo valor e depois se eleva novamente para uma redução ainda maior da fase interna (MCCLEMENTS, 2012). As amostras quando expostas a temperatura de 40 °C apresentaram desestabilização mais rápida, ao 30° dia, com aumento do tamanho da fase interna ao longo do estudo e potencial zeta sendo gradualmente reduzido. Ou seja, a temperatura elevada favoreceu a aproximação das gotículas, diminuindo o potencial zeta em 49,68%, levando a fusão entre as gotículas, com aumento de tamanho médio em 54,91%. Já quando exposta a temperatura ambiente, o tamanho médio da fase interna das nanoemulsões teve um decréscimo de 74,08%, e o potencial zeta aumentou em 8,44%. A estabilidade eletrostática de sistemas coloidais tem sido indicada pelo valor de potencial zeta, que quando se apresenta com valor negativo, representa uma alta energia de barreira entre as gotículas (HATANAKA et al., 2010). O aumento do 129 potencial zeta durante o estudo em temperatura ambiente, revela grande repulsão entre as gotículas, e quando a interação entre as gotas é predominantemente de repulsão, fenômenos de instabilidade como cremeação, coalescência e floculação não são geralmente importantes em função da predominância do movimento Browniano das gotículas (FRYD; MASON, 2010). Provavelmente por isto, os testes de centrifugação ao término de até 90 dias de estudo, reverteu a cremeação do sistema, provocada pela instabilidade do sistema contendo extrato, no estudo a temperatura ambiente. A taxa de reversão entre o sistema coloidal e as fases separadas, em uma nanoemulsão, é determinada pela frequência em que as gotículas de óleo entram em contato uma com a outra, fenômeno este que depende do movimento Browniano, agitação aplicada e forças da gravidade, ou seja a centrifugação (MCCLEMENTS, 2012). A reversão da separação de fases também foi verificada nas amostras expostas a 40 °C. No entanto, após o período de 180 dias de exposição a temperatura ambiente e a 40 °C, a não reversão do sistema, representou a desestabilização física irreversível do sistema. A desestabilização do sistema durante o estudo a 40 °C ficou evidente também analisando a redução da concentração dos marcadores AMA e AMB, 51,12% e 15,83%, respectivamente, especialmente para o AMA. Enquanto que, quando expostas a temperatura ambiente, os marcadores do extrato nas nanoemulsões apresentaram pouca redução em suas concentrações, 12,92% para o AMA e 9,87% para o AMB. Zermiani (2014) verificou que em ensaios de degradação forçada do extrato mole das cascas de R. ferruginea, o AMA demonstra menor estabilidade, sofrendo hidrólise ácida e oxidação, enquanto o AMB sofre degradação menos significativa em meio ácido. Quanto à degradação térmica, nenhum dos dois marcadores apresentaram degradação quando expostos a temperatura de 40 °C por 60 dias, diferente dos dados encontrados neste estudo. Esta diferença demonstra a possibilidade de interação entre os componentes do extrato e da nanoemulsão o que levou a degradação dos marcadores. Nas nanoemulsões, a adição de um agente doador de consistência contribuiu para a formação da energia de barreira estérica, favorecendo a estabilidade do sistema, conforme percebe-se quando se verificada a estabilidade estudada com o veículo. Estas alterações observadas na nanoemulsão contendo extrato e exposta a temperatura elevada (40 °C) podem ser explicada por possível interação molecular 130 entre o extrato e os componentes que formam a barreira eletrostática e estérica da formulação, reduzindo-a, pois se percebe grande redução da viscosidade do sistema na presença do extrato e do potencial zeta. A viscosidade aparente apresentou redução semelhante entre a nanoemulsão com extrato exposta a temperatura ambiente e a 40 °C, queda de cerca de 98,28 e 98,50% até o término do estudo, respectivamente. A mistura de tensoativos e polímeros possuem propriedades reológicas e a habilidade em estabilizar sistemas coloidas. O tensoativo não iônico polietoxilado, usado na composição da nanoemulsão, possui grande sensibilidade a temperatura, podendo também sofrer interações eletrostáticas em sistemas aquosos envolvendo componentes iônicos, embora menos importante que a temperatura (GALINDO-ALVAREZ et al., 2011). A instabilidade desta classe de tensoativo frente a temperaturas elevadas, se deve a desidratação da porção polar da sua molécula, provocando mudanças em sua solubilidade levando à redução da tensão interfacial e aumento da flexibilidade interfacial, provocando a coalescência das gotas de óleo da fase interna de uma nanoemulsão submetida a altas temperaturas (GUTTOFF; SABERI; MCCLEMENTS, 2015). Em estudo realizado por Guttoff, Saberi e Mcclements (2015) no desenvolvimento de uma nanoemulsão contendo vitamina D pelo método da emulsificação espontânea, foi verificada a estabilidade do sistema em temperatura ambiente e a 80 °C. O sistema se manteve estável em temperatura ambiente porém instável com elevação no tamanho da fase interna quando armazenado a 80 °C. Os autores relacionaram este comportamento à presença do tensoativo não iônico, que possui estabilidade dependente da temperatura. Foi avaliado então, a influência da adição de um co-tensoativo, o dodecil sulfato de sódio, na formulação. O co-tensoativo melhorou a estabilidade térmica da nanoemulsão, provavelmente, por ter aumentando as forças de repulsão entre as gotas da fase interna, reduzindo a tendência à coalescência. Considerando que a nanoemulsão veículo apresentou-se estável durante o estudo, o tensoativo Alkest® CSO 400, possivelmente sofreu interação molecular com o extrato e a temperatura intensificou esta interação, provocando a desestabilização do sistema. Este achado nos indica a necessidade de testes com novos tensoativos para estudo de interações com o extrato. Sandig e colaboradores (2013) relataram o estudo de estabilidade para nanoemulsões com imipramina e doxepina, preparadas usando banho ultrassônico, 131 somente a temperatura ambiente e por período de 3 meses. As nanoemulsões com e sem substâncias ativas não apresentaram alterações significativas em suas características físico-químicas que evidenciasse perda de estabilidade. Alam e colaboradores (2012) avaliaram a estabilidade acelerada de uma nanoemulsão com betametasona, preparada por emulsificação espontânea, por 3 meses nas temperaturas de 4 °C e 25 °C, em que foram avaliados mensalmente aspectos como tamanho da fase interna, viscosidade e índice de refração, já o teor do fármaco foi avaliado mensalmente por 3 meses na nanoemulsão armazenada nas temperaturas de 30, 40, 50 e 60 °C. A nanoemulsão não apresentou mudanças significativas nos aspectos físicos e químicos. Atrux-Tallau e colaboradores (2014) verificaram a estabilidade de uma nanoemulsão contendo licorice (extrato da raiz de Glycyrrhiza glabra) preparada por processo de ultrassonificação. Neste estudo, a estabilidade foi verificada através da análise do tamanho das gotas e observações macroscópicas, para verificar sinais de desestabilização, em diferentes nanoemulsões armazenadas a 4 °C, temperatura ambiente (22 °C) e 40 °C, por 3 meses. Não foi verificado qualquer sinal de desestabilização (floculação, cremeação ou sedimentação) e o tamanho da fase interna não apresentou aumento de valor, demostrando estabilidade física , segundo os autores. Baseado nos resultados encontrados no estudo de estabilidade acelerada, a nanoemulsão contendo extrato não permaneceu estável com alterações no seu aspecto, redução do teor de AMA e perda da viscosidade inicial. Este estudo revelou que, para a incorporação do extrato mole das cascas de R. ferruginea são necessárias adequações farmacotécnicas, como construção do diagrama de fases utilizando o extrato na composição para verificar a formulação mais adequada e estável à incorporação do mesmo, além de mais testes com diferentes tensoativos. 5.8 Avaliação do potencial irritante das nanoemulsões contendo R. ferruginea O ensaio in vitro para avaliação do potencial irritante das nanoemulsões neste estudo foi baseado na citotoxicidade pela difusão em gel de agarose, que é recomendado para emulsões com a fase externa aquosa. Neste teste a citotoxicidade em cultura de fibroblastos é baseada na medida no diâmetro do halo formado pela lise celular revelado pelo corante vermelho neutro (ANVISA, 2003). 132 O potencial irritante encontrado neste estudo para as nanoemulsões com e sem extrato da R. ferruginea, foi moderado de acordo com a classificação descrita pela Farmacopéia Americana (UNITED STATES PHARMACOPEIA, 2007). A média do halo de lise de uma duplicata foi de 6,5 ± 0,70 mm para a nanoemulsão com extrato e 7,25 ± 0,35 mm para a nanoemulsão sem extrato, conforme figura 25. Os cremes com e sem extrato de R. ferruginea (Figura 25) e o extrato mole, figura 26, não apresentaram formação de halo, indicando nenhuma ação irritante na metodologia empregada. Figura 25 - Fotografia de placa de cultivo celular do teste de irritação cutânea in vitro para as nanoemulsões e cremes contendo extrato de R. ferruginea. Figura 26 - Fotografia de placa de cultivo celular do teste de irritação cutânea in vitro para o extrato mole da casca de R. ferruginea a 0,25% em DMSO. 133 Baseado nos resultados encontrados, a composição da nanoemulsão é responsável pelo grau irritativo acusado no ensaio, pois foi a única formulação com formação de halo mesmo sem adição do extrato. Em estudo prévio realizado por Müller (2013), o potencial de irritação do tensoativo Alkest® CSO 400, referenciado como R400, foi de grau severo com formação de halo com 1,1 cm de diâmetro. Este dado suporta a avaliação da possível causa do grau de irritação da nanoemulsão, como consequência do grau irritante do Alkest® CSO 400, empregado na formulação. A maioria dos tensoativos induz a reações irritantes na pele, pois provoca alterações bioquímicas como dissolução das membranas lipídicas que perdem sua capacidade de barreira aumentando a sua permeabilidade, podendo levar a lise celular quando o tensoativo se encontra em altas concentrações (EFFENDY; MAIBACH, 1996). 5.9 Análise de liberação in vitro da nanoemulsão contendo extrato da R. ferruginea O perfil de liberação in vitro de sistemas coloidais contendo fármacos é uma caracterização físico-química muito importante, pois além de prever a performance in vivo, pode ser correlacionada à microestrutura do veículo, descrevendo o comportamento estrutural da formulação em escala microscópica e as possíveis interações entre o fármaco e o veículo (MORAIS; BURGESS, 2014). Para a execução do ensaio de liberação foi escolhida a membrana sintética de acetato de celulose por ser inerte e recomendada pelo FDA (FDA, 1997) e como meio receptor uma solução hidroalcoólica 70%, por ter sido capaz de proporcionar a condição sink para a dissolução dos marcadores do extrato, AMA e AMB. Como amostra foi usado 300 mg de cada formulação teste, por ser esta a capacidade do suporte para a amostra nas células. Conforme observado no perfil de liberação do extrato na concentração de 0,13% em propilenoglicol (Figura 27), a liberação do AMB ocorreu após 2 h de ensaio, enquanto o AMA foi liberado a partir de 4 h de análise. Por ser a amostra uma solução, o perfil observado pode estar relacionado com a resistência dos marcadores em transpor a membrana, devido às características físico-químicas destas moléculas e da própria membrana. A membrana se apresenta com característica hidrofílica sendo uma barreira a passagem dos marcadores AMA e AMB, que são compostos fenólicos 134 e com características hidrofóbicas. Estes compostos químicos são muito reativos podendo formar ligações de hidrogênio (CARVALHO; GOSMANN; SCHENKEL, 2004) e consequente lentificação na liberação para o meio receptor. Este mesmo comportamento foi observado por Plessis e colaboradores (2001), quando avaliou a liberação de diversos compostos fenólicos através de membrana de silicone, que foi saturada com octanol ou tolueno para que interagissem com os compostos fenólicos e influenciassem nas suas absorções através da membrana. Este trabalho demonstra o grande efeito das ligações de hidrogênio quando a membrana pode interagir com a substância que irá permeá-la (PLESSIS et al., 2001). A diferença nos tempos de detecção entre o AMA e o AMB, se deve, provavelmente, a maior reatividade do AMA em formar ligações de hidrogênio em relação ao AMB, o que retardou mais a sua liberação. Quantidade liberada µg/cm² Figura 27 - Perfil de liberação in vitro dos marcadores AMA e AMB do extrato mole de R. ferruginea 0,13% em propilenoglicol. n= 6 células. 0,8 0,7 0,6 AMB 0,5 AMA 0,4 0,3 0,2 0,1 0 1 2 4 6 8 12 24 Tempo (horas) A Figura 28 apresenta o perfil de liberação dos marcadores AMA e AMB presentes no extrato mole de R. ferruginea incorporado na nanoemulsão. Para ambos os marcadores, foi observado um maior lag time com início da liberação mais retardado do que o observado no perfil de liberação da solução de extrato. Conforme apresentado na Figura 28, o AMB e o AMA foram liberados a partir de 6 e 12 h de análise, respectivamente. 135 Quantidade liberada µg/cm² Figura 28 - Perfil de liberação in vitro dos marcadores AMA e AMB da nanoemulsão com 0,13% de extrato mole de R. ferruginea. n= 6 células. 0,8 0,7 AMB 0,6 AMA 0,5 0,4 0,3 0,2 0,1 0 1 2 4 6 8 12 24 Tempo (horas) Um comportamento de liberação semelhante ao das nanoemulsões é observado no perfil de liberação dos cremes convencionais contendo o extrato (Figura 29). A liberação dos marcadores AMB e AMA ocorreu a partir de 4 e 12 horas, respectivamente. Em relação ao marcador AMB, o início da liberação foi mais lento do que a partir da solução, porém mais rápido do que quando o extrato foi incorporado nas nanoemulsões. Os resultados indicam que as nanoemulsões possuem uma maior capacidade de retenção dos ativos na fase interna oleosa, provavelmente pelo seu grau de organização na interface, assim como, a maior afinidade dos marcadores pela fase interna do sistema. Figura 29 - Perfil de liberação in vitro dos marcadores AMA e AMB do creme com 0,13% de extrato mole de R. ferruginea. n= 6 células. Quantidade lIberada ug/cm² 1 0,9 0,8 0,7 AMB AMA 4 6 0,6 0,5 0,4 0,3 0,2 0,1 0 1 2 Tempo (horas) 8 12 24 136 Para análise cinética do perfil de liberação de fármacos a partir de formas farmacêuticas são empregados diferentes modelos matemáticos. No entanto, a seleção do melhor modelo que descreve corretamente a liberação de fármacos é muito difícil, em função de diversas etapas envolvidas durante o transporte e liberação dos fármacos no interior de uma forma farmacêutica. Como parâmetro para escolha do modelo matemático em que o perfil de liberação apresenta melhor ajuste é utilizado o valor de coeficiente de determinação (R²), não se devendo utilizar modelos em que o coeficiente seja baixo. Para a descrição adequada de um perfil de liberação, recomenda-se o uso de pelo menos 5 tempos de dissolução (COSTA, 2002). Neste estudo, para analisar o mecanismo de liberação dos marcadores do extrato a partir das formulações, os perfis de liberação foram ajustados em diferentes modelos matemáticos (ordem zero, primeira ordem, Higuchi e Peppas). A análise cinética foi realizada com os resultados da quantidade de marcadores dissolvidos após período de lag time, ou seja, após o início da liberação. O perfil de liberação do AMA em todas as formulações e do AMB na solução do extrato em propilenoglicol e no creme, apresentou um bom ajuste ao modelo cinético de ordem zero (Tabela 13). O perfil de liberação do AMB a partir da nanoemulsão seguiu uma cinética de acordo com o modelo da equação geral da liberação. Este modelo é empregado para analisar a liberação de formas farmacêuticas poliméricas, quando o mecanismo de liberação não é bem conhecido ou quando estão envolvidos mais que um mecanismo de liberação (COSTA, 2002). A partir do ajuste a este modelo e a partir do expoente de liberação obtido (n = 1,995), observou-se que o mecanismo de liberação do AMB a partir da nanoemulsão segue super transporte caso-II, em que a liberação é controlada somente pelo relaxamento das cadeias poliméricas (BRUSCHI et al., 2007; COSTA, 2002). O fluxo de liberação dos marcadores em cada formulação foi obtido a partir da constante de liberação K no modelo cinético com melhor ajuste. Os resultados obtidos confirmam que as emulsões lentificam a liberação dos marcadores, pois o fluxo de liberação destes quando incorporados no creme, assim como, na nanoemulsão, é menor do que o fluxo de liberação a partir da solução do extrato em propilenoglicol. Esta liberação retardada proporcionada pelas emulsões é baseada na lipofilicidade do fármaco incorporado na fase dispersa (disperso ou dissolvido na fase interna da emulsão), reduzindo a cedência destes para a membrana e o meio de liberação (MORAIS; BURGESS, 2014). 137 Comparando o fluxo de liberação dos marcadores a partir do creme e da nanoemulsão, independente do modelo matemático empregado para o ajuste, foi observado que a nanoemulsão diminuiu ainda mais o fluxo de liberação, prolongando a liberação dos marcadores. Para um fármaco lipofílico dissolvido ou disperso na fase interna oleosa de uma emulsão O/A, durante o processo de liberação, deve, inicialmente, se particionar para a fase externa aquosa da emulsão. No caso das nanoemulsões, emulsões com tamanho da fase interna muito pequeno, espera-se uma liberação mais rápida que para macroemulsões (MORAIS; BURGESS, 2014). No entanto, o modo de preparo da nanoemulsão, em que o extrato é incorporado na fase oleosa antes da formação da emulsão, pode resultar na maior proteção aos marcadores lipofílicos AMA e AMB, fazendo com que a liberação seja retardada. Além do efeito da lipofilicidade dos marcadores, o uso do tensoativo polimérico na composição da nanoemulsão deve ser considerado ao se avaliar o perfil de liberação. Os tensoativos poliméricos ao formarem um filme espesso na interface da fase interna proporcionam maior estabilidade e uma forte barreira ao transporte de fármacos (MORAIS; BURGESS, 2014; NAM et al., 2012). O uso do tensoativo nãoiônico Alkest® CSO 400 para a formação das nanogotículas provavelmente formou um filme interfacial polimérico nas gotículas o que pode ter retardado o transporte dos marcadores na interface do sistema e consequentemente seu fluxo. Provavelmente, não pode ter ocorrido influência do polímero Sepigel® adicionado a fase externa da nanoemulsão, já que o mesmo foi adicionado à nanoemulsão já formada, no entanto, seriam necessários testes para confirmar esta probabilidade. A incorporação do extrato no creme convencional foi realizada após o veículo estar pronto. Este procedimento pode não promover a total incorporação do extrato na fase interna da emulsão, embora os marcadores possuam alto coeficiente de particção. Isto por ter resultado também no maior fluxo dos marcadores para esta amostra. Comparando o perfil de liberação entre as formulações, a nanoemulsão proporciona uma liberação mais lenta para os marcadores do que o creme convencional, devido a provável incorporação adequada do marcador na fase interna e a formação das estruturas poliméricas interfaciais das gotículas. 138 Tabela 13 - Análise dos dados obtidos com o ensaio de liberação in vitro do AMB e AMA a partir do extrato mole em propilenoglicol, do creme e da nanoemuls ão contendo extrato. Modelos matemáticos Formulação Solução Creme Nanoemulsão Marcador Ordem zero Primeira ordem Higuchi Equação Geral de Liberação R2 K R2 K R2 K R2 K n AMB 0,9593 0,0264 0,9548 2,49.10-4 0,7313 0,0916 0,9547 0,0250 0,9993 AMA 0,9751 0,0255 0,8767 1,88.10-4 0,5463 0,0665 0,9496 0,0049 1,4582 AMB 0,9984 0,0404 0,8836 0,0003 0,5357 0,1018 0,9910 0,0048 1,6124 AMA 1,0000 0,0142 0,5997 5,67.10-5 0,3333 0,0231 0,9951 1,72.10-7 4,342 AMB 0,9897 0,0367 0,8085 0,0002 0,4664 0,0830 0,9913 0,0018 1,995 AMA 1,0000 0,0042 0,5999 1,67.10-5 0,3333 0,0068 0,9951 5,06.10-8 4,342 139 5.10 Estudo de permeação cutânea in vitro das nanoemulsões contendo extrato de R. ferruginea A metodologia empregada para estudar a permeação cutânea in vitro das nanoemulsões, usando as células de Franz, é um experimento clássico que se baseia na avaliação da difusão passiva dentro e através da pele não viável. Neste modelo o transporte do fármaco é controlado pelo seu coeficiente de difusão dentro dos lipídeos do estrato córneo, pela retenção através da adsorção pela queratina dos corneócitos e o coeficiente de partição entre a formulação que contém o fármaco e os lipídeos do estrato córneo (BOLZINGER et al., 2012). Parâmetros físico-químicos do fármaco como massa molar, número de ligações de hidrogênio doadoras e receptoras, e o coeficiente de partição octanol-água (Log de P), têm relação com o coeficiente de permeabilidade cutânea (BOLZINGER et al., 2012). O estudo de permeação cutânea com a nanoemulsão e o creme contendo extrato e a solução do extrato em propilenoglicol, que é um promotor de permeação cutânea, revelou a ausência dos marcadores AMA e AMB no meio receptor, no estrato córneo e na pele. A presença dos marcadores foi encontrada na formulação remanescente e nas duas primeiras fitas adesivas que foram aderidas à pele para extração dos resquícios da formulação, após o término do estudo, conforme apresentado na Tabela 14. Tabela 14 - Resultados do estudo de permeação cutânea para a nanoemulsão e creme contendo extrato de R. ferruginea e para o extrato de R. ferruginea em propilenoglicol, em modelo de célula de Franz, usando pele de porco. Formulações Extrato Mole de R. ferruginea 0,13% em propilenoglicol Creme 0,13% de R. ferruginea Nanoemulsão 0,13% de R. ferruginea AMA (µg/cm²) Formulação Remanescente 1 Porcentagem AMB Porcentagem Retida AMA (%) (µg/cm²) Retida AMB (%) 8,07 ± 1,72 13,14 ± 2,80 13,09 ± 2,60 11,69 ± 2,33 1,75 ± 0,49 12,37 ± 3,75 2,21 ± 0,53 16,09 ± 4,30 2,86 ± 0,80 15,97 ± 4,34 3,01 ± 0,73 18,52 ± 4,19 Nota: 1A formulação remanescente corresponde ao excesso de formulação sobre a pele no término do estudo juntamente com as duas primeiras fitas adesivas que foram aderidas a pele de porco. 140 Observando os resultados das porcentagens retidas dos marcadores nas formulações foi verificado que houve a cedência dos marcadores a partir das formulações. Os marcadores AMA e AMB são derivados de ácidos benzoicos prenilados (GAZONI, 2009), ou seja, compostos fenólicos (NOVAES, 2011), os quais são muito suscetíveis a formação de ligações de hidrogênio (CARVALHO; GOSMANN; SCHENKEL, 2004) e apresentam alta lipofilicidade (ZERMIANI, 2014). Estas características dos marcadores originam diversas hipóteses quanto ao resultado encontrado para o estudo de permeação cutânea. A presença de grupos ligantes de hidrogênio nas substâncias, retardam a sua penetração dérmica, possivelmente devido a interação destes grupos com os grupos –COOH dos ácidos graxos e –OH dos grupos amidas das ceramidas presentes nos lipídeos do espaço intercelular do estrato córneo (PLESSIS et al., 2001). Segundo resultados encontrados para um estudo sobre a influência do número e a substituição do grupo –OH, em uma seleção de fenóis sobre a permeação in vitro em epiderme humana, estas ligações de hidrogênio afetam negativamente o coeficiente de difusão das substâncias, sendo dependente da simetria das substituições do grupo –OH (PLESSIS et al., 2002). Os marcadores AMA e AMB por pertencerem aos compostos fenólicos, podem sofrer estas interações moleculares com os lipídeos do estrato córneo, no entanto, não foi detectado a presença dos mesmos na análise do estrato córneo. Isto sugere que esta interação ocorreu, provavelmente, nas camadas bem superficiais do estrato córneo, a qual foi extraída nas primeiras duas fitas adesivas e quantificadas juntamente com a formulação remanescente. Quanto à característica lipofílica dos marcadores AMA e AMB, possivelmente, não afetou a permeação dos marcadores, já que no estudo de liberação in vitro ocorreu a partição dos ácidos a partir das formulações. Para a nanoemulsão, deve-se também levar em conta a influência gerada pelo tensoativo polimérico presente em sua composição, o que pode ser observado na maior porcentagem retida dos marcadores nesta formulação. O filme polimérico interfacial formado pelo Alkest® CSO 400 pode ter dificultado a eficiência do transporte dos marcadores para a pele. Na literatura sugere-se o uso de um sistema híbrido lipídeo-polímero para otimizar a nanoemulsão como veículo tópico, além de melhorar a estabilidade da dispersão (NAM et al., 2012). Estes resultados encontrados, porém, não comprometeram a atividade farmacológica anti-inflamatória tópica, conforme descrito no item 5.11. O que pode 141 indicar a possibilidade de limitações no método analítico empregado para a quantificação dos marcadores para este ensaio, já que houve a cedência dos marcadores a partir da formulação. Sugere-se, então, estudos aprofundados a respeito da permeação dos marcadores AMA e AMB, com o objetivo de confirmar as possíveis variáveis que podem influenciar a permeação cutânea dos mesmos. 5.11 Ensaios farmacológicos O método do edema de orelha é frequentemente empregado para o estudo do potencial efeito anti-edematogênico de possíveis agentes anti-inflamatórios tópicos. Neste método há a indução de reações inflamatórias dérmicas, evidenciada pelo aumento da espessura da orelha, onde um sensibilizante químico é aplicado, refletindo a dermatite alérgica de contato (KIMBER et al., 1999; LEITE et al., 2011). O óleo de cróton, agente sensibilizante escolhido para este estudo, contém 12-Otetradecanoilforbol acetato (TPA) como principal agente irritante na sua composição (LEITE et al., 2011; OLIVEIRA, 2009). É necessária uma única aplicação do óleo de cróton para a obtenção de resultados de atividade antiedematogênica de compostos em processos inflamatórios agudos, tendo como primeiro sinal de irritação cutânea e inflamação local o edema (LEITE et al., 2011; OTUKI et al., 2011). A exposição da pele ao TPA induz respostas que englobam uma forte reação inflamatória similar aquelas observada em várias doenças cutâneas severas (PASSOS et al., 2013), com ativação da proteína kinase C que leva a ativação de outras cascatas enzimáticas que por sua vez liberam o fator de ativação plaquetária (PAF), o ácido araquidônico (AA) e seus metabólitos como as prostaglandinas e leucotrienos (HORINOUCHI et al., 2013; LEITE et al., 2011). Estes eventos, juntamente com as citocinas geradas pela indução com TPA, que inclui TNF, IL-1β, KC, MIP-2 (PASSOS et al., 2013), levam aos sinais microscópicos da inflamação aguda como aumento da permeabilidade vascular, vasodilatação e migração celular (HORINOUCHI et al., 2013; LEITE et al., 2011). Para definição da concentração de extrato a ser incorporada na nanoemulsão na fase da sua otimização, item 5.5, inicialmente foi realizado teste de edema de orelha incorporando o extrato mole de R. ferruginea em um veículo de creme convencional, formulação descrita no item 4.5.3, Quadro 4. O resultado encontrado, representado na Figura 30, indica redução do edema induzido pelo óleo de cróton, e com base neste resultado a concentração de extrato escolhida para incorporação na 142 nanoemulsão foi de 0,5%, pois foi a concentração intermediária que apresentou efeito antiedematogênico, não apresentando diferença significativas entre as concentrações empregadas no ensaio. Figura 30 - Efeito dos cremes contendo extrato mole de R. ferruginea (RF 0,25%, 0,5% e 1,0%) e AMB (0,5% e 0,1%) administrados topicamente sobre edema de orelha induzido pelo óleo de cróton. Nota: Cada barra representa a média S.E.M. para 8 animais. Os símbolos gráficos indicam os níveis de significância quando comparado com o grupo controle. Significativamente diferente do controle, *** para P < 0,0001, ** para P < 0,01 e * para P < 0,05. Posteriormente, novo teste de avaliação anti-inflamatória foi realizado para definição da concentração de extrato de R. ferruginea a ser incorporado na nanoemulsão com formulação definida no item 4.6 Quadro 6 e no creme convencional, formulação descrita no item 4.5.3 Quadro 4, com o objetivo de avaliar a ação antiinflamatória confrontando as mesmas concentrações de extrato em veículos diferentes. O resultado encontrado, representado na Figura 31, indica que a concentração de 0,13% de extrato apresentou atividade anti-inflamatória mais efetiva quando incorporado no veículo nanoemulsão. Quando se compara a inibição do edema provocada pela ação do extrato incorporado no creme convencional, não houve diferença estatística entre as concentrações testadas. Para averiguar a influência na ação anti-inflamatória do extrato mole das cascas de R. ferruginea incorporado em diferentes veículos, a concentração de extrato incorporada na nanoemulsão e creme convencional foi de 0,13%. Conforme observado na Figura 31, a aplicação tópica do óleo de cróton promoveu a formação do edema nas orelhas do grupo controle, apresentando uma 143 espessura média de 455,5 ± 36,65 µm. De acordo com Patrick e colaboradores (1987), a aplicação do óleo de cróton desenvolve um edema auricular após 1h da aplicação, no entanto, seu efeito máximo se dá após 6 horas. Figura 31 - Efeito das nanoemulsões e cremes contendo extrato mole de R. ferruginea e dexametasona administrados topicamente sobre edema de orelha induzido por óleo de cróton. O edema de orelha foi mensurado após 6 h da indução com óleo de cróton. Nota: Cada barra representa a média ± S.E.M para 6 animais. O símbolo gráfico (*) indica o nível de significância quando comparado com o grupo controle e (#) indica o nível de significância quando comparado entre os grupos. Significativamente diferentes do controle, *** para P < 0,0001 e diferentes entre os grupos, # para P < 0,05. A presença do extrato da R. ferruginea proporcionou a redução do edema em todas as orelhas tratadas com a nanoemulsão e o creme, conforme observa-se na Tabela 15 que indica a porcentagem de inibição do edema nos grupos tratados, demonstrando a atividade anti-inflamatória tópica das formulações contendo o extrato. Esse resultado também demonstra que os veículos, nanoemulsão branco e creme branco, não causaram interferência na ação. 144 Tabela 15 - Porcentagem de inibição e média da espessura do edema de orelha induzido pelo óleo de cróton 2,5% nos grupos tratados com as nanoemulsões e cremes contendo extrato mole de R. ferruginea. Inibição do edema Espessura ± s (% ) (µm) Nanoemulsão 0,13% 90,50% 43,25 ± 1,6 Nanoemulsão 0,25% 64,98% 159,5 ± 41,02 Creme 0,13% 56,53% 198,0 ± 28,8 Creme 0,25% 58,64% 188,4 ± 38,86 Creme 0,5% 64,65% 161,0 ± 22,2 Dexametasona 0,1% 97,80% 10,0 ± 10,0 Tratamento A inibição do edema no grupo tratado com a nanoemulsão com 0,13% de extrato, foi superior a todas as outras formulações contendo extrato da R. ferruginea. Comparando os resultados entre as nanoemulsões, a menor concentração de 0,13% de extrato, foi mais efetiva em relação à concentração de 0,25% de extrato, ou seja, a atividade anti-inflamatória tópica do extrato de R. ferruginea veiculado na nanoemulsão foi potencializada. Esta diferença de ação entre as nanoemulsões é, possivelmente, devido a melhor incorporação e/ou dissolução na fase oleosa durante o seu preparo, pois nesta concentração, 0,13%, o extrato demonstrou melhor homogeneização em relação as concentrações maiores. Comparando os resultados entre os diferentes veículos, nanoemulsão e creme, ficou evidente que a nanoemulsão se apresenta como melhor veículo em comparação ao creme, 1,6% mais eficaz, com significativa diferença estatística quanto ao efeito inibitório do edema. Confirmando mais uma vez a potencialização do efeito antiinflamatório do extrato quando incorporado em nanoemulsão. A resposta antiedematogênica dos cremes contendo o extrato da R. ferruginea, não apresentou diferença estatística entre as diferentes concentrações, conforme verificado na Figura 31. Estes resultados demonstram a ação anti-inflamatória tópica do extrato de R. ferruginea em modelo de edema de orelha induzido por óleo de cróton. Esta atividade farmacológica deve-se possivelmente a presença do AMA e AMB no extrato mole da planta, pois estudos anteriores, com estes compostos isolados, confirmaram a atividade anti-inflamatória de ambos em modelo de edema de orelha induzido por TPA (DONG et al., 1999; HIROTA et al., 2002; MIZUSHINA et al., 2000). No entanto, deve- 145 se levar em conta que nesse estudo foi utilizado o extrato da planta, o qual contém inúmeros componentes desconhecidos, ainda, e podem atuar sinergicamente com os marcadores conhecidos proporcionando esta atividade farmacológica. A ação sinérgica entre os componentes do extrato de R. ferruginea ficou claro no estudo realizado por Baccarin (2010), em que a avaliação da atividade farmacológica quanto à antinocicepção, demonstrou que o resultado foi superior no extrato seco que não continha maior concentração do marcador AMB. Para a realização dos demais testes farmacológicos foi selecionado como grupo de tratamento, a nanoemulsão com 0,13% de extrato da R. ferruginea, pois esta forma farmacêutica demonstrou melhor ação farmacológica em relação a todos os demais grupos. Para verificar a influência do veículo na ação anti-inflamatória tópica do extrato, optou-se por confrontar a nanoemulsão com o creme incorporando a mesma concentração do extrato de R. ferruginea, ou seja, 0,13%. Histologicamente, a análise do tecido das orelhas no grupo controle, tratado somente com óleo de cróton 2,5%, quando comparado ao naive, evidencia a derme mais espessa, com elevada concentração de infiltrado celular e maior extravasamento plasmático, caracterizando o edema visualizado macroscopicamente (figuras 32 A e B). Estes achados ganham suporte com estudo realizado por Patrick e colaboradores (1987), que observaram, após 6 h da aplicação do óleo de cróton, um aumento do número de vasos sanguíneos, edema moderado a severo, com um difuso infiltrado celular. Os grupos tratados com creme e nanoemulsão contendo 0,13% de extrato de R. ferruginea (Figuras 32 E e G), apresentaram-se histologicamante com redução do extravasamento plasmático e espessura dérmica, em relação ao grupo controle, demonstrando a atividade anti-inflamatória tópica. Apresentam também semelhante concentração de células em relação aos grupos que receberam creme e nanoemulsão sem extrato (Figuras 32 D e F). Visualiza-se que não houve redução da espessura dérmica e do extravasamento plasmático nos grupos tratados com os veículos creme e nanoemulsão sem extrato, em relação ao grupo controle. Estas observações confirmam que a presença do extrato de R. ferruginea possui efeito anti-inflamatório. Os resultados histológicos confirmam os resultados macroscópicos encontrados na avaliação da atividade anti-inflamatória tópica pelo método do edema de orelha induzido por óleo de cróton. 146 Figura 32 - Fotomicrografias dos cortes histológicos das orelhas dos camundongos, corados em hematoxilina-eosina (HE), 6 horas após a indução do edema com óleo de cróton 2,5% (4x e 10x). (A) naive, (B) controle negativo, (C) controle positivo tratado com dexametasona 0,1%, (D) tratamento com veículo-creme, (E) tratamento com creme 0,13% extrato de R. ferruginea, (F) tratamento com veículo-nanoemulsão, (G) tratamento com nanoemulsão 0,13% extrato de R. ferruginea. As setas indicam a presença de infiltrado celular e as barras vermelhas indicam a espessura dérmica. 147 Para elucidar os mecanismos envolvidos na inibição do edema de orelha provocado pela nanoemulsão contendo extrato de R. ferruginea, foi realizada a quantificação de algumas citocinas envolvidas em um processo inflamatório como a IL-1β, o TNF e a KC, além da avaliação da atividade enzimática da MPO. A diferença na quantidade de infiltrado celular nos grupos tratados pode ser elucidada pela avaliação indireta da atividade da MPO, a qual faz referência somente a infiltração de neutrófilos, pois a MPO é uma enzima sinalizadora da infiltração (HORINOUCHI et al., 2013) e sobrevivência de neutrófilos (VEEN; WINTHER; HEERINGA, 2009). No resultado obtido pela medida indireta da atividade da MPO neste estudo, Figura 33, o grupo que recebeu o óleo de cróton 2,5% apresentou elevada atividade da MPO, indicando o estímulo promovido pela aplicação do óleo de cróton a liberação desta enzima pelos neutrófilos. Percebe-se que houve significativa redução da atividade enzimática no grupo tratado com a nanoemulsão com 0,13% de extrato (concentração média= 0,355 ± 0,06 DO/mg correspondendo a 64,60% de inibição), tanto em relação ao grupo controle como quando comparado com o grupo tratado com o creme com 0,13% de extrato (concentração média= 0,689 ± 0,02 DO/mg correspondendo a 31,30% de inibição). Estes resultados demonstram o efeito da nanoemulsão com 0,13% de extrato em reduzir a atividade da MPO, consequentemente promovendo a redução da infiltração e migração de neutrófilos no local da inflamação, além de evidenciar melhor resultado quando o veículo é a nanoemulsão e não o creme. 148 Figura 33 - Efeito da nanoemulsão e creme contendo 0,13% de extrato de R. ferruginea sobre a atividade da mieloperoxidase no sobrenadante de homogeneizados das orelhas tratadas com óleo de cróton 2,5%. A atividade da MPO foi mensurada após 6 h da indução pelo óleo de cróton. Nota: Cada barra representa a média ± S.E.M. para 6 animais. O símbolo gráfico (*) indica o nível de significância quando comparado com o grupo controle e (#) quando comparado entre os grupos. Significativamente diferente do controle, *** para P < 0,0001, * para P < 0,05, significativament e diferente entre os grupos, ## para < 0,01. Estas observações se confirmam também analisando os resultados obtidos através da quantificação da KC, uma quimiocina responsável pelo recrutamento de neutrófilos (FILIPPO et al., 2008), representada na Figura 34. A quantificação da KC realizada no grupo controle demonstra uma quantidade elevada como resposta a aplicação do óleo de cróton. O grupo tratado com a nanoemulsão contendo 0,13% de extrato apresentou redução na quantificação da quimiocina (concentração média= 365,96 ± 35,6 pg/mg correspondendo a 42,72% de inibição) assim como o creme com 0,13% do extrato (concentração média= 268,97 ± 72,73 pg/mg correspondendo a 57,90% de inibição), não apresentando diferença estatística significativa entre si. 149 Figura 34 - Efeito da nanoemulsão e creme contendo 0,13% de extrato de R. ferruginea sobre a inibição da quimiocina derivada de queratinócitos (KC) induzida por óleo de cróton 2,5% em orelhas de camundongos. Nota: Cada barra representa a média ± S.E.M. para 6 animais. Os símbolos gráficos indicam os níveis de significância quando comparado com o grupo controle. Significativamente diferente do controle, ** para P < 0,01. O tratamento com veículos tópicos contendo extrato da R. ferruginea inibe a infiltração e migração de neutrófilos para o local da inflamação. A ação do extrato de R. ferruginea é melhorada quando veiculado em nanoemulsão, em relação a inibição da enzima mieloperoxidase liberada pelos neutrófilos. Não se observou diferença na ação do extrato entre os veículos com relação ao recrutamento de neutrófilos, representada pela inibição da quimiocina KC. Os queratinócitos quando expostos a agentes irritantes ou sensibilizantes respondem através da síntese e liberação de citocinas pró-inflamatórias como IL-1 e TNF, que induzem as células endoteliais a expressarem moléculas de adesão necessárias ao acúmulo de células inflamatórias (FUCHS et al., 2001). A análise da quantificação das citocinas IL-1β e TNF, representada pela Figura 35, evidencia diferenças na atividade inibitória entre os grupos tratados com a nanoemulsão e o creme contendo o extrato da R. ferruginea. A nanoemulsão contendo o extrato reduziu a quantidade de IL-1β (concentração média= 668,49 ± 39,4 pg/mg) e TNF (concentração média 251,24 ± 10,64 pg/mg) correspondendo a 40,96% e 42,23%, respectivamente. Comparando-se a ação do extrato nos diferentes veículos, percebe-se que a nanoemulsão foi superior ao creme com relação a inibição da TNF, com diferença 150 estatística significativa, o creme inibiu 28,72% (concentração média= 309,95 ± 2,47 pg/mg). Para IL-1β, a inibição do creme com extrato foi de 45,89% (concentração média= 612,72 ± 21,52 pg/mg), sem diferença estatística significativa. Como o TNF também é produzido a partir da MPO ativa (VEEN; WINTHER; HEERINGA, 2009), este resultado tem estreita ligação com a maior redução da MPO observado no grupo tratado com a nanoemulsão com 0,13% de extrato. Figura 35 - Efeito da nanoemulsão e do creme contendo 0,13% de extrato de R. ferruginea sobre a produção de IL-1β e TNF, induzida por óleo de cróton 2,5% em orelhas de camundongos. Nota: Cada barra representa a média ± S.E.M para 6 animais. O símbolo gráfico (*) indica o nível de significância quando comparado com o grupo controle e (#) quando comparado entre os grupos. Significativamente diferente do controle, *** para P < 0,0001, significativamente diferente entre os grupos, # para P < 0,05. Estes resultados demonstram a ação anti-inflamatória tópica do extrato mole de R. ferruginea veiculada em nanoemulsão e creme, com redução do edema, infiltrado celular e redução da quantificação de citocinas pró-inflamatórias IL-1β e TNF, redução da atividade da MPO e da quimiocina KC. Em relação a veiculação do extrato em nanoemulsão e creme, a nanoemulsão demonstrou melhor ação anti-inflamatória que o creme, quanto à inibição do edema de orelha induzido pelo óleo de cróton tanto macroscopicamente como microscopicamente, além de melhor ação inibitória da atividade da MPO e redução na produção de TNF. Estes achados demonstram que a ação anti-inflamatória tópica do extrato mole da R. ferruginea testada em modelo de edema de orelha induzido por óleo de cróton, é influenciada pelo veículo e sua provável interação com o sistema fisiológico da pele. 151 6 CONCLUSÕES A coleta das cascas de R. ferruginea foi padronizada para árvores com 35 cm de diâmetro e no tronco à altura de 20 cm do chão, devido ao maior teor de marcadores. O marcador AMA apresenta-se em maior concentração que o AMB nas cascas de R. ferruginea. Foi obtido extrato mole das cascas de R. ferruginea com teor de 37,34 ± 0,09 mg/g de AMB de 40,04 ± 0,02 mg/g de AMA. Foi desenvolvida a nanoemulsão a partir da seleção da melhor e mais estável proporção de componentes em um diagrama de fases pseudoternário. A nanoemulsão foi desenvolvida pelo método de inversão de fases, usando como componente oleoso o miristato de isopropila, a mistura de tensoativos Alkest® CSO400 e o Span® 80. O extrato mole das cascas de R. ferruginea foi incorporado na fase oleosa da nanoemulsão. Para adequação da viscosidade da nanoemulsão para aplicação tópica, foi usado um doador de consistência. A nanoemulsão contendo extrato apresentou textura cremosa na cor caramelo claro, com pH de 5,24 ± 0,02, o tamanho médio da fase interna foi de 47,88 ± 8,20 nm com índice de polidispersibilidade adequado no valor de 0,228 e potencial zeta de 34,7 ± 1,15 mV. A análise morfológica por MET, confirmou que o sistema é pouco disperso sem a formação de agregados com as gotículas na forma esférica. O sistema apresentou comportamento reológico pseudoplástico tixotrópico, com viscosidade média de 5773,28 ± 950,86 mPa.s-1. O teor dos ácidos AMA e AMB foi de 54,10 ± 0,08 μg/g e 53,03 ± 0,03 μg/g de formulação, respectivamente. O estudo de estabilidade acelerada revelou a necessidade de adequações farmacotécnicas futuras para assegurar a estabilidade da nanoemulsão incorporando o extrato mole de R. ferruginea, pois houve um decréscimo de 51,12% para o AMA e de 15,83% para o AMB após 180 dias a 40 °C, com diminuição de 98,50% na viscosidade aparente. A nanoemulsão veículo e contendo extrato apresentaram moderado grau de irritação cutânea in vitro. O extrato mole não desenvolveu irritação no ensaio de difusão em ágar. Estes resultados demonstram que o grau de irritação das nanoemulsões se deve a composição das mesmas. 152 O ensaio de liberação in vitro demonstrou liberação mais lenta dos marcadores AMA e AMB quando incorporados na nanoemulsão. Os marcadores AMA e AMB não permearam através da pele de porco no estudo de permeação cutânea, sendo detectados somente na formulação remanescente. Sugere-se novos estudos aprofundados quanto a influência de variáveis na permeação cutânea dos marcadores do extrato em nanoemulsão. A atividade anti-inflamatória tópica foi maior para a nanoemulsão em comparação ao creme convencional com a mesma concentração de extrato (0,13%), com inibição do edema de orelha de 90,5 e 56,53%, respectivamente. O resultado da análise histológica dos tecidos inflamados não demonstrou diferenças visuais significativas entre o tratamento com o creme convencional e a nanoemulsão contendo extrato. A quantificação de citocinas e da atividade da MPO, demonstrou que a nanoemulsão contendo extrato possui melhor atividade inibitória na liberação de TNF e MPO, não havendo diferença significativa, entre os tratamentos, quanto à inibição da liberação de KC e IL-1β. Portanto, a incorporação do extrato em um sistema nanoemulsionado promoveu uma maior eficácia anti-inflamatória tópica, em modelo de edema de orelha induzido por óleo de cróton, em relação à emulsão convencional não diferindo estatisticamente do creme contendo 0,1% de dexametasona, demonstrando o seu potencial anti-inflamatório tópico. Sugere-se a continuidade dos estudos buscando o aprimoramento farmacotécnico da nanoemulsão para adequá-la a incorporação do extrato de R. ferruginea e também buscar maiores evidências quanto a permeação cutânea do AMA e AMB presentes no extrato quando incorporado em nanoemulsão. 153 REFERÊNCIAS ABDEL-MOTTALEB, M. M.; MOULARI, B.; BEDUNEAU, A.; PELLEQUER, Y.; LAMPRECHT, A. Nanoparticles enhance therapeutic outcome in inflamed skin therapy. European Journal of Pharmaceutics and Biopharmaceutics, v. 82, p. 151-157, 2012. ABRAMOVITS, W.; BEJARANO, J. J.; VALDECANTOS, W. C. Role of interleukin 1 in atopic dermatitis. Dermatologic Clinics, v. 31, n. 3, p. 437-444, 2013. ALAM, M. S.; ALI, M. S.; ALAM, N.; SIDDIQUI, M. R.; SHAMIM, M.; SAFHI, M. M. In vivo study of clobetasol propionate loaded nanoemulsion for topical application in psoriasis and atopic dermatitis. Drug Invention Today, v. 5, p. 8-12, 2013. ALAM, S.; BABOOTA, S.; ALI, S.; ALI, M.; ALAM, N.; ALAM, I.; ALI, J. Accelerated stability testing of betamethasone dipropionate nanoemulsion. International Journal of Pharmacy and Pharmaceutical Sciences, v. 4, n. 4, p. 1-4, 2012. ALI, M. S.; ALAM, M. S.; IMAM, F.; SIDDIQUI, M. R. Topical nanoemulsion of turmeric oil for psoriasis: characterization, ex vivo and in vivo assessment. International Journal of Drug Delivery, v. 4, n. 2, p. 184-197, 2012. AMANI, A.; YORK, P.; CHRYSTYN, H.; CLARK, B. J. Factors affecting the stability of nanoemulsions - use of artificial neural networks. Pharmaceutical Research, v. 27, n. 1, p. 37-45, jan. 2010. AMANI, A.; YORK, P.; CHRYSTYN, H.; CLARK, B. J.; DO, D. Q. Determination of factors controlling the particle size in nanoemulsions using artificial neural networks. European Journal of Pharmaceutical Sciences, v. 35, p. 42-51, 2008. ANTON, N.; VANDAMME, T. F. The universality of low-energy nano-emulsification. International Journal of Pharmaceutics, v. 377, p. 142-147, 2009. ANTON, N.; VANDAMME, T. F. Nano-emulsions and micro-emulsions:clarifications of the critical differences. Pharmaceutical Research, v. 28, n. 5, p. 978-985, mai. 2011. ANTONIALLI, C. S. Avaliação do efeito do ácido mirsinóico b em diferentes modelos de hipernocicepção inflamatória e neuropática persistente em camundongos. 2009. 97 f. Dissertação (Mestrado) - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2009. ANTONIALLI, C. S.; DA SILVA, G. F.; ROCHA, L. W.; MONTEIRO, E. R.; DE SOUZA, M. M.; MALHEIROS, A.; YUNES, R. A.; QUINTÃO, N. L. Antihyperalgesic effects of myrsinoic acid b in pain-like behavior induced by inflammatory and neuropathic pain models in mice. Anesthesia & Analgesia, v. 115, n. 2, p. 461-469, 2012. ANVISA. Ministério da Saúde. Guia para Avaliação de Segurança de Produtos Cosméticos. Brasília, DF, 2003. ANVISA. Ministério da Saúde. Guia de Estabilidade de Produtos Cosméticos. Brasília, DF, 2004. 154 ARAÚJO, F. A.; KELMANN, R. G.; ARAÚJO, B. V.; FINATTO, R. B.; TEIXEIRA, H. F.; KOESTER, L. S. Development and characterization of parenteral nanoemulsions containing thalidomide. European Journal of Pharmaceutical Sciences, v. 42, p. 238-245, 2011. ATRUX-TALLAU, N.; LASSELIN, J.; HAN, S.; DELMAS, T.; BIBETTE, J. Quantitative analysis of ligand effects on bioefficacy of nanoemulsion encapsulating depigmenting active. Colloids and Surfaces B: Biointerfaces, v. 122, p. 390-395, 2014. AZEEM, A.; RIZWAN, M.; AHMAD, F. J.; KHAR, R. K.; IQBAL, Z.; TALEGAONKAR, S. Components screening and influence of surfactant and cosurfactant on nanoemulsion formation. Current Nanoscience, v. 5, p. 220-226, 2009. BACCARIN, T. Desenvolvimento e padronização de extrato seco de Rapanea ferruginea MEZ. (Mirsinaceae) obtido por spray drying e avaliação in vivo da atividade antinociceptiva. 2010. 144 f. Dissertação (Mestrado) - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2010. BACCARIN, T.; FERREIRA, R. A.; GAZONI, V. F.; YUNES, R. A.; MALHEIROS, Â.; LUCINDASILVA, R. M. Influence of extraction parameters on hydroalcohol extracts of the stem bark of Rapanea ferruginea Mez using myrsinoic acid b as marker. Tropical Journal of Pharmaceutical Research, v. 13, n. 7, p. 1113-1119, jul. 2014. BACCARIN, T.; MUCENEEKI, R. S.; BRESOLIN, T. M.; YUNES, R. A.; MALHEIROS, Â.; LUCINDA-SILVA, R. M. Development and validation of an HPLC-PDA method for the determination of myrsinoic acid b in the extracts of Rapanea ferruginea Mez. Talanta, v. 85, p. 1221-1224, 2011. BALI, V.; ALI, M.; ALI, J. Study of surfactant combinations and development of a novel nanoemulsion for minimising variations in bioavailability of ezetimibe. Colloids and Surfaces B: Biointerfaces, v. 76, p. 410-420, 2010. BARKER, J. N.; MITRA, R. S.; GRIFFITHS, C. E.; DIXIT, V. M.; NICKOLOFF, B. J. Keratinocytes as initiators of inflammation. The Lancet, v. 337, n. 26, p. 211-214, jan. 1991. BARRETTA, C. Atividade Antioxidante de Extratos e Compostos Isolados de Eugenia umbelliflora e Rapanea ferruginea. 2011. 97f. Dissertação (Mestrado) - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2011. BARTON, G. M. A calculated response: control of inflammation by the innate immune system. The Journal of Clinical Investigation, v. 118, n. 2, p. 413-420, 2008. BEDI, M. K.; SHENEFELT, P. Herbal therapy in dermatology. Archives of Dermatology, v. 138, n. 2, p. 232-242, 2002. BERNARDI, D. S. Desenvolvimento de nanoemulsão de óleo de arroz como adjuvante no tratamento de dermatite atópica e psoríase. 2011. 104 f. Dissertação (Mestrado) Faculdade de Ciências Farmacêuticas de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, 2011. BICKERS, D. R.; ATHAR, M. Oxidative stress in the pathogenesis of skin disease. Journal of Investigative Dermatology, v. 126, p. 2565-2575, 2006. BIDONE, J.; ZORZI, G. K.; CARVALHO, E. L.; SIMÕES, C. M.; KOESTER, L. S.; BASSANI, V. L.; TEIXEIRA, H. F. Incorporation of Achyrocline satureioides (Lam.) DC extracts into topical 155 nanoemulsions obtained by means of spontaneous emulsification procedure. Industrial Crops and Products, v. 62, p. 421-429, 2014. BLUNT, S. B.; CHEN, T.; WIEMER, D. F. Prenylated benzoic acids from Rapanea myricoides. Journal of Natural Products, v. 61, p. 1400 - 1403, 1998. BOLZINGER, M.; BRIANÇON, S.; PELLETIER, J.; CHEVALIER, Y. Penetration of drugs through skin, a complex rate-controlling membrane. Current Opinion in Colloid & Interface Science, v. 17, p. 156-165, 2012. BRASIL. Ministério da Saúde. Secretaria de Ciência, T. e. (2006). Política nacional de plantas medicinais e fitoterápicos. Brasília, DF, 2006. Disponível em: <bvsms.saude.gov.br/bvs/publicacoes/politica_nacional_fitoterapicos.pdf>. Acesso em: 26 jun. 2013. BRASIL. Farmacopéia Brasileira. São Paulo: Atheneu, 2010. 5 ed. Parte I. BRUSCHI, M. L.; JONES, D. S.; PANZERI, H.; GREMIÃO, M. P. D.; FREITAS, O.; LARA, E. H. G. Semisolid systems containing propolis for the treatment of periodontal disease: in vitro release kinetics, syringeability, rheological, textural, and mucoadhesive properties. Journal of Pharmaceutical Sciences, v. 96, n. 8, p. 2074-2089, 2007. BURGUERA, J. L.; BURGUERA, M. Analytical applications of emulsions and microemulsions. Talanta, v. 96, p. 11-20, 2012. CARLSON, R. P.; O’NEIL-DAVIS, L.; CHANG, J.; LEWIS, A. J. Modulation of mouse ear edema by cyclooxygenase and lipoxygenase inhibitors and other pharmacologic agents. Agents Actions, v. 17, n. 2, p. 197-204, 1985. CARVALHO, J. C.; GOSMANN, G.; SCHENKEL, E. P. Compostos fenólicos simples e heterosídicos. . In: SIMÕES, C. M.; SCHENKEL, E. P.; GOSMANN, G.; MELLO, J. C.; MENTZ, L. A.; PETROVICK, P. R. Farmacognosia da planta ao medicamento. Porto Alegre/Florianópolis: Editora da UFRGS, 2004. p. 526-528. CECHINEL FILHO, V.; MEYRE-SILVA, C.; NIERO, R.; MARIANO, L. N.; DO NASCIMENTO, F. G.; FARIAS, I. V.; GAZONI, V. F.; SILVA, B. S.; GIMÉNEZ, A.; GUTIERREZ-YAPU, D.; SALAMANCA, E.; MALHEIROS, A. Evaluation of antileishmanial activity of selected brazilian plants and identification of the active principles. Evidence-based Complementary and Alternative Medicine, v. 2013, p. 7, 2013. CESCA, T. G.; FAQUETI, L. G.; ROCHA, L. W.; MEIRA, N. A.; MEYRE-SILVA, C.; DE SOUZA, M. M.; QUINTÃO, N. L. M.; SILVA, R. M. L.; CECHIBEL FILHO, V.; BRESOLIN, T. M. Antinociceptive, anti-inflammatory and wound healing features in animal models treated with a semisolid herbal medicine based on Aleurites molucana L. Willd. Euforbiaceae standardized leaf extract semisolid herbal. Journal of Ethnopharmacology, v. 143, p. 355-362, 2012. CONVERGENT, C. Emulsions and the HLB system. Disponível em: <http://www.lotioncrafter.com/pdf/Emulsions_&_HLB_System.pdf>. Acesso em: 23 jun. 2013. CORAZZA, M., BORGHI, A., LAURIOLA, M. M., & VIRGILI, A. Use of topical herbal remedies and cosmetics: a questionnarie-based investigation in dermatology out-pacients. Journal of the European Academy of Dermatology and Venereology, v. 23, p. 1298-1303, 2009. 156 CORSINI, E.; GALLI, C. L. Epidermal cytokines in experimental contact dermatitis. Toxicology, v. 142, p. 203-211, 2000. COSTA, P. Avaliação da atividade do extrato dos frutos de Rapanea ferruginea e dos compostos isolados ácido mirsinóico a e triglicerídeo sobre a memória de animais normais e com alzheimer induzido. 2011. 133 f. Dissertação (Mestrado) - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2011. COSTA, P. J. Avaliação in vitro da lioequivalência de formulações farmacêuticas. Revista Brasileira de Ciências Farmacêuticas, v. 38, n. 2, p. 141-153, abr/jun. 2002. CRUZ, A. B.; KAZMIERCZAK, K.; GAZONI, V. F.; MONTEIRO, E. R.; FRONZA, L. M.; MARTINS, P., YUNES, R. A.; BÜRGER, C.; TOMIO, T. A.; FREITAS, R. A. MALHEIROS, A. Bio-guided isolation of antimicrobial compounds from Rapanea ferruginea and its cytotoxic and genotoxic potential. Journal of Medicinal Plants Research, v. 7, n. 19, p. 1323-1329, mai. 2013. CZEPULA, A. I. Desenvolvimento de preparações semi-sólidas contendo extrato de Sphagneticola trilobata (L.) Pruski (Acmela brasiliensis, Wedelia paludosa) (Asteraceae) e avaliação da atividade antiinflamatória tópica in vivo. 2006. 119 f. Dissertação (Mestrado) - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2006. DALTIN, D. Introdução e primeiros conceitos. In: DALTIN, D. Tensoativo: química, propriedades e aplicações. São Paulo: Blucher, 2011. p. 1-43. DAMASCENO, B. P.; SILVA, J. A.; OLIVEIRA, E. E.; SILVEIRA, W. L.; ARAÚJO, I. B.; OLIVEIRA, A. G.; EGITO, E. S. Microemulsão: um promissor carreador para moléculas insólúveis. Revista de Ciências Farmacêuticas Básica e Aplicada, v. 32, n. 1, p. 9-18, 2011. DE CARLI, R. B. Desenvolvimento de formas farmacêuticas semi-sólidas contendo ácido caurenóico e avaliação da antividade antiinflamatória in vivo. 2007. 117 f. Dissertação (Mestrado) - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2007. DESAI, A.; VYAS, T.; AMIJI, M. Cytotoxicity and apoptosis enhancement in brain tumor cells upon coadministration of paclitaxel and ceramide in nanoemulsion formulations. Journal of Pharmaceutical Sciences, v. 97, n. 7, p. 2745-2756, 2008. DONG, M.; NAGAOKA, M.; MIYAZAKI, S.; IRIYE, R.; HIROTA, M. 3-geranyl-4-hydroxy-5-(3'methyl-2'-butenyl) bezoic acid as an anti-inflammatory compound from Myrsine seguinii. Bioscience, Biotechnology and Biochemistry, v. 63, n. 9, p. 1650-1653, 1999. EFFENDY, I.; MAIBACH, H. I. Detergent and skin irritation. Clinics in Dermatology, v. 14, p. 15-21, 1996. EL-DIN, M. R.; EL-GAMAL, I. M.; EL-HAMOULY, S. H.; MOHAMED, H. M.; MISHRIF, M. R.; RAGAB, A. M. Rheological behavior of water-in-diesel fuel nanoemulsions stabilized by mixed surfactants. Colloids and Surfaces A: Physicochemical and Engineering Aspects, v. 436, p. 318-324, 2013. EMA. Committee for medicinal products for human use (CHMP). Reflection paper on nanotechnology-based medicinal products for human use. Londres, Inglaterra, jun. 2006. 157 ERNST, E. The efficacy of herbal medicine – an overview. Fundamental & Clinical Pharmacology, v. 19, p. 405-409, 2005. ESCOBAR-CHÁVEZ, J. J.; DÍAZ-TORRES, R.; RODRÍGUEZ-CRUZ, I. M.; DOMÍNGUEZDELGADO, C. L.; MORALES, R. S.; ÁNGELES-ANGUIANO, E.; MELGOZA-CONTRERAS, L. M. Nanocarriers for transdermal drug delivery. Research and Report in Transdermal Drug Delivery, p. 3-17, nov. 2012. FARIAS, M. R. Avaliação da qualidade de matérias-primas vegetais. IN: SIMÕES, C. M.; SCHENKEL, E. P.; GOSMANN, G.; MELLO, J. C.; MENTZ, L. A.; PETROVICK, P. R. Farmacognosia da planta ao medicamento. Porto Alegre/Florianópolis: Editora da UFRGS, 2004. p. 263-288. FASOLO, D. Nanoemulsões contendo quercetina e 3-o-metilquercetina: estudos de formulação e permeação cutânea. 2007. 97 f. Dissertação (Mestrado) - Programa de PósGraduação em Ciências Farmacêuticas, Faculdade de Farmácia da Universidade Federal do Rio Grande do Sul, Porto Alegre, 2007. FDA. Department of Health and Human Services - Food and Drug Administration. Guidance for industry: SUPAC-SS nonsterile semisolid dosage forms: scale-up and post-approval changes: chemistry, manufacturing, and controls: in vitro release testing and in vivo bioequivalence documentation. Rockville, U.S., 1997. FELDMEYER, L.; WERNER, S.; FRENCH, L. E.; BEER, H. Interleukin-1, inflammasomes and the skin. European Journal of Cell Biology, v. 89, p. 638-644, 2010. FERNANDEZ, P.; ANDRÉ, V.; RIEGER, J.; KÜHNLE, A. Nano-emulsion formation by emulsion phase inversion. Colloids and Surfaces A: Physicochemistry Engineering Aspects, v. 251, p. 53-58, 2004. FERNÁNDEZ-CAMPOS, F.; NAVEROS, B. C.; SERRANO, O. L.; MERINO, C. A.; CAMPMANY, A. C. Evaluation of novel nystatin nanoemulsion for skin candidosis infections. Mycoses, v. 56, p. 70-81, 2013. FILIPPIN, F. B. Avaliação da atividade anticolinesterásica dos ácidos mirsinóicos a e b isolados da Rapanea ferruginea. 2010. 52 f. Monografia (Graduação) - Curso de Farmácia, Universidade do Vale do Itajaí, Itajaí, 2010. FILIPPO, K. D.; HENDERSON, R. B.; LASCHINGER, M.; HOGG, N. Neutrophil chemokines KC and macrophage-inflammatory protein-2 are newly synthesized by tissue macrophages using distinct TLR signaling pathways. The Journal of Immunology, v. 180, p. 4308-4315, 2008. FREITAS, M. F.; CARRIJO, T. T. A família myrsinaceae nos contrafortes do maciço da Tijuca e entorno do Jardim Botânico do Rio de Janeiro, Brasil. Rodriguésia, v. 59, n. 4, p. 813-828, 2008. FRONZA, L. M.; GIURADELLI, S. F. Estudos fitoquímicos adicionais com as cascas da Rapanea ferruginea. 2009. 53 f. Monografia (Graduação) - Curso de Farmácia, Universidade do Vale do Itajaí, Itajaí, 2009. FRYD, M. M. Time-dependent nanoemulsion droplet size reduction by evaporative ripening. The Journal of Physical Chemistry Letters, v.1, p. 3349-3353, 2010. 158 FUCHS, J.; ZOLLNER, T. M.; KAUFMANN, R.; PODDA, M. Redox-modulated pathways in inflammatory skin diseases. Free Radical Biology & Medicine, v. 30, n. 4, p. 337-353, 2001. GALINDO-ALVAREZ, J.; LE, K.; SADTLER, V.; MARCHAL, P.; PERRIN, P.; TRIBET, C.; MARIE, E.; DURAND, A. Enhanced stability of nanoemulsions using mixtures of non-ionic surfactant and amphiphilic polyelectrolyte. Colloids and Surfaces A: Physicochemical and Engineering Aspects, v. 389, p. 237-245, 2011. GALVAN, F. Avaliação da atividade anti-hiperalgésica do extrato bruto da Rapanea sp. (myrsinacea) e do ácido mirsinóico b sobre a neuropatia diabética. 2007. 39 f. Monografia (Graduação) - Curso de Farmácia, Universidade do Vale do Itajaí, Itajaí, 2007. GANTA, S.; AMIJI, M. Coadministration of paclitaxel and curcumin in nanoemulsion formulations to overcome multidrug resistance in tumor cells. Molecular Pharmaceutics, v. 6, n. 3, p. 938-939, 2009. GAZONI, V. F. Análise fitoquímica e avaliação do efeito anticolinesterásico do extrato e compostos isolados da Rapanea ferruginea. 2009. 84 f. Dissertação (Mestrado) - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2009. GILBERT, L.; PICARD, C.; SAVARY, G.; GRISEL, M. Rheological and textural characterization of cosmetic emulsions containing natural and synthetic polymers: relationships between both data. Colloids anda Surfaces A: Physicochemical and Engineering Aspects, v. 421, p. 150-163, 2013. GOMBAR, V. K.; ENSLEIN, K. Assessment of n-octanol/water partition coefficient: when is the assessment reliable? Journal of Chemical Information and Computer Sciences, v. 36, p. 1127-1134, 1996. GOUWYA, M.; SCHIRALDI, M.; STRUYF, S.; DAMME, J. V.; UGUCCIONIB, M. Possible mechanisms involved in chemokine synergy fine tuning the inflammatory response. Immunology Letters, v. 145, p. 10-14, 2012. GRÖNE, A. Keratinocytes and cytokines. Veterinary Immunology and Immunopathology, v. 88, p. 1-12, 2002. GUGLIELMINI, G. Nanostructured novel carrier for topical application. Dermatology, p. 341-346, 2008. Clinics in GUNASEKARAN, T.; HAILE, T.; NIGUSSE, T.; DHANARAJU, M. D. Nanotechnology: an effective tool for enhancing bioavailability and bioactivity of phytomedicine. Asian Pacific Journal of Tropical Biomedicine, v. 4, supl. 1, p. S1-S7, 2014. GUTIÉRREZ, J. M., GONZÁLEZ, C., MAESTRO, A., SOLÈ, I., PEY, C. M., & NOLLA, J. Nanoemulsions: new applications and optimization of their preparation. Current Opinion in Colloid & Interface Science, v. 13, 4, p. 245-251, ago. 2008. GUTTOFF, M.; SABERI, A. H.; MCCLEMENTS, D. J. Formation of vitamin d nanoemulsionbased delivery systems by spontaneous emulsification: factors affecting particle size and stability. Food Chemistry, v. 171, p. 117-122, 2015. HARDEN, G. J. Myrsinaceae. Flora of New South Wales, v.1, p. 501-504, 1990. 159 HARWANSH, R. K.; PATRA, K. C.; PARETA, S. K.; SINGH, J.; RAHMAN, M. A. Nanoemulsions as vehicles for transdermal delivery of glycyrrhizin. Brazilian Journal of Pharmaceutical Sciences, v. 47, n. 4, p. 769-778, out/dez. 2011. HATANAKA, J.; CHIKAMORI, H.; SATO, H.; UCHIDA, S.; DEBARI, K.; ONOUE, S.; YAMADA, S. Physicochemical and pharmacological characterization of alfa-tocopherol-loaded nanoemulsion system. International Journal of Pharmaceutics, v. 396, p. 188-193, 2010. HESS, S. Atividade antinociceptiva do ácido mirsinóico b. 2006. 107 f. Dissertação (Mestrado) - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2006. HESS, S.; PADOANI, C.; SCORTEGANHA, L. C.; HOLZMANN, I.; MALHEIROS, A.; YUNES, R. A.; MONACHE, F. D.; DE SOUZA, M. M. Assessment of mechanisms involved in antinociception caused by myrsinoic acid b. Biological and Pharmaceutical Bulletin, v. 33, n. 2, p. 209-215, fev. 2010. HIROTA, M.; MIYASAKI, S.; MINAKUCHI, T.; TAKAGI, T.; SHIBATA, H. (2002). Myrsinoic acids b, c and f, anti-inflammatory compounds from Myrsine seguinni. Bioscience, Biotechnology and Biochemistry, v. 66, n. 3, p. 655-659. HORINOUCHI, C. D.; MENDES, D. A.; SOLEY, B. S.; PIETROVSKI, E. F.; FACUNDO, V. A.; SANTOS, A. R. S.; CABRINI, D. A.; OTUKI, M. F. Combretum leprosum Mart. (Combretaceae): Potential as an antiproliferative and anti-inflammatory agent. Journal of Ethnopharmacology, v. 145, p. 311-319, 2013. ITO, S.; NARISE, A.; SHIMURA, S. Identification of a methioninase inhibitor, myrsinoic acid b, from Myrsine seguinii Lév., and its inhibitory activities. Bioscience, Biotechnology and Biochemistry, v. 72, n. 9, p. 2411-2414, 2008. ITO, S.; SHIMURA, S.; TANAKA, T.; YAEGAKI, K. Myrsinoic acid b inhibits the production of hydrogen sulfide by periodontal pathogens in vitro. Journal of Breath Research, v. 4, 2010. IZQUIERDO, P.; FENG, J.; ESQUENA, J.; TADROS, T. F.; DEDEREN, J. C.; GARCIA, M. J.; AZEMAR, N.; SOLANS, C. The influence of surfactant mixing ratio on nano-emulsion formation by the pit method. Journal of Colloid and Interface Science, v. 285, p. 388-394, 2005. JANUÁRIO, A. H.; FÁTIMAS DAS, M.; DA SILVA, G. F.; VIEIRA, P. C.; FERNANDES, J. B. Dammarane and cycloartane triterpenoids from three Rapanea species. Phytochemistry, v. 31, n. 4, p. 1251-1253, 1992. JOOSTEN, L. A.; NETEA, M. G.; DINARELLO, C. A. Interleukin-1B in innate inflammation, autophagy and immunity. Seminars in Immunology, v. 25, p. 416-424, 2013. KECK, C. M.; MÜLLER, R. H. Nanotoxicological classification system (NCS) – a guide for the risk-benefit assessment of nanoparticulate drug delivery systems. European Journal of Pharmaceutics and Biopharmaceutics, v. 84, p. 445-448, 2013. KELMANN, R. G.; KUMINEK, G.; TEIXEIRA, H. F.; KOESTER, L. S. Carbamazepine parenteral nanoemulsions prepared by spontaneous emulsification process. International Journal of Pharmaceutics, v. 342, p. 231-239, 2007. KESARWANI, K.; GUPTA, R. Bioavailability enhancers of herbal origin: an overview. Asian Pacific Journal of Tropical Biomedicine, v. 3, n. 4, p. 253-266, 2013. 160 KHURANA, S.; JAIN, N. K.; BEDI, P. M. Nanoemulsion based gel for transdermal delivery of meloxicam: physico-chemical, mechanist investigation. Life Sciences, v. 92, p. 383-392, 2013. KIMBER, I.; PICHOWSKI, J. S.; BASKETTER, D. A.; DEARMAN, R. J. Immune responses to contact allergens: novel approaches to hazard evaluation. Toxicology Letters, v. 106, p. 237246, 1999. KLANG, V.; MATSKO, N. B.; VALENTA, C.; HOFER, F. Electron microscopy of nanoemulsions: an essential tool for characyerisation and stability assessment. Micron, v. 43, p. 85-103, 2012. KLANG, V.; VALENTA, C.; MATSKO, N. B. Electron microscopy of pharmaceutical systems. Micron, v. 44, p. 45-74, 2013. KORINTH, G.; WELLNER, T.; SCHALLER, K. H.; DREXLER, H. Potential of the octanol-water partition coefficient (log P) to predict the dermal penetration behaviour of amphiphilic compounds in aqueous solutions. Toxicology Letters, v. 215, p. 49-53, 2012. LEE, D. Y.; CHOO, B. K.; YOON, T.; CHEON, M. S.; LEE, H. W.; LEE, A. Y.; KIM, H. K. Antiinflammatory effects of Asparagus cochinchinensis extract in acute and chronic cutaneous inflammation. Journal of Ethnopharmacology, v. 121, p. 28-34, 2009. LEITE, G. O.; LEITE, L. H.; SAMPAIO, R. S.; ARARUNA, M. K.; RODRIGUESA, F. F. G.; MENEZES, I. R. A.; DA COSTA, J. G. M.; CAMPOS, A. R. Modulation of topical inflammation and visceral nociception by Vanillosmopsis arborea essential oil in mice. Biomedicine & Preventive Nutrition, v.1, p. 216-222, 2011. LI, P.; GHOSH, A.; WAGNER, R. F.; KRILL, S.; JOSHI, Y. M.; SERAJUDDIN, A. T. Effect of combined use of nonionic surfactant on formation of oil-in-water microemulsions. International Journal of Pharmaceutics, v. 288, p. 27-34, 2005. LIANG, R.; XU, S.; SHOEMAKER, C. F.; LI, Y.; ZHONG, F.; HUANG, Q. Physical and antimicrobial properties of peppermint oil nanoemulsions. Journal of Agricultural and Food Chemistry, v. 60, p. 7548-7555, 2012. LORENZI, H. Árvores Brasileiras. Nova Odessa: Plantarum, 1992. LU, Y.; QI, J.; WU, W. Absorption, disposition and pharmacokinetics of nanoemulsions. Current Drug Metabolism, v. 13, p. 396-417, 2012. LUKIC, M.; JAKSIC, I.; KRSTONOSIC, V.; CEKIC, N.; SAVIC, S. A combined approach in characterization of an effective w/o hand cream: the influence of emollient on textural, sensorial and in vivo skin performance. International Journal of Cosmetic Science, v. 34, p. 140-149, 2012. MASON, T. G.; WILKING, J. N.; MELESON, K.; CHANG, C. B.; GRAVES, S. M. Nanoemulsions: formation, structure and physical properties. Journal of Physics: Condensed Matter, v. 18, p. 635-666, 2006. MATTOS, F. B. Análise do efeito hipoglicemiante do extrato bruto da planta Rapanea sp. sobre a glicemia de animais hiperglicêmicos. 2006. Trabalho de Conclusão de Curso (Graduação) - Curso de Farmácia, Universidade do Vale do Itajaí, Itajaí, 2006. 161 MCCLEMENTS, D. J. Nanoemulsions versus microemulsions: terminology, differences, and similarities. Soft Matter, v. 8, p. 1719-1729, 2012. MCCLEMENTS, D. J.; RAO, J. Food-grade nanoemulsions: formulation, fabrication, properties, performance, biological fate, and potential toxicity. Critical Reviews in Food Science and Nutrition, v. 51, n. 4, p. 285-330, 2011. MEOTTI, F. C.; SENTHILMOHAN, R.; HARWOOD, D. T.; MISSAU, F. C.; PIZZOLATTI, M. G.; KETTLE, A. J. Myricitrin as a substrate and inhibitor of myeloperoxidase: Implications for the pharmacological effects of flavonoids. Free Radical Biology & Medicine, v. 44, p. 109-120, 2008. MIHRANYAN, A.; FERRAZ, N.; STROMME, M. Current status and future prospects of nanotechnology in cosmetics. Progress in Materials Science, v. 57, p. 875-910, 2012. MIZUSHINA, Y.; MIYAZAKI, S.; OHTA, K.; HIROTA, M.; SAKAGUCHI, K. Novel antiinflammatory compounds from Myrsine seguinii, terpeno-benzoic acids, are inhibitors of mammalian dna polymerases. Biochimica et Biophysica Acta, v. 1475, p. 1-4, 2000. MORAIS, J. M.; BURGESS, D. J. In vitro release testing methods for vitamin E nanoemulsions. International Journal of Pharmaceutics, v. 475, p. 393-400, 2014. MORTIER, A.; DAMME, J. V.; PROOST, P. Overview of the mechanisms regulating chemokine activity and availability. Immunology Letters, v. 145, p. 2-9, 2012. MOU, D.; CHEN, H.; DU, D.; MAO, C.; WAN, J.; XU, H.; YANG, X. Hydrogel-thickened nanoemulsion system for topical delivery of lipophilic drugs. International Journal of Pharmaceutics, v. 353, p. 270-276, 2008. MÜLLER, A. F. F Desenvolvimento de sistemas nanoemulsionados contendo extrato de flores de Allamanda cathartica L. para aplicação cosmética. 2013. 138 f. Dissertação (Mestrado) - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2013. MÜLLER-GOYMANN, C. C. Physicochemical characterization of colloidal drug delivery systems such as reverse micelles, vesicles, liquid crystals and nanoparticles for topical administration. European Journal of Pharmaceutics and Biopharmaceutics, v. 58, p. 343356, 2004. MURAKAWA, M.; YAMAOKA, K.; TANAKA, Y.; FUKUDA, Y. Involvement of tumor necrosis factor (TNF)-a in phorbol ester 12-O-tetradecanoylphorbol-13-acetate (TPA)-induced skin edema in mice. Biochemical Pharmacology, v. 71, p. 1331-1336, 2006. NAM, Y. S.; KIM, J.; PARK, J.; SHIM, J.; LEE, J. S.; HAN, S. H. Tocopheryl acetate nanoemulsions stabilized with lipid–polymer hybrid emulsifiers for effective skin delivery. Colloids and Surfaces B: Biointerfaces, v. 94, p. 51-57, 2012. NOVAES, P. Alelopatia e bioprospecção de Rapanea ferruginea e de Rapanea umbellata. 2011. 112 f. Tese (Doutorado) - Programa de Pós-graduação de Ecologia e Recursos Naturais do Centro de Ciências Biológicas e da Saúde, Universidade Federal de São Carlos , São Carlos, 2011. 162 OECD. Guideline for the Testing of Chemicals. Test No. 428 Skin Absorption: in vitro Method. abr. 2004. Disponível em: <http://www.oecd-ilibrary.org/environment/oecdguidelines-for-the-testing-of-chemicals-section-4-health-effects_20745788>. Acesso em: 05 jul. 2013. OKUR, N. Ü.; APAYDIN, S.; YAVASOGLU, N. Ü.; YAVASOGLU, A.; KARASULU, H. Y. Evaluation of skin permeation and anti-inflammatory and analgesic effects of new naproxen microemulsion formulations. International Journal of Pharmaceutics, v. 416, p. 136-144, 2011. OLIVEIRA, B. D. Avaliação do efeito anti-inflamatório tópico da inosina no modelo de edema de orelha induzido pelo óleo de cróton em camundongos. 2009. 37 f. Projeto de Monografia, Universidade Federal do Paraná, Curitiba, 2009. OLIVEIRA, B. R. Desenvolvimento e avaliação de nanoemulsões com óleos de carapa guianensis e copaifera sp. e estudo da ação repelente frente frente a aedes aegypti. 2008. 108 f. Dissertação (Mestrado) - Programa de Pós-graduação em Ciências Farmacêuticas, Universidade de São Paulo, Faculdade de Ciências Farmacêuticas de Ribeirão Preto, 2008. OTUKI, M. F.; SCHWOB, O.; PRUDENTE, A. S.; ZALTSMAN, I.; MERETSKI, S.; SEGAL, J.; YEDGAR, S.; ROSENBLAT, G. Attenuation of experimental TPA-induced dermatitis by acetylenic acetogenins is associated with inibition of PLA2 activity. European Journal of Pharmacology, v. 15, n. 1-3, p. 175-179, 2011. OTUKI, M. F.; VIEIRA-LIMA, F.; MALHEIROS, A.; YUNES, R. A.; CALIXTO, J. B. Topical antiinflammatory effects of the ether extract from Protium kleinii and a-amyrin pentacyclic triterpene. European Journal of Pharmacology, v. 507, p. 253-259, 2005. PASCOTTO, M. C. Rapanea ferruginea (Ruiz & Pav.) Mez. (Myrsinaceae) como um importante fonte alimentar para as aves em uma mata de galeria no interior do estado de São Paulo. Revista Brasileira de Zoologia, v. 24, n. 3, p. 735-741, 2007. PASSOS, G. F.; MEDEIROS, R.; MARCON, R.; NASCIMENTOS, A. F.; CALIXTO, J. B.; PIANOWSKI, L. F. The role of PKC/ERK1/2 signaling in the anti-inflammatory effect of tetracyclic triterpene euphol on TPA-induced skin inflammation in mice. European Journal of Pharmacology, v. 698, p. 413-420, 2013. PATHAN, I. B.; SETTY, C. M. Enhancement of trandermal delivery of tamoxifen citrate using nanoemulsion vehicle. International Journal of Pharmaceutical Technology Research, v. 3, n. 1, p. 287-297, 2011. PATRICK, E.; BURKHALTER, A.; MAIBACH, H. I. Recent investigations of mechanisms of chemically induced skin irritation in laboratory mice. Mechanisms of Irritation, v. 88, n. 3, p. 24s-31s, 1987. PENG, L.; LIU, C.; KWAN, C.; HUANG, K. Optimization of water-in-oil nanoemulsions by mixed surfactants. Colloids and Surfaces A: Physicochemical Engineering Aspects, v. 370, p. 136-142, 2010. PINTO, M. R. Utilização de Materiais de Origem Vegetal em Produtos Farmacêuticos e Cosméticos de Aplicação Cutânea. 2013. 49 f. Dissertação (Mestrado) - Faculdade de Ciências e Tecnologias da Saúde, Universidade Lusófona de Humanidades e Tecnologias, Lisboa, 2013. 163 PIRES, P. A. Potencial analgésico, anti-edematogênico, antipirético e atividade ulcerogênica de fármacos anti-inflamatórios em roedores. 2009. 82 f. Dissertação (Mestrado) - Curso de Pós-Graduação em Medicina Veterinária, Universidade Federal Rural do Rio de Janeiro, Seropédica, 2009. PLESSIS, J. DU.; PUGH, W. J.; JUDEFEIND, A.; HADGRAFT, J. The effect of hydrogen bonding on diffusion across model membranes: consideration of the number of H-bonding groups. European Journal of Pharmaceutical Sciences, v. 13, p. 135-141, 2001. PLESSIS, J. DU.; PUGH, W. J.; JUDEFEIND, A.; HADGRAFT, J. Physico-chemical determinants of dermal drug delivery: effects of the number and substitution pattern of polar groups. European Journal of Pharmaceutical Sciences, v. 16, p. 107-112, 2002. QUINTÃO, F. J.; TAVARES, R. S.; VIEIRA-FILHO, S. A.; SOUZA, G. H.; SANTOS, O. D. Hydroalcoholic extracts of vellozia squamata: study of its nanoemulsions for pharmaceutical or cosmetic applications. Revista Brasileira de Farmacognosia, v. 23, n. 1, p. 101-107, jan/fev. 2013. RAUH, L. K. Avaliação da atividade atiinflamatória tópica da Vernonia scorpioides (Lam) Persons em modelos de inflamação cutânea em camundongos. 2008. 118 f. Dissertação (Mestrado) - Curso de Pós-graduação em Farmacologia, Universidade Federal do Paraná, Curitiba, 2008. REUTER, J.; MERFORT, I.; SCHEMPP, C. M. Botanicals in dermatology: an evidence-based review. American Journal of Clinical Dermatology, v. 11, n. 4, p. 247-267, 2010. SAKEENA, M. H.; YAM, M.; ELRASHID, S. M.; MUNNAVAR, A. S.; AZMIN, M. N. Antiinflammatory and analgesic effects of ketoprofen in palm oil esters nanoemulsion. Journal of Oleo Science, v. 59, 12, p. 667-671, 2010. SAKULKU, U.; NUCHUCHUA, O.; UAWONGYART, N.; PUTTIPIPATKHACHORN, S.; SOOTTITANTAWAT, A.; RUKTANONCHAI, U. Characterization and mosquito repellent activity of citronela oil nanoemulsion. International Journal of Pharmaceutics, v. 372, p. 105111, 2009. SANDIG, A. G.; CAMPMANY, A. C.; CAMPOS, F. F.; VILLENA, M. J.; NAVEROS, B. C. Transdermal delivery of imipramine and doxepine from newly oil-in-water nanoemulsions for an analgesic and anti-allodynic activity: development, characterization and in vivo avaluation. Colloids and Surfaces B: Biointerfaces, v. 103, p. 558-565, 2013. SARAF, A. S. Applications of novel drug delivery system for herbal formulations. Fitoterapia, v. 81, p. 680-689, 2010. SCHÄCKE, H.; DÖCKE, W.; ASADULLAH, K. Mechanisms involved in the side effects of glucocorticoids. Pharmacology & Therapeutics, v. 96, p. 23-43, 2002. SCHÄFER-KORTING, M.; MEHNERT, W.; KORTING, H. Lipid nanoparticles for improved topical application of drugs for skin diseases. Advanced Drug Delivery Reviews, v. 59, p. 427-443, 2007. SCHALBART, P.; KAWAJI, M.; FUMOTO, K. Formation of tetradecane nanoemulsion by lowenergy emulsification methods. International Journal of Refrigeration, v. 33, p. 1612-1624, 2010. 164 SCHÄTZEL, K. Correlation techniques in dynamic light scattering. Applied Physics B, v. 42, p. 193-213, 1987. SHAFIQ-UN-NABI, S.; SHAKEEL, F.; TALEGAONKAR, S.; ALI, J.; BABOOTA, S.; AHUJA, A.; KHAR, R. K.; ALI, M. Formulation development and optimization using nanoemulsion technique: a technical note. Journal of the American Association of Pharmaceutical Scientists, v. 8, n. 2, p. E1-E6, 2007. SHAKEEL, F.; RAMADAN, W. Transdermal delivery of anticancer drug caffeine from water-inoil nanoemulsions. Colloids and Surfaces B: Biointerfaces, v. 75, p. 356-362, 2010. SHAKEEL, F.; HAQ, N.; ALANAZI, F. K.; ALSARRA, I. A. Impact of various nonionic surfactants on self-nanoemulsification efficiency of two grades of capryol (capryol-90 and capryol-pgmc). Journal of Molecular Liquids, v. 182, p. 57-63, 2013. SHAKEEL, F.; RAMADAN, W.; FAISAL, M. S.; RIZWAN, M.; FAIYAZUDDIN, M.; MUSTAFA, G.; SHAFIQ, S. Transdermal and topical delivery of anti-inflammatory agents using nanoemulsion/microemulsion: an updated review. Current Nanoscience, v. 6, p. 184-198, 2010. SHERWOOD, E. R.; TOLIVER-KINSKY, T. Mechanisms of the inflammatory response. Best Practice & Research Clinical Anaesthesiology, v. 18, n. 3, p. 385-405, 2004. SILVA, B. S. Avaliação da composição química e atividade antimicrobiana de diferentes extratos e frações de Rapanea ferruginea. 2013. 64 f. Trabalho de Conclusão de Curso (Graduação) - Curso de Farmácia, Universidade do Vale do Itajaí, Itajaí, 2013. SOLANS, C.; SOLÈ, I. Nano-emulsions: formation by low-energy methods. Current Opinion in Colloid & Interface Science, v. 17, n. 5, p. 246-254, out. 2012. SOLANS, C.; IZQUIERDO, P.; NOLLA, J.; AZEMAR, N.; GARCIA-CELMA, M. J. Nanoemulsions. Current Opinion in Colloid & Interface Science, v. 10, n. 3-4, p. 102-110, out. 2005. SONNEVILLE-AUBRUN, O.; SIMONNET, J. T.; L'ALLORET, F. Nanoemulsions: a new vehicle for skincare products. Advances in Colloid and Interface Science, v. 108-109, p. 145-149, 2004. SOSA, S.; BALICK, M. J.; ARVIGO, R.; ESPOSITO, R. G.; PIZZA, C.; ALTINIER, G.; TUBARO, A. Screening of the topical anti-inflammatory activity of some Central American plants. Journal of Ethnopharmacology, v. 81, p. 211-215, 2002. STROHER, A.; ARMIJO, C. J.; RAFFIN, R. Nanocosméticos: Conceitos, vantagens e aplicações. Cosmetics & Toiletries Brasil, v. 22, n. 5, p. 54-60, set/out. 2010. SUBRAMANIAN, B.; KUO, F.; ADA, E.; KOTYLA, T.; WILSON, T.; YOGANATHAN, S.; NICOLOSI, R. Enhancement of anti-inflammatory property of aspirin in mice by a nanoemulsion preparation. International Immunopharmacology, v. 8, p. 1533 - 1539, 2008. SUGUMAR, S.; GHOSH, V.; NIRMALA, M. J.; MUKHERJEE, A.; CHANDRASEKARAN, N. Ultrasonic emulsification of eucalyptus oil nanoemulsion: antibacterial activity against Staphylococcus aureus and wound healing activity in wistar rats. Ultrasonics Sonochemistry, v. 21, p. 1044-1049, 2014. 165 TADROS, T. Application of rheology for assessment and prediction of the long-term physical stability of emulsions. Advances in Colloid and Interface Science, v. 108-109, p. 227-258, 2004. TADROS, T. F. Fundamental principles of emulsion rheology and their applications. Colloids and Surfaces: Physicochemical and Engineering Aspects, v. 91, p. 39-55, 1994. TADROS, T.; IZQUIERDO, P.; ESQUENA, J.; SOLANS, C. Formation and stability of nanoemulsions. Advances in Colloid and Interface Science, v. 108-109, p. 303-318, mai. 2004. TESTONI, B. L. Obtenção de ésteres derivados do ácido benzoico prenilado 5-carboxi7-(3",3"-dimetialil)-2-(1'-hidroxi-1',5'-dimetilex-4'-enil)2,3-diidrobenzenofurano isolado de Rapanea sp. - Avaliação do potencial antinociceptivo e antitumoral do ácido. 2004. 47 f. Trabalho de Conclusão de Curso (Graduação) - Curso de Farmácia, Universidade do Vale do Itajaí, Itajaí. THAKUR, N.; GARG, G.; SHARMA, P. K.; KUMAR, N. Nanoemulsions: a review on various pharmaceutical application. Global Journal of Pharmacology, v. 6, n. 3, p. 222-225, 2012. TOMIO, T. A. Atividade citotóxica e antitumoral dos extratos e compostos isolados de Rapanea ferruginea e Piper aduncum. 2011. 171 f. Dissertação (Mestrado) - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2011. TURMINA, M. Estudo fitoquímico com as cascas da Rapanea sp. 2005. 35 f.Trabalho de Conclusão de Curso (Graduação) - Curso de Farmácia, Universidade do Vale do Itajaí, Itajaí. 2005. UNITED STATES PHARMACOPEIA, U. S. Biological Tests, In Vitro. 2007. VEEN, B. S.; WINTHER, M. P.; HEERINGA, P. Myeloperoxidase: molecular mechanisms of action and their relevance to human health and disease. Antioxidants & Redox Signaling, v. 11, n. 11, p. 2899-2937, 2009. VEIGA JUNIOR, V. F.; PINTO, A. C.; MACIEL, M. A. M. Plantas medicinais: cura segura? Química Nova, v. 28, n. 3, p. 519-528, 2005. WANG, X.; JIANG, Y.; WANG, Y.; HUANG, M.; HO, C.; HUANG, Q. Enhancing antiinflammation activity of curcumin trough O/W nanoemulsions. Food Chemistry, v. 108, p. 419424, 2008. WOOSTER, T. J.; GOLDING, M.; SANGUANSRI, P. Impact of oil type on nanoemulsion formation and ostwald ripening stability. Langmuir, v. 24, p. 12758-12765, 2008. YILMAZ, E.; BORCHERT, H. Effect of lipid-containing, positively charged nanoemulsions on skin hydration, elasticity and erythema—an in vivo study. International Journal of Pharmaceutics, v. 307, p. 232-238, 2006. ZERMIANI, T. Ácidos mirsinoicos a e b: caracterização físico-química e validação de metodologias por cromatografia líquida de alta eficiência (clae) para quantificação em nanoemulsões. 2015. 169 f. Dissertação de Mestrado - Programa de Mestrado Acadêmico em Ciências Farmacêuticas, Universidade do Vale do Itajaí, Itajaí, 2015. 166 ZERMIANI, T.; MALHEIROS, A.; SILVA, R. M.; COUTO, A. G.; DAL MAS, J.; XAVIER, B.; BRESOLIN, T. M. Validação de metodologia por cromatografia líquida de alta eficiência (CLAE) para quantificação dos ácidos mirsinoicos a e b em extratos de Rapanea ferruginea. Apresentação de pôster CISDEM - Cátedra Iberoamericana-suiza de desarrollo de medicamentos. Itajaí, SC. 2014. ZHANG, X. W.; WANG, Y. W.; LIU, Q.; THORLACIUS, H. Redundant function of macrophage inflammatory protein-2 and KC in tumor necrosis factor-a-induced extravasation of neutrophils in vivo. European Journal of Pharmacology, v. 427, p. 277-283, 2001. ZHOU, H.; YUE, Y.; LIU, G.; LI, Y.; ZHANG, J.; GONG, G.; YAN, Z.; DUAN, M. Preparation and characterization of a lecithin nanoemulsion as a topical delivery system. Nanoscale Research Letter, p. 224-230, 2010. 167 ANEXO A – Parecer Comissão de Ética no Uso de Animais – CEUAUNIVALI
Download