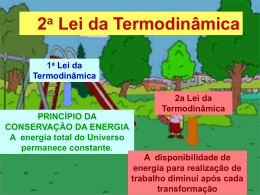
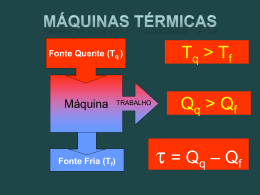
Resoluções de Exercícios EA – EXERCÍCIOS DE APRENDIZAGEM EH – EXERCITANDO HABILIDADES TC – TAREFA DE CASA FÍSICA II 02 B Capítulo O CALOR E OS FENÔMENOS TÉRMICOS 06 Termodinâmica O uso intensivo do carvão mineral, substituído pelo petróleo no início do século XX, inaugurou a era dos combustíveis fósseis, com consequências extremamente danosas para o meio ambiente, tais como a chuva ácida e a aceleração do efeito estufa. EH ă BLOCO EA ă BLOCO 01 01 C Na compressão (V<0) e sendo isotérmica, a temperatura se mantém. Como d = m / V, a redução de volume acarreta um aumento na densidade. 02 E Sendo uma compressão (V<0) há trabalho negativo (W < 0). Se o processo é isotérmico, U = 0. 03 E = Área. = P . V = (10 – 5) . (5 . 105) = 25 . 105 J EA ă BLOCO 02 01 D O trabalho obtido será máximo se a máquina operar em ciclos de Carnot. Deste modo seu rendimento seria: T 300 x x = h = 1– 2 = & 1– T1 Q1 500 1.000 x = 400 cal. 02 h = x 200 – 120 = 200 Q1 h = 40%. Por conservação da energia: Q2 = 4.000 – 800 = 3.200J Se operar com rendimento máximo (Carnot): T2 Q = 2 T1 Q1 300 3.200 = 4.000 T1 T1 = 375k 03 01 B Pois seu enunciado corresponde à lei zero da termodinâmica. 02 C A máquina térmica ideal já pressupõe a realização de trabalho sem aumento de entropia. Uma máquina hipotética com rendimento superior implicaria em redução da entropia geral, o que é proibido pela segunda lei da termodinâmica. EH ă BLOCO 01 01 A Para conter o avanço do efeito estufa é necessário reduzir o lançamento de CO2 na atmosfera. 12 01 A Na combustão, a energia de combustão (química) é convertida em calor, e no cilindro do automóvel, o calor é convertido em energia cinética, que é transmitida às rodas do automóvel através de um conjunto de peças que constitui o sistema de transmissão. EH ă BLOCO 03 01 C Com o radiador de calor ventilado, a transferência de calor para o ambiente se dá mais facilmente. TC ă BLOCO 01 01 B No processo 1 2 o gás se expande (V cresce) mas sua temperatura permanece constante (transformação isotérmica), assim, sua energia interna permanece constante. Expansão W > 0 e Isotérmica U = 0. U = Q – W Q = U + W Q > 0 (o gás recebe calor) 02 C W = área = b . h = 2 . 10–3 . 2 . 104 = 40 J T = 1/f = 1/10 = 0,1 s P = W / T = 40/0,1 = 400 W = 0,4 kW 03 C 03 A EA ă BLOCO 02 Ciências da Natureza e suas Tecnologias FÍSICA – Volume 02 AP 2013 FIS II V2 RESOLUÇÃO.indd 12 Transformação A B Isobárica, logo, V é proporcional a T. Assim, VB > VA TB > TA. Logo, se a temperatura aumentou a energia interna também aumentou. Transformação B C Isovolumétrica, logo, W = 0. Isovolumétrica, logo, p é proporcional a T. Assim, pB > pC TB > TA. Consequentemente, se a temperatura diminuiu a energia interna também diminuiu. Transformação C A pCVc/Tc = pAVA/TA 1,5 . 1.2 / TC = 1,2 . 1,5 / TA TA = TC 04 A O processo AB tem acréscimo de temperatura (U > 0) e > 0 pois o volume aumentou, o que só é possível com fornecimento de calor. Já o processo BC começou e terminou com a mesma temperatura, pois PBVB = PCVC, então, em BC não há variação de energia interna. 05 A A temperatura de A para B , segundo o gráfico, acontece de modo que a curva p x T é uma reta, ou seja: p = a T , onde a é uma constante. Como este gás é ideal, temos: pV = nRT p = (nR/V) . T a = nR/V Assim, se a é constante, V também é constante. Se V é constante, temos W = 0. De acordo com o gráfico, sabemos que TB > TA U > 0. Assim, de acordo com a Primeira Lei da Termodinâmica, temos: U = Q – W Q = U + W, logo Q > 0. FÍSICA II 26/03/2013 18:38:23 06 D Como a curva b é uma hipérbole equilátera, ela representa uma isotérmica, logo as temperaturas dos pontos i e f são iguais, o que significa que nos trechos a, b e c não há variação da energia interna (U = 0). U = Q – W Q = W + U Q = W, logo, Q será máximo no trecho de trabalho (área) máximo (trajetória a). TC ă BLOCO 02 01 D = W/Q1 0,6 = 3 . 104 / Q1 Q1 = 5 . 104 J Q2 = 2 . 104 J U = 0, pois a transformação é cíclica. 02 B 07 E p constante transformação isobárica. W = p . V = 300 . 0,4 = 120 J U – Q – W = 100 cal – 120 J = 400J – 120 J = 280 J = 70 cal. Isobárica V1/T1 = V2/T2 0,2/300 = 0,6/T2 T2 = 900 K = 627oC. A velocidade média das moléculas variou, pois a temperatura do gás variou. 08 D Ao soprar, o ar comprimido na boca é rapidamente expelido, sofrendo expansão brusca logo que sai da boca, não tendo tempo de trocar calor com o meio. Trata-se de uma expansão adiabática onde, devido à expansão sem recebimento de calor, a temperatura cai, ou seja, o gás realiza trabalho às custas de sua energia interna que, naturalmente, irá diminuir. 09 A A energia total gerada será: E = 3,6 . 107 x 2,5 = 9 . 107 J Rendimento: = 1, 8 .107 = 0,2 = 20% 9 .107 03 C Para o intervalo de 1 segundo, a quantidade de calor liberada pela queima do combustível (Q) pode ser dada por: Q = m . C = 4 g x 11.100 cal/g = 44.400 cal = 44.400 x 4 J = 177.600 J f = 3.300 rpm = 3.300/60 Hz = 55 Hz T = 1/f = 1/55 s Podemos então fazer a seguinte proporção: Intervalo de tempo x quantidade de calor liberada 1s 177.600 J 1/55 s Q Assim, temos: Q = 177.600 x 1/55 J 3.229,1 J U = Q – U = – 42 – 60 U = – 102 J Como a pressão média é de 8 atm, podemos calcular o trabalho realizado pelo pistão por: W = p .V = 8 atm x 1 L = 8 . 105 x 1 . 10–3 = 800 J 10 A A água ao evaporar, rouba calor da pele resfriando-a. 11 A Um segmento de reta crescente, alinhado com a origem, indica uma proporcionalidade direta entre V e T, ou seja a razão V/T é constante. o que ocorre quando a transformação é isobárica. O aumento da temperatura indica o aumento da energia interna do sistema. 12 D = 0 na transformação isométrica pois V = 0. 13 C Se T = 0 U = 0 14 A Na compressão isobárica, o volume diminui e a pressão se mantém, com isso, o produto PV diminui. Como PV = nRT, a temperatura também diminuirá, indicando uma redução na energia interna do sistema. Finalmente, para um ciclo, podemos calcular o rendimento () por: = W/Q1 = 800/3229,1 0,248 25% 04 C Pela Lei Geral dos Gases, a temperatura (e a energia interna) será maior onde o produto PV for maior: PV PV 1 1 = 2 2 T1 T2 No processo BC, PB = PC, mas VB < VC, logo PBVB < PCVC e TB < TC No processo DA, VD = VA, mas PA < PD, logo PAVA < PDVD e TA < TD Nos processos adiabáticos, como não há troca de calor, quando o trabalho é positivo a energia interna cai (temperatura cai) e quando o trabalho é negativo a energia interna aumenta (temperatura sobe), assim: AB – compressão – trabalho negativo – energia interna sobe – temperatura sobe: TA < TB CD – expansão – trabalho positivo – energia interna cai – temperatura cai: TC > TD 05 B 15 D W = p . V = 50 . 5 . 10–3 = 2,5 . 10–1 J 16 A O trabalho pode ser calculado pelas áreas sob as curvas: AC = (5 .102 + 2 .102) . 2 = 700 J 2 06 E = 2 . 2 . 102 = 400 J ABC 17 A Como num ciclo de U = 0 Q = pela área interna do ciclo. | | e o trabalho pode ser calculado b . h 0, 5 . 500 = = 125 J 2 2 18 E I. (V) Pois pV = nRT e se V diminui, p deve aumentar para manter a igualdade. II. (F) Sendo pV = nRT, com p constante, se V aumenta, T deve aumentar para manter a igualdade. III. (V) Sendo U = Q – W, com Q = 0 (adiabática) e W < 0 (compressão), teremos U > 0 e, consequentemente, T > 0. FÍSICA II AP 2013 FIS II V2 RESOLUÇÃO.indd 13 No tempo 2, ocorre a compressão (com as válvulas fechadas), o êmbolo sobe, movido pelo virabrequim, comprimindo a mistura do ar com o combustível rapidamente – observe que como a compressão é muito rápida, não ocorre trocas de calor com o meio, portanto o processo é adiabático. De acordo com a 2a Lei da Termodinâmica, nenhuma máquina térmica, operando em ciclos, consegue transformar integralmente calor em trabalho. Portanto o rendimento nunca pode chegar a 100%, sendo, no máximo, igual ao da máquina de Carnot. De fato, analisando o gráfico, vemos que o rendimento seria igual a 100% quando T2/T1 = 0 T2 = 0 K, o que é um absurdo. Logo, o rendimento de uma máquina térmica será sempre menor que 100%. 07 C Em AB, U > 0, pois é compressão ( < 0) sem troca de calor. Em BC, U > 0, pois T > 0 (PBVB < PCVC). Em CD, U < 0, pois é uma expansão ( > 0) sem troca de calor. Em DA, U < 0, pois T (PDVD < PAVA). No ciclo todo, U = 0. 08 A = Eútil / Erecebida = 1,2 / 71 = 0,2 = 20%, logo o desperdício é igual a 80% da energia (calor) recebida. Ciências da Natureza e suas Tecnologias FÍSICA – Volume 02 13 26/03/2013 18:38:27 09 D A figura mostra o esquema de uma térmica: A máquina recebe calor da fonte quente, executa trabalho e rejeita calor para a fonte fria. O rendimento da máquina é: h = Qq – Qf W = Qq Qq Atuando em um ciclo de Carnot a expressão do Tq – Tf . rendimento é: h = Tq Igualando as equações, vem: Transformação B C Adiabática (Q = 0) e Expansão (W > 0) U = Q – W U < 0 Transformação C D Isoterma (U = 0) e Compressão (W < 0) Q = U + W Q < 0 (o gás fornece calor) TC ă BLOCO 01 B w = 1600 cal Qq – Qf Tq – Tf 2.400 – Qf 400 – 300 = = " Qq Tq 2.400 400 2.400 – Qf = 2.400 " Qf = 2.400 – 600 = 1.800J 4 10 A Na combustão são gerados gases que, ao expandir, impulsionam os pistões do motor realizando trabalho mecânico. 11 C Quando o enunciado diz “não há tempo para a troca de calor entre o gás e o meio exterior” fica caracterizada uma transformação adiabática. Sendo uma expansão, há um trabalho realizado para o qual não foi dada a energia equivalente, portanto esta só pode ter saído da energia interna do gás que, por isso, diminui, diminuindo a temperatura junto. 12 D O refrigerador é antinatural. Ele força o fluxo de calor do ponto de menor para o de maior temperatura. 13 E Nos processos adiabáticos, como não há troca de calor, quando o trabalho é positivo a energia interna cai (temperatura cai) e quando o trabalho é negativo a energia interna aumenta (temperatura sobe), assim: expansão – trabalho positivo – energia interna cai – temperatura cai 14 D Como o volume de café não varia o mesmo ocorrerá com o volume de ar dentro da garrafa. O processo será isocórico e esta forma P/T = constante para um volume constante. 15 D O ciclo Carnot é um ciclo teórico que expressa o valor máximo que o rendimento da máquina térmica poderia oferecer. Assim, sob mesmas condições, uma máquina térmica qualquer terá rendimento inferior ao obtido pelo ciclo de Carnot, ou seja, < 50%. 16 D A) (F) O ciclo de Carnot é um ciclo teórico que dá o máximo rendimento que uma máquina térmica poderia oferecer. B) (F) Estas grandezas se relacionam pela fórmula P = F.v. C) (F) O calor de combustão é obtido pela queima do combustível, a faísca é necessária apenas para iniciar a combustão. D) (V) O petróleo é obtido a partir da decomposição de matéria orgânica ao longo de milhões de anos. 17 A Antes de tudo é necessário esclarecermos que estas informações (1.0, 1.6, 1.8 e 2.0) dizem respeito ao volume interno do curso de todos os cilíndros, expresso em litros. Assim, dizermos que um carro popular tem motor 1.0 significa dizer que, em cada um dos 4 cilíndros, a variação de volume do gás durante a expansão, após a combustão, é de 0,25 litro. Como o trabalho está associado à expansão do gás, cilíndros maiores permitem potências maiores. Lembre que nada é de graça, se a potência é maior, o consumo também é. 18 B Transformação A B Isoterma (U = 0) e Expansão (W > 0) Q = U + W Q > 0 (o gás recebe calor) 14 Ciências da Natureza e suas Tecnologias FÍSICA – Volume 02 AP 2013 FIS II V2 RESOLUÇÃO.indd 14 03 Q2 Sistema Q1 = 2400 cal = Q2/W = (2400 – 1600)/1600 = 0,50 02 B O ciclo anti-horário representa uma máquina refrigeradora (recebe trabalho) e a área dentro do ciclo é numericamente igual ao trabalho recebido. 03 D Ao condensar sobre a placa, a água passa da forma mais dispersa e desorganizada (vapor) para uma forma mais condensada e organizada (líquida), com a equivalente perda de calor latente, o que faz sua entropia reduzir-se. Atente para o fato de que ao receber este calor, a placa de vidro tem a sua entropia aumentada, compensando a redução de entropia do vapor e não deixando que a entropia total se reduza (o que não poderia ocorrer num processo espontâneo). 04 C I. Verdadeiro – em processos irreversíveis, a entropia aumenta. II. Falso – Considerando a entropia do gás como uma função de estado, como o estado inicial do gás é igual ao final, a sua entropia também é igual. III. Falso – Numa expansão adiabática, há trabalho positivo sem o recebimento de calor, portanto a energia interna diminui. IV. Verdadeiro – energia interna é função de estado. Como o estado inicial é igual ao final, a energia interna também o é. 05 E I. Falso – a energia interna é a soma das energias de todas as partículas, portanto depende do número total delas. II. Verdadeiro III. Falso – numa transformação adiabática o volume, a pressão e a temperatura são alteradas. IV. Verdadeiro 06 C De acordo com o conceito de entropia, máquina nenhuma converte integralmente calor em trabalho. 07 C O ar recebe calor do radiador, o que aumenta a sua entropia. 08 B O calor flui de maneira forçada do interior da geladeira (parte mais fria) para a parte externa (parte mais quente). 09 E A máquina térmica não pode ter rendimento igual a 100% porque isto viola o princípio da entropia. 10 A Esquema geral: W Q1 sistema Q2 Onde: Q1 é o calor recebido W é o trabalho realizado Q2 é o calor desperdiçado (rejeitado para a fonte fria) FÍSICA II 26/03/2013 18:38:27 11 C Nos processos espontâneos a entropia total aumenta. 12 A Esse sistema nunca entraria em equilíbrio térmico pois um lado sempre teria moléculas com alta energia cinética (temperatura alta) e o outro com moléculas de baixa energia cinética (temperatura baixa). 13 D Em um sistema de refrigeração, como uma geladeira ou ar-condicionado, o trabalho é recebido para que o calor oriundo da fonte fria seja transferido para a fonte quente. 14 E Na situação inicial temos: T T I. n1 = 0, 3 = 1– 2 & 2 = 0, 7. T1 T1 Na nova situação: T 1 T n2 = 1– 2 = 1– e 2 o 2T1 2 T1 1 n2 = 1– (0, 7) = 0, 65 = 65% 2 15 B Os processos adiabático e isotérmico não são lineares e logo eliminamos as opções I, II e V. Os processos adiabáticos tem trabalho associado inferior ao dos processos isotérmicos e desta forma os diagramas IV e III são os que melhores atendem, nesta ordem, o solicitado. 16 D I. (V) Transfere calor da fonte quente para a fonte fria. II. (V) A fase de evaporação é quando o gás recebe calor e de condensação, quando ele cede. III. (F) Quanto maior o calor latente de vaporização do líquido refrigerante, menor é o trabalho realizado pelo refrigerador. IV. (V) A máquina refrigeradora recebe trabalho (energia) e com isso retira calor da fonte fria e o transfere para a fonte quente. 17 E I. (V) O rendimento máximo possível é o da máquina que opera no ciclo de Carnot, que ainda assim é inferior a 100%. II. (V) Esta passagem é forçada, pois o calor tende a passar espontaneamente no sentido inverso. III. (V) De acordo com o conceito de calor. 18 E Observe que a ordem do sistema na figura 3 é maior que a da figura 1, logo, a entropia do sistema diminui. 19 D O trabalho realizado em um ciclo num diagrama de pressão e volume é numericamente igual à área dentro do ciclo. A área será determinada pela diferença entre as áreas sob as linhas até o eixo de volume. A área maior dada pela linha superior é um trapézio e um retângulo: 3 Área do trapézio: (2 + 4) . =9J 2 Área do retângulo: 2 . 3 = 6 J Área maior: 9 + 6 = 15 J A área menor dada pela linha inferior é um trapézio e um retângulo: 3 =6J Área do trapézio: (1 + 3) . 2 Área do retângulo: 1 . 3 = 3 J Área maior: 6 + 3 = 9 J O trabalho no ciclo então é 15 – 9 = 6 J 20 C Como os estados inicial e final são comuns aos três processos, a variação de energia interna é a mesma em todos. Se, de acordo com a 1ª lei, U = Q – W, temos que Q = U + W de tal modo que o processo de maior trabalho será também o que trocou o maior calor. Lembrando que o trabalho pode ser obtido pela área sob o gráfico da transformação teremos W1 > W2 > W3 e consequentemente Q1 > Q2 > Q3. FÍSICA II AP 2013 FIS II V2 RESOLUÇÃO.indd 15 TC ă BLOCO 04 01 A) Os gráficos I a IV mostram temperaturas variáveis. O gráfico VI mos- tra uma curva onde o produto P x V é igual em todos os pontos, portanto só este último mostra uma transformação isotérmica. B) Os gráfico I, II, V e VI mostram pressões variáveis. O gráfico III mostra uma reta crescente onde a razão V/T é constante, logo só este último mostra uma transformação isobárica. C) Os gráficos III a VI mostram volumes variáveis enquanto o gráfico I mostra uma reta crescente onde a razão P/T é fixa, logo este último mostra uma transformação isométrica. 02 A U = (3/2)nRT. Se o processo é isotérmico (T=0), temos U=0. 03 D Sendo U=0 e U=Q – W teremos Q = W = 200J. 04 A Em ambos os processos a temperatura duplicou, logo a energia cinética média das moléculas também duplicou, visto que as duas grandezas são diretamente proporcionais. 05 C Nas etapas AB e CD, o trabalho é nulo, pois não há variação de volume. Na etapa BC, o trabalho é positivo, pois a variação de volume é positiva (expansão) enquanto na etapa DA o trabalho é negativo, pois a variação de volume é negativa (compressão). 06 D Durante o processo de combustão biológico a energia dos alimentos é liberada de forma gradual. Os organismos autótrofos conseguem transformar a energia luminosa em energia química que fica armazenada no ATP. Em todo sistema físico isolado vale o princípio da conservação da energia. No caso da primeira lei da termodinâmica: Q = U + W O calor trocado (Q) pelo sistema igual à variação da energia interna desse sistema (U) somada ao trabalho realizado (W) pelas forças por ele aplicadas. 07 D A) Incorreta. Pela convenção de sinais da 1a lei da termodinâmica, quando se realiza trabalho (W) sobre o gás, esse trabalho é negativo (W = –400 J). B) Incorreta. A temperatura é constante, portanto, a transformação é isotérmica. C) Incorreta. A energia interna é função exclusiva da temperatura. Se a transformação é isotérmica a energia interna é constante (U = 0). D) Correta. Da 1a lei da termodinâmica: Como o sinal do calor é negativo, de acordo com a convenção de sinais, o gás cedeu calor à vizinhança. E) Incorreta. De acordo com o exposto na afirmativa anterior: Q = – 400 J. 08 C Dados: Q = 0 (adiabática); Da primeira lei da termodinâmica: U = Q – W U = Q – W Tendo sido uma expansão, W > 0 o que implica em U < 0. 09 A A) Correta. Devido à pressão, o gás exerce força sobre o êmbolo, empurrando o pistão, realizando trabalho positivo. B) Incorreta. Transformação adiabática é aquela em que o gás não troca calor com a vizinhança. C) Incorreta. A energia interna de um gás ideal depende exclusivamente da sua temperatura absoluta. Portanto, somente não ocorre variação da energia interna, quando a transformação é isotérmica. D) Incorreta. Na compressão o gás recebe trabalho de um agente externo. E) Incorreta. Se a transformação é isovolumétrica, não ocorre deslocamento do pistão, não havendo realização de trabalho. Ciências da Natureza e suas Tecnologias FÍSICA – Volume 02 15 26/03/2013 18:38:27 10 D Da equação de Clapeyron: pV pV=nRT & T= . nR 02 C Torre de Transmissão Gerador Essa expressão nos mostra que a temperatura é diretamente proporcional ao produto pressão x volume. O gráfico nos mostra que o mínimo valor desse produto é no final da transformação III, portanto, esse é o ponto em que a temperatura atinge o menor valor. Água 11 D 3 1 kT = mv2 2 2 Ao duplicar a velocidade do lado direito da equação, a temperatura quadruplica. Agora, se analisarmos pela equação de Clapeyron, PV = nRT, o aumento da temperatura provocará um aumento proporcional na pressão. Turbina Ec = A geração de energia elétrica numa hidrelétrica segue a seguinte ordem: Energia potencial da água energia cinética da água energia cinética da turbina energia elétrica no gerador. 12 C O gráfico V x T em reta crescente indica proporcionalidade direta entre V e T, o que ocorre quando o processo é isobárico. Com a pressão constante, pode-se escrever: W = P . V = nR . T Substituindo os valores na expressão do lado direito: W = 1. 8,31. (620-310) W = 2.573 J Capítulo O CALOR E OS FENÔMENOS TÉRMICOS 07 Energia Elétrica via Calor EH ă BLOCO 01 D O magma que circula no subsolo aquece as massas de água subterrâneas, cuja energia térmica é utilizada na geração de energia elétrica. 02 E O calor liberado pelos sais fundos é utilizado para aquecer a água da caldeira, transformando-a em vapor e posteriormente acionar o gerador, ou seja, os sais fundidos funcionam com se fossem uma bateria térmica. EH ă BLOCO EA ă BLOCO 04 01 D Uma possibilidade para um resfriamento natural da água antes de sua reinserção no rio, seria um resfriador em forma de cascata, de tal sorte que o contato com o ar durante a queda permitisse o resfriamento e a reoxigenação da água. Quanto mais próximo à linha do equador (menores latitudes) maior e mais regular é a insolação anual, possibilitando um maior aproveitamento da energia solar. 05 01 B As centrais nucleares em uso atualmente obtém sua energia da fissão (quebra) de átomos de Urânio enriquecido em reações controladas. Embora se use o termo “combustível nuclear”, o que ocorre não é a reação do urânio com o oxigênio (combustão) e sim sucessivas fissões de átomos por nêutrons de alta velocidade, liberando o calor que gera o vapor d’água a alta pressão para movimentar as turbinas acopladas aos geradores de eletricidade. 02 B A água usada no resfriamento da usina, se entregue ainda quente ao ambiente aquático, pode alterar a temperatura média da água naquele ponto, alterando a quantidade de gases dissolvidos na água e o seu pH, interferindo assim, nas condições de sobrevivência das espécies que ali habitam. EA ă BLOCO 06 01 D Dados: P = 12.000 MW = 12 106 kW; t = 2 h; E1 = 400 kWh. A energia gerada em 2 horas é: E = P t = 12 106 2 = 24 106 kWh. A quantidade, N, de casas abastecidas é: E 24 # 106 = N= N = 60 103. E1 400 16 05 01 D Estas massas de água são usadas para condensar o vapor d’água para que a água obtida a partir da condensação possa ser reutilizada no processo de geração de energia elétrica. TC ă BLOCO 05 01 A 02 A EA ă BLOCO 04 Ciências da Natureza e suas Tecnologias FÍSICA – Volume 02 AP 2013 FIS II V2 RESOLUÇÃO.indd 16 Pela ordem, a água contida na caldeira é aquecida, se transformando em vapor, em seguida este vapor aciona a turbina. Finalmente o vapor se transforma de volta em água no condensador e a bomba d’água faz a água retornar à caldeira, para dar início a um novo ciclo. 02 B Cada etapa do processo implica numa perda de energia, pois nenhuma delas é ideal, ou seja, nenhuma delas consegue transformar 100% da energia (uma parte sempre é perdida, normalmente sob a forma de calor). Portanto, a cada etapa a energia útil diminui. 03 C Ambas utilizam água quente, em forma de vapor, para a geração de eletricidade. A diferença é que a usina termelétrica utiliza a combustão para a geração de calor, enquanto a usina geotérmica utiliza a energia térmica de águas subterrâneas, que são aquecidas pelo magma. Enquanto as termelétricas emitem gases causadores do efeito estufa, as geotérmicas não emitem, porém emitem o ácido sulfídrico que é nocivo à saúde humana. 04 A Trata-se de uma usina geotérmica, que utiliza o calor liberado pelo magma para aquecer uma massa de água e transformá-la em vapor, para então acionar a turbina da usina. 05 E Desta forma, o calor que seria liberado para o ambiente é aproveitado para nova geração de energia elétrica, aumentando, assim, o rendimento da usina. 06 A Tal qual a questão anterior, a queima do bagaço possibilitaria o uso de uma energia que não seria aproveitada, aumentando o rendimento da usina. FÍSICA II 26/03/2013 18:38:27 07 A A recuperação energética se dá pela transformação do calor que seria liberado para o ambiente, que será transformado em energia cinética (da turbina). 08 D Numa usina geotérmica, assim como numa nuclear ou numa termelétrica convencional, o calor produz vapor a alta pressão, cujo movimento é convertido em energia elétrica por um gerador eletromecânico. 07 D Realmente as usinas nucleares não contribuem para o aquecimento global, por não emitirem gases causadores do efeito estufa. Isto ocorre porque o calor não é obtido pela queima de combustíveis fósseis, mas pela fissão nuclear. Apesar de não emitir os gases do efeito estufa, este tipo de usina é temido por muitos porque os rejeitos radioativos precisam ser guardados por milhares de anos, e qualquer vazamento gera um desastre ambiental de grandes proporções. 08 A 09 A Observe no processo 2 que o rendimento da termelétrica é de 40%, fazendo com que este processo tenha rendimento total igual a 0,4 x 0,95 = 0,38 = 38%, que é inferior ao rendimento do primeiro processo, que é igual a 0,95 x 0,70 = 0,665 = 66,5%. 10 A A celulignina seria o combustível deste processo, logo teria o mesmo papel do gás natural numa usina termelétrica, do magma numa usina geotérmica e do urânio numa usina nuclear. 11 E A geração de energia às custas da queima de combustíveis fósseis emite gases que colaboram para o efeito estufa, causador do aquecimento global. 12 D As termelétricas podem utilizar, como combustível para a geração de calor, diversas fontes, tais como petróleo, gás natural ou carvão, mas todas elas têm em comum o fato de emitirem gases poluentes que contribuem para o efeito estufa. 13 A A energia petrolífera é esgotável e tem boas chances de ser cada vez mais substituídas por energias de fontes renováveis. Toda geração de energia traz algum tipo de impacto, não há exploração sem impacto, mas sim com impacto controlado. Os rejeitos radioativos continuam emitindo radiação por milhares de anos e, por esta razão, precisam ser guardados com extremo zelo. 09 C A fissão nuclear também pode ser usada em material bélico. 10 D De acordo com a figura, as transformações de energia térmica (calor) em energia elétrica, ocorridas nas usinas termelétricas e nucleares, possuem um baixo índice de aproveitamento energético, aproximadamente 30%. 11 D Levando-se em conta que E = Pot x T e sendo a potência constante, temos: E1 = Pot x 45 E2 = Pot x 100 Economia: E2 – E1 = 100Pot – 45Pot = 55Pot Percentualmente: 55Pot = 0, 55 = 55% 100Pot 12 D A água mais fria é mais densa e tende a descer, enquanto a água mais quente é menos densa e tende a subir, portanto o arranjo mais adequado é o D. 13 D 14 A Transformação adiabática é aquela em que não há troca de calor (Q = 0) e isobárica é aquela em que a pressão p permanece constante, logo p = 0. W = áreaciclo = b . h = 2 V0 . 2 p0 = 4 p0 . V0 W = 4 nRT0 = W/Qrecebido = 4 nRT0 / 18 nRT0 = 4/18 0,22 = 22% 14 A 15 C A entropia aumenta, uma vez que esta transformação é irreversível. 16 C A entropia aumenta, pois o processo é irreversível. W = 0, pois V permanece constante. U = Ufinal – Uinicial = 600 – 200 = 400 cal U = Q – W Q = U + W = 400 + 0 = 400 cal Qv = n .cV . T 400 = 1 . cV . 100 cV = 4 cal/goC 15 A TC ă BLOCO 06 01 B Os projetos nucleares em sua grande maioria não têm fins militares, mas fins energéticos. 02 B Os rejeitos das reações de fissão nuclear emitem radiação por milhares de anos. 03 E O calor não aproveitado na geração de energia elétrica é liberado para o ambiente externo, no condensador. 04 D 7/21 = 1/3 33% 05 D I. (V) É o vapor obtido a partir da água contida na caldeira, aquecida pela energia térmica liberada na fissão nuclear, que aciona a turbina. II. (V) De acordo com a lei de Faraday. III. (F) A água é resfriada no condensador. 06 A A água é aquecida por receber calor do vapor d’água, quando este condensa. FÍSICA II AP 2013 FIS II V2 RESOLUÇÃO.indd 17 Na transformação isotérmica a temperatura é constante, logo não há variação da energia interna (U = 0). De acordo com a 1a Lei da Termodinâmica, temos U = Q – W, logo 0 = Q – W Q = W Q = área (p x V). É fácil perceber que o trecho em que a área sob o gráfico é maior é o trecho I, então este é o trecho em que há maior troca de calor. 16 D Como o trabalho realizado pelo gás equivale à área sob o gráfico p x V, temos W1 > W2 > W3. 17 B Transformação isotérmica Tcte Ucte U = 0 U1 = U2 = U3 = 0 W = área p x V W1 > W2 > W3 TC ă BLOCO 07 01 E Dados: P = 1 kW = 103 W; t = 1 h = 3,6 103 s; h = 72 m; g = 10 m/s2; dágua = 1 kg/L. A energia consumida pelo ferro de passar em 1 hora deve ser igual à variação da energia potencial de uma massa m de água. Então: DEágua = DEferro & mgh = PDt & PDt 103 # 3, 6 # 103 = = 5.000 kg m= gh 10 # 72 V = 5.000 L. & Ciências da Natureza e suas Tecnologias FÍSICA – Volume 02 17 26/03/2013 18:38:29 Para calcular a área do coletor, basta uma simples regra de três: " 1m2 800 W 9, 3 # 104 = 116, 25 m2. A= * 4 800 9, 3 # 10 W " A 02 D 03 21 (01 + 04 + 16) = 21 Calculando o comprimento (d) do coletor: A = d L 116,25 = d(6) d 19 m. Resolução Leve em consideração: 5 = Q2/W Q2 = 5.W Q 1 = Q2 + W = 5 . W + W = 6 . W 10 D mgh W = V.i " = V.i " Dt Dt Dt mgh 3.000 x 10 x 6 = = 100.000 s , 28 h Dt = Vi 9 x 0, 2 P= 04 A Aplicando os dados direto na equação de Einstein: E = m0c2 11 C Montemos uma tabela com as reduções propostas em cada opção: 2,0 106 3,6 106 = m0 (3 108)2 m0 = 8 10–5 Kg m0 = 0,08 g APARELHO(S) 05 A Um mol de U-235 tem massa 235 g (M = 235 g/mol). Calculemos então quantos mols há em 1 kg (1.000 g). m 1.000 = = 4, 23mols. n= M 235 Para calcular a quantidade de átomos (N), basta multiplicar pelo número de Avogadro. N = 4,23 6 1023 N = 2,55 1024 lâmpadas 10 8 25 2 kWh lâmpadas 10 2 100 2 kWh condicionador 1 2 2.000 4 kWh lâmp + cond. 10 1 1 1 100 2.000 3 kWh lâmpadas 2 8 8 2 100 100 3,2 kWh Como cada átomo libera 208 MeV é 1 eV = 4,45 × 10 kWh A, energia liberada por essa quantidade de átomos, em kWh, é: E = 2,55 1024 208 4,45 10–20 E = 2,36 107 kWh. 12 A Como em 1 mês são consumidos 230 kWh, o tempo pedido é: 2, 36 # 107 102.620 = 102.620 meses = t= anos & 230 12 t = 8.551 anos. 13 C −20 Ou seja, mais de 8.000 anos. 06 E ER = 300 kWh = 300 103 (J/s) 3.600 s = 1.080.000 103 J = 1,08 109 J EC = 180 30.000 = 5.400.000 kJ = 5,4 109 J 5, 4 # 109 =5 EC/ER = 1, 08 # 109 07 E Os sistemas que já apresentam alto rendimento não têm muito mais para crescer, leve-se em conta ainda que melhorar o que já é bom é muito mais difícil. Por outro lado, os de rendimento mais baixo são os que têm mais margem para crescimento e, por isso, seriam mais beneficiados com o investimento em pesquisa, ou seja, dariam um retorno maior para o investimento. Das opções apresentadas, a célula solar (E), é a que se encaixa no perfil. 08 E O enunciado, antes das opções, especifica: “A opção que detalha o que ocorre em cada etapa é:” Porém, nenhuma das opções detalha o que ocorre em cada etapa, mas sim, o que ocorre em uma ou em outra etapa. A opção correta deveria conter todo o texto abaixo. Etapa I – A energia potencial da água transforma-se em energia cinética da própria água, que transfere energia cinética de rotação às turbinas, gerando energia elétrica. Etapa II – A energia elétrica é transportada por condutores, havendo dissipação por efeito Joule na rede de transmissão. Etapa III – O sistema de bombeamento transforma energia elétrica em cinética e potencial gravitacional para a água, havendo dissipações por atrito na tubulação e por efeito Joule no circuito elétrico do motor. 09 A Dados: Intensidade da radiação captada, l = 800 W/m2; largura do coletor, L = 6 m; calor específico da água, c = 4.200 J/(kg.°C); massa de água, m = 1.000 kg; tempo de aquecimento, t = 1 h = 36 102 s; variação de temperatura, T = 80 °C. Quantidade de calor necessária para aquecer a água: Q = m c T = (1.000)(4.200)(80) = 336 106 J. Q 336 # 106 = = 9, 3 # 104 W. Potência recebida: P = Dt 36 # 102 18 Ciências da Natureza e suas Tecnologias FÍSICA – Volume 02 AP 2013 FIS II V2 RESOLUÇÃO.indd 18 HORAS POTÊNCIA QUANT ECONOMIA REDUZIDAS DESLIGADA (N) N X DT X DP (DT) (DP) I. Energia cinética associada ao movimento da mochila. II. Energia elétrica obtida pela transformação da energia cinética. 14 C 15 E Nem toda energia é plenamente utilizável. A entropia de um sistema nos permite dimensionar quanto dessa energia é aproveitável, ou seja, conversível em trabalho útil. 16 C I. Incorreta. A fissão é usada para produzir calor e aquecer a água no reator, como na afirmativa (II) II. Correta. III. Correta. IV. Incorreta. Recentemente foi descoberta no sul da Índia a mina Tumalapalli, a maior reserva natural de urânio do mundo, estimada em 150 mil toneladas. 17 B Dados: m = 3,6 . 104 kg; M = 18 g = 18 . 10–3 kg; R = 8 . 10–2 atm . L/mol; T = 227oC = 5 . 102 K; P = 30 atm. Usando a equação de Clapeyron: m mRT 3, 6 # 104 # 8 # 10-2 # 5 # 102 = PV = RT & V = M MP 18 # 10-3 # 30 6 V = 2, 67 # 10 L. & 18 C Dados: 0 = 20°C; = 40°C; Z = 10 L/min; = 1 kg/L; 1 cal = 4,2 J; c = 1 cal/g . °C c = 4,2 J/g . °C. A massa de água que passa pelo chuveiro a cada minuto é: m t= & m = t V = 1 _10 i & m = 10 kg = 10.000 g. V A quantidade de calor absorvida por essa massa de água é: Q = m c _i – i0 i = 10.000 _4, 2 i_40 – 20 i & 840.000 J. Como essa quantidade de calor é trocada a cada minuto (60 s), vem: Q 840.000 = P= & P = 14.000 W & P = 14 kW. Dt 60 FÍSICA II 26/03/2013 18:38:29
Download