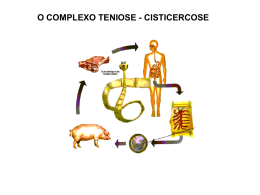
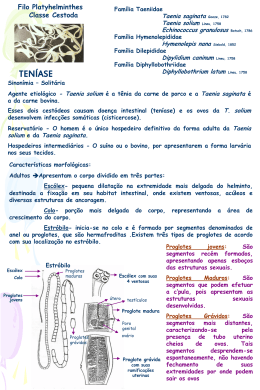
UNIVERSIDADE CASTELO BRANCO PRÓ-REITORIA DE PESQUISA E PÓS-GRADUAÇÃO COORDENAÇÃO DE PÓS-GRADUAÇÃO CURSO DE PÓS-GRADUAÇÃO “LATO SENSU” EM HIGIENE E INSPEÇÃO DE PRODUTOS DE ORIGEM ANIMAL A CISTICERCOSE E O CONSUMO DA CARNE SUÍNA Juan Carlos Vargas Lobato Vitória, nov. 2008 JUAN CARLOS VARGAS LOBATO Aluno do Curso de Especialização “Lato sensu” em Higiene e Inspeção de produtos de Origem Animal Matrícula 075270 A CISTICERCOSE E O CONSUMO DA CARNE SUÍNA Trabalho monográfico do curso de Pósgraduação “Lato Sensu” em Higiene e Inspeção de produtos de Origem animal apresentado à UCB, como Requisito parcial para a obtenção de título de Especialista em Higiene e Inspeção de alimentos de Origem Animal, sob a Orientação do Prof. Guido Carlos Iselda Masson. Vitória, nov. 2008 A CISTICERCOSE E O CONSUMO DA CARNE SUÍNA Elaborado por Juan Carlos Vargas Lobato Aluno do Curso de Especialização Latu Sensu Em Higiene e inspeção de produtos de origem Animal Foi analisado e aprovado com grau: .................................. Vitória, _____ de ________________ de _______. _________________________ Membro _________________________ Membro __________________________ Professor Orientador Presidente Vitória, nov. 2008 RESUMO O presente trabalho de revisão consiste na caracterização atual do complexo teníase-cisticercose (TC), problema de saúde pública grave, com ocorrência elevada em locais onde se evidencia a falta de saneamento básico e baixo nível sócio-econômico. Mostra sua repercussão econômica na suínocultura, como também levanta conhecimentos sobre os riscos á saúde do homem como indivíduo e salienta a fundamental importância do Setor Público na implementação da Vigilância Sanitária e nas Medidas de Controle dessa parasitose, que tem no homem o seu hospedeiro definitivo. Fica evidente a sua importância no contexto econômico e na saúde pública. Palavras-Chaves: Complexo teníase-cisticercose; melhoria na produção de suínos. SUMÁRIO Resumo ....................................................................................................... iii Parte 1 Introdução ................................................................................................. 1 2 Revisão da literatura ................................................................................. 3 2.1 Histórico da doença 2.2 Morfologia 2.3 Biologia e Ciclo Evolutivo 2.4 Aspectos Epidemiológicos 2.4.1 Reservatórios e Fonte de Infecção 2.4.2 Distribuição, Morbidade, Mortalidade e Letalidade 2.4.3 Aspectos Clínicos 2.4.4 Diagnóstico 2.4.5 Tratamento da Teníase e da Cisticercose 2.4.6 Vigilância Epidemiológica 2.4.7 Medidas de Controle 3 Conclusão ............................................................................................... 21 Referências bibliográficas ......................................................................... 22 1. INTRODUÇÃO Ainda nos dias de hoje, mesmo após a modernização da criação de suínos, é possível observarmos um evidente preconceito em relação ao consumo da carne suína, indicando que não apenas os fatores culturais ou religiosos, mas também a falta de conhecimento gera alguns mitos que influem diretamente no seu consumo. Devemos ressaltar que esta parasitose está intimamente relacionada à falta de higiene, ao saneamento básico precário e ao baixo nível socioeconômico que induzem e permitem o acesso da população ao consumo de carne de procedência desconhecida, verduras e águas contaminadas (MENDEZ; et. al. 2005). O complexo teníase-cisticercose (TC), engloba duas doenças distintas caracterizadas por sintomatologia e epidemiologia totalmente diferentes – a teníase que corresponde ao ciclo final do parasita, presente apenas no homem e a cisticercose, estágio larval da Taenia saginata, ou da Taenia solium, que podem acometer bovinos, suínos e humanos. Ao abrigar a fase larval, Cysticercus cellulosae, instala-se a cisticercose, que pode estar presente no coração, na musculatura estriada esquelética e principalmente no sistema nervoso central, desenvolvendo a neurocisticercose (REY, 2002), a forma mais grave da doença. É causada principalmente pela Taenia solium que afeta suínos e acidentalmente o ser humano, sendo um sério problema de saúde pública, ocorrendo mais em países onde a pobreza e a falta de higiene favorecem sua transmissão (DE ALUJA; et. al. 1996). Desta forma a doença representa relevada importância, pois o homem é o hospedeiro definitivo e consequentemente a principal fonte de infecção deste parasita, sendo responsável pela sua transmissão aos animais e a si próprio, caracterizando a enfermidade como uma zoonose principalmente nas regiões onde a doença incide com certa freqüência, como ocorre no nosso país. Dados da Organização Mundial de Saúde indicam que a neurocisticercose é responsável por 50 mil óbitos por ano em países subdesenvolvidos ou em desenvolvimento como alguns países asiáticos, africanos e da América Latina. Segundo Mendez; et.al.(2005) no Brasil, os Estados de São Paulo, Minas Gerais, Paraná e Goiás apresentam a doença na forma endêmica. Neste trabalho fica demonstrado que, com os conhecimentos atuais, o consumo de carne suína, pode ser totalmente seguro adotando-se medidas higiênico-sanitárias adequadas, rigorosas e permanentes que com certeza proporcionarão uma melhoria na criação suína. Torna-se necessário um sério comprometimento do setor público com a Saúde e a Educação promovendo extenso e permanente trabalho educativo nas escolas e comunidades rurais e urbanas implementando o Serviço de Inspeção Sanitária e de Vigilância ao abate clandestino. A acentuada persistência das zoonoses causadas por cestóideos, em humanos e animais, reflete as deficiências nos métodos de diagnóstico e, consequentemente, nos mecanismos de controle dessas infecções (HERBERT; OBERG, 1974). Levando-se em consideração as incertezas quanto ao benefício, a viabilidade e os riscos das terapêuticas propostas, a verdadeira solução da neurocisticercose está colocada primordialmente nas medidas de prevenção da infestação (OPS, 1994) 2. REVISÃO DA LITERATURA 2.1 Histórico da doença A cisticercose foi descrita pela primeira vez em suínos pelo pensador grego Aristóteles (CARVALHO, 2005). Em 1995, Tavares Júnior relatou que, talvez o horror à lepra humana, associada por Aristóteles à “lepra suína” (cisticercose suína), tenha facilitado a penetração da abstinência nas religiões, através das quais viajou aos dias de hoje. A partir de então, gerou-se um conceito equivocado que considerava o porco como transmissor da tão temida doença, o que serviu de base (associado às proibições religiosas judaico-muçulmanas) para o repúdio ao consumo de carne suína em grande parte dos povos antigos. Exemplo deste fato pode ser constatado em 300 AC época em que os primeiros escritos judeus já proibiam o consumo desse tipo de carne, sob pena de prisão (ROPPA, 2006). A proibição da carne suína acha-se presente no texto da Bíblia, no Antigo Testamento em especial no Levítico (11:4-7) e no Deuteronômio (14: 7,8). Observar proglótides de Taenia solium é relativamente fácil, quando ela é eliminada do organismo junto com as fezes. Provavelmente por causa dessa facilidade, é que se encontram referências à teníase, desde a remota antigüidade. No Papyrus Ebers há indicações de que os egípcios conhecessem a teníase. (CHENG, 1964). Segundo Foster (1965) e Pessoa & Martins (1988), é interessante notar que, desde remotas eras, pouco se duvidou da natureza animal da tênia adulta. Na medicina moderna, o primeiro caso de cisticercose humana foi descrito no século XVI, sendo, no entanto, desconhecida a natureza da doença. Isso veio a ser sanado somente na segunda metade do século XIX, quando pesquisadores alemães demonstraram que a responsável pela doença era a forma larvária da Taenia solium (DEL BRUTTO; et. al.,1988; LINO; et. al., 2006). Em 1853, Küchenmeister consegue claramente, fazer a distinção entre as duas espécies de tênias humanas: a T. solium e a T. saginata. Entre os anos de 1855 a 1860, Leuckart, Küchenmeister e Hauber demonstram, o ciclo da T. solium. A comprovação da relação entre a teníase humana e a cisticercose porcina, foi realizada por Küchenmeister, por meio de experimentação humana utilizando prisioneiros condenados à morte. Em 1854, Küchenmeister obtém permissão do governo da Saxônia para seu primeiro experimento e, nos três dias anteriores à execução, adiciona 75 cisticercos frescos à alimentação de um assassino “marcado para ser dissipado de sua vida para a morte, pela guilhotina” (Mc GREEVY & NELSON, 1991). Em 1855 Küchenmeister, obtém nova permissão do governo e administra vinte cisticercos, no pão, a outro condenado, quatro meses antes da execução, e nova dose composta por 20 cisticercos, dois meses antes. Na autópsia, foram encontradas 19 tênias intestinais bem desenvolvidas, 11 já com proglótides maduras. Tão grande foi o fascínio e a curiosidade determinados pelos estudos de Küchenmeister que dois estudantes de Medicina, Humbert, de Genebra e Hollenbach, de Montecarlo, decidem repetir em si próprios a experimentação para comprová-la. Semanas após ingerirem cisticercos, confirmam sua própria teníase intestinal por meio de análise coprológica. Nessa época, o termo Cysticercus cellulosae deixa de designar uma espécie à parte e passa representar a forma larval da T. solium. (SAIZ MORENO, 1987). Já com relação à natureza animal dos cisticercos seu reconhecimento não ocorreu tão cedo como o das tênias adultas, tendo sido objeto de discussão por muito tempo. Houve hipóteses de que fossem “tumores hidáticos”, glândulas em degeneração, acúmulos de pus e soro, alterações vasculares, varizes linfáticas e degeneração de “sacos mucosos” (PESSOA & MARTINS, 1988). Desta maneira, durante quase dois milênios, desde a descrição da doença por Aristóteles, a cisticercose, conhecida como ”cangiquinha”, assombrou a humanidade, sendo que apenas no século XIX ficou claro o ciclo da doença, indicando que a cisticercose é transmitida pelo homem e não pelos animais infectados, como se pensava. Mas, como será possível observar, a influência social e cultural desse mal entendido, que perdura por séculos, ainda permeia a sociedade, principalmente nos países subdesenvolvidos ou em vias de desenvolvimento, onde o baixo acesso à informação, além de contribuir para a perpetuação deste mito, contribui para a disseminação da cisticercose. A proliferação de doenças de importância em saúde pública está, geralmente, associada às precárias condições socioeconômicas dos países em desenvolvimento onde a falta de saneamento básico e o baixo nível cultural e sócio econômico favorecem a infestação. 2.2 Morfologia A espécie T. solium é um helminto achatado, em forma de fita, medindo habitualmente dois a três metros de comprimento, mas podendo atingir oito a nove metros. São da.?..Platyhelmintes,classe cestoda, família taenidae, gênero taenia, espécie taenia solium. Possuem escólex pequeno, globuloso, medindo aproximadamente um milímetro de diâmetro bem como ventosas conspícuas e orbiculadas. Entre as ventosas podemos visualizar o rostéolo situado em posição central e anterior. O escólex é dotado de um número variável de ganchos (25 a 50) dispostos circularmente com as pontas voltadas para a periferia. Os ganchos são de dois comprimentos, dispondo-se de modo a que as pontas dos ganchos menores se alinhem circularmente com as dos maiores. Segundo Moraes et. al. (1971), o pescoço é mais delgado e curto que o escólex. Este mesmo autor ainda descreve que, o estróbilo é formado por 800 a 1000 proglótides que vão apresentando gráus sucessivos de diferenciação do pescoço para a extremidade distal. As proglótides proximais são imaturas, as da porção média maduras, isto é, com os órgãos dos aparelhos genitais diferenciados e as da porção posterior ou distal, grávidas, com útero repleto de ovos. A largura do corpo cresce de uma extremidade à outra, como um triângulo muito estreito e muito longo. O ápice do triângulo pode ser considerado, para comodidade de descrição, como sendo anterior. Há, contudo, razões para se admitir sua equivalência à extremidade posterior de outros animais. A cor é geralmente branca, de aspecto leitoso, outras vezes levemente amarelada ou rosada, devido a substâncias diversas absorvidas pelo verme. A superfície é lisa, brilhante, mas por vezes enrugada ou marcada por sulcos longitudinais devidos a contraturas da parede. Goteiras transversais marcam os limites das proglótides (REY, 1973). No ovo das tênias, supõem alguns autores que o córion e o blastoderma sejam abandonados e o envoltório embrionário se transforme no embrióforo ou “casca do ovo”, tal como é encontrado nas fezes. Esse embrióforo é espesso, medindo cerca de três micras, amarelo-pálido, e apresenta-se com estrutura finamente estriada no sentido radial; muito característica, devido à justaposição de elementos em forma de bastonetes, unida por uma substância ligante (REY, 1973). A larva no seu interior é uma esfera armada de três pares de acúleos, denominada oncosfera ou embrião hexacanto. O ovo completo mede 30 a 35 micras de diâmetro. O Cysticercus cellulosae, é constituído de cabeça e colo, invaginados dentro de uma vesícula. A cabeça é semelhante à da tênia, e o colo, diminuto. Ambos se apresentam enrolados sobre si mesmos. A vesícula é clara, semitransparente, mede cerca de 10 a 15 mm, tem forma variável e seu interior é preenchido por líquido cristalino. Na carne de animais abatidos, os cistos mortos ou calcificados são esbranquiçados e mais fáceis de serem identificados em relação aos cistos vivos ou viáveis, os quais são rosa-pálidos (ONYANGO-ABUJE; et. al.,1996) 2.3 Biologia e ciclo evolutivo Os seres humanos são o hospedeiro definitivo da T. solium, mas existem relatos da tênia adulta no cão. O cisticerco tem sido encontrado em diversas espécies, mas apenas no homem, suíno, cão e macaco ele se desenvolve promovendo infecção (HERBERT e OBERG, 1974). Humanos portadores da teníase albergam, em geral, um único parasita adulto no intestino, que libera proglótides grávidas nas fezes (SOBESTIANSKY, 1999). As proglótides maduras da Taenia solium são eliminadas no intestino juntamente com as fezes. No meio ambiente, degeneram e deixam livres os ovos, embrióforos, que encerram o embrião (hexacanto). Quando os ovos são ingeridos pelo hospedeiro intermediário, o embrião, ao atingir o estomago, deixa o ovo, penetra na mucosa gástrica, e pela circulação geral é levado até a sede da sua localização definitiva. Desenvolve-se a partir do embrião a forma larvária, o Cysticercus cellulosae, A partir do cisticerco, desenvolve-se a forma adulta, a tênia, no intestino delgado do hospedeiro definitivo. O fato de o porco constituir um alimento humano usual faz dele o hospedeiro intermediário, pois é principalmente em seus tecidos que se desenvolve o cisticerco. Este pode porém desenvolver-se em outros animais, inclusive no homem. O homem adquire a cisticercose por auto ou por heteroinfecção. A auto-infecção ocorre em portadores de teníase quando proglótides maduras chegam ao estomago quer pelo refluxo do conteúdo intestinal (auto-infecção interna), quer pela ingestão de proglótides eliminadas em suas fezes (auto-infecção externa). A heteroinfecção ocorre quando se ingere carne bovina ou suína crua ou mal cozida, água ou outros alimentos contaminados pelos cisticercos (VERONESI, et. al.,1991) adquirindo desta forma a teníase. As proglótides grávidas são eliminadas em cadeia, em número de um a cinco pelas fezes dos humanos. Estas fezes, quando depositadas no solo, sofrem dessecamento, liberando então os ovos embrionários, que se espalham no ambiente contaminando as pastagens e a água (FORTES, 1993). As proglótides não possuem orifício de postura, no entanto, durante a apófise, as superfícies de ruptura entre os anéis não cicatrizam, nem apresentam revestimento, e por elas os fundos de saco uterinos podem formar uma hérnia e romper-se, liberando os ovos. É assim que se explica a presença de ovos de Taenia nas fezes. Por vezes, ao transpor o esfíncter anal, as proglótides são comprimidas, expulsando grande quantidade de ovos. Nesse caso, o encontro dos ovos pode ser feito pelo método de “swabs” anais ou da fita gomada. Mas, em geral, as proglótides liberam seus ovos no meio externo. Cada proglótide contém em média de 30000 a 50000 ovos (REY, 1973). Os ovos no exterior são viáveis até 12 meses aproximadamente. Para prosseguir o ciclo evolutivo, os ovos devem ser ingeridos pelo suíno (FORTES, 1993). O embrião hexacanto só abandona seu envoltório (embrionário) no interior do tubo digestivo do hospedeiro intermediário representado pelo suíno (REY, 1973). Aparentemente, o embrióforo não sofre ação do suco gástrico ou digestivo do hospedeiro. O estímulo para a eclosão é a ação do suco pancreático. A eclosão dá-se provavelmente no duodeno, 24 a 72 horas depois de ingerido. O embrião hexacanto, por meio de seus acúleos, prende-se à mucosa, insinua-se entre seus elementos celulares, invade os vasos da mucosa ou da submucosa e ganha a circulação (FORTES, 1993). A larva estaciona no tecido conjuntivo interfascicular dos músculos onde se desenvolve e perde os seis acúleos que trazia. Ao fim de algum tempo, sofre uma vacuolização e começa a apresentar uma invaginação em um ponto da superfície da vesícula. No fundo dessa invaginação formam-se as estruturas próprias do escólex da futura T. solium adulta. Segundo Moraes et. al. (1971) a forma larval completa o desenvolvimento em três a quatro meses. O cisticerco completa seu desenvolvimento em cerca de 60 a 75 dias. Apresentase como uma vesícula do tamanho de um grão de ervilha ou de um grão de feijão, cuja forma esférica, ovóide ou alongada, depende das pressões exercidas pelos tecidos do hospedeiro. Nos músculos, costuma alongar-se no sentido das fibras, medindo 10 a 15 milímetros de comprimento por sete a oito milímetros de largura. A cor é branca, semitransparente, permitindo notar-se no interior a parte invaginada que contém o escólex conhecido também por receptaculum capitis (REY, 1973). A estrutura é simples. A vesícula é envolvida por um tegumento delicado. Sob ela está uma camada de fibras musculares e um parênquima pouco espesso. O interior da vesícula é ocupado por um líquido de aspecto límpido que se aproxima, por sua composição, de um transudato do plasma ou do líquido cefalorraquidiano. O receptaculum capitis compreende externamente o tecido parenquimatoso, mais abundante e, internamente, uma luz irregular, de superfície extremamente pregueada e revestida de espesso tegumento. Quando o escólex se desinvagina por um ponto da superfície do cisticerco denominado hilo, a camada tegumentar exterioriza-se, e as ventosas ou os acúleos ficam em posição de desempenhar sua função fixadora (REY, 1973). No hospedeiro definitivo em condições favoráveis, o escólex fixa-se à mucosa do intestino delgado, a porção vesicular atrofia-se, desenvolve-se o colo e se inicia a proglotização. Ao fim de uns três meses, o paciente começará a expulsar proglótides maduros em suas fezes. 2.4 Aspectos epidemiológicos 2.4.1 Reservatório e fonte de infecção O complexo teníase/cisticercose é considerado endêmico em muitos países, nos quais a persistência dessas zoonoses está relacionada a fatores culturais e sócioeconômicos (SARTI; et. al., 2002) Humanos se infectam ao ingerirem carne parasitada pela forma larvária (cisticerco), consumida crua ou que tenha sofrido apenas cocção parcial. Quando ingerida, passa do estômago para o intestino, onde sob a ação conjugada dos líquidos digestivos e da bile, liberta o escólex característico desta espécie que, por suas quatro ventosas e o rostéolo, se fixa à mucosa das primeiras porções do intestino delgado (MORAES; et. al., 1971). A transmissão pode também ser feita por meio da transferência direta dos ovos da T. solium presente nas fezes de um portador para a sua própria boca ou a de outras pessoas. Os movimentos retroperistálticos favorecem a migração das proglótides alcançando o estômago de onde em seguida retornam ao intestino delgado liberando as oncosferas (auto-infecção). Outra fonte de infecção são os alimentos, principalmente verduras irrigadas com água contaminada ou a ingestão da própria água contaminada com ovos de Taenia solium, demonstrando a importância da via fecal-oral na epidemiologia desta doença. No geral, a principal fonte de infecção são os hospedeiros definitivos (os humanos) que contaminam o ambiente podendo vir a infectar os hospedeiros intermediários como, por exemplo, os suínos. Uma vez ingeridos, os ovos liberam as larvas. O período de incubação da cisticercose pode variar de 01 a 35 dias, mas geralmente, o quadro clínico manifesta-se entre dois a cinco anos pós-infecção. Os dados da literatura sugerem que animais imunizados teriam um menor risco de adquirir cisticercose do que os animais não imunizados, demonstrando ampla variação na relação hospedeiro-cisticerco. Sabe-se que antígenos de parasitas vivos em qualquer estágio de desenvolvimento como ovos, embriões e seus extratos conferem algum grau de imunidade. Os anticorpos podem ser os principais mediadores de resistência contra as formas larvárias (LINO JUNIOR; et. al., 1998). No entanto, a imunidade é específica, tendo sido constatado que uma espécie não parece impedir o desenvolvimento da outra, no mesmo hospedeiro. A imunidade cessa logo que a tênia deixa o organismo. As tênias adultas vivem na luz do intestino delgado principalmente de humanos, portadores da Taenia sp. Em geral, cada paciente é portador de um único espécime. O nome popular por que são designadas, “solitárias”, traduz esse fato de observação corrente (REY, 1973) Tem-se observado que a presença de uma espécie de Taenia garante certa imunidade, pois dificilmente um indivíduo apresenta mais de um exemplar da mesma espécie no seu intestino, porém não existem muitos estudos abordando este aspecto da infestação. Explica-se assim a infecção única, mesmo em populações expostas à ingestão cotidiana de cisticercos, como sucede na Abissínia. Segundo Rey (1973), para alguns autores, o parasitismo múltiplo seria devido à infestação concomitante com vários cisticercos, em virtude de o número muito elevado de tênias apresentado por certos pacientes não parecer resultado de uma só refeição infestante. A infecção múltipla pela T. solium tem sido descrita algumas vezes em nosso País. A maior sobrevivência do parasita no hospedeiro pode ser atribuída à imunotolerância, pois ele utiliza mecanismos para evadir-se da resposta imune, minimizando ou até mesmo escapando de suas ações (DEL BRUTTO; et. al., 1988) 2.4.2 Distribuição, morbidade, mortalidade e letalidade A cisticercose é uma enfermidade de distribuição cosmopolita e de caráter zoonótico (MONTEIRO; et. al., 2007) típica de países em desenvolvimento, sendo considerada a mais importante doença parasitária do sistema nervoso humano (WHO, 2000). É endêmica na área andina da Ámerica do Sul, Brasil, China, Subcontinente Indiano, Indonésia, México, América Central, Papua, Nova Guiné, Sudeste Africano e África Sub-Saariana (REY, 1991). Os registros sobre a prevalência da cisticercose suína no Brasil estão relativamente desatualizados e sinalizam para um ligeiro decréscimo em animais inspecionados pelo SIF (Sistema de Inspeção Federal). Mantém-se, contudo, um quadro indefinido e preocupante associado à clandestinidade do abate e da comercialização dos animais, o que dificulta a determinação de sua real prevalência. No Brasil, a cisticercose tem sido cada vez mais diagnosticada, principalmente nas regiões Sul e Sudeste, tanto em serviços de neurologia e neurocirurgia quanto em estudos anatomopatológicos (SILVA, 1993; SILVA; et. al.,1994; AGAPEJEV,1994; TAVARES,1994; COSTA-CRUZ; et. al., 1995). A baixa ocorrência de cisticercose em algumas áreas do Brasil, como por exemplo, nas regiões Norte e Nordeste, pode ser explicada pela falta de notificação ou porque o tratamento realizado em grandes centros, como São Paulo, Curitiba, Brasília e Rio de Janeiro, dificultam a identificação da procedência do local de infecção. Segundo dados da Fundação Nacional de Saúde/Centro Nacional de Epidemiologia (FNS/CENEPI, 1993), o Brasil registrou um total de 937 óbitos por cisticercose no período de 1980 a 1989. Até o momento não existem dados disponíveis para que se possa definir a letalidade do agravo. No entanto, por ser uma doença de tratamento ambulatorial, não há registros de casos nos hospitais, o que leva a uma subnotificação da helmintose. Assim, o percentual de casos de teníase registrados pode ser considerado baixo, visto que constitui apenas uma subestimativa da doença. (Silva et. al. 2007). Além disto, a criação livre de suínos no ambiente está associada ao abate e distribuição de carnes não inspecionadas interferindo nas estatísticas da real prevalência da cisticercose suína (HERBERT; OBERG, 1974). Em Barbalha – CE, a secretaria de Saúde do Município disponibilizou dados referentes ao período, de 1998 a 2003. Essa parasitose correspondeu a 1,1% das verminoses diagnosticadas. Esse percentual está de acordo com a prevalência estimada da doença no Brasil, que pode variar de 0,3% (CAPUANO; et. al., 2002) a 3% (EPIDEMIOLOGY, 1994). Segundo a Organização Panamericana de Saúde, a prevalência acima de 1% deve ser considerada alta (YANEZ, 2001). 2.4.3 Aspectos clínicos Os sinais clínicos produzidos pela T. solium são inaparentes em seres humanos portadores de tênias adultas. Suínos portadores de cisticercos geralmente também são assintomáticos. Entretanto, quando o homem é infectado com ovos, podem ocorrer vários sinais clínicos, dependendo da localização dos cistos nos órgãos, músculos ou tecido subcutâneo. Mais gravemente, os cisticercos podem se desenvolver no sistema nervoso central, produzindo distúrbios mentais ou sinais clínicos de epilepsia ou hipertensão intracraniana; também podem desenvolver-se no olho, com conseqüente perda de visão. Na América Latina, calcula-se que quase 0,5 milhão de pessoas apresentam as formas nervosas ou ocular de cisticercose (URQUHART; et. al., 1987). Nos suínos, os músculos mais comumente atingidos são os da língua, os do pescoço, dos quartos anteriores, os intercostais, o psoas, os dos quartos posteriores e os da região vertebral posterior. Os órgãos internos como o cérebro, rins, coração, fígado, pulmões, também podem ser pontos para onde se dirigem e evoluem as oncosferas (MORAES; et. al., 1971). Dados estatísticos sobre localizações revelam que em suínos parasitados pelo Cysticercus cellulosae foram registrados 78,6% no coração, 77,5% nos músculos mastigadores e 75% na língua e, em menor porcentagem, em outros órgãos e carcaça (FORTES, 1993). Geralmente não ocorre sintomatologia neurológica, nem comportamento anormal nos suínos infectados, entretanto são observadas associações com deficiências nutricionais e outras doenças, tais como infecções pulmonares de origem bacteriana ou parasitária (FLISSER, 1987). A infecção natural maciça nos suínos pode provocar respiração dificultosa, estertorosa e acelerada, rigidez das extremidades, sensibilidade no focinho e na língua, com dificuldade de ingestão de alimentos, edema, emagrecimento, anemia e convulsões. Consideram-se sinais clínicos patognomônicos da cisticercose nos suínos, a presença de cisticercose na superfície inferior da língua, na conjuntiva e nas pregas anais (VILLA, 1995). Da mesma forma, os animais infectados experimentalmente também podem omitir sinais clínicos, embora evidenciem a presença de cisticercos (HERBERT e OBERG, 1974). Segundo Pawlowski (1982), as infecções moderadas geralmente são assintomáticas, mas os suínos experimentalmente infectados com 200000 embrioóforos de T. solium apresentam sintomas de anorexia, febre, respiração e pulso acelerado, vômito e diarréia. As complicações neurológicas nos suínos, principalmente hidrocefalia, hipertensão intracraniana e desequilíbrio, geralmente estão ausentes, pois os cisticercos nunca se localizam no cerebelo e apenas ocasionalmente nos ventrículos. Além disso, os animais são abatidos precocemente, antes que os sintomas neurológicos se desenvolvam (PAWLOWSKI, 1982). Observa-se que a maioria dos suínos apresenta infecção natural com um número superior a 10 cistos por animal, o que já configura uma infecção severa (HERBERT e OBERG, 1974). Entretanto, Sciutto et. al. (1998) verificaram que 82% dos suínos infectados experimentalmente com 100000 ovos apresentaram menos de 10 larvas. Pela legislação brasileira, entende-se como infecção extensa, a presença de cistos em diversas partes da musculatura e numa área equivalente à da palma da mão (BRASIL, 1980). Os locais preferencialmente atingidos pela cisticercose suína são a musculatura estriada esquelética principalmente os músculos mastigadores, os músculos respiratórios, o coração, o cérebro e a língua (VILLA, 1995). Num grupo de suínos naturalmente infectados, a neurocisticercose foi revelada em 50% dos animais que apresentavam de um a três cistos no músculo ancôneo e em 100% daqueles que continham mais que sete cistos (PAWLOWSKI, 1982). Os cisticercos podem se desenvolver nos suínos entre 1 a 3 meses após a infecção (FLISSER, 1987). 2.4.4 Diagnóstico Como os suínos são hospedeiros intermediários, a prevalência da cisticercose suína é um indicador confiável de zonas de transmissão ativa (SCIUTTO; et. al., 1998) O diagnóstico da cisticercose em abatedouros, somado à informação da origem do animal, possibilita a definição de áreas de ocorrência da doença, bem como a sua qualificação para que possam ser executadas medidas de controle (UNGAR E GERMANO, 1992). O método mais comum para o diagnóstico na espécie suína é a inspeção post-mortem das carcaças (BIONDI; et. al., 1996). Para o diagnóstico da cisticercose suína, usualmente também se empregam os exames durante o período de pré-abate. O exame pré-abate (ante-mortem) mais empregado é a observação de lesões na língua enquanto que após o abate (postmortem) utiliza-se o exame anátomo-patológico. O exame da língua tem alta especificidade (geralmente 100%), embora a sensibilidade seja menor (por volta de 70%), pois os sintomas são raros e as lesões na língua são visíveis apenas em infecções pronunciadas. Mesmo assim, é útil na determinação da prevalência da cisticercose suína em áreas endêmicas (GONZALEZ; et. al., 1990; WORLD HEALTH ORGANIZATION WHO, 1993). Na rotina da inspeção sanitária realizada em frigoríficos, são examinados os músculos mastigatórios (masseter e pterigóide), coração e língua, que podem não ser identificados em animais com baixa infecção (SOARES; et. al., 2006). O exame anátomo-patológico (necrópsia) pode deixar escapar lesões em animais com baixos níveis de infecção, principalmente, se procedentes de áreas endêmicas, não sendo o método mais indicado para selecionar animais sadios, apenas os infectados (GONZALEZ; et. al.,1990). Este exame, empregado na conhecida Inspeção post-mortem foi aprimorado por Santos (1975) para o diagnóstico da cisticercose bovina, visando aumentar sua sensibilidade. Analisando resultados do exame post-mortem, Flisser; et. al., (1991) verificaram que 90% dos suínos com cisticercos cerebrais revelaram imagens tomográficas de cisticercose, sendo que o único animal falso-negativo continha apenas um cisto cerebral, enquanto 75% dos cistos encontrados no exame post-mortem foram visualizados na tomografia. É importante ressaltar a inviabilidade deste último teste no diagnóstico de campo da cisticercose suína, como também a possibilidade de não detectar lesões cerebrais em alguns animais positivos. Recentemente os testes sorológicos para pesquisa de anticorpos têm sido empregados com sucesso. Os métodos sorológicos, em especial o ELISA e o Immunoblot vêm sendo estudados e recomendados no diagnóstico da cisticercose suína (DORNY; et. al., 2003). Estes testes têm atingido destacado espaço no diagnóstico da cisticercose humana e mais recentemente da suína, como alternativa aos demais, devendo ser padronizados para assegurarem um bom desempenho (MONTEIRO; et. al., 2004) Os antígenos de larvas de T. crassiceps revelaram desempenho ligeiramente superior aos de larvas de T. solium no teste ELISA, principalmente quanto à sensibilidade, segundo Pinto et. al. (2000). Entretanto os antígenos de ambos os parasitas mostraram resultados favoráveis ao seu emprego no diagnóstico da cisticercose suína. A técnica do ELISA é o teste sorológico mais indicado para o diagnóstico da cisticercose suína, dada a sua alta sensibilidade, especificidade e reprodutibilidade (SOARES; et. al., 2006). Segundo Nascimento; et. al., (1987) vários antígenos obtidos de C. cellulosae são utilizados no ELISA para o diagnóstico da cisticercose, porém o escólex do parasita é a fração que possui antígenos capazes de conferir alta sensibilidade e especificidade ao teste. Em humanos portadores da neurocisticercose Ev.; et. al., (1999) encontraram sensibilidade e especificidade de 100%. Soares; et. al., (2006) descreveram um aumento nos valores de absorbância a partir do sétimo dia de infecção com resultados positivos aos 21 dias e, a partir daí, com oscilações ao longo da infecção. Estes mesmos autores encontraram sensibilidade entre 87,7 e 100% durante o curso da infecção. Santamaria; et. al., (2002) observaram que suínos infectados com ovos de T. solium apresentaram anticorpos somente 30 dias após a infecção e Smith et. al. (1991) verificaram os maiores valores de absorbância aos 40 e 60 dias após a infecção de bovinos com T. hydatigena. Os títulos crescentes ao longo da infecção podem estar relacionados com a existência de cisticercos viáveis, metabolicamente ativos, produzindo e secretando substâncias que estimulam o sistema imunológico do hospedeiro (FLISSER; et. al., 1990). Investigando a prevalência da cisticercose suína em área endêmica, utilizando quatro diferentes métodos, Gonzalez et. al. (1990) verificaram maior sensibilidade para o Immunoblot, seguido em ordem decrescente pelo teste ELISA, necrópsia e exame da língua. Considerando a necrópsia como prova padrão (padrão-ouro), o teste do Immunoblot apresentou melhor desempenho (sensibilidade, especificidade e valores preditivos) que o ELISA e o exame da língua, confirmando sua melhor eficiência no diagnóstico da cisticercose suína. Reações falso-positivas tem sido um problema no ELISA e decorrem de reações cruzadas com outras patologias, além das reações inespecíficas imprevisíveis. Por isso a padronização dos ensaios empregados é fundamental para a confiabilidade dos resultados. Os parâmetros a serem avaliados nos ensaios de padronização são diversos, variando entre tipos de solução bloqueadora, antígenos, concentrações dos reagentes, tempo e temperatura de reação, dentre outras. Na medicina humana, dados de teníase e neurocisticercose podem ser obtidos, respectivamente, por meio de exames coprológicos e tomografia computadorizada (PFUETZENREITER, 1997) além de exames do líquido cefalorraquidiano e sangue, os quais fornecem elementos consistentes para o diagnóstico, pois o parasita determina alterações compatíveis com o processo inflamatório crônico, mas as provas sorológicas, apresentam resultados limitados, uma vez que não permitem localizar os parasitas ou estimar a carga parasitária, além de que, a simples presença de anticorpos não significa que a infecção seja atual. Os testes sorológicos mais utilizados são o ELISA, com sensibilidade aproximada de 80%; a imunoeletroforese, que embora não forneça resultados falso-positivos, revela apenas 54% a 87% dos pacientes com cisticercose e a imunofluorescência indireta, altamente específica, mas pouco sensível. Outros exames freqüentemente indicados para o diagnóstico da cisticercose em humanos são os exames radiográficos realizados mediante imagens dos cistos calcificados; imagens relativamente características são obtidas pela tomografia computadorizada e ressonância magnética que auxiliam na localização das lesões, notadamente ao nível do sistema nervoso central, tanto para os cistos viáveis, como para os calcificados e os exames anatomopatológicos realizados por meio de biópsias quando presentes eventuais nódulos subcutâneos e a própria necrópsia com exame histopatológico no caso do óbito de indivíduos doentes. 2.4.5 Tratamento da teníase e cisticercose Para o tratamento da teníase são utilizados medicamentos com ação parasiticida. Os princípios ativos mais conhecidos são o Mebendazol, Niclosamida ou Clorossalicilamida, Praziquantel e Albendazol. Até há pouco mais de uma década e meia, a terapêutica medicamentosa da neurocisticercose era restrita ao tratamento sintomático. Atualmente, Praziquantel e Albendazol têm sido considerados eficazes na terapêutica etiológica da neurocisticercose. (TAKAYANAGUI, 1987, 1990-b). Há questionamentos sobre a eficácia das drogas parasiticidas na localização cisternal ou intraventricular e na forma racemosa (na espécie humana quando desprovidos de escolex, não sendo possível classificar a espécie a que pertencem), recomendando-se, como melhor opção, a extirpação cirúrgica, quando exeqüível (COLLI, 1996; COLLI; et. al., 1994-b; TAKAYANAGUI, 1990-b, 1994). 2.4.6 Vigilância epidemiológica A notificação da teníase/cisticercose pode fornecer dados epidemiológicos mais preciosos sobre a prevalência populacional e permitir o mapeamento geográfico das áreas mais afetadas para melhor direcionamento das medidas de controle. A inspeção sanitária da carne, efetuada em matadouro, constitui um importante mecanismo de controle da teníase e da cisticercose, como recurso preventivo, reduzindo o consumo de carne contaminada com cisticercos e contribuindo com a vigilância epidemiológica da doença, pela notificação dos casos aos serviços de Saúde Pública e Animal, segundo sua procedência (ARRUDA; et. al., 1990). A inspeção da cisticercose suína é ainda mais eficiente que a bovina, porque os cisticercos são maiores e as infecções geralmente maciças, pois os suínos geralmente ingerem proglotes inteiros (PAWLOWSKI, 1982). O regulamento do SIF (BRASIL, 1980), em seus artigos 176 e 204, prevê a condenação total de carcaças com infecção extensa e rejeição parcial das partes infectadas, seguida de tratamentos pelo frio, calor ou salga das partes aparentemente sadias, nos casos de infecção discreta. Hoje tem sido rotina o emprego de congelamento de carcaças infectadas em estabelecimentos inspecionados pelo SIF(Sistema de Inspeção Federal). Segundo a Organização Mundial de Saúde (STABENOW; et. al., 1987), devem ser obedecidos os seguintes critérios para a destinação de carne de animais com cisticercose: 0-5 cisticercos, congelamento a -5°C/350h ou a -15°C/ 145h; 6-20 cisticercos, enlatados (120°C/1h); mais de 20 cisticercos, condenação total. A carne suína mal cozida representa a base para se completar o ciclo de T. solium, daí a importância do papel do médico veterinário frente à inspeção da referida carne em matadouros, inclusive dos embutidos como lingüiças (STABENOW; et. al., 1987) Para a erradicação de T. solium é necessário uma combinação de medidas de controle que incluam: melhoria na criação suína, aplicação da inspeção de carnes e da educação sanitária com melhoria dos padrões sanitários da população humana (ARRUDA; et. al., 1990). 2.4.7 Medidas de controle Medidas de controle devem ser feitas principalmente em regiões endêmicas. O foco do complexo teníase/cisticercose pode ser definido por unidades habitacionais onde estão presentes indivíduos com sorologia positiva para cisticercose, indivíduos com teníase, indivíduos eliminando proglótides, indivíduos com sintomatologia nervosa suspeitas de cisticercose e regiões onde existem criações de suínos ou bovinos. São incluídos no mesmo foco famílias que tenham tido contato e risco de contaminação. Uma vez identificado o foco, os indivíduos deverão receber tratamento com medicamento específico. Uma das medidas mais eficazes no controle da teníase/cisticercose é a promoção de extenso e permanente trabalho educativo da população nas escolas e nas comunidades. A aplicação prática dos princípios básicos de higiene pessoal e o conhecimento dos principais meios de contaminação constituem medidas importantes de profilaxia. O trabalho educativo da população deve visar à conscientização, ou seja, ao corte dos hábitos e costumes inadequados e à adoção de novos, mais saudáveis, por opção pessoal. A fiscalização da carne visa reduzir ao menor nível possível a comercialização ou o consumo de carne contaminada por cisticercose e orientar os produtores sobre medidas de aproveitamento da carcaça. A fiscalização de produtos de origem vegetal também deve ser realizada. Produtos originários de hortas ou pomares irrigados com água de rios e córregos que recebem esgoto devem ser retirados do varejo. Da mesma maneira deve ser fiscalizado e coibido os sistemas de produção animal onde o acesso a dejetos humanos é praticado por falta de saneamento. Com base nos conhecimentos atuais, a erradicação das tênias, T. solium e T. saginata, é perfeitamente possível pelas seguintes razões: os ciclos de vida necessitam do homem como hospedeiro definitivo; a única fonte de infecção para os hospedeiros intermediários pode ser controlada; não existe nenhum reservatório selvagem significativo; existem drogas seguras e eficazes para combater a teníase. É importante informar ás pessoas para evitar a contaminação fecal do solo, da água e dos alimentos destinados ao consumo humano e animal e não utilizar águas servidas para a irrigação das pastagens e cozinhar totalmente as carnes de suínos e bovinos. Identificar e tratar, imediatamente, os indivíduos infectados com a T. solium para evitar a cisticercose, tomando precaução autocontaminação, bem como seus contatos. para Outros proteger métodos os pacientes para prevenir da o consumo de carnes contaminadas são congelar a carne suína e bovina a temperatura abaixo de –5° C, por um mínimo de 04 dias; ou irradiar a 1 Kgy?, a fim de que os cisticercos sejam destruídos eficazmente. Sempre submeter as carcaças à inspeção, nos abatedouros de suínos e bovinos, dando-lhes destinos adequados conforme os níveis de contaminação: condenação total, parcial, congelamento, irradiação ou envio para as indústrias de reprocessamento. Não há necessidade de isolamento de indivíduos com cisticercose ou portadores de teníase. Para os portadores de teníase, entretanto, recomenda-se medidas para evitar a sua propagação: tratamento específico, investir na educação em saúde promovendo mudanças de hábitos, como a lavagem das mãos após defecar e antes de comer, investigar os contatos e as fontes de infecção e informar à autoridade sanitária local O controle da infecção por T. solium deve basear-se no tratamento dos dejetos humanos contaminados e em medidas de saneamento básico, afim de que os suínos não tenham acesso a esses dejetos (SOBESTIANSKY, 1999). A medida básica para prevenção e erradicação das teníases consiste em assegurar sempre um destino adequado aos dejetos humanos, impedindo a contaminação do solo com proglótides e ovos de T. solium e, conseqüentemente a infecção dos hospedeiros intermediários. A vacinação vem sendo objeto de estudos como uma alternativa de controle da cisticercose suína. 3. CONCLUSÃO Apesar do conhecimento adquirido a respeito do complexo teníase-cisticercose, ainda é grande o número de indivíduos e animais contaminados, indicando que medidas de controle devem ser priorizadas pelos governos nos níveis federal, estadual e municipal, particularmente nos países em desenvolvimento. Tais programas devem ter por objetivo conscientizar a população sobre hábitos de higiene e intensificar a fiscalização da carne suína e bovina e propiciar condições de saneamento básico adequados a toda população. Cumpre ressaltar que o homem ao contaminar o ambiente possibilita a continuidade do ciclo biológico dessa importante zoonose e consequentemente se torna a principal fonte de infecção. Torna-se não só o responsável pela sua transmissão aos animais e a si próprio como também pela comercialização clandestina ainda muito presente nos países em desenvolvimento, como o Brasil. A fiscalização, ao orientar os produtores sobre medidas de aproveitamento da carcaça (salga, congelamento, graxaria, conforme a intensidade da infecção), pode reduzir a perda financeira e aumentar o consumo na medida que proporciona mais segurança ao consumidor. A imunização de suínos em países com alta taxa de cisticercose pode resolver sérios problemas de perdas na produção animal e promover queda nas taxas de teníase e de cisticercose humanas (MOLINARI et. al., 1983). 3. REFERÊNCIAS BIBLIOGRÁFICAS AGAPEGEV, S. Incidência de cisticercose em Botucatu (SP). Estudo Clínico e Patológico. I Encontro Cone-Sul Teníase/Cisticercose – Seminário LatinoAmericano sobre Teníase/Cisticercose. Curitiba – PR, 1994. ARRUDA, W. O.; CAMARGO, N.J.; COELHO,R.C. Neurocysticercosis: na epidemiological survey in two small rurar communities. Arq. Neuro-Psiquiat., São Paulo. v.48,n.4,p.419-424, 1990. BIONDI, O.F.; et al. Immunodiagnosis of swine cysticercosis by indirect ELISA employing a heterologous antigen from Taenia crassiceps metacestode. Vet. Parasitol., v.64, p.261-266, 1996. BRASIL. Ministério da Agricultura. Regulamento de inspeção industria e sanitária de produtos de origem animal. Brasília, DF, 1980. Aprovado pelo decreto 30.691 de 29/03/52 e alterado pelo decreto 1.255 de 25/06/1962. BROTTO, W. Aspectos neurológicos da cisticercose. Arq Neuropsiquitr, v. 5, p. 258294, 1947. CAPUANO, D.M.; et al. Busca ativa de teníase e de outras endoparasitoses em manipuladores de alimentos no município de Ribeirão Preto, SP, Brasil. Rev. Inst. Adolfo Lutz, v.61, p.33-38, 2002. CARVALHO, R. W.; et al. A Neurocisticercose Humana na Baixada Fluminense, Estado do Rio de Janeiro, Brasil. Rev. Arquivo Neuropsiquiatria, 2005, 63(4): p.10581062. ISSN 0004-282X CIIENG, T.C. History of parasitology. In: The Biology of animal parasites. Philadelphia: WB Sounders. 1964; 2:29-42. COSTA-CRUZ JM, ROCHA A, SILVA AM, et al. Ocorrência de cisticercose em necropsias realizadas em Uberlância, Minas Gerais, Brasil. Arq Neuropsiquiatr 1995;53:227-232. DE ALUJA, A. S.; et al. Experimental Taenia solium cysticercosis in pigs: characteristics of the infection and antibody response. Vet. Parasitol., v. 61, p. 49-59, 1996. DEL BRUTTO et al. Sex-related severity of inflammation in parenchymal brain cysticercosis. Arch. Intern. Med., v.148, p.544-546, 1988 DEL BRUTTO. O.H.; SOTELO, J. Neurocysticercosis: Na update. Reviews of Infectious Diseases. v.10.p. 1075-1087. 1988. DORNY, P; BRANDT, J; ZOLI, A; GEERTS, S. Immunodiagnostic tools for human and porcine cysticercosis. Acta Tropica 00, p. 1-8, 2003. EV, L.V.; MAIA, A.A.M.; PIANETTI, G. et al. Imunological evaluation of a 26-kDa antigen from Taenia solium larvae for specific immunodiagnosis of human neurocysticercosis. Parasitol. Res., v.85, p.98-102, 1999 FLISSER, A. Neurocysticercosis in México. Parasitology Today, vol. 4, p. 131137,1988. FLISSER, A.; GONZALEZ, D.; PLANCARTE, A. et al. Praziquantel reatment of brain and muscle porcine Taenia solium cysticiercosis. 2 - immunological and cytogenetic studies. Parasitol. Res., v.76, p.640-2, 1990 FORTES, E. Parasitologia veterinária. 2ed. Porto Alegre: Sulina, 1993. 606p. FOSTER, W.D. The Cestodes. In: A History of parasitology. Edinburg: F. & S Livingstone, 1965:29-51. GONZALEZ, A.E.; et al. Prevalence and comparison of serologic assays, necropsy, and trongue examination for the diagnosis of porcine cysticercosis in Peru. Am. J. Trop. Med. Hyg., Lawrence, v.43, n.2, p. 194-199,1990. HERBERT, I.V.; OBERG. C. Cysticercosis in pigs due to infection with Taenia soliun (LINNAEUS, 1958). In: SOULSBY, E. J. L. Parasitic zoonoses, clinical and experimental studies. New York, Academic, 1974. p. 199-211. KUCHENMEISTER, F. Die in und na dem Korper dês lebenden menschen vorkommenden parasiten. Leipzig: Druck und Verlarg vou BG Teubner, 1855; 161-178. LINO, J.; et al. Ocurrence of encephalic and cardiac cysticercosis (Cysticercus cellulosae) in necropsy. Rev. Saúde Publ.; v.33, p.495-498, 1999. LINO JUNIOR, R.S.; REIS, M.A. dos; TEIXEIRA, V. De P.A. Anatomia patológica da cisticercose. HTTP:// www.mednet.com.br/instpuh/palge/cisticercose.htm. Editado em 25/03/1998. Mc GREEVY, P.B. & NETSON, G.S. Larval cestode infections. In: Strickland GT ed. Hunter’s Tropical Mediche, Philadelphia: WB Sounders, 1991 a 834-46. MENDES, E C.; SILVA, SCINTILLA S.; FONSECA, E. A. LA TEREZA; SOUZA, HILIANA R. R.; CARVALHO, R.W. A Neurocisticercose Humana na Baixada Fluminense, Estado do Rio de Janeiro, Brasil. Rev. Arquivo Neuropsiquiatria, 2005, 63(4): p.10581062. ISSN 0004-282X MOLINARI, J. L.; et al. Taenia soliun:immunity in hogs to the cysticercus. Exp.Parasit. New York, v. 55,p. 340- 357,1983. MONTEIRO LL (2004) Antígenos de larvas de T. crassicepse T. solium em teste ELISA para diagnóstico dacisticercose bovina. Dissertação de mestrado.Universidade Federal de Viçosa. 80p. MONTEIRO, L.L.; SANTOS, L.A.G.; TEODORO, V.A.M.; GUIMARÃES, K.R.; PINTO, P.S.A; BEVILACQUA, P.D. Aplicação de imunoensaios no diagnóstico de doenças veiculadas por produtos de origem animal. Higiene Alimentar, São Paulo, v.18, n. 123, p. 23-29, 2004. MORAES, R.G.; LEITE, I.C.; GOULART, E.G.. Parasitologia Médica. Atheneu S.A., p. 204, 1971. São Paulo; OPAS. Epidemiologia y control de la teníase / cisticercosis en América Latina. Versão 3.0 Washington Organização Panamericana de Saúde: 1994. ORGANIZATION PANAMERICANA DE LA SALUD. Epidemiologia y control de la teniasis/cisticercosis en America Latina. Washington: OPS/OMS, 1994, 297 p. PAWLOWSKI, Z. S. Teniasis and cysticercosis. In: STEELE, J.H. Handbook series in zoonoses: parasitic zoonoses. Boca Ratón: crc, 1982.P.313-348. PESSOA, S.B.; MARTINS A.V. Classe Cestoídea. Histórico, morfologia e sistemática. In: Parasitologia médica, Rio de Janeiro; Guanabarakoogan, 1988, 433-42. PFUETZENREITER, M.R. Aspectos sócio-culturais e econômicos de pacientes com diagnóstico preliminar de cisticercose cerebral em Lages, SC. Rev. Inst. Ciênc. Saúde. v.15, p.78-79, 1997. PINTO, P.S.A; VAZ, A.J; GERMANO, P.M.L; NAKAMURA, P.M. Performance of the ELISA test for swine cysticercosis using antigens of Taenia solium and taenia crassiceps cysticerci. Veterinary Parasitology 88, p.127-300, 2000. REY, L. Parasitologia. Rio de Janeiro: Guanabara Koogan, 1991. REY, L. Parasitologia. Rio de Janeiro: Guanabara Koogan, 1973, 695p. ROPPA, L. Carne Suína: Mitos e Verdades. [online] [citado 06 Janeiro 2006]. Disponível na World Wide Web: <http://www.abipecs. org.br/mitos_verdades.pdf>. SAIZ MORENO, B. Historiografia dos importantes zoonosis. Triquinosis y lepra (cisticercosis porcina). II. Lepra Del cerdo y/o cisticercosis Porcina. Ver. San. Hig. Publ., 1987; 61:1147-58. SANTAMARIA, E.; PLANCARTE, A.; ALUJA, A.S. The experimental infection of pigs with different numbers of Taenia solium eggs: immune response and efficiency of establishment. J. Parasitol., v.88, p.69-73, 2002. SANTOS, I.F. Diagnóstico da cisticercose bovina em matadouros: novas técnicas de exame e esôfagos e diafragma. São Paulo, 1984, 127 p. Tese (Doutorado) Faculdade de Saúde Pública, Universidade de São Paulo. SANTOS, I. F. Diagnóstico da cisticercose bovina em matadouro, II – exame do diafragma. Arquivo Fluminense de Medicina Veterinária, v. 2 n. 3, p. 72-78. 1987. SANTOS, i. f. O Cysticercus bovis (forma larvar da Taenia saginata) pode infectar o homem? Higiene Alimentar, v.10, n. 44, p. 13-14. 1996. SANTOS, I. F. Nova técnica de exame do coração na rotina de Inspeção da Cisticercose Bovina. Niterói, R. J. : UFF, 1975. Tese (Mestrado em Medicina Veterinária) – Faculdade de Medicina Veterinária Universidade Federal Fluminense, 1975. SARTI, G, E.; SCHANTZ, P. M.; AGUILLERA, J.; LOPEZ, A . Epidemiologic observations on porcine cysticercosis in a rural community of Michoacan state, Mexico. Veterinary Parasitology 41, p. 195-201, 2002. SILVA-VERGARA, M. L.; VIEIRA, C. O.; CASTRO, J. H..; MICHELETTI, L.G.; OTAÑO, A. S.; FRANQUINI Jr., J.; CABRAL, M.; LEBOREIRO, A.; MARQUES, J. O.; SOUZA, W. F., COSTA-CRUZ, J. M.; PRATA, A. Achados neurológicos e laboratoriais em população de área endêmica para teníase-cisticercose, Lagamar, MG, Brasil. (1992-1993). Rev. Inst. Med. Trop. S. Paulo, 36:335-42, 1994. SMITH, H.J.; SNOWDON, K.E.; FINLAY, R.C. Serological diagnosis of Cysticercosis by an Enzyme-linked Immunossorbent assay in experimentally infected cattle. Vet. Res., v.55, p.274-276, 1991. SOARES, K. A. et al., Imunodiagnóstico da cisticercose em suíno experimentalmente infectado com ovos de Taenia solium, utilizando antígenos de escolex de Cysticercus cellulosae. Arq. Brás. Méd. Vet. Zootec., v.58, n.1, p.15-20, 2006 SOBESTIANSKY, J. Clínica e Patologia Suína. 2ed. Goiânia. 1999. 464p. SCIUTTO, E; MARTINEZ, J.J; VILLALOBOS, N.M; HERNANDEZ, M; JOSE, M.V; BELTRAN, C; RODARTE, F; FLORES, I; BOBADILLA, J.R; FRAGOSO, G; PARKHOUSE, M.E; HARRISON, L.J.S; DE ALUJA, A.S. Limitations of current diagnostic procedures for the diagnosis of Taenia solium cysticercosis in rural pigs. Veterinary Parasitology 79, p. 299-313, 1998. TAKAYANAGUI, O.M. Aspectos Clínicos da neurocisticercose: análise de 500 casos. Dissertação de Mestrado. Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, Ribeirão Preto 1980. TAKAYANAGUI, O. M. (1990). Neurocisticercose: evolução clinicolaboratorial de 151 casos. Arquivos de Neuropasiquiatria, 48, 1-10 TAVARES JÚNIOR, A.R. (1994). Aspectos neuropsiquiátricos da neurocisticercose humana. Tese de Doutorado. Escola Paulista de Medicina. TAVARES JUNIOR, A.R.. Alguns comentários sobre a história da cisticercose e dos seus transtornos neuropsiquiátricos. Revista médica. Minas Gerais. V. 5, n. 2 abr/jun. 1995. TERRA, V.C. Takayanagui AMM. Notificação compulsória da cisticercose em Ribeirão Preto-SP. Arq Neuropsiquiatr 1996; 54:557-564. UNGAR, M.L & GERMANO, P.M.L. Bovine cysticercosis prevalence in the state of Sao Paulo, Brazil. Revista de Saúde Pública 26 (3), p. 167-172, 1992. URQUHART, G.M.; ARMOUR, J.; DUNCAN, J.L.; DUNN, A.M.; JENNINGS, F.W. Parasitologia veterinária. Rio de Janeiro: Guanabara Koogan, 1987. 306p. VERONESI, R.; FRANÇA NETTO, A.S.; FOCACIA, R. Doenças Infecciosas e Parasitárias. 8ed. Editora Guanabara-Koogan. Rio de Janeiro, p. 820-821,1991. VIANNA, LG, MACEDO, V., COSTA, JM. Cisticercose músculo-cutânea e visceral doença rara. Revista do Instituto de Medicina Tropical de São Paulo, v.33, 2004. VILLA, M. F. G. Situação epidemiológica do complexo teníase/cisticercose como problema de saúde pública no Brasil. Higiene Alimentar; São Paulo, v. 9 n. 36, p. 8-11, mar/abr 1995. WHO. A. Proposal to Declare Neurocysticercosis na International Reportable Disease. Geneva: WHO, 2000. YANEZ, G.C. Zoonoses de importância para a economia e saúde pública. In: REUNIÃO INTERAMERICANA, SOBRE SAÚDE E AGRICULTURA. 12., 2001, São Paulo. Anais... São Paulo: OPAS, 2001.
Download