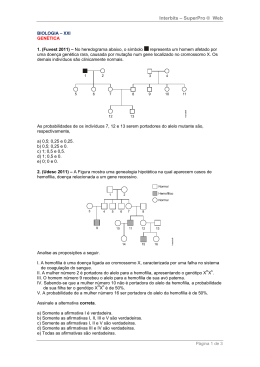
MÔNICA BOTKE OLDRA ABORDAGEM FISIOTERAPÊUTICA NO TRATAMENTO E NA PREVENÇÃO DAS HEMARTROSES EM HEMOFÍLICOS: REVISÃO SISTEMÁTICA Cascavel 2003 MÔNICA BOTKE OLDRA ABORDAGEM FISIOTERAPÊUTICA NO TRATAMENTO E NA PREVENÇÃO DAS HEMARTROSES EM HEMOFÍLICOS: REVISÃO SISTEMÁTICA Trabalho de Conclusão de Curso apresentado à Universidade Estadual do Oeste do Paraná - Campus Cascavel, para obtenção do Título de graduado em Fisioterapia. Orientador: Gustavo Kiyosen Nakayama Cascavel 2002 TERMO DE APROVAÇÃO MÔNICA BOTKE OLDRA ABORDAGEM FISIOTERAPÊUTICA NO TRATAMENTO E NA PREVENÇÃO DAS HEMARTROSES EM HEMOFÍLICOS Trabalho de Conclusão de Curso aprovado como requisito parcial para obtenção do título de graduado em Fisioterapia, na Universidade Estadual do Oeste do Paraná. ______________________________________________ Gustavo Kiyosen Nakayama – UNIOESTE (Orientador) _______________________________________________ Ceres Giacometti – UNIOESTE _______________________________________________ Gladson Ricardo Flor Bertolini – UNIOESTE Cascavel, 16 de Abril de 2003. DEDICATÓRIA Aos meus pais, Luiz e Miria, e meu irmão, Marcelo, que com seu amor e compreensão, incentivaram-me e apoiaram em todos os momentos, não somente no percurso deste trabalho, mas durante toda a minha vida. AGRADECIMENTOS A Deus Por sua misericórdia infinita, pelas bênçãos que negligenciei em agradecer, por minha existência, por sua presença em minha vida, por minha saúde, pela ciência e pela capacidade que me concedeu, possibilitando a conclusão de mais esta etapa de minha vida. Aos meu pais Obrigada por me incentivarem nos momentos de desânimo e estarem sempre prontos a me ajudar. Ao meu irmão Obrigado pelo amor de irmão e amigo. Você é parte de mim e por isso essa vitória também é sua! Não importa a distância que existe entre nós, nossos corações estarão sempre juntos! Aos meus amigos Obrigada por tudo! Obrigada pelo incentivo nas horas de dificuldade e por fazerem parte da minha vida! Ao meu orientador Obrigado pela paciência e por ter me estimulado muitas vezes para a realização deste trabalho. E a todos que direta e indiretamente contribuíram para a realização deste trabalho. RESUMO A hemofilia é uma doença hemorrágica hereditária que afeta homens, resultante da deficiência de um fator da coagulação sanguínea. Sua manifestação clínica mais comum é a hemartrose. Embora qualquer articulação possa estar envolvida, as articulações mais afetadas são o joelho, o cotovelo e o tornozelo. Estas hemorragias podem ocorrer espontaneamente ou como resultado de um trauma. Pelo fato da hemofilia ser uma desordem da coagulação geneticamente determinada, a incidência de hemartroses pode começar cedo na vida de uma criança. As manifestações clínicas das hemartroses podem incluir edema, aumento da temperatura corporal e da pele, atrofia muscular e diminuição na amplitude de movimento da articulação. A primeira hemartrose não costuma deixar seqüelas, porém sua repetição ou cronificação resulta em alterações patológicas na articulação, como a sinovite crônica e a artropatia hemofílica. As intervenções fisioterapêuticas podem auxiliar a prevenir e tratar as seqüelas das recorrentes hemartroses, através de várias modalidades terapêuticas, incluindo a cinesioterapia, a hidroterapia e a eletrotermofototerapia. Objetivo: Verificar as evidências da ação fisioterapêutica no que diz respeito à prevenção e ao tratamento das hemartroses em pacientes hemofílicos através de uma revisão sistemática. Estratégia de busca: Foi realizada utilizando as bases de dados eletrônicas MEDLINE-PUBMED, LILACS e Biblioteca Cochrane. Critérios de seleção dos estudos: Qualquer ensaio clínico randomizado ou quaserandomizado com a utilização de qualquer intervenção fisioterapêutica utilizada na prevenção e tratamento das hemartroses. Resultados: Não foi encontrado nenhum ensaio clínico que preenchesse os critérios de inclusão, ou seja, não foi encontrado nenhum ensaio clínico randomizado ou quase-randomizado. Conclusão: Conclui-se, dessa maneira, que faltam estudos com boa qualidade metodológica para que existam evidências para embasar as intervenções fisioterapêuticas na prevenção e tratamento das hemartroses dos pacientes hemofílicos. Palavras-chave: hemofilia, hemartroses, fisioterapia, ensaio clínico randomizado. SUMÁRIO 1 2 2.1 2.1.1 2.1.2 2.1.3 2.1.4 2.2 2.2.1 2.2.2 2.2.3 2.2.4 2.2.4.1 2.2.4.2 2.2.4.3 2.3 2.3.1 2.3.2 2.3.3 2.3.3.1 2.3.3.2 2.3.3.3 2.3.3.4 2.3.3.5 2.3.3.6 2.3.3.7 2.4 2.4.1 2.5 2.5.1 2.5.2 2.6 2.6.1 2.6.2 2.6.3 2.6.4 2.6.5 LISTA DE FIGURAS............................................................................... 8 LISTA DE QUADROS............................................................................. 9 INTRODUÇÃO.......................................................................................... 10 REVISÃO DE LITERATURA................................................................. 12 HEMOSTASIA............................................................................................ 12 Fase Vascular............................................................................................... 12 Fase plaquetária........................................................................................... 13 Fase coagulante............................................................................................ 13 Fase da fibrinólise........................................................................................ 13 MECANISMO DE COAGULAÇÃO SANGUÍNEA................................. 14 Conversão da protrombina em trombina..................................................... 14 Conversão do fibrinogênio em fibrina – formação do coágulo................... 15 Ciclo vicioso da formação do coágulo......................................................... 16 Início da coagulação: formação do ativador da protrombina...................... 17 Mecanismo extrínseco para o início da coagulação.................................... 19 Mecanismo intrínseco para o início da coagulação..................................... 21 Interação entre as vias extrínsecas e intrínsecas.......................................... 23 HEMOFILIAS............................................................................................. 24 Hemofilia A................................................................................................. 24 Hemofilia B................................................................................................. 26 Outras deficiências de fator......................................................................... 26 Deficiência de Protrombina (Fator II)......................................................... 26 Deficiência do Fator V................................................................................. 27 Deficiência do Fator VII.............................................................................. 27 Deficiência do Fator X................................................................................. 27 Deficiência do Fator XI............................................................................... 28 Deficiência do Fator XIII............................................................................. 28 Doença de von Willebrand.......................................................................... 28 GENÉTICA................................................................................................. 30 Padrões de herança recessiva ligada ao X................................................... 30 DIAGNÓSTICO.......................................................................................... 32 Testes laboratoriais...................................................................................... 32 Diagnóstico por imagem.............................................................................. 33 MANIFESTAÇÕES CLÍNICAS................................................................. 37 Hematomas subcutâneos e intramusculares................................................. 38 Hemorragia gastrointestinal e genitourinária............................................... 39 Hemartroses................................................................................................. 39 Hemorragia do sistema nervoso................................................................... 40 Síndrome da dor regional complexa............................................................ 40 2.7 2.7.1 2.7.2 2.7.3 2.7.4 2.7.5 2.7.6 2.8 2.8.1 2.8.1.1 2.8.2 2.8.2.1 2.8.2.2 2.8.2.3 2.8.2.4 2.8.2.4.1 2.8.2.4.2 2.8.2.4.3 2.8.2.4.4 2.8.2.5 2.8.2.6 2.8.2.7 3 3.1 3.2 3.3 3.3.1 3.3.2 3.3.2.1 3.4 4 5 6 HEMARTROSES........................................................................................ 41 Hemartrose do Ombro................................................................................. 45 Hematrose do Cotovelo............................................................................... 46 Hemartrose de punho e mão........................................................................ 47 Hemartrose do quadril................................................................................. 47 Hemartrose do joelho................................................................................... 48 Hemartrose de tornozelo e pé...................................................................... 49 TRATAMENTO.......................................................................................... 50 Reposição de Fator...................................................................................... 50 Reposição de Fator - Tratamento profilático............................................... 51 Tratamento Fisioterapêutico........................................................................ 52 Cinesioterapia.............................................................................................. 53 Imobilização................................................................................................ 57 Crioterapia................................................................................................... 58 Correntes elétricas....................................................................................... 58 Correntes Contínuas (galvanização e iontoforese)...................................... 59 Correntes diadinâmicas................................................................................ 59 Estimulação Nervosa Elétrica Transcutânea (TENS)................................. 59 Correntes excitomotoras ............................................................................. 59 Ultra-som (US)............................................................................................ 60 Diatermia por Ondas Curtas Pulsada (DOCP)............................................. 60 Hidroterapia................................................................................................. 60 METODOLOGIA........................................................................................ 62 Critérios de inclusão dos estudos................................................................. 63 Estratégia de busca para identificação dos estudos..................................... 63 Análise dos dados........................................................................................ 65 Análise da qualidade dos estudos................................................................ 65 Análise estatística: metanálise..................................................................... 67 Análise da sensibilidade.............................................................................. 67 Apresentação dos resultados........................................................................ 68 RESULTADOS.......................................................................................... 70 DISCUSSÃO.............................................................................................. 71 CONCLUSÃO............................................................................................ 72 REFERÊNCIAS BIBILIOGRÁFICAS................................................... 73 LISTA DE FIGURAS Figura 1 Esquema da conversão de protrombina em trombina e da polimerização do fibrinogênio para formar as fibras de fibrina........................................... 15 Figura 2 Via extrínseca para o início da coagulação sanguínea.................................. 20 Figura 3 Via intrínseca para o início da coagulação sanguínea................................... 22 Figura 4 Homem afetado X Mulher normal - Xh Y x XH XH ..................................... 31 Figura 5 Homem normal X Mulher portadora - XHY x XH Xh.................................... 31 Figura 6 Secção longitudinal ultrasonográfica de um joelho com sinovite hemofílica crônica. Note o espessamento sinovial (T), patela (P), fêmur (F).................................................................................................................. 36 Figura 7 Imagem de ressonância magnética de um tarso hemofílico de um menino de 8 anos mostrando um grau severo de sinovite hipertrófica.................... 36 Figura 8 Sinóvia do joelho de um menino de 9 anos com uma história de recorrentes hematroses há 20 meses. Note a formação de vilosidades, aumento da vascularização e infiltrado de células inflamatórias.................. 43 Figura 9 Progressão da artropatia do joelho. Uma série de visões do mesmo paciente com diferentes idades, com 8 anos, 14 e 30 anos........................... 44 Figura 10 Radiografias mostrando mudanças progressivas na articulação do cotovelo como resultado de hemartroses recorrentes. (A) radiografia lateral do cotovelo esquerdo de um pacientes de 11 anos, mostrando osteopenia, formação de cisto subcondral, estreitamento do espaço da cartilagem, e irregularidade da epífise radial; (B) radiografia lateral de um cotovelo do paciente com 22 anos mostrando severa artropatia, incluindo estreitamento do espaço articular e formação de osteófito........................... 45 Figura 11 Ossificação acelerada da cabeça do rádio no cotovelo esquerdo com a articulação contralateral em um menino de 6 anos de idade com hemofilia A severa......................................................................................................... 47 Figura 12 Alargamento da fossa olecraniana em um menino de 14 anos com hemofilia B severa......................................................................................... 47 Figura 13 Crescimento acelerado e osteopenia em um menino de 6 anos com severa hemofilia A. No lado esquerdo afetado, as epífises femoral e tibial estão aumentadas em tamanho e estão osteopênicas.............................................. 49 Figura 14 Progressão da artropatia no tornozelo de um menino de 14 anos. Note a evolução de um osteófito anterior proeminente............................................ 50 LISTA DE QUADROS Quadro 1 Fatores de coagulação no sangue e seus sinônimos....................................... 18 Quadro 2 Classificação radiológica baseada em pontuações......................................... 35 1 INTRODUÇÃO A hemofilia, uma doença hemorrágica hereditária com padrão recessivo que afeta homens, resulta de uma deficiência de um específico fator de coagulação e produz grandes alterações no sistema músculo-esquelético. Na hemofilia clássica, ou hemofilia A, existe a deficiência do fator VIII, e na doença de Christmas, ou hemofilia B, a deficiência é do fator IX (KOCK et al., 1982). Somente estas duas moléstias estão associadas a sangramento articular importante (BATTISTELLA et al., 1985). Segundo Soucie et al. (1998), a prevalência total da hemofilia é usualmente estimada entre 1:5.000 e 1:10.000 homens. A hemofilia é classificada com leve, moderada e grave dependendo do nível de fator circulante. Um paciente com hemofilia severa pode sangrar espontaneamente, enquanto um com hemofilia leve ou moderada geralmente tem uma história de trauma que produz hemorragia em uma articulação (KOCK et al., 1982). Enquanto as hemofilias leve e moderada não são sempre diagnosticadas durante a infância, a hemofilia severa é geralmente diagnosticada em uma idade bastante precoce. Nos últimos anos, o diagnóstico e tratamento da hemofilia têm tido grande avanço. Enquanto a literatura dos anos sessenta refere que apenas 10% dos hemofílicos eram diagnosticados no primeiro mês de vida, a situação hoje tem mudado devido aos métodos diagnósticos sofisticados. Diagnóstico e tratamento precoces são necessários para evitar destruição articular (POLLMANN et al., 1999). O sangramento, a hemorragia, é a manifestação clínica mais importante desta moléstia e é no aparelho locomotor que aparece com maior freqüência (BATTISTELLA et al., 1995). As manifestações clínicas da hemartrose hemofílica são semelhantes a qualquer hemartrose: distensão, dor e impotência funcional. A dor decorre da irritação que o sangue produz na sinovial, da distensão brusca das partes moles que são ricamente inervadas. A hemartrose colocará a articulação em posição de maior distensibilidade, geralmente em flexão, para poder diminuir a relação conteúdo/continente. Isto acarreta diminuição da amplitude articular com impotência funcional. Quando o quadro persiste, aparece a atrofia muscular (BATTISTELLA et al., 1995). De acordo com Gal e Nagata (1985), a primeira hemartrose não costuma deixar seqüelas; sua repetição ou cronificação resulta numa articulação quente e indolor, com sinóvia hipertrófica e muito vascularizada (sinovite crônica hemofílica), favorecendo a reincidência da hemartrose. A evolução natural mostrará o espessamento sinovial, a fibrose dos tecidos, a destruição e remodelação progressiva da cartilagem e dos ossos, que determinam as deformidades (GAL E NAGATA, 1985). Esta situação, acrescida da instabilidade, caracteriza a artropatia hemofílica (BATTISTELLA et al., 1985). O tratamento da hemartrose consiste na infusão imediata de fator VIII ou IX ao primeiro sinal de hemorragia articular (BRETTLER et al., 1995). A dosagem do fator dependerá de vários fatores. Entre eles estão a severidade do sangramento, a localização do sangramento e a idade do paciente. A dose inicial varia de 20 a 70 IU por Kg de peso corporal (BIOTEST, 1998). Nos últimos anos um dos maiores debates no que se refere à hemofilia tem sido a aplicação de fator VIII ou IX de modo profilático para garotos hemofílicos severamente afetados a partir de pouca idade (LIESNER et al., 1996). Esta aplicação é realizada 2 ou 3 vezes por semana, iniciando com 1 ou 2 anos de idade e tendo o objetivo de transformar uma hemofilia severa em moderada, evitando o desenvolvimento de uma artropatia (ASTERMARK et al.,1999; LÖFQVIST et al., 1997). A fisioterapia é parte importante no tratamento global do portador de hemofilia, já que este se encontra facilmente predisposto a adquirir graves seqüelas em seu sistema músculoesquelético no decorrer de suas atividades cotidianas (RIBEIRO e SOARES, 1986). Pode estar atuando na prevenção e no tratamento da fase aguda, subaguda e crônica das hemartroses, utilizando diversas modalidades terapêuticas, como a cinesioterapia, a eletrotermofototerapia e a hidroterapia. A revisão sistemática corresponde ao nível mais alto no que se refere à evidência em pesquisas, sendo um método de situalização, avaliação e sintetização de evidências. Esta revisão sistemática tem o objetivo de verificar as evidências da ação fisioterapêutica no que diz respeito à prevenção e ao tratamento das hemartroses em pacientes hemofílicos. 2 REVISÃO DE LITERATURA Para um melhor entendimento do mecanismo envolvido na hemofilia serão descritos inicialmente os acontecimentos normais que ocorrem na hemostasia e na coagulação sanguínea. Em seguida serão descritos os aspectos específicos da hemofilia, como sua herança genética, tipos de hemofilia e manifestações clínicas, dando ênfase às hemartroses e o tratamento fisioterapêutico, os quais são o foco principal deste estudo. 2.1 HEMOSTASIA Entende-se por hemostasia o fenômeno fisiológico dinâmico, que mantém o sangue fluindo no interior dos vasos e impede a saída do sangue do interior dos vasos (AIRES, 1991). Sempre que um vaso é lesionado ou rompido, a hemostasia é alcançada por vários mecanismos, incluindo espasmo vascular, formação de tampão plaquetário, formação de um coágulo sanguíneo como resultado da coagulação sanguínea e eventual crescimento de tecido fibroso para dentro do coágulo sanguíneo para fechar permanentemente a lesão no vaso (GUYTON e HALL, 1997). A partir destes mecanismos pode-se considerar a hemostasia dividida em quatro fases ou etapas interligadas: fase vascular, fase plaquetária, fase coagulante e fase da fibrinólise (AIRES, 1991). 2.1.1 Fase Vascular Imediatamente após um vaso sanguíneo ser cortado ou rompido, o estímulo do trauma provoca a contração da parede do vaso; isto, instantaneamente, reduz o fluxo de sangue a partir do vaso rompido. A contração é resultado de reflexos nervosos, espasmo miogênico local e fatores humorais locais provenientes dos tecidos traumatizados e plaquetas. A maior parte da vasoconstrição provavelmente é resultado da contração miogênica local dos vasos sanguíneos iniciada pela lesão direta na parede vascular. Para vasos menores, as plaquetas são as responsáveis pela maior parte da vasoconstrição ao liberar a substância vasoconstritora tromboxano A2. Quanto mais o vaso é traumatizado, maior é o grau de espasmo. Este espasmo vascular local pode permanecer durante muitos minutos ou mesmo horas, tempo para que os processos subseqüentes de tamponamento plaquetário e coagulação sanguínea possam se realizar (GUYTON e HALL, 1997). 2.1.2 Fase plaquetária Dentro de segundos após o dano vascular, as plaquetas, pequenas células sem núcleo do sangue circulante, aderem ao local danificado e empilham-se, umas sobre as outras, para formar um tampão mecânico que, efetivamente, detenha os sangramentos dos danos pequenos. A hemorragia dos ferimentos maiores é estancada pela coagulação do sangue (BERNE e LEVY, 1996). Segundo Aires (1991), é importante a presença do fator von Willebrand, presente no endotélio vascular, para a aderência e agregação plaquetária, bem como tromboxano A2, liberado da plaqueta estimulada. O vaso, por sua vez, para modular a agregação plaquetária, libera a prostaciclina, que tem ação antiagregante. 2.1.3 Fase coagulante O terceiro mecanismo da coagulação sanguínea é a formação do coágulo sanguíneo. O coágulo começa a se desenvolver em 15 a 20 segundos, se o trauma da parede vascular for grave; e em 1 a 2 min, se o trauma for menor. Substâncias ativadoras oriundas da parede vascular traumatizada e das plaquetas e proteínas sanguíneas aderem à parede vascular traumatizada, iniciando o processo de coagulação (GUYTON e HALL, 1997). Os mecanismos da coagulação e seus componentes serão esclarecidos com maior profundidade em um outro tópico, devido à sua relevância para uma melhor compreensão dos mecanismos envolvidos na hemofilia. 2.1.4 Fase da fibrinólise Segundo Guyton e Hall (1997), uma vez que o coágulo sanguíneo tenha sido formado, ele pode seguir um dos dois caminhos: pode ser invadido por fibroblastos que, subseqüentemente, formam tecido conjuntivo dentro de todo o coágulo, ou pode dissolver-se. O caminho usual para um coágulo que se forma numa lesão pequena da parede vascular é a invasão por fibroblastos, começando dentro de poucas horas após o coágulo estar formado (o que é parcialmente provocado pelo fator de crescimento secretado pelas plaquetas). Isto continua até a complexa organização do coágulo em tecido fibroso dentro de cerca de uma a duas semanas. Por outro lado, quando o sangue forma um coágulo grande, assim como o sangue que extravasou para os tecidos, substâncias especiais dentro do coágulo tornam-se ativadas, funcionando como enzimas que o dissolvem. 2.2 MECANISMO DE COAGULAÇÃO SANGUÍNEA. Segundo Robbins et al. (1996), o sistema de coagulação compreende essencialmente, uma série de transformações de pró-enzimas em enzimas ativas que culmina na formação da trombina, que converte o fibrinogênio solúvel em fibrina, proteína fibrosa insolúvel. Mais de 50 substâncias importantes que participam da coagulação sanguínea foram encontradas no sangue e tecidos, algumas promovendo a coagulação, chamadas de prócoagulantes, e outras a inibindo, chamadas de anticoagulantes. Se o sangue coagulará ou não, isto depende do equilíbrio entre estes dois grupos de substâncias. Normalmente, os anticoagulantes predominam, e o sangue não coagula; mas quando um vaso é rompido, os pró-coagulantes na área da lesão tornam-se ativados e sobrepõem aos anticoagulantes, e então o coágulo se desenvolve (AIRES, 1991). De acordo com Guyton e Hall (1997) a coagulação ocorre em três etapas essenciais: primeiro, em resposta à ruptura do vaso ou dano ao próprio sangue, ocorre uma cascata complexa de reações químicas no sangue, envolvendo mais de uma dúzia de fatores de coagulação sanguínea. O resultado é a formação de um complexo de substâncias ativadas, chamado de ativador da protrombina. Segundo, o ativador da protrombina catalisa a conversão da protrombina em trombina. E por último, a trombina age como uma enzima que converte o fibrinogênio em fibras de fibrina, e estas envolvem as plaquetas, os glóbulos sanguíneos e o plasma para formar o coágulo. Primeiramente serão descritos os eventos que ocorrem na conversão da protrombina em trombina e do fibrinogênio em fibrina, e depois a formação do ativador da protrombina, que tem grande importância para o entendimento dos mecanismos básicos envolvidos na hemofilia. 2.2.1 Conversão da protrombina em trombina Conforme Guyton e Hall (1997), após a formação do ativador da protrombina como resultado da ruptura do vaso sanguíneo ou como resultado de uma falha nas substâncias ativadoras especiais no sangue, o ativador da protrombina, na presença de quantidade suficiente de Ca++ iônico, promove a conversão de protrombina em trombina (Fig.1). A trombina, por sua vez, causa polimerização das moleculares de fibrinogênio em fibras de fibrina dentro de 10 a 15 s. Protrombina Ativador da protrombina Ca++ Trombina Fibrinogênio Monômeros de fibrinogênio Ca++ Fibras de fibrina Trombina – ativada fator estabilizador de fibrina (XIIa) Rede de fibras de fibrina Figura 1. Esquema da conversão de protrombina em trombina e da polimerização do fibrinogênio para formar as fibras de fibrina. Fonte: GUYTON, A. C.; HALL, J.E. Tratado de Fisiologia Médica. 9. ed. Rio de Janeiro: Guanabara Koogan, 1997. As plaquetas também têm um papel importante na conversão da protrombina em trombina porque grande parte da protrombina primeiro se liga a receptores de protrombina nas plaquetas que já aderiram ao tecido danificado. Esta ligação acelera a formação de trombina a partir da protrombina, exatamente no tecido onde o coágulo é necessário (BERNE e LEVY, 1996). 2.2.2 Conversão do fibrinogênio em fibrina – Formação do coágulo. A trombina é uma enzima protéica com capacidade proteolítica. Ela age sobre o fibrinogênio removendo quatro peptídeos de baixo peso molecular de cada molécula de fibrinogênio e formando uma molécula de monômero de fibrina que tem a capacidade automática de polimerizar com outros monômeros de fibrina. Em conseqüência disto, muitos monômeros de fibrina polimerizam em segundos em longas fibras de fibrina que formam o retículo do coágulo (GUYTON e HALL, 1997). Berne e Levy (1996) colocam que nas fases iniciais desta polimerização, os monômeros de fibrina estão unidos por pontes fracas não-covalentes de hidrogênio, e as fibras recém-formadas não fazem ligações cruzadas umas com as outras; conseqüentemente, o coágulo resultante é frágil e pode ser fragmentado com facilidade. Contudo, um outro processo ocorre durante os minutos seguintes, reforçando intensamente o retículo de fibrina. Este envolve uma substância chamada de fator estabilizador da fibrina que está normalmente presente em pequenas quantidades nas globulinas plasmáticas, mas que também é liberado pelas plaquetas retidas no coágulo. O fator estabilizador da fibrina precisa ser ativado antes de atuar sobre as fibras de fibrina. A mesma trombina que estimula a formação de fibrina também ativa o fator estabilizador de fibrina. Em seguida, esta substância ativada atua como uma enzima responsável pela formação de ligações covalentes entre os monômeros de fibrina, assim como por múltiplas ligações cruzadas entre fibras adjacentes de fibrina, aumentando a força tridimensional da malha de fibrina. O coágulo sanguíneo é composto de uma rede de fibras de fibrina dispostas em todas as direções e glóbulos sanguíneos, plaquetas e plasma. As fibras de fibrina também aderem às superfícies lesadas dos vasos sanguíneos; por conseguinte, o coágulo sanguíneo torna-se aderente a qualquer orifício vascular, evitando perda sanguínea (GUYTON e HALL, 1997). Poucos minutos após a formação do coágulo, este começa a se contrair e geralmente expele a maior parte do seu líquido dentro de 20 a 60 minutos. O líquido expelido é chamado de soro porque todo o seu fibrinogênio e a maioria de outros fatores de coagulação foram removidos; desse modo, o soro difere do plasma. O soro não pode coagular porque lhe faltam estes fatores (GUYTON e HALL, 1997). As plaquetas são necessárias para que ocorra a retração do coágulo. Por conseguinte, falha na retração do coágulo é uma indicação de que o número de plaquetas no sangue circulante está baixo (GUYTON e HALL, 1997). 2.2.3 Ciclo vicioso da formação do coágulo. Uma vez iniciado o desenvolvimento do coágulo, este normalmente se prolonga para o interior do vaso em poucos minutos. Isto é, o coágulo inicia um ciclo vicioso (feedback positivo) para promover mais coagulação. Uma das mais importantes razões para isto é o fato de que a ação proteolítica da trombina permite que a mesma atue sobre muitos outros fatores da coagulação sanguínea além do fibrinogênio. Por exemplo, a trombina tem um efeito proteolítico direto sobre a protrombina, tendendo a converte-la em ainda mais trombina, e age sobre alguns fatores da coagulação sanguínea responsáveis pela formação do ativador da protrombina. Uma vez formada uma quantidade crítica de trombina, um ciclo vicioso se desenvolve e estimula mais coagulação sanguínea e mais produção de trombina; desse modo, o coágulo sanguíneo continua a crescer até que algum fator detenha o seu crescimento (GUYTON e HALL, 1997). 2.2.4 Início da coagulação: Formação do ativador da protrombina. Após a discussão sobre o processo da coagulação, deve-se retornar aos mecanismos mais complexos que iniciam a coagulação em primeiro lugar. Estes mecanismos podem ser iniciados por um trauma na parede vascular e tecidos adjacentes, alteração no sangue, ou contato do sangue com as células endoteliais lesadas ou com o colágeno e outros elementos teciduais abaixo do endotélio do vaso sanguíneo. Em cada exemplo, eles induzem a formação do ativador da protrombina, que, por sua vez, induz a conversão da protrombina em trombina e todas as etapas subseqüentes da coagulação (GUYTON e HALL, 1997). De um modo geral, considera-se que o ativador da protrombina seja formado por duas vias, a intrínseca e a extrínseca, ambas as quais convergem para o ponto onde o fator X é ativado (ROBBINS et al., 1996). A via extrínseca se inicia com o trauma da parede vascular e tecidos circunjacentes, e a via intrínseca começa no próprio sangue (GUYTON e HALL, 1997). Segundo Guyton e Hall (1997), tanto na via extrínseca como na intrínseca, uma série de diferentes proteínas plasmáticas, especialmente as beta-globulinas, desempenham papéis importantes. Juntamente com outros fatores que entram no processo de coagulação, elas são chamadas de fatores sanguíneos de coagulação, e, na maior parte são formas inativas de enzimas proteolíticas. Quando convertidas para as formas ativas, suas ações enzimáticas provocam as reações sucessivas em cascata do processo de coagulação. A maioria dos fatores de coagulação, que estão listados no Quadro 1, é designada por algarismos romanos. Quando alguém deseja indicar a forma ativa do fator, deve acrescentar a letra minúscula “a” depois do algarismo romano, tal como o Fator VIIIa para indicar o estado ativado do Fator VIII (GUYTON e HALL, 1997). Fator de Coagulação Fibrinogênio Protrombina Fator tecidual Cálcio Fator V Fator VII Fator VIII Fator IX Fator X Fator XI Sinônimos Fator I Fator II Fator III; tromboplastina tecidual Fator IV Pró-acelerina; fator lábil; Acglobulina (Ac-G) Acelerador sérico da conversão de trombina (SPCA); pró-convertina; fator estável Fator anti-hemofílico (AHF); globulina anti-hemofílica (AHG); Fator anti-A hemofílico Componente plasmático da tromboplastina (PTC); Fator Christmas Fator B anti-hemofílico Fator Stuart; fator Stuart-Prower Antecedente plasmático da tromboplastina (PTA); Fator C anti-hemofílico Fator Hageman Fator estabilizante da fibrina Fator de Fletcher Fator Fitzgerald; HMWK Fator XII Fator XIII Pré-calicreína Cininogênio de alto peso Molecular Plaquetas Quadro1. Fatores de coagulação no sangue e seus sinônimos. Fonte: GUYTON, A. C.; HALL, J. E. Tratado de Fisiologia Médica. 9. ed. Rio de Janeiro: Guanabara Koogan, 1997. Aires (1991) coloca que outros fatores ainda não figuram nesse quadro, porém tem sido comprovada a sua participação de forma direta ou indireta no mecanismo da coagulação. São os seguintes fatores: von Willebrand, proteína C, proteína S e proteína Z. O número VI não tem características físico-químicas próprias, e foi identificado como pró-fator V (AIRES, 1991). Segundo Aires (1991), praticamente todos os fatores pró-coagulantes têm origem no fígado. Entretanto, os hepatócitos só sintetizam quatro fatores de coagulação quando a vitamina K estiver presente: fator Christmas (fator IX), fator VII, fator Stuart (fator X) e protrombina (fator II). Os fatores de coagulação são glicoproteínas, com exceção da tromboplastina tecidual, que é uma fosfolipoproteína, e do fator IV, que é o cálcio (AIRES, 1991). Os fatores XIII, XII, XI, X, II e a pré-calicreína são pró-enzimas (AIRES, 1991). Três fatores coagulantes de alto peso molecular, o cininogênio, o fator anti-hemofílico (fator VIII) e proacelerina (fator V), não tiveram demonstrada qualquer atividade catalítica e parecem agir como co-fatores não-enzimáticos (BERNE e LEVY, 1996). Cada reação da via de coagulação resulta da agregação de um complexo reacional composto de uma enzima (fator de coagulação ativado), de um substrato (forma pró-enzima de um fator de coagulação) e de um co-fator (acelerador da reação). Estes componentes são agregados sobre uma superfície fosfolipídica e mantidos coesos por íons cálcio. Assim a coagulação tende a manter-se localizada em regiões onde é possível a ocorrência desta agregação, como por exemplo, na superfície de plaquetas ativadas (ROBBINS et al., 1996). Quando o trauma dilacera o revestimento vascular endotelial, o sangue entra em contato com as estruturas subendoteliais e outros tecidos danificados que ficam expostos. Isso desencadeia uma sucessão de eventos catalíticos através de uma ou outra via, ou de ambas. Em cada etapa, uma pró-enzima, que é fator de coagulação, é ativada para sua forma enzimática, na qual pode ativar a próxima pró-enzima na via. As séries de etapas enzimáticas amplificam o distúrbio original do sangue até, ao final, a trombina ser liberada explosivamente (BERNE e LEVY, 1996). Segundo Berne e Levy (1996), as enzimas que são ativadas pela via extrínseca ou intrínseca são endopeptidases (isto é clivam ligações específicas de peptídeos, que não estão localizadas nas pontas extremas das moléculas de substrato). A clivagem expõe no substrato o local do fator de coagulação responsável por sua função biológica. Com a ruptura da ligação peptídica, a cadeia do polipeptídeo é dividida em duas partes, que são mantidas juntas por uma ponte de dissulfeto. Para uma melhor compreensão, a seguir serão descritas separadamente as etapas que compõem as vias extrínseca e intrínseca para o início da coagulação. 2.2.4.1 Mecanismo Extrínseco para o início da coagulação O mecanismo extrínseco para iniciar a formação do ativador da protrombina começa com a parece vascular ou tecidos extravasculares traumatizados e ocorre de acordo com as seguintes etapas, ilustradas na Figura 2 e descritas em seguida (GUYTON e HALL, 1997). Trauma tecidual Fator tecidual VII VIIa X X ativado Ca++ Ca++ V Ativador da Protrombina Fosfolipídios Plaquetários Protrombina Trombina Ca++ Figura 2. Via extrínseca para o início da coagulação sanguínea. Fonte: GUYTON, A. C.; HALL, J. E. Tratado de Fisiologia Médica. 9. ed. Rio de Janeiro: Guanabara Koogan, 1997. Liberação de um fator tecidual - Tecidos traumatizados liberam um complexo de vários fatores chamado de fator tecidual ou tromboplastina tecidual. Este é composto especialmente de fosfolipídios das membranas dos tecidos e de um complexo lipoprotéico que contém uma importante enzima proteolítica (GUYTON e HALL, 1997). Ativação do Fator X, papel do Fator VII e do fator tecidual - O complexo lipoprotéico do fator tecidual interage com o Fator VII da coagulação sanguínea e, na presença de íons cálcio, atua enzimaticamente sobre o Fator X para formar o Fator X ativado (GUYTON e HALL, 1997). Efeito do Fator X ativado para formar o ativador da protrombina, papel do Fator V - O Fator X ativado combina-se imediatamente com os fosfolipídios teciduais, que são parte do fator tecidual, ou com fosfolipídios adicionais liberados das plaquetas, assim como com o Fator V, para formar o complexo denominado ativador da protrombina. Em poucos segundos, este quebra a protrombina para formar trombina, e o processo de coagulação continua. Inicialmente, o Fator V no complexo ativador da protrombina é inativo, mas, uma vez iniciadas a coagulação e a formação de trombina, a ação proteolítica da trombina ativa o Fator V. Este, por sua vez, torna-se um forte acelerador adicional da ativação da protrombina. Assim, no final do complexo ativador da protrombina, o Fator X ativado é a protease efetiva que promove a quebra da protrombina em trombina, o Fator V acelera intensamente esta atividade proteásica e os fosfolipídios funcionam como um instrumento que acelera ainda mais o processo (GUYTON e HALL, 1997). 2.2.4.2 Mecanismo intrínseco para o início da coagulação O segundo mecanismo que inicia a formação do ativador da protrombina e, por conseguinte, a coagulação, começa com uma alteração no sangue ou exposição deste ao colágeno do vaso sanguíneo traumatizado e se prolonga através da seguinte série de reações em cascata ilustrada na Figura 3 e descritas a seguir (GUYTON e HALL, 1997). Alteração no sangue causa ativação do Fator XII e liberação de fosfolipídios plaquetários - Alteração no sangue ou exposição do sangue ao colágeno da parede vascular modifica dois importantes fatores de coagulação no sangue: o Fator XII e as plaquetas. Quando o Fator XII entra em contato com o colágeno ou com uma superfície que pode ser molhada, tal como o vidro, ele adquire uma nova configuração que o converte em uma enzima proteolítica denominada “Fator XII ativado”. Simultaneamente, a alteração sanguínea também danifica as plaquetas devido à aderência ao colágeno ou à superfície que pode ser molhada (ou por danos de outras maneiras); isto libera o fosfolipídio plaquetário que contém a lipoproteína chamada de fator 3, o qual tem um papel subseqüente nas reações de coagulação (GUYTON e HALL, 1997). Trauma sangüíneo ou Contato com o colágeno XII XII ativado (Cininogênio HMW, pré-calicreína) XI XI ativado Ca++ IX IX ativado VIII Trombina Ca++ VIIIa X X ativado Fosfolopídios Plaquetários Trombina V Fosfolipídios Plaquetários Ativador da protrombina Protrombina Trombina Ca++ Figura 3. Via intrínseca para o início da coagulação sanguínea. Fonte: GUYTON, A. C.; HALL, J. E. Tratado de Fisiologia Médica. 9. ed. Rio de Janeiro: Guanabara Koogan, 1997. Ativação do Fator XI - O Fator XII ativado atua enzimaticamente sobre o Fator XI para ativá-lo, constituindo a segunda etapa na via intrínseca. Esta reação também requer cininogênio HMW (alto peso molecular) e é acelerada pela pré-calicreína (GUYTON e HALL, 1997). Ativação do Fator IX pelo Fator XI ativado - O Fator XI ativado age enzimaticamente sobre o Fator IX para ativar este fator também (GUYTON e HALL, 1997). Ativação do Fator X, papel do Fator VIII - O Fator IX ativado, atuando em conjunto com o Fator VIII ativado, fosfolipídios plaquetários e com o fator 3 das plaquetas traumatizadas, ativa o Fator X. Obviamente, quando Fator VIII ou as plaquetas estão em pequena quantidade, esta etapa é deficiente (GUYTON e HALL, 1997). Ação do Fator X ativado para formar o ativador da protrombina, papel do Fator V - Esta etapa na via intrínseca equivale à última etapa da via extrínseca. Isto é, o Fator X ativado combinase com o Fator V ou com os fosfolipídios teciduais ou plaquetários para formar o complexo denominador de ativador da protrombina. Por sua vez, o ativador da protrombina, em segundos, inicia a quebra da protrombina para formar trombina, desencadeando desse modo o processo final da coagulação (GUYTON e HALL, 1997). Exceto para as duas primeiras etapas da via intrínseca, os íons cálcio são necessários para promover ou acelerar todas as reações. Portanto, na ausência de íons cálcio, não ocorre a coagulação sanguínea (BERNE e LEVY, 1996). 2.2.4.3 Interação entre as vias extrínsecas e intrínsecas A partir dos sistemas intrínseco e extrínseco precedente, fica claro que, após a ruptura dos vasos sanguíneos, a coagulação se inicia por ambas as vias simultaneamente. O fator tecidual inicia a via intrínseca, enquanto o contato do Fator XII e das plaquetas com o colágeno da parede vascular inicia a via intrínseca (AIRES, 1991). Segundo Guyton e Hall (1997), uma diferença especialmente importante entre as vias extrínseca e intrínseca é que a via extrínseca pode ser de natureza explosiva; uma vez deflagrada, sua rapidez de ocorrência está limitada somente pela quantidade de fator tecidual liberada pelos tecidos traumatizados e pela quantidade de Fatores X, VII e V no sangue. Com trauma tecidual grave, a coagulação pode iniciar-se em apenas 15 s. A ocorrência da via intrínseca é mais lenta, necessitando normalmente de 1 a 6 min para produzir a coagulação. 2.3 HEMOFILIAS A deficiência hereditária dos fatores de coagulação leva a doenças hemorrágicas comumente chamadas hemofilias. Os fatores mais freqüentemente encontrados em deficiência são os fatores VIII (FVIII) e o IX (FIX), cujos genes estão localizados no cromossomo X e, quando mutados, causam a herança recessiva ligada ao X das hemofilias A e B (MANNUCCI, 2002). Somente estas duas moléstias estão associadas a sangramento articular importante (BATTISTELLA et al., 1995). O sangramento, a hemorragia, é a manifestação clínica mais importante desta moléstia e é no aparelho locomotor que aparece com maior freqüência (BATTISTELLA et al., 1995). O hemofílico não sangra mais rapidamente que uma pessoa normal, e sim o sangramento pode se prolongar por um tempo maior caso não seja reposto corretamente com os concentrados de fator de coagulação (BEZERRA, 2001). Segundo Soucie et al. (1998), a prevalência total da hemofilia é usualmente estimada entre 1:5.000 e 1:10.000 homens. Uma recente pesquisa epidemiológica detalhada revelou um total de 13.320 casos de hemofilia A e 3.640 casos de hemofilia B na população dos Estados Unidos. Isto corresponde a uma prevalência de aproximadamente 1:10.000 homens para a hemofilia A e 1:35.000 para a hemofilia B. A incidência combinada para ambas foi estimada em aproximadamente 1:5.000 homens nascidos vivos. As hemofilias serão descritas aqui de forma a dar ênfase para as hemofilias A e B, que serão descritas separadamente, enquanto as outras hemofilias estarão agrupadas. 2.3.1 Hemofilia A A hemofilia A, também conhecida como hemofilia clássica, é a desordem de coagulação hereditária mais comum. É caracterizada por alterações quantitativas ou qualitativas do fator VIII. O defeito genético do gen do fator VIII pode levar a ausência ou redução de moléculas de fator VIII, e a alterações estruturais que levam à diminuição de sua atividade funcional (VEIGA e MIRANDA, 1998). A hemofilia A exibe graus diversos de gravidade clínica que apresentam uma boa correlação com o nível de atividade do fator VIII (ROBBINS et al., 1996). Níveis do fator abaixo de 1% estão associados com a hemofilia severa, níveis entre 1 e 5% classificam-se como hemofilia moderada e níveis entre 5 e 30% como leve (VEIGA e MIRANDA, 1998; BEZERRA, 2001). Para Ogashawara e Marino-Lamari (1997) o nível mínimo de fator VIII necessário para a hemostasia efetiva é de 30% Entretanto, segundo Bezerra (2001) o nível médio normal da atividade de fator VIII é de 100%, variando de 50 a 180%. Outros autores diferem seus conceitos no que diz respeito aos níveis plasmáticos do fator para a classificação da hemofilia A. Para Robbins et al. (1996), a forma leve da doença pode apresentar níveis plasmáticos do fator entre 6 a 50%. Pantoja e Magullón (1993) afirmam que a forma leve apresenta níveis plasmáticos entre 5 e 20%. E para Soucie et al. (1998), a forma leve apresenta entre 5 e 25% de níveis plasmáticos do fator VIII. Por definição, uma unidade de fator VIII é a quantidade encontrada em 1 ml de pool de plasma fresco normal. Também por definição, 1 U/ml de fator VIII é igual a 100% do normal (VEIGA e MIRANDA, 1998). Os graus variáveis da deficiência dos níveis procoagulantes do fator VIII correlacionam-se com o tipo de mutação no gene do fator VIII. Os pacientes com deleções e mutações pontuais que criam códons de interrupção não apresentam fator VIII detectável e, conseqüentemente, desenvolvem a forma grave da doença. Em uma minoria dos pacientes, as mutações não afetam a síntese de fator VIII, mas os domínios funcionais são alterados. Nesses casos, os níveis de fator VIII são aparentemente normais nos ensaios biológicos, mas a proteína é inativa (ROBBINS et al., 1996). A pesquisa epidemiológica realizada nos Estados Unidos, já citada anteriormente, identificou aproximadamente 43% de hemofílicos com hemofilia severa, 26% classificados como moderada e 31% como leve (SOUCIE et al.,1998). Segundo Bezerra (2001), pacientes com hemofilia grave são severamente afetados, sofrendo freqüentemente episódios de sangramentos internos nos músculos e articulações, e outras formas de hemorragias decorrentes de lesões mínimas usualmente esquecidas ou mesmo não identificadas. Os hemofílicos moderados possuem sangramento após trauma moderado. Os problemas de sangramento tendem a ser menos freqüentes e menos sérios do que aqueles afetados severamente, porém mais freqüentes e mais sérios do que os de pessoas afetadas brandamente, enquanto pacientes com hemofilia leve apresentam sangramento após traumatismo ou por intervenções cirúrgicas (BEZERRA, 2001). 2.3.2 Hemofilia B A hemofilia B ou doença de Christmas é caracterizada por uma diminuição da atividade do fator IX devido a ausência ou disfunção do fator (VEIGA e MIRANDA, 1998). Robbins et al. (1996) afirma que em cerca de 14% destes pacientes está presente um fator IX não-funcional. De acordo com Soucie et al. (1998), a hemofilia B conta com aproximadamente 2025% dos casos de hemofilia. A apresentação clínica da hemofilia B é indistinguível da hemofilia A, e como esta, também é classificada como leve, moderada ou severa, de acordo com os níveis da atividade coagulante do fator IX (VEIGA e MIRANDA, 1998). 2.3.3 Outras deficiências de fator As hemofilias A e B são as mais freqüentes e mais relacionadas a sangramento articular importante, porém outras coagulopatias hereditárias menos freqüentes são: deficiência de fatores II (protrombina), V, VII, X, XI e XIII, além da doença de von Willebrand. 2.3.3.1 Deficiência de Protrombina (Fator II) Uma variedade de mutações no gene da protrombina tem sido descoberta. Estas mutações causam tanto diminuição da produção ou instabilidade da protrombina, ou produção de disfunção nas moléculas com redução da atividade. A subseqüente diminuição na atividade da protrombina resulta em ausência ou defeituosa formação de coágulo, agregação plaquetária defeituosa, e defeitos em outras vias normalmente ativadas pela protrombina (ROBERTS e GRAY, 1995a). Sangramento associado com deficiência de protrombina tipicamente consiste de fácil ferimento, epistaxe, hemorragia de tecidos moles, sangramento pós-operatório, e nas mulheres, menorragia. Hemartroses também têm sido descritas, mas não são comuns. A correlação entre os níveis de protrombina e severidade do sangramento é pobre (ROBERTS e GRAY, 1995a). 2.3.3.2 Deficiência do Fator V. A tendência hemorrágica na deficiência do fator V é uma conseqüência direta da falta de sua atividade no plasma e nas plaquetas. Alguns pacientes deficientes têm níveis normais de antígenos, mas baixos níveis de atividade funcional (ROBERTS e GRAY, 1995a). A deficiência severa de fator V apresenta com anormal ferimento, epistaxe, hemorragia de tecidos moles, e ocasional hemartroses. Artropatia hemofílica não é usualmente vista. Aproximadamente metade dos pacientes é diagnosticada na idade adulta. Embora hemorragia possa ocorrer em pacientes com menos de 1% de fator V, o sangramento não é freqüente como na hemofilia A (ROBERTS e GRAY, 1995a). 2.3.3.3 Deficiência do Fator VII O Fator VIIa é um componente importante da via extrínseca da coagulação, na qual ele ativa o fator X na presença do fator tecidual e do cálcio. O complexo fator VIIa/fator tecidual também ativa o fator IX, contribuindo para a ativação da via intrínseca. Então, a deficiência do Fator V está associada com manifestações clínicas significantes (ROBERTS e GRAY, 1995a). A deficiência do fator VII comumente apresenta fácil ferimento, hemorragia de tecidos moles, epistaxe, e, na mulher, menorragia. Hemartroses e artropatia hemofílica ocorrem em pacientes severamente afetados e podem ser tão severas quanto as vistas na hemofilia A e B. O sangramento na deficiência do Fator V é geralmente mais fácil para controlar do que na hemofilia A ou B (ROBERTS e GRAY, 1995a). 2.3.3.4 Deficiência do Fator X. Hemartroses, hematomas retroperitoniais e outras hemorragias de tecidos moles, hematúria, pseudotumores, e menorragia são observadas em pacientes com severa deficiência do fator X. Sangramentos severos comparáveis àqueles vistos na hemofilia A podem ocorrer. Artropatia hemofílica é vista, mas não é tão severa quanto na hemofilia A ou B (ROBERTS e GRAY, 1995a). 2.3.3.5 Deficiência do Fator XI. Pacientes afetados podem ser divididos naqueles com maior deficiência (menor ou igual a 20% do normal) e naqueles com deficiência menor. Pacientes com deficiência maior podem experimentar sangramentos excessivos. Pacientes com deficiência menor tem pequeno ou nenhum sangramento (ROBERTS e GRAY, 1995a). Aqueles pacientes que sangra, geralmente só o fazem após um trauma. Até pacientes com níveis muito baixos do fator não têm episódios hemorrágicos tão freqüentes como aqueles vistos na hemofilia A e B. Epistaxe, hemorragia de tecidos moles, e sangramentos após extração dentária podem ocorrer. Hemartroses são muito incomuns, e doença articular crônica não é vista (ROBERTS e GRAY, 1995a). 2.3.3.6 Deficiência do Fator XIII. A deficiência do Fator XIII se correlaciona diretamente com a ausência da atividade subunidade A. Duas formas de deficiência deste fator são conhecidas. Na deficiência Tipo I, estão faltando as subunidades A e B, enquanto no Tipo II, a subunidade A está faltando e a B está presente quantidades aproximadamente normais (ROBERTS e GRAY, 1995a). As características da deficiência severa do fator XIII são o sangramento umbilical na período neonatal; hemorragia intracraniana com pouco ou nenhum trauma, recorrentes sangramentos em tecidos moles com a tendência à formação de cistos hemorrágicos (pseudotumores) (ROBERTS e GRAY, 1995a). 2.3.3.7 Doença de von Willebrand. O fator VIII-vWF plasmático é um complexo constituído por duas proteínas separadas (fator VIII e fator vW), que podem ser diferenciadas por critérios funcionais, bioquímicos e imunológicos. Através de ligações não-covalentes, o fator VIII é vinculado a uma proteína muito maior, denominada fator de von Willebrand (vW). Esta última, que constitui aproximadamente 99% do complexo, não é uma proteína distinta, mas existe sob a forma de uma série de multímeros que chegam a conter até 100 subunidades. O fator de von Willebrand também é capaz de ligar diversas outras proteínas envolvidas na hemostasia (ROBBINS et al., 1996). A função mais importante do fator vW é a de facilitar a adesão das plaquetas ao colágeno subendotelial. O fator vW atua como um transportador do fator VIII e é importante para a sua estabilidade. A meia-vida do fator VIII na circulação é de 12 horas, caso o fator vW esteja presente, mas de apenas 2,4 horas quando existe uma carência do último (ROBBINS et al., 1996). Com uma freqüência estimada de 1%, acredita-se, segundo Robbins et al. (1996), que a doença de von Willebrand seja um dos distúrbios hemorrágicos hereditários mais comuns nos seres humanos. Em termos clínicos, caracteriza-se por sangramento espontâneo a partir das mucosas, sangramento excessivo em feridas, menorragia e um tempo de sangramento prolongado na presença de uma plaquetometria normal, na maioria dos casos é transmitida como um distúrbio autossômico dominante, mas foram identificadas diversas variantes autossômicas recessivas raras (ROBBINS et al., 1996). Foram descritas mais de 20 variantes da doença de von Willebrand, e estas podem ser agrupadas em duas categorias principais (ROBBINS et al., 1996): Doença de von Willebrand dos tipos I e III - associada com uma quantidade reduzida de Fator vW circulante. O tipo I, um distúrbio autossômico dominante, responde por aproximadamente 70% dos casos e é relativamente brando. O tipo III (um distúrbio autossômico recessivo) associa-se com níveis extremamente baixos de fator vW, e, conseqüentemente, as manifestações clínicas são graves. Felizmente, é muito menos comum do que o tipo I. A base molecular para a redução dos níveis de fator vW nestas duas variantes ainda não foi determinada (ROBBINS et al., 1996). Doença de von Willebrand do tipo II - caracterizada por um defeito qualitativo no fator, é herdada como um distúrbio autossômico dominante. Como decorrência de mutações pontuais, ou, às vezes, de deleções, o fator formado é anormal e a agregação dos multímeros é defeituosa. Multímeros grandes e de tamanho intermediário, que correspondem às formas mais ativas do fator, não são encontrados no plasma. A doença de von Willebrand do tipo II responde por 10 a 15% de todos os casos da doença e se associa a sangramentos discretos e moderados (ROBBINS et al., 1996). Uma vez que o fator vW estabiliza o fator VIII ao se ligar a ele, uma deficiência de fator vW origina uma redução secundária nos níveis de fator VIII. Em resumo, pacientes com doença de von Willebrand apresentam um defeito composto, que envolve a função plaquetária e a via de coagulação. Entretanto, exceto no caso dos pacientes mais gravemente afetados, os efeitos da deficiência do fator VIII que caracterizam a hemofilia são incomuns (ROBBINS et al., 1996). 2.4 GENÉTICA Os principias tipos de hemofilia são causados por mutações nos genes do fator VIII ou fator IX, classificadas como hemofilia A e hemofilia B, respectivamente. Ambos os genes estão localizados no cromossomo X, causando a estas patologias uma clássica herança ligada ao X (HEDNER et al., 2000). Com o advento da genética molecular moderna, os genes para todos os bem caracterizados fatores de coagulação têm sido clonados e seqüenciados, e um largo espectro de mutações nos genes dos fatores VIII e IX tem sido identificado (HEDNER et al., 2000). O gene decodificador do fator VIII está localizado no braço longo do cromossomo X, na banda Xq28 e mede 186 kilobase (kb) (GITSCHIER et al.1, apud FAVIER et al., 2000). Assim como ocorre com o fator VIII, o gene correspondente ao fator IX está também localizado no braço longo do cromossomo X (SOUCIE et al.,1998). Segundo Hedner et al. (2000), a hipótese de Haldane prediz que um terço de todos os pacientes com uma doença letal ligada ao X apresentaria novas mutações. Isto resulta do fato de que um terço de todos os cromossomos X residem em homens e dois terços em mulheres. Antes da época médica moderna, um terço dos cromossomos da hemofilia presentes em homens seria perdido pela população com a morte precoce e pacientes severamente afetados. Por causa do fato da freqüência da doença estar em equilíbrio, esta perda dos alelos da hemofilia poderia ser reposta por um igual número de novas mutações. Entretanto, essas novas mutações diferem entre a hemofilia A e a B. 2.4.1 Padrões de herança recessiva ligada ao X. A hemofilia constitui-se numa anomalia transmitida por um gene recessivo vinculado ao sexo. E a herança de fenótipos recessivos ligados ao X segue um padrão bem definido e facilmente reconhecido. Uma mutação ligada ao X expressa-se fenotipicamente em todos os homens que a recebem, mas apenas nas mulheres que são homozigóticas para a mutação. Em conseqüência, os distúrbios recessivos ligados ao X geralmente se restringem aos homens e, à exceção dos raros heterozigotos manifestos, quase não são vistos nas mulheres (THOMPSON et al., 1993). 1 GITSCHIER, J.; WOOD, W. I.; GORALKA, J. M. Characterization of the human factor VIII. Nature, - , v. 312, n. - , p. 326-330, - . 1984. Nas figuras a seguir, Xh representa o alelo mutante do fator VIII causador da hemofilia A ou B e XH o alelo normal. Se um hemofílico tiver filhos com uma mulher normal, todos os filhos do sexo masculino recebem o cromossomo Y do pai e um X materno, não sendo afetados, mas todas as filhas recebem o cromossomo X paterno com seu alelo para hemofilia e são portadoras obrigatórias (Fig. 4) (THOMPSON et al., 1993). XH XH Xh XHXh XHXh Filhas: todas heterozigóticas Y XHY XHY Filhos: todos normais Figura 4 - Homem afetado X Mulher normal - Xh Y x XH XH Fonte: THOMPSON, M. R.; McINNES, R. R.; WILLARD, H. F. Genética Médica. 5 ed. Rio de Janeiro: Guanabara, 1993. Supondo-se que uma filha do homem afetado tenha filhos com um homem não afetado, quatro genótipos são possíveis na progênie, com probabilidades iguais (Fig 5) (THOMPSON et al., 1993). XH Xh XH XHXH XHXh Filhas: 1/2 normais ; 1/2 portadoras Y XHY XhY Filhos: 1/2 normais ; 1/2 afetados Figura 5 - Homem normal X Mulher portadora - XHY x XH Xh Fonte: THOMPSON, M. R.; McINNES, R. R.; WILLARD, H. F. Genética Médica. 5 ed. Rio de Janeiro: Guanabara, 1993. O gene de um distúrbio ligado ao X às vezes está presente num pai e numa mãe portadora e, então, as filhas podem ser homozigóticas afetadas. No entanto, a maioria das doenças ligadas ao X é tão rara que é muito incomum uma mulher ser homozigótica (THOMPSON et al., 1993). Entretanto, tem sido relatado o aparecimento do fenótipo em mulheres. Isto se deve, com maior freqüência, à inativação do cromossomo X normal, resultando em níveis mais baixos do fator VIII, em mulheres portadoras da hemofilia A. Ainda que isto produza redução nos níveis do fator VIII para hemofilia leve e até moderada, sangramentos graves associados são poucos prováveis (HEDNER et al., 2000). 2.5 DIAGNÓSTICO Enquanto as hemofilias leve e moderada não são sempre diagnosticadas durante a infância, a hemofilia severa é geralmente diagnostica em uma idade bastante precoce. Nos últimos anos, o diagnóstico e tratamento da hemofilia têm tido grande avanço. Enquanto a literatura dos anos sessenta refere que apenas 10% dos hemofílicos eram diagnosticados no primeiro mês de vida, a situação hoje tem mudado devido aos métodos diagnósticos sofisticados. Diagnóstico e tratamento precoces são necessários para evitar destruição articular (POLLMANN et al., 1999). Em um estudo realizado por Pollmann et al. (1999), verificou-se que dos 37 pacientes com hemofilia severa avaliados, 14 (37%) foram diagnosticados no primeiro mês de vida; 5 (14%) entre o segundo e sexto mês de vida; 11 (30%) entre o sétimo e décimo segundo mês e 7 (19%) pacientes foram diagnosticados após um ano de idade, sendo que o mais tardiamente diagnostico foi aos 2 anos de idade. Quanto às razões para o diagnóstico verificou-se que em 15 pacientes (47%) o hematoma levou a uma investigação. Cirurgias levaram ao diagnóstico em 5 pacientes (14%) e a história familiar em 9 casos (24%). Sangramentos bucais, sangramentos musculares e articulares ocorreram em dois pacientes respectivamente (5%). Uma vez que a presença de uma doença hemorrágica tenha sido estabelecida ou que grande suspeita é gerada também pela história ou exame físico, ou ambos, testes laboratoriais são aplicados para estabelecer o diagnóstico (SANTORO e EBY, 1995). Além disso, como em todas as entidades de patologia osteoarticular, o diagnóstico por imagem é um recurso imprescindível para um correto diagnóstico (BESUSCHIO e SERRANO, 2001). 2.5.1 Testes laboratoriais Segundo Robbins et al. (1996), na maioria dos casos, quatro procedimentos de triagem localizam a anormalidade hemostática: o tempo de sangramento, a plaquetometria, o tempo de protrombina e o tempo parcial de tromboplastina. A contagem das plaquetas é realizada para detectar trombocitopenia, que é usualmente definida como uma contagem de plaquetas de menos de 150.000/mm3 (SANTORO e EBY, 1995). O tempo de sangramento é um teste para a função plaquetária. O teste não é, como o nome pode demonstrar, um teste global para o sistema hemostático. O teste não é significantemente prolongado em muitas doenças que resultam em prolongamento do tempo de tromboplastina parcialmente ativado (TTPA) ou do tempo de atividade da protrombina (TAP) (por exemplo, as deficiências dos fatores VIII, IX ou XII) (SANTORO e EBY, 1995). O TAP é realizado pela adição de uma preparação de fator tecidual (comumente uma extração do cérebro) ao plasma citrato-anticoagulado, pela recalcificação do plasma, e pela mensuração do tempo de coagulação. O TAP é o método mais usado para monitorar a diminuição da atividade dos fatores dependentes da vitamina K: VII, IX e X e protrombina. (SANTORO e EBY, 1995). O TTPA é realizado pela adição de um agente ativador de superfície, como sílica, ácido elágico e fosfolipídio ao plasma citrato-anticoagulado. Após incubação por um período suficiente para promover a ótima ativação dos fatores de contato, o plasma é recalcificado e o tempo de coagulação é mensurado. O nome do teste provém do fato dos fosfolipídios reagentes serem originalmente derivados de um lipídio extraído da tromboplastina completa. O TTPA é dependente dos fatores de ambas as vias: intrínseca e extrínseca (SANTORO e EBY, 1995). Na hemofilia A, caracteristicamente, os pacientes com severa ou moderada hemofilia apresentam um TTPA prolongado. O TAP é o tempo de sangramento são normais. Em casos leves o TTPA pode ser levemente prolongado ou dentro dos limites da normalidade. O diagnóstico definitivo deverá ser baseado em ensaios específicos para o fator VIII (VEIGA e MIRANDA, 1998). A hemofilia B apresenta um TTPA alargado e TAP normal. A distinção com a hemofilia A se faz pelos ensaios específicos para o fator IX (VEIGA e MIRANDA, 1998). 2.5.2 Diagnóstico por imagem Além dos sinais e sintomas pode-se utilizar métodos complementares para o diagnóstico e graduação da artropatia hemofílica, porque o tratamento a ser instituído depende principalmente do segundo (BESUSCHIO e SERRANO, 2001). Vários autores propõem distintas classificações baseadas nos achados radiológicos. Arnold e Hilgartner2 (apud BESUSCHIO e SERRANO, 2001) utilizam a seguinte: Estágio I: sem sinais radiológicos esqueléticos apreciáveis, mas há tumefação nos tecidos moles, secundária às hemorragias ocorridas nos tecidos periarticulares (Besuschio e Serrano, 2001). Estágio II: usualmente coincide com o estado clínico da hemartrose subaguda. Apresenta osteoporose epifisária com hipertrofia da mesma. A integridade articular está mantida sem pinçamento do espaço cartilaginoso nem cistos ósseos (Besuschio e Serrano, 2001). Estágio III: evidente desorganização radiológica articular sem pinçamento significativo do espaço interósseo. São visíveis cistos subcondrais que podem comunicar-se com o espaço articular. A sinovial pode estar ossificada por depósitos de hemosiderina. Neste estágio, um achado radiológico importante é a integridade da cartilagem articular. É até o final deste estágio que a artropatia hemofílica é reversível através do tratamento (Besuschio e Serrano, 2001). Estágio IV: caracterizado pelo pinçamento articular e destruição da cartilagem. As alterações que aparecem no estágio III são as mais evidentes (Besuschio e Serrano, 2001). Estágio V: estágio final manifestado por anquilose fibrosa articular; há pronunciada desorganização das estruturas articulares. A restrição do movimento articular é moderada e os episódios hemorrágicos podem ser menos freqüentes. Patologicamente a sinóvia pode estar pouco alterada ou, pelo contrário, podem estar irreconhecíveis os tecidos sinoviais no ato cirúrgico. Adicionalmente, a cartilagem articular está ausente, podendo aparecer em tom verde, marrom ou com pigmentos negros (Besuschio e Serrano, 2001). Petterson et al.3 (apud BESUSCHIO e SERRANO, 2001) propõem uma classificação baseada em pontuação, demonstrada no Quadro 2. 2 ARNOLD, W. D.; HILGARTNER, M. W. Hemophilic Arthropathy: Current Concepts of Pathogenesis and Management. Journal of Bone and Join Surgery, - , v. 59, n. - , p. 287-305, - . 1977. 3 PETTERSSON, H.; AHLBERG, A.; NILSSON, I. M. A Radiologic Classification of Hemophilic Arthopathy. Clinical Orthopaedics And Related Research, - , v. 1, n. 149, p. 153-159, - . 1980. Sinais radiológicos Osteoporose Achados Ausente Presente Ausente Presente Pontuação 0 1 0 1 Ausente Leve Pronunciada 0 1 2 Redução do espaço articular Ausente Menor que 50% Maior que 50% 0 1 2 Formação de cistos subcondrais Ausente 1 cisto Mais que 1 cisto 0 1 2 Ausente Presente 0 1 Mal acoplamento da superfície articular Ausente Leve Pronunciada 0 1 2 Deformidade (angulação) Ausente Leve Pronunciada 0 1 2 Comprometimento epifisário Irregularidade da superfície subcondral Erosão da margem articular Quadro 2 – Classificação radiológica baseada em pontuações. FONTE: BESUSCHIO, S.; SERRANO, M. S. Patologia Ósteoarticular de la Hemofilia. Prensa Médica Argentina, Buenos Aires, v. 88, n. 8, p. 717-729, oct. 2001 Por esta classificação a pontuação máxima foi de 13 pontos, mas a articulação que apresenta apenas anquilose, recebe a pontuação máxima (treze). Não redução ou estacionamento dos achados radiológicos, ao contrário, são sempre progressivos (BESUSCHIO e SERRANO, 2001). Quanto maior a pontuação, mais grave é a artropatia. Não há correlação entre os achados clínicos e radiológicos. Em geral, estes últimos precedem as alterações na mobilidade e função articular (BESUSCHIO e SERRANO, 2001). Em vários pacientes, a osteoporose e o comprometimento epifisário ocorrem simultaneamente e são os sinais radiológicos iniciais mais precoces (BESUSCHIO e SERRANO, 2001). As imagens ultrasonográficas demonstram os contornos da superfície óssea, músculos normais e outras estruturas periarticulares (Fig 6). O engrossamento da sinovial é claramente demonstrado e diferenciado da coleção sanguínea. Apesar do ultra-som poder detectar quantidades mínimas de sangue intraarticular (inclusive menos de 10 ml no quadril), sua aplicação é mais útil para a avaliação de hematomas e pseudotumores que para hemartrose (BESUSCHIO e SERRANO, 2001). Figura 6 – Secção longitudinal ultrasonográfica de um joelho com sinovite hemofílica crônica. Note o espessamento sinovial (T), patela (P), fêmur (F). Fonte: RODRIGUEZ-MERCHAN, E. C. Effects of hemophilia on articulations of children and adults. Clinical Orthopaedics And Related Research, Madrid, v. 1, n. 328, p. 7-13, Jul. 1996. A imagem de ressonância magnética pode ser utilizada como suporte diagnóstico em casos de proliferação sinovial e expansão da articulação (Fig 7) (RODRÍGUEZ-MERCHÁN, 1997). Figura 7 – Imagem de ressonância magnética de um tarso hemofílico de um menino de 8 anos mostrando um grau severo de sinovite hipertrófica. Fonte: RODRIGUEZ-MERCHAN, E. C. Pathogenesis, early diagnosis, and prophylaxis for chronic hemophilic synovitis. Clinical Orthopaedics And Related Research, v. 1, n. 343, p. 6-11, Out. 1997. A artroscopia é usada tanto como método de diagnóstico como para tratamento. Em geral, as alterações encontradas na visualização da cartilagem são mais avançadas que nos Raios X. Apresenta a vantagem de efetuar a extração de corpos livres intraarticulares, recém realizado o diagnóstico. Não obstante, tem a desvantagem de ser um método invasivo (BESUSCHIO e SERRANO, 2001). A artrografia, como método de diagnóstico das alterações articulares em hemofílicos, é de pouco benefício quando já se instalou a artropatia estágio III, já que as alterações do menisco e a hipertrofia sinovial tornam difícil sua interpretação (BESUSCHIO e SERRANO, 2001). 2.6 MANIFESTAÇÕES CLÍNICAS. A hemofilia é caracterizada por uma tendência hemorrágica aos pequenos traumatismos e até espontaneamente (VEIGA e MIRANDA, 1998). Conforme Brettler et al. (1995), a manifestação clínica das hemofilias A e B é praticamente a mesma; os dois tipos de hemofilia caracterizam-se por episódios de sangramento tardios, prolongados e repetidos. Segundo Besuschio e Serrano (2001), na forma grave, os sintomas em geral aparecem antes do primeiro ano de vida, as hemartroses são muito freqüentes e afetam várias articulações. Os hematomas de localização subcutânea, intramusculares, intraabdominais e retroperitoniais aparecem sem uma relação causa-efeito direta ou posteriores a traumatismos leves. Os episódios hemorrágicos são freqüentes e se manifestam como epistaxe, hematúria e hemorragias digestivas. Estes pacientes requerem alta freqüência de hospitalização e tratamento de reposição intenso. Na forma intermediária ou moderada, os sintomas aparecem em geral depois dos 5 anos de idade, as hemartroses são menos freqüentes e têm relação com traumatismos. A insuficiência funcional residual é menor. Os hematomas e episódios hemorrágicos são esporádicos e têm relação com traumatismos mais importantes (BESUSCHIO e SERRANO, 2001). Na hemofilia leve, os sintomas iniciais aparecem depois dos 10-15 anos de vida. As hemartroses são uma exceção e são produzidas por traumas importantes e não produzem seqüelas funcionais. Os hematomas só aparecem depois de traumas intensos. Os episódios hemorrágicos se observam depois de extrações dentárias ou em intervenções cirúrgicas (BESUSCHIO e SERRANO, 2001). 2.6.1 Hematomas subcutâneos e intramusculares. De acordo com Veiga e Miranda (1998), ocorrem freqüentemente e podem atingir grandes proporções com comprometimento hemodinâmico. As manifestações são variáveis de acordo com a localização do sangramento. Podem levar a compressão de estruturas vitais como as vias aéreas, e compressão de vasos e nervos periféricos. Hemorragia de tecidos moles pode ser leve e descomplicada, como em um hematoma localizado, mas deve ser tratada com cuidado devido ao risco de progressão e complicações sérias resultantes (ROBERTS e GRAY, 1995b). Os hematomas musculares são vistos como grupos musculares endurecidos, tensos, dolorosos. Os músculos mais acometidos são, por ordem de gravidade: o músculo psoas, os gastrocnêmios e a musculatura do antebraço. Estas retrações nas crianças podem levar a um comprometimento do crescimento dos membros acometidos, com repercussão estática e dinâmica ao nível das cinturas (escapular e pélvica) e da coluna vertebral (GAL E NAGATA, 1985). De acordo com Palazzi et al. (1985), com exceção do hematoma do psoas, as demais não são recorrentes, devido à cicatriz fibrosa que segue o hematoma, a qual estrangula o foco sangrante evitando recidivas. Quando um determinado volume de sangue está preso entre as fibras musculares, algumas destas morrem, sendo mostradas como células anucleadas dentro do coágulo. Poucas horas após a ocorrência do hematoma aparece uma reação celular de defesa com exsudação de leucócitos polimorfonucleares, fagócitos mononucleados e células conectivas imaturas. Durante e depois da reabsorção do sangue e detritos tem lugar uma fibrose característica que impede a progressão ou recidiva do hematoma, mas que podem comprimir as fibras musculares, levando sempre a um maior ou menor grau de lesão muscular residual (PALAZZI et al., 1985). Se o tamanho do hematoma é muito grande e de difícil remoção pelos fagócitos antes que este processo normal de fibrose se desenvolva, se produz uma lesão cística contendo detritos e resíduos sanguíneos, com tendência não só a persistir como também a crescer dando um aspecto pseudotumoral que pode inclusive chegar a planos superficiais e romper a pele com o conseqüente perigo de infecção. Se o músculo afetado é um músculo com grandes e diferenciadas inserções musculares ou tendinosas geralmente o hematoma fica confinado ao músculo e sua fáscia, mas se é um músculo de inserção única, tal como psoas ilíaco, o hematoma pode invadir o periósteo, sendo uma das formas de produção dos pseudotumores (PALAZZI et al., 1985). A dor é de menor intensidade do que nas hemartroses e depende da tensão a que está submetido o músculo dentro de seu envoltório fascial. Sendo a dor o sintoma predominante, algumas vezes pode passar até 48 a 72 horas antes que sua intensidade seja comparável àquela produzida por uma hemartrose. É devida a produção de tensão dentro do compartimento muscular. Assim, onde o músculo permite pouca distensão a dor será mais precoce e forte e menos severa em grandes músculos que podem tolerar melhor grandes hemorragias, como é o caso do hematoma do psoas (PALAZZI et al., 1985). A tumefação produzida pelo hematoma coloca as articulações movidas por estes músculos em questão em posições de proteção devido ao espasmo muscular. Estas contraturas secundárias devem ser tratadas precocemente para evitar a sua fixação e o desenvolvimento de uma deformidade resultante e a diminuição da atividade funcional, que favorecem alterações mecânicas levando a artropatia secundária (PALAZZI et al., 1985). 2.6.2 Hemorragia gastrointestinal e genitourinária. Hemorragia na cavidade oral (gengivas, língua, frênulo e lábios) são comuns e podem ser graves. Hematúria, embora mais freqüente do que as hemorragias digestivas, está menos associada a lesões orgânicas. Cólica renal pode surgir decorrente da formação de coágulos (VEIGA e MIRANDA, 1998). Grande hematúria ocorre freqüentemente e algumas vezes leva a significante perda sanguínea. Na primeira ocasião, uma grande hematúria deve ser avaliada com estudos diagnósticos apropriados, mas mais freqüentemente uma lesão estrutural não será encontrada. Episódios subseqüentes não requerem estudos extensivos novamente. A complicação mais comum da hematúria é a cólica renal causada pela obstrução por coágulos. A hematúria é resolvida em poucos dias, mas pode persistir por semanas se não tratada (ROBERTS e GRAY, 1995b). 2.6.3 Hemartroses. É a manifestação mais comum, e por ser o foco deste estudo será descrita detalhadamente em outro tópico. 2.6.4 Hemorragia do Sistema Nervoso. Segundo Veiga e Miranda (1998), o quadro hemorrágico mais grave é o sangramento intracraniano e/ou extracraniano. Pode ser espontâneo, mas geralmente segue-se a um trauma. Os sinais podem surgir imediatamente, mas também podem surgir vários dias ou semanas após o trauma. Mesmo traumas aparentemente sem gravidade requerem observação neurológica cuidadosa. Em pacientes com suspeita de hemorragia intracraniana, deve-se administrar fator VIII imediatamente e realizar uma tomografia de crânio. De acordo com Roberts e Gray (1995b), hemorragia intracraniana é uma das maiores causas de morte na hemofilia B e pode ocorrer até na ausência de um trauma reconhecível. Entretanto, poucos bebês hemofílicos têm hemorragia intracraniana como uma complicação de um parto vaginal. Pelo fato de que esta hemorragia é catastrófica, o sangramento deve ser prevenido se possível. Qualquer sinal ou sintoma de hemorragia intracraniana deve ser tratado como uma emergência médica potencial. Por exemplo, qualquer cefaléia incomum ou peculiar em um paciente hemofílico deve ser considerada decorrente de uma hemorragia intracraniana, até que se prove o contrário. Outra complicação dos sangramentos afetando o tecido nervoso inclui as neuropatias que resultam da compressão dos nervos pelos hematomas ou pelo sangramento intraneural ou por ambos. A compressão de nervos periféricos por hematomas é um problema particularmente comum, como a paralisia do nervo femoral secundária ao hematoma retroperitoneal que penetra e comprime o canal femoral. O prognóstico de recuperação após prolongada compressão nervosa é pobre, necessitando de um tratamento agressivo (ROBERTS e GRAY, 1995b). 2.6.5 Síndrome da dor regional complexa. Norris et al. (2001) citam que pacientes com deficiência severa do fator VIII comumente apresentam dor e/ou edema de uma articulação ou de tecidos moles de uma extremidade. Se os sintomas não melhoram com tratamento apropriado, um diagnóstico alternativo pode ser considerado. A síndrome da dor regional complexa (SDRC), que inclui a causalgia e a distrofia simpático reflexa (DSR), é uma causa incomum de dor em crianças com hemofilia, mas deve ser considerada. A causalgia é o termo utilizado para descrever a dor em queimação causada por lesão de um nervo periférico. A distrofia simpático reflexa é a entidade clínica mais controversa na qual a dor existe em associação com uma disfunção autonômica. Os sintomas incluem parestesia (queimação ou sensação de formigamento) e hiperalgesia. Os achados clínicos incluem edema, cianose, manchas e mudanças na temperatura na área afetada (NORRIS et al., 2001). A mais nova nomenclatura, SDRC, inclui várias entidades (incluindo DSR e causalgia), sendo caracterizada pela dor com severidade e duração fora da proporção para aquela esperada (NORRIS et al., 2001). A causa da SDRC é obscura. Alguns casos desenvolvem-se em associação com condições crônicas como doença degenerativa crônica das articulações ou condições neurológicas. A patofisiologia é igualmente confusa. Alguns autores têm sugerido o envolvimento do sistema nervoso simpático no desenvolvimento e manutenção dos sintomas da SDRC (NORRIS et al., 2001). Pacientes mais jovens tipicamente apresentam um curso mais brando com menos dor, melhor função, tempo mais curto de duração dos sintomas, e mais completa resolução dos sintomas após o tratamento. O prognóstico é geralmente bom, mas os sintomas podem persistir por meses (NORRIS et al., 2001). 2.7 HEMARTROSES A hemartrose é definida como o extravasamento de sangue para o interior da articulação ou para a cavidade sinovial. As hemartroses geralmente iniciam em articulações que suportam peso na fase em que a criança está aprendendo a andar (WEST, 2001). A hemorragia do aparelho locomotor tem como principal característica a reincidência, principalmente nas articulações (BATTISTELLA et al., 1985). As articulações mais comprometidas são as de maior solicitação ou carga, e por ordem de freqüência: joelho, cotovelo e tornozelo. Seguem as articulações coxo-femurais, ombro e punho, e mais raramente as pequenas articulações das mãos, pés e coluna (GAL e NAGATA, 1985). Segundo Pelletier et al. (1987), as manifestações clínicas das hemartroses podem incluir edema, aumento da temperatura da pele e central do corpo, dor, atrofia muscular e diminuição na ADM da articulação. De acordo com Gal e Nagata (1985), a dor é causada pela distensão e pressão sobre a cápsula articular causadas pelo derrame articular. A percepção inicial do paciente de uma hemartrose aguda freqüentemente começa como uma sensação de formigamento na articulação. A articulação afetada tende a posicionarse de maneira antálgica, normalmente em flexão, onde há maior espaço sinovial, e a movimentação passiva e ativa são dolorosas e muito restritas (RODRÍGUEZ-MERCHÁN, 1997). Adquire, assim, posição viciosa e antifuncional, que, sendo persistente, leva à contratura muscular com diminuição da capacidade funcional e hipotrofia dos músculos distendidos, o que poderá ser uma das causas de novas hemartroses (OGASHAWARA e MARINO-LAMARI, 1997). Falk et al. (2000) avaliaram a força anaeróbica e a força muscular em garotos jovens e adolescentes com hemofilia A, comparando com garotos saudáveis sem hemofilia e com seus resultados concluíram que os garotos com hemofilia tinham força anaeróbica e força muscular mais baixas em relação aos controles. Greene e Strickler (1983) referem que a força muscular não é apenas geradora de movimento, mas também tem uma função maior na absorção de energia. Com adequado tratamento a articulação retorna ao seu estado anterior ao da hemartrose, sem causar qualquer alteração. Se a articulação torna-se local de recorrentes hemartroses, pode-se referir à articulação como uma articulação-alvo. Hemartroses crônicas desenvolvem-se após um envolvimento subagudo da articulação estar presente por meses ou anos. Quanto uma articulação falha na sua recuperação entre os episódios de sangramento, a sinóvia hipertrofia e a articulação permanece permanentemente quente e aumentada (RODRÍGUEZ-MERCHÁN, 1996). A sinóvia mostra áreas de vilosidades após 4 dias da ocorrência de um hemartrose. A reação rápida da sinovial ao sangramento intraarticular inclui hipertrofia sinovial, deposição de hemosiderina nas células fagocíticas, infiltrados perivasculares, e fibrose precoce da camada subsinovial. As hemartroses recorrentes estimulam a sinóvia, que hipertrofia para dentro da articulação. Este tecido hipertrofiado ocupa espaço e está propenso a ser lesado e causar adicional sangramento. Este processo inicia e é responsável pelo sinovite crônica nas articulações dos pacientes hemofílicos (RODRÍGUEZ-MERCHÁN, 1997). A hipertrofia sinovial é caracterizada por formação de vilosidades, marcado aumento da vascularização e células inflamatórias crônicas (Fig 8) (RODRÍGUEZ-MERCHÁN, 1997). Figura 8 – Sinóvia do joelho de um menino de 9 anos com uma história de recorrentes hematroses há 20 meses. Note a formação de vilosidades, aumento da vascularização e infiltrado de células inflamatórias. FONTE: RODRÍGUEZ-MERCHÁN, E. C. Effects of hemophilia on articulations of children and adults. Clinical Orthopaedics And Related Research, Madrid , v. 1, n. 328, p. 7-13, Jul. 1996. O estado de sinovite hemofílica é definido pelo crônico inchaço da uma articulação por mais de 3 meses, que não reponde à normal substituição profilática do fator. Ela está freqüentemente associada a um aumento na freqüência de sangramentos na articulação afetada (RODRÍGUEZ-MERCHÁN et al., 1997). Fibrose densa intraarticular e subsinovial eventualmente pode levar a fibrose capsular e contratura articular. As células da sinóvia se desintegram e liberam enzimas lisossômicas, que não apenas destroem a cartilagem articular, mas também inflamam o tecido sinovial. Produtos da degradação do sangue também afetam os condrócitos (RODRÍGUEZMERCHÁN, 1996). Segundo Pantoja e Magullón (1993), a contribuição da presença de ferro, secundária a reabsorção das múltiplas hemorragias intraarticulares, na degeneração articular não está totalmente clara. O ferro pode favorecer a precipitação de cristais de pirofosfato, assim como alterar o pH do líquido sinovial. A alta concentração de ferro no líquido sinovial dos hemofílicos pode influir na produção de procolagenases por parte dos leucócitos, como ocorre no líquido sinovial reumatóide. A sinovite causa hipertrofia das placas epifisárias de crescimento. A sinóvia anormal produz um excessivo suprimento sanguíneo para a área das placas epifisárias. Este estímulo para as placas de crescimento resulta em hipertrofia óssea. Esta pode levar a uma discrepância no comprimento dos membros, deformidades angulares, e alterações no contorno do esqueleto em desenvolvimento. Então, uma reação inflamatória causa aceleração da ossificação e crescimento das epífises, que aparecem com osteopenia, com um padrão trabecular grosseiro ou paralelo. Finalmente, osteoporose pode se desenvolver como resultado do desuso e imobilização da articulação. O excessivo crescimento das epífises leva a problemas ósseos em pacientes jovens (RODRÍGUEZ-MERCHÁN, 1997). Além disso, conforme Pantoja e Magullón (1993), em um joelho normal a pressão intraarticular é igual à atmosférica, e se contrair o quadríceps, esta pressão se torna negativa. Quando há hemorragia intraarticular, a pressão não se negativiza e se o derrame for muito grande, se positiviza. A epífise óssea se nutre através de vasos epifisários e metafisários. Na criança, estes últimos não têm importância para a nutrição da epífise já que se interpõe a cartilagem de crescimento. Se ocorrer uma hemartrose severa com uma elevada pressão intraarticular se produzirá uma compressão dos vasos que irrigam o tecido ósseo epifisário subcondral, e com ela uma isquemia e necrose deste, deixando a cartilagem sem base se sustentação. Segundo o autor, tudo isso explica porque a artropatia hemofílica se produz em idades precoces e porque a maioria dos pacientes apresenta ao menos uma artropatia antes que fechem as cartilagens de crescimento. De acordo com Gal e Nagata (1985), apesar das hemartroses facilitarem a maturação precoce dos núcleos de ossificação, não se tem notado modificações significativas quanto ao comprimento dos membros por esta causa. Como a sinóvia torna-se progressivamente lesada, há uma gradual conversão de tecido com hiperemia em tecido fibrótico. Este processo é a evolução natural da sinovite hemofílica. Pressão intraarticular aumentada, pela hemartrose e pela deformidade em flexão, pode contribuir para a destruição da sinóvia e da cartilagem articular. Na articulação hemofílica, a nutrição da cartilagem articular pode estar afetada pelo líquido sinovial anormal, pela imobilização da articulação, e pela presença de adesão fibrosa. Se a sinovite não é controlada, a destruição da cartilagem continuará. O estágio da artropatia hemofílica terá sido alcançado, e redução funcional da articulação torna-se aparente (Fig 9 e 10). Sintomas da artropatia crônica tipicamente desenvolvem-se na segunda ou terceira década. Como a cartilagem degrada-se progressivamente, a deterioração da função articular ocorre (movimentos limitados e dolorosos) (RODRÍGUEZ-MERCHÁN, 1997). Figura 9 – Progressão da artropatia do joelho. Uma série de visões do mesmo paciente com diferentes idades, com 8 anos, 14 e 30 anos. Fonte: RODRÍGUEZ-MERCHÁN et al. Hemophilic Synovitis of the Knee and the Elbow. Clinical Orthopaedics And Related Research, Madrid, v. 1, n. 343, p. 47-53, out. 1997. Figura 10 - Radiografias mostrando mudanças progressivas na articulação do cotovelo como resultado de hemoartroses recorrentes. (A) radiografia lateral do cotovelo esquerdo de um pacientes de 11 anos, mostrando osteopenia, formação de cisto subcondral, estreitamento do espaço da cartilagem, e irregularidade da epífise radial; (B) radiografia lateral de um cotovelo do paciente com 22 anos mostrando severa artropatia, incluindo estreitamento do espaço articular e formação de osteófito. Fonte: RODRÍGUEZ-MERCHÁN et al. Hemophilic Synovitis of the Knee and the Elbow. Clinical Orthopaedics And Related Research, Madrid, v. 1, n. 343, p. 47-53, out. 1997. Em pacientes nos quais o crescimento já está completo e as epífises já se fecharam, o maior efeito está na cartilagem articular. Como as cartilagens articulares progressivamente pioram, ocorre deterioração física das funções articulares, com movimentos tornando-se limitados e dolorosos. Radiografias mostram o estreitamento do espaço articular e uma irregularidade das anteriormente congruentes superfícies articulares (Fig 10) (RODRÍGUEZMERCHÁN, 1996). Os efeitos da hemofilia são basicamente os mesmos em todas as articulações, mas acabam resultando em padrões peculiares para cada articulação (RODRÍGUEZ-MERCHÁN, 1996). 2.7.1 Hemartrose do Ombro. Quando hemartroses ocorrem nas articulações do ombro, elas são extremamente angustiantes para o paciente. Pacientes com hemofilia não referem dor severa com episódios de sangramento nos ombros, mas apresentam dificuldade para encontrar uma posição confortável para a articulação envolvida. Episódios de sangramento no ombro são resolvidos geralmente em poucos dias com terapia de reposição. No ombro, distúrbio de crescimento das epífises pode causar uma pequena cabeça umeral atrófica, com uma deformidade vara. No ombro maduro, a formação de osteófitos pode ser pronunciada, que é rara em outras articulações. A formação de cistos subcondrais é rara, mas a formação de cistos adjacente a ambos os lados da placa de crescimento tem sido encontrada (PETTERSON et al.4, apud RODRÍGUEZ-MERCHÁN, 1996). 2.7.2 Hemartrose do Cotovelo. Na articulação úmeroradial, a posição da placa de crescimento radial proximal em relação à cápsula articular explica a íntima relação entre a sinovite crônica e o desenvolvimento da cabeça do rádio. Uma cabeça radial aumentada leva à limitação do movimento. Ossificação acelerada da cabeça radial (Fig 11) e aumento da fossa olecraniana (Fig 12) são achados típicos no cotovelo hemofílico. A presença de sinovite estabelecida inevitavelmente resulta em movimento comprometido (RODRÍGUEZ-MERCHÁN5, apud RODRÍGUEZ-MERCHÁN, 1996). Tem sido sugerido que a razão para o envolvimento do cotovelo é que carga significativa é conduzida através da articulação. Uma vez que o joelho tenha sido afetado, os pacientes têm extrema dificuldade em assumir a postura em pé depois de estar sentado. Para ajudar a levantar, o membro superior geralmente é colocado numa superfície firme, com a aplicação de força através do membro superior, o paciente hemofílico tenta levantar-se. A síndrome do túnel cubital em uma criança hemofílica tem sido descrita (RENWICK e MONEIM6, apud RODRÍGUEZ-MERCHÁN, 1996). No cotovelo hemofílico maduro, a hipertrofia da cabeça radial é seguida por um alargamento da incisura radial da ulna. O úmero distal pode estar alargado, e a fossa do olecrano pode estar aumentada em tamanho, com seu osso cortical reabsorvido, produzindo um forame no olecrano. Formação de cistos na ulna proximal é comum (RODRÍGUEZ-MERCHÁN, 1996). 4 PETTERSSON, H.; AHLBERG, A.; NILSSON, I. M. A Radiologic Classification of Hemophilic Arthopathy. Clinical Orthopaedics And Related Research, - , v. 1, n. 149, p. 153-159, - . 1980. 5 RODRÍGUEZ-MERCHÁN. E. C. The hemophilic elbow. Thesis. Complutense University, Madrid 1990. 6 RENWICK, S. E.; MONEIM, M. S. Cubital tunnel syndrome in a child with hemophilia. Journal of Hand Surgery, - , v. 18, n. - , p. 458-461, - . 1993. Figura 11 – Ossificação acelerada da cabeça do rádio no cotovelo esquerdo com a articulação contralateral em um menino de 6 anos de idade com hemofilia A severa. Fonte: RODRÍGUEZ-MERCHÁN, E. C. Effects of hemophilia on articulations of children and adults. Clinical Orthopaedics And Related Research, Madrid, v. 1, n. 328, p. 7-13, Jul. 1996. Figura 12 - Alargamento da fossa olecraniana em um menino de 14 anos com hemofilia B severa. Fonte: RODRÍGUEZ-MERCHÁN, E. C. Effects of hemophilia on articulations of children and adults. Clinical Orthopaedics And Related Research, Madrid, v. 1, n. 328, p. 7-13, Jul. 1996. 2.7.3 Hemartrose de punho e mão. No punho, distúrbios de crescimento precoce da ulna distal podem resultar em deslocamento da articulação radioulnar distal. Hemartrose é mais rara na mão do que em grandes articulações. Artropatia nas articulações metacarpofalangeanas ou nas interfalangeanas da mão também têm sido notadas em um limitado número de pacientes. Estas observações são notadas após um trauma. Quando considera-se um trauma repetitivo realizado diariamente com os dedos, é surpreendente que estas articulações sejam raramente afetadas na hemofilia (RODRÍGUEZ-MERCHÁN, 1996). 2.7.4 Hemartrose do quadril. A articulação do quadril não é tão comumente envolvida como se suspeitaria. Tem sido postulado que a distribuição anatômica da sinóvia na articulação do quadril é a chave para as hemartroses pouco freqüentes. Hemorragias no quadril em crescimento pode resultar em mudanças semelhantes à doença de Perthes (PETTERSSON et al.7, apud RODRÍGUEZMERCHÁN, 1996). Estas mudanças sempre envolvem a epífise inteira, enquanto a metáfise é menos afetada do que na clássica doença de Perthes. Protrusão acetabular pode ser encontrada no quadril; coxa valga é comum e provavelmente causada pelo desuso do membro inferior por causa dos joelhos e tornozelos afetados (RODRÍGUEZ-MERCHÁN, 1996). 2.7.5 Hemartrose do Joelho. Os joelhos são as articulações mais afetadas nos pacientes hemofílicos. As razões para a sua vulnerabilidade incluem a função de sustentação de peso, falta de uma estabilidade óssea intrínseca, e os movimentos tridimensionais e estresses que ocorrem nestas articulações (RODRÍGUEZ-MERCHÁN, 1996). Como um aspecto da função muscular é absorver estresses, boa força muscular ajuda a proteger a articulação do joelho. Tem sido mostrado que pacientes com hemofilia e uma história de hemartroses unilaterais no joelho têm uma disfunção neuromuscular na extremidade envolvida que precede o aparecimento de evidência radiológica de patologia articular (PIETRI et al.8, apud RODRÍGUEZ-MERCHÁN, 1996).Ocorrem-se hemartroses repetidas no joelho, a sinovite hipertrófica é acompanhada por uma dramática atrofia muscular. Esta fraqueza muscular faz a articulação mais vulnerável ao estresse, resultando em mais episódios hemorrágicos. Na criança, não apenas é de grande importância a patologia intraarticular, mas os efeitos da sinovite crônica podem ter um profundo efeito nesta área. A epífise femoral distal, que é responsável pela maior parte do crescimento femoral em comprimento, está situada próxima à, e afetada pela, sinóvia do joelho (Fig 13). Angulações dos membros em valgo e varo e comprimento e largura podem ser afetados pela sinovite crônica. A patela é classicamente notada na hemofilia por sua forma côncava, e aplanamento dos côndilos femorais e alta fossa intercondilar tem se tornado características radiológicas da hemofilia (RODRÍGUEZ-MERCHÁN, 1996). 7 PETTERSSON, H.; WINGSTRAND, H.; THAMBERT, C.; NILSSON, I. M.; JONSSON, K. Legg-CalvePerthes Disease in Hemophilia: Incidence and Etiologic Considerations. Journal of Pediatric Orthopedics. - , v. 10, n. - , p. 28-32, - . 1990. 8 PIETRI, M. M; FRONTERA, W. R.; PRATTS, I. S.; SUAREZ, E. L. Skeletal muscle function in patients with hemophilia A and unilateral hemarthrosis of the knee. Archives of Physical Medicine and Rehabilitation. - , v. 73, n. - , p. 22-28, - . 1992. Figura 13 – Crescimento acelerado e osteopenia em um menino de 6 anos com severa hemofilia A. No lado esquerdo afetado, as epífises femoral e tibial estão aumentadas em tamanho e estão osteopênicas. Fonte: RODRÍGUEZ-MERCHÁN, E. C. Effects of hemophilia on articulations of children and adults. Clinical Orthopaedics And Related Research, Madrid, v. 1, n. 328, p. 7-13, Jul. 1996. No joelho maduro, o estágio final pode ser uma subluxação da tíbia, combinado o geno valgo, fixação em flexão, e rotação externa da tíbia. Pelo fato de que os joelhos em flexão causam tanto aumento na demanda do quadríceps quanto aumento na compressão patelofemoral, a deambulação é marcadamente comprometida por esta deformidade. Anquilose pode ocorrer no joelho (RODRÍGUEZ-MERCHÁN, 1996). 2.7.6 Hemartrose de tornozelo e pé. O envolvimento do tornozelo imaturo pode resultar em flexão plantar fixa, calcâneo valgo e varo. Episódios hemorrágicos recorrentes afetam a articulação de forma que a perda de amplitude é aparente na dorsiflexão (Fig 14). A flexão plantar é raramente afetada. É importante notar que a articulação do tornozelo é freqüentemente envolvida no lado ipsilateral ao joelho problemático. Quando o joelho é afetado, a articulação mantem-se em alguns graus de flexão. Este membro é agora encurtado e a discrepância de comprimento da perna é compensada pela flexão plantar do pé. Isto altera a posição do tálus no tornozelo e muda a linha biomecânica de força no membro. Uma vez que o pé está em posição eqüina, o calcanhar não faz mais contato com o solo. A área de sustentação de peso então é deslocada para o antepé. Hemartroses, do mesmo modo, levam a articulação do tornozelo para flexão plantar e a combinada ação destes problemas resulta em precoce perda da completa dorsiflexão do tornozelo (RODRÍGUEZ-MERCHÁN, 1996). A destruição do tornozelo adulto pode resultar em uma deformidade em valgo. Anquilose também pode ocorrer. Como com a articulação do cotovelo, severa destruição do tornozelo vista pela radiografia é ainda compatível com uma razoavelmente boa função. O que deveria ser lembrado é que como a amplitude de dorsiflexão diminui, então diminui a habilidade para andar. Para dar um passo a frente o tornozelo deve dorsifletir, e como esta amplitude está perdida, torna-se óbvio o encurtamento do passo para compensar a perda da dorsiflexão, e a rotação do quadril e joelho do membro afetado e subseqüente rotação externa. Este padrão de marcha é prejudicial para o joelho por causa do excessivo estresse no lado medial da articulação (RODRÍGUEZ-MERCHÁN, 1996). Figura 14 – Progressão da artropatia no tornozelo de um menino de 14 anos. Note a evolu’’cão de um osteófito anterior proeminente. Fonte: RODRÍGUEZ-MERCHÁN, E. C. Effects of hemophilia on articulations of children and adults. Clinical Orthopaedics And Related Research, Madrid, v. 1, n. 328, p. 7-13, Jul. 1996. 2.8 TRATAMENTO O tratamento do paciente hemofílico, hoje, é totalmente suprido pelo Governo Federal Brasileiro, que, por sua Hemo-rede, vem proporcionando ao hemofílico medicação originária dos melhores laboratórios do mundo, oferecendo ainda acompanhamento global, isto é, hematológico e clínico, realizados por profissionais treinados e capacitados no manuseio deste paciente, além de tratamento multidisciplinar prestado por ortopedistas, dentistas, enfermeiras, fisioterapeutas e psicólogos, tudo dotado de uma infra-estrutura favorável ao sucesso do tratamento (BEZERRA, 2001). O tratamento da hemartrose consiste na infusão imediata de fator VIII ou IX ao primeiro sinal de hemorragia articular, que é a chamada terapia de reposição. (BRETTLER et al., 1995). Mas, além disso, existe o tratamento profilático que é aplicado a estes pacientes, o qual será explicado mais adiante. 2.8.1 Reposição de Fator A norma no cuidado a pacientes hemofílicos em todo o mundo é a substituição de fator quando um sangramento é reconhecido (RODRÍGUEZ-MERCHÁN, 1997). Segundo Bezerra (2001), por meio de uma terapia de substituição apropriada do fator de coagulação ausente, os problemas relacionados à hemofilia podem ser controlados, conseguindo-se com isso normalização da deficiência durante o período em que dura a substituição. Os concentrados de fatores são aplicados nos hemofílicos a cada episódio hemorrágico (BEZERRA, 2001). A dosagem da substituição do fator é calculada em unidades (BRETTLER et al., 1995). Por definição, 1 unidade de fator VIII é a quantidade encontrada em 1 ml de pool de plasma fresco normal. Também por definição 1U/ml de fator é igual (VEIGA e MIRANDA, 1998). Essa dosagem do fator dependerá de vários fatores. Entre eles estão a severidade do sangramento, a localização do sangramento e a idade do paciente. A dose inicial varia de 20 a 70 IU por Kg de peso corporal. A dose será justada às necessidades individuais e a manutenção da dose será governada pela resposta clínica e pela idade (BIOTEST, 1998). Bezerra (2001) cita que até meados da década de 60 só se dispunha de sangue total ou plasma, que dificultava a reposição para atingir níveis hemostáticos normais. A partir daí os fatores VIII e IX puderam ser obtidos sob a forma de crioprecipitado. Com a evolução da ciência, surgiram os concentrados purificados de pureza intermediária e de alta pureza. Nessa evolução, surgiram o Fator Monoclonal, obtido por um sistema que usa muito menos plasma, o concentrado de fator obtido pelo sistema recombinante, que não utiliza nenhum elemento biológico. A evolução desse campo da hematologia e hemoterapia diminuiu, ou talvez, eliminou a exposição do paciente hemofílico a vírus como o HIV e hepatites (BEZERRA, 2001). Os pacientes podem ser orientados a realizar a auto-aplicação do fator em casa após um episódio hemorrágico. 2.8.1.1 Reposição de Fator - Tratamento profilático. Nos últimos anos um dos maiores debates no que se refere à hemofilia tem sido a aplicação de fator VIII ou IX de modo profilático para garotos hemofílicos severamente afetados a partir de pouca idade. (LIESNER et al., 1996). Segundo Löfqvist et al. (1997), o objetivo do tratamento profilático é converter uma hemofilia severa em uma forma moderada, assim prevenindo sangramentos articulares e o subseqüente desenvolvimento da artropatia. Astermark et al. (1999) referem que a dose recomendada é 25 a 40 IU/kg, duas (hemofilia B) ou três (hemofilia A) vezes por semana, iniciando com a idade de 1 a 2 anos. O objetivo deste regime é manter o nível do fator deficiente maior que 1%, convertendo assim uma forma severa em moderada. Entretanto, as recomendações sobre a idade e a dose de início do tratamento continuam em debate. De acordo com Fischer et al. (2002) alguns centros estipulam o início da profilaxia antes do primeiro sangramento articular, enquanto outros esperam até que um ou mais sangramentos articulares tenham ocorrido. Esse tipo de profilaxia é algumas vezes denominada profilaxia primária (a longo prazo ou permanente), diferentemente da profilaxia secundária, tratamento profilático a curto-prazo administrado depois de sangramentos recorrentes quando a artropatia freqüentemente já está presente (LJUNG, 1998). Assim, o tratamento profilático também é recomendado nas seguintes circunstâncias: crianças entre 12 e 15 anos (maturação do sistema locomotor); se os episódios hemorrágicos são freqüentes (mais que 4 por mês); hemartroses recorrentes em uma articulação; sinovite; exposição a especial estresse mental ou físico e fases pós-operatória e pós-traumática (BIOTEST, 1998). 2.8.2 Tratamento Fisioterapêutico. O ponto-chave no tratamento da hemofilia é a prevenção de todos os episódios hemorrágicos ou o tratamento precoce com a terapia de reposição quando um episódio ocorre. A fisioterapia é também parte integral deste tratamento. Um tratamento precoce com fisioterapia junto à terapia de reposição tem sido mostrado como redutores da incidência da artropatia hemofílica (BUZZARD, 1997). A fisioterapia é parte importante do tratamento global do portado de hemofilia, já que este se encontra facilmente predisposto a adquirir graves seqüelas em seu sistema músculoesquelético, no decorrer de suas atividades cotidianas (RIBEIRO e SOARES, 1986). A reabilitação tem uma função primordial na abordagem do hemofílico, tanto na prevenção quanto no tratamento das seqüelas músculo-esqueléticas. Assim, a fisioterapia pode estar atuando na prevenção, na fase aguda, subaguda e crônica, além de participar do pré e pós-operatório das cirurgias ortopédicas (GAL e NAGATA, 1985). O objetivo terapêutico é aumentar a capacidade funcional do aparelho locomotor para suportar as atividades da vida diária e seus episódios hemorrágicos habituais, diminuindo o período de imobilização, a freqüência e a duração das hemorragias (RIBEIRO e SOARES, 1986). Várias intervenções fisioterapêuticas são disponíveis para prevenir ou tratar as seqüelas de recorrentes hemartroses, como a cinesioterapia, a hidroterapia, a imobilização e a eletrotermofototerapia. 2.8.2.1. Cinesioterapia O emprego de exercícios terapêuticos será determinado pelo tipo e grau de comprometimento, pela fase do processo e o objetivo requerido. De forma geral, deverá seguir os princípios: de relaxamento; de manutenção e reforço da musculatura; de restabelecimento e manutenção da amplitude de movimento articular; de estímulo neuromotor para reforço de esquema corporal, coordenação e equilíbrio de orientação postural; e de finalidade funcional (GAL e NAGATA, 1985). A cinesioterapia será instituída precocemente, respeitando as manifestações álgicas que podem constituir fator de impedimento para a realização dos exercícios (BATTISTELLA et al., 1995). Segundo Buzzard (1997), a progressão no tratamento deve ser gradual e baseada nos achados clínicos, mas o seguinte plano de tratamento usualmente pode ser adotado: (1) exercícios isométricos nos limites do desconforto e assistência na amplitude da articulação para ajudar na reabsorção; (2) exercícios isotônicos sem peso; (3) exercícios isotônicos com peso (graduado); (4) exercícios dinâmicos com resistência progressiva e com contração concêntrica e excêntrica; (5) Treino isocinético dinâmico com várias resistências graduais como parte de um treino de fortalecimento (deve-se ter cuidado quando crianças estão sendo tratadas); (6) treino de propriocepção deve ser iniciado tão logo possível e continuado por vários meses (especialmente importante depois da sinovite de tornozelo e joelho); e (7) exercícios de flexibilidade, incluindo exercícios de alongamento. Nas primeiras 24 horas de sangramento, recomenda-se o uso de exercícios, que poupam a mobilização articular e, portanto, não provocam dor, enquanto mantém e desenvolvem força muscular. Trabalham-se os músculos ligados diretamente à articulação comprometida e todos aqueles que irão participar de um equilíbrio dinâmico e estático ed finalidade funcional (GAL e NAGATA, 1985). Por causa da influência traumática dos exercícios isotônicos e isocinéticos na musculatura e ligamentos, leve exercício isométrico na tolerância da dor pode ser iniciada na fase aguda da hemofilia para promover melhora na integridade muscular e da articulação (PELLETIER et al., 1987). O início do exercício isométrico pode começar em uma idade bastante precoce em pacientes com hemofilia como uma técnica de tratamento e como uma possível medida preventiva. O exercício isométrico pode começar cedo durante a recuperação das hemartroses pois ele permite um controle voluntário da intensidade da contração muscular. Esta intensidade pode ser mínima inicialmente, mas pode aumentar a nutrição e minimizar o trauma na presença da suplementação de fator. Mantendo a força muscular, o exercício isométrico pode diminuir ou eliminar a necessidade de uma reeducação muscular. A intensidade da contração pode ser aumentada voluntariamente pelo indivíduo de acordo com a sua tolerância e com a melhora da sua condição (PELLETIER et al., 1987). Estudos anteriores com indivíduos hemofílicos têm demonstrado que em uma mínima quantidade de tempo, o exercício isométrico pode aumentar a força e a mineralização óssea. Isto pode diminuir a probabilidade ou a gravidade da destruição da articulação e da musculatura associada, enquanto o indivíduo está sujeito a episódios hemorrágicos espontâneos e traumáticos (LIBERSON e ASA9, apud PELLETIER et al., 1987). Normas específicas para a duração, freqüência, e intensidade do exercício para os hemofílicos não têm sido demonstradas adequadamente na literatura. Koch et al. (1982) descreveu um programa de reabilitação para indivíduos com hemofilia. Eles referem em seu artigo o uso de exercício isométrico, mas omitem detalhes específicos. Pelletier et al. (1987), então, realizaram exercícios isométricos com um menino de 12 anos com hemofilia A severa. O estudo experimental consistiu de três semanas (9 sessões) de mensurações das variáveis, três semanas (9 sessões) de tratamentos e mensurações, e três semanas (9 sessões) de retorno às mensurações. Durante a fase experimental os exercícios isométricos para o quadríceps femoral e ísquio-tibiais foram realizados em 45, 60 e 90 graus de flexão do joelho. O paciente realizava a máxima contração voluntária para cada ângulo. Então, o paciente era estimulado a realizar 10 repetições de 10 segundos de contração com dois terços ou mais da máxima contração voluntária. Dez segundos de descanso seguiam cada repetição. Seus resultados demonstraram um aumento na força muscular em um indivíduo hemofílico. O tratamento com exercício isométrico nesta intensidade não foi associado com um aumento na incidência de hemartroses, sangramentos musculares, e outras condições patológicas. Nas primeiras sessões, entretanto, eles perceberam uma inicial perda de força. 9 LIBERSON, W. T; ASA, M. M. Further Studies of Brief Isometric Exercices. Archives of Physical Medicine and Rehabilitation. - , v. 40, n. - , p. 330-336, - . 1959. Esta observação sugere que na primeira ou segunda semana de tratamento, o nível de exercício possa ser um pouco menor. Dez repetições de 10 segundos realizadas três vezes por semana ou menos foram suficientes para aumentar a força muscular de 40% a 70% em três semanas. À medida que diminui o volume articular e a dor, iniciam-se mobilizações ativas e suaves. Poderá imprimir-se gradativamente uma resistência cuidadosa manual ou através de pesos, iniciando-se com 0,5 kg por semana, para evitar sangramentos, aumentando progressivamente até poder fazer uso de bicicleta ou outros dispositivos de mecanoterapia. (GAL e NAGATA, 1985). No exercício isocinético os membros são movidos a uma velocidade constante, e a resistência contra o músculo é adaptável, sendo então, a máxima tensão muscular mantida por todo o arco de movimento da articulação. Em contraste, o mais convencional exercício isotônico move um certo peso através da ADM. Entretanto, como os músculos são relativamente ineficientes em certas posições articulares, o exercício isotônico pode usar um peso que se adapta ao ponto mais fraco na ADM, e durante o resto do arco de movimento o músculo está sendo completamente fortalecido. Embora o exercício isométrico teoricamente produza máxima contração sem movimento articular, eles têm sido mostrados como produzindo menor potencial muscular do que os exercícios isocinéticos. Os exercícios isocinéticos também podem ser benéficos porque eles permitem a modulação da contração muscular durante todo o arco de movimento (GREENE e STRICKLER, 1983). No programa de exercícios ativos resistidos para os extensores de joelho realizados por Koch et al. (1982), estes foram iniciados com o peso de 1 Ib (1Ib = 0,4536kg), podendo progredir para 4 Ib. Segundo Pelletier et al. (1987), embora o programa de exercícios descritos por eles possa ser conveniente, não é vigoroso o suficiente para restaurar a força total do quadríceps femoral, que pode ser 10 a 20 vezes mais forte que a resistência utilizada no estudo. Os indivíduos estão limitados a usar o peso na região em que a parte mais fraca do músculo pode completar a ADM. Estresse considerável pode ser esperado em certas articulações e tecidos conectivos, particularmente na fase excêntrica destes exercícios, embora a musculatura mais forte pode não estar suficientemente estressada para aumentar a força em certos pontos na dada ADM. Greene e Strickler (1983) apresentaram um diferente programa usando exercícios isocinéticos para os extensores e flexores de joelho, para serem realizados em casa. Os exercícios foram feitos na posição sentada, com as pernas livres. Começando com os joelhos flexionados a 90º, a perna esquerda está cruzando a tíbia distal direita. Contrações simultâneas dos flexores de joelho esquerdos e extensores de joelho direitos foram estimuladas. O paciente foi estimulado a empurrar com o máximo de força que ele poderia tolerar, enquanto as pernas ganhavam a extensão completa em 5 a 10 segundos. A perna direita era então cruzada sobre a tíbia distal esquerda para o fortalecimento dos flexores do joelho direitos e extensores do joelho esquerdos, os pacientes eram encorajados a realizar o programa por 15 minutos todos os dias, durante seis meses. Como resultado obtiveram a redução da incidência de hemartroses agudas nos joelhos, aumento da força muscular, mensuradas através dos torques dos extensores e flexores do joelho. Se uma hemartrose ocorre, o paciente deve retornar para os exercícios isométricos, e novamente progredir dos exercícios ativos contra a gravidade para os ativos contra resistência. (KOCH et al., 1982). Battistella et al. (1995) cita que a única recomendação que se faz com respeito à cinesioterapia é no que tange ao uso dos exercícios isotônicos contra resistência , já que o risco de aparecimento precoce de artrose fêmuro-patelar torna esta modalidade de exercício parcialmente contra-indicada. Restrição semelhante é feita aos exercícios passivos pelo risco de desencadear-se hemorragia articular e/ou muscular. De acordo com Gal e Nagata (1985) também existe resistência e até mesmo contraindicação à mecanoterapia, por não respeitar exatamente os eixos articulares fisiológicos, favorecendo e agravando as instabilidades ligamentares. No entanto, a supervisão adequada ou a utilização de equipamentos com resistência controlada (isocinéticos, tipo Cibex) podem ser úteis dentro de suas indicações. As técnicas de Kabat são métodos de exercícios de resistência manual que, ao contrário de trabalharem a contração isolada de determinados músculos, têm por objetivo a realização de padrões de movimentos e contrações complexas e são especialmente valiosas para reintegrar o músculo à sua condição de funcionamento normal, combatendo as contraturas e atitudes viciosas, sendo um técnica que pode ser utilizada com um paciente hemofílico (RIBEIRO e SOARES, 1986). Atividades de recreação também são importantes no fortalecimento e na manutenção da força muscular. A natação é sugerida para todos os pacientes, pois quase não há riscos de causar um episódio hemorrágico com esta atividade. Na natação o paciente adquire boa amplitude de movimento e pode realizar exercícios de fortalecimento (KOCH et al., 1982). É interessante ressaltar que a literatura refere um aumento de nível do fator VIII na população normal após a realização de exercícios, mas isto não parece ser significativo nos hemofílicos (GAL e NAGATA, 1985). Rizza10 (apud KOCH et al., 1982), demonstrou em um estudo com 15 adultos normais e 2 hemofílicos leve exercitados ativamente, a elevação significante do nível de fator VIII. Em relação aos estudos citados anteriormente na cinesioterapia todos se tratam de estudos não conclusivos, com metodologia pobre, representando na sua maioria estudos de caso. 2.8.2.2 Imobilização A imobilização é de grande importância para o alívio da dor ou desconforto e para prevenção ou correção das deformidades, na fase aguda. Geralmente é feita por uma tala gessada ou de material termoplástico (RIBEIRO e SOARES, 1986). Segundo Buzzard (1997), o uso de talas é efetivo em um curto período de tempo para hemartroses agudas e subagudas; e o uso excessivo de talas pode levar a uma diminuição adicional na força muscular e instabilidade, causando hemartroses adicionais. Imobilizar a articulação afetada pode ser um recurso valioso já que o repouso articular leva à melhoria da sintomatologia dolorosa propiciando, ainda, proteção à articulação. Todavia, a imobilização tem seus efeitos deletérios já que a mesma pode levar a um menor ou maior grau de atrofia muscular. Deve ser usada por curtos períodos e somente quando for absolutamente necessária e sempre utilizar as contrações isométricas para tentar minimizar os efeitos indesejáveis da imobilização. Algumas vezes, ao invés de prescrever uma goteira gessada, simplesmente prescreve-se o uso de suportes para deambulação, evitando-se carga sobre a articulação afetada (BATTISTELLA et al., 1995). Para Heijnen e Roosendaal (1997), quando a terapia de reposição é disponível e instituído como altas doses profiláticas ou como adequada terapia precoce, a imobilização não é muito usada. Entretanto, se a terapia de reposição não é disponível ou quando um paciente tem uma alta quantidade de inibidores, a imobilização é útil. Isto especialmente é verdade se há uma história de recorrentes hemartroses ou aumento do inchaço da sinovite começando à noite por causa de movimentos descontrolados durante o sono. De acordo com Buzzard (1997), se um paciente é suscetível a ter episódios de sangramento em uma determinada articulação, é benéfico ter uma tala de material 10 RIZZA, C. R. Effect of Exercise on Level of Antihaemophilic Globulin in Human Blood. Journal of Physiology. - , v. 156, n. - , p. 128-135, - . 1961. termoplástico disponível que possa ser aplicado tão logo um novo episódio hemorrágico ocorra, reduzindo assim, os efeitos lesivos de uma hemorragia aguda 2.8.2.3 Crioterapia A terapêutica pelo gelo tem sido particularmente indicada durante a fase aguda para diminuir a dor e o mal estar, auxiliar na contenção das hemorragias e no relaxamento muscular (RIBEIRO e SOARES, 1986). Segundo Buzzard (1997), o uso do gelo é benéfico no tratamento das hemartroses por produzir três principais efeitos: anestesia local produzida pela redução da taxa de condução dos nervos sensoriais; uma redução na taxa metabólica na área que está sendo tratada; e mudanças na circulação local. Gal e Nagata (1985) citam os seguintes efeitos fisiológicos da crioterapia na hemofilia: diminuição da produção de substâncias algógenas, lentificação dos processos metabólicos e da proteólise responsável pela degeneração da cartilagem; hemostasia; redução da atividade dos receptores sensitivos da condução nervosa e a excitabilidade das fibras A delta, condutoras de dor; diminuição da atividade do sistema músculo-fusal responsável pela manutenção do tônus. O gelo produz vasoconstrição superficial e seus efeitos mais importantes parecem ser a redução da dor no trauma agudo, e a redução da taxa metabólica das células que não estão lesadas ao redor da área (BUZZARD, 1997). Durante a fase crônica, o tratamento pelo frio é menos empregado, mas quando ao fim dos exercícios observa-se aumento de temperatura na articulação tratada, usa-se este tipo de terapia como medida profilática (RIBEIRO e SOARES, 1986). 2.8.2.4 Correntes elétricas. Na eletroterapia, diversas correntes elétricas podem ser utilizadas com diferentes objetivos, como a corrente galvânica, as diadinâmicas e a TENS, além das excito motoras, como o FES e a corrente russa. 2.8.2.4.1 Correntes Contínuas (galvanização e iontoforese) A iontoforese acelera o processo de reabsorção do hematoma ou do derrame associado às propriedades eletroforéticas da corrente e o transporte de íons. Mais comumente é empregado o bicloridrato de histamina a 1/10.000 por sua ação repulsiva, contra-irritativa e vasodilatadora. Empregou-se no passado a iontoforese com hialuronidase, pois acreditava-se que a hidrólise do ácido hialurônico contido nos tecidos intersticiais facilitaria a circulação dos fluidos e partículas e sua reabsorção. O maior benefício da iontoforese, no entanto, está na ação direta da corrente em si; em muito casos a histamina se mostra irritativa para a pele, trazendo maior desconforto; neste caso, a galvanização simples será suficiente (GAL e NAGATA, 1985). 2.8.2.4.2 Correntes diadinâmicas As correntes diadinâmicas aceleram a reabsorção de fluidos, mantêm o trofismo muscular e propiciam uma melhor identificação do esquema corporal, sobretudo em crianças que permanecem por tempo prolongado (GAL e NAGATA, 1985). 2.8.2.4.3 Estimulação Nervosa Elétrica Transcutânea (TENS) A estimulação nervosa transcutânea é uma modalidade eletroterapêutica não-invasiva usada para tratar dores agudas e crônicas (BUZZARD, 1997). De acordo com Buzzard (1997), a TENS usa impulsos elétricos de baixa intensidade para estimular nervos periféricos, que ativam circuitos locais inibitórios na coluna dorsal da medula espinhal. Estes inibem a transmissão da informação nociceptiva ao longo dos nervos, aliviando ou reduzindo a dor. Além disso, a TENS leva o organismo a liberar suas próprias substâncias redutoras da dor, as endorfinas. 2.8.2.4.4 Correntes excitomotoras. Gal e Nagata (1985) descrevem a utilização de correntes para estímulo trófico sempre que a cinesioterapia não puder ser utilizada. 2.8.2.5 Ultra-som (US) Segundo Buzzard (1997) no ultra-som terapêutico são emitidas ondas sonoras de alta freqüência pelo transdutor, que podem produzir calor usando um feixe contínuo, ou o aquecimento dos tecidos pode ser evitado utilizando-se um feixe pulsado. Os efeitos biológicos do ultra-som auxiliam no reparo tecidual, e tem sido demonstrado que o US tem efeito no processo inflamatório e nas mudanças na taxa de permeabilidade da membrana celular. Isto também pode reduzir a dor e acelerar o reparo tecidual. 2.8.2.6. Diatermia por Ondas Curtas Pulsada (DOCP) Os aparelhos de DOCP não emitem um fluxo contínuo de energia para os tecidos e, conseqüentemente, não é transmitido tanto calor como ocorreria na diatermia por ondas curtas contínuas. Isto é importante quando se trata alguém com hemofilia, onde um aumento na vasodilatação nos vasos sanguíneos não é benéfico porque pode causar adicional sangramento intraarticular (BUZZARD, 1997). Ainda de acordo com Buzzard (1997), os efeitos gerais da energia pulsada de alta freqüência são os seguintes: aumento no número de células brancas, histiócitos e fibroblastos nos tecidos moles que envolvem a articulação; aumento da taxa de dispersão do edema; melhora na reabsorção da hemartrose; e redução da inflamação. Buzzard e Jones11 (apud BUZZARD, 1997) sugerem que baixas doses devem ser usadas para hemartroses agudas e, progredindo para doses mais altas enquanto o sangramento é resolvido. 2.8.2.7 Hidroterapia Os efeitos terapêuticos do exercício na água são: alívio da dor, redução do espasmo muscular; manutenção da ADM, fortalecimento muscular; aumento na tolerância ao exercício; melhora na circulação; melhora na estabilidade, coordenação, postura e propriocepção; e encorajamento para atividades adicionais (BUZZARD, 1997). O calor da água ajuda a reduzir a dor e as articulações podem ser suavemente exercitadas usando a flutuação da água. Quando a articulação é afetada por repetidos 11 BUZZARD, B. M.; JONES, P. J. Physiotherapy Management of Haemophilia. An update. Physiotherapy. - , v. 74, n. - , p. 221-226, - . 1988. sangramentos, a hidroterapia por auxiliar a manter a ADM naquela articulação se um aumento na movimentação não é possível por causa de mudanças estruturais já presentes nas superfícies articulares (BUZZARD, 1997). A flutuação da água pode ajudar a fortalecer os músculos que envolvem a articulação afetada. Isto é conseguido pelo uso de suaves exercícios graduados usando a flutuação como assistência, suporte, ou resistência. A progressão é gradual; o que é especialmente importante para as articulações que suportam peso. A hidroterapia é particularmente um bom meio para restabelecer a estabilidade, a coordenação e a propriocepção que podem ter sido perdidos no joelho ou tornozelo depois de um episódio hemorrágico (BUZZARD, 1997). 3 METODOLOGIA A revisão sistemática (sinônimos: systematic overview; overview; qualitative review) é uma revisão planejada para responder a uma pergunta específica e que utiliza métodos explícitos e sistemáticos para identificar, selecionar e avaliar criticamente os estudos, e para coletar e analisar os dados destes estudos incluídos na revisão. Os métodos estatísticos (metaanálise) podem ou não ser utilizados na análise e na síntese dos resultados dos estudos incluídos. Assim, a revisão sistemática utiliza toda esta estruturação para evitar viés – tendenciosidade - em cada uma de suas partes (CASTRO, 2001a). Segundo Castro (2001a), a revisão sistemática está dividida em sete passos: Formulação da pergunta: questões mal formuladas levam a decisões obscuras sobre o que deve ou não ser incluído na revisão. Assim uma pergunta bem formulada, onde são definidos os pacientes/doença e a intervenção é o passo inicial na realização da revisão sistemática (CASTRO, 2001a). Localização e seleção dos estudos: não existe uma única fonte de busca de estudos. Para identificar todos os estudos relevantes pode-se utilizar as bases de dados eletrônicas, verificar as referências bibliográficas dos estudos relevantes, solicitar estudos de especialistas, e pesquisar manualmente algumas revistas e anais de congressos. Para cada uma das fontes utilizadas deve ser detalhado o método utilizado (CASTRO, 2001a). Avaliação crítica dos estudos: são critérios para determinar a validade dos estudos selecionados e qual a probabilidade de suas conclusões estarem baseadas em dados viciados. Com a avaliação crítica determina-se quais são os estudos válidos que irão ser utilizados na revisão; e os que não preenchem os critérios de validade são citados e explicado o porquê de sua exclusão (CASTRO, 2001a). Coleta de dados: todas as variáveis estudadas devem ser observadas nos estudos e resumidas, além das características do método, dos participantes e dos desfechos clínicos, que permitirão determinar a possibilidade de comparar ou não os estudos selecionados. Algumas vezes será necessário entrar em contato com o autor dos estudos para pedir-lhe informações mais detalhadas (CASTRO, 2001a). Análise e apresentação dos dados: baseados na semelhança entre os estudos, estes serão agrupados para a meta-análise. Cada um desses agrupamentos deverá ser preestabelecido no projeto, assim como a forma de apresentação gráfica e numérica, para facilitar o entendimento do leitor (CASTRO, 2001a). Interpretação dos dados: é determinada a força da evidência encontrada, a aplicabilidade dos resultados, informações sobre custo e a prática corrente que sejam relevantes, e determinados claramente os limites entre os benefícios e os riscos (CASTRO, 2001a). Aprimoramento e atualização da revisão - uma vez publicada a revisão sofrerá críticas e receberá sugestões que devem ser incorporadas às edições subseqüentes, caracterizando uma publicação viva, e ainda ser atualizada cada vez que surjam novos estudos sobre o tema (CASTRO, 2001a). 3.1 Critérios de inclusão dos estudos. Para a realização da revisão sistemática os artigos a serem utilizados devem apresentar algumas características especiais. Os critérios utilizados para a seleção dos estudos para a revisão foram os seguintes: Tipos de estudos: Qualquer ensaio clínico randomizado ou quase-randomizado que apresente especificação dos participantes, intervenções e resultados de acordo com os critérios da revisão. São utilizados estes tipos de estudos, visto que estes demonstram maior evidência, apresentando melhor metodologia e resultados conclusivos. Tipos de participantes: Indivíduos portadores de hemofilia, tipo A ou B. Tipos de intervenção: Qualquer intervenção Fisioterapêutica utilizada no tratamento ou na prevenção de hemartroses em hemofílicos, comparada com outro tratamento fisioterapêutico ou com o controle. Tipos de resultados mensurados: Número de hemartroses, dor, força e trofismo muscular, amplitude de movimento (ADM) e classificação radiológica das articulações. 3.2 Estratégia de busca para identificação dos estudos. A busca foi realizada utilizando-se as bases de dados eletrônicas MEDLINEPUBMED, LILACS e Biblioteca Cochrane. Além disso, foram consultados centros de atendimento a hemofílicos. Na MEDLINE a pesquisa foi realizada com os termos específicos descritos a seguir: 1. Haemophilia 2. Hemophilic 3. Hemarthrosis 4. #1 or #2 or #3 5. Prevention 6. Physiotherapy 7. Physical therapy 8. Rehabilitation 9. #5 or #6 or #7 or #8 10. #4 and #9 11. randomized controlled trials 12. quasi-randomized controlled trials 13. randomized trials 14.RCT 15. RT 16. # 11 or #12 or #13 or #14 or #15. 17. #10 and #16 Na LILACS, os termos utilizados para a pesquisa foram: 1. Hemofilia 2. Hemofílicos 3. Hemartrosis 4. #1 or #2 or #3 5. Prevención 6. Fisioterapia 7. Rehabilitación 8. # 5 or #6 or #7 9. #4 and #8 10. Ensaio clinico randomizado 11. Ensaio clinico quase randomizado 12. Ensaio randomizado 13. #10 or #11 or #12 14. #10 and #12 Para selecionar os estudos que seriam incluídos, foram lidos os abstracts dos estudos que poderiam fazer parte da revisão. 3.3 Análise dos dados A análise dos dados de uma revisão sistemática envolve dois processos: análise da qualidade dos estudos e análise estatística (CASTRO, 2001b). Na análise da qualidade dos estudos são observados a validade interna, a validade externa e o método estatístico usado em cada estudo e no conjunto. Dessa análise resultam a primeira e a segunda partes dos resultados de uma revisão sistemática – a primeira é a qualidade metodológica e a segunda, a descrição das variáveis (CASTRO, 2001b). Na análise estatística são feitas múltiplas metanálises e análises de sensibilidade. Este conjunto de cálculos resulta na terceira e última parte dos resultados - os desfechos clínicos (CASTRO, 2001b). A meta-análise, ou metanálise, ou ainda, metaanálise (sinônimos: quantitalive review; pooling; quantitative synthesis) é o método estatístico utilizado na revisão sistemática para integrar os resultados dos estudos incluídos. O termo também é utilizado para se referir a revisões sistemáticas que utilizam a meta-análise (CASTRO, 2001a). A análise da qualidade dos estudos tem caráter qualitativo, enquanto que a análise estatística é quantitativa. Uma revisão sistemática não envolve obrigatoriamente uma metanálise, seu planejamento precisa ser delineado antes do início da revisão sistemática. A análise estatística (metanálise) só pode ser executada se os estudos incluídos forem semelhantes, ou seja, se a amostra, a intervenção e os desfechos clínicos forem homogêneos. Se a combinação dos estudos não fizer sentido clínico, a metanálise não deve ser executada (CASTRO, 2001b). A principal justificativa para a avaliação da qualidade dos estudos incluídos é a detecção das semelhanças (homogeneidades) e diferenças (heterogeneidades) entre eles. Os aspectos analisados envolvem método, participantes, intervenção e desfechos clínicos (CASTRO, 2001b). 3.3.1 Análise da qualidade dos estudos Depois de coletar e tabular os dados é possível comparar um estudo com outro a fim de verificar semelhanças e diferenças. A qualidade é avaliada pelos componentes que foram coletados em quatro seções (método, participantes, intervenção e desfechos clínicos) e comparados ao padrão de referência que foi adotado (CASTRO, 2001b). A validade externa dos estudos é avaliada pelo conhecimento da situação clínica. Já a validade interna é verificada pelo conhecimento do método científico. Por mais que se queira simplificar e separar estas avaliações, na maior parte das vezes, os conhecimentos clínico e científico não podem ser separados - são, portanto, indissociáveis (CASTRO, 2001b). O processo de avaliação da qualidade pode, e deve, ser complementado pelo uso de listas e escalas de qualidade. Uma destas listas é a de Jadad et al.12 (apud CASTRO, 2001b). Nesta lista, uma relação com os itens constantes em várias escalas e listas de critérios de avaliação de ensaios clínicos aleatórios foi construída por um painel multidisciplinar de seis especialistas, que a resumiram em três itens, diretamente relacionados com a redução de tendenciosidades (validade interna). Este instrumento de avaliação da qualidade tem duas opções de resposta: sim ou não (CASTRO, 2001b). Estes itens são: 1.a) O estudo foi descrito como aleatório (uso de palavras como "randômico", "aleatório", "randomização")? 1.b) O método foi adequado. 2.a) O estudo foi descrito como duplo-cego? 2.b) O método foi adequado? 3) Houve descrição das perdas e exclusões? (CASTRO, 2001b). Pontuação: cada item (1, 2a e 3a) recebe um ponto para a resposta sim ou zero ponto para a resposta não. Um ponto adicional é atribuído se, no item 1b, o método de geração da seqüência aleatória foi descrito e foi adequado; no item 2b, se o método de mascaramento duplo-cego foi descrito e foi adequado. Um ponto é deduzido se, na questão 1b, o método de geração da seqüência aleatória foi descrito, mas de maneira inadequada; na questão 2b, se foi descrito como duplo-cego, mas de maneira inadequada (CASTRO, 2001b). Em relação aos três itens citados descritos por Jadad et al.12 (apud CASTRO, 2001b) para a avaliação pela escala de qualidade temos: a) Para a randomização: o método de geração da seqüência aleatória será considerado apropriado se permitir a cada participante do estudo ter a mesma chance de receber cada intervenção, e o investigador não puder prever qual será o próximo tratamento. Métodos de geração da seqüência usando data de aniversário, data de admissão, número de registro no hospital, ou alternância entre os grupos são considerados inadequados (CASTRO, 2001b). b) Para o mascaramento duplo-cego: um estudo deve ser considerado duplo-cego se a termo "duplo-cego" é usado. O método será considerado apropriado se nem o responsável pelo cuidado do paciente e nem o paciente tiveram como identificar o tipo de tratamento dado 12 JADAD, A. R.; MOORE, R. A.; CARROL, D. JENKINSON, C.; REYNOLDS, J. M. GAVAGHAN, D. J., MCQAUY, H. J. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Controled Clinical Trials, - , v. 17, n. 1, p. 1-12, - . 1996. a cada um, ou, na ausência desta declaração, se o uso de placebos idênticos ou limitações foram mencionados (CASTRO, 2001b). c) Para as perdas e exclusões: os participantes que entraram no estudo mas não completaram o período de observação ou que não foram incluídos na análise têm que ser descritos. O número e as razões para perdas em cada grupo têm que ser declarados. Se não houve perdas, isto também tem que ser declarado no artigo. Se não houver descrição de perdas, deve-se atribuir a nota zero a este item (CASTRO, 2001b). Um máximo de cinco pontos pode ser obtido: três pontos para cada sim, um ponto adicional para um método adequado de randomização e um ponto adicional para um método adequado de mascaramento. Um estudo é considerado de má qualidade se ele receber dois pontos ou menos (CASTRO, 2001b). 3.3.2 Análise Estatística: Metanálise As análises dependem do tipo de desfecho clínico (ou seja, da variável) que está sendo analisada. As variáveis podem ser: dicotômicas, contínuas ou ordinais. De acordo com a categoria da variável, alguns dados específicos são coletados (CASTRO, 2001b). Uma vez estabelecido que faz sentido executar a metanálise, os estudos podem ser agrupados. Como regra geral, pelo menos duas metanálises são produzidas: a primeira com todos os estudos classificados como A e outra com os estudos classificados como B, de acordo com o sigilo da alocação. Estas duas metanálises podem ser apresentadas em um mesmo gráfico (figura), no qual os estudos A (com descrição adequada do sigilo da alocação) são agrupados sendo calculado um subtotal para eles, assim como o mesmo é feito para os estudos B (que não descrevem o sigilo da alocação) com seu subtotal. Ao final tem-se um total dos dois grupos de estudos (CASTRO, 2001b). 3.3.2.1 Análise da sensibilidade A análise de sensibilidade (que é a segunda parte da análise estatística) é usada para determinar qual a sensibilidade dos resultados de um estudo ou de uma revisão sistemática quando são mudados os premissas da forma como foi feita. A análise de sensibilidade é usada para avaliar qual o grau de confiança dos resultados em situações de decisões incertas ou suposições sobre os dados e resultados usados (CASTRO, 2001b). A seguir há a descrição de possíveis análises de sensibilidade. O que existe é uma variação das possíveis formas de executar a análise de sensibilidade. O uso de todas as formas possíveis é recomendado em qualquer revisão sistemática (CASTRO, 2001b): Mudando os critérios de inclusão (tipos de participantes, intervenções, medidas de desfechos e pontos de corte metodológicos); a metanálise de ensaios clínicos aleatórios foi realizada por duas comparações de ensaios clínicos: uma com todos os ensaios clínicos aleatórios e a outra apenas com ensaios clínicos com sigilo da alocação adequada. Em cada comparação, os ensaios clínicos foram estratificados levando-se em conta o grupo experimental, de acordo com a homogeneidade clínica (validade externa) (CASTRO, 2001b). Incluindo ou excluindo estudos que apresentaram alguma ambigüidade nos seus critérios de inclusão (CASTRO, 2001b); Excluindo estudos não-publicados (CASTRO, 2001b); Excluindo estudos de baixa qualidade metodológica (estudos graduados na escala de Jadad de zero a três) (CASTRO, 2001b); Reanalisando os dados utilizando uma variação razoável dos resultados dos estudos, onde havia alguma incerteza sobre os resultados (CASTRO, 2001b); Reanalisando os dados colocando uma variação razoável de valores para dados perdidos: os revisores assumiram que participantes que se perderam do grupo experimental apresentaram insucesso no tratamento e aqueles que se perderam do grupo controle apresentaram melhora, para as variáveis dicotômicas (CASTRO, 2001b); Reanalisando os dados utilizando métodos estatísticos diferentes (CASTRO, 2001b); O uso destas múltiplas análises de sensibilidade vai influenciar na determinação do grau de certeza dos resultados. A função delas é identificar se a modificação de alguns critérios é suficiente para modificar os resultados e a interpretação da metanálise. Se houver mudança no resultado da metanálise, a confiança nos resultados será menor. A análise de sensibilidade auxilia no aumento ou redução, da confiança nos resultados da metanálise. No entanto, a ausência de heterogeneidade estatística não implica que não exista heterogeneidade clínica e/ou metodológica (CASTRO, 2001b). 3.4 Apresentação dos resultados Os resultados da revisão sistemática são divididos em três partes: descrição dos estudos, qualidade dos estudos e resultado das variáveis. A primeira e a segunda parte dos resultados são descritivas. A terceira parte é quantitativa e os detalhes importantes da análise estatística devem ser apresentados (CASTRO, 2001b). Na parte descritiva dos resultados é preciso fazer a descrição das variáveis com os valores necessários para avaliar o efeito da intervenção, isto é, número total de participantes e de estudos, número de eventos e tamanho de cada grupo, número relativo de eventos, e ponto estimado e o intervalo de confiança de 95% para a medida do efeito da intervenção (CASTRO, 2001b). 4 RESULTADOS Não foi encontrado nenhum ensaio clínico que preenchesse os critérios de inclusão, ou seja, não foi encontrado nenhum ensaio clínico randomizado ou quase-randomizado. 5 DISCUSSÃO Devido à falta de ensaios clínicos com boa qualidade metodológica, percebe-se a falta de evidências para embasar a ação da fisioterapia no paciente hemofílico, tanto na prevenção como no tratamento das seqüelas das hemartroses, mesmo sabendo que este tipo de intervenção tem sido muito utilizada e que tem demonstrado grande importância pra o bemestar e a boa condição do sistema músculo-esquelético desse pacientes. 6 CONCLUSÃO Faltam estudos com boa qualidade metodológica para que existam evidências para embasar as intervenções fisioterapêuticas na prevenção e tratamento das hemartroses dos pacientes hemofílicos. REFERÊNCIAS BIBLIOGRÁFICAS AIRES, M.M. Fisiologia. Rio de Janeiro: Guanabara Koogan, 1991. ASTERMARK, J.; PETRINI, P.; TENGBORN, L.; SCHULMAN, S.; LJUNG, R.; BERNTORP, E. Primary prophylaxis in severe haemophilia should be started at an early age but be individualized. British Journal of Haemotology, Gothenburg, v. 105, n. - . p. 11091113, - . 1999. BATTISTELLA, L. R.; LOURENÇO, C.; RIBEIRO, J. B. S. Reabilitação em hemofilia. In: LIANZA, S. Medicina de reabilitação – Sociedade brasileira de medicina física e reabilitação. 2. ed. Rio de Janeiro: Guanabara Koogan, 1995. BATTISTELLA, L. R.; PAPLER, P. G.; TIEPPO, A.; CARELLI, C. R. Medicina de reabilitação e hemofilia – Imperativos. Boletim da sociedade brasileira de hematologia e hemoterapia, São Paulo, v. 7, n. 136, p. 229-234, nov/dez. 1985. BERNE, R. M.; LEVY, M. N. Fisiologia. 3. ed. Rio de Janeiro: Guanabara Koogan, 1996. BESUSCHIO, S.; SERRANO, M. S. Patologia ósteoarticular de la hemofilia. Prensa Médica Argentina, Buenos Aires, v. 88, n. 8, p. 717-729, oct. 2001. BEZERRA, J. Noções básicas sobre hemofilia. Hematologia-Hemoterapia, São Paulo, v. 7, n. 2, p. 19-20, mar/abr. 2001. BIOTEST. Haemoctin SDH/Factor VIII Bioset – Quality and Safety in the Management of Haemophilia.1998. BRETTLER, D. B.; KRAUS, E.; LEVINE, P. H. Clinical Aspects of and therapy for hemophilia A. In: HOFFMAN, R.; BENZ, E. J.; SHATTIL, S. J.; FURIE, B.; COHEN, H. J.; SILBERSTEIN, L. E. Hematology – Basic Principles and Practice. 2. ed. New York: Churchill Livingstone, 1995. BUZZARD, B. M. Physiotherapy for prevention and treatment of chronic hemophilic synovitis. Clinical Orthopaedics And Related Research, Newcastle, v. 1, n. 343, p. 42-46, out. 1997. Disponível em: http://gateway2.ovid.com/ovidweb.cgi. Acesso em: 28 out. 2002. CASTRO, A. A. Revisão Sistemática: Análise e Apresentação dos Resultados. São Paulo: AAC; 2001a. Disponível em: http://www.metodologia.org. Acesso em: 03 set. 2002. CASTRO, A. A. Revisão sistemática Com ou Sem Metanálise. São Paulo: AAC; 2001b. Disponível em: http://www.metodologia.org. Acesso em: 03 set. 2002. FALK, B.; PORTAL, S.; TIKTINSKY, R.; WEINSTEIN, Y.; CONSTANTINI, N.; MARTINOWITZ, U. Anaerobic power and muscle strength in young patients with hemophilia A. Medicine & Science in Sports & Exercise, Tel HaShomer, v. 32, n. 1, p. 5257, - . 2000. FAVIER, R.; LAVERGNE, J.; COSTA, J.; CARON, C.; MAZURIER, C.; VIÉRMONT, M.; DELPECH, M.; VALLEIX, S. Unbalanced X-chromosome inactivation with a novel FVIII gene mutation resulting in severe hemophilia A in a female. Blood, Paris, v. 96, n. 13, p.43734375, dec. 2000. Disponível em: <http://www.bloodjournal.org/cgi/content/full/96/13/4373>. Acesso em: 15 jan. 2003. FISCHER, K.; BOM, J. G.; MAUSER-BUNSCHOTEN, E. P.; ROOSENDAAL, G.; PREJS, R.; KLEIJN, P.; GROBBEE, D. E.; BERG, M. The effects of postponing prophylactic treatment on long-term outcome in patients with severe hemophilia, Blood, Utrecht, v. 99, n. 7, p. 2337-2341, abril. 2002. GAL, P. L. M.; NAGATA, A. Y. Medicina física no tratamento das seqüelas músculoarticulares da hemofilia - bases fisiológicas do uso de agentes físicos. Boletim da Sociedade Brasileira de Hematologia e Hemoterapia, São Paulo, v. 7, n. 136, p. 235-238, nov/dez. 1985. GREENE, W. B.; STRICKLER, E. M. A modified isokinetic strengthening program for patients with severe hemophilia. Developmental Medicine and Child Neurology, Chapel Hill, v. 25, n. 2, p. 198-196, abril. 1983. GUYTON, A. C.; HALL, J. E. Tratado de Fisiologia Médica. 9. ed. Rio de Janeiro: Guanabara Koogan, 1997. HEDNER, U.; GINSBURG, D.; LUSHER, J. M.; HIGH, K. A. Congenital hemorrhagic disorders: new insights into the pathophysiology and treatment of hemophilia. Hematology American Society of Hematology Education Program Book, - , v. 1, n. - , p. 241-265, dec. 2000. Disponível em: <http://www.asheducationbook.org/cgi/content/full/2000/1/241>. Acesso em: 20 dez. 2002. KOCH, B.; COHEN, S.; LUBAN, N. C.; ENG, G. Hemophiliac knee: rehabilitation techniques. Archives of Physical Medicine and Rehabilitation, Washington, v.63, n. 8, p. 379-382, ago. 1982. LIESNER, R. J.; KHAIR, K.; HANN, M. The impact of prophylactic treatment on children with severe haemophilia. British Journal of Haematology, London, v. 92, n. - . p. 973-978, . 1996. LJUNG, R. C. R. Can haemophilic arthropathy be prevented? British Journal of Haemotology. Malmö, v. 101, n. - , p. 215-219, - . 1998. LÖFQVIST, T.; NILSSON, I. M.; BERNTORP, E.; PETTERSON, H. Haemophilia prophylaxis in young patients – A long-term follow-up. Journal of Internal Medicine, Lund, v. 241, n. -. p. 395-400, - . 1997. MANNUCCI, P. M. Hemophilia and related bleeding disorders: a story of dismay and success. Hematology - American Society of Hematology Education Program Book.- , v. 1, n. - , p. 1-9, - . 2002. Disponível em: <http://www.asheducationbook.org/cgi/content/Full/2002/1/1>. Acesso em: 20 dez. 2002. NORRIS, C. F.; BINGHAM, BUTLER, R. B.; MANNO, C. S. Complex regional pain syndrome in pediatric patients with factor VIII deficiency. Journal of Pediatric Hematology/Oncology, Philadelphia, v. 23, n. 9, dec. 2001. OGASHAWARA, T.; MARINO-LAMARI, N. Estudo dos padrões articulares em hemofílicos. Boletim da Sociedade Brasileira de Hematologia e Hemoterapia, São José do Rio Preto, v. 19, n. 175, p. 57-60, maio/ago.1997. PALAZZI, F. F.; HERNANDEZ, S. R.; BOSCH, N. B.; VALECILLO, H. Hematoma del psoas en hemofilia. Boletim da Sociedade Brasileira de Hematologia e Hemoterapia, Caracas, v. 7, n. 136, p. 243-247, nov/dez. 1985. PANTOJA, L.; MAGULLÓN, M. Artropatía hemofílica. Revista Española de Reumatología, Madrid, v. 20, n. - , p. 101-106, - ,1993. Disponível em: <http://www.ser.es/publicaciones/revision/hemofil.html>. Acesso em: 26 set. 2002. PELLETIER, J. R.; FINDLEY, T. W.; GEMMA, S. A. Isometric exercise for an individual with hemophilic arthropathy. Physical Therapy, Boston, v. 67, n. 9, p. 1359-1364, set. 1987. POLLMANN, H.; RICHTER, H.; RINGKAMP, H.; JÜRGENS, H. When are children diagnosed as having severe haemophilia and when do they start to bleed? A 10-Year SingleCentre PUP Study. European Journal of Pediatrics, Utrecht, v. 158, n. 3, p. 166-170, - . 1999. RIBEIRO, M. E. L.; SOARES, B. R. A Fisioterapia no paciente institucionalizado. Boletim da Sociedade Brasileira de Hematologia e Hemoterapia, - , v. 8, n. 140, p. 158-161, jul/ago. 1986. ROBBINS, R. S.; COTRAN, R. S.; KUMAR, V. Patologia estrutural e funcional. 5 ed. Rio de Janeiro: Guanabara Koogan, 1996. ROBERTS, H. R.; GRAY, T. F. Factor XI and other clotting factor deficiencies. In: HOFFMAN, R.; BENZ, E. J.; SHATTIL, S. J.; FURIE, B.; COHEN, H. J.; SILBERSTEIN, L. E. Hematology – basic principles and practice. 2 ed. New York: Churchill Livingstone, 1995a. ROBERTS, H. R.; GRAY, T. F. Clinical aspects of and therapy for hemophilia B. In: HOFFMAN, R.; BENZ, E. J.; SHATTIL, S. J.; FURIE, B.; COHEN, H. J.; SILBERSTEIN, L. E. Hematology – basic principles and practice. 2 ed. New York: Churchill Livingstone, 1995b. RODRÍGUEZ-MERCHÁN, E. C. Effects of hemophilia on articulations of children and adults. Clinical Orthopaedics And Related Research, Madrid, v. 1, n. 328, p. 7-13, jul. 1996. Disponível em: http://gateway2.ovid.com/ovidweb.cgi. Acesso em: 28 out. 2002. RODRÍGUEZ-MERCHÁN, E. C. Pathogenesis, early diagnosis, and prophylaxis for chronic hemophilic synovitis. Clinical Orthopaedics And Related Research, Madrid, v. 1, n. 343, p. 6-11, out. 1997. Disponível em: http://gateway2.ovid.com/ovidweb.cgi. Acesso em: 28 out. 2001. RODRÍGUEZ-MERCHÁN, E. C.; MAGALLON, M.; GALINDO, E.; LOPEZ-CABARCOS, C. Hemophilic synovitis of the knee and the elbow. Clinical Orthopaedics And Related Research, Madrid, v. 1, n. 343, p. 47-53, out. 1997. Disponível em: http://gateway2.ovid.com/ovidweb.cgi. Acesso em: 28 out. 2002. SANTORO, S. A.; EBY, C. S. Laboratory evaluation of hemostatic disorders. In: HOFFMAN, R.; BENZ, E. J.; SHATTIL, S. J.; FURIE, B.; COHEN, H. J.; SILBERSTEIN, L. E. Hematology – Basic Principles and Practice. 2 ed. New York: Churchill Livingstone, 1995. SOUCIE, J. M.; EVATT, B., JACKSON, D. Occurrence of hemophilia in the United States. the hemophilia surveillance system project investigators. American Journal of Haematology, - , v. 59, n. - , p. 288-294, - . 1998 THOMPSON, M. W.; McINNES, R. R.; WILLARD, H. F. Genética médica. 5. ed. Rio de Janeiro: Guanabara Koogan, 1993. VEIGA, M. T. A.; MIRANDA, P. A. P. Normas para atendimento aos hemofílicos. Curitiba: Centro de hematologia e Hemoterapia do Paraná – HEMEPAR, 1998. WEST, S. G. Segredos em reumatologia. Porto Alegre: Artmed, 2001.
Download