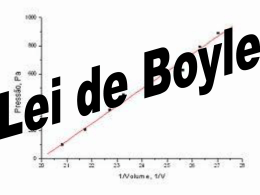
Leonnardo Cruvinel Furquim GASES Leonnardo Cruvinel Furquim GASES Um gás é definido como uma substância que se expande espontaneamente para preencher completamente seu recipiente de maneira uniforme. VOLUME O volume de um gás ocupa todo o recipiente que o contém. m³ = 1000 L dm³ = L cm³ = mL PRESSÃO Pressão é definida como a força por unidade de área. SI Pa = 1 N.m-2 1 atm = 101325 Pa 1 mmHg = 133,322 Pa 760 mm Hg = 1 atm TEMPERATURA A temperatura de um objeto mede a energia cinética média de suas partículas. T (K) = t (°C) + 273,15 LEI DE BOYLE LEI DE BOYLE LEI DE BOYLE LEI DE BOYLE LEI DE BOYLE Para uma amostra de gás mantido à temperatura constante, o produto P x V é uma constante, se P1 e P2 representam a pressão e o volume iniciais de um gás e P2 e V2, a pressão e o volume finais, então: P1V1 = P2V2 LEI DE BOYLE Uma certa quantidade de um gás ideal é encerrada em um aparelho que obedece à lei de Boyle. Seu volume é 247 cm³ a uma pressão de 62,5 kPa. Se a pressão do gás é aumentada para 82,5 kPa com redução de seu volume, qual será o novo volume ocupado pelo gás, se a temperatura é mantida constante? LEI DE BOYLE LEI DE BOYLE LEI DE CHARLES LEI DE CHARLES Uma amostra de gás ideal ocupa um volume de 1,20 L a 25 °C. Se a temperatura aumenta a 50 °C, qual é o novo volume do gás se a pressão permaneceu constante? LEI DE CHARLES CÁLCULOS COMBINADOS CÁLCULOS COMBINADOS P T V Inicial (1) 1 atm 25 + 273 = 298 K 2,65 L Final (2) 2 atm 75 + 273 = 348 K ? LEI DE GAY-LUSSAC COMBINAÇÃO DE VOLUMES E Quando os gases hidrogênio e oxigênio reagem para formar água gasosa, existe uma relação simples entre os volumes dos reagentes e dos produtos, se estes forem medidos na mesma pressão e temperatura: 2 V de hidrogênio + 1 V de oxigênio 2 V de água Compare isto com a equação balanceada para a reação: 2H2(g) + O2 (g) 2H2O(g) Quando medidos sob as mesmas condições de T e P, os volumes dos reagentes e produtos gasosos de uma reação está na razão de números inteiros e pequenos. PRINCÍPIO DE AVOGADRO Por que a relação entre os volumes é exatamente igual à relação entre os números de moléculas das diferentes substâncias, como mostrado pelos coeficientes na equação balanceada? Princípio de Avogadro – volumes iguais de gases diferentes contêm números iguais de moléculas quando medidos nas mesmas condições de pressão e temperatura. PRINCÍPIO DE AVOGADRO LEI DO GÁS IDEAL As Leis de Boyle, de Charles e o princípio de Avogadro são todos enunciados de proporcionalidade que descrevem o gás ideal. Podemos resumi-la como: Constantes Lei de Boyle V Ten Lei de Charles V T Pen Princípio de Avogadro V n TeP LEI DO GÁS IDEAL DETERMINAÇÃO DE R DETERMINAÇÃO DE R CÁLCULO DA LEI DO GÁS IDEAL Suponha que 0,176 mol de um gás ideal ocupa 8,64 litros à pressão de 0,432 atm. Qual é a temperatura do gás em graus Celsius? CÁLCULO DA LEI DO GÁS IDEAL CÁLCULO DA LEI DO GÁS IDEAL Suponha que uma amostra de 5 g de gás oxigênio, O2, a 35 °C é colocada em um recipiente com a capacidade de 6 L. Considerando o comportamento do gás ideal para o oxigênio, calcule a pressão do oxigênio em milímetros de mercúrio. (massa atômica do O = 16 g/mol; 1 atm = 760 mmHg). CÁLCULO DA LEI DO GÁS IDEAL VOLUME MOLAR DO GÁS IDEAL MASSA MOLECULAR A PARTIR DA DENSIDADE DO GÁS A densidade do gás fosfina é 1,26 g L-1 a 50 °C e 747 mmHg. Calcule a massa molecular da fosfina. MASSA MOLECULAR A PARTIR DA DENSIDADE DO GÁS A densidade do gás fosfina é 1,26 g L-1 a 50 °C e 747 mmHg. Calcule a massa molecular da fosfina. T = 50 °C + 273 = 323,2 K P = 747 mmHg = 0,983 atm Sabemos a partir da densidade que 1 L possui uma massa de 1,26 g. A lei do gás ideal pode ser usada pra encontrar quantos mols estão presentes em 1L: MASSA MOLECULAR A PARTIR DA DENSIDADE DO GÁS LEI DE DALTON DAS PRESSÕES PARCIAIS A lei de Dalton das pressões parciais estabelece que a pressão total exercida por uma mistura de gases é igual à soma das pressões parciais dos gases individuais. Pressão parcial é definida como a pressão que um gás exerceria se ele fosse o único gás do recipiente. LEI DE DALTON DAS PRESSÕES PARCIAIS LEI DE DALTON DAS PRESSÕES PARCIAIS Amostra de H2, O2 e N2 contêm, cada uma, massa de 1 g. Suponha que os gases sejam colocados conjuntamente em um recipiente de 10 L a 125 °C. Considere o comportamento ideal e calcule a pressão total em atmosferas. LEI DE DALTON DAS PRESSÕES PARCIAIS LEI DE DALTON DAS PRESSÕES PARCIAIS LEI DE DALTON DAS PRESSÕES PARCIAIS LEI DE DALTON DAS PRESSÕES PARCIAIS LEI DE DALTON DAS PRESSÕES PARCIAIS LEI DE DALTON DAS PRESSÕES PARCIAIS Leonnardo Cruvinel Furquim [email protected]
Download