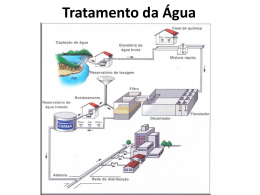
Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 2 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Aula 4 – Coagulação e Mistura rápida 1 – Coagulação O processo de coagulação envolve a aplicação de produtos químicos para a precipitação de compostos em solução e desestabilização de suspensões coloidais de partículas sólidas que não poderiam ser removidas por sedimentação, flotação ou filtração. Os termos “coagulação” e “floculação” são frequentemente aplicados como sinônimos. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 3 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Vamos pensar como se fossem duas fases distintas: A coagulação é a alteração físico-química de partículas coloidais da água, produzindo partículas que possam ser removidas em seguida em por um processo físico de separação. Essa seria a primeira fase: envolve a adição de coagulantes químicos com a finalidade de reduzir as forças que mantêm separadas as partículas em suspensão (processo rápido). Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 4 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida A segunda fase seria a floculação: a agitação lenta do material coagulado promove as colisões entre as partículas previamente desestabilizadas, formando partículas de maior tamanho, visíveis a olho nu: os flocos (processo lento). A coagulação acontece através de dois fenômenos: O primeiro químico (coagulação = desestabilização da dispersão coloidal pela supressão da camada dupla), em que acontecem as reações do coagulante com a água e a dos precipitados do metal do coagulante usado. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 5 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida O segundo físico, consiste no transporte dos precipitados para que haja contato com as impurezas presentes na água, de maneira que formem aglomerados maiores. Assim, a coagulação (ou mistura rápida) e a floculação (mistura lenta) são, portanto, processos de transporte de fluido. Como fenômenos de transporte de fluido, a diferença entre as duas reside no tempo e na intensidade da mistura, que é definida pelo gradiente de velocidade. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 6 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida O conhecimento da taxa de união entre as partículas previamente desestabilizadas (cinética da floculação), é fundamental para o dimensionamento das unidades de floculação. Os coagulantes usuais incluem sais de alumínio ou ferro, sendo o mais utilizado é o sulfato de alumínio – Al2(SO4)3 . 14H2O. Em aplicações específicas é comum a adição de auxiliares de coagulação: polímeros, sílica ativada e bentonita. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 7 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida O processo de coagulação efetua-se na unidade de mistura rápida da estação, presente na quase totalidade das tecnologias de tratamento (excetuando-se a filtração lenta). O pH de coagulação é um parâmetro crítico na eficiência do processo, dependendo O pH depende do coagulante utilizado, da dose aplicada e da alcalinidade presente. Para otimizar o processo é necessária a realização de ensaios de coagulação “jar-test”. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 8 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida 2 – Coloides (suspensão coloidal) Coloides formam a linha divisória entre as soluções e as misturas heterogêneas (tamanho das partículas se situa entre 10-3 μm e 1 μm (10-6 mm e 10-3 mm). 10-3 m Partículas dissolvidas 1 m Partículas coloidais Partículas em suspensão Os coloides estão sempre presentes nas águas naturais. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 9 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 10 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida As partículas coloidais têm uma área superficial específica muito alta. Seu comportamento na suspensão é determinado pelas suas propriedades de superfície. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 11 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 12 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Apesar dos coloides poderem ser tão pequenas que a dispersão pareça uniforme, elas são grandes o suficiente para desviar a luz de modo eficiente (efeito tyndall). Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 13 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Coloides mais importantes: são aqueles nos quais o meio dispersante é a água: Hidrofílicos e Hidrofóbicos Hidrofóbicos: não sofrem interação com a água (são instáveis). Hidrofílicos: interagem com a água (são estáveis). Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 14 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 15 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Os coloides hidrofílicos são estáveis devido à sua atração para com as moléculas da água. Exemplos: sabão, goma de roupa e detergentes. Devido à sua afinidade com água, não são facilmente removidos de suspensões como os coloides hidrofóbicos, sendo necessárias dosagens 10 a 20 vezes maiores que as usadas no tratamento convencional para coagular materiais hidrofílicos. Partículas hidrofóbicas não possuindo afinidade com água, dependem da sua carga elétrica para manterem sua estabilidade na suspensão. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 16 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Estabilização de um coloide hidrofóbico em água por íons adsorvidos As partículas individuais são mantidas separadas por forças de repulsão eletrostáticas, desenvolvidas por íons positivos absorvidos na sua superfície provenientes da solução. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 17 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Uma analogia é a força repulsiva que existe entre os polos iguais de duas barras magnéticas. Os coloides presentes em sistemas aquáticos apresentam predominantemente carga elétrica negativa. Reduzindo ou neutralizando sua carga, as partículas coloidais irão progressivamente aglomerar, possibilitando sua sedimentação. Esse é o objetivo da coagulação química Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 18 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida A maior parcela de turbidez oriunda de matérias orgânica e inorgânica, encontrada nas águas naturais, é hidrofóbica. A magnitude da força repulsiva desenvolvida pela camada dupla eletrizada dos íons atraídos para uma partícula é denominada potencial zeta. A desestabilização de coloides hidrofóbicos é obtida através da adição de coagulantes químicos (sais de alumínio e de ferro). Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 19 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Os íons metálicos hidrolisados, altamente carregados eletricamente produzidos por esses sais em solução, reduzem as forças repulsivas entre os coloides através de compressão da camada dupla difusa que envolve as partículas individuais. Com as forças de repulsão anuladas, a mistura lenta provoca contato das partículas, e as forças de atração causam a aglomeração progressiva das partículas. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 20 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida A remoção da turbidez por coagulação depende do tipo de coloides existentes na suspensão; da temperatura, do pH, da composição química da água, do tipo e da dosagem de coagulantes e auxiliares de coagulação; e do grau e o tempo de mistura para a dispersão química e formação de floco. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 21 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Três fenômenos favorecem o desenvolvimento de carga negativa na superfície das partículas: 1) Para o caso das argilas minerais a carga negativa esta associada à substituição de silício por átomo de menor valência na estrutura do cristal (alumínio, ferro ou magnésio). Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 22 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida 2) O segundo fenômeno refere-se aos grupos carboxilas ou hidroxilas, presentes na superfície das partículas → caso típico de das bactérias agregadas as partículas → dissociarem-se na água e, dependendo do pH do meio aquoso, produzirem carga elétrica negativa. 3) A adsorção de íons na superfície da partícula, de correntes das forças de Van der Walls e pontes de hidrogênio. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 23 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida 3 – Teoria da coagulação (a ideia da DCE) Quando as partículas coloidais são dispersas na água, íons de carga positiva se aproximam (K+, Na+ e Ca++) e forma-se uma camada de íons positivos e negativos: Camada compacta ou Camada de Stern. Essa camada (CC) é decorrente de forças de repulsão eletrostática e de atração de Van der Walls (que atuam a pequenas distâncias). Assim, apesar da carga negativa da maioria dos coloides, a suspensão tende a ser eletricamente neutra. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 24 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 25 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida As estas forças de atração contrapõem-se as forças difusivas impelidas pelos íons (positivas), nas direções das menores concentrações iônicas. Como consequência, há formação de uma segunda camada, denominada camada difusa (CD). Sua espessura dependerá mais da concentração iônica do que do tamanho das partículas. A carga elétrica que se forma em virtude dessa camada tende a manter a individualidade das partículas e a estabilidade da dispersão. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 26 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 27 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida A medida que se afasta da superfície da partícula, menor se torna a concentração de íons ao redor. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 28 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Como função dessa decrescente concentração de íons surgem potenciais elétricos de grande interesse ao processo de coagulação: 1) Potencial existente na superfície da partícula , chamado de potencial de Nernst (diminui com a distância); 2) Potencial existente na interface entre as camadas aderida e difusa; 3) Potencial existente no plano de cisalhamento (potencial zeta). Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 29 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 30 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Plano de cisalhamento: define a porção de água (e de íons), que se move juntamente com a partícula. Esse plano esta situado entre o limite externo da camada aderida e o limite interno da camada difusa. Stern afirmou que há uma distância mínima entre a superfície do coloide e os íons de carga contrária, na qual o potencial elétrico decresce linearmente. Em seguida, a diminuição resulta exponencial, passando pela fronteira das camadas compacta e difusa, região em que o potencial elétrico é chamado de Zeta. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 31 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 32 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Não é possível medir o potencial na superfície da partícula, daí a importância do potencial zeta. O potencial zeta consiste na energia eletrostática (em Volts) a ser aplicada capaz de deslocar um íon de mesmo sinal do ponto mais remoto da camada difusa à superfície da camada compactada. O potencial zeta é determinado pela medida da mobilidade das partículas coloidais através de uma célula, visto através de um microscópio. Para as águas naturais o potencial zeta é negativo, variando geralmente entre -8 mV e -20 mV. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 33 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida A ideia da DCE foi proposta por Helmholtz (AWWA, 2000). que desenvolveu o conceito de um sistema contendo cargas distribuídas em dois planos paralelos. Quando dois coloides semelhantes se aproximam um do outro, ocorre interação entre as camadas difusas, fazendo com que haja repulsão em decorrência da força eletrostática entre os mesmos. A energia potencial de repulsão diminui com a distância a partir da superfície do coloide. O potencial zeta diminui com o aumento da concentração iônica. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 34 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Existe uma força natural de atração entre duas massas quaisquer (força de Van der Waals). A energia potencial de repulsão é conhecida como o trabalho necessário para a aproximação de duas partículas coloidais semelhantes. Ela é tanto maior quanto menor a distância entre as partículas. Quando a força iônica é pequena, a energia resultante é de repulsão e atinge um valor máximo, denominado de barreira de energia (plano de cisalhamento) Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 35 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Por isso, o potencial zeta fornece informações sobre o grau de estabilidade de um sistema coloidal. Já quando a força iônica é grande, a energia resultante pode ser reduzida a ponto de eliminar a barreira de energia, de modo que as partículas podem se aproximar sem que haja repulsão entre elas. Mecanismos teóricos de desestabilização de partículas: segundo Di Bernardo, atualmente considera-se a coagulação como o resultado individual ou combinado da ação de quatro mecanismos distintos: Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 36 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Mecanismos teóricos de desestabilização de partículas coloidais 1. Compressão da dupla camada. 2. Adsorção-desestabilização ou adsorçãoneutralização ou neutralização. 3. Varredura. 4. Formação de pontes químicas. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 37 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida 1) Compressão da dupla camada elétrica: o aumento da concentração de íons ocasiona a compressão da camada difusa. Segundo o modelo de Schulze-Hardy (1900) tal intento é obtido mais facilmente com a dispersão de íons de carga positiva trivalentes como ferro e alumínio. Os íons de carga positiva atravessam a camada compacta → reduzem a magnitude do potencial zeta e a espessura da dupla camada → permitem a posterior aproximação das partículas. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 38 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Dois aspectos devem mecanismo de coagulação: i) ser destacados neste A quantidade de eletrólitos para conseguir a coagulação é independente da concentração de coloides na água; ii) Para qualquer quantidade adicionada de eletrólitos é impossível reestabilizar as partículas coloidais, ou seja, a reversão de carga das mesmas, que passa a ser positiva. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 39 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida 2) Adsorção-desestabilização ou adsorçãoneutralização ou neutralização de cargas: ocorre imediatamente após a dispersão do coagulante na massa líquida. Dependendo do pH há a formação de carga positiva que pode ser adsorvida na superfície das partículas, desestabilizando-as. Em alguns casos partículas do coagulante são adsorvidos na superfície das partículas coloidais → pode resultar na reversão de carga da partícula e consequente restabilização da suspensão. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 40 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Isso explica a existência de uma estreita faixa de variação em termos de dosagem de coagulante e pH → específica para cada água natural. O pH usual para coagulação com sulfato de alumínio esta entre 4,5 e 6,5 (melhor eficiência no processo de coagulação). A adsorção ocorre em intervalo de tempo inferior a 1 s e elevado gradiente de velocidade. Esse mecanismo de coagulação predomina em estações de filtração direta de escoamento ascendente e descendente. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 41 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Nesse caso as partículas desestabilizadas são retidas no meio granular dos filtros. A dosagem do coagulante necessária neutralização é diretamente proporcional concentração e a área superficial do coloide. á à É influenciada pelo número e distribuição dos tamanho de partículas que constituem a dispersão. Águas com alcalinidade e turbidez de mesma magnitude desestabilizar-se-ão com dosagens distintas de coagulante. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 42 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida A água que apresentar maior número de partículas de menor dimensão (maior área superficial), há de necessitar de uma dosagem mais elevada. 3) Varredura: passa a predominar a medida que, em função do pH de coagulação, se eleva progressivamente a dosagem do coagulante. Em função das dosagens de coagulante e do pH do meio, as partículas coloidais são adsorvidas e as suspensas envolvidas pelo precipitado de hidróxido de alumínio Al(OH)3 ou de ferro Fe(OH)3. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 43 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida O mecanismo de varredura conduz a dosagens mais elevadas de coagulante. Assim, em geral, o floco formado adquire maior peso, sedimentando-se ou flotam com mais facilmente que os flocos obtidos com a coagulação realizada no mecanismo de adsorção e neutralização de cargas (densidade relativa de 1,01 a 1,05). Entretanto, isso pode favorecer a não sedimentação e consequente arraste as unidades filtrantes. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 44 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Variações no pH de coagulação ou na dosagem de coagulante podem conduzir à reestabilização das partículas coloidais e evitar a agregação. 4) Formação de pontes químicas: com o objetivo de reduzir as dosagens de coagulante e ao mesmo tempo conferir aos floco maior densidade são empregados polímeros orgânicos ou sintéticos (auxiliares de coagulação). Esses polímeros são composto orgânicos de longas cadeias. A coagulação efetua-se por intermédio da formação de pontes químicas. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 45 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida As partículas coloidais são adsorvidas na superfície das diversas cadeias dos polímeros. A molécula deve ser longa para evitar o efeito repulsivo da dupla camada e permitir a adsorção em sua superfície. Entretanto a excessiva dosagem de polímeros evitará a formação de pontes pela ausência de sítios disponíveis. Ao alto custo, quando comparados com sais de ferro e alumínio. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 46 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida O seu uso apresenta algumas vantagens: Formação de flocos mais resistentes à erosão nos interstícios do meio filtrante; Redução do volume de lodo gerado; Redução dos gastos com alcalinizante para correção do pH final → menores dosagens de coagulante minimizam a queda do pH; Maior facilidade de desidratação do lodo gerado comparada aos sair de ferro e alumínio. Os mecanismos de varredura e de neutralização de cargas são fundamentais nas ETAs. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 47 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Diagrama de coagulação (remoção de turbidez) com o uso de sulfato de alumínio Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 48 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Verificam-se duas regiões principais, a de coagulação por varredura e a de neutralização de cargas. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 49 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Nas tecnologias de ciclo completo, a coagulação é realizada, predominantemente, por varredura. Nas ETAs de filtração direta (FDD, FDA e DF), a coagulação acontece no mecanismo de neutralização de carga. Considerações sobre diagramas de coagulação: As regiões delimitadas pelas linhas são sensíveis às características de cada água podendo sofrer oscilações. Cada estudo exige a construção de um diagrama de coagulação específico, para que sejam definidas regiões de melhor remoção para a água em questão. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 50 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida A condição apropriada de coagulação (dosagem de coagulante x pH de coagulação) para cada tecnologia de tratamento pode ser obtida em equipamento de laboratório chamados Jartest. 4 - Tipos de coagulantes e suas propriedades As propriedades das águas provenientes de rios variam com grande facilidade (sazonalmente e devido ao descarte de esgotos e outros agentes poluidores). Isso torna o tratamento complexo, exigindo uma flexibilidade operacional a fim de atender as variações da qualidade da água. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 51 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Critérios para definição do tipo de coagulante a ser utilizado (literatura clássica): A tecnologia de tratamento; O custo de manutenção da estação (manutenção dos tanques e dosadores); O custo dos coagulantes e dos demais produtos químicos associados (alcalinizantes, ácidos ou auxiliares de coagulação). Entretanto, segundo Di Bernardo e Richter, a característica da água bruta é um dos fatores mais importantes. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 52 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida O principal resíduo gerado nas ETAs, o lodo nos decantadores, vai depender dessa característica. Os dois componentes principais dos resíduos do tratamento de água (RTA) são: Os materiais contidos na água (solúveis ou insolúveis) Os coagulantes utilizados para a remoção destes materiais. As características químicas e físicas dos RTA variam conforme a composição química do coagulante. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 53 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Problemas com o manuseio, tratamento e disposição dos RTA são minimizados ajustando-se o processo de coagulação ou mudando o coagulante. Obs: O desempenho da coagulação pode apresentar diferenças quando se utilizam coagulantes de mesmo nome fornecidos por empresas diferentes. Isso se deve à variação das concentrações de impurezas no material utilizado em sua produção. Devem ser estudas as propriedades do lodo gerado a fim de equalizar soluções que minimizem os problemas advindos do seu manuseio e disposição. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 54 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida A maioria dos coagulantes utilizados são metálicos (a base de alumínio ou ferro) e são classificados como coagulante superiores. Outras espécies utilizadas são os coagulantes naturais e polímeros. A utilização de polímeros é bastante restrita devido o seu custo elevado e potencial de geração de resíduos tóxicos na água tratada. Já a utilização de coagulantes naturais vem sendo alvo de estudos a fim de determinar a sua eficiência e a viabilidade de se tornarem substitutos dos coagulantes superiores. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 55 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Entretanto, nas ETAs brasileiras, a sua utilização é limitada à auxiliar dos coagulantes metálicos. Os coagulantes de origem orgânica naturais são conhecidos como polieletrólitos. São constituídos de grandes cadeias moleculares (dotados de sítios com cargas positivas ou negativas). Apenas os polieletrólitos catiônicos podem ser utilizados sem a aplicação do coagulante primário. A presença de um coagulante orgânico na água pode aumentar o teor de matéria orgânica e causar o aparecimento de sabor e odor desagradáveis. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 56 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Dentre os coagulantes naturais, destaca-se a quitosana, que é proveniente da quitina e coagulantes de origem vegetal a base de tanino. Os coagulantes naturais têm vantagens em relação aos coagulantes químicos como: Menor custo; Uso de matéria orgânica renovável; Biodegradabilidade; menor geração de massa de lodo; Geração de lodo orgânico com maior facilidade de eliminação. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 57 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Como auxiliares de coagulação apresentam vantagens como: Redução do consumo do coagulante primário; Redução dos gastos com produtos químicos; Redução no volume do lodo no decantador. O sulfato de alumínio e cloreto férrico, pertencentes ao grupo dos sais metálicos simples contendo os íons Al+3 ou Fe+3, são os mais estudados e usados. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 58 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida SULFATO DE ALUMÍNIO. Fórmula molecular Al2(SO4)3.nH2O. Em que n é número de moléculas de água de hidratação, que varia dependendo do produto, sendo 14 ou18. É caracterizado pela cor branca-acinzentada, sendo o coagulante mais utilizado nas ETAs brasileiras, devido ao seu baixo custo e eficiência. É sintetizado pela dissolução de hidróxido de alumínio, Al(OH)3, em ácido sulfúrico, H2SO4: Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 59 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida 2 Al(OH)3 + 3 H2SO4 + 3 H2O → Al2(SO4)3.6H2O É disponibilizado seco em pedras ou granular, ou líquido (em soluções). O produto seco tem entre 14 e 18 % de Al2O3. Líquido apresenta um teor padronizado de 8%. É capaz de promover coagulação efetiva em faixas de pH que vão de 5 a 7. Fora dessa faixa é impraticável a coagulação com sulfato de alumínio. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 60 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida O sulfato de alumínio em solução é um ácido corrosivo, devendo ser armazenado em tanques com revestimento de borracha, plástico, epóxi ou aço inoxidável. Sulfato de alumínio adquirido na forma sólida: • Dosagens de coagulante: (5 mg/L a 100 mg/L). • Sacos com 25 kg e 40 kg de capacidade. • Pureza: 90% a 95%. • Massa Específica Aparente: 700 a 800 kg/m3. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 61 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida FONTE: Prof. Dr. Roque P. Piveli e Prof. Dr. Sidney Seckler Ferreira Filho ESCOLA POLITÉCNICA DA USP DEPARTAMENTO DE ENGENHARIA HIDRÁULICA E SANITÁRIA Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 62 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida FONTE: Prof. Dr. Roque P. Piveli e Prof. Dr. Sidney Seckler Ferreira Filho ESCOLA POLITÉCNICA DA USP DEPARTAMENTO DE ENGENHARIA HIDRÁULICA E SANITÁRIA Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 63 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Sulfato de alumínio adquirido na forma líquida: • Dosagens de coagulante: (5 mg/L a 100 mg/L). • Produto adquirido na forma líquida. • Caminhão tanque. • Pureza: 50 %. • Massa Específica: 1.300 kg/m3. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 64 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida FONTE: Prof. Dr. Roque P. Piveli e Prof. Dr. Sidney Seckler Ferreira Filho ESCOLA POLITÉCNICA DA USP DEPARTAMENTO DE ENGENHARIA HIDRÁULICA E SANITÁRIA Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 65 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida FONTE: Prof. Dr. Roque P. Piveli e Prof. Dr. Sidney Seckler Ferreira Filho ESCOLA POLITÉCNICA DA USP DEPARTAMENTO DE ENGENHARIA HIDRÁULICA E SANITÁRIA Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 66 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Com a adição de sulfato de alumínio a água é produzido CO2, que é o responsável pela diminuição da alcalinidade e o Al(OH)3 que é o hidróxido responsável pela formação dos flocos. A reação do sulfato de alumínio com a água pode ser representada por: Al2(SO4 )3.18H2O + 3Ca(HCO3)2 → 3CaSO4 + 2Al(OH )3↓ + 6CO2 1 mg/L de sulfato de alumínio produz 0,26 mg/L de Al(OH)3. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 67 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Para a correção de alcalinidade natural são utilizados cal, carbonato de sódio (barrilha) ou soda cáustica : Cal: Al2(SO4)3.14H2O + 3Ca(OH)2 → 2Al(OH)3↓ + 3CaSO4+ 6H2CO3 + 14H2O Carbonato de sódio : Al2(SO4)3.14H2O + 3Na2CO3 → 2Al(OH)3↓ + 3Na2SO4 + 11H2O Soda cáustica : Al2(SO4)3.14H2O + Na(OH) → 2Al(OH)3↓ + 3Na2SO4 + 14H2O Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 68 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Normatização: a ABNT possui uma norma que fixa as condições exigíveis para o fornecimento e recebimento do sulfato de alumínio para utilização no tratamento de água destinada ao abastecimento público. NBR 11176 Sulfato de alumínio: ela fixa condições relativas às características de apresentação, embalagem, armazenamento, inspeção, aceitação e rejeição, e condições específicas, que englobam composição química e granulometria. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 69 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida CLORETO FÉRRICO É representado pela fórmula molecular FeCl3.6H2O. Pode ser encontrado na forma líquida e sólida. Propriedades corrosivas. Sua manipulação exige cuidados especiais (utilização de equipamentos de segurança e recipientes anticorrosivos). Matérias para o seu armazenamento: PVC, PRFV (plástico reforçado por fibra de vidro), polietileno, polipropileno, poliéster. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 70 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Sua utilização é feita em associação com cal (atualmente o uso de cloreto férrico em ETA não é muito difundido). Quando ocorre a hidrólise do cloreto férrico, os complexos de ferro formados adquirem cargas positivas. A agregação das partículas é resultante da neutralização das cargas negativas dos sólidos da água pelos complexos de ferro dotados de caga positiva. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 71 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Alcalinidade natural: 2FeCl3.6H2O + 3Ca(HCO3)2 → 2Fe(OH)3↓ + 3CaCl2+ 6CO2 + 6H2O Cal: 2FeCl3.6H2O + 3Ca(OH)2 → 2Fe(OH)3↓ + 3CaCl2+ 6CO2 + 6H2O Carbonato de sódio : 2FeCl3.6H2O + 6H2O + 3Na2CO3 → 2Fe(OH)3↓ + 6NaCl+ 3CO2 + 9H2O Soda cáustica : 2FeCl3.6H2O + 6H2O + 3 Na(OH) → 2Fe(OH)3↓ + 3NaCl + 6H2O 1 mg/L de cloreto férrico produz 0,40 mg/L de Fe(OH)3. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 72 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Diagrama de coagulação com o uso de cloreto férrico Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 73 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Existem três regiões típicas: A região A, em que a coagulação é decorrente do mecanismo de varredura. O pH é compreendido entre 6 e 9. A a dosagem de cloreto férrico de FeCl3.6H2O, entre 27 e 270 mg/L. A região B, em que há predominância do mecanismo de coagulação por adsorção e neutralização de carga. O pH por volta de 4,5 a 6,0; Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 74 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Dosagem de cloreto férrico variando de 27 a 270 mg/L. A região C, onde geralmente para valores de pH inferires a 6,0. Dependendo da dosagem de cloreto férrico, ocorre a reestabilização. SULFATO FÉRRICO. É representado Fe2(SO4)3.8H2O. pela fórmula molecular Pode ser encontrado na forma líquida e sólida. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 75 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Propriedades corrosivas quando em solução. Quando sólido é fornecido em forma granular, com composição em peso de 68% a 78% de Fe2(SO4)3. Quando líquido em solução 50% de Fe2(SO4)3 ou 756 kg/m3 de concentração, com densidade de 1,5. Alcalinidade natural: Fe2(SO4)3 + 3Ca(HCO3)2 → 2Fe(OH)3↓ + 3CaSO4+ 6CO2 Cal: Fe2(SO4)3 + 3Ca(OH)2 → 2Fe(OH)3↓ + 3CaSO4 Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 76 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Carbonato de sódio : Fe2(SO4)3 + 3H2O + 3Na2CO3 → 2Fe(OH)3↓ + 3Na2SO4 + 3CO2 Soda cáustica : Fe2(SO4)3 + 6Na(OH) → 2Fe(OH)3↓ + 3Na2SO4 1 mg/L de sulfato férrico produz 0,54 mg/L de Fe(OH)3. Todos os coagulantes férricos são eficientes em uma larga faixa de pH que vai de 4 a 11. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 77 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Outro composto de ferro que pode ser utilizado é o sulfato ferroso Fe2SO4.7H2O. Ele produz hidróxido férrico somente a pH acima de 9. O sulfato ferroso com cal encontram seu uso no abrandamento (redução da dureza) da água. Em reação com o cloro, o sulfato ferroso produz sulfato férrico e cloreto férrico, com aplicabilidade de pH 4 a 11. Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 78 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida Cloreto e sulfato férrico adquirido na forma liquida FONTE: Prof. Dr. Roque P. Piveli e Prof. Dr. Sidney Seckler Ferreira Filho ESCOLA POLITÉCNICA DA USP DEPARTAMENTO DE ENGENHARIA HIDRÁULICA E SANITÁRIA Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 79 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida FONTE: Prof. Dr. Roque P. Piveli e Prof. Dr. Sidney Seckler Ferreira Filho ESCOLA POLITÉCNICA DA USP DEPARTAMENTO DE ENGENHARIA HIDRÁULICA E SANITÁRIA Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 80 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida FONTE: Prof. Dr. Roque P. Piveli e Prof. Dr. Sidney Seckler Ferreira Filho ESCOLA POLITÉCNICA DA USP DEPARTAMENTO DE ENGENHARIA HIDRÁULICA E SANITÁRIA Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 81 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida FONTE: Prof. Dr. Roque P. Piveli e Prof. Dr. Sidney Seckler Ferreira Filho ESCOLA POLITÉCNICA DA USP DEPARTAMENTO DE ENGENHARIA HIDRÁULICA E SANITÁRIA Sistemas de Água II - Aula 4 - Coagulação – Mistura 17/09/2014 82 ________________________________________________________________________________________________________________________________________________________________________________________________________ rápida NA PRÓXIMA AULA: • Gradiente de velocidade. • Dispositivos de mistura rápida.
Download