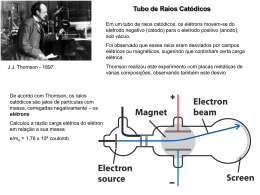
Modelos Atômicos Dalton (1808) Dalton (1808) Dalton (1808) • Modelo “Bola de bilhar” • Esfera maciça indestrutível, indivisível, indestrutível. • Esfera homogênea J.J.Thomson (1897) J.J.Thomson J.J.Thomson 9 J.J.Thomson Modelo “pudim de passas” J.J.Thomson Tubo de Raios Catódicos Exemplo de um tubo de raios catódicos J.J.Thomson ( 1897) • Modelo “pudim de passas” • Descobriu o elétron. • Tubos de raios catódicos. •Esfera de massa positiva com cargas negativas incrustadas. E.Rutherford (1911) E.Rutherford Modelo “Planetário” 16 E.Rutherford • Modelo “Planetário” • Descobriu o núcleo. • Átomo imenso vazio. Resumo Dalton Thomson • “Bola de bilhar” • Homogênea • “Pudim de passas” • Tubos de raios catódicos • Descobriu o elétron. • “Planetário” Rutherford • Esfera maciça • Indestrutível • Descobriu o núcleo • Átomo imenso vazio O átomo atual Modelo atômico de Rutherford Bohr – postulados O modelo proposto por Rutherford foi aperfeiçoado por Bohr. Baseando-se nos estudos feitos em relação ao espectro do átomo de hidrogênio e na teoria proposta por Planck em 1900 (Teoria Quântica), segundo a qual a energia não é emitida em forma contínua, mas em ”pacotes”, denominados quanta de energia. Foram propostos os seguintes postulados: 1. Na eletrosfera, os elétrons descrevem sempre órbitas circulares ao redor do núcleo, chamadas de camadas ou níveis de energia. 2. Cada camada ocupada por um elétron possui um valor determinado de energia (estado estacionário). 3. Os elétrons só podem ocupar os níveis que tenham uma determinada quantidade de energia, não sendo possível ocupar estados intermediários. Ao saltar de um nível para outro mais externo, os elétrons absorvem uma quantidade definida de energia (quantum de energia). O átomo atual Número atômico Quantidade de prótons Z nº Atômico O átomo atual prótons + nêutrons prótons prótons + nêutrons prótons A nº de Massa E Z - nº Atômico 7 Li 3 - + + + - ISÓTOPOS ??? Prótio - - + + 1 H 1 2 H 1 99,99% Trítio Deutério 0,01% ELEMENTO - + 3 H 1 ÍONS + - + + + - Cátion - - + + + - _ - - Ânion 27 Exemplos: 23 +1 Na 11 Z = 11 19 F 9 Z= 9 1_ 19 21 Z = 10 Z = 10 Ne 10 X 10 A = 19 A = 19 A = 21 p = 10 p = ISÓBAROS p = 11 p = 10 9 ISÓTOPOS e = 10 e = 10 e = 10 e = 10 ISOELETRÔNICOS n= 9 n = 10 n = 12 n = 11 A = 23 FIM 29 30
Download