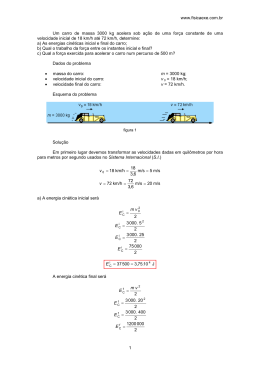
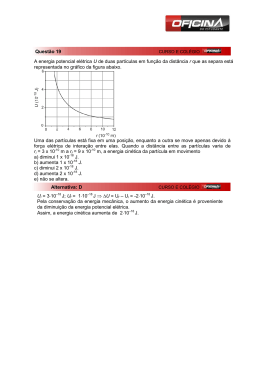
Efeitos da adição de Nb2O5 com grande área superficial na cinética de formação e decomposição do hidreto de magnésio MgH2 Monique Osorio Talarico da Conceição*, Mariana Coutinho Brum, Dilson Silva dos Santos *[email protected], Aluna de doutorado Laboratório de Propriedades Mecânicas dos Materiais, PEMM-COPPE-UFRJ CP 68505, 21941-972, Rio de Janeiro, RJ Resumo Foram processadas amostras de MgH2-Nb2O5 por moagem mecânica sob atmosfera de H2, com o objetivo de se estudar a cinética de formação e dissolução dos hidretos, além das transformações de fases e a evolução microestrutural. Utilizaram-se as técnicas de DRX, DSC e curvas de cinética de absorção/dessorção de H2. À 300°C a amostra com 5% em peso de Nb2O5 apresentou uma cinética de absorção mais rápida, em apenas 1,5 min foi absorvido 5 % em peso de H2. Foi observado que a área superficial do Nb2O5 contribuiu para uma absorção mais rápida. Palavras-chave: hidreto de magnésio, armazenamento de hidrogênio, energia de ativação. Introdução Devido à sua alta capacidade de armazenar hidrogênio (aproximadamente 7,6 w.t. %) e pelo fato de ser um metal abundante na natureza, o magnésio é muito atrativo para uso como armazenador de hidrogênio. Sua limitação em aplicações práticas se deve à baixa cinética de absorção/dessorção e sendo necessário alta temperatura (300 a 400 °C) para ocorrer. O H2 é considerado por muito como o combustível do futuro. Porém, seu armazenamento deve ser feito de maneira segura, logo, o estudo do armazenamento de hidrogênio em estado sólido através de hidretos metálicos torna-se ainda mais promissor. Muitas pesquisas têm demonstrado que a adição de catalisadores (como por exemplo, o óxido de nióbio) e/ou o aumento no tempo de moagem dos hidretos metálicos melhora consideravelmente as propriedades de armazenamento desses hidretos, tornando a cinética do processo mais rápida. Materiais e métodos As amostras foram processadas em duas etapas: primeiro o hidreto de magnésio foi submetido a moagem mecânica num moinho planetário com velocidade de 300 RPM sob atmosfera de hidrogênio por 24 h. Após esta etapa o Nb2O5 foi adicionado e novamente foi realizada moagem em tempo adicional de 20min. O resultado da moagem é um material rico em defeitos e contornos de grão. A cinética de absorção/dessorção de H2 foi analisada em um equipamento do tipo Sieverts (PCT-Pro2000) a partir de testes a 10 bar de pressão em 300 e 350 °C. Para a determinação da energia de ativação de cristalização do óxido de nióbio foi utilizado o método de Kissinger através das curvas não isotérmicas obtidas por calorimetria diferencial exploratória (DSC). As razões de aquecimentos utilizadas foram 5, 10, 15 e 20 °C/min. Resultados e discussão A partir dos resultados de DSC, observou-se que todas as amostras moídas apresentaram um decréscimo na temperatura do pico relacionado a dissolução dos hidretos presentes nas amostras MgH2-Nb2O5. A maior adição do catalisador contribuiu para um decréscimo maior da temperatura de dessorção do hidrogênio. Através dos resultados encontrados pelo teste não-isotérmicos de DSC e utilizando a equação de Kissinger: d(ln β / T p2 ) E =− d(1 / T p ) R Painel PEMM 2011 – 10 e 11 de novembro de 2011 – PEMM/COPPE/UFRJ, Rio de Janeiro, RJ, Brasil Eq.1 As energias de ativação obtidas para as amostras de 1 e 5 % em peso são 95 e 83 kJ/mol, respectivamente. Estes valores são significativamente menores do que a energia de ativação do hidreto de magnésio puro (120kJ/mol). dissolução do hidreto para as duas diferentes concentrações de Nb2O5 (1 e 5%). Em torno de 5 min a amostra com 5% de Nb2O5 dessorveu por completo o hidrogênio. 0 Capacidade de Hidrogênio (% em peso) MgH2+1wt.% Nb2O5 Fluxo de Calor (u.a.) 449 °C 372 °C 397 °C 354 °C MgH2+5wt.% Nb2O5 -1 -2 -3 -4 -5 1% Nb2O5 5% Nb2O5 -6 0 300 15 20 25 443 °C 350 400 450 500 Temperatura (°C) Figura 1 – Curvas de DSC das amostras a taxa de 10°C/min. Após o processamento das amostras foram realizados testes de cinética de formação e dissolução do hidreto de Mg. Durante os ensaios de cinética o catalisador (Nb2O5) encontrava-se em estado amorfo, pois foi verificado através de ensaios de DSC que a cristalização do material ocorre a partir de 600 °C. A figura 2 apresenta os resultados obtidos da cinética de formação para as amostras de MgH2-1% em peso Nb2O5 e MgH2-5% em peso Nb2O5 todas processadas sob as mesmas condições. Figura 3 – Curvas de cinética de dessorção de H2 nas amostras MgH2+5 e 1 % em peso de Nb2O5 à 300°C. Conclusões A temperatura do pico referente a cristalização do Nb2O5 é igual a 613,7°C (taxa de aquecimento de 5°C/min) obtida por ensaio de DSC, mostrando que o catalisador ainda estava em estado amorfo nos testes cinéticos. A amostra com 5 % em peso de Nb2O5 apresentou a maior capacidade de absorção de H2 e a cinética mais rápida em 1,5 min a amostra absorveu 5 % em peso de H2. O aumento do teor de Nb2O5 contribui para o decréscimo da energia de ativação de dessorção de H2. Agradecimentos 6.5 6.0 Capacidade de Hidrogênio (% em peso) 10 Tempo (min) 1wt.% Nb2O5 5wt.% Nb2O5 MgH2 como recebido 250 5 5% Nb2O5 5.5 5.0 1% Nb2O5 4.5 Os autores agradecem ao CNPq, Capes e Finep pelo apoio financeiro a pesquisa. 4.0 3.5 3.0 Referências 2.5 2.0 1.5 1.0 MgH2+1wt.% Nb2O5 1.5 min 0.5 MgH2+5wt.% Nb2O5 0.0 0 5 10 15 20 25 30 Tempo (min) Figura 2 – Curvas de cinética de absorção de H2 nas amostras MgH2+5 e 1 % em peso de Nb2O5 à 300°C. A amostra com maior teor de óxido de nióbio apresentou uma cinética mais rápida, em apenas 1,5 min a amostra absorveu 5% em peso de H2. A figura 3 apresentou as curvas de cinética de [1] O. Friedrichs, T. Klassen, J.C Sánches-Lópoz, R. Bormann, A. Férnandez. Scripta Materialia 54 (2006) 1293-1297. [2] O. Friedrichs, F. Aguey-Zinsou, J.R Ares Fernández, J.C Sánches-López, A. Justo, T. Klassen, R. Bormann, A. Férnandez. Scripta Materialia 54 (2006) 105-110. Painel PEMM 2011 – 10 e 11 de novembro de 2011 – PEMM/COPPE/UFRJ, Rio de Janeiro, RJ, Brasil
Download