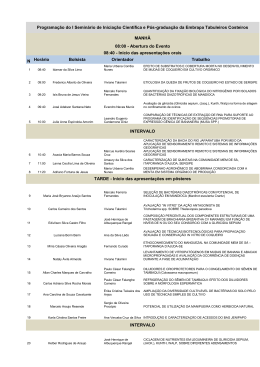
UNIVERSIDADE ESTADUAL DO CEARÁ PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA FACULDADE DE VETERINÁRIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS VETERINÁRIAS TICIANA FRANCO PEREIRA DA SILVA AVALIAÇÃO ANDROLÓGICA, MÉTODOS DE COLETA E TECNOLOGIA DO SÊMEN DE GATOS DOMÉSTICOS UTILIZANDO ÁGUA DE COCO EM PÓ (ACP-117®) FORTALEZA, CEARÁ 2008 TICIANA FRANCO PEREIRA DA SILVA AVALIAÇÃO ANDROLÓGICA, MÉTODOS DE COLETA E TECNOLOGIA DO SÊMEN DE GATOS DOMÉSTICOS UTILIZANDO ÁGUA DE COCO EM PÓ (ACP-117®) Tese submetida à Coordenação do Curso de Pós-Graduação em Ciências Veterinárias da Faculdade de Veterinária da Universidade Estadual do Ceará, como requisito parcial para a obtenção do Grau de Doutor em Ciências Veterinárias. Área de Concentração: Reprodução e Sanidade Animal. Orientadora: Profa. Machado da Silva FORTALEZA, CEARÁ 2008 Dra. Lúcia Daniel S586a Silva, Ticiana Franco Pereira Avaliação andrológica, métodos de coleta e tecnologia do sêmen de gatos domésticos utilizando água de coco em pó (ACP-117®)/Ticiana Franco Pereira da Silva. __Fortaleza, 2008. 164p. ; il. Orientadora: Profa. Dra. Lúcia Daniel Machado da Silva. Tese (Doutorado em Ciências Veterinárias) – Universidade Estadual do Ceará, Faculdade de Veterinária. 1. Gato. 2. Sêmen. 3. Água de coco em pó. I.Universidade Estadual do Ceará, Faculdade de Veterinária. CDD: 636 TICIANA FRANCO PEREIRA DA SILVA AVALIAÇÃO ANDROLÓGICA, MÉTODOS DE COLETA E TECNOLOGIA DO SÊMEN DE GATOS DOMÉSTICOS UTILIZANDO ÁGUA DE COCO EM PÓ (ACP-117®) Tese submetida à Coordenação do Curso de PósGraduação em Ciências Veterinárias da Faculdade de Veterinária da Universidade Estadual do Ceará, como requisito parcial para a obtenção do Grau de Doutor em Ciências Veterinárias. Aprovada em 17/04/2008 BANCA EXAMINADORA: _____________________________________ _____________________________________ Profa. Dra. Lúcia Daniel Machado da Silva Prof. Dr. Alexandre Rodrigues Silva Orientadora Examinador _____________________________________ _____________________________________ Prof. Dr. Airton Alencar de Araújo Profa. Dra. Maria Denise Lopes Examinador Examinadora _____________________________________ _____________________________________ Prof. Dr. Marcos Renato Franzzosi Mattos Dra. Cristiane Clemente de Mello Salgueiro Examinador Examinadora Suplente _____________________________________ Dra. Ana Kelen Felipe Lima Examinadora Suplente Aos animais ameaçados de extinção pela ganância do homem, dedico. AGRADECIMENTOS À Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico (FUNCAP) pela bolsa de estudos concedida e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo apoio financeiro, sem os quais os experimentos não teriam sido possíveis. Ao Centro de Controle de Zoonoses do Município de Fortaleza pelas vacinas antirábicas concedidas aos animais experimentais. À Universidade Estadual do Ceará, que ao longo de 11 anos se tornou a minha segunda casa. Ao Programa de Pós-Graduação em Ciências Veterinárias (PPGCV) da Faculdade de Veterinária da Universidade Estadual do Ceará pela oportunidade de realização de mais este sonho. Ao Laboratório de Tecnologia do Sêmen Caprino e Ovino da Universidade Estadual do Ceará na pessoa do Prof. Dr. José Ferreira Nunes e da Dra.Cristiane Clemente de Mello Salgueiro, pelo uso do analisador computadorizado de sêmen e de suas instalações. À Dra. Cristiane, em nome da ACP® Biotecnologia, em especial, pela disponibilização do ACP-117® e também por sua participação na banca. À Profa. Dra. Lúcia Daniel Machado da Silva, não só pela orientação há tantos anos, mas por sua paciência, compreensão, fé e disponibilidade; pelo seu exemplo, carinho, dedicação e incentivo; por ter aberto os meus olhos quando necessário; pelo seu ombro amigo, e por tudo mais que é não é possível expressar em palavras! Ao Dr. Ronaldo Gonçalves Morato, meu co-orientador, por sua atenção em vários momentos de desespero mesmo à distância, pelo apoio, incentivo e exemplo. Aos membros da banca examinadora, por terem aceitado participar desta defesa, pelas sugestões, críticas e questionamentos. À Profa. Dra. Maria Denise Lopes, por sua disponibilidade em ajudar sempre que necessário. Ao Prof. Dr. Airton Alencar de Araújo, pelo apoio e incentivo, mas também por sua crítica sempre aguçada e precisa. Ao Prof. Dr. Alexandre Rodrigues Silva, meu amigo e companheiro na “odisséia ejaculatória”, não só pela sua amizade que só se fortalece a cada dia, mas pelo exemplo na pesquisa e por todas as suas considerações na Tese. À Dra. Ana Kelen Felipe Lima, pela sua participação na banca, mas também por todas as vivências divididas no doutorado (cirurgias, noites de cultivo de folículos, experimentos que não deram certo, etc), e pela ajuda valiosa prestada com os “números” na fase final da Tese. Ao Prof. Dr. Marcos Renato Franzzosi Mattos, meu amigo, ex-“chefe” e incentivador, por ter aguçado a minha vontade de trabalhar com felinos e ter possibilitado a realização deste sonho, meu eterno e terno agradecimento. Aos Professores, funcionários e colegas do PPGCV, em especial às secretárias Adriana Maria Sales Albuquerque e Ana Cristina Sabóia do Nascimento pela paciência com minhas múltiplas interrupções e perguntas na coordenação; e aos colegas de doutorado Marcelo José da Ascensão Feitosa Vieira pela ajuda no analisador de sêmen computadorizado e Michelline Maciel, representando todos os outros, pelas conversas rápidas no corredor e pelas angústias de teses compartilhadas! Ao funcionário Selmar Alves da Silva, não só pelo seu trabalho diário na limpeza do gatil, mas por todas as atividades extras que realizou sempre com muita alegria de viver, fosse carregando a ração ou subindo no telhado para caçar os gatos que fugiam! Ao meu funcionário José Aparecido Dias de Oliveira, por toda ajuda com as tarefas domésticas, aliviando a minha carga, mas principalmente por ter tratado os meus animais com todo carinho, fossem os de casa ou os da UECE que insisti tantas vezes em levar para o “Spa de engorda Casa da Tia Tici” (como minha casa foi apelidada no laboratório!) para que arrumassem um lar ou para um tratamento personalizado. Pela alegria contagiante e pelo pensamento sempre positivo quando mais estava angustiada. A todos os colegas do Laboratório de Reprodução de Carnívoros (LRC) ao logo desses 4 anos fossem estagiários de outras universidades (a quem agradeço em especial à Cibele Cavalcante Souza de Melo, pela ajuda com as fotografias que eu não consegui realizar!), bolsistas, estagiários voluntários, mestrandos e doutorandos pelos momentos bons e ruins compartilhados e pelas vivências trocadas de domingo a domingo. Em especial, aos meus “co-orientandos” e “eternos” estagiários: Camila Louise Ackermann e Francisco Tiago Silva Pinheiro, por toda amizade e ajuda prestada, sem a qual os experimentos seriam ainda mais difíceis de serem realizados; ao amigo e “terapeuta”: Carlos Gabriel Almeida Dias, pela disponibilização não só do aparelho de anestesia, mas também do seu ombro, tempo, conhecimento e amor aos felinos. Ao Leonardo Tavernezi, Raimundo Diones Carneiro, Daniel Falcão Menezes Brilhante, Iran Águila Maciel, Janaína de Fátima Saraiva Cardoso, Antônio Cavalcante Mota Filho e Cláudia Cunha Barbosa por toda ajuda no gatil e nos experimentos. À Henna Roberta Quinto, não só por poder confiar plenamente o gatil em suas mãos quando foi necessário, não só pela sua ajuda na execução da Tese, mas pelos bolos, filmes, textos e conversas partilhadas. À Cynthia Levi Baratta Monteiro e Barbara Sucupira Pereira, pelo apoio neste último ano, pela velha amizade e pela segurança em saber que sempre posso contar com vocês. Aos demais membros da “grande família LRC” que se confundi e que se tornou parte da minha família durante mais de 7 anos. A todos que tiveram seu sobrenome modificado para TRABALHO!! À amiga e colega veterinária Ana Cristina Paulino Braga, pela ajuda imprescindível nas anestesias para eletrojaculação, transmistindo a segurança necessária não só a mim, mas a toda a equipe. À ex-colega de laboratório e amiga Rita de Cássia Soares Cardoso, exemplo de pesquisadora, pelo companheirismo no laboratório e fora dele, pelas conversas e choros e por toda a ajuda inestimável prestada nas duas partes do experimento. Aos amigos Joaquim Hélder Teixeira Pinheiro, Lucilene Simões Mattos e Alline Ferreira Brasil pelo pensamento positivo mesmo à distância e por todos os momentos que já compartilhamos dentro e fora da universidade. À colega veterinária Rochele Bezerra de Araújo, e ao Instituto Ababy de Conservação- Eco Point pela parceria na coleta paralela de dados biométricos e reprodutivos de felídeos silvestres, mostrando que o estudo da reprodução de felinos faz sentido e vale à pena! À minha fisioterapeuta Mônica Leonardo, pelo seu profissionalismo que nos últimos meses tem transformado e dizimado as dores de braços, punho e ombros cansados de digitação e do gatil. Ao Daniel Couto Uchoa, meu marido, não só pelo seu amor e cumplicidade, mas por compreender as minhas prioridades durante esses últimos e longos 4 anos. Pelos trabalhos divididos no laboratório e no gatil, e pelos quase 10 anos de companheirismo na pesquisa. Por ter sido o responsável pela logística da alimentação dos animais e dos frascos de anestésicos que sempre faltavam na hora errada! Em especial, pelo incentivo, pela paciência, por ter sido meu ponto de equilíbrio nos mais diversos momentos de desespero e desânimo, por não ter me deixado desistir nas tantas vezes que pensei, e por me fazer sorrir logo após uma crise de choro. Aos meus animais experimentais, pelos momentos de conflito, com arranhaduras, mordidas, sustos e fugas, mas também pelos momentos de brincadeira e carinho que me fizeram voltar a ser criança, apesar da seriedade do dia-a-dia. Tudo que fizeram me ensinaram ainda mais a respeitá-los. Aos meus “filhos felinos” por me ensinarem também sobre manejo e comportamento diariamente, em especial à “caçula”, Isabel Cristina, pelo exemplo de superação dos limites, mostrando que a natureza nos faz, mas que o resto é por nossa conta. Por ser minha companheira nas muitas horas de leitura e digitação, não deixando que me sentisse só. Aos meus pais: Vilany Franco Pereira da Silva e João de Deus Pereira da Silva, pelo apoio incondicional necessário para a realização de mais este sonho, pelos exemplos de caráter, e por todos os sacrifícios que fizeram em nome da minha educação, saúde e felicidade. Espero não tê-los decepcionado. A Deus, primeiro por ter me feito uma “gateira” assumida. Agradeço também por ter me permitido chegar até este ponto, por ter me dado vários obstáculos, mas principalmente por ter dado a força necessária para superá-los colocando pessoas e seres especiais em minha vida. A Ele, o meu muito obrigada! “Sábio não é aquele que dá as respostas corretas, mas o que faz as perguntas certas.” Claude Levi-Strauss RESUMO O objetivo do trabalho foi avaliar: 1) protocolos anestésicos (cetamina/xilazinaprotocolo A, tiletamina/zolazepam- protocolo B, tiletamina/zolazepam e tramadolprotocolo C e isoflurano- protocolo D) empregados para coleta de sêmen eletroejaculação (EEJ) de gatos domésticos em relação à analgesia e segurança; 2) e em relação à obtenção de ejaculado; 3) os parâmetros seminais e biometria da genitália externa de gatos domésticos submetidos ao fotoperíodo equatorial natural e verificar a ocorrência de correlações entre eles; 4) o uso do ACP-117® como diluidor do sêmen de gatos domésticos para inseminação artificial intravaginal; 5) o uso do ACP-117® na criopreservação de sêmen de gatos domésticos. Para alcançar o primeiro e o segundo objetivo, quatorze gatos foram anestesiados e submetidos a 3 séries de choques elétricos (2-6 mA). Os parâmetros de freqüência cardíaca, respiratória temperatura, sensibilidade dolorosa e reflexo palpebral foram aferidos antes e após a indução da anestesia e durante e após a eletroejaculação. Os parâmetros volume, qualidade seminal, a presença de espermatozóides e a contaminação por urina foram avaliados para todos os protocolos após eletroejaculação. A de fim de alcançar o terceiro objetivo, sêmen de 7 gatos coletados por vagina artificial foram avaliados quanto aos parâmetros de volume e qualidade seminal. Foi realizada aferição do peso corporal, da consistência e do volume testicular, do comprimento peniano, verificação do aspecto e do grau de espículas penianas, para correlacionar com a qualidade seminal. Para alcançar o quarto objetivo, 11 ejaculados foram coletados por vagina artificial, analisados quanto aos parâmetros de qualidade seminal e diluído em ACP-117®. Fêmeas em estro natural foram inseminadas no 2° e 4° dia do estro pela via intravaginal com o sêmen diluído em ACP-117®. E para alcançar o último objetivo, o sêmen coletado por vagina artificial foi avaliado quanto ao volume, coloração, motilidade e vigor espermático, concentração espermática, funcionalidade de membrana plasmática, e porcentagem de alterações morfológicas e espermatozóides vivos e mortos. O sêmen foi diluído em ACP 117®-gema de ovo (50 x 106 sptz/mL), submetido ao resfriamento e acrescidos de glicerol (concentração final de 6%). Os ejaculados foram congelados em vapor de nitrogênio líquido e armazenados a 196 °C. O sêmen foi descongelado (37 °C/ 1 min) e os parâmetros espermáticos foram avaliados. Parte dos ejaculados também foram submetidos ao teste de termorresistência e análise computadorizada de sêmen (CASA). Conclui-se que: 1 e 2) o protocolo D foi o que melhor promoveu analgesia, segurança e rapidez recuperação dos animais, e que este protocolo permite uma melhor coleta de sêmen por EEJ em gatos domésticos; 3) o volume testicular não é um parâmetro preditivo de outros parâmetros reprodutivos; 4) a diluição do sêmen fresco de gatos domésticos com ACP-117® não altera a motilidade e o vigor espermático, mas o protocolo utilizado para inseminação artificial intravaginal necessita ser modificado; 5) e que, o protocolo utilizado para criopreservação de sêmen de gatos domésticos em ACP-117® permite baixa viabilidade in vitro dos espermatozóides pós-descongelação. Palavras-chave: gato, sêmen, água de coco em pó. ABSTRACT The aim of this study was to evaluate: 1) the security and analgesia of anesthetics protocols (ketamine/xylazine- protocol A, tiletamine/zolazepam- protocol B, tiletamine/zolazepam and tramadol- protocol C, and isofluorane- protocol D for electroejaculation (EEJ) in domestic cats; 2) and for semen collection; 3) sperm parameters and the genital biometrie of domestic cats under natural equatorial photoperiod and verify the existence of correlation among then; 4) the use of powdered coconut water (ACP-117®) as seminal extender for intravaginal artificial insemination; 5) the use of ACP-117® for the preservation of domestic cat sperm. To reach the first objective, fourteen toms were anesthetized and submitted to a 3 series of electric stimuli (2-6 mA). The heart rate, respiratory rate, temperature, pain sensibility and eyes blink were analyzed prior and after induction, and during and after electroejaculation. The parameters of semen quality, volume, spermatozoa presence and urine contamination were analyzed for all protocols after electroejaculation. To reach the third objective, the semen of the seven cats were collected by artificial vagina and were analyzed for the parameters of volume, and quality. The analyses of body weight, testicular consistence and volume, penis length and degree of penis spines were used to correlate with semen quality.To reach the fourth objective, queens in natural estrus were submitted to intravaginal artificial insemination in the second and forth day of estrus with semen diluted in ACP-117®. To reach the last objective, the semen colleted by artificial vagina was analyzed for the parameters of volume, color, motility, vigour, sperm concentration, acrosomal status, percentual of abnormal spermatozoa, functionality of membrane and the percentual of alive or dead spermatozoa. The semen was initially extended in ACP117®- egg yolk (50 x 106 sptz/mL) and submitted to cooling and glycerol addition (final concentration of 6%) The ejaculates were submitted to frozen in nitrogen vapor and stored in liquid nitrogen (-196 °C). The samples were thawed (37 °C/ 1 min) and the spermatic parameters were analyzed. Part of the ejaculates was also submitted to thermoresistance tests and computer aided semen analysis (CASA). In conclusion: 1 and 2) the protocol D was the best for analgesic parameters, security, speed of recuperation and semen collection by electroejaculation in domestic cats; 3) testicular volume is not trustful to predict another reproductive parameters; 4) the dilution of domestic cat semen in ACP-117® did not affect motility and vigour, but the protocol for intravaginal artificial insemination must be changed; 5) and the protocol used for domestic cat semen criopreservation in ACP-117® allow low in vitro post-thaw viability. Key Words: cat, semen and powdered coconut water. SUMÁRIO Pág. Lista de Abreviaturas e Símbolos........................................................................ ..............i Lista de Ilustrações............................................................................................... ............iii 1. Introdução.......................................................................................................... .............1 2. Revisão de Literatura....................................................................................... 2.1. Anatomo-Fisiologia da Reprodução do Gato Doméstico........................ 3 2.1.1. Fotoperíodo e Controle Hormonal ................................................... 3 2.1.2. Morfologia e Comportamento Sexual............................................... 4 2.2. Tecnologia do Sêmen................................................................................. 8 2.2.1. Métodos de Coleta Seminal................................................................ 8 2.2.1.1. Eletroejaculação............................................................................ 8 2.2.1.1.1. Conceito e Histórico................................................................... 8 2.2.1.1.2. Tipos de aparelho....................................................................... 10 2.2.1.1.3. Anestésicos utilizados................................................................. 11 2.2.1.1.4. Controle dos parâmetros fisiológicos durante a anestesia e 15 EEJ............................................................................................................... 2.2.1.1.5. Posicionamento do animal para EEJ....................................... 16 2.2.1.1.6. Protocolos de estímulos elétricos.............................................. 17 2.2.1.1.7. Contaminação do ejaculado por urina................................... 18 2.2.1.1.8. Falha na obtenção do ejaculado e ejaculação 19 retrógrada.................................................................................................... 2.2.1.2. Vagina artificial.............................................................................. 21 2.2.1.3. Lavagem vaginal............................................................................ 23 2.2.1.4. Lavagem Epididimária.................................................................. 23 2.2.1.5. Lavagem da bexiga urinária......................................................... 24 2.2.2. Características Seminais .................................................................... 24 2.2.3. Meios e Métodos de Conservação Seminal........................................ 26 2.2.3.1.Água de Coco............................................................................ 28 2.2.4. Inseminação Artificial ......................................................................... 30 3. Justificativa........................................................................................................ 34 4. Objetivos............................................................................................................ 36 5. Experimentos Realizados........................................................................... 37 5.1. Capítulo 1............................................................................................. 37 5.2. Capítulo 2............................................................................................. 54 5.3. Capítulo 3............................................................................................. 77 5.4. Capítulo 4............................................................................................. 97 5.5. Capítulo 5............................................................................................. 110 6. Conclusões.................................................................................................... 131 7. Perspectivas ...................................................................................................... 132 8. Referências Bibliográficas................................................................................ 133 9. Apêndices........................................................................................................... 159 10. Anexos.............................................................................................................. 163 i LISTA DE ABREVIATURAS E SÍMBOLOS %: porcentos ® marca registrada μL: microlitros μm/s micrômetros por segundo °: graus °C: Graus Celsius A: amperes ABP: proteína transportadora de andrógenos ACP®: água de coco em pó CASA: análise computadorizada da motilidade espermática CITES: Convenção sobre o Comércio Internacional das Espécies da Fauna e da : Flora Selvagens Ameaçadas de Extinção cm: centímetros eCG: gonadotrofina coriônica eqüina EDTA: ácido etilenodiamino tetra-acético EEJ: eletroejaculação FeLV: vírus leucemia felina FIV: vírus da imunodeficiência felina FSH: hormônio folículo estimulante G: gaus GnRH: hormônio liberador de gonadotrofinas h: horas hCG gonadotrofina coriônica humana Hz: Hertz IA: inseminação artificial IUCN: União Internacional para a Conservação da Natureza e dos Recursos Naturais Kg: quilogramas LH: hormônio luteinizante mA: miliamperes ii min: minutos mL: mililitros mm: milímetros mOsmol/L: miliosmoles por litro MP: motilidade progressiva mrm: movimentos respiratórios por minuto MT: motilidade total n°: número pH: potencial hidrogênio SCA: Sperm Class Analyser® sptz: espermatozóides T4: testosterona Tes: N- Tris- metil 2- ácido sulfônico aminometano TesT: hidroximetil aminometano e N- Tris- metil 2- ácido sulfônico aminometano Tris: hidroximetil aminometano V: Volts VAP: velocidade média da trajetória do espermatozóide μg: microgramas iii LISTA DE ILUSTRAÇÕES Revisão de LiteraturaFigura 1: Pênis Felino. FONTE: PARAGON e VAISSAIRE (2001). Figura 2: Ritual de acasalamento de felinos domésticos. FONTE: FOGLE (2001). Quadro 1: Protocolos de inseminação artificial em gatas domésticas relatados na literatura. FONTE: ZAMBELLI e MARCO, 2005-modificado. Capítulo 1Tabela 1: Descrição do número de animais, fármacos, doses e via de administração dos protocolos anestésicos utilizados. Tabela 2: Freqüência cardíaca (média ± erro padrão) de gatos submetidos à eletroejaculação após anestesia com 4 diferentes protocolos. Tabela 3: Freqüência respiratória (média ± erro padrão) de gatos submetidos à eletroejaculação após anestesia com 4 diferentes protocolos. Tabela 4: Temperatura retal (média ± erro padrão) de gatos submetidos à eletroejaculação após anestesia com 4 diferentes protocolos. Tabela 5: Saturação de oxigênio (SpO2) de gatos submetidos à eletroejaculação após anestesia com 4 diferentes protocolos antes, durante e nos intervalos da EEJ. Capítulo 2Tabela 1: Volume médio (± DP) do ejaculado (com ou sem espermatozóides), máximos e míninos obtidos na eletroejaculação em gatos domésticos utilizando quatro diferentes protocolos anestésicos. Capítulo 3Tabela 1: Média ± desvio padrão do peso corporal e da biometria dos testículos, comprimento e grau de espículas do pênis de gatos domésticos mantidos em fotoperíodo equatorial natural (n=15). Tabela 2: Média ± desvio padrão dos parâmetros seminais obtidos de ejaculados de iv gatos domésticos mantidos em fotoperíodo equatorial natural coletados por vagina artificial (n= 7). Tabela 3: Tamanho da amostra (N), valores de correlação (r) e de probabilidade (P) obtidos na aplicação da correlação de Sperman entre parâmetros seminais e biométricos de gatos domésticos mantidos em fotoperíodo equatorial natural coletados por vagina artificial. Capítulo 4Tabela 1: Valores (média ± desvio padrão) obtidos para o sêmen fresco de gatos domésticos e diluído em ACP-117® (n= 11 ejaculados). Capítulo 5Tabela 1: Avaliação (média ± desvio padrão) do sêmen fresco dos gatos domésticos utilizados (n= 23 ejaculados). Tabela 2: Motilidade e vigor (média ± erro padrão) durante os tempos de avaliação do teste de termorresistência do sêmen dos gatos domésticos após criopreservação em água de coco em pó (ACP-117®). Tabela 3: Avaliação do sêmen de gatos domésticos a fresco e após criopreservação em água de coco em pó (ACP-117®) em relação aos parâmetros de percentual de espermatozóides vivos, com funcionalidade de membrana, e alterações morfológicas (integridade acrossomal, percentual de normais e anormais e alterações primárias e secundárias; n= 10 ejaculados). Tabela 4: Análise computadorizada (CASA) do sêmen de gatos domésticos após criopreservação em água de coco em pó (ACP-117®) em relação aos parâmetros de motilidade total (MT, %), motilidade progressiva (MP, %), velocidade média da trajetória do espermatozóide (VAP, μm/s) e sub-populações de espermatozóides rápidos e lentos (%; n= 10 ejaculados). Gráfico 1: Motilidade média do sêmen fresco de gatos domésticos e nas etapas de criopreservação (diuição inicial, a 15°C, a 4°C, após a glicerolização, e descongelação) utilizados (n= 23 ejaculados) com água de coco em pó (ACP-117®). Gráfico 2: Vigor médio do sêmen fresco de gatos domésticos e nas etapas de criopreservação (diuição inicial, a 15°C, a 4°C, após a glicerolização, e descongelação) utilizados (n= 23 ejaculados) com água de coco em pó (ACP-117®). v ApêndicesAPÊNDICE 1: Anel de pêlo na base do pênis de um gato doméstico. APÊNDICE 2: Vagina artificial para coleta de sêmen de gatos domésticos. AMontagem da vagina com tubo plástico de 1,5 mL sem tampa e borracha de conta-gotas. B- Amostra de seminal. APÊNDICE 3: Coleta de sêmen de um gato doméstico com uso da vagina artificial. APÊNDICE 4: Biometria do pênis de um gato doméstico com paquímetro. APÊNDICE 5: Eletroejaculação. A- Aparelho para eletroejaculação utilizado nos experimentos (Eletrojet®, Electrovet®, Brasil). B- Exposição peniana para colocar o tubo de coleta de sêmen antes da aplicação dos choques elétricos em um gato doméstico anestesiado. APÊNDICE 6: Monitoração da saturação de oxigênio durante a eletroejaculação, utilizando oxímetro de pulso digital através de sensor localizado na língua do animal (Oxifast 9504®, Takaoka®). APÊNDICE 7: Esfregaço de sêmen felino a fresco corado com azul de bromo fenol. Seta amarela- espermatozóides corados totalmente ou parcialmente corados (mortos). Seta verde- espermatozóides descorados (vivos). Aumento de 400x. APÊNDICE 8: Análise computadorizada (Sperm Class Analiser®) após descongelação do sêmen de gato doméstico criopreservado em ACP-117® acrescido de 20% de gema de ovo e 6% de glicerol. Pontos amarelos- espermatozóides imóveis. Traçados vermelho, verde e azul: trajetória de espermatozóides rápidos, médios e lentos, respectivamente. Pontos brancos- grumos de gema de ovo. Aumento de 100x. AnexosANEXO 1: Composição e modo de preparo do corante Rosa de Bengala. ANEXO 2: Composição e modo de preparo do corante Azul de Bromofenol. ANEXO 3: Composição da água de coco anão maduro. FONTE: NUNES e COMBARNOUS, 1995. 1. INTRODUÇÃO A criação doméstica de gatos vem se expandindo e, em muitos países e nas maiores capitais do mundo, o número de gatos superou já o de cães (FUNEZ, 1998; SOUZA, 2000). No Brasil, espera-se que em 2020, a população felina igualar-se-á à canina (SOUZA, 2000). Atribui-se a esta expansão mundial, o fato dos gatos necessitarem de menor espaço e menos cuidados do que os requeridos pelos cães (CORRADA e GOBELLO, 2000). O aumento da criação alavanca um mercado de produtos e serviços especializados, além de criar uma demanda por biotecnologias, em especial as reprodutivas, já que muitos criam não só por hobby, mas também como uma atividade comercial. Isto gera a necessidade dos criadores em potencializar a capacidade reprodutiva de seus animais (SILVA JÚNIOR, 2002). Em comparação aos cães, há menos pesquisas sobre características reprodutivas a serem disponibilizadas aos técnicos e proprietários de gatos (GRUFFYDD-JONES, 1988). Embora diversas biotécnicas já tenham sido desenvolvidas para gatos domésticos, são encontrados poucos trabalhos sobre machos felinos, principalmente no que se refere às pesquisas sobre características reprodutivas, fisiológicas e biotécnicas aplicadas. Entre as biotecnologias já desenvolvidas para gatos domésticos estão, a sincronização de estro e superovulação (SILVA et al., 2001), a transferência de embriões (MATTOS et al., 2001), a manipulação e criopreservação de folículos ovarianos pré-antrais (LIMA et al., 2006), a clonagem (SHIN et al., 2002) e a conservação de sêmen (ZAMBELLI et al., 2002). Além de serem animais de companhia, os gatos têm importante papel como modelo experimental, permitindo o aperfeiçoamento do conhecimento dos processos biológicos e reprodutivos a serem aplicados aos felídeos selvagens (LUVONI et al., 1999; LUVONI et al, 2003). Entretanto, diferenças entre as diversas espécies são perceptíveis na biologia reprodutiva de felídeos e devem ser consideradas na extrapolação de protocolos experimentais (SILVA, 2003). A Família Felinae é composta de duas subfamílias, 13 gêneros, 36 espécies das quais 10 são neotropicais, e destas, oito são encontradas no Brasil. Apesar de sua larga distribuição natural por quase todos os biótipos, com exceção da Austrália, Madagascar e da Antártica, apenas o gato doméstico (Felis silvestris catus), uma subespécie do gato selvagem europeu, apresenta distribuição cosmopolita. As 36 espécies de felídeos estão classificadas nos Apêndices I e II da Convenção sobre o Comércio Internacional das Espécies da Fauna e da Flora Selvagens Ameaçadas de Extinção (CITES) em diferentes graus de ameaça de extinção. As espécies que ocorrem no território brasileiro estão classificadas desde a categoria de aproximadamente ameaçado a ameaçado de extinção na categoria vulnerável, segundo a IUCN- União Internacional para a Conservação da Natureza e dos Recursos Naturais (OLIVEIRA, 1994; CITES, 2007; IUCN, 2007; SILVA e ADANIA, 2007). Esses animais são ameaçados pela caça furtiva para troféu, a caça predatória para comércio de peles e comércio de animais vivos (GASPARINI e PRADA, 1997). A ação deletéria do homem, além de caçá-los, destrói o hábitat natural, criando ilhas de matas, causando um isolamento genético destes animais. Conseqüentemente, esta perda de variabilidade genética afeta a espermatogênese, a ovulação, aumenta a susceptibilidade desses animais a doenças e aumenta a mortalidade perinatal. Há um consenso geral que a manutenção da diversidade genética de uma espécie é dependente da reprodução. Neste contexto, a aplicação de técnicas de reprodução assistida surge como importante ferramenta na conservação de espécies selvagens ameaçadas de extinção, na medida em que pode minimizar a perda da variabilidade genética por meios de programas reprodutivos (MORATO e BARNABE, 1998). Uma alternativa bastante discutida para a preservação de espécies e da variabilidade genética é o banco de genoma, o qual armazenaria à longo prazo, material genético criopreservado, incluindo gametas e embriões de espécies ameaçadas de extinção (MORAIS, 1999). Além disto, percebe-se atualmente uma demanda dos criadores comercias de gatos domésticos pelos serviços de avaliação andrológica e inseminação artificial (IA- STORNELLI e STORNELLI, 2001). Para o uso comercial da IA em gatos, um dos entraves são os protocolos de conservação do sêmen felino. A conservação de sêmen, seja pelo resfriamento ou pela congelação, permite o transporte de material genético de animais de alto valor comercial por longas distâncias, facilitando significativamente a criação comercial e possibilitando, também, a troca de sêmen entre populações selvagens geograficamente isoladas, restaurando o vigor genético (LUVONI et al., 2003). 2. REVISÃO DE LITERATURA 2.1. Anatomo-Fisiologia da Reprodução do Gato Doméstico 2.1.1. Fotoperíodo e Controle Hormonal A estacionalidade reprodutiva observada em outras espécies animais ainda é controversa nos machos de felinos domésticos. Esta está diretamente relacionada com o número de horas de luz diárias (fotoperíodo) a quais os animais estejam submetidos em localizações geográficas onde exista marcada variação da duração do dia durante o ano (STORNELLI, 2007). Entretanto, há divergências entre os trabalhos realizados ao longo do ano em diferentes localizações. Há quem afirme não haver variação na qualidade ou quantidade de espermatozóides recuperados de epidídimo de gato doméstico (38° de latitude Norte - SPINDLER e WILDT, 1999) até a ocorrência de moderada sazonalidade (52° de latitude Norte - BLOTTNER e JEWGNOW, 2007). Trabalhos realizados na cidade de La Plata - Argentina, localizada a 34° de latitude Sul, com recuperação de espermatozóides de epidídimo de gato doméstico demonstraram a presença de variação na quantidade e na qualidade espermática em diferentes épocas do ano (STORNELLI et al., 2004; TITTARELLI et al., 2004). O número de espermatozóides recuperados e o percentual de espermatozóides vivos é maior em epidídimos de gatos castrados submetidos a mais de 11h de luz/dia (STORNELLI et al., 2004; TITTARELLI et al., 2004). Reyna et al. (2006c) observaram concentração espermática significativamente superior em epidídimos de gatos castrados na primavera que no inverno. Estudos histológicos dos testículos por microscopia óptica demonstraram também uma significativa quantidade de células de Leydig e de túbulos seminíferos em estágio de amadurecimento avançado em amostras obtidas na primavera que as obtidas em outono-inverno (REYNA et al, 2005bc e 2006ab). À observação por microscopia eletrônica, testículos de gatos castrados no verão possuíam uma grande quantidade de túbulos seminíferos com muitas espermátides maduras e espaço intersticial com numerosas células de Leydig com grande quantidade de gotas lipídicas citoplasmáticas. Estas imagens foram relacionadas à maior produção espermática e hormonal, tomando-se por base a estação reprodutivas das fêmeas felinas (REYNA et al, 2005a). Assim como nas demais espécies domésticas, o aumento da testosterona (T4) no sangue periférico, quer por produção endógena pelas células de Leydig ou aplicação exógena durante um tratamento, promove feedback negativo sobre o eixo hipotalâmico hipofisário, bloqueando a descarga pulsátil de hormônio liberador de gonadotrofinas (GnRH), fato que também suprime a liberação de hormônio luteinizante (LH), suprimindo também a liberação da T4 pelas células de Leydig. Os estrogênios são produzidos pelas células de Leydig e de Sertoli. A relação estrogênios e testosterona possuem uma ação moduladora na secreção de LH e hormônio folículo estimulante (FSH) na hipófise anterior. A inibina pode bloquear a secreção de FSH pela hipófise. As células de Sertoli produzem também a ABP (proteína transportadora de andrógenos), que se liga a T4, o que permite uma taxa elevada deste hormônio nos túbulos seminíferos e epidídimo (MIALOT, 1988). As concentrações de testosterona podem ser acompanhadas através de dosagens sangüíneas seriadas em gatos domésticos (TSUTSUI et al., 1990). A excreção de mais de 70% dos hormônios esteróides, incluindo a testosterona, nas fezes e na urina destes animais facilita as interações reprodutivas, assim como possibilita o monitoramento das concentrações fisiológicas destes hormônios de forma não invasiva tanto do gato doméstico como de outros felídeos em cativeiro ou em vida livre (MORAIS et al., 2002). Considera-se que aproximadamente 4,5 ciclos são necessários para o processo de espermatogênese seja completado. Assim, estima-se a espermatogênese em 46,8 dias (FRANÇA e GODINHO, 2003). 2.1.2. Morfologia e Comportamento Sexual No gato doméstico, o pênis encontra-se na posição ventral ao escroto, normalmente voltado para trás, mas fazendo uma reversão após a ereção, penetrando de cima para baixo (JOHNSTON et al., 1996). Pode haver um osso peniano vestigial (PARAGON e VAISSAIRE, 2001). Cerca de dois terços de sua superfície encontra-se recoberto de papilas córneas (100 a 200), variando de 0,75 a 1mm de comprimento e direcionadas à base peniana (JOHNSTON et al., 1996 - Figura 1). Estão completamente desenvolvidas na maturidade sexual, aproximadamente aos 9 meses, e são andrógeno-dependentes, podendo ser classificados em uma escala de 0 a 3, onde zero é ausência de espículos e três são espículos no tamanho máximo para a espécie (MORAES et al, 2002; SILVA et al., 2003). Nas espécies comprovadamente de ovulação induzida, incluindo-se os gatos domésticos, a ovulação ocorre na dependência da cópula (BAKKER e BAUM, 2000). Isso ocorre devido à estimulação de mecano-receptores (somato-sensoriais) presentes na vagina através do contato com as centenas de espículas penianas (BANKS, 1986; CHRISTIANSEN, 1988). Os testículos estão na bolsa escrotal ao nascimento, mas só serão mais facilmente palpáveis as 6 a 8 semanas de vida. As células de Leydig estão maduras aos 5 meses de idade, sendo encontrados espermatozóides no ejaculado logo após este período (FELDMAN e NELSON, 1996). Os testículos possuem em média de 1,5 x 1 x 1 cm cada (JOHNSTON et al., 2001). Para identificação de parceiros e facilitação das interações sexuais, os felinos utilizam os sinais olfativos (glândulas de cheiro na cabeça, pescoço, cauda e almofadas das patas), visuais (arranhaduras) e sonoros, com um vasto repertório de vocalizações (MORAIS, 1999; MORATO, 2001). Os feromônios e outras substâncais alelomiméticas são substâncias químicas voláteis deixadas por fezes e urina ou secretadas por glândulas cutâneas que são perceptíveis ao sistema olfatório e que iniciam respostas endócrinas ou comportamentais em indivíduos da mesma espécie exercendo o seu efeito sobre a atividade reprodutiva via sistema hipotalâmico, gerando pulsos de GnRH (REKWOT et al., 2001). Na fase pré-cópula o gato doméstico observa a fêmea a uma certa distância e só se aproxima quando sente segurança do momento ideal, pois uma fêmea no cio pode ser extremamente agressiva antes e após o coito. Ele monta sobre a fêmea, morde sua nuca, fixando-a, e a gata só permite a intromissão peniana quando está plenamente receptiva (FUNEZ, 1998- Figura 2). Na maior parte das espécies felinas, a ovulação é induzida pela cópula através da estimulação exercida pelos espículos penianos nos mecano-receptores vaginais. Entretanto, fêmeas de gato maracajá não submetidas à cópula apresentaram dosagens de progesterona fecais compatíveis com a ocorrência de ovulação, além de corpos lúteos visíveis à laparoscopia (MOREIRA et al., 2001). Os machos desta mesma espécie não possuem espículos penianos (MORAIS et al, 2002). Figura 1: Pênis Felino 1- Orifício uretral externo; 2- Espículos penianos; 3- Osso peniano; 4- Prepúcio. FONTE: PARAGON e VAISSAIRE (2001). D Figura 2: Ritual de acasalamento de felinos domésticos. Na seqüência, o macho: A- Observa o interesse da fêmea; B- Cheira a genitália da fêmea; C- Aproxima-se da nuca da fêmea; D- Realiza a tentativa de monta na fêmea; E- Realiza fixação na nuca da fêmea; F- Realiza a penetração (cópula) e ejaculação; G- Afasta-se após a cópula. FONTE: FOGLE (2001). 2.2. Tecnologia do Sêmen 2.2.1. Métodos de Coleta Seminal 2.2.1.1. Eletroejaculação 2.2.1.1.1. Conceito e Histórico A eletroejaculação (EEJ) teve sua primeira aplicação prática em 1936 por Gunn para ovinos na Austrália, mas teve uso científico relatado para felídeos somente no final da década de 60 para onça pintada (CARVALHO, 1968) e de 70 para gatos domésticos (PLATZ e SEAGER, 1978; MIES FILHO, 1982). A técnica original de EEJ consistia em fazer passar uma corrente elétrica pela medula ao nível da 4ª vértebra lombar, sendo o aparelho provido de dois pólos, um deles introduzido no reto do animal e o outro adaptado à região lombar depois de raspados os pêlos. Somente em 1945, Laplaud e Cassou modificaram para bovinos e suínos o primitivo sistema de Gunn, introduzindo o eletrodo bipolar em anéis. Esta modificação reduziu significativamente a extensão das excitações necessárias à coleta de sêmen, além de não haver mais a necessidade da forte amarração do animal, podendo-se realizar a EEJ na posição de estação, diminuindo os riscos de acidentes e fraturas (MIES FILHO, 1982). A EEJ é considerada o método de eleição para obtenção de sêmen felino, especialmente para felídeos silvestres, já que possibilita o manuseio do animal vivo (MORAIS et al., 2002). Este método possibilita análises andrológicas em animais de alto valor genético ou animais silvestres que não permitem avaliação sem anestesia devido à sua agressividade ou por não serem treinados para ejaculação em vagina artificial (MORATO e BARNABE, 1998). Baseia-se na indução do reflexo ejaculador através de estímulos elétricos, com a introdução de uma sonda trans-retal lubrificada conectada a um estimulador elétrico, no assoalho da ampola retal do animal anestesiado (SILVA et al., 2004a). É considerado o método ideal para aplicação clínica em casos de questionamento por parte de criadores e proprietários do status reprodutivo de seus animais. É utilizada não só para avaliação andrológica, mas principalmente para obtenção de sêmen para estudos de conservação e inseminação artificial, eliminando o contato físico necessário no momento da cópula ou coleta por vagina artificial e reduzindo risco de transmissão de doenças; bem como, possibilitando o fracionamento do ejaculado para utilização em mais de uma fêmea em gatis comerciais (PLATZ e SEAGER, 1978; TEBET et al., 2006). Os estudos de eletroejaculação em animais domésticos como cães e camundongos, além de serem úteis para o desenvolvimento e uso da técnica na própria espécie, são utilizados para o desenvolvimento de protocolos em seres humanos nos casos de problemas neurogênicos decorrente de injúria espinhal, cirurgias retroperineais, esclerose múltipla ou neuropatias diabéticas que resultam na ausência de ejaculação (PINEDA et al., 1987; PINEDA e DOOLEY, 1991; OHL et al., 1994; CAZES, 2006; MUNO et al., 2006). A EEJ é realizada também em uma ampla gama de espécies não domésticas, entre elas lobos - Canis rufus (GOODROWE et al., 1998; GOODROWE et al., 2001), cães selvagens africanos - Lycaon pictus (WARD et al., 2006), raposas voadoras selvagens - Pteropus spp.(JONG et al., 2005), panda gigante Ailuropoda melanoleuca (SPLINDER et al., 2004), urso marrom de Hokkaido - Ursos arctos yesoensis (ISHIKAWA et al., 2002), cateto - Tayassu tajacu (COSTA e PAULA, 2005), chinchila - Chinchilla lanigera (BUSSO et al., 2005), macaco-prego- Cebus apella (ARAÚJO et al., 2007), quatis - Nasua nasua (PIRES FILHO et al., 2005; QUEIROZ, 2007; VIANA et al., 2007) e irara- Eira barbara (MORGADO et al., 2007). Em felídeos, já foi realizada, entre outras espécies, em leões - Panthera leo (SWANSON, 2003), onças-pintadas - Phantera onca (MORATO et al., 1998; MORATO et al., 2001; PAZ et al., 2000; PAZ et al., 2003), pumas - Puma concolor (WILDT et al., 1988), guepardos - Acinonyx jubatus (WILDT et al., 1983; HOWARD et al., 1993; ROTH et al., 1995), tigres - Panthera tigris (DONOGHUE et al., 1992; BYERS et al., 1989) e tigres siberianos - Panthera tigris altaica (SCHMEL et al., 1990), leopardos - Phantera pardus (JAYAPRAKASH et al., 2001), leopardos das neves - Uncia uncia (ROTH et al., 1994), gatos leopardo - Felis bengalensis (HOWARD e WILDT, 1990), leopardos nebulosos - Neofelis nebulosa (WILDT et al., 1986; PUKAZHENTHI et al., 2006), jaguatiricas - Leopardus pardalis (MORAIS et al., 2002; QUEIROZ, 2003; TEBET, 2004), gatos-do-mato pequeno - Leopardus tigrinus (MORAIS et al., 2002; TEBET, 2004; ERDMANN et al., 2005), gatos maracajás - Leopardus wiedii (MORAIS et al., 2002) e gatos de Palla - Otocolobus manul (SWANSON et al., 2006). 2.2.1.1.2. Tipos de aparelho Existem vários modelos de aparelhos de EEJ, alguns utilizam corrente elétrica contínua, outras alternada (WILDT, 1996). O aparelho pode ser fabricado sob medida para uso em felinos (PLATZ e SEAGER, 1978; DOOLEY et al., 1983) ou pode-se adquirir o mesmo tipo utilizado para bovinos (MORATO e BARNABE, 1998). A sonda deve possuir o tamanho adequado ao porte da espécie, sendo aproximadamente do diâmetro das fezes do animal (WILDT, 1996). Para carnívoros, a que permitiu melhores respostas ejaculatórias foi as que possuíam tiras longitudinais ao invés de circulares (HOWARD, 1999). Em geral, a sonda trans-retal possui três eletrodos, um positivo, um negativo e um neutro em tiras longitudinais dispostas paralelamente (MORATO e BARNABE, 1998; SILVA et al., 2004). Platz e Seager (1978) descreveram a manufatura de uma sonda para gatos domésticos de 1 cm de diâmetro por 12 cm de comprimento e 3 eletrodos inoxidáveis ventrais de 5 cm. Os mostradores podem expressar tensão elétrica (voltagem) e intensidade de corrente (amperagem), mas recomenda-se o uso do mostrador de voltagem para facilitar o procedimento, já que os protocolo de estímulos elétricos para felídeos são descritos nesta unidade (PLATZ e SEAGER, 1978; DOOLEY et al., 1983; MORATO e BARNABE, 1998). Em geral, aparelhos com mostradores de voltagem e amperagem não estão facilmente disponíveis no mercado nacional brasileiro. A maior parte das descrições nacionais se referem a aprelhos portáteis com monitor em miliamperagem. Um opção para utilização de aparelhos com os dois mostradores é a aquisição de aparelho importado (ERDMANN, 2005), ou nos nacionais a solicitação para inclusão de mais um mostrador. Entretanto Pineda et al. (1984) descrevem para gatos domésticos certa correspondência da tensão elétrica aplicada com a intensidade de corrente, utilizando uma onda elétrica sinusoidal de 60Hz de freqüência. Segundo estes autores, uma descarga de 2V corresponde ao intervalo de 20 a 30 mA, e de 3V de 30 a 40 mA. Os aparelhos adquiridos podem ser manuais, automáticos ou podem possuir as duas opções de estimulação. Os automáticos, desencadeam a sequência de choques sem a ação do operador, necessitando-se de um único operador para todo o procedimento de EEJ, além de fornecem maior precisão na aplicação dos choques (DOOLEY et al., 1983; SILVA et al., 2003; ERDMANN et al., 2005; LIMA et al., 2007). Os aparelhos atuais possuem alimentação através de cabos ligados a tomadas elétricas ou por baterias portáteis e automotivas. Antigos aparelhos possuíam alimentação por dínamos, produzindo energia eletromagnética através de uma manivela (MIES FILHO, 1982). 2.2.1.1.3. Anestésicos utilizados A EEJ é um procedimento simples, rápido e prático (MORAIS et al., 2002). Embora os primeiros estudos em felinos domésticos e silvestres tenham sido realizados somente com a contenção física sem auxílio de anestesia (CARVALHO, 1968; SCOTT, 1970; MIES FILHO, 1974), aos moldes do realizado para animais de produção, a EEJ em felinos, seja em domésticos ou silvestres necessita da aplicação de anestésicos para contenção do animal, evitando riscos à equipe, mas implicando ao animal os riscos envolvidos no procedimento anestésico. Assim, a qualidade da anestesia deve ser suficiente para executar a colheita de sêmen com eficácia e promover analgesia ao animal durante o procedimento (ERDMANN, 2005). Há um variável número de combinações farmacológicas e variações de doses entre autores. Tiletamina, zolazepam e três doses distintas de xilazina foram testadas para gato-do-mato (ERDMANN, 2005). As combinações de cetamina e midazolam, e cetamina, midazolam e butorfanol foram testadas para jaguatirica e gatodo-mato pequeno (TEBET, 2004). Dentre os protocolos anestésicos mais utilizados para EEJ em gatos domésticos e felídeos silvestres estão: cloridrato de cetamina (PLATZ e SEAGER, 1978; ZAMBELLI et al., 2002; PUKAZHENTNI et al., 2006) e as associações de cloridrato de cetamina e xilazina (MORAIS et al., 2002) e tiletamina e zolazepam (PUKAZHENTNI et al., 1999; MORAIS et al., 2002; MORATO et al., 2002; TEBET et al., 2006). Outras associações também já foram utilizadas com este propósito para gatos domésticos como: tiletamina, zolazepam e morfina; tiletamina, zolazepam, butorfanol e acepromazina (TEBET et al., 2006), cetamina e medetomidina (AXNÉR et al., 1998; ZAMBELLI et al., 2007), propofol (CHATDARONG et al., 2006), propofol e buprenofina (CHATDARONG et al., 2006), indução anestésica com propofol e anestesia epidural com lidocaína (LEITE et al., 2006), metoxamina (DOOLEY et al, 1991) ou anestesia inalatória com a indução anestésica à base cetamina, diazepam, tiopental sódico, tramadol e manutenção anestésica com isoflurano (SILVA et al., 2004b). Tebet (2004) realizou EEJ com dois diferentes protocolos para gato doméstico, obtendo melhores resultados com a associação de tiletamina, zolazepam e um opióide, a morfina, para gatos domésticos. Isto provavelmente se deveu à analgesia mais profunda promovida pelo opióide que a associação da tiletamina, zolazepam à acepromazina e butorfanol. Em resultados preliminares bastante satisfatórios, SILVA et al. (2004b) utilizaram a anestesia inalatória com a indução anestésica à base de cloridrato de quetamina, diazepam, tiopental sódico e manutenção anestésica com isoflurano por EEJ em gatos domésticos. Uma desvantagem do uso de determinados fármacos é a diminuição do volume seminal. Quando a atropina é utilizada para diminuir a sialorréia comum na anestesia com tiletamina e zolazepam, este fato pode ser observado (PLATZ e SEAGER, 1978; MORATO et al., 2002). As características de alguns fármacos utilizados para contenção química e anestesia para EEJ em felídeos estão abaixo relacionadas: Cetamina: é um anestésico dissociativo, ou seja, que promove interrupção do fluxo de informações para o córtex sensitivo e depressão seletiva de alguns centros cerebrais, com concomitante estímulo de áreas límbicas (ANDRADE, 2002). Tiletamina: é utilizada exclusivamente em combinação ao zolazepam. Produz analgesia intensa no sistema muscular esquelético e os sinais clínicos obtidos são semelhantes à cetamina. Na recuperação da anestesia podem ocorrer delírios e alucinações (FANTONI e CONTOPARSSI, 2002). Isoflurano: é um agente anestésico inalatório geral administrado e eliminado por via inalatória que promove analgesia, relaxamento muscular e inconsciência. Uma grande vantagem do seu uso frente aos anestésicos dissociativos é a alta potência e o maior controle do plano anestésico, a indução e recuperação rápidas, além do fato do efeito tempo não ser um limitante, já que devido à sua baixa solubilidade somente 0,2% deste fármaco é biotransformado, gerando ausência de efeitos cumulativos e conseqüente baixa toxicidade renal e hepática (ANDRADE, 2002). Xilazina: relaxante muscular que apresenta efeitos cardio-pulmonares que incluem bradicardia, bloqueio átrio-ventricular de primeiro, segundo e terceiro grau, redução do débito cardíaco e aumento inicial da pressão arterial, seguido de hipotensão duradoura, devido aos seus efeitos sedativos de α-2 agonista (ANDRADE, 2002). O efeito do uso da xilazina na EEJ já foi estudado em cães (DOOLEY et al., 1990) e bodes (MARTIN et al., 2003), mas em relação ao aspecto de produção de ejaculação retrógrada. Medetomidina: é um agonista α2-adrenérgico com importante ação sedativa e analgésica, mais potente que xilazina e que pode produzir, por si só, anestesia. Este agente tem sido empregado para promover analgesia e sedação no período pósoperatório e nas unidades humanas de tratamento intensivo, sendo seguro para uso também em felinos (BREARLEY, 1994; AXNÉR et al., 1997 e 1998; VILLELA e NASCIMENTO JR., 2002; ZAMBELLI et al., 2006). Zolazepam: benzodiazepínico de efeito anti-convulsivante, ansiolítico, hipnótico e relaxante muscular, sendo utilizado somente em combinação com a tiletamina (ANDRADE, 2002). Diazepam: promove depressão respiratória de pequena monta, e embora seja bastante comum e útil como medicação anti-convulsivante, é amplamente usado na indução anestésica, promovendo redução da dose anestésica em até 50% (ANDRADE, 2002). Morfina: analgésico opiáceo usado no tratamento da dor aguda e crônica e na medicação pré-e pós-operatória. Amplamente utilizada em gatos, e segura na doses recomendadas, não promovendo excitação (ANDRADE, 2002; ROBERTSON, 2007). Tramadol: agente analgésico de ação central, estruturalmente relacionado à morfina e codeína (CASSU e LUNA, 2003) e de uso relativamente recente na Medicina Veterinária quando comparado à morfina. É conhecido por não causar a depressão respiratória comumente causada pela morfina, nem tampouco efeitos cardiovasculares graves (ANDRADE, 2002). Propofol: anestésico intravenoso, classsificado como um alquil-fenol, é um agente hipnótico com período de latência curta e duração de efeito ultracurta. Promove rápida perda de consciência (20 a 40 segundos) após administração. Em bolus mostrouse eficiente para EEJ e diferentemente da cetamina, promove uma diminuição das concentrações séricas de cortisol, e demonstrou não indução de dor ou estresse durante a EEJ (CARTER et al., 1984; CHATDARONG et al., 2006). Os protocolos dissociativos mais utilizados (cetamina e xilazina; tiletamina e zolazepam) são descritos como seguros e eficazes para EEJ de diversas espécies de felídeos (MORAIS et al., 2002; MORATO et al., 2002). Algumas combinações farmacológicas apresentam a vantagem de possuírem antagonistas específicos. Nestas duas combinações anestésicas citadas, a xilazina pode ser revertida por antagonistas como a ioimbina (ANDRADE et al., 2000; EMÍLIO et al., 2004) e o zolazepam pelo flumazenil, acelerando o tempo de retorno anestésico e inibindo os efeitos indesejados desses fármacos. Outra anestesia relatada, com o uso da medetomidina pode ser revertida com o atipamezol (AXNÉR et al., 1997). As anestesias que utilizam opiódes podem ser revertidas com naloxona ou ioimbina (ANDRADE, 2002; CASSU e LUNA, 2003). PLATZ e SEAGER (1978) relatam que a EEJ com anestesia utilizando-se a cetamina pode ser executada rotineiramente uma vez por semana sem efeitos causados pela anestesia ou pela inserção da sonda no reto do animal. A capacidade de ejaculação do gato não é afetada pela estimulação elétrica e anestesias repetidas (PINEDA et al., 1984). 2.2.1.1.4. Controle dos parâmetros fisiológicos durante a anestesia e EEJ Para o procedimento de eletroejaculação, os animais monogástricos devem ser mantidos em jejum de 12 a 24 h, recebendo anestésico até atingir estágio de anestesia cirúrgica, ou estágio 3 de Guedel (HOWARD, 1999). Com o transcurso da EEJ, os animais devem ser monitorados para serem mantidos no plano I deste estágio (QUEIROZ, 2003). Os estágios de Guedel valorizam a verificação dos reflexos interdigital, palpebaral, pupilar, laringotraqueal e anal; a freqüência e o padrão respiratório e cardíaco. O plano I do estágio 3 corresponde ao plano de anestesia superficial com desparecimento do reflexo interdigital, respiração regular e automática, no qual é possível realizar a intubação do animal. No plano II do 3 de Guedel, a respiração torna-se gradativamente menos profunda, há perca do reflexo palpebral com rotação do globo ocular (sinal patognomônico em cães, gatos e ruminantes). No plano III do mesmo estágio, a respiração é preferencialmente abdominal com esforço inspiratório, estímulos dolorosos de qualquer intensidade não promovem estimulação simpática e o reflexo corneal está ausente (ANDRADE et al., 2002). A presença de reflexo palpebral é esperada para anestesias dissociativas mesmo em plano anestésico, mas o reflexo palpebral deve estar ausente na anestesia inalatória quando o plano anestésico é alcançado (ANDRADE et al., 2002). O acompanhamento do ritmo e da freqüência cardíaca é extremamente importante, já que o conhecimento do seu valor a cada instante permite estabelecer comparações entre as médias consideradas fisiológicas para a espécie e aquelas apresentadas pelo indivíduo antes e após a anestesia. Esta avaliação pode ser realizada mesmo por profissional menos treinado através da estetoscopia, ou de forma mais apurada, através da eletrocardiografia. A contínua observação da freqüência respiratória também é imprescindível, já que a simples contagem dos movimentos respiratórios pode dar idéia da profundidade da anestesia. Outras avaliações podem ser realizadas para um melhor o acompanhamento anestésico, entre elas, pressão arterial e oximetria de pulso (NUNES, 2002). Para EEJ em felídeos, relata-se o uso de oximetria de pulso com sensor na língua dos animais, embora no uso de anestesias dissociativas, movimentos da língua possam causar interferência na aferição (MORATO et al., 2002). Nestes casos, outros posicionamentos para avaliação da oximetria podem ser tentados, como patas (BRAGA, 2007) ou orelhas (NUNES, 2002). Alguns equipamentos fornecem o traçado da onda pletismográfica e o valor da freqüência de pulso que deve ser virtualmente a mesma da freqüência cardíaca. Os valores aferidos de oximetria e freqüência são confiáveis desde que o aparelho reconheça uma onda pletismográfica válida e de boa intensidade. O traçado pletismográfico não deve substituir a eletrocardiografia (NUNES, 2002). Para felídeos, a eletrocardiografia é procedida, em geral, após a EEJ (CORTEZE, 2006). Os monitores eletrocardiográficos sofrem interferências de fontes diversas, inclusive do próprio paciente como tremores musculares (NUNES, 2002). Uma avaliação já utilizada para avaliação do grau de analgesia do protocolo anestésico empregado em EEJ de felídeos é reflexo por compressão do periósteo de falanges dos membros pélvicos e torácicos em substituição à compressão interdigital (ERDMANN, 2005). A temperatura retal também deve ser avaliada e uma diminuição é esperada com o uso das associações de cetamina e xilazina; e tiletamina e zolazepam (SANTOS et al., 2004; MORATO et al., 2002). 2.2.1.1.5. Posicionamento do animal para EEJ Para coleta de sêmen, após anestesia, o animal é colocado em decúbito lateral e o pênis é exposto aplicando-se uma suave pressão na sua base e um frasco, em geral pré-aquecido, é colocado sobre o pênis, tomando-se o cuidado de substituí-lo em cada série ou subsérie (10 estímulos elétricos sucessivos), evitando a contaminação por urina da amostra obtida nos estímulos anteriores (PLATZ e SEAGER, 1978; PLATZ et al, 1978; HOWARD et al., 1986; MORAIS, 1999; MOREIRA e MORATO, 2007). Recomenda-se o uso destes frascos pré-aquecidos (22 a 37°C - PLATZ e SEAGER, 1978; MOREIRA e MORATO, 2007), podendo ser aquecido na mão do manipulador (MORATO et al., 1998). Bons resultados de qualidade após EEJ foram obtidos por Tebet et al. (2006), utilizando tubos mantidos à temperatura ambiente para recolhimento dos ejaculados obtidos nas séries e processamento do sêmen de forma conjunta após a EEJ. 2.2.1.1.6. Protocolos de estímulos elétricos Diferentes protocolos de estímulos elétricos já foram desenvolvidos em felinos. Platz e Seager (1978) utilizaram para coleta por EEJ de gatos domésticos, 180 estímulos de 2 a 7V. Nesta descrição, foram procedidos três blocos de 60 estímulos. Cada bloco foi dividido em 4 séries de 15 estímulos, no qual para cada série houve um acréscimo de 1V sem intervalo entre séries. No primeiro bloco foram procedidos 15 estímulos de 2, 3, 4 e 5V; no segundo 5 estímulos de 2, 10 de 3 e 15 de 4, 5 e 6V; e no terceiro 5 estímulos de 2, 5 de 3, 5 de 4, 15 de 5, 6 e 7. Outros trabalhos que avaliaram o efeito da voltagem na coleta de sêmen de gatos domésticos foram realizados com estímulos de 1 a 8V (PINEDA et al., 1984; PINEDA e DOOLEY, 1984 DOOLEY e PINEDA, 1986). Porém, atualmente os mais utilizados são o método de Wildt et al. (1983), inicialmente descrito para chitas, e o de Howard et al. (1984), descrito para 28 espécies de felídeos. Os dois métodos são utilizados para gato doméstico e em ambos os casos, após anestesia (AXNÈR et al., 1997; SILVA et al., 2004b). No primeiro, são aplicados 80 estímulos elétricos divididos em três séries. Na primeira série, é procedida a administração de 10 estímulos de 2, 3 e 4 V, sucessivamente. Na segunda, 10 estímulos de 3, 4 e 5 V e, na terceira, 10 estímulos de 5 e 6 V. Entre cada série, há 5 minutos de intervalo. Já no protocolo definido por Howard et al. (1984), são aplicados também 80 estímulos elétricos divididos em três séries, onde somente a terceira série diferencia-se do anteriormente descrito, com 10 estímulos de 4V e 10 de 5 V e intervalos entre séries variando de 5 a 10 minutos. Cada estímulo que é aplicado vai de 0V até a voltagem desejada em 1 segundo e permanece nela cerca de 2 a 3 segundos, seguido de um retorno abrupto a 0V, no qual permanece por 2 a 3 segundos. Para a coleta de animais de produção, excitações de 3 a 5 segundos e pausa igual de tempo são promovidas (MIES FILHO, 1982). Deve-se lubrificar a sonda antes da introdução no reto para manter o contato elétrico entre eletrodos e a parede retal, podendo o lubrificante ser um enema comercial, carboxi-metil-celulose, lubrificante íntimo humano ou água (PLATZ e SEAGER, 1978; PLATZ et al., 1978; MIES FILHO, 1982; MORATO et al., 1998). Um protocolo padronizado, no qual o macho recebe o mesmo número de estímulos elétricos na mesma voltagem é interessante para comparar as características do ejaculado entre machos e resultados de diferentes locais (HOWARD, 1993). 2.2.1.1.7. Contaminação do ejaculado por urina Coletas por EEJ, em geral, são seguidas por centrifugação quando se suspeita que a amostra esteja contaminada por urina (TEBET, 2004). A contaminação por urina no ejaculado após EEJ em gato doméstico é pouco observada e mais freqüentemente relatada com uso de voltagens superiores a 8V (PINEDA e DOOLEY, 1984) ou com o uso de combinações anestésicas contendo acepromazina (MARTIN, 1978). O protocolo anestésico combinando tiletamina, zolazepam, butorfanol e acepromazina foi considerado insatisfatório para EEJ em gatos domésticos por induzir contaminação por urina, quando comparado ao tiletamina, zolazepam e morfina (TEBET, 2004). Para outros felídeos não domésticos, protocolos à base de tiletamina e zolazepam, ou combinações contendo cetamina, associada à xilazina, diazepam e/ou butorfanol propiciaram obtenção de ejaculados contaminados por urina em 26,9 a 53% e 59 a 69% das EEJ, respectivamente para gato-do-mato pequeno e jaguatirica (MORAIS, 1999; TEBET, 2004). No gato-maracajá, relata-se a contaminação de uma única subsérie (10 estímulos elétricos suscessivos) em 41 ejaculado obtidos (MORAIS, 1999). Procedimentos de EEJ em gato-do-mato-pequeno mostraram que em planos anestésicos muito profundos ou muito superficiais a incidência de contaminação por urina é maior (TEBET, 2004). De acordo com Howard (1993), o uso de anestésicos inalatórios pode relaxar a musculatura ao redor da bexiga, facilitando a ejaculação com urina. Entretanto, a contaminação do ejaculado por urina na EEJ de jaguatiricas utilizando tiletamina, zolazepam não diferiu das anestesiadas com a mesma combinação suplementadas com isoflurano (QUEIROZ et al., 2004). O mecanismo fisiológico da ejaculação e da prevenção da contaminação por urina é controlado pelo sistema nervoso simpático eferente. Aumentar as concentrações de anestésicos inalatórios pode reduzir marcadamente a resposta dos nervos eferentes, tanto centrais, como periféricos, decrescendo as chances de sucesso na EEJ (SHORT, 1987 apud QUEIROZ et al., 2004; HOWARD, 1993). Para gatos domésticos, na EEJ com o uso da anestesia inalatória com isoflurano a contaminação do ejaculado por urina não foi observada (SILVA et al., 2004b). O posicionamento muito cranial da sonda no momento da ejaculação pode resultar em ejaculado com urina, uma vez que parece haver maior proximidade entre a inervação controladora da micção e a da ejaculação na Família Felidae (MARTIN, 1978). O reflexo de micção requer uma integração complexa e coordenada entre três sistemas nervosos: simpático, parassimpático e o somático. A integração destes sistemas resulta em contração do músculo destrusor da bexiga urinária e o relaxamento da musculatura lisa e estriada da uretra. As vísceras pélvicas possuem três pontos principais de inervação: nervo pélvico, o pudendo e o hipogástrico, ou seja, os mesmos nervos envolvidos no processo ejaculatório. O músculo destrusor da bexiga relaxa-se pela estimulação simpática e contrai-se por estimulação parassimpática. O esfíncter uretral interno contrai pela estimulação simpática e o externo contrai via nervo pudendo (CAZES, 2006; TUDURY et al., 2006). A contaminação por urina, portanto, parece ser independente da escolha do anestésico e ser conseqüência da proximidade das vias neurais que controlam as funções da bexiga e da ejaculação (HOWARD, 1999). 2.2.1.1.8. Falha na obtenção do ejaculado e ejaculação retrógrada Para felídeos, os relatos de obtenção de ejaculado na coleta por EEJ vão de 60,6 a 80% no gato doméstico e 100% dos procedimentos de EEJ na onça pintada e no gato-do-mato-pequeno (PLATZ e SEAGER, 1978; MORATO et al, 1998; ERDMANN et al., 2005; LEITE et al., 2006). Em guepardos, de 22 animais, 18 ejacularam (WILDT et al., 1983). Em gatos domésticos, 20% dos animais não ejacularam em nenhuma das séries (LEITE et al., 2006). Embora a obtenção de ejaculado seja freqüente, a presença de espermatozóides no ejaculado, nem sempre é observada. Erdmann et al. (2005) relatam que em gato-do-mato-pequeno, todas as coletas resultaram em ejaculado contendo espermatozóides, mas a obtenção de somente plasma seminal foi relatada em 20% dos procedimentos EEJ para onças pintadas (MORATO et al., 1998). A ejaculação retrógrada é freqüentemente observada durante ejaculação natural ou EEJ no gato doméstico, com percentuais de 15 a mais de 90% (DOOLEY et al., 1991). A realização de cistocentese com a visualização de células espermáticas na urina colhida é a forma de determinar a ocorrência deste tipo de ejaculação. A visualização de pequena quantidade de espermatozóides na urina colhida por cistocentese é normal mesmo sem o uso de qualquer contenção farmacológica ou estímulo ejaculatório (DOOLEY et al., 1991; TEBET, 2004; ZAMBELLI et al., 2007). O uso da xilazina comprovadamente induz uma maior freqüência de ejaculação retrógrada em cães (DOOLEY et al., 1990) e suínos (MARTIN et al., 2003). Um α-2 agonista semelhante à xilazina, a medetomidina, sem uso de qualquer estímulo copulatório induziu em gatos domésticos a ejaculação retrógrada semelhantemente à cetamina isolada (ZAMBELLI et al., 2007). Na ejaculação antrógrada observa-se três eventos: a emissão seminal, o fechamento do colo da bexiga e a expulsão seminal pela uretra peniana. Na ejaculação retrógrada, há o fechamento inadequado do colo da bexiga. Assim, não há aumento de pressão dentro da uretra prostática e o sêmen segue o caminho de menor resistência, indo para o interior da bexiga. Qualquer processo que interfira na inervação simpática do sistema reprodutor e da bexiga pode resultar em retroejaculação (ROMAGNOLI et al., 1999). O sucesso de uma coleta de sêmen em felídeos por EEJ envolve a combinação de múltiplos fatores (QUEIROZ et al., 2004). As variações na obtenção de ejaculados, com ou sem espermatozóides, podem estar vinculadas a vários fatores, como os diferentes procedimentos anestésicos realizados entre autores. Além das variações promovidas pelas combinações anestésicas utilizadas para as diferentes espécies e protocolo de voltagens utilizado, deve-se considerar a variação individual, o posicionamento e tamanho da sonda, a presença de fezes no reto. Para gatos domésticos, deve ser inserido cerca de 7 a 9 cm no reto tomando-se o cuidado para que fiquem voltados em sentido ventral, a fim de promoverem adequada estimulação do plexo pélvico (PLATZ e SEAGER, 1978; MOREIRA eMORATO, 2007). Na EEJ é esperado o reflexo de extensão das patas traseiras e exposição das unhas. Se o reflexo nas primeiras sub-séries não é observado, ou a reação for exacerbada, a posição da sonda pode não estar sendo adequada ou há interferência no estímulo elétrico pela presença de fezes no reto (SILVA et al., 2004a; PLATZ JR. e SEAGER, 1978). No momento da aplicação dos estímulos elétricos, a contração simétrica dos membros posteriores deve ser observada como indicativo da aplicação dos estímulos elétricos de forma satisfatória (HOWARD et al., 1984). A sonda deve ser pressionada contra o assoalho da ampola retal e o aprofundamento ou a exteriorização dessa não deve ocorrer. No intervalo das séries, a sonda deve ser retirada, as fezes da sonda devem ser limpas e uma nova lubrificação dos eletrodos feita a cada nova inserção (PLATZ e SEAGER, 1978). Para gatos domésticos Platz e Seager (1978), descreveram que em alguns casos ejaculados não eram obtidos antes do terceiro bloco de estímulos. Segundo o descrito para animais de produção, a emissão do sêmen se produz geralmente depois do terceiro ou quarto choque. O animal tanto pode ejacular com pênis flácido, como fazê-lo em ereção, dependendo do alcance dos estímulos. A excitação mais posterior (região lombo-sacra) implica em resposta de ereção, e excitações dirigidas para a área mais anterior (região lombar propriamente dita) produzem um efeito mais acentuado de ejaculação. A excitação da região sacra ou lombo-sacra produz além do efeito eretivo, a expulsão das secreções das glândulas acessórias. Os nervos eretores possuem origem exatamente nesta região, constituindo-se pelo 1°, 2°, e 3° pares sacros, e dependem do plexo hipogástrico. O plexo mesentérico posterior se relaciona de um lado com o hipogástrico, e de outro com o espermático, desempenhando seu papel na ejaculação. A disposição destes nervos explica porque se pode obter sêmen com pênis flácido, o que ocorre freqüentemente; com pênis em ereção ou semi-ereção; apenas ereção sem ejaculação ou simplesmente ejaculação de glândulas anexas. Assim, a EEJ possibilita um resultado falso na avaliação andrológica, ou seja, falha na coleta de um macho fértil que poderia fornecer ejaculação integral se coletado por vagina artificial (MIES FILHO, 1982). A ausência de ejaculação em um procedimento isolado não deve, no entanto, caracterizar a incapacidade de produção espermática pelo animal. Dois procedimentos de EEJ são necessários para uma boa avaliação andrológica de um animal pelo procedimento de EEJ (PLATZ e SEAGER, 1978). 2.2.1.2. Vagina artificial A coleta de sêmen por vagina artificial não é considerada um método prático de avaliação andrológica de animais em ambiente clínico, já que há necessidade do treinamento de 2 a 3 semanas do animal, e este treinamento é bem sucedido em somente 60 a 70% dos casos (PLATZ e SEAGER, 1978). O gato mesmo que treinado, se colocado em ambiente que não é o seu usual, provavelmente não ejaculará (AXNÉR e LINDE-FORSBERG, 2002). Este método é útil para gatos domésticos de colônias (AXNÉR e LINDE-FORSBERG, 2002) e nestas condições já foi utilizado por vários autores (SOJKA et al., 1970; PLATZ et al., 1978; PLATZ e SEAGER, 1978; TANAKA et al., 2000ab; TSUTSUI et al., 2000a; 2000b; 2001; SÁNCHEZ e TSUTSUI, 2002; VILLAVERDE, 2007), entretanto, em alguns gatos com temperamento mais agressivo e em felídeos selvagens, esta é uma prática que oferece inúmeros riscos às pessoas que irão manipular o animal (MORATO et al., 1998; STORNELLI e STORNELLI, 2001; AXNÉR e LINDE-FORSBERG, 2002). Uma exceção foi a coleta relatada de guepardos por Watson em 1978 (WATSON e HOLT, 2001). A vagina artificial para gatos domésticos é manufaturada a partir da parte superior de borracha de um conta-gotas, cuja ponta bojuda é cortada e acoplada a um tubo de ensaio ou coleta, podendo este ser plástico do tipo Eppendorf® sem tampa. O tubo com a borracha deve ser encaixado em uma garrafa de polietileno de 60 mL contendo água a 52°C, permitindo uma temperatura interna de trabalho de 44 a 46°C. Na entrada da vagina artificial é espalhado lubrificante íntimo de uso humano. O macho é posto em contato com uma fêmea em estro natural ou induzido e no momento da ereção do pênis para a cópula, encaixa-se a vagina artificial, onde o ejaculado será depositado (SOJKA et al., 1970). A coleta se completa em 1 a 4 minutos (ZAMBELLI e CUNTO, 2006). O mesmo resultado também é obtido sem o uso da garrafa (AXNÉR, 1998; TANAKA et al., 2000ab; VILLAVERDE e LOPES, 2007), tornando o procedimento mais prático. Neste caso sem a garrafa, a vagina artificial é fixada entre os dedos indicador e médio (TANAKA et al., 2000a). TANAKA et al. (2000a) descrevem a colocação da borracha na região interna com a fixação ao tubo com parafilme. Quando a cobertura aquecedora (garrafa) é utilizada, o cuidado deve ser redobrado no momento de desencaixe do tubo, afim de que a água não entre em contato com o sêmen (SOJKA et al., 1970). Alguns autores sugerem que a vagina artificial mesmo sem a cobertura aquecedora, deva estar aquecida a 36 °C (STORNELLI e STORNELLI, 2001), ou ainda utilizar o tubo plástico diretamente, sem borracha, contendo 100 μL de diluidor aquecido (STORNELLI, 2007- comunicação pessoal). STORNELLI e STORNELLI (2001) consideram a coleta por vagina artificial um procedimento dificultoso, já que mesmo treinados previamente e já coletados por vagina, os gatos podem não aceitá-la em um novo procedimento. Assim, indica-se a sociabilização e o treinamento do gato desde a puberdade para um melhor sucesso na coleta (STORNELLI e STORNELLI, 2001). Coletas com manequins inanimados (bichos de pelúcia) já foram relatadas em machos bem treinados (VILLAVERDE, 2007). A coleta por vagina artificial apresenta a vantagem de permitir a sua realização de forma diária, ou em intervalos curtos regulares, diferentemente da EEJ. Intervalos de coleta dupla (2 coletas consecutivas intervaladas por 5 a 10 minutos) por vagina artificial de 24, 48 e 72 h foram testadas quanto ao seu efeito na qualidade seminal, e demonstrou-se que a qualidade seminal não é afetada por até 10 dias de coletas diárias (TANAKA et al., 2000a). 2.2.1.3. Lavagem vaginal A lavagem vaginal para obtenção de sêmen é um método pouco prático na rotina clínica, já que poucos gatos copulam em ambientes diferentes dos seus domicílios. Após a cópula, é realizada a sedação da fêmea e a lavagem da vagina do animal é feita com solução fisiológica a 37 ºC (AXNÈR, 1998). A lavagem com 1 mL de solução salina permite a recuperação de 4 x 105 a 10 x 106 espermatozóides (STORNELLI e STORNELLI, 2001). Este método não é muito eficiente, já que os espermatozóides coletados podem ter sofrido alterações relacionadas à técnica utilizada. Somente é uma boa alternativa quando os métodos de vagina artificial e eletroejaculação não possam ser realizados ou foram realizados com insucesso (AXNÈR, 1998). 2.2.1.4. Lavagem Epididimária A lavagem epidimária é uma boa alternativa para obtenção de gametas de felídeos domésticos e selvagens post-mortem (AXNÈR, 1998; AXNÈR e LINDE-FORSBERG, 2002). Este método é muito eficaz e útil, principalmente para animais de alto valor genético e de felídeos selvagens, já que garante uma boa conservação do material gênético dos mesmos. Este método consiste na obtenção dos espermatozóides logo após a castração ou morte do animal, lavando o epidídimo com um diluente seminal (300 a 500 µL) para obtenção de espermatozóides da cauda ou pelo sistema de fatiamento (AXNÈR, 1998; AXNÈR e LINDE-FORSBERG, 2002; TIRARELLI et al., 2004). 2.2.1.5. Lavagem da bexiga urinária Pode-se também fazer a recuperação de espermatozóides da bexiga determinando a produção espermática do animal, já que os gatos apresentam entre 15 e 90% de ejaculação de forma retrógrada (STORNELLI e STORNELLI, 2001). Uma alternativa, ainda em estudo no gato doméstico, ao uso da EEJ é o uso de cateter uretral associado à contenção farmacológica com medetomidina sem uso de qualquer estímulo ejaculatório (ZAMBELLI, et al., 2007 e 2008). O contato das células espermáticas com a urina ácida deve ser considerado a depender do destino do sêmen a ser coletado. 2.2.2. Características Seminais A avaliação do sêmen em gatos é normalmente superficial devido à dificuldade de obtenção do sêmen e de seu baixo volume (JOHNSTON et al., 2001). Apesar do volume do ejaculado obtido por EEJ ser maior (média de 0,22 mL) quando comparado à coleta por vagina artificial (média de 0,04 mL), a concentração espermática média obtida é de 1,68 x 108/ mL por EEJ e de 1,73 x 109/ mL por vagina artificial, o que dificulta o fracionamento do ejaculado quando este é coletado pelo primeiro método (AXNÈR e LINDE-FORSBERG, 2002). Portanto, o aumento da secreção de glândulas acessória é acompanhado do decréscimo da concentração espermática (PLATZ et al., 1978). Os valores de concentração espermática relatados na literatura são de 9 a 198,88 x 106 sptz/mL (PLATZ et al., 1978; ZAMBELLI et al., 2006) e de 867 x 106 sptz/mL (SILVA et al., 2004b) para coleta de sêmen por EEJ em gatos domésticos e de até 1730 x 106 sptz/mL por vagina artificial (SOJKA et al., 1970). Redução no volume do ejaculado por EEJ é observado com uso da atropina na pré-anestesia (MARTIN, 1978), e o aumento do volume pode ser observado com a repetição das coletas (PINEDA et al., 1984), ou contrariamente, a repetição pode causar redução no volume (AXNÈR et al., 1997). Alguns autores não incluem o volume do ejaculado na estatística, já que o método pode afetá-lo (AXNÈR et al., 1997). O volume do ejaculado é um dado bastante variável entre autores, protocolos de coleta e anestesia, encontrando-se valores de 42,5 μL para isoflurano (SILVA et al., 2004b) a 738 μL no uso da cetamina isolada (PLATZ et al., 1978). A motilidade e o vigor espermáticos são parâmetros muito variáveis em relação ao tempo de abstinência sexual (AXNÈR e LINDE-FORSBERG, 2002) e entre métodos de coleta. Após EEJ, são descritos valores de 47 a 55,7% (PLATZ et al., 1978; AXNÈR et al., 1997) de 70 a 91% (SILVA et al., 2004b; LEITE et al., 2006; TEBET et al., 2006; ZAMBELLI et al., 2006) com grande variação entre os animais. Já o vigor espermático médio, em geral, é descrito com valores de 3 a 5 (PLATZ et al., 1978; AXNÈR et al., 1997; SILVA et al., 2004b; LEITE et al., 2006; TEBET et al., 2006; ZAMBELLI et al., 2006). Com vagina artificial, relata-se de 75 a 92% de motilidade (TANAKA et al., 2000a). O sêmen coletado por EEJ apresenta pH mais elevado do que o coletado por vagina artificial, provavelmente devido à maior estimulação da próstata, cujo conteúdo é mais alcalino (DOOLEY e PINEDA, 1986). O pH varia de 6 a 9 (AXNÈR E LINDEFORSBERG, 2002; LUVONI et al., 2003). Pode-se conseguir uma melhor qualidade com relação à morfologia e motilidade do ejaculado quando uma segunda EEJ também composta de 3 séries é procedida dentro do mesmo período anestésico após um curto intervalo (AXNÈR et al., 1997). Relatos comprovam que a EEJ altera a osmolaridade do sêmen (DOOLEY e PINEDA, 1986), O sêmen felino apresenta osmolaridade em torno de 290 a 320 mOsmol/L (AXNÈR e LINDE-FORSBERG, 2002; LUVONI et al, 2003). O percentual médio de alterações morfológicas observado é de <2 a 59,1% encontrado após para EEJ em gatos domésticos (PLATZ et al., 1978; AXNÈR et al., 1997). Gatos com percentual de alterações morfológicas de 40% são considerados normospérmicos. Entretanto, gatos com alterações morfológicas acima deste patamar podem ainda possuir boa fertilidade após monta natural (PUKAZHENTHI et al, 2001; AXNÈR e LINDE-FORSBERG, 2002). Quanto maior a voltagem, maior é a proporção de líquido das glândulas acessórias no ejaculado (DOOLEY e PINEDA, 1986). A diminuição da qualidade e o aumento de alterações morfológicas parecem estar mais vinculadas ao aumento da secreção das glândulas acessórias (AXNÉR et al., 1998), já que o uso da EEJ causa aumento do volume do plasma seminal quando comparado à vagina artificial (PLATZ et al., 1978). Sabe-se que a presença do plasma seminal afeta negativamente a habilidade de fertilização no gato doméstico (LUVONI et al., 2003). 2.2.3. Meios e Métodos de Conservação Seminal O sêmen felino vem sendo conservado segundo o padrão adotado para outras espécies carnívoras, com grande variação nos tipos de protocolos entre os autores. Sabe-se que quando não diluído, o sêmen felino pode ser incubado a 37 °C mantendo boa motilidade por 60 minutos. Este período é prolongado para 140 minutos quando a temperatura é de 23 °C. O sêmen felino pode ser também resfriado a 5 °C ou congelado em vapor de nitrogênio líquido e estocado a –196°C (AXNÈR, 1998; SÁNCHEZ e TSUITSUI, 2002; LUVONI et al., 2003). A 5 °C, o sêmen pode manter-se com boa qualidade por até 14 dias (LUVONI et al., 2003). Os diluidores de sêmen ainda mais empregados são o Tes (NTris- metil 2- ácido sulfônico aminometano) e o Tris (hidroximetil aminometano), isolados, seja adicionado de frutose ou glicose (HAY e GOODROWE, 1993), ou em conjunto (Tris e Tes), constituindo o TesT (AXNÈR, 1998; SÁNCHEZ e TSUITSUI, 2002). Hay e Goodrowe (1993) também utilizaram a lactose com meio diluidor. Sánchez e Tsuitsui (2002) utilizaram Tris adicionado de citrato de sódio e gema de ovo na conservação a 4 °C com boa manutenção de motilidade e vigor (acima de 50%) por até 72 horas. Grande parte dos trabalhos apresenta também diluidores acrescidos de antibióticos como a penicilina e a estreptomicina (AXNÈR, 1998; SÁNCHEZ e TSUITSUI, 2002; LUVONI et al., 2003), a amicacina (TEBET, 2004). A adição do Equex® ao Tris, formando o Tris-Equex®, vem sendo testada. O duodecil sulfato de sódio, presente no Equex®, possue função de detergente biológico (TEBET, 2004). Novos diluidores como o MP-50, composto por rafinose, glicose, lactose, citrato de sódio, e de potássio, EDTA, gema de ovo, leite em pó desnatado, meios de cultivo (Meio Hepes, Meio de Dubelco’s e Meio Eagle’s Modificado), antibiótico (amicacina) e crioprotetores (glicerol e dimetilformamida -TEBET, 2004) também vêem sendo testados. Para o sêmen felino resfriado, o agente crioprotetor mais comumente utilizado é a gema de ovo, embora se afirme que sua adição não aumenta a sobrevivência dos espermatozóides felinos quando conservados à 5°C. A sua ação protetora se deve às lipoproteínas de membrana incluídas na sua fração de baixa densidade, protegendo a célula por interação com a membrana plasmática. A inclusão de monossacarídeos adiciona substrato energético, porém não representa vantagem real na estocagem de espermatozóides felinos (LUVONI et al., 2003). Uma grande importância é atribuída ao ajuste da osmolaridade dos diluidores. Glover e Watson (1985) relataram turgência celular e ruptura de membrana quando submeteram os espermatozóides felinos à solução hiposmótica, tendo sido esta resposta mais danosa que quando células espermáticas felinas foram submetidas à solução hiperosmótica que promoveram enrugamento celular. A presença do plasma seminal também é relatada como danosa à célula espermática, afetando a fertilidade. Assim, é indicada a centrifugação das amostras a baixa rotação (300g) e subseqüente remoção do plasma seminal para prolongar o tempo de vida da célula (LUVONI, 2003; MOREIRA e MORATO, 2007). Nos protocolos de conservação, estes diluidores são em geral adicionados de 20% de gema de ovo (HAY e GOODROWE, 1993) e nos casos de congelação de 3% (HAY e GOODROWE, 1993) a 4% de glicerol (ZAMBELLI et al, 2002). Concentrações de 8% de glicerol são consideradas tóxicas aos espermatozóides felinos (ZAMBELLI et al., 2002). O sêmen felino inicialmente era congelado em pellets (PLATZ e SEAGER., 1978), evoluindo para congelação em frascos (LENGWINANT e BLOTNNER, 1994), até chegar ao protocolo padrão atual de congelação em palhetas (HAY e GOODROWE, 1993; ZAMBELLI et al., 2002, TEBET, 2004). Entretanto, a velocidade de congelação ainda continua sendo alvo de estudos e comparações. Para tentar estabelecer a melhor taxa de congelação, ZAMBELLI (2002) testou as taxas de 3,85; 9; 22,8; 36; 43 °C/ min com descongelação a 37 °C/ 30 segundos, onde a taxa de 3,85 °C/ min foi superior as demais com 61,55% de motilidade pós-descongelação. Após a descongelação, de 25 a 50% da motilidade é mantida em leões (Panthera leo), onças (Panthera onca), leopardo nebuloso (Neofelis nebulosa), chitas (Acinonyx jubatus) e gatos leopardos (Prionailurus bengalensis- GRAHAM et al., 1978 apud SILVA et al., 2004a). Os mesmos autores relatam baixos índices de motilidade após descongelação (1 a 20%) para tigres (Panthera tigris), gato do mato grande (Oncifelis geoffroy), e jaguatirica (Leopardus pardalis). Os espermatozóides do gato dourado africano (Felis aurata) não sobreviveram à criopreservação. Para gatos domésticos, são relatados resultados de motilidade pós-descongelação de: 24% para sêmen epididimário (TSUTSUI et al., 2003); 26% (TSUTSUI et al., 2000), 52,8% (VILLAVERDE, 2007) e 70,6% (PLATZ et al., 1978) para sêmen coletado por vagina artificial; e 70% por eletroejaculação (CHATDARONG et al.,2007). 2.2.3.1. Água de Coco A água proveniente do fruto do coqueiro Cocos nucifera L. (membro da família Palmae) é uma solução estéril, ligeiramente ácida, contendo proteínas, sais, açúcares, vitaminas (Anexo 3), fatores de crescimento (fitormônios) e muito pouco fosfolipídeo (LAGUNA, 1996). A água de coco contém ainda outros compostos que mostram atividades semelhantes àquelas das citocininas e que são derivados das purinas (difeniluréia), possuindo atividades biológicas consideradas excelentes para as células (NUNES e SALGUEIRO, 1999). O isolamento da citocinina na água de coco foi realizado por Letham (1974) apud NUNES e COMBARNOUS (1995) e depois de várias pesquisas, verificou-se que a auxina principal era o ácido 3-indol-acético (LETHAM, 1974 apud NUNES e COMBARNOUS, 1995) que foi então isolada (Nunes e Combarnous, 1995). O ácido 3-indol-acético apresentava uma ação benéfica sobre a motilidade do sêmen de caprinos e ovinos incubado a 37 °C, e já foi empregado no teste de termoresistência em cães (UCHOA et al., 2002). A água de coco sofre mudanças na sua composição durante o desenvolvimento do fruto. Fatores como grau de maturação, variedade, região e época do ano de produção têm influência sobre as suas características físico-químicas (JAYALEKSHMY et al., 1984, MACIEL et al., 1992 - apud MAGALHÃES et al., 2005). Os açúcares, no início da maturação, encontram-se sob a forma de redutores (glicose e frutose), próximo ao 6° e 7° mês, alcançando níveis máximos de 5%. Com a maturação do fruto, a concentração de açúcares redutores diminui em até 1%, porém são formados os não redutores (sacarose), sendo, ao final da maturação, o teor de açúcares totais de, aproximadamente, 2% (CAMPOS et al., 1996; JAYALEKSHMY et al., 1984 apud MAGALHÃES et al., 2005). A água de coco in natura proveniente de frutos com idade de seis meses (variedade verde da praia) apresenta uma osmolaridade em torno de 500 mOsmol/L e um pH de 4,5 a 5,0 (NUNES e COMBARNOUS, 1995). Para uma perfeita compatibilização da água de coco in natura como diluente para o sêmen, deve ser feita uma correção da osmolaridade e pH. Para tal correção, após filtrar a água de coco, adiciona-se água destilada e uma solução de citrato de sódio a 5% (NUNES, 1995). Em carnívoros, esta solução contendo 20% de gema de ovo e 6% de glicerol já foi utilizada com eficiência na congelação de sêmen canino (CARDOSO, 2001). Apesar da água de coco ser um diluente eficiente na conservação do sêmen de diversas espécies, é necessário preparar a solução para cada utilização. Acima de dois dias, a água de coco apresenta um aumento de osmolaridade e diminuição do pH (dados não publicados), não estando dentro dos padrões fisiológicos para o uso adicionado ao sêmen das mais diversas espécies. A fim de solucionar os problemas relacionados à estocagem e impulsionado pelos excelentes resultados obtidos com os primeiros estudos com a água de coco in natura na conservação, principalmente, de células espermáticas, levou-se à elaboração, o meio de conservação à base de água de coco em pó (ACP®), sendo este um produto genuinamente nordestino. O coco é obtido numa seqüência de procedimentos iniciada pela rigorosa seleção e higienização do produto, seguida de colheita da água de coco de forma asséptica. Então, é realizada a filtração e o líquido é bombeado de forma contínua para o sistema de secagem, denominado de spray dryer. A amostra seca é transformada em pó fino e uniforme, amorfo, destituído de água livre, com alta solubilidade (NUNES et al., 2005). A uniformidade do produto, obtida mediante rigoroso controle de processamento, em condições específicas, leva à manutenção dos valores agregados do endosperma líquido do coco (NUNES et al., 2005). O pó resultante final, registrado como ACP® (ACP Biotecnologia®, Fortaleza - Ceará, Brasil), é ajustado quanto ao pH e osmolaridade a cada espécie a ser utilizado, recebendo uma denominação numérica de acordo com a espécie e sua utilização, que para o uso como diluidor de sêmen de felinos é o ACP-117®. Assim, para felinos ele é formulado com pH e osmolaridade de aproximadamente 310 mOsm/L e 8,2 respectivamente. Ele deve ser reconstituido em água destilada, segundo as recomendações do fabricante. O ACP® foi testado com diferentes aplicações para o sêmen de diversas espécies, como: em eqüinos para a refrigeração (SAMPAIO-NETO et al., 2002), diluição para inseminação artificial em caprinos caprinos (SALGUEIRO et al., 2002), e ovinos (BRAZ et al., 2003), e também em peixes (VIEIRA et al., 2007). Em cães, para congelação com variações nos protocolos (CARDOSO, 2005; BARBOSA, 2007; MADEIRA, 2007), resfriamento a 4°C (MADEIRA et al., 2004; CARDOSO, 2006) e na inseminação artificial com sêmen a fresco (UCHOA et al., 2004) e refrigerado (UCHOA et al., 2007). Apesar dos resultados já obtidos para criopreservação de sêmen de cães pela Equipe do Laboratório de Reprodução de Carnívoros da Universidade Estadual do Ceará por Cardoso (2005) e de sua utilização em várias espécies, para gatos domésticos, o ACP® ainda não havia sido utilizado. 2.2.4. Inseminação Artificial Na década de 70 surgiram os primeiros relatos de coleta e conservação de sêmen de gatos domésticos (PLATZ e SEAGER, 1978) e de inseminação artificial (SOJKA, et al., 1970; PLATZ et al., 1978). Desde então, a tecnologia de sêmen vem ganhando espaço cada vez mais crescente nos estudos de reprodução. A IA é utilizada principalmente nos casos de problemas em acasalamentos naturais por não aceitação do macho pela fêmea, ou o inverso, limitações físicas ou, em animais selvagens, pela agressividade natural da espécie (LUVONI et al, 2003). Esta técnica evita o contato entre os animais, diminuindo o risco de transmissão de doenças sexualmente transmissíveis ou infecto-contagiosas, como vírus da imunodeficiência felina (FIV), leucemia felina (FeLV), coronavirose, clamidiose, calicivirose, entre outros (STRÖMHOLST, 2002), inclusive a brucelose (Brucella canis) já identificada sorologicamente em felinos domésticos (LARSSON et al., 1984). Até os dias atuais, a coleta de sêmen de felídeos já foi realizada em pelo menos 28 espécies (HOWARD et al., 1984), e a utilização da inseminação artificial a partir de diferentes formas de coleta e conservação e vias de inseminação já foi realizada em chitas (Acinonyx jubatus- HOWARD et al., 1992), na pantera nebulosa (Neofelis nebulosa- HOWARD et al., 1996), tigres (Phantera tigris- DONOGHUE et al., 1992), gatos leopardo (Prionailurus bengalensis- WILDT et al., 1992), pumas (Puma concolor- BARONE et al., 1994), jaguatirica (Leopardus pardalis- SWANSON et al., 1996), leopardo das neves (Uncia uncia- ROTH et al., 1997) e em gatos domésticos (TSUTSUI et al., 2000a; TSUTSUI et al., 2000b; TSUTSUI et al., 2001; VILLAVERDE, 2007; CHATDARONG et al., 2007). Entretanto um maior desenvolvimento desta técnica está na dependência dos métodos de coleta e conservação seminal. As inseminações artificias são na maior parte realizadas com sêmen a fresco, muitas vezes, diluído em solução salina fisiológica (SANCHEZ e TSUTSUI, 2002) e em poucos relatos com sêmen congelado. Por via intravaginal com sêmen a fresco, SOJKA et al. (1970) obtiveram 50% de taxa de concepção, contra 78% de TANAKA et al. (2000b) e 10% de PLATZ et al. (1978), neste último caso com sêmen congelado. Por via intrauterina, foi obtida uma taxa de 50% de concepção por HOWARD et al. (1992) e 80% por TSUTSUI et al. (2000a). Uma taxa de 57 % de concepção foi alcançada com sêmen congelado via intrauterina por TSUTSUI et al. (2000b). Também é relatada concepção em gatas domésticas com inseminação artificial por via laparoscópica injetando-se o sêmen diretamente no corno uterino (MATTOS et al, comunicação pessoal). A IA pode ser realizada com a fêmea em estro natural ou induzido por hormônios como o FSH (homonio folículo estimulante) ou eCG (gonadotrofina coriônica equina). Para ambos os casos, estro natural ou induzido, faz-se uso de hCG (gonadotrofina coriônica humana) para indução de ovulação, já que nesta espécie a ovulação é induzida pela cópula (ZAMBELLI e MARCO, 2005). Mas apesar da gata doméstica ser de ovulação induzida, há relatos que comprovaram a ocorrência de ovulação sem estímulo coital nesta espécie (LAWLER et al., 1993; GUDERMUTH et al., 1997; MADEIRA et al., 2002). Ovulações na ausência de cobertura freqüentemente ocorrem em fêmeas de gatas domésticas criadas em grupo (POPE, 2000). A ovulação pode ser induzida também de forma artificial durante a manipulação vaginal, como na inseminação artificial e na colpocitologia (SCHMIDT, 1986; VERSTEGEN, 1998; POPE, 2000). No caso de estímulo artificial com o intuito de cessar a manifestação estral, a indução pode ser realizada com o auxílio de um swab introduzido cuidadosamente na vagina (FELDMAN e NELSON, 1996). Para determinar o momento adequado da IA, assim como da cobertura, os sinais de comportamento sexual necessitam ser observados para caracterização do momento ideal. Os sinais de estro observados são: vocalização, lateralização de cauda, patinar de patas posteriores, rolamento, secreção vaginal , tremor de corpo e cauda, permissão da fixação pela mordedura da nuca e penetração peniana, momento este no qual a fêmea exarceba a patinação das patas e lateralização da cauda (SILVA et al., 2006). O estro comportamental pode não ser observado (cio silencioso). Casos de estro silenciosos nesta fase podem ocorrer (SCHMIDT, 1986), onde sinais de proestro e estro não são exibidos, porém características do epitélio vaginal e a permissão da cópula evidenciam a fase estral (ROOT et al., 1995). A inseminação artifcial na espécie felina pode ser realizada pelas vias intravaginal e intra-uterina (cirúrgica e não cirúrgica): a) Intravaginal: por deposição do sêmen na vagina com uma agulha 20G longa de 9 cm contendo um bulbo e acoplado a uma seringa de 0,25mL (SOJKA et al., 1978) ou uma sonda de nylon de 9 cm x 1,5 mm de diâmetro conectada a uma seringa de 1mL (TANAKA et al., 2000b). É também recomendada nesta espécie a elevação do trem posterior por 15 a 20 minutos após a inseminação a fim de minimizar o refluxo seminal. b) Intauterina cirúrgica: por deposição do sêmen no lumen do corno uterino atavés de laparotomia (TSUTSUI et al., 2000ab) ou laparoscopia (HOWARD et al, 1992; MATTOS et al., 2002 - comunicação pessoal). Na laparotomia o corno uterino é exposto para injeção de sêmen por um catéter endovenoso de 20G acoplado a uma seringa de 1mL. Para a laparoscopia, os cornos são aproximados a região ventral do animal e a injeção pode ser realizada de forma percutânea. Tsutsui et al., em 2001, através de sêmen fresco, realizaram a inseminação intratubárica bilateral a aproximadamente 2 cm das fímbrias ovarianas. c) Intrauterina não cirúrgica: por deposição do sêmen no corpo do útero de forma transcervical usando uma sonda urinária modificada proposta por CHATDARONG et al. (2001) ou por uma adaptação também de uma sonda urinária, acoplando-se uma seringa de ponta romba de 0,65 mm de diâmetro por 30 mm de comprimento na extremidade da sonda e injetando-se o sêmen aproximadamente a 2 cm cranial a cérvix, proposto com sucesso por ZAMBELLI et al. (2001). Em relação ao suceso da IA nas diferentes vias e pelos diferente tipos de sêmen utilizado, o Quadro 1 traz uma compilação de dados dos da literatura, demonstrando o percentual de gestação nos casos obtidos. Quadro 1: Protocolos de inseminação artificial em gatas domésticas. Tipo de estro Método de Tipo de Taxa de Autor inseminação sêmen Concepção Induzido Laparoscopia Fresco 34,4% HOWARD et al, 1992 (eCG) (intrauterino) Natural Laparotomia Fresco 80,0% TSUTSUI et al, 2000a Congelado 57,1% TSUTSUI et al, 2000b (intrauterino) Natural Laparotomia (intrauterino) Natural Intravaginal Fresco 42,9% SOJKA et al., 1978 Natural Intravaginal Fresco 77,8% TANAKA et al., 2000b Induzido Intravaginal Congelado 10,6% PLATZ et al., 1978 Natural Intratubárica Fresco 42,9% TSUTSUI et al, 2001 -------- Laparotomia Congelado 27,3% TSUTSUI et al.,2003 (intrauterino) Epididimário Transcervical Fresco/ 75 e 100% ZAMBELLI et al., 2001 (FSH) Induzido Congelado Intravaginal Congelado 0% VILLAVERDE, 2007 Induzido Laparotomia Congelado 75% VILLAVERDE, 2007 (eCG) (intrauterino) Natural Intravaginal Fresco 33,3% CHATDARONG et al., 2007 Natural Transcervical Congelado 41,7% CHATDARONG et al., 2007 Natural Intravaginal Congelado 0% CHATDARONG et al., 2007 Induzido (eCG) FONTE: ZAMBELLI e MARCO, 2005-modificado. 3. JUSTIFICATIVA Nos Estados Unidos, na década de 70, segundo FRANTI et al. (1974), já havia relatos da existência de animais de estimação, a maioria cães e gatos, em até 77% das residências das áreas investigadas. O Brasil é o segundo país do mundo com maior população de animais domésticos, só perdendo para os Estados Unidos. Em 2004, eram 27,9 milhões de cães, 12 milhões de gatos e 4 milhões de outros pets, com uma relação de um cão para cada seis habitantes e um gato para cada 16 habitantes. Em 2005, eram 29 milhões de cães e 13 milhões de gatos. Dados do Instituto Brasileiro de Geografia e Estatística (IBGE) apontam que nos últimos quatro anos houve um aumento de 17,6% no número de cães e gatos no Brasil. Segundo estimativas do Instituto Brasileiro de Opinião Pública e Estatísitica (IBOPE), cerca de 59% dos domicílios possuem algum animal de estimação, sendo que em 44% deles há pelo menos um cachorro e em 16% pelo menos um gato. Conforme a mesma fonte, 63% das famílias das classes A e B possuem animais de companhia. Já na classe C, este número é de 64%, e na classe D este percentual cai para 55% (PARRA, 2007). No Nordeste, existem poucos dados sobre a população felina, destacando-se um estudo na cidade de Recife-PE que demonstrou que os gatos são criados em 20% dos domicílios (LIMA JÚNIOR, 1999). Percebe-se atualmente uma demanda cada vez mais crescente dos criadores comerciais de gatos domésticos pelas biotécnicas da reprodução, principalmente envolvendo problemas de acasalamento natural. Entretanto, um dos maiores entraves para a difusão destas práticas, são os protocolos de coleta e conservação de sêmen felino. A conservação de sêmen, seja por resfriamento ou por congelação, viabiliza o seu transporte com manutenção da qualidade seminal, facilitando significativamente a criação comercial. Além disto, o desenvolvimento de protocolos de coleta e conservação de sêmen utilizando o gato doméstico como modelo experimental, visa sua a utilização em programas de conservação de espécies felídeas ameaçadas de extinção. Para felídeos selvagens é importante que existam biotécnicas que simplifiquem a troca de material gênico, possibilitando rápido crescimento populacional e, principalmente, propiciando a formação de bancos de gametas e embriões nos quais este material genético é resguardado. A tecnologia de sêmen permite também a reprodução de animais com deficiências reprodutivas, físicas ou comportamentais quando os animais envolvidos representam linhas genéticas que não podem ser perdidas (MORATO e BARNABE, 1998). Como o ACP® vem sendo utilizado com sucesso para conservação de sêmen em diferentes espécies (SALGUEIRO et al., 2002; SAMPAIO-NETO et al., 2002; BRAZ et al., 2003; BARBOSA, 2007; MADEIRA, 2007; VIEIRA et al., 2007), este diluidor pode constituir-se em uma boa alternativa para conservação de sêmen de gatos domésticos. Além disto, o aperfeiçoamento dos protocolos de coleta (vagina artificial ou EEJ) e informações sobre a qualidade seminal de gatos domésticos mantidos sobre fotoperíodo equatorial são necessárias para a melhor compreensão da fisiologia reprodutiva dos animais de zonas equatoriais e aplicação de biotécnicas. 4. OBJETIVOS 4.1. Objetivo Geral Avaliar a andrológia, os métodos de coleta e a tecnologia do sêmen de gatos domésticos utilizando água de coco em pó (ACP®-117). 4.2. Objetivos Específicos • Avaliar a analgesia e segurança da anestesia empregada na eletroejaculação; • Avaliar protocolos de anestesia empregada na coleta de sêmen por eletroejaculação;. • Determinar possíveis relações entre a biometria da genitália externa e os parâmetros seminais de gatos domésticos; • Avaliar o efeito in vitro e in vivo sobre a qualidade espermática da diluição do sêmen felino diluído em ACP117®. • Avaliar in vitro o efeito sobre a qualidade espermática da congelação e descongelação do sêmen felino diluído em ACP117®. 5. EXPERIMENTOS REALIZADOS 5.1. Capítulo 1: Artigo enviado para publicação na Revista Ciência Animal Brasileira Avaliação de quatro protocolos anestésicos para eletroejaculação em gatos domésticos (Felis catus) [Evaluation of four anesthetics protocols for electroejaculation in domestic cats (Felis catus)] Ticiana Franco Pereira da Silva1*, Carlos Gabriel Almeida Dias1, Janaína de Fátima Saraiva Cardoso1, Daniel Couto Uchoa1, Ana Cristina Paulino Braga2, Camila Louise Ackermann1, Francisco Tiago Silva Pinheiro1, Daniel Falcão Menezes Brilhante1, Raimundo Diones Carneiro1, Leonardo Tavernezi1, Henna Roberta Quinto1, Lúcia Daniel Machado da Silva1 1 Laboratório de Reprodução de Carnívoros-FAVET, PPGCV, UECE , Av. Paranjana, 1700, Cep 60740-903, Fortaleza, CE, Brasil, Fone: (85) 31019860; Fax: (85)31019840 2 Médica Veterinária Autônoma e-mail: * [email protected] Resumo O objetivo deste trabalho foi avaliar a segurança e analgesia dos protocolos anestésicos usualmente empregados para eletroejaculação (EEJ) de gatos domésticos. Quatorze gatos foram anestesiados com 4 protocolos e submetidos a 3 séries de choques elétricos (2-6 mA). Os parâmetros de freqüência cardíaca, respiratória, temperatura, sensibilidade dolorosa e reflexo palpebral foram aferidos antes e após a indução da anestesia e durante e após a eletroejaculação. O protocolo de anestesia com isoflurano foi o que melhor promoveu analgesia, segurança e rapidez na recuperação para EEJ em gatos domésticos. Palavras-chave: Eletroejaculação, gato, anestesia. Abstract The objective of this study was to evaluate the security and analgesia of anesthetics protocols usually used for electroejaculation (EEJ) in domestic cats. Fourteen toms were anesthetized with 4 protocols and submitted to a 3 series of electric stimuli (2-6 mA). The heart rate, respiratory rate, temperature, pain sensibility and eyes blink were analyzed prior and after induction, and during and after electroejaculation. The anesthesia protocol that used isoflurane was the best for analgesic parameters, security and speed of recuperation for electroejaculation in domestic cats. Key Words: Electroejacutation, cat, anesthesia. Introdução A eletroejaculação (EEJ) foi desenvolvida em 1936 para ovinos, mas teve uso científico relatado para gatos domésticos somente na década de 70 (PLATZ e SEAGER, 1978; MIES FILHO, 1982), sendo considerado o método de eleição para obtenção de sêmen felino, especialmente para felídeos silvestres, já que permite o manuseio do animal vivo (MORAIS et al., 2002). Este método possibilita análises andrológicas em animais de alto valor genético ou animais silvestres que não permitem avaliação sem anestesia devido à sua agressividade ou por não serem treinados para ejaculação em vagina artificial (MORATO e BARNABE, 1998) e baseia-se na indução do reflexo ejaculador através de estímulos elétricos, com a introdução de uma sonda trans-retal conectada a um estimulador elétrico, no assoalho da ampola retal do animal (SILVA et al., 2004a). Diferentes protocolos de estímulos elétricos já foram desenvolvidos, porém os mais utilizados são o método de Wildt et al. (1983), inicialmente descrito para chitas, e o de Howard et al. (1984), descrito para 28 espécies de felídeos. Os dois métodos são utilizados para gato doméstico e, em ambos os casos, após anestesia são aplicados 80 estímulos elétricos divididos em três séries, fornecendo-se de 2 a 6V. A EEJ é considerada pela maior parte dos autores um procedimento simples, rápido e prático (PLATZ e SEAGER, 1978; MORAIS et al., 2002; MORATO et al., 2002). Embora os primeiros estudos em felinos silvestres tenham sido realizados somente com a contenção física sem auxílio de anestesia (CARVALHO, 1968; MIES FILHO et al., 1974), aos moldes do realizado para animais de produção, a EEJ em felinos, seja em domésticos ou silvestres, necessita da aplicação de anestésicos para contenção do animal, evitando riscos à equipe, mas implicando ao animal os riscos envolvidos no procedimento anestésico. Dentre os protocolos anestésicos mais utilizados para EEJ em gatos domésticos e felídeos silvestres encontram-se o uso de cloridrato de cetamina (PLATZ e SEAGER, 1978) e as associações de cloridrato de cetamina e xilazina (MORAIS et al., 2002) e tiletamina e zolazepam (MORAIS et al., 2002; MORATO et al., 2002; TEBET et al., 2006). Outros fármacos utilizados isoladamente ou em associações também já foram utilizadas com este propósito para gatos domésticos, tais como: tiletamina, zolazepam e morfina; tiletamina, zolazepam, butorfanol e acepromazina (TEBET et al., 2006); cetamina e medetomidina (AXNÉR et al., 1998; ZAMBELLI et al., 2007); propofol (CHATDARONG et al., 2006); propofol e buprenofina (CHATDARONG et al., 2006); indução anestésica com propofol e anestesia epidural com lidocaína (LEITE et al., 2006) ou anestesia inalatória com indução anestésica à base cetamina, diazepam, tiopental sódico e manutenção anestésica com isoflurano (SILVA et al., 2004b). Além do variável número de combinações farmacológicas, observam-se também variações de doses entre autores. O uso de diferentes associações em diferentes doses torna difícil a comparação da eficiência entre os protocolos mais utilizados, bem como dos efeitos fisiológicos causados pelas combinações farmacológicas utilizadas. Após constatar-se que há grande variedade nos protocolos anestésicos utilizados para EEJ em gatos domésticos, o objetivo deste trabalho foi avaliar quatro diferentes associações anestésicas, em relação à manutenção dos parâmetros fisiológicos promovendo analgesia, segurança e rapidez de recuperação para EEJ em gatos domésticos. Material e Métodos 1. Animais Foram previamente selecionados para a etapa 1 do experimento 14 gatos machos púberes sem raça definida (SRD), com peso entre 3 e 5 Kg, provenientes do gatil experimental da Universidade Estadual do Ceará (3º 44’ de latitude Sul e 38° 34’ de longitude Oeste), submetidos a 12 horas diárias de luz natural. Os animais foram mantidos em gaiolas individuais e alimentados com ração comercial de manutenção para gatos (Kitekat®- Éffem®, Brasil), recebendo água potável à vontade. 2. Protocolos anestésicos Etapa 1: Os mesmos animais foram submetidos a uma coleta por EEJ para cada protocolo anestésico testado, respeitando-se intervalo mínimo de 15 dias entre cada coleta do mesmo animal. Os animais foram previamente submetidos a jejum alimentar de 24h e hídrico de 12h e, após serem pesados, foram contidos farmacologicamente com associações de cloridrato de cetamina e xilazina (protocolo A); cloridrato de tiletamina e zolazepam (protocolo B); de cloridrato de tiletamina e zolazepam tramadol (protocolo C); ou indução da anestesia com cloridarato de cetamina e diazepam, e manutenção com isoflurano (protocolo D). Quando necessário, após a indução anestésica e antes da intubação, os animais eram submetidos à máscara com isoflurano dissolvido em oxigênio medicinal. Para a intubação foi utilizada lidocaína spray a 10% para dessensibilização da laringe, cânulas de 4 ou 4,5 mm de diâmetro interno, e circuito semi-aberto de Baraka, conectados a um vaporizador universal. Após a perda do reflexo de endireitamento postural, uma veia foi canulada para administração de soro fisiológico 0,9% (NaCl), permitindo a reposição do anestésico por via intravenosa na velocidade de 22 gotas/min até o erguimento espontâneo da cabeça e tentativa por parte do animal de levantar-se. Tabela 1: Descrição do número de animais, fármacos, doses e via de administração dos protocolos anestésicos utilizados. Protocolo N° Fármacos animais A B 13 13 Via de Dose administração cloridrato de cetamina1 IM 15 mg/kg cloridrato de xilazina2 IM 1 mg/kg cloridrato de tiletamina e IM 15 mg/kg IM 15 mg/kg cloridrato de tramadol4 IM 2 mg/kg cloridrato de cetamina1 IM 15 mg/kg diazepam5 IM 1mg/Kg isoflurano6 inalatória - zolazepam3 C 13 cloridrato de tiletamina e 3 zolazepam D 14 IM= intramuscular 1 Dopalen®,Vetbrands®, Brasil 2 Anasedan®, Vetbrands®, Brasil 3 Zoletil®, Virbac, Brasil e Telazol®, Fort Dodge Saúde Animal Ltda ®, Brasil 4 Sylador®, Sanofi Synthelabo Ltda®, Brasil 5 Compaz®, Cristália®, Brasil 6 Isoforine®, Cristália®, Brasil As freqüência cardíaca (bpm) e respiratória (mrm), a temperatura retal (°C), a sensibilidade dolorosa e o reflexo palpebral foram aferidos antes da anestesia, após 10 minutos da aplicação de todos os fármacos, durante as séries de choques elétricos, em cada intevalo de série de choques e aos 5, 10, 30 e 60 minutos após o término da última série de choques. Em todos os procedimentos anestésicos os animais foram acompanhados quanto aos parâmetros fisiológicos citados até a tentativa espontânea de erguer a cabeça e manter-se na posição de estação. A sensibilidade dolorosa foi avaliada através da avaliação de parâmetros como reflexo de retração ao pinçamento interdigital dos membros anteriores ou posteriores; vocalização perceptível na caixa torácica ao momento da auscultação ou vocalização audível sem auxílio de aparelhos.A entrada em plano anestésico era considerada quando o animal não mais apresentava sensibilidade dolorosa. A qualquer momento da EEJ no qual o plano anestésico não fosse mantido a suplementação da anestesia era realizada por via intravenosa (IV) com metade da dose inicial calculada, até obtenção do plano anestésico ideal. Para o protocolo C somente a combinação tiletamina e zolazepam foi complementada. Os protocolos anestésicos utlizados em cada animal foram distribuídos de forma aleatória, não havendo uma seqüência pré-definida. Etapa 2: Nesta etapa foram utilizados 4 gatos adultos, dos quais 1 já havia participado da etapa 1. Foi procedido 1 protocolo anestésico anteriormente descrito por animal (protocolo A, n = 1; B, n = 1; C, n = 1; D, n =1). Realizou-se monitoração contínua da saturação funcional de oxigênio (SpO2) utilizando oxímetro de pulso digital, através de sensor localizado na língua do animal nos momentos após a anestesia antes dos choques elétricos, durante, nos intervalos e após os choques elétricos. O equipamento facilitou o monitoramento da freqüência cardíaca e permitiu a visualização da representação gráfica de ondas pletismográficas com derivação DII (Oxifast 9504®, Takaoka®), permitindo um melhor acompanhamento de possíveis alterações cardíacas e respiratórias ao longo da EEJ. 3. Coleta do sêmen Para a obtenção do sêmen foi utilizado um eletroejaculador portátil (Eletrojet®Electrovet®-Brasil), acoplado a uma sonda trans-retal (13 x 1 cm) com os eletrodos voltados para o assoalho da ampola retal, previamente lubrificado com gel inócuo à base de um polímero carboxivinílico. Após a entrada em plano anestésico, o reto foi limpo de bolos fecais e a sonda introduzida cerca de 5 a 7 cm no reto dos animais, e então foram aplicados 80 estímulos elétricos divididos em 3 séries. Na primeira série, 10 estímulos sucessivos de 20, 30 e 40 mA. Na segunda, 10 estímulos de 30, 40 e 50 mA e na terceira, estímulos de 50 e 60 mA. Cada estímulo elétrico durou entre 2 e 3 segundos, e entre cada série, foi realizado um intervalo de 5 minutos. 3. Análise Estatística Os parâmetros fisiológicos das freqüência cardíaca, respiratória e temperatura retal antes, após anestesia até 60 min pós-EEJ foram expressos na forma de média ± erro padrão. O reflexo palpebral e a sensiblidade dolorosa foram descritos subjetivamente. Os parâmetros freqüência cardíaca, respiratória e temperatura retal após anestesia até 60 min pós-EEJ foram comparados entre os protocolos por ANOVA, seguido de teste de Fisher PLSD. Para todos os parâmetros, considerou-se p<0,05 (Stat View for Windows®, SAS Institute Inc., Versão 5.0, 1998). Resultados e Discussão Considerando-se que o gato doméstico é modelo experimental para desenvolvimento de protocolos de conservação de sêmen a serem utilizados em programas de conservação de espécies felídeas ameaçadas de extinção, optou-se por 4 protocolos anestésicos que permitissem administração inicial por via IM. Os parâmetros fisiológicos de freqüência cardíaca, respiratória e temperatura não puderam ser aferidos em todos os animais. Por características próprias da espécie, alguns animais apresentavam-se inquietos e agressivos após o deslocamento do gatil ao laboratório, não permintindo a manipulação para aferição de temperatura e auscultação cardiorespiratória; ou ainda no sentido inverso, ronronando e não permitindo a aferição cardíaca. Em alguns casos, nos quais as aferições foram possíveis, o estresse também alterou sensivelmente a freqüência respiratória, já que a frequência respiratória normal do gato não submetido à anestesia é de 20 a 30 mrm (KELLY, 1986). Assim, as comparações estatísticas dos parâmetros fisiológicos só foram realizadas a partir de 10 min após de anestesia. Os resultados obtidos após a anestesia e durante a EEJ para freqüência cardíaca e respiratória e temperatura retal encontram-se descritos na Tabelas 2, 3 e 4 respectivamente. Após 60 min do final da EEJ, em todos os protocolos testados, os valores de temperatura encontravam-se em limites aceitáveis para gatos que foram submetidos a procedimentos anestésicos, não denotando significado clínico relevante, haja vista que a diminuição de temperatura é esperada com o uso das associações de cetamina e xilazina e tiletamina e zolpazepam (SANTOS et al., 2004). Segundo ERDMANN (2005) os valores de temperatura obtidos no presente trabalho durante a EEJ encontram-se dentro do limite de segurança para felídeos. O reflexo palpebral esteve presente ao longo de toda anestesia nos protocolos B e C, todavia, no protocolo A, observou-se diminuição deste reflexo em 1 animal e ausência antes da EEJ em outro animal, que foi recuperado após o início da EEJ. No protocolo D o reflexo palpebral alternou ausência e presença ao longo da EEJ em 13 dos 14 animais testados. Considerando-se que a manutenção do reflexo palpebral é desejada nas anestesias dissociativas e se constitui em um bom indicativo do não aprofundamento indesejado da anestesia, as observações no protocolo D com presença de reflexo indicam que o plano anestésico não estava sendo alcançado satisfatoriamente ao longo de toda a EEJ (ANDRADE et al., 2002). Tabela 2: Freqüência cardíaca (média ± erro padrão) de gatos submetidos à eletroejaculação após anestesia com 4 diferentes protocolos. Tempos de avaliação Antes da Anestesia 10 min após 1ª série 1° Intervalo 2ª série 2° Intervalo 3ª série 5 min após EEJ 10 min após EEJ 30 min após EEJ 60 min após EEJ A (bpm) Protocolos anestésicos C B (bpm) (bpm) D (bpm) (n=13) (n=13) (n=13) (n=14) 193,00 ± 11,52 142,00 ± 5,59a 153,45 ± 6,11a 138,18 ± 5,77a 161,45 ± 4,95ad 137,45 ± 7,52a 173,82 ± 9,21a 137,45 ± 6,48a 138,00 ± 7,30a 134,73 ± 5,29a 124,73 ± 9,10a 171,00 ± 13,64 167,00 ± 8,73ac 187,11± 9,77b 192,00 ± 15,49b 179,11 ± 10,30ac 185,33 ± 12,45bc 182,22 ± 6,54a 180,00 ± 11,33b 195,08 ± 7,40b 192,44 ± 10,10bc 217,78 ± 15,80b 165,60 ± 16,47 174,00 ± 10,42cb 200,00 ± 6,70b 191,56 ± 11,02b 194,22 ± 6,70bc 200,00 ± 16,30b 172,00 ± 15,52a 187,11 ± 13,85b 180,62 ± 11,93b 194,78 ± 9,56b 199,11 ± 9,47b 169,00 ± 14,27 155,00 ± 14,84ac 127,83 ± 20,60a 138,33 ± 22,68a 133,17 ± 22,90d 149,83 ± 24,53ac 148,17 ± 25,69a 126,83 ± 20,62a 151,36 ± 11,89a 126,83 ± 18,53ac 146,67 ± 6,98a A: protocolo de anestesia dissociativa de cetamina + xilazina; B: protocolo de anestesia dissociativa tiletamina + zolazepam; C: protocolo de anestesia dissociativa tiletamina + zolazepam + tramadol; D: protocolo de anestesia inalatória (indução com cetamina + diazepam e manutenção com isoflurano); a,b,c,d- letras diferentes representam diferenças entre colunas; (P<0,05) Tabela 3: Freqüência respiratória (média ± erro padrão) de gatos submetidos à eletroejaculação após anestesia com 4 diferentes protocolos. Tempos de avaliação Antes da Anestesia 10 min após 1ª série 1° Intervalo 2ª série 2° Intervalo 3ª série 5 min após EEJ 10 min após EEJ 30 min após EEJ 60 min após EEJ A (mrm) Protocolos anestésicos C B (mrm) (mrm) D (mrm) (n=13) (n=13) (n=13) (n=14) 71,20 ± 5,57 18,14 ± 4,11a 24,29 ± 2,63a 15,43 ± 1,84ad 24,00 ± 2,31a 16,57 ± 1,62ac 21,86 ± 1,46a 18,43 ± 1,38ac 21,14 ± 1,44ab 25,71 ± 2,74a 30,29 ± 4,85a 50,40 ± 6,00 22,00 ± 1,71a 22,67 ± 1,98a 23,33 ± 1,23bc 23,33 ± 1,61a 24,67 ± 1,91b 24,67 ± 1,91a 26,00 ± 2,25bd 26,67 ± 2,23a 28,00 ± 2,73a 40,00 ± 5,56a 67,33 ± 9,43 15,33 ± 1,41a 22,44 ± 1,99a 18,78 ± 1,10cd 22,89 ± 1,21a 20,44 ± 1,94cb 22,78 ± 0,94a 22,11 ± 1,67cd 24,00 ± 2,00ab 23,33 ± 3,02a 29,89 ± 4,90a 52,75 ± 5,22 20,56, ± 9,69a 8,44 ± 2,62b 12,44 ± 2,71a 9,56 ± 3,58b 10,78 ± 2,90a 12,11 ± 4,04b 17,89 ± 2,37c 19,67 ± 2,19b 20,22 ± 1,94a 32,78 ± 9,82a A: protocolo de anestesia dissociativa de cetamina + xilazina; B: protocolo de anestesia dissociativa tiletamina + zolazepam; C: protocolo de anestesia dissociativa tiletamina + zolazepam + tramadol; D: protocolo de anestesia inalatória (indução com cetamina + diazepam e manutenção com isoflurano); a,b,c,d- letras diferentes representam diferenças entre colunas; (P<0,05) Tabela 4: Temperatura retal (média ± erro padrão) de gatos submetidos à eletroejaculação após anestesia com 4 diferentes protocolos. Tempos de avaliação Antes da Anestesia 10 min após 1ª série 1° Intervalo 2ª série 2° Intervalo 3ª série 5 min após EEJ 10 min após EEJ 30 min após EEJ 60 min após EEJ A (°C) Protocolos anestésicos B C (°C) (°C) D (°C) (n=13) (n=13) (n=13) (n=14) 38,58 ± 0,40 39,20 ± 0,15a 38,93 ± 0,08a 38,75 ± 0,19a 38,58 ± 0,21a 38,37 ± 0,16a 37,96 ± 0,17a 37,61 ± 0,17a 38,58 ± 0,40a 39,20 ± 0,15a 38,93 ± 0,08a 37,30 ± 0,37 38,30 ± 0,15a 37,50 ± 0,16bc 37,30 ± 0,17a 37,30 ± 0,17ac 37,29 ± 0,24b 37,08 ± 0,20bc 36,84 ± 0,24bc 37,30 ± 0,37b 38,30 ± 0,15a 37,50 ± 0,16bc 38,30 ± 0,00 38,40 ± 0,15a 38,10 ± 0,17ac 37,80 ± 0,18a 37,80 ± 0,17ac 37,82 ± 0,13c 37,43 ± 0,15ac 36,90 ± 0,27c 38,30 ± 0,00c 38,40 ± 0,15a 38,10 ± 0,17ac 37,50 ± 0,45 38,43 ± 0,47a 38,20 ± 0,31c 37,97 ± 0,50a 37,50 ± 0,30bc 37,50 ± 0,15bc 37,01 ± 0,22bc 37,10 ± 0,32ac 37,50 ± 0,45bc 38,43 ± 0,47a 38,20 ± 0,31c A: protocolo de anestesia dissociativa de cetamina + xilazina; B: protocolo de anestesia dissociativa tiletamina + zolazepam; C: protocolo de anestesia dissociativa tiletamina + zolazepam + tramadol; D: protocolo de anestesia inalatória (indução com cetamina + diazepam e manutenção com isoflurano); a,b,c,d- letras diferentes representam diferenças entre colunas; A,B- letras diferentes representam diferenças linhas (tempos avaliados x parâmetros antes da anestesia). P<0,05 Como o protocolo de anestesia inalatória (D) fez uso da intubação do animal para fornecimento de oxigênio medicinal e permitiu a regulação do volume de anestésico a ser fornecido ao paciente, a ocorrência e conseqüente manutenção do animal em bradipinéia, como ocorrido no protocolo D durante os choques, ou sem reflexo palpebral é menos preocupante do ponto de vista anestésico que no protocolo A e C, desde que mantidos batimentos cardíacos regulares, como apresentado. O uso da combinação cetamina e xilazina é uma prática comum na anestesia de pequenos animais, embora o grau de analgesia possa ser questionável de acordo com o procedimento (FANTONI et al., 1999). Sabidamente a xilazina apresenta efeitos cardiopulmonares que incluem bradicardia; redução do débito cardíaco e aumento inicial da pressão arterial seguido de hipotensão duradoura, devido aos seus efeitos sedativos de α-2 agonista, os quais nem sempre são contrabalançados pela ação simpatomimética da cetamina usada em associação anestésica com a xilazina (ANDRADE et al., 2002). Assim como afirmado por ERDMANN (2005) com o uso da combinação xilazina com tiletamina e zolazepam para EEJ, um menor controle da dor com os protocolos A, B e C podem justificar as elevações de freqüência cardíaca e respiratória em vários momentos de observação. Os valores obtidos para freqüência cardíaca estão dentro dos limites normais para gatos domésticos submetidos à anestesia (CISTOLA et al., 2004). A adição do tramadol à combinação tiletamina e zolazepam (protocolo C) foi usada em substituição à morfina utilizada na combinação anestésica anteriormente descrita por Tebet et al. (2006) para EEJ de gatos domésticos. Estes autores não descreveram os efeitos desta associação ao longo da EEJ e detiveram-se aos aspectos de coleta seminal e criopreservação. Tebet (2004) citou que o protocolo tiletamina, zolazepam e morfina foi considerado mais adequado à EEJ de gatos domésticos do que a mesma associação sem o uso de opióide pois, além dos resultados satisfatórios de colheita de sêmen, promoveu tranqüilidade dos animais sem ocorrências de vocalização ou quaisquer sinais de desconforto. A decisão de substituir a morfina pelo tramadol no protocolo testado no presente trabalho foi devida aos efeitos analgésicos similares dos dois fármacos, evitando os efeitos indesejados de bradicardia da morfina. Além disto, o tramadol possui apresentação comercial de mais fácil acesso, podendo ser empregado futuramente com maior facilidade do que a combinação tiletamina, zolazepam e morfina. O tramadol, ainda pouco empregado clinicamente em gatos domésticos, já demonstrou ser bastante seguro para a espécie em dose até duas vezes maior que a utilizada no presente trabalho (BRAGA, 2007). Interferências na auscultação cardíaca no momento da EEJ e arritmias transitórias logo após uma série de EEJ levaram à realização da Etapa 2 (Tabela 5), onde percebeuse que a SpO2 diminuiu considerável e abruptamente no momento dos choques elétricos no animal submetido à anestesia dissociativa com o protocolo A. A SpO2, que estava em torno de 90 a 93%, caiu a 47 a 58%, considerado um valor preocupante durante uma anestesia, todavia após o fim da EEJ os valores retornaram aos valores iniciais. É possível que a queda na oxigenação seja dificultada pelas contrações abdominais e/ou torácicas que os animais apresentam no momento do choque elétrico em conjunto com a distensão dos membros posteriores. Isto pode se constituir um risco quando o animal já possui limitações respiratórias não detectáveis antes da anestesia. No animal submetido ao protocolo B os valores de SpO2 de 78 a 97% após anestesia, mas antes do choque elétrico, decaíram a 59 a 86% durante a série de choques. No protocolo C os valores mantiveram-se praticamente constantes, entre 89 a 98%, antes e ao longo dos choques elétricos. No animal submetido ao protocolo D com anestesia inalatória também não foi observada queda preocupante na SpO2 (82 a 98%); desta forma, pode-se concluir que o comprometimento temporário dos movimentos respiratórios provavelmente não afetou a SpO2, já que o animal continuou passivamente recebendo oxigênio medicinal (100%) via traqueotubo. Quanto ao traçado da onda pletismográfica, foram observados traçados compatíveis com os protocolos utilizados, com presença de taquicardia sinusal nos protocolos dissociativos (NUNES, 2002). Contudo, no momento da EEJ independente do protocolo utilizado, foram observados em alguns momentos traçados estranhos, que causaram impossibilidade de leitura. À auscultação logo após o final da série de EEJ no qual o traçado anormal era observado havia taquicardia sem evidências de arritmia, sugerindo interferência na leitura da condutividade elétrica do coração pelos estímulos elétricos gerados pelo equipamento utilizado para EEJ. As aferições em aparelhos deste tipo sofrem interferências com movimentos (MORATO et al., 2002). As arritmias transitórias observadas na Etapa 1 não foram evidenciadas em nenhum dos 4 animais utilizados na Etapa 2. De todos os protocolos testados no presente estudo somente a anestesia inalatória (protocolo D) foi capaz de eliminar a dor de forma efetiva, haja vista que a vocalização audível sem auxílio de aparelhos, um dos sinais mais evidentes de desconforto e dor, foi observada em 3, 2 e 2 animais dos respectivos protocolos A, B e C. Para eliminar a sensibilidade dolorosa, seja pelo reflexo de retração ao pinçamento interdigital, ou pela vocalização, foram necessárias novas aplicações dos fármacos dissociativos antes de iniciar a EEJ ou no seu transcurso. No protocolo A, 10 animais receberam uma única dose da combinação anestésica. No protocolo B, somente 1 animal não necessitou de complementação. No protocolo C, somente 2 não necessitaram de reforços. A necessidade de complementações anestésicas pode ser o desencadeante dos tempos de recuperação encontrados para os protocolos testados. No protocolo A, a tentativa espontânea de erguer a cabeça e manter-se na posição de estação foi observada entre 60 e 229 min após o final da EEJ, enquanto nos protocolos B e C, de 30 a 90 min, e no D, de 30 a 60 min. A recuperação anestésica foi acompanhada de intensa excitação em 1 animal nos protocolos A e B. Uma grande vantagem do uso do protocolo anestésico D, frente ao A, B e C é a alta potência do isoflurano e o maior controle do plano anestésico. A indução e recuperação são rápidas, além do fato do efeito tempo não ser um limitante, já que devido à sua baixa solubilidade do isoflurano somente 0,2% do fármaco é biotransformado, gerando ausência de efeitos cumulativos e conseqüente baixa toxicidade renal e hepática (CASSU e LUNA, 2003). Tabela 5: Saturação de oxigênio (SpO2) de gatos submetidos à eletroejaculação após anestesia com 4 diferentes protocolos antes, durante e nos intervalos da EEJ. Tempos de avaliação A Antes da EEJ 91,67 ± 0,88 Protocolos anestésicos B C 90,18 ± 1,63 D 97,00 ± 0,00 96,00 ± 2,00 49,00 ± 1,53 72,39 ± 1,63 95,00 ± 1,29 Durante a EEJ Intervalos e 91,67 ± 0,88 93,60 ±0,82 97,50 ± 0,50 após a EEJ A: protocolo de anestesia dissociativa de cetamina + xilazina (n= 1); 95,00 ± 1,29 94,26 ± 0,69 B: protocolo de anestesia dissociativa tiletamina + zolazepam (n= 1); C: protocolo de anestesia dissociativa tiletamina + zolazepam + tramadol (n= 1); D: protocolo de anestesia inalatória (indução com cetamina + diazepam e manutenção com isoflurano- n= 1); Os protocolos dissociativos de cetamina/xilazina e tiletamina/zolazepam foram descritos como seguros e eficazes para EEJ de diversas espécies de felídeos (MORAIS et al., 2002; MORATO et al., 2002). Nestas duas combinações anestésicas a xilazina pode ser revertida por antagonistas como a ioimbina (ANDRADE et al., 2000; EMÍLIO et al., 2004) e o zolazepam pelo flumazenil, acelerando o tempo de retorno anestésico e inibindo os efeitos indesejados desses fármacos. O uso de reversor não foi avaliado no presente trabalho, já que não houve necessidade de seu uso e desejava-se avaliar o tempo de recuperação espontânea. Embora os protocolos dissociativos sejam mais práticos e menos onerosos em relação aos custos de equipamentos e fármacos é preciso avaliar a dose a ser utilizada e os riscos implicados a ela de acordo com o paciente a ser eletroejaculado. O intervalo de 15 dias entre coleta e anestesia não causou efeitos indesejados para a maioria dos animais no presente trabalho, com exceção à convulsão observada em um animal após o final da EEJ no protocolo A (cetamina e xilazina). Este animal apresentou outras crises convulsivas somente mais de 6 meses após o final dos 4 procedimentos de EEJ, responsivas à fenobarbital, em momentos de transporte ou estresse. O zolazepam e o diazepam usados nos protocolos B, C e D são importantes agentes anti-convulsivantes (ANDRADE et al., 2002). Assim, em um paciente epilético, pode-se creditar à ausência de um anti-convulsivante, associado ao uso de um fármaco sabidamente excitatório (cetamina) à possível causa da convulsão apresentada. Platz e Seager (1978) relataram que a EEJ com anestesia utilizando-se a cetamina pode ser executada rotineiramente uma vez por semana sem efeitos causados pela anestesia ou pela inserção da sonda no reto do animal. Conclusão O protocolo de anestesia inalatória com indução anestésica com cetamina, diazepam e manutenção com isoflurano foi o que melhor promoveu analgesia, segurança ao procedimento anestésico e à equipe e rápida recuperação, para EEJ em gatos domésticos. Agradecimentos Ao CNPQ, à CAPES e à FUNCAP pelo custeio do experimento e pelas bolsas de pesquisas concedidas. Ao Centro de Controle de Zoonoses de Fortaleza pela concessão das vacinas anti-rábicas aplicadas nos animais. Referências ANDRADE, S. F.; CORRÊA, E. M.; SILVA, S. R. G. Uso do bloqueador α2adrenérgico como antagonista da associação quetamina + xilazina em gatos. A Hora Veterinária, Ano 19, n.114, 2000. ANDRADE, S. F.; FANTONI, D. T.; CORTOPASSI, S. R. G.; ANDRADE NETO, J. P. Terapêutica do Sistema Nervoso. In: ANDRADE, S. F. Manual de Terapêutica Veterinária. 2. ed. São Paulo: Roca, 2002, p.348. AXNÉR, E.; HOLST STRÖM, B.; LINDE-FORSBERG, C. Morphology of spermatozoa inthe cauda epididymidis before and after electroejacutation and a comparision with ejaculated spermatozoa in the domestic cat. Theriogenology, v.50, p. 973-979, 1998. BRAGA, A.C.P. Avaliação da dor pós-operatória de gatas domésticas submetidas a OSH utilizando 2 e 4mg de cloridrato de tramadol. Fortaleza, 2007. Monografia de Especialização (Especialização em Clínica e Cirurgia de Pequenos Animais, Universidade Estadual do Ceará). Fortaleza, 2007. CARVALHO, C. T. Sêmen de grandes felinos. Revista de Medicina Veterinária, v.2, n.4, p. 195-201, 1968. CASSU, R. N.; LUNA, S. P. L. Tramadol. Revista Científica de Medicina Veterinária-Pequenos Animais e Animais de Estimação, v. 1, n.4, 295-301, 2003. CHATDARONG, K.; PONGLOWHAPAN, S.; MANEE-IN, S.; PONGPHET, K. The use of propofol for electroejaculation in domestic cats, Theriogenology, v.66, p.16151617, 2006. CISTOLA, A. M.; GOLDER, F. J.; CENTOZE, L.A.; MCKAY, L.W.; LEVY, J. K. Anestthetic and physiologic effects of tiletamine, zolazepam, ketamine and xilazyne combination (TKX) in feral cats undergoing surgical sterilization. J. Fel. Med. Surg, v. 6, n. 5, p. 297- 303, 2004. EMÍLIO, C. R.; OSÓRIO, D. D. P.; MARIANO, A. P.; LUNA, S. P. L.; GONÇALVES, R.C.; MANNARINO, R.; FOLONI, V. S. Efeito da ioimbina como antagonista da xilazina em cães e gatos. Acta Scientiea Veterinariae, v. 32, n.1, p.5357, 2004. ERDMANN, R. H. Exame reprodutivo, contenção farmacológica e criopreservação de sêmen em gato-do-mato-pequeno (Leopardus tigrinus Scherber, 1775). Curitiba, 2005. Dissertação (Mestrado em Ciências Veterinárias do Curso de Pós-Graduação em Ciências Veterinárias, Setor de Ciências Agrárias, Universidade Federal do Paraná). 70 p. FANTONI, D. T.; CORTOPASSI, S. R. G.; BERNARDI, M. M. Anestésicos intravenosos e outros parenterias.In: SPINOSA, H. S.; GÓRNIAK, S. L., BERNARDI, M.M. Farmacologia Aplicada à Medicina Veterinária, 2. ed. Rio de Janeiro: Guanabara Koogan, 1999, p.114-124. HOWARD, J. G., BUSH, M. HALL, L. L. et al. Morfological abnormalities in spermatozoa of 28 species of non-domestic felids. In: INTERNATIONAL CONGRESS ON ANIMAL REPRODUCTION AND ARTIFICIAL INSEMINATION, 10, 1984. Urbana-Champaign. Proceedings. Urbana Champaign, 1984.p. 57. KELLY, W. R. Respiração. In: KELLY, W. R. Diagnóstico Clínico Veterinário. 3. ed. Rio de Janeiro: Discos CBS, 1986. LEITE, D. K. V. H.; PIRES, M. V. M.; SUZANO, S. M. C.; LISBOA, D.; SILVEIRA, A. M.; FEREIRA, A. M. R. Avaliação da coleta de sêmen pelo método de eletroejaculação no gato doméstico (Felis catus). Revista da Universidade Federal Rural do Rio de Janeiro, v. 26, suplemento, p. 361-362, 2006. MIES-FILHO, A. In: Reprodução dos Animais e Inseminação Artificial. 5. ed., Porto Alegre: Sulina, 1982. MIES-FILHO, A.; TELECHEA, N. L.; BOHRER, J. L.; WALLAWER, W. P. Produção espermática de Panthera onca. Arquivos da Faculdade de Medicina Veterinária da Universidade Federal do Rio Grande do Sul, v. 2, n. 1, p. 55-65, 1974. MORAIS, R.N.; MUCIOLO, R.G.; GOMES, M.L.F.; LACERDA, O.; MORAES, W.; MOREIRA, N.; GRAHAM, L.H.; SWANSON, W. F.; BROWN, J.L. Seasonal analysis of semen caracteristics, serum testosterone and fecal androgens in the ocelot (Leopardus pardalis), margay (L. weidii) and tigrina (L. tigrinus). Theriogenology, v. 57, p. 20272041, 2002. MORATO, R. G.; BARNABE, R. C. Biotécnicas de Reprodução Aplicadas à Preservação de Felídeos Selvagens. Clínica Veterinária, v. 12, p. 24-26, 1998. MORATO, R.G.; MOURA, C.A.; CRAWSHAW JR., P.G. Inmobilización química de jaguares libres con una combinación de tiletamina y zolazepam. In: MEDELLIN, R. A.; CHETKIEWICZ, C.; RABINOWITZ, A.; REDFORD, K. H.; ROBINSON, J. G.; SANDERSON, E.; TABER, A. El Jaguar en el nuevo milenio. Una evaluacion de su estado, deteccion de prioridades y recomendaciones para la conservacion de los jaguares en America. Mexico: Universidad Nacional Autonoma de Mexico/Wildlife Conservation Society, 2002, p.63. NUNES, N. Monitoração da Anestesia. In: FANTONI, D. T.; CORTOPASSI, S. R. G Anestesia em Cães e Gatos, 1. ed. São Paulo: Rocca, 2002, p.64-81. PLATZ., C. C.; SEAGER, S. W. J. Semen collection by electroejaculation in the domestic cat. Journal of American Veterinary Medicine Association, v. 173, p. 1353-1355, 1978. SANTOS, G. J. G; MASSONE, F.; MATTOS JÚNIOR, E.; HATSCHBACH, E. Avaliação cardiovascular de case submetidos a associação anestésicas fundamentadas em fármacos dissociativos. Revista Científica de Medicina Veterinária - Pequenos Animais e Animais de Estimação, v. 2, n.8, p. 276-284, 2004. SILVA, A.R.; MORATO, R.G.; SILVA, L.D.M. The potential for gamete recovery from non-domestic canids and felids. An. Reprod. Sc., v. 81, p. 159-175, 2004a. SILVA, T. F. P.; DIAS, C. G.A.; BRAGA, A. C. P.; UCHOA, D. C.; CARDOSO, J. F. S.; ACKERMANN, C. L.; THOMÁS, L. A; SILVA, L. D. M. Anestesia inalatória associada à opióide para eletroejaculação em gatos domésticos: resultados preliminares. In: SEMANA UNIVERSITÁRIA DA UNIVERSIDADE ESTADUAL DO CEARÁ. Anais…, 2004b, p.1 TEBET, J. M. Efeito da criopreservação sobra a célula espermática em três espécies de felinos: o gato-do-mato-pequeno (Leopardus tigrinus, Schreber, 1775), a jaguatirica (Leopardus pardalis, Linnaeus, 1758) e o gato doméstico (Felis catus). Botucatu, 2004. Tese (Doutorado em Reprodução Animal pela Faculdade de Medicina Veterinária e Zootecnia da Universidade Estadual Paulista).115 p. TEBET, J.M.; MARTINS, M. I. M.; CHIRINEA, V. H.; SOUZA, F. F.; CAMPAGNOL, D.; LOPES, M. D. Cryopreservation effects on domestic cat epididymal versus electroejaculated spermatozoa, Theriogenology, v. 66, p. 1629-1632, 2006. WILDT, D. E.; BUSH, M.; HOWARD, J. G., et al. Unique seminal quality in the South African cheetah and a comparative evaluation in the domestic cat. Biology of Reproduction, v. 29 , n.4, p. 1019-1025, 1983. ZAMBELLI, D.; CUNTO, M.; PRATI, F.; MERLO, B. Effects of ketamine or medetomidine administration on quality of eletrocejaculated sperm flow in the domestic cat. Theriogenology, v. 68, p. 796-83, 2007. 5.2. Capítulo 2: Artigo aceito para publicação na Revista Ciência Animal Comparação de quatro protocolos anestésicos para a coleta de sêmen por eletroejaculação em gatos domésticos (Comparison of four anesthetic protocols for semen collection by electroejaculation in domestic cats) Ticiana Franco Pereira da Silva1*, Carlos Gabriel Almeida Dias1, Janaína de Fátima Saraiva Cardoso1, Daniel Couto Uchoa1, Ana Cristina Paulino Braga2, Camila Louise Ackermann1, Francisco Tiago Silva Pinheiro1, Daniel Falcão Menezes Brilhante1, Raimundo Diones Carneiro1, Leonardo Tavernezi1, Henna Roberta Quinto1, Lúcia Daniel Machado da Silva1 1 Laboratório de Reprodução de Carnívoros-FAVET, PPGCV, UECE , Av. Paranjana, 1700, Cep 60740-903, Fortaleza, CE, Brasil, Fone: (85) 31019860; Fax: (85)31019840 2 Médica Veterinária Autônoma e-mail: * [email protected] Resumo O objetivo deste trabalho foi avaliar quatro protocolos de anestesia para a coleta de sêmen em gatos domésticos por eletroejaculação (EEJ). Quatorze gatos foram anestesiados com cetamina/ xilazina (protocolo A), tiletamina/ zolazepam (protocolo B), tiletamina/ zolazepam e tramadol Protocolo C), e isoflurano (protocolo D) e foram submetidos a 3 séries de choques elétricos (20 – 60 mA). Os parâmetros de qualidade seminal, volume, a presença de espermatozóides e a contaminação por urina foram avaliados para todos os protocolos após eletroejaculação. O sucesso na obtenção de ejaculado foi de 84,62% (11/13); 92,31% (12/13); 92,31% (12/13) e 100% (14/14), respectivamente para os protocolos A, B, C e D. Diferenças significativas entre os grupos foram encontradas para motilidade, vigor e volume seminal. O protocolo de anestésico com isoflurano é eficientemente indicado para coleta de sêmen por eletroejaculação em gatos domésticos. Palavras-chave: Eletroejaculação, anestesia, gato. Abstract The aim of this study was to compare four anesthetics protocols for semen collection by electroejaculation in domestic cats. Fourteen tom cats were anesthetized with ketamine/ xylazine (protocol A), tiletamine/ zolazepam (protocol B), tiletamine/ zolazepam and tramadol (protocol C), and isofluorane (protocol D) and submitted to a 3 series of electric stimuli (20 – 60 mA). The parameters of semen quality, volume, spermatozoa presence and urine contamination were analyzed for all protocols after electroejaculation. The success in ejaculated obtaining was 84.62% (11/13); 92.31% (12/13); 92.31% (12/13) and 100% (14/14), respectively to A, B, C e D protocols. Significant diferences in motility, vigour and seminal volume were observed among groups. The inalatory anesthetic protocol with isofluorane is efficiently indicated for semen collection in domestic cats by electroejaculation. Key Words: Electroejaculation, anesthesia, cat. Introdução A eletroejaculação (EEJ) é considerada o método de eleição para obtenção de sêmen felino. Este método possibilita análises andrológicas em animais de alto valor genético ou animais silvestres que não permitem avaliação sem anestesia devido à sua agressividade ou por não serem treinados para ejaculação em vagina artificial (MORATO e BARNABE, 1998) e baseia-se na indução do reflexo ejaculador através de estímulos elétricos, com a introdução de uma sonda trans-retal conectada a um estimulador elétrico, no assoalho da ampola retal do animal (SILVA et al., 2004a). A EEJ é considerada, pela maioria dos autores, um procedimento simples, rápido e prático (MORAIS et al., 2002). É uma técnica útil para avaliação andrológica do animal em ambiente clínico, já que o treinamento para a coleta do sêmen por vagina artificial pode levar de duas a três semanas, obtendo-se sucesso em apenas 60 a 70% dos casos (PLATZ e SEAGER, 1978). Para felinos, os protocolos de estimulação elétrica não apresentam grandes diferenças (WILDT et al., 1983; HOWARD et al., 1984), entretanto os protocolos anestésicos utilizados variam de acordo com os autores, que na grande maioria optam por um único protocolo de anestesia para coleta. Entre estes protocolos para EEJ em gatos domésticos e felídeos silvestres são citados: cloridrato de cetamina (PLATZ e SEAGER, 1978) e as associações de cloridrato de cetamina e xilazina (MORAIS et al., 2002); tiletamina e zolazepam (MORAIS et al., 2002; MORATO et al., 2002; TEBET et al., 2006); tiletamina, zolazepam e morfina; tiletamina, zolazepam, butorfanol e acepromazina (TEBET et al., 2006); cetamina e medetomidina (AXNÉR et al., 1998; ZAMBELLI et al., 2007); propofol (CHATDARONG et al., 2006), propofol e buprenofina (CHATDARONG et al., 2006); indução anestésica com propofol e anestesia epidural com lidocaína (LEITE et al., 2006), ou anestesia inalatória com a indução anestésica à base cetamina, diazepam, tiopental sódico e manutenção anestésica com isoflurano (SILVA et al., 2004b). Alguns autores atribuem parte do sucesso na coleta, ou seja, boa qualidade seminal, volume suficiente para análise e/ou conservação e ausência de contaminação do ejaculado por urina ao protocolo de anestesia empregado (ZAMBELLI et al., 2007; TEBET, 2004). O uso de diferentes associações torna difícil a comparação da eficiência entre os protocolos mais utilizados. Assim, o objetivo deste trabalho foi comparar quatro protocolos de anestesia para coleta de sêmen em gatos domésticos por eletroejaculação. Material e Métodos 1. Animais Foram utlizados 14 gatos machos púberes sem raça definida (SRD), com peso entre 3 e 5 Kg, provenientes do gatil experimental da Universidade Estadual do Ceará (3º 44’ de latitude Sul e 38° 34’ de longitude Oeste), estando os animais submetidos a 12 horas diárias de luz natural. Os animais foram mantidos em gaiolas individuais e alimentados com ração comercial de manutenção para gatos (Kitekat®- Éffem®, Brasil), recebendo água à vontade. 2. Anestesia Os animais foram submetidos a uma coleta por EEJ por protocolo anestésico testado, respeitando-se um intervalo mínimo de 15 dias entre cada coleta do mesmo animal. Os animais foram previamente submetidos a um jejum alimentar de 24h e hídrico de 12h, e após serem pesados, foram contidos farmacologicamente com associações de cloridrato de cetamina (15 mg/Kg - Dopalen®,Vetbrands®, Brasil) e cloridrato de xilazina (1 mg/Kg - Anasedan®, Vetbrands®, Brasil), por via IM (n=13 – protocolo A); cloridrato de tiletamina e zolazepam (15 mg/Kg - Zoletil ®, Virbac, Brasil e Telazol®, Fort Dodge Saúde Animal Ltda ®, Brasil) por via IM (n=13 – protocolo B); cloridrato de tiletamina e zolazepam (15 mg/Kg), e tramadol (2 mg/Kg - Sylador®, Sanofi Synthelabo Ltda®, Brasil) por via IM (n=13 – protocolo C); e indução anestésica com cloridarato de ketamina (15 mg/Kg) e diazepam (1mg/Kg - Compaz®, Cristália®, Brasil) por via IM, e manutenção em isoflurano (Isoforine®, Cristália®, Brasil - n=14 – protocolo D). Após a indução anestésica, quando necessário, antes da intubação os animais eram submetidos à máscara com isoflurano dissolvido em oxigênio medicinal. Para a intubação foi utilizada lidocaína spray a 10% para dessensibilização da laringe, cânulas de 4 ou 4,5 mm de diâmetro interno e circuito semi-aberto de Baraka, conectados a um vaporizador universal. Após a perca da reação de endireitamento postural, uma veia foi canulada para administração de cloreto de sódio (NaCl) a 0,9%, permitindo a reposição do anestésico por via intravenosa. Em todos os procedimentos anestésicos, os animais foram acompanhados quanto aos parâmetros fisiológicos até a tentativa espontânea de erguer a cabeça e manter-se em estação. A qualquer momento da EEJ no qual o plano anestésico não fosse mantido, a suplementação da anestesia era realizada por via IV com metade da dose inicial calculada, até obtenção do plano anestésico ideal. Para o protocolo C, somente a combinação tiletamina e zolazepam foi complementada. 3. Coleta de sêmen Para coleta do sêmen, foi utilizado um eletroejaculador portátil (Eletrojet® Electrovet®-Brasil), acoplado a uma sonda trans-retal (13 x 1 cm) com os eletrodos voltados para o assoalho da ampola retal, previamente lubrificado com gel inócuo à base de um polímero carboxivinílico. Após a entrada em plano anestésico, o reto foi limpo de bolos fecais e a sonda introduzida cerca de 5 a 7 cm no reto dos animais, e então foram aplicados 80 estímulos elétricos divididos em 3 séries. Na primeira série, 10 estímulos sucessivos de 20, 30 e 40 mA. Na segunda, 10 estímulos de 30, 40 e 50 mA e na terceira, estímulos de 50 e 60 mA. Cada estímulo elétrico durou entre 2 e 3 segundos, e entre cada série, foi realizado um intervalo de 5 minutos. O ejaculado de cada série de estímulos foi coletado em tubos plásticos de 1,5 mL 4. Análise do sêmen Afim de evitar possíveis alterações por conta do tempo transcorrido até o final do procedimento de EEJ, imediatamente após cada série, os ejaculados, foram observados em relação às características macroscópicas de volume e coloração, e microscópicas de presença ou não de células espermáticas, porcentagem de espermatozóides móveis (motilidade) e o vigor espermático (0 a 5), em microscopia de luz (100 e 400x). Amostras com suspeita de contaminação por urina foram mensuradas quanto ao pH através de fitas (D52348, Macherey-Nagel®, Alemanha). A porcentagem de alterações morfológicas espermáticas foi avaliada em microscópia óptica de contraste de fase (1000x) por coloração de uma alíquota do sêmen em Rosa de Bengala. Os espermatozóides foram classificados como normais ou anormais quando apresentavam algum defeito de acrossoma, cabeça, peça intermediária ou cauda. Os ejaculados contendo células espermáticas do mesmo animal (1ª e 2ª série) em cada protocolo foram mantidos em banho-maria a 37°C e misturados à 3ª série somente para a mensuração da concentração espermática, através de uma câmara de Neubauer em microscópio óptico (400x). 5. Análise Estatística Os parâmetros de volume, motilidade, vigor, concentração e alterações morfológicas foram expressos para o procedimento de EEJ somando-se os resultados das 3 séries na forma de média e desvio padrão. A motilidade, após conversão em arcoseno, e o volume foram comparados entre os protocolos e/ou séries pelo teste t-Student e o vigor pelo teste de Mann Whitney. Para todos os parâmetros, considerou-se p<0,05 (Stat View for Windows®, SAS Institute Inc., Versão 5.0, 1998). Resultados Todos os 14 animais ejacularam com conteúdo espermático em pelo menos uma série da coleta, mostrando possuírem produção seminal. A obtenção de ejaculado no procedimento de EEJ foi de 84,62% (11/13); 92,31% (12/13); 92,31% (12/13) e 100% (14/14), respectivamente para os protocolos A, B, C e D. Nos protocolos A e B, mais de ¼ das séries de EEJ resultou em falha de ejaculação. No C, mais de 80% das séries resultou em ejaculação; ao passo que no protocolo D, o inverso foi observado. A ejaculação contendo células espermáticas foi observada independentemente da série (voltagem) executada. O volume médio do ejaculado quando analisado quanto à presença ou não de células espermáticas, não diferiu entre os protocolos (Tab. 1). Para o cálculo de motilidade e vigor médios, os ejaculados contendo baixa concentração espermática (uma a quatro células em todos os campos observados) não foram considerados. A tabela 2 traz os resultados de motilidade e vigor obtidos para os protocolos. A coloração das séries do ejaculados variou de transparente a esbranquiçado (n= 122 séries do ejaculado), com exceção das amostras contaminadas por urina que apresentavam coloração amarelada (n= 4 séries do ejaculado). Estes ejaculados com urina foram obtidos nos protocolos A e D. Nestes casos, o pH do ejaculado obtido foi 7 e 8, enquanto que nas outras séries de EEJ no mesmo protocolo para o mesmo animal o pH foi igual a 9. A contaminação com urina ocorreu em um animal nas duas primeiras séries de EEJ do protocolo de anestesia inalatória, nas quais foi obtido plasma seminal (400 e 140 μL); e em outro animal na 2ª (10 μL) e 1ª série (110 μL) dos protocolos A e D, respectivamente, nas quais foi obtido ejaculado contendo células espermáticas. A concentração espermática média para os protocolos A e C, foi respectivamente de 460 e 258 x 106 sptz/ mL. A avaliação de concentração não foi efetuada nos protocolos B e D. Em relação à morfologia espermática foram obtidos: 55,47% ± 27,05; 85,03% ± 21,17; 35,63% ± 5,13; e 46,82% ± 17,74 de anormalidades, respectivamente para os grupos A, B, C e D, predominando o defeito de cauda enrolada. Discussão Para felídeos, os relatos de obtenção de ejaculado na coleta por EEJ são de 100% na onça pintada, utilizando tiletamina e zolpazepam (MORATO et al., 1998), 100% no gato-do-mato-pequeno, utilizando tiletamina zolazepam e xilazina (ERDMANN et al., 2005) e 80% no gato doméstico, utilizando indução anestésica com propofol e anestesia epidural com lidocaína (LEITE et al., 2006). Assim como no presente trabalho, a presença de espermatozóides no ejaculado nem sempre é observada. A obtenção de somente plasma seminal foi relatada para onças pintadas em 20,4% dos procedimentos de EEJ. ERDMANN et al. (2005) relataram que em gato-do-mato-pequeno, todas as coletas resultaram em ejaculado contendo espermatozóides, sendo portanto a EEJ um procedimento satisfatório para confirmar a produção seminal dos animais. A ausência de ejaculação em um procedimento isolado não deve, no entanto, caracterizar a incapacidade de produção espermática pelo animal. Segundo PLATZ e SEAGER (1978), duas EEJ são necessárias para uma boa avaliação andrológica de um animal. Já LEITE et al. (2006) relataram que 20% dos animais não ejacularam em nenhuma das séries, entretanto, somente uma EEJ foi procedida por animal. As variações na obtenção de ejaculados com ou sem espermatozóides podem estar vinculadas a vários fatores, entre eles os diferentes procedimentos anestésicos realizados entre autores. No presente trabalho, a obtenção de ejaculados parece não ter sido influenciado pela anestesia. A EEJ não é só utilizada para avaliação andrológica, mas principalmente para obtenção de sêmen para estudos de conservação e inseminação artificial (PLATZ e SEAGER, 1978; TEBET et al., 2006). Assim, a obtenção de um ejaculado contendo espermatozóides torna-se essencial. Por este ponto de vista, utilizando-se o protocolo B (tiletamina e zolazepam), obteve-se menos freqüentemente ejaculado contendo espermatozóides móveis (5,13%) e mais freqüentemente somente plasma seminal (64,10%). Já utilizando o protocolo D, obteve-se um sucesso maior em relação à obtenção do ejaculado (11,90% de ausência de ejaculação) e este contendo espermatozóides móveis (40,48%). A ocorrência de contaminação por urina em 14,28 % das EEJ pelo protocolo D e em 7,69% pelo protocolo A, ambas confirmadas pela coloração e pH mais baixo que do ejaculado contaminado, é considerada normal. O sêmen coletado por EEJ apresenta pH mais elevado do que o coletado por vagina artificial, provavelmente devido à maior estimulação da próstata, cujo conteúdo é mais alcalino (DOOLEY e PINEDA, 1986). Assim, a queda do pH no ejaculado contendo urina não é tão acentuada, como foi observado no presente trabalho (pH= 7 e 8 com urina e pH=9 sem urina). A contaminação por urina no ejaculado após EEJ em gato doméstico é mais freqüentemente relatada com uso de voltagens superiores a 8V (PINEDA e DOOLEY, 1984) ou com o uso de combinações anestésicas contendo acepromazina (MARTIN, 1978). Procedimentos de EEJ em gato-do-mato-pequeno mostraram que em planos anestésicos muito profundos ou muito superficiais a incidência de contaminação por urina é maior (TEBET, 2004). De acordo com HOWARD (1993), o uso de anestésicos inalatórios pode relaxar a musculatura ao redor da bexiga, facilitando a ejaculação com urina. Entretanto, a contaminação do ejaculado por urina na EEJ de jaguatiricas utilizando tiletamina, zolazepam não diferiu das anestesiadas com a mesma combinação suplementadas com isoflurano (QUEIROZ et al., 2004). Experimento anterior de EEJ com o uso de anestesia inalatória com isoflurano e indução anestésica com cetamina, diazepam, tiopental sódico de parte dos mesmos animais utilizados no presente trabalho, não observou a contaminação por urina descrita com o protocolo D (SILVA et al., 2004b). A contaminação do ejaculado por urina não é um fenômeno fisiológico, entretanto a ejaculação retrógrada é freqüentemente observada durante ejaculação natural ou EEJ no gato doméstico (DOOLEY et al., 1991; TEBET, 2004; ZAMBELLI et al., 2007). No presente trabalho, nas séries sem obtenção de ejaculado ou com ejaculação de pequeno volume, somente de plasma seminal e com concentração baixa de células espermáticas é possível que a ejaculação retrógrada tenha ocorrido. Entretanto, não foi realizada cistocentese dos animais, para a verificação de células espermáticas na urina de forma a confirmar a ejaculação retrógrada. A visualização de pequena quantidade de espermatozóides na urina colhida por cistocentese é normal em gatos mesmo sem o uso de qualquer contenção farmacológica ou estímulo ejaculatório (ZAMBELLI et al., 2007). Uma repetição do experimento com cistocentese seria interessante para evidenciar se as EEJ realizadas com o protocolo A, contendo xilazina, induziriam ou não nos animais uma maior freqüência de ejaculação retrógrada, já que este fenômeno ocorre com o uso da xilazina em cães (DOOLEY et al., 1990), mas não em suínos (MARTIN et al., 2003). O sucesso de uma coleta de sêmen em felídeos por EEJ envolve a combinação de múltiplos fatores (QUEIROZ et al., 2004). Além das variações promovidas pelas combinações anestésicas utilizadas para as diferentes espécies e protocolo de voltagens utilizado, deve-se considerar a variação individual, o posicionamento e tamanho da sonda, e a presença de fezes no reto. No presente trabalho, o reflexo de extensão das patas foi observado em todos os estímulos, para todos os animais em todos os protocolos, aventando-se que mesmo nas séries em que não houve ejaculação, o estímulo elétrico foi fornecido satisfatoriamente. Na EEJ, é esperado o reflexo de extensão das patas traseiras. Se o reflexo nas primeiras sub-séries não é observado, ou a reação for exacerbada, a posição da sonda pode não estar sendo adequada ou há interferência no estímulo elétrico pela presença de fezes no reto (PLATZ e SEAGER, 1978; SILVA et al., 2004a). Assim como relatado por PLATZ e SEAGER (1978), a inserção da sonda no reto do animal e aplicação de choques elétricos nesta região em intervalos de até 1 semana, não promoveu no presente trabalho efeitos indesejados. O volume médio obtido após a EEJ, para todos os protocolos pode ser considerado baixo. Grandes volumes só foram observados quando houve contaminação por urina (100 – 400 μL). Redução no volume do ejaculado por EEJ é observado com uso da atropina na pré-anestesia (MARTIN, 1978), e o aumento do volume pode ser observado com a repetição das coletas (PINEDA et al., 1984), ou a repetição pode causar redução no volume (AXNÉR et al., 1997). Alguns autores não incluem o volume do ejaculado na estatística, já que o método de coleta pode afetá-lo (AXNÉR et al., 1997). O volume do ejaculado é um dado bastante variável entre autores, protocolos de coleta e anestesia, indo de 77 a 738 μL no uso da cetamina isolada (PLATZ e SEAGER, 1978), 140 μL para associações à base de tiletamina e zolazepam (TEBET et al., 2006), e 42,5 μL para isoflurano (SILVA et al., 2004b). A EEJ mostrou-se satisfatória para determinação da ocorrência de produção seminal pelos animais utilizados, visto que nem todos haviam sido previamente coletados por vagina artificial ou qualquer outro método. A qualidade média dos ejaculados pode ser considerada normal para a espécie já que resultados de motilidade para o gato doméstico após EEJ são bastante variáveis (47% a 91%- PLATZ e SEAGER, 1978; LEITE et al., 2006;) Valores de 80 a 100% de motilidade foram observados em pelo menos 8 animais em 1 ou mais de 1 protocolo. Todos os animais em pelo menos 1 ejaculado de cada série individual apresentou resultado de motilidade ≤ 50% distribuído entre os protocolos, parecendo não haver efeito de 1 ou mais animais naturalmente com melhor ou pior qualidade seminal, mas sim do procedimento de EEJ, o qual proporcionou uma grande variação na motilidade observada. Já o vigor espermático médio, está abaixo dos valores descritos para os diferentes protocolos, sendo observado em geral valores de 3 a 5 (AXNÉR et al., 1997; TEBET et al., 2006; ZAMBELLI et al., 2007). A utilização de tubos de coleta à temperatura ambiente (aproximadamente 28°C) e não pré-aquecidos (37°C) pode ter contribuído para uma discreta diminuição da qualidade seminal em algumas amostras. Porém, o tempo da coleta de cada série até a analise não parece ser suficiente para determinar significativa queda de qualidade em todos os procedimentos (PLATZ e SEAGER, 1978; SILVA et al., 2004a). Bons resultados de qualidade após EEJ foram obtidos por TEBET et al. (2006), utilizando tubos coletores mantidos à temperatura ambiente (não descrita) e processamento do sêmen após a EEJ. O percentual de alterações morfológicas observadas está dentro do limite médio de <2 a 59,1% encontrado após EEJ em gatos domésticos (PLATZ e SEAGER, 1978; AXNÉR et al., 1997). Relatos comprovam que a EEJ altera a osmolaridade do sêmen (DOOLEY e PINEDA, 1986), o que pode ter influenciado na predominância de defeitos de cauda enrolada. A diminuição da qualidade e aumento de alterações morfológicas parecem estar mais vinculadas ao aumento da secreção das glândulas acessórias (AXNÉR et al., 1998), já que o uso da EEJ causa aumento do volume do plasma seminal quando comparado à vagina artificial (PLATZ e SEAGER, 1978) e sabe-se que a presença do plasma seminal afeta negativamente a habilidade de fertilização no gato doméstico (LUVONI et al., 2003). Quanto maior a voltagem, mais líquido de glândulas acessórias (DOOLEY e PINEDA, 1986). Salienta-se que os animais do presente trabalho foram submetidos em ordem aleatória aos protocolos anestésicos para realização da EEJ. Assim, diminui-se a possibilidade do efeito da ordem da coleta, avaliando-se somente o uso da associação anestésica. O aumento da secreção de glândulas acessória é acompanhado do decréscimo da concentração espermática (PLATZ e SEAGER, 1978), entretanto os valores de concentração espermática obtidos foram superiores aos relatados na literatura (9 a 198,88 x 106 sptz/mL- PLATZ e SEAGER, 1978; ZAMBELLI et al., 2007) para coleta de sêmen por EEJ em gatos domésticos, assemelhando-se aos resultados anteriormente obtidos em parte do mesmo grupo experimental para anestesia com isoflurano (867 x 106 sptz/mL- SILVA et al., 2004b). Estas diferenças podem se dever a fotoperiodicidade do gato doméstico, já que os diferentes experimentos podem ter sido realizados em localizações geográficas e estações do ano distintas, influenciando na concentração espermática obtida (STORNELLI, 2007). Modificações no número de séries e intensidade de estímulos partindo-se de um protocolo base (TEBET, 2004), a realização de uma segunda EEJ em um mesmo plano anestésico após alguns minutos (AXNÉR et al., 1997) e o uso de sondagem uretral durante o procedimento da EEJ (HERRON et al., 1986; TEBET, 2004) são alternativas já descritas a fim de melhorar volume e a qualidade do ejaculado ou facilitar a manipulação de pequenos volumes em gatos domésticos. A obtenção no tubo coletor de pequenos volumes foi bastante comum no presente trabalho, e uma alternativa ao uso do cateter foi a pipetagem, em alguns casos, do líquido aderido entre a mucosa peniana e o prepúcio, diminuindo as perdas. Quando a obtenção de um volume suficiente de ejaculado contendo espermatozóides móveis de boa qualidade é considerada não somente para avaliação andrológica, mas para o processamento do sêmen por métodos de refrigeração e/ou criopreservação, o uso do protocolo anestésico B para EEJ resulta nos piores resultados. O protocolo D apresenta o inconveniente de necessitar do uso de um equipamento e de um profissional treinado para realização da anestesia, utilizando também maior quantidade de combinações farmacológicas, tornando o protocolo mais oneroso e menos prático. Apesar destes incovenientes, para uso clínico, apresenta boa relação custobenefício, diminuindo riscos anestésicos no procedimento de EEJ quando realizado em animais de alto valor zootécnico, financeiro e/ou afetivo. O protocolo A, permite a coleta na maior parte das séries de EEJ, entretanto a qualidade da analgesia e segurança desta combinação anestésica é inferior à do protocolo D (SILVA et al., dados não publicados). O protocolo C mostra-se como uma alternativa no uso de uma anestesia dissociativa e apresenta no geral resultados semelhantes aos protocolos A e D. Conclusão O protocolo de anestesia inalatória com a indução anestésica com cetamina, diazepam e manutenção com isoflurano é eficientemente indicado para coleta de sêmen por eletroejaculação em gatos domésticos. Agradecimentos Ao CNPQ, à CAPES e à FUNCAP pelo custeio do experimento e pelas bolsas de pesquisas concedidas. Ao Centro de Controle de Zoonoses de Fortaleza pela concessão das vacinas anti-rábicas aplicadas nos animais. Referências AXNÉR, E.; HOLST STRÖM, B.; LINDE-FORSBERG, C. Sperm morphology is better in the second ejaculate than in the first in domestic cats eletroejaculated twice during the same period of anesthesia. Theriogenology, v.47, p.929-934, 1997. AXNÉR, E.; HOLST STRÖM, B.; LINDE-FORSBERG, C. Morphology of spermatozoa in the cauda epididymidis before and after electroejacutation and a comparision with ejaculated spermatozoa in the domestic cat. Theriogenology, v.50, p.973-979, 1998. CHATDARONG, K.; PONGLOWHAPAN, S.; MANEE-IN, S.; PONGPHET, K. The use of propofol for electroejaculation in domestic cats, Theriogenology, v.66, p.16151617, 2006. DOOLEY, M. P.; PINEDA, M. H. Effect of method of collection on seminal characteristics of the domestic cat. Am. J. Vet. Res. v. 47, n. 2, p. 286 -292, 1986. DOOLEY, M. P.; PINEDA, M. H.; HOPPER, J. G.; HSU, W. H. Retrograde flow of spermatozoa into urinary bladder of dogs during ejaculation or after sedation with xylazine. Am. J. Vet. Res, v. 51, n. 10, p.1574-1579, 1990. DOOLEY, M. P.; PINEDA, M. H.; HOPPER, J. G.; HSU, W. H. Retrograde flow of spermatozoa into the urinary bladder of cats during electroejaculation, collection of semen with artificial vagina, and mating. Am. J. Vet. Res, v. 52, n. 5, p.687- 691, 1991. ERDMANN, R. H; JUVENAL, J. C.; MORAES, W.; CUBAS, P.; CARVALHO, A. L.; MOREIRA, N. Estudo reprodutivo em gato-do-mato-pequeno (Leopardus tigrinus Schreber, 1775). Arch. Vet. Sc., v.10, n.2, p. 75-79, 2005. HERRON, M. A.; BARTON, C. L.; APPLEGATE, B. A modified technique for semen collection by eletroejaculation in the domestic cat. Theriogenology, v. 26, n. 3, p. 357364, 1986. HOWARD, J. G. Semen collection and análisis in carnivoress. In: FLOWER, M. E. Zoo Wild Animal Medicine and Current Therapy. Philadelphia: W. B. Saunders, 1993, p. 390-399. HOWARD, J. G.; BUSH, M.; HALL, L. L; WILDT, D. E. Morfological abnormalities in spermatozoa of 28 species of non-domestic felids. In: INTERNATIONAL CONGRESS ON ANIMAL REPRODUCTION AND ARTIFICIAL INSEMINATION, 10, 1984. Urbana-Champaign. Proceeddings...Urbana Champaign, 1984.p. 57. LEITE, D. K. V. H.; PIRES, M. V. M.; SUZANO, S. M. C.; LISBOA, D.; SILVEIRA, A. M.; FEREIRA, A. M. R. Avaliação da coleta de sêmen pelo método de eletroejaculação no gato doméstico (Felis catus). Rev. UFRRJ, v. 26, suplemento, p. 361-362, 2006. LUVONI, G.C.; KALCHSCHMIDT, E.; LEONI, S.; RUGGIERO, C. Conservation of feline semen. Part I: cooling and freezing protocols. J. Fel. Med. Surg., p. 1-6, 2003. MARTIN, I. C.A. The principles and practice of eletroejaculation of mammals. Symposium of Zoological Socitey of London, n. 43, p.127-152, 1978. MARTIN, P. A.; PINEDA, M. H., DOOLEY, M. P. Xylazine does not induce retrograde flow of spermatozoa onto the urinary bladder of sexually rested boars. J. Vet Med. A Physiol. Pathol. Clin. Med., v.50, n.3, p. 16-163, 2003. MORAIS, R.N.; MUCIOLO, R.G.; GOMES, M.L.F.; LACERDA, O.; MORAES, W.; MOREIRA, N.; GRAHAM, L.H.; SWANSON, W. F.; BROWN, J.L. Seasonal analysis of semen caracteristics, serum testosterone and fecal androgens in the ocelot (Leopardus pardalis), margay (L. weidii) and tigrina (L. tigrinus). Theriogenology, v.57, p. 20272041, 2002. MORATO, R. G.; BARNABE, R. C. Biotécnicas de Reprodução Aplicadas à Preservação de Felídeos Selvagens. Clin. Vet., v. 12, p. 24-26, 1998. MORATO, R. G.; GUIMARÃES, M. A. B. V.; NUNES, A. L. V.; CARCIOFI, A. C.; FERREIRA, F.; BARNABE, V. H.; BARNABE, R. C. Colheita e avaliação do sêmen em onça pintada (Panthera onca). Braz. J. Vet.. Res. Anim. Sc., v. 35, n. 4, p. 178-181, 1998. MORATO, R.G.; MOURA, C.A.; CRAWSHAW JR., P.G. Inmobilización química de jaguares libres con una combinación de tiletamina y zolazepam. In: MEDELLIN, R. A.; CHETKIEWICZ, C.; RABINOWITZ, A.; REDFORD, K. H.; ROBINSON, J. G.; SANDERSON, E.; TABER, A. El Jaguar en el nuevo milenio. Una evaluacion de su estado, deteccion de prioridades y recomendaciones para la conservacion de los jaguares en America. Mexico: Universidad Nacional Autonoma de Mexico/Wildlife Conservation Society, 2002, p.63. PINEDA, M. H.; DOOLEY, M. P. Effects of voltage and order of voltage application on seminal characteristics of electroejaculates of the domestic cat. Am. J. Vet. Res, v. 45, n. 8, p. 1520-1525, 1984. PINEDA, M. H.; DOOLEY, M. P; MARTIN, P. A. Long-term study on the effects of electroejaculation on seminal characteristics of the domestic cat. Am. J. Vet. Res, v. 45, n. 5, p. 1038-1041, 1984. PLATZ, C. C., SEAGER, S. W. J. Semen collection by electroejaculation in the domestic cat. J. Am. Vet. Med. A., v. 173, p.1353-1355, 1978. QUEIROZ, V. S.; FRANCA, G. D. A.; SANTOS, M.C.F.; CORTOPASSI, S. G.; GUIMARÃES, M. A. B. V. Urine contamination during ocelot (Leopardus pardalis) electroejaculation: considerations of the inhalant anesthesia. In: INTERNACIONAL SYMPOSIUM ON CANINE AND FELINE REPRODUCTION, 5, 2004. Embu das Artes, Brasil. Anais…, 2004, p.279-251. SILVA, A.R.; MORATO, R.G.; SILVA, L.D.M. The potential for gamete recovery from non-domestic canids and felids. An. Reprod. Sc., v. 81, p. 159-175, 2004a. SILVA, T. F. P.; DIAS, C. G.A.; BRAGA, A. C. P.; UCHOA, D. C.; CARDOSO, J. F. S.; ACKERMANN, C. L.; THOMÁS, L. A; SILVA, L. D. M. Anestesia inalatória associada à opióide para eletroejaculação em gatos domésticos: resultados preliminares. In: SEMANA UNIVERSITÁRIA DA UNIVERSIDADE ESTADUAL DO CEARÁ, 9, 2004. Fortaleza, Brasil. Proceeddings… 2004b, p.1. STORNELLI, M. A. Evaluación de semen en el gato doméstico: análisis de rutina y metodologías especiales felino. 2007. Rev. Bras. Reprod. An., v.31, n.1, p. 135-140, 2007. TEBET, J. M. Efeito da criopreservação sobre a célula espermática em três espécies de felinos: o gato-do-mato-pequeno (Leopardus tigrinus, Schreber, 1775), a jaguatirica (Leopardus pardalis, Linnaeus, 1758) e o gato doméstico (Felis catus). 115 p. Tese (Doutorado em Reprodução Animal pela Faculdade de Medicina Veterinária e Zootecnia da Universidade Estadual Paulista). 2004. TEBET, J.M.; MARTINS, M. I. M.; CHIRINEA, V. H.; SOUZA, F. F.; CAMPAGNOL, D.; LOPES, M. D. Cryopreservation effects on domestic cat epididymal versus electroejaculated spermatozoa, Theriogenology, v. 66, p.1629-1632, 2006. WILDT, D. E.; BUSH, M.; HOWARD, J. G., et al. Unique seminal quality in the South African cheetah and a comparative evaluation in the domestic cat. Biol. Reprod., v.29 , n.4, p.1019-1025, 1983. ZAMBELLI, D.; CUNTO, M.; PRATI, F.; MERLO, B. Effects of ketamine or medetomidine administration on quality of eletrocejaculated sperm flow in the domestic cat. Theriogenology, v. 68, p. 796-83, 2007. Tabela 1: Volume médio (± DP) do ejaculado (com ou sem espermatozóides), máximos e míninos obtidos na eletroejaculação em gatos domésticos utilizando quatro diferentes protocolos anestésicos. Protocolos anestésicos Ejaculado A B C D (μL) Com espermatozóides Sem espermatozóides 8,64 ± 7,10 14,50 ± 19,55 10,24 ± 6,05 51,07 ± 106,63 (5 - 25) (4 - 90) (4 - 20) (5 - 400) 13,24 ± 10,89 11,25 ± 4,79 18,62 ± 28,72 18,70 ± 26,85 (5 - 40) (5 - 15) (2 - 105) (4 - 110) A: protocolo de anestesia dissociativa de cetamina e xilazina (n=28 ejaculados); B: protocolo de anestesia dissociativa tiletamina e zolazepam (n=29 ejaculados); C: protocolo de anestesia dissociativa tiletamina, zolazepam e tramadol (n=32 ejaculados); D: protocolo de anestesia inalatória (indução com cetamina, diazepam e manutenção com isoflurano - n= 37 ejaculados). (P>0,05) Tabela 2: Média ± DP do volume, da motilidade e vigor espermáticos obtidos na eletroejaculação em gatos domésticos utilizando quatro diferentes protocolos anestésicos. Parâmetros Protocolos anestésicos Volume Motilidade Vigor (μL) (%) (0 - 5) A 11,43 ± 9,71a 42,73 ± 25,92a 2,66 ± 1,21ab B 14,41 ±17,94a 46,67 ± 50,33ab 1,67 ± 1,44a C 10,50 ± 8,88a 54,64 ± 40,78ab 2,93 ± 1,82ab D 30,95 ± 69,28a 55,73 ± 29,32b 3,08 ± 1,22b A: anestesia dissociativa de cetamina e xilazina (n=15 ejaculados); B: anestesia dissociativa tiletamina e zolazepam (n=3 ejaculados); C: anestesia dissociativa tiletamina, zolazepam e tramadol (n=14 ejaculados); D: anestesia inalatória (indução com cetamina, diazepam e manutenção com isoflurano n=22 ejaculados). a,b Letras diferentes representam diferença entre linhas (P<0,05). 5.3. Capítulo 3: Artigo enviado para publicação na Revista Brasileira de Zoociências Biometria da genitália externa e parâmetros seminais de gatos domésticos mantidos em fotoperíodo equatorial natural Ticiana Franco Pereira da Silva*,Camila Louise Ackermann, Francisco Tiago Silva Pinheiro, Leonardo Tavernezi, Lúcia Daniel Machado da Silva Laboratório de Reprodução de Carnívoros - FAVET, PPGCV, UECE Av. Paranjana, 1700, Cep 60740-903, Fortaleza, CE, Brasil Fone: (85) 3101-9860; Fax: (85)3101-9840 e-mail: *[email protected] Resumo: Para gatos domésticos, poucas informações estão disponíveis sobre o volume testicular e se este parâmetro pode ou não predizer o potencial reprodutivo de um animal. O objetivo do trabalho foi avaliar os parâmetros seminais e biometria da genitália externa em gatos domésticos submetidos ao fotoperíodo equatorial natural e verificar a ocorrência de correlações entre eles. Quinze gatos machos púberes foram treinados à ejaculação em vagina artificial. O sêmen dos 7 machos que se adaptaram ao método de coleta foi avaliado quanto aos parâmetros de volume, coloração, motilidade e vigor espermático, concentração espermática, número total de espermatozóides e porcentagem de alterações morfológicas. Após anestesia, foi realizada aferição da consistência, volume testicular, e comprimento peniano, verificação do aspecto e da presença ou ausência de espículas penianas. O teste de correlação de Spearman foi aplicado, porém o volume testicular não apresentou correlações com os parâmetros de concentração espermática, n° total de espermatozóides, volume seminal, peso corporal, comprimento peniano e grau de espículas penianas. Conclui-se que em condições de fotoperíodo equatorial natural, os valores de volume testicular não é indicado nesta espécie, até o momento, para predizer outros parâmetros reprodutivos. Palavras-chave: concentração espermática, volume testicular, vagina artificial e felino. Abstract: In domestic cats, few information about testicular volume are avaiable and if this parameter can predict or not the reproductive potencial of an animal. The aim of this study was to analyze the sperm parameters and the genital biometrie of domestic cats under natural equatorial photoperiod and verify the existence of correlation among then. Fifteen tom cats were trained to ejaculate in artificial vagina. The semen of the seven one that had the best adaptation was analyzed for the parameters of volume, color, motility, vigour, sperm concentration and the percentual of abnormal spermatozoa. The analyses of testicular consistence, testicular volume, penis length and presence of penis spines were done under anesthesy. The Spearman rank correlation coefficient was applied, but the parameters of sperm concentration, total number of spermatozoa, seminal volume, body weight, penis length and penis spines degree were not correlated with testicular volume. In conclusion, under natural equatorial photoperiod, until the moment, the testicular volume is not indicated as predictive test for another reproductive paramethers. Key words: sperm concentration, testicular volume, artificial vagina and feline. INTRODUÇÃO Sabe-se que o volume testicular é uma forma utilizada para predizer a capacidade reprodutiva em ruminantes (BALEY et al., 1998). Cerca de 70-80% da massa testicular constitui-se de túbulos seminíferos, podendo o volume testicular refletir a espermatogênese (GOULETSOU et al., 2007). O volume testicular é usualmente calculado durante exame andrológico de carnívoros silvestres, desde felídeos (MORATO et al., 1999; MORAIS et al., 2002; ERDMANN et al., 2005), a quatis (QUEIROZ, 2007) e também primatas (PAZ et al., 2006). Em cães, poucos e divergentes estudos foram realizados abordando a relação entre as características seminais e parâmetros biométricos da genitália externa (OLAR et al., 1983; ENGLAND, 1991). Nesta espécie, na raça Pastor Alemão, a circunferência escrotal não foi correlacionada com a concentração espermática (CORTEZ et al., 2002). Para gatos domésticos, poucas informações estão disponíveis sobre o volume testicular (JOHNSTON et al., 2001; TEBET, 2004), em especial aquelas que indiquem que o parâmetros biométricos da genitália externa possam ou não predizer o potencial reprodutivo de um animal. A estacionalidade reprodutiva observada em outras espécies animais ainda é controversa nos machos de gatos domésticos. Segundo Stornelli (2007), esta está diretamente relacionada com o número de horas de luz diárias (fotoperíodo) a qual os animais estejam submetidos em localizações geográficas onde exista marcada variação da duração do dia durante o ano. Entretanto, trabalhos realizados através de coletas epididimárias ao longo do ano em diferentes localizações afirmam não haver variação na qualidade ou quantidade de espermatozóides recuperados de gatos domésticos (38° de latitude norte - SPINDLER & WILDT, 1999) até a ocorrência de moderada sazonalidade (52° de latitude norte - BLOTTNER & JEWGNOW, 2007). Em condições equatoriais, não foram encontradas informações sobre a qualidade espermática ou sazonalidade de gatos domésticos, sendo as informações limitadas ao comportamento sexual das fêmeas da mesma espécie durante os períodos chuvoso (SILVA et al., 2006) e seco (MACIEL, 2006). Informações sobre a qualidade seminal de gatos domésticos mantidos sobre fotoperíodo de 12h de luz/dia são necessárias para a melhor compreensão da fisiologia reprodutiva dos animais de zonas equatoriais e aplicação de biotécnicas. Assim, o objetivo deste trabalho foi verificar a existência de correlação entre os parâmetros seminais e biometria da genitália externa em gatos domésticos submetidos ao fotoperíodo equatorial natural. MATERIAL E MÉTODOS ANIMAIS Foram utlizados 15 gatos machos púberes sem raça definida (SRD), provenientes do gatil experimental da Universidade Estadual do Ceará, Fortaleza/ Ceará (3º 44’ de latitude sul e 38° 34’ de longitude oeste, clima equatorial semi-úmido e aproximadamente 12h diárias de luz natural ao longo do ano). Os animais foram mantidos em gaiolas individuais e alimentados com ração comercial de manutenção para gatos (Kitekat®- Éffem®, Brasil), recebendo água à vontade. Todos os animais já haviam sido previamente submetidos à coleta de sêmen por eletroejaculação (EEJ), e ejacularam com conteúdo espermático em pelo menos uma coleta, mostrando possuírem produção espermática. Os animais antes de cada coleta por EEJ foram pesados em balança mecânica. COLETA DE SÊMEN As coletas foram realizadas entre maio de 2006 a junho de 2007. Todos os animais foram antes submetidos a um período de treinamento de no mínimo 2 meses (2 a 3 tentativas de coleta por semana) para ejaculação em vagina artificial. A vagina artificial foi manufaturada utilizando-se o dispositivo de borracha de um conta-gotas acoplado a um tubo plástico de 1,5 mL desprovido de tampa. Para a coleta do sêmen por este método, o animal era solto no seu ambiente de coleta para demarcação territorial e reconhecimento da área, e então, apresentado a uma gata em estro natural, sendo-lhe permitido cortejar a fêmea. O estro foi determinado como o momento da aceitação de cópula, quando a fêmea permitia a fixação pela nuca e lateralização da cauda em resposta à tentativa de intromissão peniana, entretanto a cópula para todos os casos foi impedida pelo observador. Por ocasião da monta, inicialmente o observador com a mão enluvada realizou massagem peniana com os espaços interdigitais indicador e médio ou médio e anelar para que o macho viesse a ejacular sobre a luva, permitindo uma melhor adaptação ao manuseio de pênis durante a coleta. Após um período para a aceitação da coleta sobre a luva, a vagina artificial era posicionada entre os dedos de forma a permitir a penetração do pênis do gato, vindo este a ejacular no interior do tubo, sendo o sêmen imediatamente destinado à avaliação. Os tubos de coleta foram trocados quando necessário, até que fosse obtido ejaculado contendo células espermáticas. Durante o treinamento, alterações comportamentais (ausência de libido, desistência da coleta, não aceitação da vagina artificial ou agressividade frente às gatas ou manipulador) foram observadas. MORFOBIOMETRIA A morfobiometria foi realizada após anestesia para coleta de sêmen por EEJ. Para este procedimento foram previamente submetidos a um jejum alimentar de 24h e hídrico de 12h, e foram contidos farmacologicamente com uma das associações: cloridrato de cetamina (15 mg/Kg - Dopalen®,Vetbrands®, Brasil) e cloridrato de xilazina (1 mg/Kg - Anasedan®, Vetbrands®, Brasil), por via IM; cloridrato de tiletamina e zolazepam (15 mg/Kg - Zoletil ®, Virbac, Brasil e Telazol®, Fort Dodge Saúde Animal Ltda ®, Brasil) por via IM; cloridrato de tiletamina e zolazepam (15 mg/Kg), e tramadol (2 mg/Kg - Sylador®, Sanofi Synthelabo Ltda®, Brasil) por via IM; e indução anestésica com cloridarato de cetamina (15 mg/Kg) e diazepam (1mg/Kg Compaz®, Cristália®, Brasil) por via IM, e manutenção em isoflurano (Isoforine®, Cristália®, Brasil). Imediatamente após a coleta por EEJ, foi procedida a limpeza e secagem da genitália externa (testículos, prepúcio e pênis) com um papel toalha não áspero quando necessário. A aferição do volume testicular (VT- cm3) foi realizada com paquímetro (comprimento, largura e espessura em cm), O volume testicular foi calculado pela fórmula: VT= C x L2 x 0,524, sendo C= comprimento, L= largura e 0,524 a constante para cálculo de áreas esferóides. O VT dos animais foi expresso por testículo, e também o volume testicular total (VTT), sendo este a soma dos volumes testiculares de cada animal (MORAIS et al., 2002). Foi também raelizada palpação para determinação de sua consistência em duros, firmes ou normais e flácidos (MOREIRA & MORATO, 2007). O pênis foi exposto para verificação do aspecto (presença de aderências ou lesões), formato (cônico), comprimento (cm) e da presença ou ausência de espículas penianas classificadas, segundo MORAIS et al. (2002) em graus, variando de 0 (ausência) a 3 (tamanho de aproximadamente 0,75mm). ANÁLISE DO SÊMEN Imediatamente após a coleta do sêmen, foram observadas as características macroscópicas de volume (através de micropipetas de 2 a 50μL) e coloração; e microscópicas: porcentagem de espermatozóides móveis (motilidade) e o vigor espermático (0 a 5), através de microscopia de luz (100x e 400x). Uma alíquota foi destinada à mensuração da concentração espermática (106 sptz/mL), através de uma câmara de Neubauer em microscópio óptico de luz (400x). O número total de espermatozóides foi calculado a partir da concentração espermática e volume do ejaculado. A porcentagem de alterações morfológicas espermáticas foi avaliada em microscópia de contraste de fase (1000x) por coloração em Rosa de Bengala (CARDOSO, 2005), sendo os espermatozóides classificados como normais ou anormais quando apresentavam algum defeito de acrossoma, cabeça, peça intermediária ou cauda. ANÁLISE ESTATÍSTICA Os parâmetros de motilidade, vigor, volume, concentração espermática, número total de espermatozóides, alterações morfológicas, volume testicular, comprimento peniano e grau de espículas penianas foram expressos na forma de média e desvio padrão. O aspecto peniano e a consistência testicular e a coloração do sêmen foram descritos subjetivamente. O teste de correlação de Spearman (Stat View for Windows®, SAS Institute Inc., Versão 5.0, 1998) foi aplicado para VTT e o peso corporal, a concentração espermática, o volume do ejaculado, o n° total de espermatozóides) e aos parâmetros biométricos de comprimento peniano e grau de espículas penianas. Os dados morfométricos relativos aos animais que não ejacularam em vagina artificial foram descartados da correlação entre parâmetros seminais e biométricos. RESULTADOS E DISCUSSÃO A coleta de sêmen por vagina artificial não é considerada um método prático de avaliação andrológica de animais em ambiente clínico, sendo útil para gatos domésticos de colônias (PLATZ & SEAGER, 1978; AXNÈR & LINDE-FORSBERG, 2002), e nestas condições já foi utilizado por vários autores (SOJKA et al., 1970; PLATZ et al., 1978; TANAKA et al., 2000; TSUTSUI et al., 2000ab, 2001; SÁNCHEZ & TSUTSUI, 2002; VILLAVERDE, 2007). Apesar de todos os machos terem demonstrado em pelo menos uma coleta por EEJ possuírem produção espermática, o treinamento para a coleta por vagina artificial permitiu a seleção dos animais quanto ao parâmetro comportamental. Dos 15 machos avaliados, 2 animais não apresentaram interesse por nenhuma das manequins utilizadas, sendo que 1 apresentou-se em todas as tentativas sem libido, e o outro com episódios de ausência de libido e agressividade à fêmea. Outros 2 animais, apresentaram grande interesse pela fêmeas testadas, cercando-as e cheirando-as, entretanto, sendo agressivos em todas as tentativas com a fêmea ou com o manipulador, não sendo possível realizar a coleta sem riscos à gata e ao manipulador durante o procedimento. Todos os demais gatos ejacularam pelo menos 1 vez em vagina artificial, corroborando a presença de produção espermática previamente avaliada por EEJ. Entretanto, a rotina de coletas consecutivas só foi obtida em 7 machos. Assim, apesar do sucesso no treinamento para coleta por vagina (73,33% dos machos treinados), o que está em acordo com os percentuais descritos na literatura por PLATZ & SEAGER (1978), somente 46,66% adaptaram-se à rotina laboratorial de coletas. Um período de adaptação maior que 3 semanas, período geralmente descrito, foi necessário à coleta por vagina artificial. AXNÈR & LINDE-FORSBERG (2002) afirmam que o gato mesmo que treinado, se colocado em ambiente que não é o seu usual, provavelmente não ejaculará. Assim, este método é útil para gatos domésticos de colônias. Entretanto, em alguns gatos com temperamento mais agressivo esta é uma prática que oferece inúmeros riscos às pessoas que irão manipular o animal. Acrescenta-se com este experimento, que mesmo gatos já treinados no seu ambiente podem não ejacular. A coleta por vagina artificial envolveu uma série de fatores, desde a experiência do manipulador e o conhecimento do comportamento individual dos animais utilizados, do ambiente (como demarcação territorial prévia, ausência de barulhos externos que atrapalhassem a concentração do animal na manequim e piso adequadamente seco), do tamanho da abertura da borracha da vagina artificial (com maior ou menor compressão do pênis), e principalmente da fêmea a ser utilizada como manequim. As gatas foram utilizadas em estro médio, com comportamento sexual bastante evidente e tolerante à presença do macho sobre o seu dorso com as mordidas na nuca durante vários minutos. Fêmeas em estro inicial ou tardio, fêmeas jovens inexperientes ou naturalmente agressivas em estro muitas vezes atrapalharam a eficiência da coleta, sendo necessária a troca de 2 ou 3 manequins durante o procedimento. Uma alternativa seria o treinamento dos animais a ejacular em vagina com auxílio de uma manequim inanimada, utilizando-se animais de pelúcia, como já relatado por VILLAVERDE (2007). Outro entrave observado durante as coletas foi a formação de anéis de pêlo em torno do pênis que acabaram por vezes causando uma constrição peniana e atrapalhando a coleta. Segundo FELDMANN & NELSON (1996), este acúmulo de pêlos pode ocorrer nas tentativas frustradas de penetração pelo macho, com o friccionar do pênis sobre a região lombo-sacra da fêmea. Os machos por vezes pararam o cortejo na tentativa de retirar com lambeduras o anel, porém, nem sempre conseguiam e após várias tentativas de penetração na vagina, cansavam-se e desistiam do procedimento. Assim, nos casos necessários, a coleta foi interrompida para retirada do anel de pêlos por fricção com os dedos ou com pinça, levando, em algumas coletas, a pequenos sangramentos penianos que inviabilizaram a coleta de sêmen deste animal por 24 a 48h. Quando os animais apresentaram anéis de pêlo com constrição peniana, em geral, recusaram-se a coletas consecutivas no mesmo dia. Ferimentos e dor no momento da coleta podem diminuir a confiança do macho no manipulador e inviabilizar a utilização deste macho felino para futuros procedimentos de coleta por vagina artificial. Todos os animais apresentaram espículas penianas, estando compatível com o normal para a espécie (ELLENPORT, 1986; JOHNSTON et al., 2001). A observação da presença das espículas penianas é realizada em felídeos, embora a classificação do grau não seja rotineiramente descrita pelos autores. São descritas espículas penianas: presentes e proeminetes em gato-do-mato-pequeno (Leopardus tigrinus), jaguatirica Leopardus pardalis (MORAIS et al., 2002), gato-do-mato-grande (Leopardus geoffroy), gato-palheiro (Leopardus colocolo) e gato-mourisco (Puma yagouaroundi) (MOREIRA & MORATO, 2007); presentes, arredondadas, chatas e espaçadas na glande em onça pintada - Panthera onca (SILVA et al., 2003; MOREIRA & MORATO, 2007); e ausentes no gato-maracajá - Leopardus weiidi (MORAIS et al., 2002). SILVA et al. (2003) relataram em um macho de onça pintada espículos de grau 3. A presença dos espículos é andrógeno-dependente e parece estar correlacionada ao estímulo vaginal que culmina na ovulação (MORAIS, 1999; JOHNSTON et al., 2001). O formato, aspecto peniano e a consistência testicular foram considerados normais para todos os animais. Os valores obtidos para os parâmetros biométricos avaliados, peso corporal estão expressos na Tabela 1. Os valores obtidos para comprimento, largura e espessura estão acima dos descritos por JOHNSTON et al. (2001), que descrevem testículos em média de 1,5 x 1 x 1 cm cada. O valor de volume testicular total obtido no presente trabalho também supera os descritos por a por TEBET (2004) de 3,52 ± 0,7 cm3, embora o peso corporal médio dos animais do pesente trabalho seja 1kg inferior aos descritos por este autor (4,5 kg). Para outros felídeos brasileiros do mesmo porte, como o gato-do-mato-pequeno, os valores obtidos na literatura variam de 2,3 (ERDMANN et al., 2005) a 4,2 cm3 (MORAIS et al., 2002). Foi obtido um total de 41 ejaculados dos 7 machos que melhor se adaptaram à vagina artificial. Os parâmetros seminais avaliados estão descritos na Tabela 2. A concentração espermática em gatos domésticos pode oscilar com o método de coleta (STORNELLI, 2007). SOJKA et al. (1970) obtiveram concentração média (1730 x 106 sptz/mL) dos ejaculados de gatos domésticos coletados por vagina artificial próximas às obtidas no presente trabalho. Em 8 amostras (19,51%) que apresentavam concentração acima de 580 x 106 sptz/mL, motilidade espermática de 100% e o vigor 5, observou-se motilidade massal ou turbilhonamento. A motilidade e o vigor espermáticos são parâmetros muito variáveis em relação ao tempo de abstinência sexual (AXNÈR & LINDE-FORSBERG, 2002). O percentual de alterações morfológicas está dentro do limite aceitável para gatos domésticos, já que gatos com até 40% de alterações morfológicas, são ainda considerados normospérmicos. Entretanto, gatos com alterações morfológicas acima deste patamar podem ainda possuir boa fertilidade após monta natural (PUKAZHENTHI et al., 2001; AXNÈR & LINDE-FORSBERG, 2002). Os valores médios obtidos demonstram a boa qualidade seminal dos gatos utilizados. Os parâmetros de coloração e volume também foram considerados normais para a espécie (AXNÈR & LINDE-FORSBERG, 2002). Em fotoperíodo equatorial, as fêmeas de gato doméstico apresentam comportamento sexual ao longo de todo ano (SILVA, 2003; MACIEL, 2006), já que a diferença entre dia mais curto e mais longo do ano é de apenas 5 minutos, não sendo suficiente para promover alteração no eixo pineal-hipófisegonadal. Assim, acredita-se que a qualidade espermática do gato doméstico nestas condições também não apresente variações na coleta em relação ao período do ano, entretanto, isto não pode ser comprovado, já que as coletas não foram realizadas de forma distribuída ao longo das estações e períodos do ano. O parâmetro de volume testicular apresentou baixas correlações não significativas entre os parâmetros de concentração espermática, n° total de espermatozóides, volume seminal, peso corporal, comprimento peniano e grau de espículas penianas. Os valores obtidos e seus graus de significância estão descritos na tabela 3. Não foram encontradas descrições científicas que aplicassem teste de correlação entre parâmetros seminais e biométricos em gatos domésticos. A ausência de correlações significativas entre parâmetros seminais e biométricos também foi observada para onças pintadas de cativeiro, realizando-se coletas a cada 2 meses em 4 machos (7 avaliações por macho- MORATO et al., 1999). Na jaguatirica, correlações positivas e significativas entre o volume testicular, peso corporal (r= 0,58) e o número total de espermatozóides no ejaculado (r= 0,59) foram obtidas por MORAIS (1999). O mesmo autor obteve correlação positivas e significativas entre o volume testicular, peso corporal (r= 0,65) em gato-maracajá. Para ambas as espécies, foram utilizados 3 animais coletados mensalmente por 14 meses. O tamanho da amostra utlizada no presente trabalho associada a uma baixa variabilidade pode ter contribuído para os resultados alcançados. Sabe-se ainda que a ejaculação retrógrada é freqüentemente observada durante ejaculação natural ou EEJ no gato doméstico, com percentuais de 15 a mais de 90% (DOOLEY et al., 1991). Assim, é possível que a coleta por vagina artificial possa não ter refletido corretamente o volume do ejaculado, a concentração espermática e o n° total de epermatozóides, com parte do ejaculado indo em direção à bexiga urinária. O volume do ejaculado também é regulado pelo volume de secreção das glândulas acessórias, que nos felídeos são a próstata e bulbouretrais (AXNÈR & LINDEFORSBERG, 2002). Observa-se na prática que, em geral, a ejaculação de amostras mais concentradas aconteceu com menos tempo de contato entre o macho e a fêmea, ou seja, em um ritual (cortejo, monta, ejaculação) mais rápido. Quando o cortejo foi mais lento, com ejaculação ocorendo após a segunda ou terceira monta e fixação na nuca, em geral, vários tubos de coleta foram utilizados até que fosse obtido ejaculado contendo células espermáticas, podendo esta observação refletir uma maior estimulação e ejaculação de secreção de glândulas acessórias. Sugere-se que novas avaliações do volume testicular de gatos domésticos sejam realizadas em diferentes fotoperíodos e estações do ano, já que em condições de fotoperíodo equatorial natural, os resultados obtidos demonstram que este parêmetro não é, até o momento, indicado para avaliar os reprodutores. AGRADECIMENTOS Ao CNPQ, à CAPES e à FUNCAP pelo custeio do experimento e pelas bolsas de pesquisas concedidas. Ao Centro de Controle de Zoonoses de Fortaleza pela concessão das vacinas anti-rábicas aplicadas nos animais. À FUNCEME pela concessão dos dados climáticos. REFERÊNCIAS BIBLIOGRÁFICAS AXNÈR, E. & LINDE-FORSBERG, C. 2002. Semen collection and assessment, and artificial insemination in the cat. In: CONCANNON, P.W.; ENGLAND, G. C. W; VERSTEGEN, J. & LINDE-FORSBERG, C. Recent Advances in Small Animal Reproduction. New York: International Veterinary Information Service. Disponível em: < http:// www.ivis.org/>. -Acesso em: 08 jan. 2003. BALEY, T. L.; HUDSON, R. S.; POWE, T. A.; RIDDELL, M.G.; WOLFE, D. F. & CARSON, R. L. 1998. Caliper and ultrasonographic measurements of bovine testicules and a mathematical formula for determining testicular volume and weight in vivo. Theriogenology, 49: 581-594. BLOTTNER, S. & JEWGNOW, K. 2007. Moderate seasonality in testis function of domestic cats. Reprod. Dom. Anim., 42: 536-540. CORTEZ, A .A.; AQUINO-CORTEZ, A.; SILVA, A. R.; CARDOSO, R. C. S. & SILVA, L. D. M. 2002. Relação entre perímetro escrotal e concentração espermática em cães, clinicamente normais da raça Pastor Alemão. Arq. Bras. Méd. Vet. Zootec., 54 (5): 549-550. DOOLEY, M. P.; PINEDA, M. H.; HOPPER, J. G. & HSU, W. H. 1991. Retrograde flow of spermatozoa into the urinary bladder of cats during electroejaculation, collection of semen with artificial vagina, and mating. Am. J. Vet. Res., 52 (5) : 687- 691. ELLENPORT, C. R. 1986. Aparelho urogenital de carnívoros, p.1481-1493. In: GETTY, R. (ed.) Sisson/Grossman Anatomia dos Animais Domésticos. 5ª ed.. Rio de Janeiro, Guanabara Koogan. 2000p. ENGLAND, G. C, W. 1991. Relationships between ultrasonographic appearance, testicular size, spermatozoal output and testicular lesions in the dog. J. Small Anim. Pratic., 32: 306-311. ERDMANN, R. H. 2005. Exame reprodutivo, contenção farmacológica e criopreservação de sêmen em gato-do-mato-pequeno (Leopardus tigrinus Scherber, 1775). Dissertação de Mestrado, Universidade Federal do Paraná, Curitiba. 70p. ERDMANN, R. H; JUVENAL, J. C.; MORAES, W.; CUBAS, P.; CARVALHO, A. L. & MOREIRA, N. 2005. Estudo reprodutivo em gato-do-mato-pequeno (Leopardus tigrinus Schreber, 1775). Arch. Vet. Sc., 10 (2): 75-79. FELDMAN, E.C. & NELSON, R.W. 1996. Breeding, Pregnancy, and Parturition, p. 547-571. In: FELDMAN, E.C.; NELSON, R.W. (ed.). Canine and Feline Endocrinology and Reproduction. Philadelphia, Saunders Company.785p. GOULETSOU, P. G.; GALATOS, A. D. & LEONTIDES, L .S. 2007. Comparasion between ultrasonografic and caliper measurements of testicular volume in the dog, Anim. Reprod. Sci., doi:10.1016/j.anireprosci.2007.06.020. JOHNSTON, S. D., KUSTRITZ, M. V. R., OLSON, P. N. S. 2001. Canine and Feline Theriogenology. Philadelphia, W. B. Saunders. 592p. MACIEL, I. A. 2006. Estudo comportamental e colpocitológico do ciclo estral de gatas domésticas (Felis catus) mantidas sem cópula no período seco no município de Fortaleza (Brasil). Dissertação de Mestrado, Universidade Estadual do Ceará. 76 p. MORAIS, R. N. 1999. Fisiologia reprodutiva de pequenos felinos Leopardus pardalis, Linnaeus, 1758; Leopardus weidii, Schinz,1821; e Leopardus tigrinus, Schreber, 1775: sobre a função testicular (gametogênica e esteroidogênica) de machos em cativeiro, incluindo variações sazonais. Tese de Doutorado, Universidade de São Paulo. 177 p. MORAIS, R.N.; MUCIOLO, R.G.; GOMES, M.L.F.; LACERDA, O.; MORAES, W.; MOREIRA, N.; GRAHAM, L.H.; SWANSON, W. F. & BROWN, J.L. 2002. Seasonal analysis of semen caracteristics, serum testosterone and fecal androgens in the ocelot (Leopardus pardalis), margay (L. weidii) and tigrina (L. tigrinus). Theriogenology, 57: 2027-2041. MORATO, R. G.; GUIMARÃES, M. A. B. V.; FERREIRA, F.; VERRESCHI, I.T.N.; BARNABE, R. C. 1999. Reproductive characteristics of captive male jaguars (Panthera onca). Braz. J. Vet. Res. Anim. Sci., 36 (5): 1-8. MOREIRA, N. & MORATO, R. G. 2007.Técnicas de Reprodução Assistida em Felídeos Neotropicais, p.1280-1288. In: CUBAS, Z. S.; SILVA, J. C. R. & CATÃO-DIAS, J. L.Tratado de Animais Selvagens- Medicina Veterinária. São Paulo, Roca. 1354p. OLAR, T. T.; AMANN, R. P. & PICKETT, B. W. 1983. Relationships among testicular size, daily production and output of spermatozoa and extragonadal spermatozoa reserves of dog. Biology of Reproduction, 29: 1114- 1120. PAZ, R. C. R.; TEIXEIRA, R. H. F. & GUIMARÃES, M. A. B. V. 2006. Avaliação das características seminais de macacos pregos (Cebus apella) mantidos em cativeiro, antes e após vasectomia bilateral. Braz. J. Vet. Res. Anim. Sci, 13 (4): 561-567. PLATZ, C. C.; WILDT, D. E. & SEAGER, S. W. 1978. Pregnancy in the domestic cat after artificial insemination with previously frozen semen spermatozoa. J. Reprod. Fertil, 52: 279-282. PLATZ, C. C. & SEAGER, S. W. J. 1978. Semen collection by electroejaculation in the domestic cat. J. Am. Vet. Med. A., 173: 1353-1355. PUKAZHENTHI, B. S.; WILDT, D. E. & HOWARD, J. G. 2001. The phenomenon and significance of teratospermia in felids. J. Reprod. Fertil.Suppl., 57: 423-433. QUEIROZ, J. P. A. F. 2007. Estabelecimento de um método para coleta de sêmen de quatis (Nasua nasua). Monografia de Graduação, Universidade Federal Rural do Semi-Árido. 57p. SÁNCHEZ, A. & TSUITSUI, T. 2002. Evaluación de dos diluyentes seminales para preservación refrigerada de espermatozoides de gato (Felis catus). Nova técnica. Rev. Cient. de la Facultad de Ciencias Veterinarias de Zulia, 4: 249-253. SILVA, A. R.; MATOS, M. R. F.; CARDOSO, R. C. S; SILVA, T. F. P.; UCHOA, D.; FILGUEIRA, K. D.; CARDOSO, J. F. S.; AGUIAR, L.; MONTEIRO, C. L. B; SILVA, L. D. M.; AGUIAR, G. V. & MORATO, R. G. 2003. Avaliação Andrológica de uma Onça Pintada (Panthera onça) Oriunda da Região Norte do Brasil. Rev. Bras. Reprod. Anim., 27 (2): 217-218. SILVA, T. F. P. 2003. Comportamento sexual de gatas domésticas mantidas sem cópula em clima equatorial semi-úmido. Dissertação de Mestrado, Universidade Estadual do Ceará. 75p. SILVA, T. F. P.; SILVA, L.D.M.; UCHOA, D. C.; MONTEIRO, C. L. B. & THOMAZ, L. A.. 2006. Sexual characteristics of domestic queens kept in a natural equatorial photoperiod. Theriogenology, 66: 1476-1481. SOJKA, N. J; JENNINGS, L.; L. & HAMNER C. E. 1970. Artificial insemination in the cat (Felis catus). Lab. Anim. Care, 20: 198-204. SPINDLER, R. E. & WILDT, D. E. 1999. Circannual variations in intraovarian oocyte but not epididymal sperm quality in the domestic cat. Biology of Reproduction, 61: 188-194. STORNELLI, M. A. 2007. Evaluación de semen en el gato doméstico: análisis de rutina y metodologías especiales felino. Rev. Bras. Reprod. Anim, 31, (1): 135-140. TANAKA, A.; KUWABARA, S.; TAKAGI, Y.; NAKAGAWA, K.; FUJIMOTO, Y.; MURAI, M. & TSUTSUI, T. 2000. Effect of ejaculation intervals on semen quality in cats. J. Vet. Med. Sci, 62 (11): 1157-1161. TEBET, J. M. 2004. Efeito da criopreservação sobre a célula espermática em três espécies de felinos: o gato-do-mato-pequeno (Leopardus tigrinus, Schreber, 1775), a jaguatirica (Leopardus pardalis, Linnaeus, 1758) e o gato doméstico (Felis catus). Tese de Doutorado, Universidade Estadual Paulista. 115 p. TSUTSUI, T.; TANAKA, A.; TAKAGI, Y.; NAKAGAWA, K.; FUJIMOTO, Y. & MURAI, M. 2000a. Unilateral intrauterine horn insemination of fresh semen in cats. J. Vet. Med. Sci, 62 (12): 1241-1245. TSUTSUI, T.; TANAKA, A.; TAKAGI, Y.; NAKAGAWA, K.; FUJIMOTO, Y. & MURAI, M. 2000b. Unilateral intrauterine horn insemination of frozen semen in cats. J. Vet. Med. Sci, 62 (12): 1247-1251. TSUTSUI, T.; TANAKA, A. & HORI, T. 2001. Intratubal insemination with fresh semen in cats. J. Reprod. Fertil., Suppl. 57: 347-351. VILLAVERDE, A. I. S. B. 2007. Comparação entre dois métodos de inseminação artificial utilizando sêmen congelado em gatos domésticos. Dissertação de Mestrado, Universidade Estadual Paulista. 101 p. Tabela 1: Média ± desvio padrão do peso corporal e da biometria dos testículos, comprimento e grau de espículas do pênis de gatos domésticos mantidos em fotoperíodo equatorial natural (n=15). Parâmetros Valores Comprimento do testículo direito 2,19 ± 0,29 cm Comprimento do testículo esquerdo 2,08 ± 0,30 cm Largura do testículo direito 1,54 ± 0,21 cm Largura do testículo esquerdo 1,59 ± 1,9 cm Espessura do testículo direito 1,22 ± 0,12 cm Espessura do testículo esquerdo 1,21 ± 0,16 cm Volume testicular direito 2,83 ± 0,96 cm3 Volume testicular esquerdo 2,89 ± 0,89 cm3 Volume testicular total 5,66 ± 1,61 cm3 Peso Corporal 3,74 ± 0,45 Kg Comprimento do pênis 0,92 ± 0,11 cm Graus de espículas penianas 2,5 ± 0,50 Tabela 2: Média ± desvio padrão dos parâmetros seminais obtidos de ejaculados de gatos domésticos mantidos em fotoperíodo equatorial natural coletados por vagina artificial (n= 7). Parâmetros Coloração Volume Concentração espermática Valores Branco-opalescente a leitoso 42, 53 ± 25,08 μL (14,00 – 135,00) 1.306,25 ± 1.401,63 (130,00 – 7260,00) x 106 sptz/mL N° total de sptz Motilidade Vigor Alterações Morfológicas Totais 54,01± 62,60 x 106 sptz (2,88– 304,92) 93,95 ± 8,53 % (70,00 – 100,00) 4,69 ± 0,61 (2,00 – 5,00) 24,29 ± 11,74 % (3 – 48) Tabela 3: Tamanho da amostra (N), valores de correlação (r) e de probabilidade (P) obtidos na aplicação da correlação de Sperman entre parâmetros seminais e biométricos de gatos domésticos mantidos em fotoperíodo equatorial natural coletados por vagina artificial. Correlações N r P VTT x CE 7 0,12 0,47 VTT x N° total de sptz 7 0,05 0,77 VTT x Volume seminal 7 - 0,07 0,66 VTT x Peso corporal 15 0,34 0,20 VTT x Comprimento do pênis 15 0,34 0,20 VTT x Grau de espículas peniana 15 0,20 0,45 VTT= volume testicular total CE= concentração espermática 5.4. Capítulo 4: Inseminação artificial intravaginal com sêmen fresco de gatos domésticos diluído em água de coco em pó (ACP-117®): resultados preliminares [Intravaginal artificial insemination with domestic cats semen diluted in powdered coconut water (ACP-117®)] Ticiana Franco Pereira da Silva1*, Camila Louise Ackermann2, Francisco Tiago Silva Pinheiro2, Leonardo Tavernezi2, Daniel Falcão Menezes Brilhante1, Henna Roberta Quinto1, Lúcia Daniel Machado da Silva3 1 2 Doutoranda - PPGCV, FAVET/ UECE Graduando (a) em Medicina Veterinária, UECE 3 Prof. Adjunto, FAVET/ UECE Laboratório de Reprodução de Carnívoros – PPGCV, FAVET/ UECE Av. Paranjana, 1700, CEP 60740-903, Fortaleza, CE, Brasil Fone: (85) 3101-9860; Fax: (85)3101-9840 e-mail: *[email protected] Resumo O objetivo deste trabalho foi avaliar o uso do ACP-117® como diluidor do sêmen de gatos domésticos para inseminação artificial intravaginal. Foram utilizados 11 ejaculados de 5 machos adultos coletados por vagina artificial. Os parâmetros de qualidade seminal e volume foram avaliados para o sêmen fresco e diluído em ACP117®. Quatro fêmeas em estro natural receberam 250 UI de hCG por via intra-muscular e foram inseminadas no 2° e 4° dia do estro pela via intravaginal com o sêmen diluído em ACP-117®. A motilidade e o vigor espermáticos não foram alterados pela diluição, entretanto observou-se um aumento das alterações morfológicas após a diluição. Nenhuma gestação se desenvolveu. Conclui-se que o uso da diluição do sêmen fresco de gatos domésticos com ACP-117® não altera a motilidade e o vigor espermático, entretanto o protocolo descrito para IA intravaginal utilizado não foi adequado, necessitando de ajustes no protocolo e um maior número de inseminações. Palavras-chave: sêmen, água de coco em pó, inseminação artificial, gato. Abstract The aim of this study was to evaluate the use of powdered coconut water (ACP-117®) as seminal extender for intravaginal artificial insemination in domestic cats. Eleven ejaculates of five toms were collected by artificial vagina. The parameters of volume and semen quality were analyzed for fresh and diluted semen in ACP-117®. Four queens in natural estrus received 250 UI of hCG, IM and were submitted to intravaginal artificial insemination in the second and forth day of estrus with semen diluted in ACP-117®. The motility and vigour did were not affected by the dilution, but it was observed an increase of spermatic morphological defects after semen dilution. None gestation was carried out. In conclusion, the use of dilution of domestic cat semen in ACP-117® did not affect motility and vigour, but the protocol for intravaginal artificial insemination used was not suitable and adjustments in the protocol and more inseminations are necessary. Key Words: semen, powdered coconut water, artificial insemination, cat. Introdução A água proveniente do fruto do coqueiro Cocos nucifera L. (membro da família Palmae) é uma solução estéril, ligeiramente ácida, contendo proteínas, sais, açúcares, vitaminas, fatores de crescimento (fitormônios) e muito pouco fosfolipídeo (LAGUNA, 1996). A água de coco contém ainda outros compostos que mostram atividades semelhantes àquelas das citocininas (NUNES e SALGUEIRO, 1999). Nunes e Combarnous (1995) isolaram o ácido 3-indol-acético na água de coco, verificando que a mesma apresentava uma ação benéfica sobre a motilidade do sêmen de caprinos e ovinos incubado a 37 °C. Apesar da água de coco ser um diluente eficiente na conservação do sêmen de diversas espécies, era necessário preparar a solução para cada utilização. Para permitir a conservação do produto por um longo período, foi desenvolvida a água de coco em pó (ACP®). O líquido endospérmico do coco é transformado em pó fino e uniforme, amorfo, destituído de água livre, com alta solubilidade (NUNES et al., 2005). O ACP® recebe uma denominação de acordo com a espécie, e para felinos é o ACP-117®. Desde então, o uso do ACP® vem sendo utilizado na diluição para inseminação artificial (IA) em caprinos (SALGUEIRO et al., 2002) e cães (UCHOA et al., 2004). Entretanto, não há relatos de seu uso para IA em gatos domésticos ou felídeos silvestres. Na década de 70 surgiram os primeiros relatos de coleta e conservação de sêmen de gatos domésticos (PLATZ et al, 1978) e de IA (SOJKA et al., 1970; PLATZ et al, 1978). Desde então, a tecnologia de sêmen vem ganhando espaço cada vez mais crescente nos estudos de reprodução. A IA é utilizada principalmente nos casos de problemas em acasalamentos naturais por não aceitação do macho pela fêmea, ou o inverso, limitações físicas ou, em animais selvagens, a agressividade natural da espécie (LUVONI et al., 2003). Esta técnica evita o contato entre os animais, diminuindo o risco de transmissão de doenças sexualmente transmissíveis ou infecto-contagiosas (VILLAVERDE e LOPES, 2007). Poucos são os relatos de IA intravaginal com sêmen fresco de gatos domésticos, com taxas de concepção de 50, 78 e 33%, utilizando-se sêmen diluído em solução salina (SOJKA et al., 1970), tris (CHATDARONG et al., 2007) e tris frutose citrato e gema de ovo (TANAKA et al., 2000b), respectivamente. Mais estudos são necessários para o aperfeiçoamento do protocolo de IA em gatos, para que a IA possa ser aplicada em um futuro breve para fins comerciais. Assim, o objetivo do presente trabalho foi avaliar o efeito do ACP-117® sobre a qualidade seminal de gatos domésticos e seu uso como extensor de sêmen para IA intravaginal. Material e Métodos 1. Animais Foram utilizados 5 gatos machos púberes e 4 fêmeas sem raça definida (SRD), pesando entre 2,5 e 4 kg, provenientes do gatil experimental da Universidade Estadual do Ceará, Fortaleza/ Ceará (3º 44’ de latitude sul e 38° 34’ de longitude oeste, clima equatorial semi-úmido e aproximadamente 12h diárias de luz natural ao longo do ano). Os animais foram mantidos em gaiolas individuais e alimentados com ração comercial de manutenção para gatos (Kitekat®- Éffem®, Brasil), recebendo água à vontade. Todos os animais já haviam sido previamente submetidos à coleta de sêmen por vagina artificial, possuindo características seminais normais para a espécie segundo JOHNSTON et al. (2001). 2. Coleta de sêmen Os animais foram então submetidos à coleta de sêmen em vagina artificial, sendo esta manufaturada utilizando-se o dispositivo de borracha de um conta-gotas acoplado a um tubo plástico de 1,5 mL desprovido de tampa. Para o procedimento, o animal era solto no recinto de coleta para demarcação territorial e reconhecimento da área, e então, apresentado a uma gata em estro natural, sendo-lhe permitido cortejar a fêmea. O estro foi determinado como o momento da aceitação de cópula, quando a fêmea permitia a fixação pela nuca e lateralização da cauda em resposta à tentativa de intromissão peniana, entretanto a cópula para todos os casos foi impedida pelo observador. Por ocasião da monta, inicialmente o observador com a mão enluvada realizou massagem peniana para a entrada em ereção e posicionou a vagina artificial entre os dedos de forma a permitir a penetração do pênis do gato, vindo este a ejacular no interior do tubo, sendo o sêmen imediatamente destinado à avaliação. Os tubos de coleta foram trocados quando necessário, até que fosse obtido ejaculado contendo células espermáticas. 3. Análise e diluição do sêmen Imediatamente após a coleta do sêmen, os ejaculados foram observados em microscopia de luz (100 e 400x) em relação à presença ou não de células espermáticas. Aqueles contendo células espermáticas, foram avaliados quanto às características macroscópicas de volume e coloração, e microscópicas de porcentagem de espermatozóides móveis (motilidade) e o vigor espermático (0 a 5). A porcentagem de alterações morfológicas espermáticas foi avaliada em microscópia de contraste de fase (1000x) por coloração de uma alíquota do sêmen em Rosa de Bengala. Os espermatozóides foram classificados como normais ou anormais quando apresentavam algum defeito cabeça, peça intermediária ou cauda. A concentração espermática (106 sptz/mL) foi avaliada através de uma câmara de Neubauer em microscópio óptico (400x). Durante as análises de motilidade, vigor e concentração espermática o sêmen foi mantido em banho-maria a 37°C. O ACP-117® foi fabricado após uma etapa prévia de mensuração do pH e ajuste do diluidor ao sêmen felino realizada com 10 ejaculados de 9 gatos domésticos através de fitas (D52348, Macherey-Nagel®, Alemanha). Assim, o ACP -117® foi ajustado ao pH de 8,2. A reconstituição do ACP-117® foi preparada segundo as recomendações do fabricante, adicionando-se 2,63g do pó a 50 mL de água destilada, seguido de homogeinização. Alíquotas do ACP-117® reconstituído foram congelas a 10°C e no momento de sua utilização foram descongeladas e mantidas em banho-maria a 37°C. Após a retirada das alíquotas para análises do sêmen fresco, o sêmen foi diluído em ACP-117® até que um volume de 100 μL da diluição sêmen-diluidor fosse atingido. Imediatamente após a diluição, o sêmen diluído foi avaliado quanto aos parâmetros de porcentagem de espermatozóides móveis e o vigor espermático e porcentagem de alterações morfológicas espermáticas. O número total de espermatozóides utilizado na IA foi calculado apartir da concentração espermática do ejaculado. 4. Inseminação artificial (IA) As fêmeas com fertilidade comprovada por parição em ciclos anteriores foram avaliadas diariamente quanto à exibição dos sinais de comportamento estral. A citologia vaginal foi utilizada para confirmar o momento adequado da IA (≥ 70% de células queratinizadas). A citologia foi realizada através da introdução de uma escova interdental umedecida com solução salina fisiológica (0,9% de NaCl), rolagem em lâmina de vidro, coloração em panótico rápido e leitura em microscopia óptica de luz (100 e 400X). Durante a coleta de sêmen, as fêmeas, no 2° e 4° dias do estro foram tranqüilizadas por via intramuscular com acepromazina (1 mg/kg) e xilazina (0,5 mg/kg) e no 2° dia do estro a ovulação foi induzida por uma administração de 250UI de hCG, por via IM. O sêmen foi depositado através de uma seringa de 1mL após introdução de uma sonda urinária tom cat na porção caudal da vagina em sentido crânioascendente, mantendo-se o trem posterior da fêmea elevado. A elevação do trem posterior foi mantida por 15 minutos após a injeção do sêmen. Para diagnóstico gestacional e avaliação uterina, foram realizadas avaliações por ultra-sonografia abdominal aos 15, 22, 29 e 36 dias após a primeira IA. 5. Análise Estatística Os parâmetros de volume, porcentagem de espermatozóides móveis, vigor, concentração espermática, número total de espermatozóides e porcentagem de alterações morfológicas foram expressos na forma de média e desvio padrão. A porcentagem de espermatozóides móveis, após conversão em arco-seno, foi comparada entre o sêmen fresco e diluído pelo teste t-Student e o vigor pelo teste de Mann Whitney. A porcentagem de alterações morfológicas entre o sêmen fresco e diluído foi comparada por ANOVA seguida de do teste de Fisher PLSD. Para todos os parâmetros, considerou-se p<0,05 (Stat View for Windows®, SAS Institute Inc., Versão 5.0, 1998). Os resultados da IA foram analisados de forma descritiva. Resultados e Discussão Foram obtidos 11 ejaculados dos 5 machos. Os parâmetros seminais obtidos estão descritos na Tabela 1. O volume, a concentração espermática, motilidade, vigor e alterações morfológicas estão dentro da normalidade para a espécie através da coleta por vagina artificial tanto para o sêmen fresco, como diluído em ACP-117® (SOJKA et al., 1970; PLATZ et al., 1978; TANAKA et al., 2000ab). Em 6/11 amostras (54,54%) que apresentavam motilidade espermática de 100% e vigor 5, observou-se motilidade massal ou turbilhonamento. O preparo do ACP® seguido de congelação a -10°C e descongelação já foi utilizado para cães com o ACP-106® (CARDOSO, 2005). Entretanto neste caso, o diluidor foi acresido de 20% de gema de ovo e adicionado ao sêmen canino à temperatura ambiente, destinando-se à criopreservação. A estocagem a -10°C não afetou a criopreservação, e segundo o descrito, tornou o uso do diluidor mais prático, evitando seu preparo a cada coleta. Com o uso do ACP-106® como extensor seminal, ou seja, com utilidade semelhante ao utilizado no presente trabalho, relata-se em cães não haver alteração ou haver uma discreta melhora na motilidade e no vigor com a diluição de 0,5 a 2 mL de fração seminal com ACP-106® preparado no momento da coleta, até atingir 6 mL de volume inseminante (UCHOA, 2004, comunicação pessoal). No presente trabalho, embora a motilidade e vigor médios não tenham sido afetados após a diluição com ACP-117®, o percentual de alteraçõers morfológicas demonstrou uma predominância de alterações de cauda (> 72% das anormalidades), em grande parte de enrolamento de cauda. Pode-se supor que uma pequena alteração na composição fisicoquímica do diluidor após a congelação-descongelação possa ter induzido a alterações morfológicas, sem no entanto ter afetado a motilidade e o vigor espermático. A avaliação subjetiva destes últimos parâmetros, em especial de amostras muito concentradas pode induzir a erros de avaliação e superestimação dos valores. Outra possibilidade, é que o pH e a osmolaridade do diluidor utlizado, não sejam as ideiais para o uso com sêmen de gatos domésticos, entretanto a avaliação de osmolaridade de cada amostra antes da diluição não foi realizada devido ao peuqeno vloume seminal da espécie. Tabela 1: Valores (média ± desvio padrão) obtidos para o sêmen fresco de gatos domésticos e diluído em ACP-117® (n= 11 ejaculados). Valores Parâmetros Sêmen Fresco Sêmen Diluído Coloração Branco-opalescente a leitoso - Volume 36,73 ± 21,04 µL 100 uL Concentração espermática 1329,09 ± 966,62 x 106 sptz/mL - Motilidade 97,73% ± 4,10a 84,55% ± 31,58a Vigor 4,86 ± 0,32 a 4,18 ± 1,66 a Normais 81,82% ± 7,49a 62,32% ± 13,79b Anormais 18,18% ± 7,49a 37,68% ± 13,79b Alterações Morfológicas a,b Letras diferentes representam diferença entre colunas (P<0,05). O número médio de espermatozóides utilizado em cada IA foi de 48,06 ± 6 14,48 x 10 sptz, com mínimo de 7,20 e máximo de 144,48 x 106 sptz. O número de espermatozóides recomendado é bastante variável entre autores, tendo sido obtido gestação com sêmen a fresco via intravaginal com 1,25 x 106 sptz (SOJKA et al.,1970) a 80 x 106 sptz (TANAKA et al., 2000b). Embora o número de espermatozóides para IA utilizado tenha sido alcançado, nenhuma das gatas inseminadas apresentou diagnóstico gestacional positivo. Uma fêmea apresentou mucometra na primeira avaliação ultrasonográfica e foi tratada com prostaglandina F2α (1 μg/kg, 2x ao dia por 3 dias) e enrofloxacina (5mg/kg, 1x ao dia por 5 dias), sendo realizadas avaliações ultrasonográficas até não fosse mais visualizado imagem de conteúdo uterino. Uma fêmea que apresentou estro após a confirmação do diagnóstico negativo, e a fêmea tratada após apresentar novo estro, foram novamente submetidas ao protocolo de IA, perfazendo assim 6 protocolos de IA realizados. A ausência de gestação pode ter sido ocasionada por uma falha metodológica na inseminação, como a escolha da indução de ovulação no momento da IA no 2°dia de estro, ou do efeito da diluição do sêmen com o ACP-117®. Certo refluxo foi observado com a injeção do sêmen na vagina através da sonda tom cat, fazendo com que o procedimento tivesse que ser executado lentamente de forma a evitar ao máximo a perda seminal. Logo após a introdução de aproximadamente 0,5 cm da sonda urinária tom cat não era mais possível a sua introdução, porque a vagina da gata é curta e provavelmente atingiu-se o fórnix da vagina (AXNÉR et al., 1998). Assim, retirava-se um pouco a sonda em sentido caudal a fim de possibilitar o fluxo seminal. O volume de 100 μL da diluição sêmen-diluidor foi utilizado segundo as recomendações da literatura para IA intravaginal com sêmen fresco (SOJKA et al.,1970; TANAKA et al., 2000b). Embora o recomendado por alguns autores seja não ultrapassar o limite de 100 μL (VILLAVERDE e LOPES, 2007), outros afirmam que pode ser utilizado até 250μL da diluição por este método (CHATDARONG et al., 2007). A IA foi executada preferencialmente com o sêmen do mesmo macho nos 2 dias de estro. Somente em uma gata não foi possível executar os dois procedimentos de IA pela ausência de fornecimento de ejaculado por quaisquer dos machos utilizados. A escolha do uso de fêmeas em estro natural com a aplicação de 205 UI de hCG no segundo dia de estro foi baseada em resultados descritos por TANAKA et al. (2000b), também utilizando IA intravaginal com sêmen fresco, entretanto realizando-se a primeira IA de 15 a 30h após hCG. No presente trabalho, optou-se por aplicar no momento da IA, segundo CHATDARONG et al. (2007), utilizando gatas também em estro natural. Entretanto, pela ausência de dosagem de progesterona, torna-se impossível determinar se no presente experimento a dose de hCG e o momento da indução de ovulação foram realmente adequados. Por via intravaginal com sêmen a fresco, SOJKA et al. (1970) obteve 50% de taxa de concepção, de TANAKA et al. (2000b) 78% e 33,3% de CHATDARONG et al. (2007). O insucesso da técnica também pode ser devido ao baixo número de repetições, frente as 20 e 45 repetições relatadas na literatura, respectivamente por CHATDARONG et al. (2007) e TANAKA et al. (2000b). Não se descarta também a possibilidade da falha de fertilidade estar vinculado aos machos, já que nem todos haviam sido submetidos a teste de fertilidade prévio. Mais estudos e repetições com melhores adequações do protocolo devem ser realizados a fim de descartar o efeito da diluição do sêmen de gatos domésticos com ACP-117®. Conclusão O uso da diluição do sêmen fresco de gatos domésticos com ACP-117® não altera a motilidade e o vigor espermático, entretanto o protocolo descrito para IA intravaginal utilizado não foi adequado, necessitando de ajustes no protocolo e um maior número de inseminações. Agradecimentos Ao CNPQ, à CAPES e à FUNCAP pelo custeio do experimento e pelas bolsas de pesquisas concedidas. Ao Centro de Controle de Zoonoses de Fortaleza pela concessão das vacinas anti-rábicas aplicadas nos animais. À FUNCEME pela concessão dos dados climáticos. Referências AXNÉR, E.; HOLST STRÖM, B.; LINDE-FORSBERG, C. Morphology of spermatozoa in the cauda epididymidis before and after electroejacutation and a comparision with ejaculated spermatozoa in the domestic cat. Theriogenology, v.50, p.973-979, 1998. CARDOSO, R.C.S. Características in vitro do espermatozóide canino criopreservado em água de coco. 2005. 197p. Tese (Doutorado em Ciências Veterinárias) – Universidade Estadual do Ceará, Fortaleza, 2005. CHATDARONG, K.; AXNÉR, E.; MANEE-IN, S.; THUWANUT, P.; LINDEFORSBERG, C. Pregnacy in the domestic cat after vaginal or transcervical insemination with fresh and frozen sêmen. Theriogenology, v.68, p. 1326- 1333, 2007. JOHNSTON, S. D., KUSTRITZ, M. V. R.; OLSON, P. N. S. Canine and Feline Theriogenology. Philadelphia: W. B. Saunders. 2001, 592p. LAGUNA, L.E. Determinações físico-químicas da água de coco verde em duas variedades (Cocus nucifera) coco da praia e anão. 1996. 55f. Monografia (Especialização em Produção e Reprodução de Pequenos Ruminantes) – Universidade Estadual do Ceará, Fortaleza, 1996. LUVONI, G.C.; KALCHSCHMIDT, E.; LEONI, S.; RUGGIERO, C. Conservation of feline semen. Part I: cooling and freezing protocols. J. Fel. Med. Surg., p. 1-6, 2003. NUNES, J. F.; COMBARNOUS, Y. Utilização da água de coco como diluidor do sêmen dos mamíferos domésticos. In: I SIMPÓSIO DE BIOTECNOLOGIA DA REPRODUÇÃO DE ANIMAIS DOMÉSTICOS, 1995, Fortaleza. Anais...Fortaleza, 1995. p.53-63. NUNES, J. F.; SALGUEIRO, C.C.M. Utilização da água de coco como diluidor do sêmen de caprinos e ovinos. Rev. Cient. Prod. Animal, v. 1, p.17-26, 1999. NUNES, J.F.; SALGUEIRO, C.C.M.; GONDIM, J.M. Novos produtos com base na água de coco em pó. In: 12ª SEMANA INTERNACIONAL DA FRUTICULTURA, FLORICULTURA E AGROINDÚSTRIA - FRUTAL 2005, Fortaleza. Anais... Fortaleza: FRUTAL, 2005. PLATZ, C. C.; WILDT, D. E.; SEAGER, S. W. Pregnancy in the domestic cat after artificial insemination with previously frozen semen spermatozoa. J. Reprod. Fertil, v. 52, p. 279-282, 1978. SALGUEIRO, C. C. M.; NUNES, J.F.; OLIVEIRA, K. L. P.; VIEIRA, V. E.; GONDIM, J. M.; MATEOS-REX, E. Utilização de diluentes á base de água de coco “in natura” e em pó na inseminação artificial programada de cabras. Rev. Bras. Reprod. Anim., Supl., n.5, p.96-98, 2002. SOJKA, N. J.; JENNINGS, L. L.; HAMNER, C. E. Artificial insemination in the cat (Felis catus). Lab. Anim. Care, v. 20, p.198-204. 1970. TANAKA, A.; KUWABARA, S.; TAKAGI, Y.; NAKAGAWA, K.; FUJIMOTO, Y.; MURAI, M.; TSUTSUI, T. Effect of ejaculation intervals on semen quality in cats. J. Vet. Med. Sci, v. 62, n.11, p.1157-1161, 2000a. TANAKA, A.; TAKAGI, Y.; NAKAGAWA, K.; FUJIMOTO, Y.; HORI, T; TSUTSUI, T. Artificial intravaginal insemination using fresh semen in cats. J. Vet. Med. Sci, v. 62, p.1163-1167, 2000b. UCHOA, D.C.; SILVA, T.F.P.; ARAUJO, A.A.; SILVA, L.D.M. Uso da água de coco em pó (ACP-106®) na inseminação artificial com sêmen a fresco em cadelas. In: IX SEMANA UNIVERSITÁRIA – UECE, 2004, Fortaleza. Anais... Fortaleza, UECE, 2004. VILLAVERDE, A. I. S. B.; LOPES, M. D. É possível realizar inseminação artificial em gatas na minha clínica? Clínica Veterinária, n.70, 2007. 5.5. Capítulo 5: Criopreservação de sêmen de gatos domésticos em meio à base de água de coco em pó ACP-117® (Criopreservation of domestic cats semen in media based on coconut powered water ACP-117®) Ticiana Franco Pereira da Silva1*, Camila Louise Ackermann2, Francisco Tiago Silva Pinheiro2, Leonardo Tavernezi2, Cláudia da Cunha Barbosa1, Lúcia Daniel Machado da Silva3 1 2 Doutoranda - PPGCV, FAVET/ UECE Graduando (a) em Medicina Veterinária, UECE 3 Prof. Adjunto, FAVET/ UECE Laboratório de Reprodução de Carnívoros – PPGCV, FAVET/ UECE Av. Paranjana, 1700, Cep 60740-903, Fortaleza, CE, Brasil Fone: (85) 3101-9860; Fax: (85)3101-9840 2 Médica Veterinária Autônoma e-mail: *[email protected] Resumo O objetivo do trabalho foi avaliar o uso do ACP-117® na criopreservação de sêmen de gatos domésticos. Seis gatos foram coletados por vagina artificial, e o sêmen foi avaliado quanto ao volume, coloração, motilidade e vigor espermático, concentração espermática, funcionalidade de membrana plasmática, e porcentagem de alterações morfológicas e espermatozóides vivos e mortos. O sêmen foi diluído em ACP-117® e 20% de gema de ovo (50 x 106 sptz/mL) e submetido ao resfriamento (15°C/ 40 min e 4°C/ 30 min). O ACP 117® -gema de ovo acrescido de glicerol (concentração final de 6%) foi adicionado ao sêmen. Os ejaculados foram congelados em vapor de nitrogênio líquido e armazenados a -196 °C. O sêmen foi descongelado (37 °C/ 1 min) e os parâmetros espermáticos foram avaliados. Parte dos ejaculados também foram submetidos ao teste de termorresistência e análise computadorizada de sêmen (CASA). Após a diluição, motilidade e vigor mantiveram-se semelhante ao sêmen a fresco, havendo uma redução significativa após o resfriamento (P>0,05). Após a descongelação, os valores de motilidade e vigor foram 25,07% ± 21,40% e 3,44 ± 1,28%. A motilidade progressiva no CASA foi de 4,79 ± 5,17%. No teste de termorresistência. a motilidade e o vigor espermático se mantiveram por 20 min. As alterações morfológicas, totais e secundárias, espermatozóides mortos e perca da funcionalidade de membrana foram superiores pós-descongelação (P>0,05). Conclui-se que o protocolo utilizado para criopreservação de sêmen de gatos domésticos em ACP117® permite baixa viabilidade in vitro dos espermatozóides pós-descongelação. Palavras-chave: sêmen, água de coco, gato, criopreservação. Abstract The aim of this study was to evaluate the use of ACP-117® for the preservation of domestic cat sperm. Six cats were colleted by artificial vagina, and the sperm was analyzed for the parameters of volume, color, motility, vigour, sperm concentration, acrosomal status, percentual of abnormal spermatozoa, functionality of membrane and the percentual of alive or dead spermatozoa. The semen was initially extended in ACP117® and 20% of egg yolk (50 x 106 sptz/mL) and submitted to cooling (15°C/ 40 min and 4°C/30 min). The ACP 117® -egg yolk- glycerol (final concentration of 6%) was added to the sperm. The ejaculates were submitted to frozen in nitrogen vapor and stored in liquid nitrogen (-196 °C). The samples were thawed (37 °C/ 1 min) and the spermatic parameters were analyzed. Part of the ejaculates was also submitted to thermoresistance tests and computer aided semen analysis (CASA). After dilution, the motility and vigour were similar to fresh semen, beginning significant reduction after cooling (P>0.05). After thawing, motility and vigor values were 25.07% ± 21.40% and 3.44 ± 1.28%. The progressive motility in CASA was 4.79 ± 5.17%. In the thermoresistance tests, motility and vigour were maintained for 20 min. The total and secondary percentage of sperm abnormalities, dead sperm and the lost of functionality of membrane post-thaw were greater. In conclusion, the protocol used for domestic cat semen criopreservation in ACP-117® allow low in vitro post-thaw viability. Key Words: semen, coconut water, cat, criopreservation. Introdução O aumento da criação de gatos alavanca um mercado de produtos e serviços especializados, além de criar uma demanda por biotecnologias, em especial as reprodutivas, já que muitos criam não só por hobby, mas também como uma atividade comercial. Isto gera a necessidade dos criadores em potencializar a capacidade reprodutiva de seus animais (SILVA JÚNIOR, 2002). Entre estes serviços, encontram-se a avaliação andrológica e inseminação artificial (IA- STORNELLI & STORNELLI, 2001). Para o uso comercial da IA em gatos, um dos entraves são os protocolos de conservação do sêmen felino. A conservação de sêmen, seja pelo resfriamento ou pela congelação, permite o transporte de material genético de animais de alto valor comercial por longas distâncias, facilitando significativamente a criação comercial e possibilitando, também, a troca de sêmen entre populações selvagens geograficamente isoladas, restaurando o vigor genético (LUVONI et al., 2003). Uma alternativa bastante discutida para a preservação de espécies e da variabilidade genética é o banco de genoma, o qual armazenaria a longo prazo, material genético criopreservado, incluindo gametas e embriões de espécies ameaçadas de extinção (MORAIS et al., 2002). Além de serem animais de companhia, os gatos têm importante papel como modelo experimental, permitindo o aperfeiçoamento do conhecimento dos processos biológicos e reprodutivos a serem aplicados aos felídeos selvagens (LUVONI et al, 2003). Assim, protocolos de criopreservação de sêmen podem ser inicialmente testados em gatos domésticos e depois avaliados nas diferentes espécies selvagens. O sêmen felino vem sendo conservado segundo o padrão adotado para outras espécies carnívoras, com grande variação de protocolos entre os autores. Os resultados pós-descongelação são bastante variáveis entre autores, desde < 30% (TSUTSUI et al., 2000) a > 70% (PLATZ et al., 1978) de espermatozóides móveis. Os diluidores de sêmen ainda mais empregados são o Tes e o Tris, isolados, adicionado de frutose ou glicose (HAY & GOODROWE, 1993), ou em conjunto, constituindo o TesT (AXNER, 1998; SÁNCHEZ & TSUTSUI, 2002). Nos protocolos de conservação, estes diluidores são em geral adicionados de 20% de gema de ovo (HAY & GOODROWE, 1993) e nos casos de congelação de 3% (HAY & GOODROWE, 1993) a 4% de glicerol (ZAMBELLI et al, 2002). Os resultados obtidos com os estudos com a água de coco in natura na conservação de células espermáticas em capotes (MILITÃO et al., 1994), caprinos (SALGUEIRO et al., 2002), ovinos (NUNES, 1995), suínos (TONIOLLI e MESQUITA, 1990) e cães (CARDOSO, 2001); e a necessidade do preparo da solução para cada utilização, levaram à elaboração de um meio de conservação à base de água de coco em pó (ACP®), facilitando sua conservação. O ACP® recebe uma denominação de acordo com o pH e a osmolaridade do sêmen de cada espécie, e para felinos é denominado de ACP-117®. Em cães (ACP-106®), para testes in vitro, foi empregado no resfriamento (MADEIRA et al., 2004; CARDOSO, 2006) e na congelação (CARDOSO, 2005), e in vivo como extensor para IA com sêmen a fresco (UCHOA et al., 2004). Entretanto, ainda não havia sido empregado em gatos domésticos ou qualquer outra espécie felídea. Assim diante da necessidade de desenvolvimento de diluidores e protocolos de conservação de sêmen capazes de garantir bons resultados pós-descongelação, objetivou-se avaliar, segundo o protocolo descrito para cães, o uso do ACP-117® na criopreservação de sêmen de gatos domésticos. Material e Métodos 1.Animais Foram utlizados 6 gatos machos púberes e sem raça definida (SRD), pesando entre 3 e 4 kg, provenientes do gatil experimental da Universidade Estadual do Ceará, Fortaleza/ Ceará (3º 44’ de latitude sul e 38° 34’ de longitude oeste, clima equatorial semi-úmido e aproximadamente 12h diárias de luz natural ao longo do ano). Os animais foram mantidos em gaiolas individuais e alimentados com ração comercial de manutenção para gatos (Kitekat®- Éffem®, Brasil), recebendo água à vontade. Todos os machos já haviam sido previamente submetidos à coleta de sêmen por vagina artificial, possuindo características seminais normais para a espécie segundo JONHSTON et al. (2001). 2. Coleta de sêmen Os animais foram submetidos à coleta de sêmen em vagina artificial, sendo esta manufaturada utilizando-se o dispositivo de borracha de um conta-gotas acoplado a um tubo plástico de 1,5 mL desprovido de tampa. Para o procedimento, o animal era solto no recinto de coleta para demarcação territorial e reconhecimento da área, e então, apresentado a uma gata em estro natural, sendo-lhe permitido cortejar a fêmea. O estro foi determinado como o momento da aceitação de cópula, quando a fêmea permitia a fixação pela nuca e lateralização da cauda em resposta à tentativa de intromissão peniana, entretanto a cópula para todos os casos foi impedida pelo observador. Por ocasião da monta, inicialmente o observador com a mão enluvada realizou massagem peniana para a entrada em ereção e posicionou a vagina artificial entre os dedos de forma a permitir a penetração do pênis do gato, vindo este a ejacular no interior do tubo, sendo o sêmen imediatamente destinado à avaliação. Os tubos de coleta foram trocados quando necessário, até que fosse obtido ejaculado contendo células espermáticas. Foram processados de 3 a 4 ejaculados por animal. 3. Análise do sêmen Imediatamente após a coleta do sêmen, os ejaculados foram observados em microscopia de luz (100 e 400x) em relação à presença ou não de células espermáticas. Aqueles contendo células espermáticas, foram avaliados quanto às características macroscópicas de coloração e volume, e microscópicas de porcentagem de espermatozóides móveis (motilidade) e o vigor espermático (0 a 5). A concentração espermática (106 sptz/mL) foi avaliada através de uma câmara de Neubauer em microscópio óptico (400x), através da diluição de 2μL do sêmen em 400μL de solução salina formolizada a 0,1%. Durante as análises de motilidade, vigor e concentração espermática o sêmen foi mantido em banho-maria a 37°C. Somente ejaculados com um mínimo de 70% de motilidade e 3,0 de vigor foram destinados ao processamento. A porcentagem de alterações morfológicas espermáticas e a integridade acrossomal foram avaliadas em microscópia de contraste de fase (1000x) por coloração de uma alíquota do sêmen em de um corante constituído por 1,5% de Rosa Bengala acrescido de formol citrato a 1% (1:15). A mistura permaneceu em repouso por cerca de 60 segundos e então uma gota desta mistura foi colocada sobre uma lâmina de vidro e recoberta por lamínula para observação. Para a integridade acrossomal considerou-se sua presença, ausência, destacamento, edemaciação e vesiculação. Os espermatozóides foram classificados como normais ou anormais quando apresentavam algum defeito de cabeça, peça intermediária ou cauda, sendo classificados os defeitos em primários e secundários (CARDOSO, 2005). Para avaliar a funcionalidade da membrana, foi realizado o teste hiposmótico, no qual uma alíquota de sêmen foi diluída água destilada (1: 9), permanecendo esta mistura em banho-maria a 37 °C por 30 minutos (TEBET, 2004). Na avaliação realizada em microscopia ótica de luz (400x) considerou-se o percentual de espermatozóides com cauda enrolada como apresentando funcionalidade preservada. A avaliação do percentual de espermatozóides vivos ou mortos foi realizada em microscopia ótica de luz (400x) com o esfregaço de uma alíqüota de sêmen corada com corante à base de azul de bromofenol (1:1), na qual somente os espermatozódes que se apresentassem completamente descorados à leitura imediata eram classificados como vivos (contagem de 100 células- BARBOSA, 2007). Para o percentual de alterações morfológicas, vivos e mortos e funcionalidade de membraba, foram contados 200, 100 e 100 células, respectivamente. 4. Criopreservação Seguiu-se o protocolo de criopreservação em ACP-106®, descrito por CARDOSO (2005) para cães. A reconstituição do ACP-117® de pH 8,2 e 310 mOsm/L (ACP-117®, ACP Biotecnologia®, Fortaleza-Ceará, Brasil) foi preparada segundo as recomendações do fabricante, adicionando-se 2,63g do pó a 50 mL de água destilada, seguido de homogeinização. Alíquotas do ACP-117® reconstituído foram congelas a -10°C e no momento de sua utilização foram descongeladas em banho-maria a 37°C. Antes da adição do sêmen à temperatura ambiente (± 28°C), o ACP-117® foi modificado, substituindo-se 20% de seu volume por 20% de gema de ovo, constituindo o ACP-117®-gema. Este foi fracionado em duas porções, sendo a 1a porção adicionada ao sêmen imediatamente após a coleta e análise inicial à temperatura ambiente (± 28°C), e a 2a porção do diluidor acrescida de 12% de glicerol. Após a diluição inicial do sêmen com a 1ª porção ACP-117®-gema, permitindo uma concentração de 50 x 106 sptz/mL, os tubos de vidro foram acondicionados em banho-maria com água à temperatura ambiente em caixa plástica térmica com gelo biológico a 15 °C por 40 min. Ao final deste período, o sêmen levado ainda em banho-maria à geladeira a 4 °C por 30 min. A 2a porção do diluidor foi então adicionada ao sêmen, fornecendo uma concentração final de glicerol de 6%. Cinco minutos após a glicerolização, o sêmen foi envasado em palhetas de 250 μL e expostas aos vapores de nitrogênio de -70°C em caixa de isopor por 5 min, distando as palhetas 5 cm do nível de nitrogênio líqüido. Ao final deste período, foram acondicionados em botijão de nitrogênio a –196 °C. Motilidade e vigor foram avaliados após diluição, resfriamento a 15°C e 4°C; e glicerolização. 5. Descongelação e análise do sêmen 5.1. Análise subjetiva do sêmen Após um intervalo mínimo de uma semana, foi realizada a descongelação por imersão das palhetas em banho-maria a 37°C por um minuto, depositando-se o sêmen em tubos aquecidos a 37°C. Imediatamente, o sêmen descongelado foi avaliado quanto à motilidade e vigor espermáticos em microscopia de luz (100x). 5.2. Análise computadorizada do sêmen Dez amostras (1 a 2 ejaculados de cada animal) foram destinadas à análise computadorizada da motilidade espermática, com auxílio de um microscópio de contraste de fase acoplado a uma vídeo-câmara adaptada ao sistema Sperm Class Analyser® (SCA, Microptic S.L., versão 3.2.0). Dois μl de cada amostra foram colocados em uma Câmara de Makler® (Sel-Medical Instruments), previamente aquecida a 37ºC, sendo avaliados os parâmetros de motilidade total (MT, %), motilidade progressiva (MP, %), velocidade média da trajetória do espermatozóide (VAP, μm/s) e percentual de sub-populações de espermatozóides com velocidade média (VAP 55 a 95 μm/s) e rápida (VAP > 95 μm/s). 5.3. Teste de Termorresistência Dez amostras (1 a 2 ejaculados de cada animal) do sêmen descongelado foram avaliadas quanto à longevidade espermática pelo teste de termorresistência em microscopia de luz (100x) quanto à motilidade e vigor espermáticos imediatamente após a descongelação e a cada 10 min durante 60 min (T0 a T60). No tempo T0, foi procedido o teste hiposmótico e a avaliação do percentual de espermatozóides vivos e mortos, como descrito para o sêmen fresco. Nos tempos T0, e T60 de incubação também foram avaliadas a morfologia espermática e integridade do acrossoma, com lâminas coradas com rosa de bengala. 6. Análise Estatística Os resultados de coloração foram descritos subjetivamente e os demais parâmetros de análise subjetiva e computadorizada foram expressos na forma de média e desvio padrão. Os dados percentuais sofreram transformação angular. ANOVA seguida do teste de Fisher PLSD foi utilizada para comparar a motilidade e o vigor, alterações morfológicas, porcentagem de espermatozóides vivos, e membrana funcional entre os diferentes etapas. Para todos os parâmetros, considerou-se p<0,05 (Stat View for Windows®, SAS Institute Inc., Versão 5.0, 1998). Resultados e Discussão Foram utilizados 23 ejaculados para o processamento inicial de diluição, resfriamento, glicerolização e envase. Os resultados de motilidade e vigor espermáticos obtidos para o sêmen a fresco estão descritos na Tab 1. Grande variação no volume e na concentração foi encontrada entre as amostras, mas todos os dados encontram-se dentro da normalidade para a espécie, segundo SOJKA et al. (1970) e AXNER e LINDEFORSBERG (2002). Os mesmos parâmetros avaliados nas diferentes etapas avaliadas pré-congelação, expressos nos Gráficos 1 e 2, também revelam bons resultados com o uso do ACP117®. Entretanto, mesmo a ação protetora das lipoproteínas de membrana incluídas na fração de baixa densidade da gema de ovo, protegendo a célula por interação com a membrana plasmática, pode não ter sido suficiente para proteger de forma efetiva os danos causados pelo abaixamento da temperatura. Sabe-se que gema de ovo previne o enrolamento da cauda do espermatozóide, favorecendo sua motilidade (HOLT, 2000). Assim, a baixa dissolução da gema, observada pela grande quantidade de grumos à microscopia óptica e no CASA, pode também ter afetado a motilidade e o vigor espermático associado à redução da temperatura. O método de congelação empregado no presente trabalho não permitiu o controle efetivo da velocidade do resfriamento. BAUDI (2005) também utilizando resfriamento em geladeira relata para sêmen de gatos domésticos e para mais duas espécies de felídeos silvestres, a jaguatirica (Leopardus pardalis) e o gato-do-mato-pequeno e (L tigrinus) que independente da taxa de resfriamento utilizada (lenta ou rápida) há redução significativa na motilidade e no vigor pós-descongelação, assim como o observado no presente trabalho. Após a etapa de glicerolização, observou-se uma queda significativa da motilidade e do vigor em relação à diluição inicial, bem como no resultado pós-descongelação. A injúria pós-descongelação sofrida pelo espermatozóide e outras células viáveis ocasionada pela retirada brusca do glicerol é geralmente atribuída ao choque osmótico (FRIM e MAZUR, 1983, SCHNEIDER e MAZUR, 1984). Para sêmen felino, preconiza-se a adição de 3% (HAY & GOODROWE, 1993) a 4% de glicerol (ZAMBELLI et al, 2002), e concentrações de 8% de glicerol são consideradas tóxicas aos espermatozóides felinos (ZAMBELLI et al., 2002). Bons resultados nos testes iniciais com TRIS acrescido de 20% de gema e 6% de glicerol e o mesmo protocolo de criopreservação empregado neste trabalho realizado em nosso laboratório (SILVA et al., comunicação pessoal), levou-nos a realizar as avaliações da congelação do sêmen felino com o ACP-117® com esta concentração de glicerol. Entretanto, sugerem-se novas avaliações com taxas de glicerolização mais próximas às descritas na literatura, a fim de se obter melhores valores de motilidade e vigor espermáticos. Para cães, o ACP-106®, seguindo o mesmo protocolo utilizado, permite valores superiores entre 46 e 66% de motilidade (CARDOSO et al., 2005; MADEIRA, 2007; BARBOSA, 2007). A temperatura de adição do glicerol, também é um fator variante entre os procedimentos de criopreservação, observando-se na literatura que para gatos domésticos a adição pode ocorrer tanto a 20 (ZAMBELLI et al., 2002) como a 4°C (CHATDARONG et al., 2007). Além disto, o tempo de equilíbrio utilizado no presente trabalho (de apenas 5 minutos) pode não ter sido suficiente para que o crioprotetor exercesse a sua ação benéfica de desidratação antes congelação. Em cães, com o ACP-106®, não foram observadas diferenças na motilidade espermática com a adição de glicerol a 4 ou 27°C (BARBOSA, 2007), sugerindo que diferentes temperaturas de adição do glicerol sejam avaliadas com o ACP-117®. Após o resfriamento incial, ZAMBELLI et al. (2002), utilizando TRIS, 20% gema e 4% de glicerol afirmam que a taxa de 3,85 °C/ min permitiu os melhores resultados, com 61,55% de motilidade pós-descongelação. Após o envase, com o método de congelação utilizado no presente trabalho, realizou-se uma queda de 4 a -70°C na temperatura em aproximadamente 5 min, sendo superior à taxa de congelação descrita por ZAMBELLI et al. (2002), podendo ter contribuído para os baixos resultados observados no presente trabalho. A média de motilidade pós-descongelação obtida no presente trabalho encontra-se próxima do valor obtido para sêmen epididimário (24%TSUTSUI et al., 2003), e obtido por vagina artificial (26%- TSUTSUI et al., 2000), mas abaixo do valor médio obtido (52,8%) por VILLAVERDE, (2007), todos utilizando TRIS como diluidor base. Os resultados de motilidade pós-descongelação no presente trabalho foram muito variáveis entre as amostras (0 a 60%). O vigor espermático está compatível com o obtido por TEBET et al. (2006), porém para sêmen eletroejaculado e epididimário. Resultados de 26% (15-40%) de motilidade pós-descongelação obtidos por TSUTSUI et al. (2000) garantiram gestação de 4 de 9 gatas inseminadas via intrauterina. Desta forma, avaliações in vivo com IA intrauterina são sugeridas para que o uso do sêmen criopreservado com o ACP-117®, segundo o protocolo utilizado, seja recomendado. Resultados bastante superiores de motilidade pós-descongelação com sêmen obtido por vagina artificial (70,6%- PLATZ et al., 1978) e por eletroejaculação (70%- CHATDARONG et al., 2007), demonstram que o protocolo testado no presente trabalho necessita ser ajustado a fim de garantir melhores resultados pós-descongelação, para que o ACP-117® venha a se constituir uma alternativa aos diluidores convencionais. Outro fator a ser controlado para garantir melhores resultados pós-descongelação é a taxa de descongelação, realizada por muitos autores a 37 °C/ 30 segundos (ZAMBELLI et al., 2002; TSUTSUI et al., 2003; BAUDI, 2005), taxa esta próxima a utilizada no presente trabalho. Taxas de descongelação a 46°C/ 12 segundos (VILLAVERDE, 2007) e 15 segundos (TEBET, 2004) ou 70°C/6 segundos (CHATDARONG et al., 2007) são relatadas em protocolos de criopreservação, garantindo resultados de motilidade de vigor superiores aos aqui obtidos. Sugere-se que novas taxas de descongelação devam ser avaliadas utilizando o sêmen felino com o ACP-117®, assim como realizado para cães com o ACP-106®, que garantiu melhores resultados a 55°C/ 5 segundos (MADEIRA, 2007). Sabe-se que quando não diluído, o sêmen felino pode ser incubado a 37 °C mantendo boa motilidade por 60 minutos (AXNÈR, 1998). Entretanto, após a descongelação no presente trabalho, a motilidade já em baixos níveis se manteve por apenas 10 minutos (Tabela 2). Uma significativa redução no percentual de espermatozóides normais pós-descongelação (Tab. 3) do sêmen de gatos domésticos era esperada segundo a literatura (BAUDI, 2005), entretanto, a integridade acrossomal foi mantida, sendo a as alterações pós-descongelação caracterizadas por alterações morfológicas secundárias, predominando o enrolamento da cauda. A avaliação pósdescongelação foi realizada no presente trabalho sem a remoção do diluidor contendo o crioprotetor e a gema de ovo. Alguns trabalhos realizam a centrifugação pósdescongelação e o concentrado de espermatozóides é resuspendido em meio base (BAUDI, 2005), ou a amostra após a descongelação permanece incubada a 38°C por 5 min em meio base (CHATDARONG et al., 2007) e somente após estes procedimentos as amostras são avaliadas quanto a motilidade pós-descongelação. Entretanto, as avaliações de sêmen realizadas para cães em ACP-106®não utilizam a centrifugação. A realização da centrifugação pode contribuir para um melhor avaliação da motilidade pelo CASA (Tab. 4). No presente trabalho observou-se grande quantidade de grumos de gema, tornando esta avaliação pouco prática e requerendo a limpeza manual das imagens, já que grumos são confundidos com espermatozóides imóveis. A motilidade subjetiva das mesmas amostras submetidas ao CASA foi de 22,03 ± 6,79 %. Assim, na motilidade subjetiva, acredita-se que certos grumos de gema em movimento também podem ter sidos interpretados como espermatozóides, levando a uma grande diferença entre as análises. A análise computadorizada de sêmen é ainda pouco empregada para gatos domésticos, tendo sido os relatos encontrados na literatura oriundos de diferentes sistemas de análise: Cell Track/s System para sêmen epididimário (STACHECKI et al., 1993) e Hamilton Thorn Reasearch para sêmen obtido por vagina (VILLAVERDE, 2007). Assim, não foram encontradas descrições prévias do uso do SCA para gatos domésticos. Tabela 1: Avaliação (média ± desvio padrão) do sêmen fresco dos gatos domésticos utilizados (n= 23 ejaculados). Parâmetros Valores Coloração Branco-opalescente a leitoso Volume 42,10 ± 22,21 µL (14 – 110) Concentração espermática 1.455,00 ± 1.720,69 x 106 sptz/mL (130- 7.260) Motilidade Espermática 92,10% ± 9,67 (70 - 100) Vigor 4,67 ± 0,49 (3,5 – 5) ab bc bc c Descongelado Glicerolizado 4°C 15°C Diluição inicial d Fresco Motilidade (%) a 100 90 80 70 60 50 40 30 20 10 0 Etapas Gráfico 1: Motilidade média do sêmen a de gatos domésticos e nas etapas de criopreservação (diuição inicial, a 15°C, a 4°C, após a glicerolização, e descongelação) utilizados (n= 23 ejaculados) com água de coco em pó (ACP-117®). a,b,c,d Letras diferentes representam diferença significativa (P<0,05). a 5 4,5 ab b bc bc Vigor 4 3,5 c 3 2,5 2 1,5 1 Descongelado Glicerolizado 4°C 15°C Diluição inicial Fresco 0,5 0 Etapas Gráfico 2: Vigor médio do sêmen a de gatos domésticos e nas etapas de criopreservação (diuição inicial, a 15°C, a 4°C, após a glicerolização, e descongelação) utilizados (n= 23 ejaculados) com água de coco em pó (ACP-117®). a,b,c Letras diferentes representam diferença significativa (P<0,05). Tabela 2: Análise subjetiva de motilidade e vigor (média ± erro padrão) durante os tempos de avaliação do teste de termorresistência do sêmen dos gatos domésticos após criopreservação em água de coco em pó (ACP-117®; n= 21 ejaculados). Tempos a,b,c,d,e Parâmetros Motilidade Vigor T0 25,07% ± 21,40a 3,44 ± 1,28a T10 21,13% ± 20,95ab 3,23 ± 1,56a T20 16,80% ± 17,47ad 2,64 ± 1,71ac T30 8,68% ± 11,90bde 1,70 ± 1,70bc T40 2,56% ± 3,95ce 1,41 ± 1,74bd T50 1,16% ± 2,66ce 1,27 ± 1,59bd T60 0,16% ± 0,34c 0,65 ± 1,22d Letras diferentes na mesma coluna representam diferença significativa (P<0,05). Tabela 3: Avaliação do sêmen de gatos domésticos a fresco e após criopreservação em água de coco em pó (ACP-117®) em relação aos parâmetros de percentual de espermatozóides vivos, com funcionalidade de membrana, e alterações morfológicas (integridade acrossomal, percentual de normais e anormais e alterações primárias e secundárias; n= 10 ejaculados). Tempos Parâmetros (%) Fresco T0 T60 Sptz vivos 46,55 ± 32,32a 16,81 ± 18,03b 9,10 ± 9,37b Funcionalidade de membrana Alterações morfológicas 66,68 ± 25,70a 44,33 ± 11,63b NR Integridade acrossomal 98,67 ± 1,23a 98,56 ± 1,52a 98,11 ± 1,50a normais 81,50 ± 10,80a 66,56 ± 10,62b 65,69 ± 14,07c anormais 18,5 ± 10,80a 33,44 ± 10,62b 29,31 ± 11,78c alterações primárias 6,77 ± 12,50a 1,28 ± 1,05b 1,13 ± 1,69a alterações secundárias 11,73 ± 5,70a 47,16 ± 33,94bc 41,13 ± 38,49ac NR- não realizado a, b, c Letras diferentes na linha representam diferença significativa (P<0,05). Tabela 4: Análise computadorizada (CASA) do sêmen de gatos domésticos após criopreservação em água de coco em pó (ACP-117®) em relação aos parâmetros de motilidade total (MT, %), motilidade progressiva (MP, %), velocidade média da trajetória do espermatozóide (VAP, μm/s) e sub-populações de espermatozóides rápidos e lentos (%; n= 10 ejaculados). Parâmetros Valores MT 9,12 ± 10,54 (%) (0 – 29,50) MP 4,79 ± 5,17 (%) (0 – 15,60) VAP dos sptz rápidos 65,32 ± 45,63 (μm/s) (0 – 109,60) VAP dos sptz médios 49,02 ± 49,02 (μm/s) (0 – 81,50) Sub-população A 2,41 ± 3,15 (%) (0 – 10,10) Sub-população B 2,89 ± 3,44 (%) (0 – 9,10) A- sub-populações de espermatozóides com velocidade média (VAP 55 a 95 μm/s); B- sub-populações de espermatozóides com velocidade rápida (VAP > 95 μm/s). CASA realizada pelo sistema Sperm Class Analyser® (SCA), Microptic S.L., versão 3.2.0 Conclusão O protocolo utilizado para criopreservação de sêmen de gatos domésticos em ACP-117® permite baixa viabilidade in vitro dos espermatozóides pós-descongelação. A formulação do ACP-117® e o protocolo testado no presente trabalho necessitam ser ajustados a fim de garantir melhores resultados pós-descongelação, para que o ACP117® venha a se constituir uma alternativa aos diluidores convencionais para criopreservação de sêmen de gatos domésticos. Agradecimentos Ao CNPQ, à CAPES e à FUNCAP pelo custeio do experimento e pelas bolsas de pesquisas concedidas. Ao Centro de Controle de Zoonoses de Fortaleza pela concessão das vacinas anti-rábicas aplicadas nos animais. À FUNCEME pela concessão dos dados climáticos. Ao Prof. Dr. José Ferreira Nunes e Dra. Cristiane de Mello Salgueiro pela disponibilização do uso do CASA, e do ACP-117®. Referências AXNÈR, E. Mating and artificial insemination in domestic cats. In: SIMPISON, G.; ENGLAND, G.; HARVEY, M. Manual of Small Animal reproduction and Neonatology. British Small Animal Veterinary Association, Chelteham, p.105-111, 1998. AXNÈR, E., LINDE-FORSBERG, C. Semen collection and assessment, and artificial insemination in the cat. In: CONCANNON, P.W.; ENGLAND, G. c. W.; VERSTEGEN, J.; LINDE-FORSBERG, C. Recent Advances in Small Animal Reproduction. New York: International Veterinary Information Service. 2002. Disponível em: < http:// www.ivis.org/>. - Acesso em: 08 jan. 2003. BARBOSA, C. C. Criopreservação de sêmen canino com um diluidor à base de água de coco na forma de pó (ACP-106®): Efeito da temperatura de adição do glicerol e da adição de antibiótico. 2007. 82p. Dissertação (Mestrado em Ciências Veterinárias) – Universidade Estadual do Ceará, Fortaleza, 2007. BAUDI, D. L. K. Efeito de dois métodos de resfriamento sobre a função espermática in vitro de sêmen criopreservado de felinos (Leopardus tigrinus, Leopardus pardalis e Felis catus), avaliada através de ensaio competitivo de ligação em ovócitos de gata doméstica (Felis catus) 2005. 63p. Dissertação (Mestrado em Ciências Veterinárias) – Universidade Federal do Paraná, Curitiba, 2005. CARDOSO, J. F. S. Uso do diluidor à base de água de coco na forma de pó (ACP106®) para o resfriamento a 4 °C do sêmen canino. 2006. 68p. Dissertação (Mestrado em Ciências Veterinárias) – Universidade Estadual do Ceará, Fortaleza, 2006. CARDOSO, R.C.S. Congelação de sêmen canino com um diluidor à base de água de coco. 2001. 72p. Dissertação (Mestrado em Ciências Veterinárias) - Universidade Estadual do Ceará, Fortaleza, 2001. CARDOSO, R.C.S. Características in vitro do espermatozóide canino criopreservado em água de coco. 2005. 197p. Tese (Doutorado em Ciências Veterinárias) – Universidade Estadual do Ceará, Fortaleza, 2005. CARDOSO, R.C.S.; SILVA, A.R.; SILVA, L.D.M. Use of the powdered coconut water (ACP®-106) for cyopreservation of canine spermatozoa. Anim. Reprod. Sci., v.2, p.257262, 2005. CHATDARONG, K.; AXNÉR, E.; MANEE-IN, S.; THUWANUT, P.; LINDEFORSBERG, C. Pregnacy in the domestic cat after vaginal or transcervical insemination with fresh and frozen sêmen. Theriogenology, v.68, p. 1326- 1333, 2007. FRIM, J.; MAZUR, P. Interactions of cooling rate, warming rate, glycerol concentration, and dilution procedure on the viability of frozen-thawed human granulocytes. Cryobiology, v.20, p.657-676, 1983. HAY, M. A., GOODROWE, K. L. Comparative cryopreservation and capacitation of spermatozoa from epididymides and vasa deferentia of the domestic cat. J. Reprod. Fertil., v. 47, 297-305, 1993. HOLT, W.V. Basic aspects of frozen storage of semen. Anim. Reprod. Sci., v.62, p.322, 2000. JOHNSTON, S. D.; KUSTRITZ, M. V. R.; OLSON, P. N. S. Canine and Feline Theriogenology. Philadelphia: W. B. Saunders. 2001, 592p. LUVONI, G.C.; KALCHSCHMIDT, E.; LEONI, S.; RUGGIERO, C. Conservation of feline semen. Part I: cooling and freezing protocols. J. Fel. Med. Surg., p. 1-6, 2003. MADEIRA, V. L. H. Criopreservação do sêmen canino com um diluidor à base de água de coco na forma de pó (ACP - 106®): efeito do tempo de equilíbrio e da taxa de descongelação. 2007. 89p. Dissertação (Mestrado em Ciências Veterinárias) – Universidade Estadual do Ceará, Fortaleza, 2007. MADEIRA, V.L.H.; SILVA, L.D.M.; CARDOSO, J.F.S.; SILVA, A.R.; UCHOA, D.C.; CARDOSO, R.C.S.; OLIVEIRA, C.M. Uso da água de coco em pó (ACP®) como diluidor para conservação do sêmen de cães a 4ºC. In: IX SEMANA UNIVERSITÁRIA - UECE, 2004, Fortaleza. Anais... Fortaleza, UECE, 2004. MILITÃO, S. F.; POSSO, C. S.; SOUZA, F. M. Avaliação de diluidores alternativos para inseminação artificial em capotes (Numida meleagris). In: XXIII CONGRESSO BRASILEIRO DE MEDICINA VETERINÁRIA, Olinda. Anais...Olinda, 1994, p. 534. MORAIS, R.N.; MUCIOLO, R.G.; GOMES, M.L.F.; LACERDA, O.; MORAES, W.; MOREIRA, N.; GRAHAM, L.H.; SWANSON, W. F.; BROWN, J.L. Seasonal analysis of semen caracteristics, serum testosterone and fecal androgens in the ocelot (Leopardus pardalis), margay (L. weidii) and tigrina (L. tigrinus). Theriogenology, v.57, p. 20272041, 2002. NUNES, J. F. Utilização da água de coco como diluidor do sêmen de caprinos e ovinos. Ciência Animal, v. 7, p. 62-69, 1995. PLATZ., C. C.; WILDT, D. E.; SEAGER, S. W. Pregnancy in the domestic cat after artificial insemination with previously frozen semen spermatozoa. J. Reprod. Fertil, v. 52, p. 279-282, 1978. SALGUEIRO, C. C. M.; NUNES, J.F.; OLIVEIRA, K. L. P.; VIEIRA, V. E.; GONDIM, J. M.; MATEOS-REX, E. Utilização de diluentes á base de água de coco “in natura” e em pó na inseminação artificial programada de cabras. Rev. Bras. Reprod. Anim., Supl., n.5, p.96-98, 2002. SÁNCHEZ, A.; TSUTSUI, T. Evaluación de dos diluyentes seminales para preservación refrigerada de espermatozoides de gato (Felis catus). Nova técnica. Rev. Cient. de la Facultad de Ciencias Veterinarias de Zulia, v. 4, p. 249-253, 2002. SCHNEIDER, V.; MAZUR, P. Osmotic consequences of cryoprotectant permeability and its relation to the survival of frozen-thawed embryos. Theriogenology, v.21, p.6879, 1984. SILVA- JÚNIOR, F. X.; AGUIAR, L.; SILVA, F. M. O.; MONTEIRO, C. L. B.; MADEIRA, V. H. L.; SIMÕES-MATTOS, L.; SILVA, L. D. M.; MATTOS, M. R. F. Indução de estro em uma gata Persa. Rev. Bras. Rep. Anim. Supl. 5, p. 159-161, 2002. SOJKA, N. J; JENNINGS, L. L.; HAMNER C. E. Artificial insemination in the cat (Felis catus). Lab. Anim. Care, v. 20, p.198-204. 1970. STACHECKI, J. J.; GINSBURG, K. A.; LEACH, R. E., ARMANT, D. R. Computerassisted semen analysis (CASA) of epididymal sperm from the domestic cat. J. Andr., v. 14, n.1, 1993. STORNELLI, M. C.; STORNELLI, M. A. Evaluación, Criopreservación de Semen e Inseminacion Artificial en el Gato Doméstico. Asociación Argentina de Medicina Felina, Buenos Aires, 2001. Disponível em: < http://www.aamefe.org.ar/>. - Acesso em: 21 fev. 2004. TEBET, J. M. Efeito da criopreservação sobre a célula espermática em três espécies de felinos: o gato-do-mato-pequeno (Leopardus tigrinus, Schreber, 1775), a jaguatirica (Leopardus pardalis, Linnaeus, 1758) e o gato doméstico (Felis catus). 2004, 115 p. Tese (Doutorado em Reprodução Animal pela Faculdade de Medicina Veterinária e Zootecnia da Universidade Estadual Paulista), Botucatu, 2004. TEBET, J.M.; MARTINS, M. I. M.; CHIRINEA, V. H.; SOUZA, F. F.; CAMPAGNOL, D.; LOPES, M. D. Cryopreservation effects on domestic cat epididymal versus electroejaculated spermatozoa, Theriogenology, v. 66, p.1629-1632, 2006. TONIOLLI, R.; MESQUITA, D.S.M. Fertilidade de porcas inseminadas com sêmen diluído em água de coco estabilizada e com BTS. Rev. Bras. Reprod. Anim., v. 14, p. 249-254, 1990. TSUTSUI, T.; TANAKA, A.; TAKAGI, Y.; NAKAGAWA, K.; FUJIMOTO, Y.; MURAI, M. Unilateral intrauterine horn insemination of frozen semen in cats. J. Vet. Med. Sci, v. 62, n.12, p.1247-1251, 2000. TSUTSUI, T.; WADA, M.; ANZAI, M.; HORI, T. Artificial insemination with frozen epididymal sperm in cats. J. Vet. Med. Sci, v. 65, n.3, p. 397-399, 2003. UCHOA, D.C.; SILVA, T.F.P.; ARAÚJO, A.A., SILVA, L.D.M. Uso da água de coco em pó (ACP-106®) na inseminação artificial com sêmen a fresco em cadelas. In: IX SEMANA UNIVERSITÁRIA – UECE, 2004, Fortaleza. Anais... Fortaleza, UECE, 2004. VILLAVERDE, A. I. S. B. Comparação entre dois métodos de inseminação artificial utilizando sêmen congelado em gatos domésticos. 2007, 101 p. Dissertação (Mestrado em Reprodução Animal), Universidade Estadual Paulista, Botucatu, 2007. ZAMBELLI, D. ; CANEPPELE, B. ; CASTAGNETTI, C.; S. BELLUZZI. Cryopreservation of cat semen in straws: comparison of five different freezing rates. Reproduction in Domestic Animals, v. 37, p.310-313, 2002. 6. Conclusões • O protocolo de anestesia inalatória com indução anestésica com cetamina, diazepam e manutenção com isoflurano foi o que melhor promoveu analgesia, segurança ao procedimento anestésico e à equipe, bem como um tempo rápido de recuperação para EEJ em gatos domésticos. • O protocolo de anestesia inalatória com a indução anestésica com cetamina, diazepam e manutenção com isoflurano é eficientemente indicado para coleta de sêmen por eletroejaculação em gatos domésticos. • Em condições de fotoperíodo equatorial natural, o volume testicular de gatos domésticos não é, até o momento, indicado para indicado para avaliar os reprodutores. • O uso da diluição do sêmen fresco de gatos domésticos com ACP-117® não altera a motilidade e o vigor espermático, entretanto o protocolo descrito para IA intravaginal utilizado não foi adequado, necessitando de ajustes no protocolo e um maior número de inseminações. • O protocolo utilizado para criopreservação de sêmen de gatos domésticos em ACP-117® permite baixa viabilidade in vitro dos espermatozóides pósdescongelação. A formulação do ACP-117® e o protocolo testado no presente trabalho necessitam ser ajustados a fim de garantir melhores resultados pósdescongelação, para que o ACP-117® venha a se constituir uma alternativa aos diluidores convencionais para criopreservação de sêmen de gatos domésticos. 7. Perspectivas • Avaliação de novos protocolos anestésicos para EEJ em gatos domésticos que possam garantir qualidade seminal adequada a fim de ser utilizado em protocolos de conservação; • Aperfeiçoamento do protocolo de IA com sêmen a fresco diluído em ACP117® em gatos domésticos possibilitará incremento na taxa de gestação; • O desenvolvimento de um protocolo de criopreservação de sêmen específico para a espécie felina, utilizando ACP-117® em gatos domésticos, garantirá bons resultados in vitro e in vivo; • O desenvolvimento deste protocolo viabilizará o uso do ACP-117® para criopreservação de sêmen de espécies felídeas ameaçadas de extinção. 8. Referências Bibliográficas ANDRADE, S. F. Analgésicos. In: ANDRADE, S. F. Manual de Terapêutica Veterinária.2ª ed. São Paulo: Rocca, 2002, p.78. ANDRADE, S. F.; CORRÊA, E. M.; SILVA, S. R. G. Uso do bloqueador α2adrenérgico como antagonista da associação quetamina + xilazina em gatos. A Hora Veterinária, Ano 19, n.114, 2000. ARAÚJO, L. L. OLIVEIRA, K. G.; LIMA, J. S; PANTOJA, P. S. P.; ARAÚJO, J. B.; DOMINGUES, S. F. S. Preservação de sêmen de Cebus apella (macaco-prego) em diluidor à base de água de coco a 37 °C In: CONGRESSO BRASILEIRO DE REPRODUÇÃO ANIMAL, 2007, Curitiba, PR. Anais ... Belo Horizonte, MG: CBRA, 2007. Disponível em: <www.cbra.org.br/publicacoes.do>. Acesso 01 nov 2007. AXNÈR, E. Mating and artificial insemination in domestic cats. In: SIMPISON, G.; ENGLAND, G.; HARVEY, M. Manual of Small Animal Reproduction and Neonatology. British Small Animal Veterinary Association, Chelteham, p.105-111, 1998. AXNÈR, E., LINDE-FORSBERG, C. Semen collection and assessment, and artificial insemination in the cat. In: CONCANNON, P.W., ENGLAND, G., C., W.; VERSTEGEN, J., LINDE-FORSBERG, C. Recent Advances in Small Animal Reproduction. New York: International Veterinary Information Service.2002. Disponível em: < http:// www.ivis.org/>. - Acesso em: 08 jan. 2003. AXNÉR, E.; HOLST STRÖM, B.; LINDE-FORSBERG, C. Morphology of spermatozoa inthe cauda epididymidis before and after electroejacutation and a comparision with ejaculated spermatozoa in the domestic cat. Theriogenology, v.50, p.973-979, 1998. AXNÉR, E.; HOLST STRÖM, B.; LINDE-FORSBERG, C. Sperm morphology is better in the second ejaculate than in the frist in domestic cats eletroejaculated twice during the same period of anesthesia. Theriogenology, v.47, p.929-934, 1997. BAKKER, J.; BAUM, M. J. Neuroendocrine regulation of GnRH release in induced ovulators. Frontiers in Neuroendocrinology, v.21, p.220-260, 2000. BANKS, D. R. Physiology and endocrinology of the feline estrous cycle. In: MORROW, D. A. Current therapy in theriogenology. Philadelphia: W.B. Saunders, 1986, p. 795-800. BARBOSA, C. C. Criopreservação de sêmen canino com um diluidor à base de água de coco na forma de pó (ACP-106®): Efeito da temperatura de adição do glicerol e da adição de antibiótico. 2007. 82p. Dissertação (Mestrado em Ciências Veterinárias) – Universidade Estadual do Ceará, Fortaleza, 2007. BLOTTNER, S.; JEWGNOW, K. Moderate seasonality in testis function of domestic cats. Reprod. Dom. Anim., n.42, p. 536-540, 2007. BRAGA, A.C.P. Avaliação da dor pós-operatória de gatas domésticas submetidas a OSH utilizando 2 e 4mg de cloridrato de tramadol. Fortaleza, 2007. Monografia de Especialização (Especialização em Clínica e Cirurgia de Pequenos Animais, Universidade Estadual do Ceará). 50p. BRAZ, V. B.; ARAÚJO, A. A.; NUNES, J. F.; MACHADO, V. P.; MOURA, A. A. A.; OLIVEIRA, K. P. L. Viabilidade do sêmen ovino diluído em água de coco em pó. Revista Brasileira de Reprodução Animal. v.27, n.3, p.328-329, 2003. BREARLEY, J. C. Sedation, premedication and analgesia. In: HALL, L. W.; TAYLOR, P. M. Anesthesia of the Cat. London: W. B. Sauders Company- Baillière Tindall, p. 11-128, 1994. BUSSO, J. M.; PONZIO, M. F.; CHIARAVIGLIO, M.; FIOL DE CUNEO, M.; RUIZ, R. D. Electroejaculation in the Chinchilla (Chinchilla lanigera): effects of anesthesia on seminal characteristics. Research in Veterinary Science, v.78, p.93-97, 2005. BYERS, A. P.; HUNTER, A. G.; SEAL, U. S.; BINCZIK, G. A.; GRAHAM, E. F.; REINDI, N. J.; TILSON, R. L. In vitro induction of capacitation of fresh and frozen spermatozoa of Siberian tiger (Panthera tigris). Journal of Reproduction and Fertility, v.86, p.599-607, 1989. CARDOSO, J. F. S. Uso do diluidor à base de água de coco na forma de pó (ACP106®) para o resfriamento a 4 °C do sêmen canino. 2006. 68p. Dissertação (Mestrado em Ciências Veterinárias) – Universidade Estadual do Ceará, Fortaleza, 2006. CARDOSO, R.C.S. Congelação de sêmen canino com um diluidor à base de água de coco. 2001. 72p. Dissertação (Mestrado em Ciências Veterinárias) - Universidade Estadual do Ceará, Fortaleza, 2001. CARDOSO, R.C.S. Características in vitro do espermatozóide canino criopreservado em água de coco. 2005. 197p. Tese (Doutorado em Ciências Veterinárias) – Universidade Estadual do Ceará, Fortaleza, 2005. CARTER, K. K; CHAKRABORTY, P. K.; BUSH, M.; WILDT, D. E. Effects of electroejacutation and ketamine-HCl on serum cortisol, progesterone and testosterone in the cat. Journal of Andrology, v. 5, p.431-437, 1984. CARVALHO, C. T. Sêmen de grandes felinos. Revista de Medicina Veterinária, v.2, n.4, p. 195-201,1968. CASSU, R. N.; LUNA, S. P. L. Tramadol. Revista Científica de Medicina VeterináriaPequenos Animais e Animais de Estimação, v. 1, n.4, 295-301, 2003. CAZES, L. B. Avaliação da eficiência de métodos de recuperação de gametas masculino em cão doméstico (Canis familiaris). 2006. 68p. Dissertação (Mestrado em Produção Animal) - Universidade Estadual do Norte Fluminense, Campos dos Goytacazes, 2006. CHATDARONG, K.; AXNÉR, E.; MANEE-IN, S.; THUWANUT, P.; LINDEFORSBERG, C. Pregnacy in the domestic cat after vaginal or transcervical insemination with fresh and frozen sêmen. Theriogenology, v.68, p. 1326- 1333, 2007. CHATDARONG, K.; LOACHIT, C. PONGLOWHAPAN, S.; LINDE-FORSBERG, C. Transcervical catheterization and cervical patency during estrus cycle in domestic cats, J. Reprod. Fertil., v. 57, p. 353-356, 2001. CHATDARONG, K.; PONGLOWHAPAN, S.; MANEE-IN, S.; PONGPHET, K. The use of propofol for electroejaculation in domestic cats, Theriogenology, v.66, p.16151617, 2006. CHRISTIANSEN, I. J. Reprodução no cão e no gato. São Paulo: Manole Ltda., 1988, 362p. Convention on International Trade in Endangered Species of Wild Fauna and Flora CITES. Protected species. 2007. Disponível em: <http://www.cites.org/eng/app/appendices.shtml. > Acesso em: 02 nov. 2007. CORRADA, Y. A; GOBELLO, M. C. Reproducción felina: características del gato doméstico. Asociación Argentina de Medicina Felina, Buenos Aires, 2000. Disponível em: < http://www.aamefe.org.ar/>. - Acesso em: 04 abr. 2003. CORTEZE, A. A. Avaliação eletrocardiográfica de mamíferos silvestres. 2006. 16f. Relatório Técnico-Científico de Projeto (Universidade Federal do Paraná). COSTA, D. S.; PAULA, T. A. R. Coleta e avaliação do sêmen de catetos (Tayassu tajacu).Biota Neotropica, v.5, n.2, 2005. DONOGHUE, A. M.; JOHNSTON, L. A.; SEAL, U. S.; ARMSTRONG, D. L.; SIMMONS, L. G.; GROSS, T.; TILSON, R. L.; WILDT, D. E. Ability of thawed tiger (Panthera tigris) spermatozoa to fertilize conspecific eggs and bind and penetrate domestic cat eggs in vitro. Journal of Reproduction and Fertility, v.96, p.555-564, 1992. DOOLEY, M. P.; PINEDA, M. H. Effect of method of collection on seminal characteristics of the domestic cat. American Journal of Veterinary Research. v. 47, n. 2, p. 286 -292, 1986. DOOLEY, M. P.; MURASE, K.; PINEDA, M. H. An eletroejaculator for the collection of semen from the domestic cat. Theriogenology, v. 20, n. 3, p. 297-310, 1983. DOOLEY, M. P.; PINEDA, M. H.; HOPPER, J. G.; HSU, W. H. Retrograde flow of spermatozoa into urinary bladder of dogs during ejaculation or after sedation with xylazine. Am. J Vet Res, v. 51, n. 10, p.1574-1579, 1990. DOOLEY, M. P.; PINEDA, M. H.; HOPPER, J. G.; HSU, W. H. Retrograde flow of spermatozoa into the urinary bladder of cats during eletroejaculation, collection of semen with artificial vagina, and mating. Am. J. Vet. Res., v. 52, n. 5, p.687- 691, 1991. EMÍLIO, C. R.; OSÓRIO, D. D. P.; MARIANO, A. P.; LUNA, S. P. L.; GONÇALVES, R.C.; MANNARINO, R.; FOLONI, V. S. Efeito da ioimbina como antagonista da xilazina em cães e gatos. Acta Scientiea Veterinariae, v. 32, n.1, p.53-57, 2004. ERDMANN, R. H.; JUVENAL, J. C.; MORAES, W.; CUBAS, P.; CARVALHO, A. L.; MOREIRA, N. Estudo Reprodutivo em gato-do-mato-pequeno (Leopardus tigrinus Schreber, 1775). Archieves of Veterinary Science, v.10, n.2, p. 75-79, 2005. FANTONI, D. T.; CONTOPARSSI, S. R. G. Anestesia em Cães e Gatos, 1. ed. São Paulo: Rocca, 2002, 389p. FELDMAN, E. C.; NELSON, R. W. Breeding, Pregnancy, and Parturition. In: FELDMAN, E. C.; NELSON, R. W. Canine and feline endocrinology and reproduction. Philadelphia: Saunders Company, 1996. p. 547-571. FOGLE, B. Entenda seu gato. São Paulo: Globo, 2001, p. 128. FRANÇA, L. R.; GODINHO, C. L. Testis morphometry, seminiferous epithelium cycle length, and daily sperm production in domestic cats. Biology of Reproduction, v. 68, p. 1554-1561, 2003. FRANTI, C.E.; KRAUS, J.F.; BORHANI, N. Pet ownership in a suburban-rural area of California, 1970. Public Health Reports, v.89, n.5, p.473-484, 1974. FUNEZ, F. A. Fisiopatologia de la reproduccion en el gato. In: I CONGRESS OF EUROPEAN VETERINARY SOCIETY FOR SMALL ANIMAL REPRODUCTION, Barcelona, 5, 1998. Proceedings…Barcelona, 1998, p.15-22. GASPARINI, R. L.; PRADA, C. S. Um projeto para predadores brasileiros. Clínica Veterinária, n. 10, p. 38-41, 1997. GLOVER, T. E., WATSON, P. F. The effect of buffer osmolarity on the survival of the cat (Felis catus) spermatozoa at 5°C. Abstarcat. Theriogenology, v. 24, p. 449, 1985. GOODROWE, K. L.; HAY, M. A.; PLATZ, C. C.; BEHRNS, S. K.; JONES, M. H.; WADDELL, W. T. Characteristics of fresh and frozen-thawed red wolf (Canis rufus) spermatozoa. Animal Reproduction Science, v.53, p.299-308, 1998. GOODROWE, K. L.; MASTROMONACO, G. F.; WALKER, S. L.; BATEMAN, H. L.; RYCKMAN, D. P.; PLATZ, C. C.; WADDELL, W. T. In vitro maintenance, cooling and cryopreservation of red wolf (Canis rufus) spermatozoa. Journal of Reproduction and Fertility, v.57, p.387-392, 2001. GRUFFYDD-JONES, T. J. Sistema Genital. In: CHANDLER, E.A.; HILBERY, A.D.R.; GASKELL, C.J. Medicina e Terapêutica de Felinos. São Paulo: Manole, 198, p.170-176. GUDERMUNTH, D. F; NEWTON, L; DAELS, P; CONCANNON, P. Incedence of spontaneous ovulation in young, group-housed cats based on serum and faecal concentrations of progesterone. J. Reproduction Fert. Suppl, v. 51, p. 177-184, 1997. HAY, M. A., GOODROWE, K. L. Comparative cryopreservation and capacitation of spermatozoa from epididymides and vasa deferentia of the domestic cat. J. Reprod. Fertil., v. 47, 297-305, 1993. HOWARD, J. G. Semen collection and análisis in carnivoress. In: FLOWER, M. E. Zoo Wild Animal Medicine and Current Therapy. Philadelphia: W. B. Saunders, p. 390-399, 1993. HOWARD, J. G.; BUSH, M.; HALL, L. L; WILDT, D. E. Morfological abnormalities in spermatozoa of 28 species of non-domestic felids. In: INTERNATIONAL CONGRESS ON ANIMAL REPRODUCTION AND ARTIFICIAL INSEMINATION, 10, 1984. Urbana-Champaign. Proceddings...Urbana Champaign, 1984. p. 57. HOWARD, J. G.; MUNSON, L.; MCALOOSE, D.; KRIETE, M.; BUSH, M.; WILDT, D. E. Comparative evaluation of seminal, vaginal, and rectal bacterial flora in the cheetah and domestic cat. Zoo Biology, v.12, n. 1, p.81-96, 1993. HOWARD, J.; WILDT, D. E. Ejaculate-hormonal traits in the leopard cat (Felis bengalensis) and sperm function as measured by in vitro penetration of zona- free hamster ova and zona- intact domestic cat oocytes. Molecular Reproduction and Development, v.26, n.2, p.163-174, 1990. HOWARD, J.G, WILDT, D. E. Ejaculate-hormonal traits in the leopard cat (Felis bengalis) and sperm function as measured by in vitro penetration of zona-free manstrs ova and zona-intact domestic cat oocytes. Mol. Rep. and Devp., v. 26, p.163-174,1990. HOWARD, J.G. Assisted reproduction techniques in carnivores. In: Zoo and Wild Animal Medicine IV, p. 449-457, Eds. ME Fowler and RE Miller. WB Saunders Company, Philadelphia, 1999. HOWARD, J.G.; BARONE, M.A.; DONOGHUE, A.M.; WILDT, D.E. The effect of preovulatory anaesthesia on ovulation in laparoscopically inseminated domestic cats. Journal of Reproduction and Fertility, p. 175-186, 1992. HOWARD, J.G.; BUSH, M.; WILDT, D.E. Semen collection, analysis and cryopreservation in nondomestic mammals. In: Morrow D (ed), Current Therapy in Theriogenology II. Philadelphia: W.B. Saunders Co, p. 1047-1053, 1986. International Union for Conservation of Nature- IUCN. Red List. 2007. Disponível em: <http://www.iucnredlist.org/. > Acesso em: 02 nov. 2007. ISHIKAWA, A.; MATSUI, M.; SAKAMOTO, H.; KATAGIRI, S.; TAKAHASHI, Y. Criopreservation of the Semen Collected by Eletroejaculation from the Hokkaido Brown Bear (Ursus arctos yesoensis). J. Vet. Med. Sci., v.64, n.4, p.373-376, 2002. JAYAPRAKASH, D.; PATIL, S. B.; KUMAR, M. N.; MAJUMDAR, K. C.; SHIVAJI, S. Semen characteristics of the captive Indian leopard, Panthera pardus. Journal of Andrology, v.22, p.25–33, 2001. JOHNSTON, S. D., KUSTRITZ, M. V. R., OLSON, P. N. S. Canine and Feline Theriogenology. Philadelphia: W. B. Saunders. 2001, 592p. JOHNSTON, S. D; ROOT, M. V; OLSON, P.N.S. Ovarian and testicular function in the domestic cat: clinical management of spontaneus reproductive disease. Animal Reproduction Science, v. 42, p.261-274, 1996. JONG, C. E.; JONSSON, N.; FIELD, H.; SMITH, C.; CRICHTON, E. G.; PHILLIPS, N.; JOHNSTON, S. D. Collection, seminal characteristics and chilled storage of spermatozoa from three species of free-range flying fox (Pteropus spp.). Theriogenology, v.64, p.1072– 1089, 2005. LAGUNA, L.E. Determinações físico-químicas da água de coco verde em duas variedades (Cocus nucifera) coco da praia e anão. 1996. 55f. Monografia (Especialização em Produção e Reprodução de Pequenos Ruminantes) – Universidade Estadual do Ceará, Fortaleza, 1996. LARSSON, M. H. M. A.; LARSSON, C. E.; FERNÁNDEZ, W. R.; et al. Brucella canis: Inquéritos sorológicos e bacteriológicos em população felina. Rev. Saúde Públ., v.18, p.47-50, 1984. LAWLER, D. F; JOHNSTON, S. D; HEGSTAD, R. L; KELTNER, D. G; OWENS, S. F. Ovulation without cervical stimulation in domestic cats. J. Reproduction Fert. Suppl, v.47, p. 57-61, 1993. LEITE, D. K. V. H.; PIRES, M. V. M.; SUZANO, S. M. C.; LISBOA, D.; SILVEIRA, A. M.; FEREIRA, A. M. R. Avaliação da coleta de sêmen pelo método de eletroejaculação no gato doméstico (Felis catus). Revista da Universidade Federal Rural do Rio de Janeiro, v. 26, suplemento, p. 361-362, 2006. LENGWINAT, T.; BLOTTNER, S. In vitro fertilization of follicular oocytes of domestic cat using fresh and cryopreserved epididymal spermatozoa. Animal Reproduction Science. v.35, p.291-301, 1994. LIMA JÚNIOR, A. D. Caracterização da população canina para o controle da raiva e outros problemas de saúde pública. Ciência Veterinária nos Trópicos v.2, n.1, p. 65-78, 1999. LIMA, L. F.; TORTURELLA, R. D.; SARTORI, R.; SILVA, T. A. S. N.; CAMPOS, G. M.; NEVES, J. P. Coleta de sêmen em ovinos em estação ou decúbito lateral utilizando-se diferentes eletroejaculadores. In: CONGRESSO BRASILEIRO DE REPRODUÇÃO ANIMAL, 17, 2007, Curitiba, PR. Anais ... Belo Horizonte, MG: CBRA, 2007, p.216. Disponível em: <www.cbra.org.br/publicacoes.do>. Acesso 01 nov 2007. LIMA, A. K .F.; SILVA, A. R.; SANTOS, R. R..; SALES, D. M.; EVANGELISTA, A. F.; FIGUEIREDO, J. R.; SILVA, L. D. M. Cryopreservation of peantral ovarian follicles in situ from domestic cats (Felis catus) using differents cryoprotective agents. Theriogenology, v. 66, p. 1664- 1666, 2006. LUVONI, G. C.; PELLIZZARI, P.; PARETI, A.; BARBERO, C. Il gatto come specie modello per lo studio dei felini selvatici: produzione in vitro di embrioni. Rassegna de Medicina Felina, v. 2-3, p. 5-10, 1999. LUVONI, G.C.; KALCHSCHMIDT, E.; LEONI, S.; RUGGIERO, C. Conservation of feline semen. Part I: cooling and freezing protocols. Journal of Feline Medicine and Surgery, p. 1-6, 2003. MADEIRA, V. L. H. Criopreservação do sêmen canino com um diluidor à base de água de coco na forma de pó (ACP - 106®): efeito do tempo de equilíbrio e da taxa de descongelação. 2007. 89p. Dissertação (Mestrado em Ciências Veterinárias) – Universidade Estadual do Ceará, Fortaleza, 2007. MADEIRA, V. L. H.; SILVA, L. D. M.; CARDOSO, J. F. S.; SILVA, A. R.; UCHOUA, D.C.; CARDOSO, R. C. S.; OLIVEIRA, C. M. Uso da água de coco em pó (ACP®) como diluidor para conservação do sêmen de cães a 4ºC. In: IX SEMANA UNIVERSITÁRIA - UECE, 2004, Fortaleza. Anais... Fortaleza, UECE, 2004. MADEIRA, V. L. H; SILVA JÚNIOR, F. X; AGUIAR, L; SILVA, F. M. O; MONTEIRO, C.L.B; SIMÕES-MATTOS, L; SILVA, L.D.M; MATTOS, M.R.F. Relato de ovulação sem cópula em duas gatas (Felis catus). Ciên. Anim., n. 1, v.12, p. 95-98, 2002. MAGALHÃES, M. P.; GOMES, F. S.; MODESTA, R. C. D., MATTA, V. M., CABRAL, L. M. C. Conservação de água de coco verde por filtração com membrana. Ciênc. Tecnol. Aliment., v. 25, n. 1, p.72-77, 2005. MARTIN, I. C. A. The principles and practice of eletroejaculation of mammals. Symposium of Zoological Socitey of London, n. 43, p.127-152, 1978. MARTIN, P. A.; PINEDA, M. H.; DOOLEY, M. P. Xylazine does not induce retrograde flow of spermatozoa onto the urinary bladder of sexually rested boars. J Vet Med A Physiol Pathol Clin Med, v.50, n.3, p. 16-163, 2003. MATTOS, M. R .F., SILVA, T. F. P., PEREIRA, B. S.; SILVA, A. R.; FERREIRA, M. A. L.; UCHOA, D. C.; CARDOSO, R. C. S.; COSTA, S. H. F.; DOMINGUES, S. F. S.; COSTA-FILHO, J. C.; SILVA, L. D. M. Embryo transfer in the cat: first successful in Latin América. In: II CONGRESSO INTERNACIONAL DE MEDICINA FELINA – CIMFEL. Rio Janeiro. Anais (Errata)... Rio de Janeiro, 2001.), p.2-3. MIALOT, J. P. Patologia da Reprodução dos carnívoros domésticos. Porto Alegre: Metrópole, 1988. 160p. MIES-FILHO, A. In: Reprodução dos Animais e inseminação artificial. 5ª ed, Porto Alegre: Sulina, 1982. MIES-FILHO, A.; TELECHEA, N. L.; BOHRER, J. L.; WALLAWER, W. P. Produção espermática de Panthera onca. Arquivos da Faculdade de Medicina Veterinária da Universidade Federal do Rio Grande do Sul, v. 2, n. 1, p. 55-65, 1974. MILITÃO, S. F.; POSSO, C. S.; SOUZA, F. M. Avaliação de diluidores alternativos para inseminação artificial em capotes (Numida meleagris). In: XXIII CONGRESSO BRASILEIRO DE MEDICINA VETERINÁRIA, Olinda. Anais...Olinda, 1994, p. 534. MORAIS, R. N. Fisiologia reprodutiva de pequenos felinos Leopardus pardalis, Linnaeus, 1758; Leopardus weidii, Schinz,1821; e Leopardus tigrinus, Schreber, 1775: sobre a função testicular (gametogênica e esteroidogênica) de machos em cativeiro, incluindo variações sazonais. 177 p. Tese (Doutorado em Reprodução Animal pela Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo). 1999. MORAIS, R. N.; MUCIOLO, R. G.; GOMES, M. L. F.; LACERDA, O.; MORAES, W.; MOREIRA, N.; GRAHAM, L. H.; SWANSON, W. F.; BROWN, J. L. Seasonal analysis of semen caracteristics, serum testosterone and fecal androgens in the ocelot (Leopardus pardalis), margay (L. weidii) and tigrina (L. tigrinus). Theriogenology, v.57, p. 2027-2041, 2002. MORATO, R. G. Reprodução assistida como ferramenta auxiliar no manejo e conservação da onça pintada (Panthera onca, Linnaeus, 1758). 129p. São Paulo, 2001.Tese (Doutorado em Reprodução Animal) Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo. MORATO, R. G.; BARNABE, R. C. Biotécnicas de Reprodução Aplicadas à Preservação de Felídeos Selvagens. Clinica Veterinária, v. 12, p. 24-26, 1998. MORATO, R. G.; CONFORTI, V. A.; AZEVEDO, F. C.; JACOMO, A. T. A.; SILVEIRA, L.; SANA, D.; NUNES, A. L. V.; GUIMARÃES, M. A. B. V.; BARNABE, R. C. Comparative analyses of semen and endocrine characteristics of freeliving versus captive jaguars (Panthera onca). Reproduction, v.122, p.745-751, 2001. MORATO, R. G.; GUIMARÃES, M. A. B. V.; NUNES, A. L. V.; CARCIOFI, A. C.; FERREIRA, F.; BARNABE, V. H.; BARNABE, R. C. Colheita e Avaliação do Sêmen em Onça Pintada (Panthera onca). Braziliaan Journal of Veerinary. Research of Animal Science, v. 35, n. 4, p. 178-181, 1998. MORATO, R.G.; MOURA, C.A.; CRAWSHAW JR., P.G. Inmobilización química de jaguares libres con una combinación de tiletamina y zolazepam. In: MEDELLIN, R. A.; CHETKIEWICZ, C.; RABINOWITZ, A.; REDFORD, K. H.; ROBINSON, J. G.; SANDERSON, E.; TABER, A. El Jaguar en el nuevo milenio. Una evaluacion de su estado, deteccion de prioridades y recomendaciones para la conservacion de los jaguares en America. Mexico: Universidad Nacional Autonoma de Mexico/Wildlife Conservation Society, 2002, p.63. MOREIRA, N.; MORATO, R. G. Técnicas de Reprodução Assistida em Felídeos Neotropicais. In: CUBAS, Z. S.; SILVA, J. C. R.; CATÃO-DIAS, J. L.Tratado de Animais Selvagens- Medicina Veterinária. São Paulo: Roca, 2007, p.1280- 1288. MOREIRA, N; MONTEIRO-FILHO, E. L. A.; MORAES, W.; SWANSON, W. F.; GRAHAM, L .H.; PASQUALI, O. L.; GOMES, M. L. F., WILDT, D. E.; BROWN, J. L. Reproductive steroid hormones and ovarian activity in felids of the Leopardus genus. Zoo Biology, v. 20, p.103-116, 2001. MORGADO, T. O.; VIANA, C. T. R. ; ARRUDA, F. P.; NASCIMENTO, D. O. B.; MESQUITA JÚNIOR, N. C.; ALVES, C. H.; HATAMOTO, L. K.; PAZ, R. C. R. Citologia testicular por agulha fina e colheita de sêmen por eletroejaculação em Irara (Eira barbara). In: XXI CONGRESSO ANUAL DA SOCIEDADE DE ZOOLÍGICOS DO BRASIL. 2007, São Paulo, Anais...São Paulo, 2007. CD rom. MUNO, R. M; CUNHA, I. C. N.; SANTOS, I. P.; CAZES, L. B; ROCHA, A. A.. Efeitos da coleta seminal por eletroejaculação na qualidade espermática de cães domésticos. Revista da Universidade Federal Rural do Rio de Janeiro, v. 26, suplemento, p. 355-356, 2006. NUNES, J. F. Utilização da água de coco como diluidor do sêmen de caprinos e ovinos. Ciência Animal, v. 7, p. 62-69, 1995. NUNES, J. F., COMBARNOUS, Y. Utilização da água de coco como diluidor do sêmen dos mamíferos domésticos. In: I SIMPÓSIO DE BIOTECNOLOGIA DA REPRODUÇÃO DE ANIMAIS DOMÉSTICOS, 1995, Fortaleza. Anais...Fortaleza, 1995. p.53-63. NUNES, J. F., SALGUEIRO, C. C. M. Utilização da água de coco como diluidor do sêmen de caprinos e ovinos. Rev. Cient. Prod. Animal, v. 1, p.17-26, 1999. NUNES, J. F.; SALGUEIRO, C. C. M.; GONDIM, J. M. Novos produtos com base na água de coco em pó. In: 12ª SEMANA INTERNACIONAL DA FRUTICULTUR FLORICULTURA E AGROINDÚSTRIA - FRUTAL 2005, Fortaleza. Anais ...,Fortaleza: FRUTAL, 2005. NUNES, N. Monitoração da Anestesia. In: FANTONI, D. T.; CORTOPASSI, S. R. G Anestesia em Cães e Gatos, 1. ed. São Paulo: Rocca, 2002, p.64-81. OHL, D. A.; DENIL, J.; CUMMINS, C.; MENGE, A. C.; SEAGER, S. W. Electroejaculation does not impair sperm motility in the beagle dog: a comparative study of eletroejaculations and collection by artificial vagina. Journal of Urology, v.152, p.1034-1037, 1994. OLIVEIRA, L. F.; EVANGELISTA, J. J. F.; BEZERRA, M.B. et al. Água de coco in natura adicionada ou não de gema de ovo e sob a forma estabilizada de gel como diluidor do sêmen ovino. In: XXIII CONGRESSO BRASILEIRO DE MEDICINA VETERINÁRIA, Olinda. Anais...Olinda, p. 561, 1994. OLIVEIRA, T. G. Neotropical cats: Ecology and conservation. São Luis: EDUFMA, 1994, 224p. PARAGON, B. M.; VAISSAIRE, J. P. Enciclopédia do gato-Royal Canin. Paris: aniwasa Publising, 2001, p.443. PARRA, J. M. P. O alimento para animais de companhia. In: Associação Nacional dos Fabricantes de Alimentos para Pequenos Animais- ANFALPET. Disponível em: <http://anfalpet.org.br> Acesso em: 02 nov. 2007. PAZ, R. C. R.; LOPES, M. D.; DIAS, E. A.; BARNABE, R. C. Avaliação da maturação nuclear de oócitos de gatas domésticas. Acta Scientiae Veterinariae, supl.,v. 31, p.520521, 2003. PAZ, R. C. R.; ZÜGE, R. M.; BARNABE, V. H.; MORATO, R. G.; FELIPPE, P. A. N.; BARNABE, R. C. Avaliação da capacidade de penetração de sêmen congelado de onça pintada (Panthera onca) em oócitos heterólogos. Brazilian Journal of Veterinary Research and Animal Science, São Paulo, v.37, n.6, 2000. PINEDA, M. H.; DOOLEY, M. P. Effects of voltage and order of voltage application on seminal characteristics of electroejaculates of the domestic cat. American Journal of Veterinary Research, v. 45, n. 8, p. 1520-1525, 1984. PINEDA, M. H.; DOOLEY, M. P; MARTIN, P. A. Long-term study on the effects of electroejaculation on seminal characteristics of the domestic cat. American Journal of Veterinary Research, v. 45, n. 5, p. 1038-1041, 1984. PINEDA, M. H.; DOOLEY, M.P. Effect of method of seminal collection on the retrograde flow of spermatozoa into the urinary bladder in rams. Am. J. Vet. Res., v. 25, n. 5, p. 788, 1991. PINEDA, M. H.; DOOLEY, M.P.; HEMBROUGH, F. B.; HSU, W. H. Retrograde flow of spermatozoa into urinary bladder of rams. Am. J. Vet. Res., v. 48, n. 4, p. 562-568, 1987. PIRES-FILHO, L. A. S.; OLIVEIRA, P. C.; MANÇANARES, C. A. F.; MARTINS, D. S.; ROSA, R. A.; GREGORES, G. B.; REIS, L. S.; CARVALHO, A. F. Coleta e avaliação do sêmen de quati (Nasua nasua). 2005. In: CONGRESSO e 10° ENCONTRO DA ASSOCIAÇÃO BRASILEIRA DE VETERINÁRIOS DE ANIMAIS SELVAGENS, 15, 2005. Anais... 2005. PLATZ, C. C.; WILDT, D. E.; SEAGER, S. W. Pregnancy in the domestic cat after artificial insemination with previously frozen semen spermatozoa. J. Reprod. Fertil, v. 52, p. 279-282, 1978. PLATZ, C. C.; SEAGER, S. W. J. Semen collection by electroejaculation in the domestic cat. J. Am. Vet. Med. A., v. 173, p.1353-1355, 1978. POPE, C. E. Embryo technology in conservation efforts for endangered felids. Theriogenology, v. 53, p.163-174, 2000. PUKAZHENTHI, B. S.; WILDT, D. E.; HOWARD, J. G. The phenomenon and significance of teratospermia in felids. J. Reprod. Fertil.Suppl. v.57, p.423-433, 2001. PUKAZHENTHI, B.; LAROE, D.; CROSIER, A.; BUSH, L. M.; SPINDLER, R.; PELICAN, K. M.; BUSH, M.; HOWARD, J. G.; WILDT, D. E. Challenges in cryopreservation of clouded leopard (Neofelis nebulosa) spermatozoa. Theriogenology, v.66, p.1790-1796, 2006. PUKAZHENTHI, B.; PELICAN, K.; WILDT, D.; HOWARD, J.G. Sensitivity of domestic cat (Felis Catus) sperm from normospermic versus teratospermic donors to cold induced acrosomal damage. Biology of Reproduction. p. 135-141, 1999. QUEIROZ, J. P. A. F. Estabelecimento de um método para coleta de sêmen de quatis (Nasua nasua). 57 f. Monografia (Graduação em Medicina Veterinária pela Universidade Federal Rural do Semi-Árido), Mossoró, 2007. QUEIROZ, V. S.; FRANCA, G. D. A.; SANTOS, M.C.F.; CORTOPASSI, S. G.; GUIMARÃES, M. A. B. V. Urine contamination during ocelot (Leopardus pardalis) electroejaculation: considerations of the inhalant anesthesia. In: INTERNACIONAL SYMPOSIUM ON CANINE AND FELINE REPRODUCTION, 5, 2004. Embu das Artes, Brasil. Anais…, 2004, p.279-251. QUEIROZ, V. S. Estudo do efeito das condições de manipulação do sêmen de jaguatiricas (Leopardus pardalis Linnaeus, 1758) sobre a capacitação e a integridade morfológica e funcional dos espermatozóides. (Dissertação de Mestrado). Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo, São Paulo-SP, 2003. REKWOT, P. I.; OGWU, D.; OYEDIPE, E. O.; SEKONI, V. O. The role of pheromones and biostimulation in animal reproduction. Animal Reproduction Science, v. 65, p. 157-170, 2001. REYNA, J.C.; JURADO, S.; STORNELLI, M. A.; STORNELLI, M.C.; SAVIGNONE, C. A.; TITTARELLI, C.; DE LA SOTA, R. L. Light and ultrastructural study of seminiferous epithelium characteristics of domestic cats during queen breeding season. In: Inter American Congress of Electron Microscopy, 8th, 2005, La Habana, Cuba. La Habana: [s.n.], 2005a. p.64. CD-rom. REYNA, J. C.; SAVIGNONE, C. A.; GUZZETTI, J.; STORNELLI, M. C.; TITTARELLI, C. M.; DE LA SOTA, R. L.; STORNELLI, M. A. Estudio de la estructura testicular en el gato domestico y su relación con la estación reproductiva. In: Simposio Internacional de Reproducción Animal, 6, 2005, Còrdoba, Argentina. Cordoba: IRAC Editora, 2005b. p.515. REYNA, J. C.; SAVIGNONE, C. A.; STORNELLI, M. C.; TITTARELLI, C. M.; CATALANO, V. A.; DE LA SOTA, R. L.; STORNELLI, M. A.Variaciones observadas en el túbulo seminal y espacio intersticial del gato doméstico en diferentes épocas del año. In: Jornadas de Divulgación Técnico Científicas, 2005, Casilda, Argentina. Casilda: UNR Editora, 2005c. p.158-159. REYNA, J. C.; SAVIGNONE, C. A.; STORNELLI, M. C.; GIMENEZ, F.; TITTARELLI, C. M.; DE LA SOTA, R. L.; STORNELLI, M. A. Relación entre fotoperíodo y produción espermática en el gato doméstico. In: XXIIV CONGRESSO BRASILEIRO DA ANCLIVEPA, 2006, Vitória. Anais...Vitória, 2006. p.91. REYNA, J. C.; SAVIGNONE, C. A.; STORNELLI, M. C.; TITTARELLI, C. M.; NÚÑEZ FAVRE, R.; DE LA SOTA, R. L.; STORNELLI, M. A. Estudio de la concentración espermática testicular em diferentes estaciones del año en el gato doméstico. In: Congreso Argentino de la Sociedad Argentina de Ciencias Morfológicas, 10, 2006, Tandil, Argentina. Tandil: UNDC Editora, 2006b. Resumen. CD-ROM. REYNA, J. C.; SAVIGNONE, C. A.; STORNELLI, M. C.; TITTARELLI, C. M.; NÚÑEZ FAVRE, R.; GIMENEZ, F.; DE LA SOTA, R. L.; STORNELLI, M. A. Estudio histológico de testículos de gatos sometidos a un régimen de luz natural. In: Jornadas Científicas de la Asociación de Biología de Tucumán, 23, 2006, Tafí del Valle, Tucuman, Argentina. Libro de resúmenes … Tucuman: [s.n.], 2006c. p.284. ROBERTSON, S. A review of opioid use in cats. In: CONCANNON, P.W., ENGLAND, G., VERSTEGEN, J., LINDE-FORSBERG, C. Recent Advances in Small Animal Reproduction. New York: International Veterinary Information Service.2007. Disponível em: < http:// www.ivis.org/>. - Acesso em: 08 jan. 2008. ROOT, M. V.; JOHNSTON, S. D.; OLSON, P. N. Estrous length, pregnancy rate, gestation and parturation lengths, litter size, and juvenile mortality in the domestic cat. Journal of American Animal Hospital Association, v. 31, p. 429-433, 1995. ROTH, T. L.; HOWARD, J. G.; DONOGHUE, A. M.; SWANSON, W. F.; WILDT, D. E. Function and culture requirements of snow leopard (Panthera uncia) spermatozoa in vitro. Journal of Reproduction and Fertility, v.101, p.563-569, 1994. ROTH, T. L.; SWANSON, W. F.; BLUMER, E.; WILDT, D. E. Enhancing zona penetration by spermatozoa from a teratospermic species, the cheetah (Acinonyx jubatus). Journal of Experimental Zoology, v.271, n.4, p.323-330, 1995. SALGUEIRO, C. C. M.; NUNES, J.F.; OLIVEIRA, K. L. P.; VIEIRA, V. E.; GONDIM, J. M.; MATEOS-REX, E. Utilização de diluentes à base de água de coco “in natura” e em pó na inseminação artificial programada de cabras. Rev. Bras. Reprod. Anim., Supl., n.5, p.96-98, 2002. SAMPAIO NETO J. C.; SALGUEIRO C.C. M.; MATEOS-REX, E.; NUNES. J. F. Utilization of ACP 105® extender in the refrigeration of stallion semen. Revista Brasileira de Reprodução Animal. Supl. Supl. 5, p. 137-139, 2002. SÁNCHEZ, A.; TSUTSUI, T. Evaluación de dos diluyentes seminales para preservación refrigerada de espermatozoides de gato (Felis catus). Nova técnica. Rev. Cient. De la Facultad de Ciencias Veterinarias de Zulia, v. 4, p. 249-253, 2002. SANTOS, G. J. G; MASSONE, F.; MATTOS JÚNIOR, E.; HATSCHBACH, E. Avaliação cardiovascular de case submetidos a associação anestésicas fundamentadas em fármacos dissociativos. Revista Científica de Medicina Veterinária-Pequenos Animais e Animais de Estimação, v. 2, n.8, 276-284, 2004. SCHMEHL, M. K.; GRAHAM, E. F.; BYERS, A. P.; HUNTER, A. G. Characteristics of fresh and cryopreserved Siberian tiger (Panthera tigris altaica) semen and its seminal plasma chemical constit uents. Zoo Biology, v.9, n.6, p.431-436, 1990. SCHMIDT, P. M. Feline breeding management. Small Animal Practice, n.3, v.16 p.435- 451, 1986. SCOTT, P. Cats. In: HAFEZ, E. S. Reproduction and breeding techniques for laboratory animals, Philadelphia: Lea and Febiger, 1970, p.205. SHIN, T., KRAEMER, D., PRYOR, J. et al. A cat cloned by nuclear transplantation. Nature, v. 415, p. 859, 2002. SILVA-JÚNIOR, F. X.; AGUIAR, L., SILVA, F. M. O., MONTEIRO, C.L.B., MADEIRA, V. H. L., SIMÕES-MATTOS, L., SILVA, L. D. M., MATTOS, M. R. F. Indução de estro em uma gata Persa. Rev. Bras. Rep. Anim. Supl. 5, p. 159-161, 2002. SILVA, A. R.; MATOS, M. R. F.; CARDOSO, R. C. S; SILVA, T. F. P.; UCHOA, D.; FILGUEIRA, K. D.; CARDOSO, J. F. S.; AGUIAR, L.; MONTEIRO, C. L. B; SILVA, L. D. M.; AGUIAR, G. V.; MORATO, R. G. Avaliação Andrológica de uma Onça Pintada (Panthera onça) Oriunda da Região Norte do Brasil. Rev. Bras. Reprod. Anim., v. 27, n.2, p. 217-218, 2003. SILVA, A. R.; MORATO, R. G.; SILVA, L. D. M. The potential for gamete recovery from non-domestic canids and felids. Animal Reproduction Science, v. 81, p. 159-175, 2004a. SILVA, T. F. P.; DIAS, C. G.A.; BRAGA, A. C. P.; UCHOA, D. C.; CARDOSO, J. F. S.; ACKERMANN, C. L.; THOMÁS, L. A; SILVA, L. D. M. Anestesia inalatória associada à opióide para eletroejaculação em gatos domésticos: resultados preliminares. In: SEMANA UNIVERSITÁRIA DA UNIVERSIDADE ESTADUAL DO CEARÁ. Anais…, 2004b, p.1 SILVA, J. C. R.; ADANIA, C. H. Carnívora- Felidae (Onça, Suçuarana, Jaguatirica, Gato-do-mato). In: CUBAS, Z. S.; SILVA, J. C. R.; CATÃO-DIAS, J. L.Tratado de Animais Selvagens- Medicina Veterinária. São Paulo: Roca, 2007, p.505- 546. 2007. SILVA, T .F. P.; MATTOS, M. R. F.; SILVA, A. R.; PEREIRA, B. S.; CARDOSO, R. C. S.; UCHOA, D. C.; DOMINGUES, S. F. S.; FERREIRA, M. A. L.; COSTA, S. H. F.; COSTA-FILHO, J. C.; SILVA, L. D. M. Sexual behaviour and ovarian response after FSHp superovulation treatment in queens (Felis catus). Rev. Bras. Rep. Anim. v.25, n.3, 375-377, 2001. SILVA, T. F. P. Reprodução de Felídeos. In: IV CICLO DE ATUALIZAÇÃO EM CIÊNCIAS VETERINÁRIAS, 2003, Fortaleza. Anais...Fortaleza, 2003. p.34-39. SILVA, T. F. P.; SILVA, L. D. M.; UCHOA, D. C.; MONTEIRO, C. L. B.; THOMAZ, L. A.. Sexual characteristics of domestic queens kept in a natural equatorial photoperiod. Theriogenology, v. 66, p. 1476-1481, 2006. SOJKA, N. J; JENNINGS, L. L, HAMNER C. E. Artificial insemination in the cat (Felis catus). Lab. Anim. Care, v. 20, p.198-204. 1970. SOUZA, H. J. M. Manejo hospitalar felino. Brazilian Journal of Veterinary Science, v.7, p.31-32, 2000. SPINDLER, R. E.; HUANG, Y.; HOWARD, J. G.; WANG, P.; ZHANG, H.; WILDT, D. E. Acrosomal integrity and capacitation are not influenced by sperm cryopreservation in the giant panda. Reproduction, v.127, p.547-556, 2004. SPINDLER, R. E.; WILDT, D. E. Circannual variations in intraovarian oocyte but not epididymal sperm quality in the domestic cat. Biology of Reproduction, n.61, p. 188194, 1999. STORNELLI, M. A.; STORNELLI, M. C.; SAVIGNONE, C. A.; TITTARELLI, C. M.; REYNA, J. C.; DE LA SOTA, R. L. Influencia del fotoperíodo en la cantidad de espermatozoides epididimales en gatos. In: Congreso, 1, y Jornada Nacional de Felinos. 4, Corrientes, Argentina. Corrientes: Fac Cienc Vet de la UNNE, 2004c. v.1, p.19-20. STORNELLI, M. A. Evaluación de semen en el gato doméstico: análisis de rutina y metodologías especiales felino. 2007. Rev. Bras. Reprod. Anim.l, v.31, n.1, p. 135-140, 2007. STORNELLI, M. C.; STORNELLI, M. A. Evaluación, Criopreservacion de Semen e Inseminacion Artificial en el Gato Doméstico. Asociación Argentina de Medicina Felina, Buenos Aires, 2001. Disponível em: < http://www.aamefe.org.ar/>. - Acesso em: 21 fev. 2004. STRÖM-HOLST, B. Disease Transmission by mating or artificial insemination in the cat: concerns and prophylaxis. In: Recent Advances in Small Animal Reproduction. New York: International Veterinary Information Service.2002. Disponível em: < http:// www.ivis.org/>. - Acesso em: 08 jan. 2003. SWANSON, W. F.; JOHNSON, W. E.; CAMBRE, R. C. et al. Reproductive status of endemic felid species in Latin American zoos and implications for ex situ conservation. Zoo Biol, vol. 22, p. 421–441, 2003. SWANSON, W. F.; MAGGS, D. J.; CLARKE, H. E.; NEWELL, A. E.; BOND, J. B.; BATEMAN, H. L.; KENNEDY-STOSKOPF, S. Assessment of viral presence in semen and reproductive function of frozen-thawed spermatozoa from palla´s cats (Otocolobus manul) infected with feline herpesvirus. Journal of Zoo and Wildlife Medicine, v.37, n.3, 2006. SWANSON, W. F.; HOWARD, J. G.; ROTH, T. L.; BROWN, J. L.; ALVARADO, T.; BURTON, M.; STARNES, D.; WILDT, D. E. Responsiveness of ovaries to exogenous gonadotrophins and laparoscopic artificial insemination with frozen-thawed spermatozoa in ocelots (Felis pardalis). Journal of Reproduction and Fertility, p. 87-94, 1996b. TANAKA, A.; KUWABARA, S.; TAKAGI, Y.; NAKAGAWA, K.; FUJIMOTO, Y.; MURAI, M.; TSUTSUI, T. Effect of ejaculation intervals on semen quality in cats. J. Vet. Med. Sci, v. 62, n.11, p.1157-1161, 2000a. TANAKA, A.; TAKAGI, Y.; NAKAGAWA, K.; FUJIMOTO, Y.; HORI, T; TSUTSUI, T. Artificial intravaginal insemination using fresh semen in cats. J. Vet. Med. Sci, v. 62, p.1163-1167, 2000b. TEBET, J. M. Efeito da criopreservação sobra a célula espermática em três espécies de felinos: o gato-do-mato-pequeno (Leopardus tigrinus, Schreber, 1775), a jaguatirica (Leopardus pardalis, Linnaeus, 1758) e o gato doméstico (Felis catus). 2004, 115 p. Tese (Doutorado em Reprodução Animal pela Faculdade de Medicina Veterinária e Zootecnia da Universidade Estadual Paulista), Botucatu, 2004. TEBET, J.M.; MARTINS, M. I. M.; CHIRINEA, V. H.; SOUZA, F. F.; CAMPAGNOL, D.; LOPES, M. D. Cryopreservation effects on domestic cat epididymal versus electroejaculated spermatozoa, Theriogenology, v. 66, p.1629-1632, 2006. TITTARELLI, C. M.; SAVIGNONE, C. A.; STORNELLI, M. A.; STORNELLI, M. C.; DESMARÁS, E.; DE LA SOTA, R. L. Concentración y viabilidad de espermatozoides epididimales felinos em diferentes épocas del año. In: Reunión Interamericana de Cátedras de Fisiologia Animal, 7, 2004, Santa Rosa, La Pampa, Argentina. Libro de resúmenes … Santa Rosa: Facultad de Ciencias Veterinarias de la Universidad Nacional de La Pampa, 2004. p106. TSUTSUI, T.; TANAKA, A.; HORI, T. Intratubal insemination with fresh semen in cats. J. Reprod. Fertil., Suppl. v. 57, p.347-351, 2001. TSUTSUI, T.; TANAKA, A.; TAKAGI, Y.; NAKAGAWA, K.; FUJIMOTO, Y.; MURAI, M. Unilateral intrauterine horn insemination of fresh semen in cats. J. Vet. Med. Sci, v. 62 , n.12, p.1241-1245, 2000a. TSUTSUI, T.; TANAKA, A.; TAKAGI, Y.; NAKAGAWA, K.; FUJIMOTO, Y.; MURAI, M. Unilateral intrauterine horn insemination of frozen semen in cats. J. Vet. Med. Sci, v. 62, n.12, p.1247-1251, 2000b. TSUTSUI, T.; MURAO, I.; KAWAKAMI, E.; OGASA, A.; STABENFELDT, G. H. Androgen concentration in the blood and spermatogenic function of tom cats during the breeding season. J. Vet. Sci., v. 52, n. 4, p. 801-806, 1990. TUDURY, E. A.; BARAÚNA JÚNIOR, D.; CHIORATTO, R.; SILVA, S. R. A. M.; ROEHSING, C.; ROCHA, L. B.; ALMEIDA, A. C. M.; KEMPER, B.; MACIEL, M. J.S. Denervação dos esfínteres uretrais, via celiotomia pré-púbica, em três gatos paraplégicos. Clínica Veterinária, n.60, p.54-58, 2006. UCHOA, D. C. SATZINGER, S.; AMARAL, M.C, SILVA, L.D.M. O uso de diferentes diluidores para inseminação artificial com sêmen canino refrigerado. In: CONGRESSO BRASILEIRO DE REPRODUÇÃO ANIMAL, 17, 2007, Curitiba, PR. Anais ... Belo Horizonte, MG: CBRA, 2007. Disponível em: <www.cbra.org.br/publicacoes.do>. Acesso 01 nov 2007. UCHOA, D.C.; SILVA, A.R.; CARDOSO, R. C. S.; PEREIRA, B. S.; SILVA, L. D. M. Conservação do sêmen canino a 37 °C em diluentes à base de água de coco. Ciência Rural, v.32, p.91-95, 2002. UCHOA, D.C.; SILVA, T.F.P.; ARAUJO, A.A.; SILVA, L.D.M. Uso da água de coco em pó (ACP 106®) na inseminação artificial com sêmen a fresco em cadelas. In: IX SEMANA UNIVERSITÁRIA – UECE, 2004, Fortaleza. Anais... Fortaleza, UECE, 2004. VERSTEGEN, J.P. Physiology and endocrinology of reproduction in females cats. In: SIMPISON, G.; ENGLAND, G. C. W.; HARVEY, M. Manual of Small Animal Reproduction and Neonatology. Chelteham: British Small Animal Veterinary Association. 1998, p.11-16. VIANA, C. T.R.; ARRUDA, F. P.; DUTRA, I. G.; OLIVEIRA, D.; MORGADO, T. O.; MESQUITA JÚNIOR, N. C.; ALVES, C. H.; HAKAMOTO, L. K.; PAZ, R. C. R. Avaliação do método de eletroejaculação para obtenção e análise de sêmen de quatis (Nasua nasua) mantidos em cativeiro. In: XXVIII CONGRESSO BRASILEIRO DA ANCLIVEPA, 2007, Florianópolis, Anais... Florianópolis- SC, Anclivepa, 2007, p.164166. VIEIRA, M. J. A .F.; CARVALHO, M. A. M.; SALMITO-VANDERLEY, C. S. B.; ROMÃO, J. M.; VASCONCELOS, R. O.; SILVA NETO, R. O. A. R.; SALGUEIRO, C. C. M.; NUNES, J. F. Fertilização de óvulos de tambaqui, Colossoma macropomum (Cuvier, 1818), com uso de solução à base de água de coco em pó (ACP-104) In: CONGRESSO BRASILEIRO DE REPRODUÇÃO ANIMAL, 17, 2007, Curitiba, PR. Anais ... Belo Horizonte, MG: CBRA, 2007, p.67. Disponível em: <www.cbra.org.br/publicacoes.do>. Acesso 01 nov 2007. VILLAVERDE, A. I. S. B. Comparação entre dois métodos de inseminação artificial utilizando sêmen congelado em gatos domésticos. 2007, 101 p. Dissertação (Mestrado em Reprodução Animal), Universidade Estadual Paulista, Botucatu, 2007. VILLAVERDE, A. I. S. B.; LOPES, M. D. É possível realizar inseminação artificial em gatas na minha clínica? Clínica Veterinária, n.70, 2007. VILLELA, N. R. ; NASCIMENTO JÚNIOR, P. Uso de dexmedetomidina em anestesiologia. Revista Brasileira de Anestesiologia, v. 53, n. 1, 2002. WARD, D. G.; BLYDE, D.; LEMON, J.; JOHNSTON, S. Anesthesia of captive african wild dogs (Lycaon pictus) using a medetomidine-ketamine-atropine combination. Journal of Zoo and Wildlife Medicin , v.37, n.2, 2006. WILDT, D. E. Male Reproduction: Assessment, Mangement an Control of Fertility. In: KLEIMAN, D. G; ALLEN, M. E..; THOMPSON, K. V.; LUMPIKIN, S. Wild Mammals in captivity: Principles and techniques. Chigaco: The University of Chicago Press, 1996, p. 429-444. WILDT, D. E.; PHILLIPS, L. G.; SIMMONS, L. G.; CHAKRABORTY, P. K.; BROWN, J. L.; HOWARD, J. G.; TEARE, A.; BUSH, M. A comparative analysis of ejaculate and hormonal characteristics of the captive male cheetah, tiger, leopard, and puma. Biology of Reproduction, v.38, p.245-255, 1988. WILDT, D. E.; BUSH, M.; HOWARD, J. G., et al. Unique seminal quality in the South African cheetah and a comparative evaluation in the domestic cat. Biology of Reproduction, v.29 , n.4, p.1019-1025, 1983. WILDT, D. E.; MONFORT, S. L.; DONOGHUE, A. M.; JOHNTON, L.A.; HOWARD, J.G. Embryogenesis in conservation biology - or how to make an endangered species embryo. Theriogenology, p. 161-184, 1992. ZAMBELLI, D.; PRATI, F.; CUNTO, M.; IACONO, E.; MERLO, B. Quality and in vitro fertilizing ability of cryopreserved cat spermatozoa obtained by urethral catheterization after medetomidine administration. Theriogenology, v. 69, n.4, p.485490, 2008. ZAMBELLI, D. ; CANEPPELE, B. ; CASTAGNETTI, C. ; BELLUZI, S. Cryopreservation of cat semen in straws: comparison of five different freezing rates. Reproduction in Domestic Animals, v. 37, p.310-313, 2002. ZAMBELLI, D.; CUNTO, M. Semen collection in cats: Techniques and analysis. Theriogenology, v.66, p.159-165, 2006. ZAMBELLI, D.; CUNTO, M. Transcervical artificial insemination in the cat. Theriogenology, v. 45, p. 698-705, 2005. ZAMBELLI, D.; CUNTO, M.; PRATI, F.; MERLO, B. Effects of ketamine or medetomidine administration on quality of eletrocejaculated sperm flow in the domestic cat. Theriogenology, v. 68, p. 796-83, 2007. ZAMBELLI, D.; CASTAGNETTI, C. Transcervical insemination with fresh and frozen semen in the domestic cat: new technique and preliminary results. In: Proceddings of the fifth annual conference of the European Society for Domestic Animal Reproduction (ESDAR), 2001, p.34. 2001. 9. Apêndices APÊNDICE 1: Anel de pêlo na base do pênis de um gato doméstico. A B APÊNDICE 2: Vagina artificial para coleta de sêmen de gatos domésticos. A- Montagem da vagina com tubo plástico de 1,5 mL sem tampa e borracha de conta-gotas. B- Amostra de seminal. APÊNDICE 3: Coleta de sêmen de um gato doméstico com uso da vagina artificial. APÊNDICE 4: Biometria do pênis de um gato doméstico com paquímetro. A B APÊNDICE 5: Eletroejaculação. A- Aparelho para eletroejaculação utilizado nos experimentos (Eletrojet®, Electrovet®, Brasil). B- Exposição peniana para colocar o tubo de coleta de sêmen antes da aplicação dos choques elétricos em um gato doméstico anestesiado. APÊNDICE 6: Monitoração da saturação de oxigênio durante a eletroejaculação, utilizando oxímetro de pulso digital através de sensor localizado na língua do animal (Oxifast 9504®, Takaoka®). APÊNDICE 7: Esfregaço de sêmen felino a fresco corado com azul de bromo fenol. Seta amarela- espermatozóides totalmente corados ou parcialmente corados (mortos). Seta verdeespermatozóides descorados (vivos). Aumento de 400x. APÊNDICE 8: Análise computadorizada (Sperm Class Analiser®) após descongelação do sêmen de gato doméstico criopreservado em ACP-117® acrescido de 20% de gema de ovo e 6% de glicerol. Pontos amarelos- espermatozóides imóveis. Traçados vermelho, verde e azul: trajetória de espermatozóides rápidos, médios e lentos, respectivamente. Pontos brancos- grumos de gema de ovo. Aumento de 100x. 10. Anexos ANEXO 1: Composição e modo de preparo do corante Rosa de Bengala. Componentes Quantidades Água destilada 20 mL Citrato de sódio 0,58 g Formaldeído 0,8 mL Rosa de Bengala 0,3 g Após a mistura dos três primeiros componentes, a solução é homogeneizada e acrescenta-se o Rosa de Bengala. ANEXO 2: Composição e modo de preparo do corante Azul de Bromofenol. Componentes Quantidades Água destilada 10 mL Citrato de sódio 0,4 g Azul de Bromofenol 0,1 g Após a mistura dos componentes, o pH e osmolaridade devem ser aferidos. ANEXO 3: Composição da água de coco anão maduro. 1. Aminoácidos (μg/ml) Alanina 177,1 Aminobutírico 168,8 Arginina 16,8 Asparagina 10,4 Aspártico 5,4 Fenilalanina 10,2 Glicina 13,9 Glutâmico 78,8 Glutamina 13,4 Histidina, Metionina e Hidroxipolina Traços Homoserina 5,2 Leucina 31,7 Lisina 22,5 Prolina 21,6 Serina 65,8 Tirosina 3,1 Treonina 26,3 Valina 15,1 2. Açúcares(μg/ml) Frutose 8,9 Glicose 2,46 Sacarose 2,51 3. Vitaminas (μg/ml) Ácido fólico 0,003 Ácido nicotínico 0,64 Ácido pantotéico 0,52 Biotina 0,02 Tiamina e Piridoxina 0,01 4. Minerais (μg/ml) Cálcio Traços Cloro 183,0 Cobre 0,04 Enxofre 24,0 Ferro 0,10 Fósforo 37,0 Magnésio 30,0 Potássio 312,0 Sódio 105,0 FONTE: NUNES e COMBARNOUS, 1995.
Download