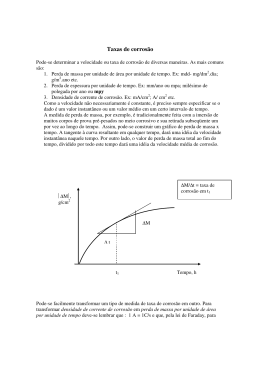
Ministério da Educação UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ Campus Curitiba PLANO DE ENSINO CURSO Engenharia de Computação – Curso 212 MATRIZ 544 / 721 Regido pela Lei nº 9.394, de 20 de dezembro de 1996; pela Resolução CNE/CES n° 11, FUNDAMENTAÇÃO de 11 de março de 2002; e a pela Resolução CONFEA/CREA n° 1010, de 22 de agosto LEGAL de 2005. Aprovado pela Resolução Nº 84/06 COEPP de 17 de novembro de 2006. DISCIPLINA/UNIDADE CURRICULAR Química CÓDIGO PERÍODO QB62A 2º CARGA HORÁRIA horas) AT AP APS Total 68 34 6 108 AT: Atividades Teóricas, AP: Atividades Práticas, APS: Atividades Práticas Supervisionadas. PRÉ-REQUISITO EQUIVALÊNCIA Não há QB70D OBJETIVOS Introduzir os conceitos fundamentais de conteúdos relacionados com a engenharia elétrica, a fim de proporcionar embasamento teórico e prático para futuros conteúdos técnicos e tecnológicos. EMENTA Cinética Química. Equilíbrio Químico. Termodinâmica Química. Eletroquímica e Corrosão. Ligações Químicas. O Estado Sólido. CONTEÚDO PROGRAMÁTICO ITEM EMENTA 1 Cinética Química 2 Equilíbrio Químico 3 Termodinâmica Química 4 Eletroquímica e Corrosão 5 Ligações Químicas 6 O Estado Sólido CONTEÚDO Velocidade de reações. Lei de velocidades. Mecanismos de reações. Fatores que alteram a velocidade das reações químicas. Velocidade das reações e equilíbrio Reações reversíveis e irreversíveis. Equilíbrios homogêneos e heterogêneos. Constantes de equilíbrio (Kc e Kp). Deslocamento do Equilíbrio Químico. Equilíbrio Iônico: Constante de ionização (Ki), Produto Iônico da água (Kw), pH e pOH, Hidrólise de sais, Solução Tampão, Produto de Solubilidade. Sistemas, estados e funções de estado. Trabalho e calor. Primeira Lei da Termodinâmica. Transformação espontânea. Segunda Lei da Termodinâmica. Termoquímica: Trocas de calor nas reações químicas, Transformações endotérmicas e exotérmicas, Energia de ligação, Lei de Hess. Entropia. Terceira Lei da Termodinâmica. Diagramas de estado: Interpretação molecular da Entropia. Energia Livre. Potenciais de eletrodo. Pilhas Eletroquímicas. Equação de Nernst. Eletrólise. Leis de Faraday. Formas e tipos de corrosão. Fatores responsáveis pela corrosão eletroquímica. Métodos de combate ä corrosão. Tipos de ligações químicas: iônica, covalente e metálica. Geometria das moléculas e Momento de dipolo. Teoria da ligação de valência. Teoria dos orbitais moleculares. Propriedades dos materiais. Sistemas cristalinos. Difração de Raio X. Redes iônicas e covalentes. Bandas de energia: condutores, semicondutores e isolantes. Semicondutores: propriedades e transporte de carga. REFERÊNCIAS Referencias Básicas: 1. GENTIL, V. Corrosão. Rio de Janeiro: Guanabara Dois, 1983. 2. MAHAN, Bruce H. Química - Um curso universitário. São Paulo: Edgard Blücher, 1972. 3. RUSSEL, John B. Química geral. São Paulo: McGraw-Hill, 1981. 4. VAN VLACK, L. H. Princípios de ciência e tecnologia dos materiais, 5 ed. Rio de Janeiro: Campus, 1984. Referências Complementares: 1. BRADY, J. E.; HUMISTON, G. E. Química geral. Rio de Janeiro: LTC Editora, 1983. 2. FONTANA, Mars G.; GREENE. Norbert D. Corrosion engineering. Singapore: McGraw-Hill, 1978. 3. 4. 5. 6. O’CONNOR, Rod. Fundamentos de química. São Paulo: Harper e Row, 1977. PORST, Alfred. Semicondutores. São Paulo: Edgard Blϋcher, 1976. RAMANATHAN, Lalgudi V. Corrosão e seu controle. São Paulo: Hemus, 1990. SLABAUGH, Wendell H.; PARSONS, Theron D. Química geral. Rio de Janeiro: LTC Editora, 1977. ORIENTAÇÕES GERAIS Sistema de Avaliação: Conforme previsto no Regulamento da Organização Didático-Pedagógica dos Cursos de Graduação da UTFPR, capítulo VII, artigo 34, parágrafo 4º: “Considerar-se-á aprovado na disciplina, o aluno que tiver frequência igual ou superior a 75% (setenta e cinco por cento) e Nota Final igual ou superior a 6,0 (seis), consideradas todas as avaliações previstas no Plano de Ensino”.
Download