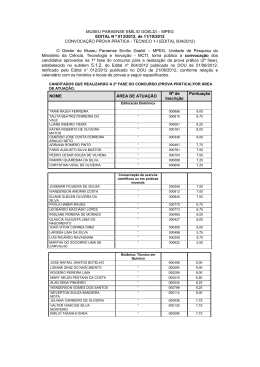
MUSEU PARAENSE EMÍLIO GOELDI UNIVERSIDADE FEDERAL DO PARÁ PROGRAMA DE PÓS-GRADUAÇÃO EM ZOOLOGIA CURSO DE MESTRADO EM ZOOLOGIA TAXOCENOSE DE SERPENTES DA ILHA DE MARAJÓ, ESTADO DO PARÁ, BRASIL Dissertação apresentada ao Curso de Pós-graduação em Zoologia, do convênio Museu Paraense Emílio Goeldi e Universidade Federal do Pará, como requisito parcial para obtenção do grau de mestre em Zoologia. Gerson Moreira Rodrigues Orientadora: Profa Dra. Ana Lúcia da Costa Prudente Co-orientador: Profº Fabiano Maschio BELÉM 2012 Dr. Gleomar GERSON MOREIRA RODRIGUES TAXOCENOSE DE SERPENTES DA ILHA DE MARAJÓ, ESTADO DO PARÁ, BRASIL Orientadora: Drª. Ana Lúcia da Costa Prudente Co-orientador: Dr. Gleomar Fabiano Maschio BELÉM 2012 GERSON MOREIRA RODRIGUES TAXOCENOSE DE SERPENTES DA ILHA DE MARAJÓ, ESTADO DO PARÁ, BRASIL ORIENTADORA: _____________________________________________________ DRª. ANA LÚCIA DA COSTA PRUDENTE MUSEU PARAENSE EMÍLIO GOELDI CO-ORIENTADOR: ___________________________________________________ DR. GLEOMAR FABIANO MASCHIO UNIVERSIDADE FEDERAL DO PARÁ AVALIADORES: _____________________________________________________ ______________________________________________________ ______________________________________________________ ______________________________________________________ ______________________________________________________ BELÉM 2012 iii D edico a Otávio Moreira de Carvalho e Antônio Gomes de Lima, homens de pouco estudo, mas de grandes saberes os quais devo muitas de minhas conquistas. iv AGRADECIMENTOS Este estudo não seria possível sem o apoio familiar, colaboração, paciência e dedicação de diversos profissionais e amigos que auxiliaram, colaboraram e criticaram construtivamente de forma a melhorar o resultado deste trabalho. Assim, agradeço a todos que participaram de forma direta e indiretamente na sua elaboração, especialmente: A minha Orientadora Drª Ana Lúcia da Costa Prudente, primeiramente pelo aceite na orientação, um ato “simples” e corriqueiro no dia-a-dia de grandes pesquisadores, mas de forte impacto na vida profissional de um estudante, pela oportunidade de trabalhar com serpentes deste bioma incrível que é a região amazônica, pela dedicação na construção, desenvolvimento e conclusão desta dissertação, mesmo nos momentos difíceis que passou, confiança em meu trabalho, paciência e amizade. Ao meu Co-Orientador e grande amigo Dr. Gleomar Fabiano Maschio, pela orientação, correções, ajuda, empréstimo de bibliografia, pelas valorosas sugestões que contribuíram para a melhoria do trabalho e por SEMPRE estar disponível nos momentos que precisei. A Drª Maria Cristina dos Santos-Costa, Drª. Marlúcia Bonifácio Martins e Dr. Marcos Pérsio pelas valiosas sugestões na melhoria deste estudo. Ao Dr. Leandro Juen, um dos melhores professores da Pós-Graduação, pela simplicidade, paciência e pela valorosa orientação nas análises estatísticas que foram de grande importância para a conclusão deste trabalho, especialmente o segundo capítulo. Ao Arthur Bispo pela ajuda nas análises estatísticas. Foi muito importante para a conclusão do segundo capítulo. Ao Marinus Steven Hoogmoed e Teresa Cristina Sauer de Ávila-Pires, pelo empréstimo de algumas bibliografias, anotações pessoais sobre os espécimes em estudo v e pela paciência na identificação dos conteúdos alimentares (anfíbios e lagartos), muitos deles praticamente irreconhecíveis. A este casal, tenho grande admiração que vai muito além do seu brilhante profissionalismo. Ao Dr. Wolmar Wosiacki e ao Luiz Peixoto pela ajuda na identificação dos peixes, a quem sou muito grato. Ao Dr. Jorge Gavinha pela receptividade e por disponibilizar-me muitas das coordenadas das localidades da Ilha de Marajó, sem as quais, este trabalho estaria incompleto. Ao Reginaldo Rocha (Rochinha) pelo empréstimo de bibliografia, paciência, dedicação e por ser meu “tira-dúvidas” nas inúmeras vezes que o procurei durante o levantamento de dados sobre a Ilha de Marajó. Ao Alessandro Menks pela amizade, importantes contribuições e auxílio nos meus passos iniciais na herpetologia. Ao Marco Antônio, pela ajuda com as coordenadas de Marajó e pelas infindáveis discussões na hora do almoço, que contribuíram na melhoraria deste trabalho. Ao Marcelo José Sturaro (Marcelinho) pelas inúmeras contribuições nas diversas etapas desta dissertação, que foram de fundamental importância para o desenvolvimento e melhoria deste trabalho. Ao Ângelo Dourado (Mano) pela ajuda na tradução dos resumos. Ao Alessandro Menks, Ana Monteiro-Leonel, Ângelo Dourado, Augusto Jarthe, Diego Meneghelli, Fagner Delfim, Gleomar Maschio, Henrique Costa, Hugo Coelho, Magno Travassos, Renato Gaiga e Ricardo Marques pela concessão de fotos. Ao Ângelo Dourado, Darlan Feitosa e João Carlos Costa pelo empréstimo de algumas bibliografias, sugestões e por estarem sempre disponíveis nos vários momentos que precisei. vi Ao Aderson Alcântara, Adriano Maciel, Alexandre Cordeiro, Annelise D’Angiolella (Anny), Ariane Silva, Cleiton (Romarinho), Chris Godinho, Fabrício Sarmento, Fernanda Silva, Francílio Rodrigues, Jerriane Gomes, Marcélia Bastos, Luana Gonçalves, Luciana Oliveira, Marcos Anaicy, Mel Oliveira, Paula Almeida, Priscila Medeiros e Thiago Nazareno que em algum momento durante o curso de mestrado foram de grande importância para meu aprendizado e/ou desenvolvimento deste trabalho. Às secretárias Dorotéia (Doró) e Wanessa, por sempre me ajudarem nos momentos que precisei e me auxiliaram nas questões relacionadas à Pós-Graduação. Aos moradores e sobreviventes da “Casa do Terror”, Shirliane Araújo, Luciana Frazão e Marina Meireles, mesmo com desentendimentos e discussões, permitiram que a amizade e companheirismo prevalecessem nestes tempos que estivemos longe de nossas famílias. A Antônia Santos, Bárbara Viana, Betto Figueira, Bruno Prudente, Daniel Coutinho, Fernanda Mendes, Guilherme Dutra, Jaderlan Bezerra, Java Mayrla, José Luiz (Zé), Kellen Matos, Leyde Cristina, Lywouty Reymond, Marianne Lourenço, Rodrigo Pena,Thiago Barbosa e Tiago Begot pela amizade formada e por proporcionarme bons momentos de descontração durante essa jornada longe da família. Ao CNPQ (Conselho Nacional de Desenvolvimento Científico e Tecnológico) pela concessão da bolsa de estudo. Ao Programa de Pós-Graduação, convênio Universidade Federal do Pará (UFPA) e Museu Paraense Emílio Goeldi (MPEG). A Secretaria de Educação e Cultura do Estado do Piauí (SEDUC) pela liberação e incentivo a capacitação profissional. Agradeço afetuosamente... A minha família, base de tudo! Principalmente: vii A meus pais, Otávio Moreira e Maria Madalena, pela educação a mim dada, incentivo e por apoiarem meus passos ao logo dos caminhos que escolhi seguir. A meus irmãos de Gilurlan Moreira e Gilson Moreira, pela carga de animo nas vezes que fui visitar minha terra querida. A minha esposa Iolanda da Silva Lima pelo apoio, incentivo e compreensão durante o tempo que fiquei afastado, buscando mais um passo para minha realização profissional. A minha filhota Lara Moreira Lima (Larinha), muitas vezes focada como fonte de motivação ao longo destes dois anos. A“Dina”, ao meu “sogro-pai” Antônio Gomes de Lima e “sogra-mãe” Doralice por cuidarem das duas mulheres da minha vida enquanto estive longe durante os anos de mestrado. A todos, meus mais sinceros agradecimentos. viii ÍNDICE DE FIGURAS INTRODUÇÃO GERAL FIGURA 1. Mapa indicando a localização da Ilha de Marajó e suas principais formações vegetais. Modificado do Projeto RADAM, 1974..................................... 7 FIGURA 2. Mapas da Ilha de Marajó, Estado do Pará, Brasil, mostrando: A) variação altimétrica; B) unidades morfoestruturais; C) temperatura em médias anuais; D) precipitação pluviométrica em médias anuais; E) período menos chuvoso; F) período mais chuvoso; G) divisão climática segundo a classificação de Koopen. (Fonte: A, C, D, E, F, G e H modificado de Lima et al., 2005; B, Adaptado do Projeto RADAM, 1974)........................................................................ 10 CAPÍTULO I FIGURA 1. Mapa indicando a proximidade da Floresta Nacional de Caxiuanã e da Ilha de Marajó, Estado do Pará, Brasil....................................................................... 28 FIGURA 2. Frequência absoluta das 55 espécies provenientes da Ilha de Marajó, Estado do Pará, Brasil, depositadas no MPEG e MZUSP entre os anos de 1958 e 2009............................................................................................................................ 36 FIGURA 3. Variação da razão entre Comprimento da Cauda (COCD) e Comprimento Total (COTO) de 24 espécies presentes na Ilha de Marajó, Estado do Pará, Brasil. Legenda: Letras acima das barras verticais referem-se ao substrato utilizado: S= Solo (terrestres, criptozóicas e fossoriais); V= Vegetação (arborícolas); e A= aquático (aquáticas). Os números abaixo referem-se a espécie: 1= Typhlops reticulatus; 2= Atractus natans; 3= Bothrops atrox; 4= Epicrates maurus; 5= Crotalus durissus; 6= Boa constrictor; 7= Liophis poecilogyrus; 8= Eunectes deschauenseei; 9= Leptodeira annulata; 10= Liophis taeniogaster; 11= Psomophis joberti; 12= Liophis almadensis; 13= Hydrodynastes gigas; 14= Thamnodynastes sp.; 15= Liophis reginae; 16= Liophis lineatus; 17= Helicops trivittatus; 18= Helicops leopardinus; 19= Helicops polylepis; 20= Helicops angulatus; 21= Oxybelis fulgidus; 22= Chironius fuscus; 23= Leptophis ahaetulla; 24= Philodryas argentea............................................................................................ 44 FIGURA 4. Distribuição temporal da ocorrência de folículos em vitelogênese secundária, ovos, embriões, filhotes e jovens de 37 espécies de serpentes presentes na Ilha de Marajó, Pará............................................................................................. 53 FIGURA 5. Dendrograma de agrupamento de uso de recursos baseado em informações de dieta, período de atividade e uso do substrato de forrageio de 61 58 ix espécies registradas para a Ilha de Marajó, Estado do Pará, Brasil........................... FIGURA 6. Curvas de rarefação da Ilha de Marajó e FLONA de Caxiuanã (continente). Linhas de cores claras representam variações com intervalo de confiança de 95%...................................................................................................... 64 FIGURA 7. Espécies registradas na Ilha de Marajó. a) Boa constrictor, Juruti, PA (Foto: Alessandro Menks); b) Corallus hortulanus, Itaituba, PA (Foto: Ângelo Dourado); c) Epicrates cenchria, Juruti, PA (Foto: Alessandro Menks); d) Eunectes murinus, Município de Abaetetuba, PA (Foto: Augusto Jarthe); e) Chironius carinatus, Município de Igarapé Mirim, PA (Foto: Augusto Jarthe); f) Chironius exoletus, Imbassaí, Município de Mata de São João, BA (Foto: Ricardo Marques); g) Chironius flavolineatus, Região Metropolitana de Salvado, BA (Foto: Hugo Coelho); h) Chironius fuscus, Rondônia (Foto: Fagner Delfim)....................................................................................................................... 138 FIGURA 8. Espécies registradas na Ilha de Marajó. a) Chironius multiventris, Porto Velho, RO (Foto: Monteiro Leonel); b) Dendrophidion dendrophis, Rondônia (Foto: Fagner Delfim); c) Drymarchon corais, Rondônia (Foto: Fagner Delfim); d) Leptophis ahaetulla, Município de Santa Barbara, PA (Foto: Augusto Jarthe); e) Mastigodryas boddaerti, Rondônia (Foto: Fagner Delfim); f) Mastigodrias boddaerti (Juvenil), Juruti, PA (Foto: Alessandro Menks); g) Oxybelis aeneus, Porto Velho, RO (Foto: Monteiro-Leonel); h) Oxybelis fulgidus, Porto Tronbetas, PA (Foto: Henrique Costa)............................................................. 139 FIGURA 9. Espécies registradas na Ilha de Marajó. a) Spilotes pullatus, Parque Metropolitano de Pituaçu, BA (Foto: Ricardo Marques); b) Tantilla melanocephala, Caetité, BA (Foto: Magno Travassos); c) Atractus schach, Porto Velho, RO (Foto: Renato Gaiga); d) Clelia clelia, São Geraldo do Araguaia, PA (Foto: Monteiro-Leonel); e) Dipsas indica, Rondônia, (Foto: Fagner Delfim); f) Drepanoides anomalus, Rondônia (Foto: Fagner Delfim); g) Helicops angulatus, Aripuanã, MT, (Foto: Henrique Costa); h) Helicops angulatus (Juvenil), Município de Abaetetuba, PA (Foto: Augusto Jarthe)............................................... 140 FIGURA 10. Espécies registradas na Ilha de Marajó. a) Helicops hagmanni, Rondônia, (Foto: Fagner Delfim); b) Helicops leopardinus, Porto Velho, RO (Foto: Diego Meneghelli); c) Helicops polylepis, Rondônia, (Foto: Fagner Delfim); d) Hydrodynastes gigas (Cabeça em detalhe), Porto Velho, RO (Foto: Monteiro-Leonel); e) Hydrops martii, Município de Abaetetuba, PA, (Foto: Augusto Jarthe); f) Imantodes cenchoa, Porto Velho, RO (Foto: Renato Gaiga); g) Leptodeira annulata, Rondônia (Foto: Fagner Delfim); h) Liophis almadensis, Parque Metropolitano de Tupiaçu, BA, (Foto: Ricardo Marques)............................. 141 FIGURA 11. Espécies registradas na Ilha de Marajó. a) Liophis lineatus, Cedro, CE (Foto: Fagner Delfim); b) Liophis meridionalis, Porto Velho, RO (Foto: Renato Gaiga); c) Liophis poecilogyrus, Santa Fé do Araguaia, TO, (Foto: Monteiro-Leonel); d) Liophis poecilogyrus (juvenil), Paraíba, (Foto: Fagner Delfim); e) Liophis reginae, Santa Fé do Araguaia, TO (Foto: Monteiro-Leonel); x f) Liophis taeniogaster, Município de Abaetetuba, PA, (Foto: Augusto Jarthe); g) Liophis typhlus (padrão marrom), Rondônia, (Foto: Fagner Delfim); h) Liophis typhlus (padrão verde), Rondônia, (Foto: Fagner Delfim)........................................ 142 FIGURA 12. Espécies registradas na Ilha de Marajó. a) Oxyrhopus melanogenys, São Geraldo do Araguaia, PA (Foto: Monteiro-Leonel); b) Oxyrhopus melanogenys (Cabeça em detalhe), Porto Velho, RO (Foto: Renato Gaiga); c) Oxyrhopus trigeminus, Paraíba, (Foto: Fagner Delfim); d) Philodryas argentea, Aripuanã, MT (Foto: Henrique Costa); e) Psomophis joberti, Cedro, CE (Foto: Fagner Delfim); f) Siphlophis cervinus, Porto Velho, RO (Foto: Renato Gaiga); g) Siphlophis compressus, Porto Velho, RO (Foto: Renato Gaiga); h) Micrurus filiformis, FLONA de Caxiuanã, PA (Foto: Gleomar Maschio)................................ 143 FIGURA 13. Espécies registradas na Ilha de Marajó. a) Micrurus hemprichii, Belém, PA (Foto: Ângelo Dourado); b) Micrurus ibiboboca, Parque Metropolitano de Pituaçú, BA (Foto: Ricardo Marques); c) Micrurus spixii, Rondônia (Foto: Fagner Delfim); d) Micrurus surinamensis (Juvenil), Porto Velho, RO (Foto: Diego Meneghelli); e) Typhlops reticulatus, Juruti, PA, (Foto: Alessandro Menks); f) Bothrops atrox, Porto Velho, RO (Foto: Renato Gaiga); g) Crotalus durissus, Porto-Velho, RO (Foto: Monteiro-Leonel); h) Lachesis muta, Porto Velho, RO (Foto: Renato Gaiga)...................................................................... 144 CAPÍTULO II FIGURA 1. Mapa da Ilha de Marajó indicando as principais formações vegetais e os pontos de coleta onde os exemplares analisados neste estudo foram coletados.................................................................................................................... 175 FIGURA 2. Localização da área florestada (1) e área aberta (2) da Ilha de Marajó e outras taxocenoses de diferentes formações vegetais usadas para avaliar a similaridade na composição de serpentes da Ilha: (3) Amazônia Oriental (Floresta Nacional de Caxiuanã e áreas adjacentes, PA; Maschio, 2008); (4) Norte da Amazônica (Guiana Francesa; Starace, 1998); (5) Amazônia Central (Manaus, AM; Martins e Oliveira, 1999); (6) Sudoeste da Amazônia (RO; Bernarde e Abe, 2006); (7) Transição Amazônia-cerrado (Querência, MT; Abe, 2010); (8) Cerrado (Sete Cidades, PI; Rocha e Prudente, 2010); (9) Cerrado (Itirapina, SP; Sawaya et al., 2008); (10) Transição Cerrado-Caatinga (Castelo do Piauí, PI; Rodrigues e Prudente, 2011); (11) Caatinga (Exu, PE; Vitt e Vangilder, 1983); (12) Pantanal (Paconé, MT; Strüssmann e Sazima, 1993)................................................................ 178 FIGURA 3. (A e B) Distribuição de espécies registradas, tanto em área florestada como em área aberta, na Ilha de Marajó, Pará: A) Bothrops atrox; B) Liophis taeniogaster (círculos) e Leptodeira annulata (quadrados). (C e D) Distribuição de espécies registradas apenas em áreas de floresta na Ilha de Marajó, Pará: C) Helicops hagmanni (quadrado), Chironius fuscus (triângulos), Lachesis muta (losangos), Atractus schach (círculo); D) Hydrops martii (círculo negro), Micrurus xi hemprichii (círculos preto/branco), Micrurus filiformis (triângulos), Siphlophis compressus (quadrado); (H, F, G e H) Distribuição de espécies registradas na metade oriental da Ilha de Marajó, Pará: E) Epicrates maurus (círculos), Crotalus durissus (triângulos); F) Liophis poecilogyrus; G) Psomophis joberti (círculos preto/branco), Liophis lineatus (quadrados claros), Chironius carinatus (quadrados negros); H) Eunectes deschauenseei (círculos), Helicops leopardinus (triângulos).................................................................................................................. 187 FIGURA 4. Riqueza de espécie de serpentes estimada pelo procedimento de Rarefação e Jackknife de primeira ordem, controlado pelo tamanho do esforço amostral de 12 quadrantes, Ilha de Marajó, Estado do Pará, Brasil. As barras representam um intervalo de confiança de 95%......................................................... 190 FIGURA 5. Curvas de acumulação de espécies usando a riqueza de espécie de serpentes estimada pelo procedimento de Rarefação, Ilha de Marajó, Estado do Pará, Brasil. a) Espécimes como unidade amostral; b) Quadrantes como unidade amostral. Legenda: as linhas pontilhadas e barras representam um intervalo de confiança de 95%........................................................................................................ 190 FIGURA 6. Diagrama de ordenação da Análise de Coordenadas Principais resultantes da composição de espécies de serpentes (presença ou ausência de 178 espécies). a) Entrada de dados de Marajó inserida em coluna única. Eixo 1: autovalor 1,23 e 36,26% de variância; Eixo 2: autovalor 0,51 e 15,20% de variância. b) Entrada de dados de Marajó inserida em duas colunas: área florestada e área aberta de Marajó. Eixo 1: autovalor 1,24 e 32,69% de variância; Eixo 2: autovalor 0,52 e 13,62% de variância ....................................................................... 193 FIGURA 7. Dendrograma da análise de agrupamento resultante da composição de espécies de serpentes (presença ou ausência de 178 espécies). a) Composição de serpentes da Ilha de Marajó analisada como um único conjunto de dados; b) Composição de serpentes da Ilha de Marajó analisada separando-se as duas unidades fisionômicas (área florestada e área aberta)................................................ 194 xii ÍNDICE DE TABELAS CAPÍTULO I TABELA 1. Lista das espécies registradas na Ilha de Marajó com base nos espécimes depositados no MPEG e MZUSP e em levantamentos bibliográficos. Legenda: n= número de espécimes depositadas no MPEG e/ou MZUSP; Traço= espécie não depositada nas coleções do MPEG e MZUSP (incluídas apud Nascimento et al.,1991); ?= espécie não mencionada por Yuki e Santos (1996)....... 29 TABELA 2. Conteúdos alimentares identificados e respectivos sentidos de ingestão registrados neste estudo, em serpentes da Ilha de Marajó, Pará, Brasil. Legenda: n= quantidade de serpentes com o respectivo conteúdo; A-P = Ântero-posterior; P-A = Póstero-anterior; algarismo arábico entre parêntese= número de presas no mesmo espécime; ?= possivelmente........................................................................................ 39 TABELA 3. Dieta, habitat e período de atividade para as espécies de serpentes presentes na Ilha de Marajó, Pará, Brasil, incluindo informações da literatura. Letras maiúsculas indicam que os itens alimentares, habitat e atividade são referidos como primários. Letras minúsculas indicam que os itens alimentares, habitat e atividade são referidos como ocasionais. Legenda: ave= aves, oav= ovos de aves, lag= lagartos, ola= ovos de lagartos, mol= moluscos, mam= mamíferos, pei= peixes, ser= serpentes, anu= anuros adultos, gir= girinos, sal= salamandras, afb= anfisbenas, cen= centopéias, art= artrópodes (exceto centopeias), min= minhocas, oni= onicóforos, aq= aquático, fo= fossorial, cr= criptozóico, te= terrestre, ar= arborícola, d= diurno, n= noturno, ?= suposição, traço= sem informação........................................................................................................ 47 TABELA 4. Distribuição temporal da ocorrência de folículos vitelogênicos secundários (Fo), ovos (Ov), embriões (Em), filhotes (Fi) e jovens (Jo) imaturos de 37 espécies de serpentes coletadas entre os anos de 1958 e 2009 na Ilha de Marajó, Pará, Brasil. Mais de uma ocorrência é indicada entre parênteses pelo respectivo algarismo arábico. Ocorrência de filhotes em destaque............................. 52 TABELA 5. Grupos formados a partir do dendrograma de agrupamento de uso de recursos, baseado em informações de dieta, período de atividade e uso do substrato de forrageio de 61 espécies registradas para a Ilha de Marajó, Estado do Pará, Brasil. Legenda: BOI= Boidae, COL= Colubridae, DIP= Dipsadidae, ELA= Elapidae, TYP= Typhlopidae e VIP= Viperidae........................................................ 59 TABELA 6. Relação das espécies registradas para a Ilha de Marajó, depositadas nas coleções herpetológicas do Museu Paraense Emílio Goeldi (MPEG), Museu de Zoologia da Universidade de São Paulo (MZUSP) e em registros de literatura, com indicação das espécies registradas na FLONA de Caxiuanã (Santos-Costa, 2003; Maschio, 2008). Legenda: n= úmero de espécimes; %= porcentagem do total do número de espécimes; - (traço)= sem registro; ?= registro de literatura.................... 61 TABELA 7. Número de espécimes, riqueza observada, riqueza estimada de serpentes, na Ilha de Marajó e FLONA de Caxiuanã, Estado do Pará, Brasil e riqueza esperada por rarefação para n= 439 (A) e n= 446 (B) espécimes para a FLONA de Caxiuanã. Entre parênteses, intervalo de confiança de 95%.................... 63 xiii CAPÍTULO II TABELA 1. Lista das espécies, abundância absoluta, e porcentagem do total do número de espécimes na área florestada e área aberta da Ilha de Marajó, Estado do Pará, Brasil, depositadas nas coleções herpetológicas do MPEG e MZUSP entre os anos de 1958 e 2009. Legenda: Traço (-)= sem registro ...................................... 179 TABELA 2. Número de espécimes, riqueza observada, riqueza estimada de serpentes, para área floresta e área aberta da Ilha de Marajó, Estado do Pará, Brasil e riqueza esperada por rarefação para n= 92 espécimes para área aberta da 189 Ilha de Marajó, Estado do Pará, Brasil .................................................................... TABELA 3. Matriz de similaridade (Coeficiente de Jaccard) entre 10 localidades analisadas e a Ilha de Marajó. Valores de similaridade (em %) entre as localidades, número de espécies registradas nas localidades (em negrito) e número de espécies comuns entre as taxocenoses analisadas (sublinhado). Valores representando maiores similaridade (>45%) estão destacados em cinza. Legenda: (1 e 2) MARJ= Ilha de Marajó (toda a ilha); (3) AORI= Amazônia oriental (FLONA de Caxiuanã e áreas adjacentes, PA, Maschio, 2008); (4) AGUI= Amazônia Guianense (Guiana Francesa, Starace, 1998); (5) ACEN= Amazônia central (Reserva Duke, AM, Martins e Oliveira, 1999); (6) ASUD= Sudeste da Amazônia, RO, Espigão do Oeste, Bernarde e Abe, 2006); (7) TACE= Transição Amazônia-cerrado (Querência, MT, Abe, 2010); (8) CEPI= Cerrado no Nordeste do Brasil (Parque Nacional de Sete Cidades, PI, Rocha e Prudente, 2010); (9) CEIT= Cerrado no Sudeste do Brasil (Itirapina, SP, Sawaya et al., 2008); (10) TCCA= Transição Cerrado-caatinga (Castelo do Piauí, PI, Rodrigues e Prudente, 2011); (11) CAAT= Caatinga (Exu, PE, Vitt e Vangilder, 1983); (12) PANT= Pantanal brasileiro (Poconé, MT, Strussmann e Sazima, 1993)................................ 195 TABELA 4 Matriz de similaridade (Coeficiente de Jaccard) entre 10 localidades analisadas e a Ilha de Marajó, considerando dois conjuntos de dados (área florestada e área aberta de Marajó). Valores de similaridade (em %) entre as localidades, número de espécies registradas nas localidades (em negrito) e número de espécies comuns entre as taxocenoses analisadas (sublinhado). Valores representando maiores similaridade (>45%) estão destacados em cinza. Legenda: (1) FLMJ= Área florestada de Marajó; (2) CAMJ= Área aberta de Marajó; (3) AORI= Amazônia oriental (FLONA de Caxiuanã e áreas adjacentes, Maschio, 2008); (4) AGUI= Amazônia Guianense (Guiana Francesa, Starace, 1998); (5) ACEN= Amazônia central (Reserva Duke, AM, Martins e Oliveira, 1999); (6) ASUD= Sudeste da Amazônia (Espigão do Oeste, RO, Bernarde e Abe, 2006); (7) TACE= Transição Amazônia-cerrado (Querência, MT, Abe, 2010); (8) CEPI= Cerrado no Nordeste do Brasil (Parque Nacional de Sete Cidades, PI, Rocha e Prudente, 2010); (9) CEIT= Cerrado no Sudeste do Brasil (Itirapina, SP, Sawaya et al., 2008); (11) CAAT= Caatinga (Exu, PE, Vitt e Vangilder, 1983); (10) TCCA= Transição Cerrado-caatinga (Castelo do Piauí, PI, Rodrigues e Prudente, 2011); (12) PANT= Pantanal brasileiro (Poconé, MT, Strussmann e Sazima, 1993) .......................................................................................................................... 196 xiv SUMÁRIO ÍNDICE DE FIGURAS...................................................................................................... ix ÍNDICE DE TABELAS .................................................................................................. xiii INTRODUÇÃO GERAL .................................................................................................. 1 DESCRIÇÃO DA ÁREA DE ESTUDO............................................................................... 6 REFERÊNCIAS BIBLIOGRÁFICAS................................................................................. 11 CAPÍTULO I: Taxocenose de Serpentes da Ilha de Marajó, Norte do Brasil: Composição, história natural e comparação de sua riqueza de espécies com a do continente............................................................................................................... 18 RESUMO........................................................................................................ 19 ABSTRACT..................................................................................................... 20 INTRODUÇÃO................................................................................................. 21 MATERIAL E MÉTODOS ................................................................................. Coleta de dados................................................................................... Análise de dados................................................................................. 23 23 24 RESULTADOS E DISCUSSÃO........................................................................... Composição de espécies...................................................................... Comentários taxonômicos................................................................... Número de espécimes.................................................................... Dieta.................................................................................................... Morfologia e uso do substrato............................................................. Uso do substrato e atividade diária..................................................... Ciclo reprodutivo................................................................................ Estrutura da taxocenose...................................................................... Comparação entre a riqueza de espécies da Ilha de Marajó e da FLONA de Caxiuanã (continente)..................................................... História natural das espécies............................................................... 29 29 32 35 38 44 47 51 55 REFERÊNCIAS BIBLIOGRÁFICAS.................................................................... 145 ANEXO I....................................................................................................... 166 60 67 xv CAPÍTULO II: Composição e distribuição de serpentes na Ilha de Marajó: Uma questão fitoecológica? ........................................................................................ 169 RESUMO........................................................................................................ 170 ABSTRACT.................................................................................................... 171 INTRODUÇÃO................................................................................................ 172 MATERIAL E MÉTODOS ................................................................................ Coleta de dados................................................................................... Análise de dados................................................................................. 174 174 176 RESULTADOS E DISCUSSÃO........................................................................... Composição de serpentes nas áreas florestada e abertas da Ilha de Marajó................................................................................................. Comparação da riqueza entre a área florestada e a área aberta da Ilha de Marajó.................................................................................... Similaridade da composição de espécies de serpentes da Ilha de Marajó com outras localidades............................................................ 179 REFERÊNCIAS BIBLIOGRÁFICAS.................................................................... 200 ANEXO I....................................................................................................... 206 ANEXO II....................................................................................................... 212 179 188 191 xvi INTRODUÇÃO GERAL A Amazônia é a floresta tropical com maior extensão e diversidade do mundo, e abrange mais de seis milhões de Km² em nove países da América do Sul (Silva et al., 2005). Sua composição florística e hídrica possui grande papel na manutenção da temperatura e da umidade, no regime hidrológico regional e nacional e no estoque de carbono terrestre (Silva et al., 2005). Sua fauna e flora compõem um mosaico de diferentes áreas de endêmismo, que são separadas pelos principais rios, onde cada um possui suas próprias biotas e relações evolutivas (Silva et al., 2005). Padrões gerais de distribuição de diferentes espécies na Amazônia, abordados em estudos biogeográficos, têm sido explicados através de uma abordagem histórica (Tuomisto e Ruokolainen, 1997). Inúmeras hipóteses biogeográficas têm sido propostas para explicar a considerável riqueza de espécies animais na Amazônia, tais como mudanças paleoclimáticas, elevação dos Andes, transgressões marinhas, barreiras fluviais, entre outras (Simpson e Haffer, 1978; Quijada-Mascareñas et al., 2007; Haffer, 2008). Eventos geológicos, como o isolamento da América do Sul durante quase todo o Cenozóico e a elevação dos Andes no Mioceno, formaram uma barreira geográfica que foi decisiva para os padrões de distribuição de espécies (Ron, 2000). As mudanças significativas nos padrões de drenagem ao norte da América do Sul, atribuídas ao surgimento dos Andes (Shephard et al., 2010) e os eventos mais recentes no Pleistoceno (como a diminuição da temperatura e umidade da Bacia Amazônica formando pequenas “ilhas” de florestas tropicais cercadas por habitats xéricos) (Haffer, 1969) também têm sido considerados fatores responsáveis pelos padrões de distribuição de muitos grupos de animais e vegetais (Ron, 2000). 1 Atualmente, estudos com diversos grupos animais têm revelado que os grandes rios amazônicos representam importantes barreiras geográficas e geralmente, resulta em diferenciações inter e intra-específicas (Ayres e Clutton-Brock, 1992; Hayes e Sewlal, 2004; Simões et al., 2008). No entanto, para os répteis a influência desses grandes rios amazônicos que funcionam como barreiras geográficas ainda é pouco conhecida. O grande número de espécies de répteis e altas taxas de endemismo (Ribeiro-Junior et al., 2006) colocam a Amazônia entre os biomas mais importantes e com a mais alta diversidade mundial (Bérnils e Costa, 2011). Entre as espécies de répteis encontradas em território brasileiro (732 de répteis), 375 são serpentes (Bérnils e Costa, 2011), das quais 149 (40%) ocorrem nos diferentes ambientes amazônicos e consequentemente constituem distintas taxocenoses (Ávila-Pires et al., 2007). Estudos com taxocenose podem gerar informações importantes sobre as respostas das diferentes espécies a fatores ecológicos (Ribeiro, 2007), bem como obter informações que podem auxiliar na compreensão dos fatores históricos que levaram a sua estruturação (Cadle e Greene, 1993). Os padrões estruturais em taxocenoses de serpentes neotropicais têm sido explicados levando-se em consideração fatores históricos (como linhagens filogenéticas, biogeografia e história de radiação de espécies) (e. g. Cadle e Greene, 1993; Martins, 1994; Marques, 1998) e ecológicos contemporâneos (como predação, competição e condições ambientais) (e. g. Henderson et al., 1979; Vitt e Vangilder, 1983). Trabalhos sobre taxocenoses de serpentes fornecem dados adicionais sobre história natural e ecologia, além de caracterizações de ciclos reprodutivos e dieta (e. g. Duellman, 1978; Hoogmoed, 1982; Dixon e Soini, 1986; Martins e Oliveira, 1999; Santos-Costa, 2003; Bernarde, 2004; Bernarde e Abe, 2006, 2010; Maschio, 2008). Para a maioria das espécies que constituem as taxocenoses de serpentes Amazônicas faltam informações 2 detalhadas sobre sua ecologia, sendo que para muitas delas as informações são inexistentes. Estudos de autoecologia proporcionam um conhecimento mais detalhado sobre a biologia das diversas espécies, fornecendo informações, principalmente, sobre padrões reprodutivos e alimentares, comportamento e morfologia. Neste contexto, vários estudos de autoecologia foram realizados com diferentes espécies, biomas e regiões brasileiras, os quais fornecem resultados que auxiliam na compreensão dos possíveis fatores responsáveis pela estruturação das comunidades (e. g.: Tantilla melanocephala e Dendrophidion dendrophis para a Amazônia - SantosCosta et al., 2006; Prudente et al., 2007; Helicops leopardinus e Bothrops mattogrossensis para o Pantanal - Ávila et al., 2006; Monteiro et al., 2006; Bothrops neuwiedi pauloensis e Pseudoboa nigra para o Cerrado - Valdujo et al.,2002; Orofino et al., 2010; Dipsas neivai e Dipsas catesbyi para a Mata Atlântica - Alves et al., 2005). A dieta de uma espécie é um dos aspectos mais importante da sua ecologia, sendo que em muitas ocasiões, informações sobre os hábitos alimentares são necessárias para compreensão das relações das serpentes como o ambiente e/ou questões comportamentais (Clark, 2002). Desta forma, os resultados obtidos através do estudo do conteúdo estomacal das diversas espécies podem proporcionar uma ferramenta importante para a compreensão das relações das serpentes com o ambiente. Muitos estudos disponíveis na literatura sobre a dieta das serpentes consistem de listas das presas encontradas nos estômagos de espécimes preservados em coleções. Estes dados podem aumentar o conhecimento sobre a importância dos itens alimentares da dieta das espécies, bem como o habitat e microhabitat utilizado pelas serpentes, uma vez que a disponibilidade, a distribuição e a abundância das presas podem influenciar sua dieta, como também o ambiente utilizado pelas mesmas (Hartmann et al., 2003; Ruffato et al., 2003; Pough et al., 2004; Leite et al., 2007). Populações amplamente 3 distribuídas podem apresentar especializações, adaptações locais ou ainda variações geográficas na dieta, em função da disponibilidade e dos hábitos de suas presas em diferentes regiões (Hartmann et al., 2003). Assim como a dieta, a reprodução das serpentes amazônicas é outro segmento que necessita ser mais explorado, pois faltam dados disponíveis sobre os aspectos reprodutivos para a maioria das espécies desta região. O conhecimento atual acerca da biologia reprodutiva expõe padrões e tendências ecológicas delineados em espécies de regiões temperadas, tendo como base os estudos realizados na Austrália, América do Norte e Europa (Pizzato et al., 2007). No Brasil, os estudos concentram-se, principalmente, nas regiões Sul e Sudeste, reforçando a necessidade de estudos na região amazônica, uma vez que as espécies de regiões de clima temperado podem apresentar aspectos reprodutivos divergentes das que ocorrem em regiões tropicais (e. g. ver Pizzato (2003)). Alguns autores associaram a extensão do ciclo reprodutivo à estabilidade climática da região, influenciando no padrão reprodutivo contínuo das espécies de regiões tropicais. Porém, isso não explica a presença de ciclo sazonal e contínuo em espécies simpátricas (Albarelli, 2007). A extensão do ciclo reprodutivo pode estar historicamente ligada a linhagens filogenéticas, sendo os fatores ecológicos contemporâneos insuficientes para explicar sua extensão (Marques, 1996). Embora alguns estudos tenham apontado uma tendência para o período reprodutivo não sazonal de serpentes amazônicas (e. g. Duellman, 1978; Fitch, 1982; Santos-Costa, 2003; Maschio, 2008), essa hipótese parece não ser válida para todas as espécies. Mesmo nos trópicos, onde a estabilidade climática é maior em relação às regiões temperadas, o recrutamento de juvenis parece ocorrer, principalmente, durante a estação chuvosa em algumas espécies como Dipsas pavonina, Helicops angulatus, Philodryas argentea e Anilius scytale (Martins e Oliveira, 1999; Maschio et al., 2007). 4 Isso estaria relacionado, segundo Martins e Oliveira (1999), à prolongada estação seca que ocorre na região, o que restringiria o recrutamento de juvenis neste período, especialmente para espécies cujos juvenis alimentam-se de presas altamente sazonais como, por exemplo, os anfíbios. O grande número de expedições científicas realizado ao longo das últimas décadas, com o registro de um grande número de serpentes, associado à condição de maior ilha fluvial do mundo (Goulding et al., 2003), com grande diversidade ambiental, faz da Ilha de Marajó, Estado do Pará, um local com grande potencial para o desenvolvimento de estudos de taxocenoses de serpentes amazônicas. Neste contexto, este estudo tem como objetivo responder as seguintes perguntas: Como a taxocenose de serpentes está estruturada na Ilha de Marajó? Como as espécies de serpentes estão distribuídas nos diferentes ambientes da Ilha (áreas abertas e florestais)? Existe um padrão de distribuição das serpentes presentes na Ilha? Existem diferenças quanto à composição de espécies entre as áreas florestadas e abertas? Se existe, este estaria associado às duas unidades fitoecológicas presentes na Ilha? Qual a semelhança, em termos de composição, da taxocenose de serpentes da Ilha de Marajó com as de outras regiões na Amazônia? Para tanto, este estudo está organizado em dois capítulos, que serão submetidos para publicação em revista científica: o primeiro intitulado “Taxocenose de Serpentes da Ilha de Marajó, Norte do Brasil: Composição, história natural e comparação de sua riqueza de espécies com a do continente”; e o segundo intitulado “Composição e distribuição de serpentes da Ilha de Marajó: Uma questão fitoecológica?”. Os textos estão formatados segundo as regras da revista South American Journal of Herpetology. 5 DESCRIÇÃO DA ÁREA DE ESTUDO A Ilha de Marajó, localizada na foz do Rio Amazonas, ao norte do Estado do Pará, é limitada ao sul pelo Rio Pará, ao norte pelo oceano Atlântico, a leste pela baía de Marajó e a oeste pelo Rio Amazonas. Com uma área aproximada de 49.000 Km2 (Goulding et al., 2003), a Ilha de Marajó possui 12 dos 16 municípios existentes no arquipélago (Figura 1). A cobertura vegetal, com espécies tanto de terra firme quanto de várzeas, reflete as características topográficas da Ilha (Furtado et al., 2009). Os diferentes padrões de vegetação observados estão relacionados ao seu processo de formação, com florestas densas prevalecendo em áreas mais antigas, enquanto que a vegetação aberta é encontrada em áreas de sedimentação mais recente do Holoceno (Rossetti e Toledo, 2006). Segundo o Projeto RADAM (1974), a Ilha apresenta três regiões ecológicas: as florestas densas, predominantes na metade ocidental; as formações pioneiras (campos aluviais), abrangendo praticamente toda a metade oriental da Ilha; e o Cerrado, predominante nas regiões centro-norte e sudeste da Ilha (Figura 1). 6 Figura 1. Mapa indicando a localização da Ilha de Marajó e suas principais formações vegetais. Modificado do Projeto RADAM, 1974. De um modo geral, podem ser observadas duas fisionomias bem distintas na Ilha de Marajó, uma de campos abertos na metade oriental, e outra de floresta densa na metade ocidental (Nascimento et al., 1991). Na área de campos, que permance alagada durante os meses de chuvas mais intensas, ocorre uma formação aluvial-campestre, onde predominam capim perene de porte relativamente baixo (Paratheria prostata, Cyperus giganteus, Panicum spp. (Nascimento et al., 1991). Ao norte e sudeste da Ilha, ocorrem as áreas de campos altos, conhecidos como tesos, onde predominam vegetação de Cerrado, raramente atingidas por inundações, sendo recobertas por sinúsia rasteira graminosa de capim “barba-debode” (Aristida e Eragrostis) e sinúsia arbórea, denominada “mangaba” (Hancornia speciosa), “caimbé” (Curatella americana) e “murici” (Byrsonima sp.) (Projeto RADAM, 1974; Nascimento et al., 1991). 7 Na metade ocidental, onde as florestas se desenvolvem em terrenos mais antigos do quarternário (Rossetti e Toledo, 2006), a composição florística é semelhante à das outras ilhas da foz do Rio Amazonas, porém com espécies mais relacionadas às florestas do continente (Projeto RADAM, 1974). Destacam-se, no estrato mais alto, leguminosas como o “jutaí-açu” (Hymenaea courbaril), “tachi” (Triplaris surinamensis), “ipês” (Macrolobiums sp.), além de espécies típicas de inundação, como o “anani” (Symphonia globulifera), “ucuuba” (Virola surinamensis) e “sumaúma” (Ceiba pentandra) (Projeto RADAM, 1974; Nascimento et al., 1991). Constituída por terrenos de origem sedimentar recente, a Ilha apresenta uma topografia que pouco ultrapassa os 15 metros de altitude (Figura 2A) (Lima et al., 2005). A compartimentalização topográfica regional é representada por duas unidades morfoestruturais do relevo amazônico: o Planalto Rebaixado da Amazônia (do Baixo Amazonas) e a Planície Amazônica (Furtado et al., 2009). A região mais baixa da Ilha, a oriental, está sujeita a grandes inundações periódicas (Goulding et al., 2003) (Figura 2B), formando uma área aluvial campestre, constituída por uma enorme bacia que recolhe a água da chuva inundando a área por cerca de seis a oito meses por ano (Gouldinget al., 2003), permanecendo inundada sobretudo entre os meses de janeiro a junho (Furtado et al., 2009). Esta área possui em seu interior o Lago Arari que, igualmente, enche ou diminui sua vazão no período chuvoso e seco, respectivamente. Em torno do Lago Arari estão presentes áreas de acumulação flúvio-lacustres periodicamente inundáveis, algumas lagoas e áreas de igapó. Este lago, como o rio do mesmo nome, constitui a principal unidade hidrográfica da região dos campos. Ainda na região oriental, outras formações pioneiras são frequentes, como os manguezais, a vegetação densa de planície aluvial e a vegetação do litoral (Furtado et al., 2009). 8 A média geral da temperatura do ar na Ilha de Marajó é de 27°C, com pouca variação mensal e anual. Os limites médios mensais estão entre 25°C e 29°C, sendo mais baixos na região florestal que na região de campos aluviais. As temperaturas mínimas absolutas atingem 18°C e as máximas 38°C. Duas regiões distintas podem ser observadas no mapa de temperatura do ar (Figura 2C): a região oriental com temperatura médias anuais de 27,3°C; e a região ocidental com 25,7°C de temperatura média anual, o que evidencia a influência da vegetação sob este parâmetro (Lima et al., 2005). A precipitação pluviométrica, em média anual, torna-se mais elevada à medida que há deslocamento da região Leste para a região Oeste (Figura 2D). Isto acontece tanto no período menos chuvoso (junho a novembro) (Figura 2E) quanto no mais chuvoso (dezembro a maio) (Figura 2F). Este aumento progressivo das chuvas condiciona a transição das áreas de campos naturais para a floresta (Lima et. al., 2005). Na faixa de transição entre as áreas de campo e áreas de florestas encontram-se os menores valores de umidade relativa do ar, crescendo tanto na direção leste quanto na direção oeste (Figura 2G). Na região de floresta densa ocorre um aumento da umidade relativa do ar chegando a 94%, influenciado pela vegetação, enquanto que a umidade diminui em direção a região de campos influenciada pelos ventos litorânea presentes na região (Lima et al., 2005). Segundo a classificação de Köppen, que distingue o clima a partir da temperatura anual, da precipitação anual e da temperatura média do mês mais frio, a Ilha de Marajó apresenta duas subclassificações climáticas que determinam o regime de umidade: Af – Clima Tropical Úmido, com o mês mais seco tendo uma precipitação média maior ou igual a 60 mm; e Am – Clima Tropical Úmido de Monção, com precipitação excessiva durante alguns meses (Lima et. al, 2005) (Figura 2H). 9 Figura 2. Mapas da Ilha de Marajó, Estado do Pará, Brasil, mostrando: A) variação altimétrica; B) unidades morfoestruturais; C) temperatura em médias anuais; D) precipitação pluviométrica em médias anuais; E) período menos chuvoso; F) período mais chuvoso; G) divisão climática segundo a classificação de Koopen. (Fonte: A, C, D, E, F, G e H modificado de Lima et al., 2005; B, Adaptado do Projeto RADAM, 1974). 10 REFERÊNCIAS BIBLIOGRÁFICAS Albarelli, L. P. P. 2007. Biologia reprodutiva e alimentar de Liophis reginae semilineatus (Wagler, 1824) e Liophis taeniogaster JAN, 1863 (Serpentes, Colubridae, Xenodontinae) da Amazônia Oriental, Brasil. Ms. Dissertação. Museu Paraense Emílio Goeldi, Belém, 100 pp. Alves, F. Q., A. J. S. Argolo e J. JIM. 2005. Biologia reprodutiva da Dipsas neivai Amaral e D. catesbyi (Sentzen) (Serpentes, Colubridae) no sudeste da Bahia, Brasil. Revista Brasileira de Zoologia, 22: 573-579. Ávila, R. W., V. L. Ferreira e J. A. O. Arruda. 2006. Natural History of the South American Water Snake Helicops leopardinus. (Colubridae: Hydropsini) in the Pantanal, Central Brazil. Journal of Herpetology, 40: 274–279. Ávila-Pires, T. C. S., M. S. Hoogmoed e L. Vitt. 2007. Herpetofauna da Amazônia; pp. 13-43. Em: L. B. Nascimento e M. E. Oliveira (Eds.). Herpetologia no Brasil II. Sociedade Brasileira de Herpetologia, Belo Horizonte. Ayres, J. M. e T. H. Clutton-Brock. 1992. River, boundaries and species range size in Amazonian primate. American Naturalist, 140: 531-537. Bernarde, P. S. 2004. Composição faunística, ecologia e história natural de serpentes em uma região no sudoeste da Amazônia, Rondônia, Brasil. Tese. Universidade Estadual Paulista Júlio de Mesquita Filho, Rio Claro, 139 pp. Bernarde, P. S. e A. S. Abe. 2006. A snake community at Espigão do Oeste, Rondônia, southwestern Amazon, Brazil. South American Journal of Herpetology 1: 102113. Bernarde, P. S. e A. S. Abe. 2010. Hábitos alimentares de serpentes em Espigão do Oeste, Rondônia, Brasil. Biota Neotropical 10: 167-173. 11 Bérnils, R. S. e H. C. Costa (Eds.). 2011. Brazilian reptiles. List of species. Disponível em http://www.sbherpetologia.org.br/. Sociedade Brasileira de Herpetologia. Captured on February 2012. Cadle, J. E. e H. W. Greene. 1993. Phylogenetic patterns, biogeography, and ecological structure of neotropical snake assemblages; pp. 281-293. Em: R. E. Ricklefs e D. Schluter (Eds.), Species diversity in ecological communities. Historical and geographical perspectives. University of Chicago Press, Chicago. Clark, R. W. 2002. Diet of the Timber Rattlesnake, Crotalus horridus. Journal of Herpetology 36: 494-499. Dixon, J. R. e P. Soini. 1986. The reptiles of the upper Amazon Basin, Iquitos region, Peru. Milwaukee Public Museum, Milwaukee, 154 pp. Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. University of Kansas Museum Natural History, Miscellaneous Publication, 65: 1-352. Fitch, H. S. 1982. Reproductive cycles in tropical reptiles. Occasional Papers Museum Natural History. University of Kansas, 96: 1-53. Furtado, A. M. M., C. F. França e M. A. S. Pimentel. 2009. Relação Relevo-SoloVegetação da Ilha de Marajó. Em: XI Simpósio Nacional e Geografia Física Aplicada, Viçosa, Minas Gerais. Anais do XI Simpósio Nacional e Geografia Física Aplicada. Viçosa, Minas Gerais, Brasil. Goulding, M., R. Bartheme e E. Ferreira. 2003. The Smithsonian atlas of the Amazon. Smithsonian Institution. Washington, 253 pp. Haffer, J. 1969. Speciation in Amazonian Forest birds. Science 165: 131-137. Haffer, J. 2008. Hypotheses to explain the origin of species in Amazonia. Brazilian Journal of Biology, 68: 917–947. 12 Hartmann, P. A., M. T. Hartmanne e L. O. M. Giasson. 2003. Uso de hábitat e alimentação em juvenis de Bothrops jararaca (Serpentes, Viperidae) na Mata Atlântica do Sudeste do Brasil. Phyllomedusa 2: 35-41. Hayes, F. E. e J. N. Sewlal. 2004. The Amazon River as a dispersal barrier to passerine birds: effects of river width, habitat and taxonomy. Journal of Biogeography, 31:1809-1818 Henderson, R. W., J. R. Dixon e P. Soini. 1979. Resource Partitioning in Amazonian snakes communities. Contributions in Biology and Geology 22:1-11. Hoogmoed, M. S. 1982. Snakes of the Guianan region. Memória do Instituto Butantan, 46: 219-254. Leite, P. T., S. F. Nunes e S. Z. Cechin. 2007. Dieta e uso de habitat da Jararaca-dobrejo, Mastigodryas bifossatus Raddi (Serpente, Colubridae) em domínio subtropical do Brasil. Revista Brasileira de Zoologia, 24: 729-734. Lima, A. M. M., L. L. Oliveira, R. L. Fontinhas e R. J. S. Lima. 2005. Ilha de Marajó : Revisão Histórica Hidroclimatológica, Bacias Hidrográficas e Propostas de Gestão. Holos Environment, 5: 65-80. Marques, O. A. V. 1996. Biologia reprodutiva de Erythrolamprus aesculapii Linnaeus (Colubridae), no sudeste do Brasil. Revista Brasileira de Zoologia, 13: 747-753. Marques, O. A. V. 1998. Composição faunística, história natural e ecologia de serpentes da Mata Atlântica, na região da Estação Ecológica Juréia-Itatins. Tese. Instituto de Biociências, Universidade de São Paulo, São Paulo, 135 pp. Martins, M. 1994. História Natural e Ecologia de uma Taxocenose de Serpentes de Mata na Região de Manaus, Amazônia Central, Brasil. Tese. Instituto de Biologia, Universidade Estadual de Campinas, Campinas, 98 pp. 13 Martins, M. e M. E. Oliveira. 1999. Natural history of snakes in forests of the Manaus region, Central Amazonia, Brazil. Herpetological Natural History, 6: 78-150. Maschio, G. F. 2008. História natural e ecológica das serpentes da Floresta Nacional de Caxiuanã e áreas adjacentes, Pará, Brasil. Tese. Museu Paraense Emílio Goeldi, Belém, 214 pp. Maschio, G. F., A. L. C. Prudente, A. C. Lima e D. T. Feitosa. 2007. Reproductive biology of Anilius scytale (Linnaeu, 1758) (Serpentes, Aniliidae) from eastern Amazonia, Brazil. South American Journal of Herpetology, 2: 179-183. Monteiro, C., C. E. Montgomery, F. Spina, R. J. Sawaya e M. Martins. 2006. Feeding, Reproduction, and Morphology of Bothrops mattogrossensis (Serpentes, Viperidae, Crotalinae) in the Brazilian Pantanal. Journal of Herpetology, 40: 408– 413. Nascimento, O. R., T. C. S. Ávila-Pires, I. N. F. Santos e A. C. M. Lima. 1991. Répteis de Marajó e Mexiana, Pará, Brasil. I. Revisão bibliográfica e novos registros. Boletim do Museu Paraense Emílio Goeldi, 7: 25-41. Oronifo, R. P., L. Pizzato e O. A. V. Marques. 2010. Reproductive biology and food habits of Pseudoboa nigra (Serpentes: Dipsadidae) from the Brazilian cerrado. Phyllomedusa, 9: 53-61. Pizzato, L. 2003. Reprodução de Liophis miliaris (Serpentes: Colubridae) no Brasil: influência histórica e variações geográficas. Ms. Universidade Estadual de Campinas. Campinas, São Paulo, Brasil, 92 pp. Pizzato, L., S. M. Almeida-Santos, e O. A. V. Marques. 2007. Biologia reprodutiva das serpentes brasileiras. pp. 201-221. Em: L. B. Nascimento e M. E. Oliveira. (Eds.). Herpetologia no Brasil II. Belo Horizonte. 14 Projeto RADAM, Brasil. 1974. Folha SA.22. Levantamento de recursos naturais. geologia, geomorfologia, solos, vegetação e uso potencial da terra. Departamento Nacional de Produção Mineral, Rio de Janeiro, Volume 5. Prudente, A. L. C., G. F. Maschio, C. E. Yamashina e M. C. Santos-Costa. 2007. Morphology, Reproductive Biology e diet of Dendrophidion dendrophis (Schlegel, 1837) (Serpentes, Colubridae) in Brazilian Amazon. South American Journal of Herpetology, 2: 53-58. Pough, F. H., R. M. Andrews, J. E. Cadle, M. L. Crump, A. H. Savitzky e K. D. Wells. 2004. Herpetology. Pearson Prentice-Hall, Upper Saddle River, New Jersey, 724 pp. Rossetti, D. F. e P. M. Toledo. 2006. Biodiversity from a historical geology perspective: a case study from Marajó Island, lower Amazon. Geobiology, 4: 215-223. Quijada-Mascareñas, J. A., J. E. Ferguson, C. E. Pook, M. G. Salomão, R. S. Thorpe e W. Wüster. 2007. Phylogeographic patterns of trans-Amazonian vicariants and Amazonian biogeography: the Neotropical rattlesnake (Crotalus durissus complex) as an example. Journal of Biogeography, 1-17. Ribeiro, R. A. K. 2007. História natural de uma taxocenose de serpentes da RPPN Acurizael e áreas adjacentes, Serra do Amolar, Borda oeste do Pantanal, Corumbá, Mato Grosso do Sul, Brasil. Ms. Dissertação. Universidade Federal do Mato Grosso, Cuiabá, 137 pp. Ribeiro-Júnior, M. A., T. A. Gardner e T. C. S. Ávila-Pires. 2006. The effectiveness of glue traps to sample lizards in a tropical rainforest. South American Journal of Herpetology, 1: 131-137. Ron, S. R 2000. Biogeographic area relationships of lowland Neotropical rainforest based on raw distributions of vertebrate groups. Biological journal of the Linnean Society, 71: 379-402. 15 Ruffato, R., M. Di-Bernardo e G. F. Maschio. 2003. Dieta de Thamnodynastes strigatus (Serpentes, Colubridae) no sul do Brasil. Phyllomedusa, 2: 27-34. Santos-Costa, M. C. 2003. História natural das serpentes da Estação Científica Ferreira Penna, Floresta Nacional de Caxiuanã, Melgaço, Pará, Brasil. Tese. Pontifícia Universidade Católica do Rio Grande do Sul, Porto Alegre, 87 pp. Santos-Costa, M. C., A. L. C. Prudente e M. Di-Bernardo. 2006. Reproductive Biology of Tantilla melanocephala (Linnaeus, 1758) (Serpentes, Colubridae) from Eastern Amazonia, Brazil. Journal of Herpetology, 40: 553-556. Shephard, G. E., R. D. Müller, L. Liu e M. Gurnis. 2010. Miocene drainage reversal of the Amazon River driven by plate-mantle interaction. Nature geosciences, 3: 870875. Silva, J. M. C., A. B. Rylands e G. A. B. Fonsseca. 2005. O destino das áreas de endemismo da Amazônia. Megadiversidade, 1: 124-131. Simões, P. I., A. P. Lima, W. E. Magnusson, W. Hödl e A. Amézquita. 2008. Acoustic and morphological differentiation in the frog Allobates femoralis: relationships with the upper Madeira River and other potential geological barriers. Biotropica, 40: 607-614. Simpson, B. B. e J. Haffer. 1978. Speciation patterns in the Amazonian forest biota. Annual Review of Ecology and Systematic, 9: 497-518. Tuomisto, H. e K. Ruokolainen. 1997. The role of ecological Knowledge in explaining biogeography and biodiversity in Amazonia. Biodiversity and Conservation, 6: 347-357. Valdujo, P. H., C. Nogueira e M. Martins. 2002. Ecology of Bothrops neuwiedi pauloensis (Serpentes: Viperidae: Crotalinae) in the Brazilian Cerrado. Journal of Herpetology, 36 (2): 169-176. 16 Vitt, L. J. e L. D. Vangilder. 1983. Ecology of a snakes community in northeastern Brazil. Amphibia-Reptilia, 4:273-296. 17 CAPÍTULO I TAXOCENOSE DE SERPENTES DA ILHA DE MARAJÓ, NORTE DO BRASIL: COMPOSIÇÃO, HISTÓRIA NATURAL E COMPARAÇÃO DE SUA RIQUEZA DE ESPÉCIES COM A DO CONTINENTE 18 TAXOCENOSE DE SERPENTES DA ILHA DE MARAJÓ, NORTE DO BRASIL: COMPOSIÇÃO, HISTÓRIA NATURAL E COMPARAÇÃO DE SUA RIQUEZA DE ESPÉCIES COM A DO CONTINENTE Gerson M. Rodrigues1 ¹ Programa de Pós-Graduação em Zoologia da Universidade Federal do Pará/Museu Paraense Emílio Goeldi. Avenida Perimetral, 1901. Caixa Postal 399, Terra Firme, Belém, Pará, CEP 66017-970, Brasil. E-mail: [email protected] Resumo: Este estudo aborda a composição e história natural das serpentes presentes na Ilha de Marajó, Estado do Pará, Brasil, baseado em 439 espécimes depositados nas Coleções Herpetológicas do Museu Paraense Emílio Goeldi (MPEG) e Museu de Zooologia da Universidade de São Paulo (MZUSP), entre os anos de 1958 e 2009, além de registros de literatura. A Ilha de Marajó, com 49.000 Km2, está localizada na foz do Rio Amazonas, apresentando, predominantemente, dois tipos de ecossistemas: florestas densas, prevalecendo na sua metade ocidental e áreas abertas prevalecendo na sua metade oriental. Foram registradas 62 espécies de serpentes na Ilha de Marajó, distribuídas em seis famílias: Boidae (n= 6; 9,7%), Colubridae (n= 14; 23%), Dipsadidae (n= 32; 52%), Elapidae (n= 5; 8,1%), Typhlopidae (n= 1; 1,6%) e Viperidae (n= 4; 6,5%). Nove espécies (Atractus natans, Atractus schach, Dendrophidion dendrophis, Helicops hagmanni, Hydrops martii, Liophis meridionalis, Liophis typhlus, Philodryas argentea e Siphlophis cervinus) são citados pela primeira vez na área de estudo. Dentre as espécies com maior abundância relativa estão Liophis poecilogyrus (n= 94; 21,41%), Bothrops atrox (n= 36; 8,2%) e Liophis taeniogaster (n= 34; 7,74%). A riqueza de serpentes da Ilha é comparada pelo método de rarefação com a Floresta Nacional de Caxiuanã, uma área continental próxima. O número elevado de espécies presentes na Ilha evidencia sua alta riqueza a qual não difere da observada na região continental. Foram obtidos dados alimentares de 28 espécies de serpentes, sendo “anuros” o item mais consumido, seguido por “mamíferos” e “lagartos”. Observou-se a prevalência do sentido de ingestão ântero-posterior (n= 36; 71%) em relação ao pósteroânterior (n= 15; 29%). Na Ilha predominam serpentes primariamente terrestres (n= 22; 36%), seguidas por serpentes de hábitos arborícolas ou semi-arborícolas (n= 19; 31%), aquáticas ou semi-aquáticas (n= 12; 20%), fossoriais (n= 7; 11%) e criptozóicos (n= 1; 2%). Quanto à atividade diária, 30 (49%) das espécies são primariamente diurna, 17 (28%) são primariamente noturnas e 14 (23%) são diurnas e noturnas. Dados reprodutivos de 37 espécies foram obtidos, sendo que para as espécies aquáticas ou associadas a ambientes alagados, os filhotes, juvenis e fêmeas com ovos ou embriões foram capturados em quase todos os meses do ano (exceto janeiro), enquanto que para as demais espécies foram capturados filhotes, juvenis e fêmeas, principalmente durante a estação chuvosa. Os Dipsadidae apresentam o maior número de espécies, seguido pelos Colubridae, sendo este padrão de riqueza é semelhante a outras taxocenoses de serpentes sulamericanas. No entanto, espécies como Bothrops marajoensis, Chironius flavolineatus, Crotalus durissus, Eunectes deschauenseei, Epicrates maurus, Helicops leopardinus, Liophis poecilogyrus, Thamnodynastes lanei, Thamnodynastes sp. e Psomophis joberti parecem ocorrer apenas na metade oriental da Ilha de Marajó. Assim, tanto fatores históricos como ecológicos devem ter papeis importantes na estruturação da taxocenose de serpentes da Ilha de Marajó. Palavras chaves: Ilha de Marajó, Taxocenose, Amazônia, História natural, Riqueza 19 Abstract: This study addresses the composition and the natural history of the snakes form the Marajó Island, State of Pará, Brazil, based on 439 specimens deposited in the herpetological collections of the Museu Paraense Emílio Goeldi (MPEG) and Museu de Zooologia da Universidade de São Paulo (MZUSP) between the years of 1958 and 2009, and in addition to the literature records. The Marajó Island presents 49.000 Km2 and is located in the mouth of the Amazon River, with basically two types of ecosystems: dense forests, existing in its western half and open areas, prevailing in its eastern half. We recorded 62 species of snakes on the Marajó Island, distributed in six families: Boidae (n= 6; 9.7%), Colubridae (n= 14; 23%), Dipsadidae (n= 32; 52%), Elapidae (n= 5; 8.1%), Typhlopidae (n= 1; 1.6%) and Viperidae (n= 4; 6.5%). New registers to nine species are cited in this study (Atractus natans, Atractus schach, Dendrophidion dendrophis, Helicops hagmanni, Hydrops martii, Liophis meridionalis, Liophis typhlus, Philodryas argentea and Siphlophis cervinus). Among the species with the highest relative abundance we can see Liophis poecilogyrus (n= 94; 21.41%), Bothrops atrox (n= 36; 8.2%) and Liophis taeniogaster (n= 34; 7.74%). The richness of the snakes of the island by the method of rarefaction is compared with the Caxiuanã National Forest, a near continental area. The high number of species present on the island shows its high richness, which, apparently, not differ from the others richness in mainland. We obtained dietary data form 28 snakes species, being anuran the most consumed item (eaten by 18 species), followed by mammals (five species) and lizards (four species). Relative to the direction of ingestion we observed the predominance of the anterior-posterior (n= 36; 71%) in relation to the posterior-anterior (n= 15; 29%). On the Marajó Island predominate the primarily or exclusively terrestrial snakes (n= 22; 36%), Followed by arboreal or semi-arboreal snakes (n= 19; 31%), aquatic or semiaquati (n= 12; 20%), fossorial (n= 7; 11%) and criptozóicos (n= 1; 2%). Relative to the daily activity, 30 (49%) species are primarily diurnal, 17 (28%) are primarily nocturnal and 14 (23%) present diurnal and nocturnal activities. We obtained reproductive data from 37 species, whereas, for aquatic species or often found in swampy ambient, the offspring, juveniles and female with eggs or embryos were captured in almost months (except January), while for the others species were captured offspring, juveniles and females in reproductive phases mainly during the rainy season. The xenodontines constitute the majority of species registered in the island with 27 species (44%), the colubrines include 14 species (23%) and the dipsadines with only five species (8%). This richness pattern is similar to other South American assemblages. However, species as Bothrops marajoensis, Chironius flavolineatus, Crotalus durissus, Eunectes deschauenseei, Epicrates maurus, Helicops leopardinus, Liophis poecilogyrus, Thamnodynastes lanei, Thamnodynastes sp. and Psomophis joberti seems to occur only in the eastern half of the Island of Marajó. Thus, both historical and ecological factors should have important roles on the structuring of the assemblage of snakes of the Marajó Island. Keywords: Marajó Island, Assemblage, Amazon, Natural History, Richness 20 INTRODUÇÃO Estudos com taxocenoses de serpentes em ambientes florestais, como Amazônia e Mata Atlântica, têm revelado a presença de uma grande riqueza de espécies (Duellman, 1989, 1990; Cadle e Greene, 1993; Marques, 1998; Martins e Oliveira, 1999; Santos-Costa, 2003; Bernarde e Abe, 2006; Maschio, 2008; Hartmann et al., 2009). Na Amazônia, estudos envolvendo aspectos reprodutivos e alimentares de serpentes têm recebido maior atenção nos últimos anos, como pode ser visto nos estudos de Santos-Costa et al. (2006), Prudente et al. (2007), Albarelli (2007), Albarelli e Santos-Costa (2010) e Maschio et al. (2007, 2010). No entanto, para a maioria das espécies que constituem as taxocenoses de serpentes Amazônicas, ainda faltam informações detalhadas sobre sua ecologia, sendo que, para algumas espécies, existem poucas informações (e.g.: Atractus natans, Dipsas indica, Chironius flavolineatus, Eunectes deschauenseei), o que dificulta o reconhecimento e interpretação de possíveis padrões de dieta, atividade e reprodução, bem como a identificação de fatores envolvidos na estruturação das taxocenoses de serpentes amazônicas. Localizada na foz do Rio Amazonas, a Ilha de Marajó, com uma extensão aproximada de 49.000 Km2 (Goulding et al., 2003), apresenta duas formações fitofisionômicas principais: campos naturais, localizados na região oriental, com cerca de um terço da área da Ilha; e o ambiente florestal localizado na região ocidental (Furtado et al., 2009). Acredita-se que até o final do Pleistoceno, a Ilha de Marajó estava ligada ao continente e possivelmente no Holoceno Médio e Tardio, a região foi completamente separada do continente em função do surgimento do Rio Pará (Rossetti e Valeriano, 2007). Com isso, as florestas fechadas da Ilha prevaleceram em áreas mais 21 antigas do Quaternário e as formações abertas em áreas mais recentes do Holoceno (Rossetti e Toledo, 2006). Talvez pela sua localização na foz do Rio Amazonas e sua proximidade com o Município de Belém, muitos naturalistas tenham visitado a região de Marajó, como Alexandre Rodrigues Ferreira, o primeiro a visitar a Ilha em 1783 (Nascimento et al., 1991). Posteriormente, diversos naturalistas viajantes visitaram a região de Marajó, entre eles Spix e Martius em 1820, Wallace e Bates em 1849, porém com poucas referências sobre os répteis dessa região (Nascimento et al., 1991). Segundo Nascimento et al. (1991), o primeiro trabalho com maior número de informações sobre a herpetofauna da Ilha de Marajó foi publicado por Goeldi em 1897. Somente um século depois, Nascimento et al. (1991), utilizando dados da literatura sobre os répteis das Ilhas Mexiana e Marajó e examinando exemplares depositados no Museu Paraense Emílio Goeldi (MPEG) e no Museu Britânico de História Natural, forneceram uma lista com 38 espécies de serpentes, além de outros grupos de répteis como Chelonia, Lacertilia, Amphisbaenia e Crocodilia. Posteriormente, Yuki e Santos (1996), acrescentando novos exemplares depositados no MPEG, contabilizaram 52 espécies de serpentes para estas duas Ilhas. Neste estudo, são apresentadas informações sobre a composição, aspectos ecológicos e de história natural da taxocenose de serpentes da Ilha de Marajó, além de comparar a riqueza da Ilha com a Floresta Nacional de Caxiuanã, região continental mais próxima, que apresenta informações sobre taxocenose de serpentes. 22 MATERIAL E MÉTODOS Coleta de Dados Foram obtidas informações de 439 espécimes de serpentes provenientes da Ilha de Marajó (ver Descrição da Área de Estudo), coletados entre os anos de 1958 e 2009, depositados nas coleções herpetológicas do Museu Paraense Emílio Goeldi (MPEG) e Museu de Zoologia da Universidade de São Paulo (MZUSP). Com auxílio de régua milimetrada foram obtidos de cada exemplar o comprimento rostro-cloacal (CRC), comprimento da cauda (COCD), sendo calculado a partir destes o comprimento total (COTO). Através de uma incisão longitudinal, feita na região ventral, foram obtidas as informações sobre a dieta e reprodução. Foi verificada a presença de conteúdo alimentar no estômago e intestino e o sentido de ingestão da presa, quando presente. Os conteúdos alimentares foram preservados em frascos contendo álcool 70% e receberam o mesmo número de coleção do exemplar examinado. Foi computado o número de presas em cada estômago e os itens coletados foram encaminhados a especialistas para sua identificação ao menor nível taxonômico possível. Todas as presas foram depositadas na Coleção Herpetológica do MPEG. Para dados de reprodução, foi verificado o estado dos ductos deferentes, sendo considerado macho maduro aquele que apresentasse os ductos opacos e enovelados e imaturos os que apresentasse os ductos lisos (Shine, 1977a). Todos os machos com CRC igual ou superior ao menor macho de sua espécie portador de ductos deferentes enovelados, também foram considerados maduros. Nas fêmeas foi verificado o tamanho do maior folículo, a quantidade e comprimento do maior ovo (quando presente) e a presença de embriões em seu interior. Fêmeas foram consideradas maduras quando 23 apresentavam folículos maiores que 10 mm, quando apresentavam marcas de ovos nos ovidutos ou, ainda, quando apresentavam embriões (Shine, 1977b). Fêmeas com CRC igual ou superior ao da menor fêmea de sua espécie com marcas de ovos, presença de ovos, folículos maiores que 10 mm ou que apresentavam embriões também foram consideradas maduras. O tamanho mínimo de 10 mm para o tamanho dos folículos em vitelogênese secundária foi adotado mesmo para espécies de pequeno porte por conferir maior grau de confiabilidade, segundo Di-Bernardo (1998), dado às pequenas amostras analisadas. A composição faunística foi obtida a partir dos exemplares depositados nas coleções herpetológicas do MPEG, MZUSP e registros da literatura. Informações sobre atividade diária e uso do substrato foram obtidas a partir de registros das observações diretas, dos livros tombo e de informações obtidas na literatura. Foram confeccionadas pranchas para ilustrar algumas das espécies que ocorrem na Ilha de Marajó. No entanto, os padrões de desenhos mostrados podem variar em relação ao padrão observado na Ilha de Marajó, uma vez que as fotos apresentadas não são de espécimes coletados na Ilha. Análise de dados A frequência de serpentes da Ilha de Marajó neste estudo, refere-se ao número de espécimes depositados nas coleções herpetológicas do MPEG e MZUSP, sendo limitada, em sua maioria, às serpentes encontradas no campo visual de pesquisadores em expedições na Ilha e moradores locais. Assim, espécies difíceis de serem detectadas em função do habitat onde vivem, certamente foram subamostradas. As informações sobre dieta foram obtidas de forma qualitativa a partir das análises de conteúdo estomacal. Os dados foram completados com os da literatura. A 24 análise do sentido de ingestão das presas foi feita através da observação direta das presas íntegras ou pouco digeridas, encontradas no trato digestivo dos espécimes analisados (Marques e Puorto, 1994). O sentido da ingestão foi classificado conforme a orientação da cabeça da presa em relação ao corpo da serpente e nomeada como ânteroposterior (quando a cabeça da presa foi a primeira região a ser ingerida) e pósteroanterior (quando a região posterior da presa foi a primeira a ser ingerida). As presas muito pequenas e que não permitiram uma observação precisa do sentido de ingestão em função de estarem muito digeridas ou que estavam em posição transversal no tubo digestivo, não foram incluídas nesta análise (Albarelli, 2007). A utilização do substrato foi considerada de acordo com as categorias propostas por Strüssmann (2000), a saber: a) aquáticas ou semi-aquáticas: serpentes que utilizam o meio aquático para suas atividades de forrageio e descanso, embora, eventualmente possa forragear em terra; b) fossórias ou semi-fossórias: serpentes que utilizam galerias preexistentes no solo ou cavadas pela própria serpente para as atividades de forrageio e descanso; c) terrestres ou criptozóicas: serpentes que utilizam o solo (desnudo ou não) para as atividades de forrageio e descanso ou, ainda, sob ou sobre a liteira acumulada no mesmo; d) arborícolas ou semi-arborícolas: serpentes que utilizam a vegetação (árvores, arbustos, palmeiras e cipós) para suas atividades de forrageio e descanso, embora, eventualmente, possam forragear no solo. Quanto à atividade foram consideradas três categorias, segundo Strüssmann (2000): a) diurnas: serpentes encontradas em atividade durante o dia; b) noturnas: serpentes encontradas em atividade durante a noite; c) diurnas/noturnas, serpentes encontradas em atividade tanto durante o dia quanto à noite. Visto que informações de literatura foram utilizadas para complementar o banco de dados e que tanto o intervalo de luminosidade (dia) como o intervalo de escuridão (noite) podem variar de região para 25 região, não foram estabelecidos, neste estudo, horários para as categorias “dia” e “noite”. Para inferir as relações entre comprimento rostro-cloacal (CRC) e o comprimento da cauda (COCD) com o uso do substrato, foi confeccionado gráfico de boxplot dessas variáveis morfológicas, indicando-se o uso do substrato (água, solo ou vegetação) para cada espécie. Esta análise visou evidenciar a relação entre algumas características relacionadas à forma do corpo (por exemplo, tamanho do corpo e tamanho da cauda) com a utilização de determinado substrato. Espécies com hábitos fossoriais, criptozóicos e terrestres foram consideradas como aquelas espécies que utilizam o substrato “Solo”, espécies com hábito arborícola aquelas que utilizam a “Vegetação” e espécies com hábitos aquáticos como aquelas espécies que utilizam o substrato “Água” (Maschio, 2008). Devido ao baixo número de espécimes de algumas espécies, esta análise foi realizada com espécies representadas por pelo menos quatro espécimes. O padrão geral do ciclo reprodutivo das espécies foi estimado em função da distribuição temporal dos folículos em vitelogênese secundária, pela presença de ovos nos ovidutos e pela presença de filhotes (Santos-Costa, 2003). Para avaliar a estrutura da taxocenose da Ilha de Marajó, foi elaborada uma matriz de uso de recursos, uso do substrato, atividade diária e dieta para cada espécie, onde cada estado de caráter foi codificado de forma a gerar uma matriz binária de dados (Sawaya, 2003), gerando informações na forma de presença ou ausência de determinado item ou característica. Por exemplo, para dieta, foi indicado na matriz quando determinada espécie se alimentou (presença = 1) ou não (ausência = 0) de anuros, lagartos, roedores, dentre outros. Seguindo esse procedimento, cada espécie pode apresentar mais de um estado de caráter por categoria de uso de recursos (Maschio, 26 2008). Nessa análise não foram incluídos os registros considerados ocasionais, ou seja, aqueles que não são comumente relatados para a espécie. Assim, foram considerados apenas a dieta, substrato utilizado e atividade diária, conferidos como primariamente para cada espécie, sendo que para o uso do substrato, as serpentes aquáticas e semiaquáticas foram incluídas no substrato “água”, as fossorias, semi-fossorias, criptozóicas ou terrestres foram incluídas no substrato “solo” e as arborícolas e semi-arborícolas foram incluídas no substrato “vegetação”. A partir da matriz de uso de recursos, foi realizada Análise de Coordenadas Principais (ACOP), utilizando o coeficiente de similaridade de Gower e em seguida uma análise de agrupamento (Manly, 1994), utilizando o coeficiente de similaridade de Sorensen, que atribui maior peso à presença em relação à ausência de determinada característica (Krebs, 1989), em função da falta de informações completas sobre todas as espécies. Na análise de agrupamento foi utilizado o método de agrupamento UPGMA ou “média do grupo” (Sneath e Sokal, 1973). Todas as análises foram feitas no programa PAST 2.12. (Hammer et al., 2001). Para a comparação entre a riqueza de serpentes da Ilha de Marajó e a do continente, foram utilizados os dados da região da Floresta Nacional de Caxiuanã (FLONA de Caxiuanã) pela proximidade (aproximadamente 60 km em linha reta) e pelos dados disponíveis sobre serpentes dessa região (Santos-Costa, 2003; Maschio, 2008) (Figura 1). 27 Figura 1. Mapa indicando a proximidade da Floresta Nacional de Caxiuanã e da Ilha de Marajó, Estado do Pará, Brasil. A comparação de riqueza de espécies entre amostras de tamanhos diferentes pode produzir conclusões equivocadas devido à relação positiva entre riqueza e número de espécimes coletados, sendo uma das formas usuais de lidar com a comparação de riqueza de espécies entre amostras de tamanhos diferentes consiste em padronizar o tamanho da amostra para o tamanho da menor amostra em estudo (Melo et al., 2003). Devido à diferença de amostragem entre a FLONA de Caxiuanã e a Ilha de Marajó, a riqueza de espécies foi calculada pelo método de rarefação (Sanders, 1968) padronizando-se o tamanho das amostras no EcoSim 7.72 (Gotelli e Entsminger, 2010) com 1000 interações. Cada espécime foi considerado uma amostra. A riqueza estimada da FLONA foi calculada inicialmente em função do número total de espécimes provenientes da Ilha de Marajó depositados nas coleções do MPEG e MZUSP. Posteriormente, a riqueza foi calculada adicionando-se um registro para cada espécie acrescentada por meio da literatura. Para efeitos comparativos, a riqueza de espécies também foi avaliada usando o estimador de riqueza Jackknife 1 (Burnham e Overton, 1979) no programa EstimateS 8.2 (Colwell, 2009), escolhido por apresentar melhor comportamento entre os seis estimadores disponíveis (ACE, ICE, Chao 1, Chao 2, 28 Jackknife 1 e Jackknife 2) ao longo da curva de acumulação das amostras (Moraes et al., 2007). RESULTADOS E DISCUSSÃO Composição de espécies Foram registradas 62 espécies de serpentes na Ilha de Marajó, distribuídas em seis famílias: Boidae (n= 6; 9,7%), Colubridae (n= 14; 23%), Dipsadidae (n= 32; 52%), Elapidae (n= 5; 8,1%), Typhlopidae (n= 1; 1,6%) e Viperidae (n= 4; 6,5%) (Tabela 1). Tabela 1. Lista das espécies registradas na Ilha de Marajó com base nos espécimes depositados no MPEG e MZUSP e em levantamentos bibliográficos. Legenda: n= número de espécimes depositadas no MPEG e/ou MZUSP; Traço= espécie não depositada nas coleções do MPEG e MZUSP (incluídas apud Nascimento et al.,1991); ?= espécie não mencionada por Yuki e Santos (1996). BOIDAE Boa constrictor Linnaeus, 1758 Corallus hortulanus (Linnaeus, 1758) Epicrates cenchria (Linnaeus, 1758) Epicrates maurus Gray, 1849 Eunectes deschauenseei Dunn e Conant, 1936 Eunectes murinus (Linnaeus, 1758) COLUBRIDAE Chironius carinatus (Linnaeus, 1758) Chironius exoletus (Linnaeus, 1758) Chironius flavolineatus (Boettger, 1885) Chironius fuscus(Linnaeus, 1758) Chironius multiventris Schmidt e Walker, 1943 Dendrophidion dendrophis (Schlegel, 1837) Drymarchon corais (Boie, 1827) Leptophis ahaetulla (Linnaeus, 1758) Mastigodryas bifossatus (Raddi, 1820) Mastigodryas boddaerti (Sentzen, 1796) Oxybelis aeneus (Wagler, 1824) Oxybelis fulgidus (Daudin, 1803) Spilotes pullatus (Linnaeus, 1758) Tantilla melanocephala (Linnaeus, 1758) DIPSADIDAE Atractus natans Hoogmoed e Prudente, 2003 Atractus schach (Boie, 1827) Clelia clelia (Daudin, 1803) Dipsas indica Laurenti, 1768 Drepanoides anomalus (Jan, 1863) Helicops angulatus (Linnaeus, 1758) Helicops hagmanni Roux, 1910 Helicops leopardinus (Schlegel, 1837) Helicops polylepis Günther, 1861 Nascimento et al. (1991) Yuki e Santos (1996) X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X Este estudo Novos n registros (51) 6 4 1 21 13 6 (45) 4 2 1 5 1 1 1 17 3 3 2 5 (289) 4 1 1 1 12 1 25 4 X X X X 29 Helicops trivittatus (Gray, 1849) Hydrodynastes gigas (Duméril, Bibron e Duméril, 1854) Hydrops martii (Wagler, 1824) Imantodes cenchoa (Linnaeus, 1758) Leptodeira annulata (Linnaeus, 1758) Liophis almadensis (Wagler, 1824) Liophis lineatus (Linnaeus, 1758) Liophis meridionalis (Schenkel, 1901) Liophis poecilogyrus (Wied, 1825) Liophis reginae (Linnaeus, 1758) Liophis taeniogaster Jan, 1863 Liophis typhlus (Linnaeus, 1758) Oxyrhopus melanogenys (Tschudi, 1845) Oxyrhopus trigeminus Duméril, Bibron e Duméril, 1854 Philodryas argentea (Daudin, 1803) Philodryas viridissima (Linnaeus, 1758) Pseudoboa coronata Schneider, 1801 Psomophis joberti (Sauvage, 1884) Siphlophis cervinus (Laurenti, 1768) Siphlophis compressus (Daudin, 1803) Taeniophallus quadriocellatus Santos-Jr, Di-Bernardo e Lema, 2008 Thamnodynastes lanei Bailey, Thomas e Silva-Jr, 2005 Thamnodynastes sp. ELAPIDAE Micrurus filiformis(Günther, 1859) Micrurus hemprichii (Jan, 1858) Micrurus ibiboboca (Merrem, 1820) Micrurus spixii Wagler, 1824 Micrurus surinamensis (Cuvier, 1817) TYPHLOPIDAE Typhlops reticulatus (Linnaeus, 1758) VIPERIDAE Bothrops atrox (Linnaeus, 1758) Bothrops marajoensis Hoge, 1966 Crotalus durissus (Linnaeus, 1758) Lachesis muta (Linnaeus, 1766) Total de espécies registradas Total de espécimes depositados no MPEG e MZUSP X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X 8 7 1 4 8 20 16 2 94 8 34 2 1 4 1 4 6 1 1 2 3 13 X X X X ? ? ? X (7) 4 2 1 X X (4) 4 X X X X 42 X X X X 50 (43) 36 5 2 62 439 X X X X X X 10 Nove novos registros são relatados para a Ilha de Marajó: Atractus natans, Atractus schach, Dendrophidion dendrophis, Helicops hagmanni, Hydrops martii, Liophis meridionalis, Liophis typhlus, Philodryas argentea e Siphlophis cervinus. O predomínio de representantes de Dipsadidae (52%), seguido por Colubridae (23%) e Boidae (9,7%), observado neste estudo, é um padrão semelhante ao já observado para outras taxocenoses amazônicas, onde os representantes de Dipsadidae variam entre 47% e 53%, Colubridae entre 18% e 27% e Boidae entre 7% e 9% (Starace, 1998; Martins e Oliveira, 1999; Bernarde e Abe, 2006; Maschio, 2009). 30 Três exemplares de Mastigodryas bifossatus (MPEG 770; MPEG 16531; MPEG 16936) citados por Nascimento et al. (1991) e Yuki e Santos (1996), não foram localizados durante este estudo. No entanto, M. bifossatus foi mantida na composição de espécies de serpentes da Ilha de Marajó, visto que a Ilha localiza-se dentro dos limites de distribuição da espécie (Cunha e Nascimento, 1993), podendo sua ocorrência ser confirmada posteriormente. O registro de Philodryas viridissima para a Ilha de Marajó foi relatado por Nascimento et al. (1991) e Yuki e Santos (1996), não sendo possível sua confirmação neste estudo, pois o exemplar (MPEG 17358) foi doado em 1989 ao Programa de PósGraduação de Imunologia da Universidade Federal do Maranhão. A espécie foi mantida na composição de espécies de serpentes da Ilha de Marajó em função dos limites de distribuição da espécie que abrange o Estado do Pará (Cunha e Nascimento, 1993), podendo sua ocorrência ser confirmada posteriormente. Na lista geral de espécies apresentada por Nascimento et al. (1991) não estavam incluídas cinco espécies (Chironius exoletus, Chironius fuscus, Mastigodryas bifossatus, Helicops trivittatus e Oxyrhopus melanogenys), embora tenham sido citadas ao longo do texto e/ou incluídas no material examinado pelos autores. Embora Micrurus hemprichii, M. ibiboboca e M. spixii tenham sido citadas para a Ilha de Marajó por Nascimento et al. (1991), Yuki e Santos (1996) não as incluíram na lista final de espécies. Neste estudo, a presença de M. hemprichii na Ilha pôde ser confirmada pela presença de dois espécimes (MPEG 20042 e MPEG 24957) coletada em 2001 e 2009. Nascimento et al. (1991) e Yuki e Santos (1996), com base em levantamentos bibliográficos, citaram as espécies Bothrops marajoensis, Dipsas indica, Micrurus ibiboboca, Micrurus spixii, Oxyrhopus trigeminus, Spilotes pullatus e Tantilla 31 melanocephala para a Ilha de Marajó. Estas espécies foram incluídas na composição de serpentes da Ilha, porém suas ocorrências não puderam ser confirmadas neste estudo. Neste estudo, não foi confirmada a ocorrência de Corallus batesii na Ilha, embora a figura apresentada por Henderson et al. (2009) indique a presença desta espécie em Marajó. Apesar disso, os autores não citaram o exemplar na lista de material analisado, deixando a informação duvidosa. Assim, neste estudo, C. batesii não foi incluída na composição de espécies da Ilha de Marajó. O alto número de espécies registradas em Marajó evidencia a alta riqueza da região Amazônica e a importância de estudos com composição de espécies, mesmo em áreas inventariadas anteriormente. Comentários taxonômicos Hoge (1966) descreveu Bothrops marajoensis para as áreas de campos da Ilha de Marajó. Após examinarem o holótipo da espécie, Cunha e Nascimento (1993) consideraram B. marajoensis sinônimo de B. atrox. No entanto, segundo os autores, existem variações acentuadas entre os espécimes procedentes das áreas de campos e das áreas florestadas da Ilha de Marajó, o que justificaria a proposta de subespécie B. atrox marajoensis. Neste estudo, será considerado Bothrops marajoensis até que futuros estudos possam definir melhor a validade de seu status (Campbell e Lamar, 2004). O exemplar de Taeniophallus occipitalis (MPEG 17362), citado por Yuki e Santos (1996), foi identificado como T. quadriocellatus, descrita por Santos-Jr et al. (2008) para o Estado do Pará. Nascimento et al. (1991) e Yuki e Santos (1996) registraram Epicrates cenchria barbouri para a Ilha de Marajó, porém, após a revisão de Passos e Fernandes (2008), E. c. barbouri é considerada sinônimo de E. maurus. Epicrates maurus caracteriza-se por 32 apresentar faixa lateral do corpo com largura de quatro escamas, ocelos laterais irregulares em juvenis e indistintos em adultos, dorso com a cor de fundo amarelo para marrom claro nos juvenis e marrom uniforme nos adultos, com notável mudança ontogenética na coloração (Passos e Fernandes, 2008). Além de E. maurus, está presente na Ilha de Marajó E. cenchria, que segundo Passos e Fernandes (2008) se caracteriza por apresentar ocelos laterais não fusionados e a presença de mais de 245 escamas ventrais. A sobreposição observadas do número de faixas escuras na região ventral (variando de 27-46) nos espécimes analisados de Liophis taeniogaster (n= 34) dificulta sua identificação e distinção de L. cobella, embora Fernandes et al. (2002) tenham considerado esse caráter como diagnóstico das espécies (L. taeniogaster variando de 2352 faixas ao longo do ventre e L. cobella de 43-73). Até que os limites morfológicos entre as espécies sejam melhores definidos, consideramos os espécimes de Marajó como Liophis taeniogaster, com base no mapa de distribuição dos exemplares analisados por Fernandes et al. (2002). Yuki e Santos (1996) identificaram as espécies de Thamnodynastes com número de dorsais 17-17-15 como T. pallidus e aquelas com 19-19-15 como T. strigilis. Os exemplares anteriormente considerados como T. pallidus por Yuki e Santos (1996) foram re-identificados (exceto o exemplar MPEG 18665) como T. lanei (Bailey et al., 2005). Embora o espécime MPEG 18665 não tenha sido localizado, segundo as características apresentadas por Yuki e Santos (1996) (macho, 143 ventrais, 79 subcaudais, 17-17-15 dorsais ), trata-se, provavelmente, de T. lanei, cujos machos podem ser caracterizados por apresentar 142-159 ventrais, 74-86 subcaudais e 17-17-15 fileiras dorsais (Bailey et al., 2005). 33 Segundo Yuki e Santos (1996) o exemplar de T. strigilis presentes em Marajó (MPEG 18327) apresenta os seguintes caracteres: fêmea, 19-19-15 fileiras dorsais, 146 ventrais, 67 subcaudais, 8 supralabiais, 9 infralabiais, 2+2/2+3 temporais. No entanto, segundo as observações pessoais do pesquisador M.S. Hoogmoed o exemplar em questão apresenta anal dividida, uma escama pré-ocular, duas pós-oculares e dorsais levemente quilhadas. Considerando que este exemplar não foi localizado na coleção herpetológica do MPEG e que as informações não são suficientes para uma distinção adequada com as demais espécies de Thamnodynastes com 19 fileiras dorsais quilhadas, T. strigilis não foi incluída na lista geral de espécies da Ilha de Marajó. Não foi possível identificar sete espécimes de Thamnodynastes presentes na Ilha (MPEG 20808; MPEG 20809; MPEG 20810; MPEG 20811; MPEG 21200; MPEG 21201; MPEG 21202) que apresentam as seguintes características: 19-19-15 DO; machos com 146-159 VE (n= 5) e fêmeas com 147-149 (n= 2); machos com 64-69 SC e fêmeas com 62-63; machos com 7-9/7-9 SL e fêmeas com 8/8; machos com 8-9/7-8 IL; e fêmeas com 8/8; uma pré-ocular e duas pós-oculares. As características destes espécimes estão contidas na variação das seguintes espécies: T. hypoconia (19-19-15 DO; machos com 143-164 VE e fêmeas com 139-153; machos com 67-80 SC e fêmeas com 65-75; 8/8 SL; 9/9 IL; uma pré-ocular e duas pós-oculares) segundo Franco e Ferreira (2002); T. gambotensis (19-19-15 DO; machos com 150-164 VE e fêmeas com 145-155; machos com 63-73 SC e fêmeas com 53-72; 7 ou 8 SL; 8 ou 9 IL; uma préocular e duas pós-oculares) segundo Bailey e Thomas (2007); e T. dixoni (19-19-15 DO; machos com 152-160 VE e fêmeas com 141-150; machos com 63-72 SC e fêmeas com 57-66, 7 ou 8 SL; 8 ou 9 IL; uma ou duas pré-oculares e duas pós-oculares segundo Bailey e Thomas (2007). Não existem registros de T. gambotensis e T. dixoni para o Brasil (Bailey e Thomas, 2007) e pouco se sabe sobre a distribuição de T. hypoconia no 34 território brasileiro. Marques et al. (2001) citaram T. hypoconia para a Mata Atlântica do Sul e Sudeste do Brasil e Franco e Ferreira (2002) para os estados de Pernambuco, Goiás, Mato Grosso, Mato Grosso do Sul, Minas Gerais, Espírito Santos, Rio de Janeiro, São Paulo, Paraná, Santa Catarina e Rio Grande do Sul. Desta forma, a identificação precisa destes exemplares de Thamnodynastes sp. só poderá ser feita após análise de material comparativo das três espécies (T. dixoni, T. gambotensis e T. hypoconia), não estando descartada a possibilidade de haver novas espécies. Os exemplares de Liophis meridionalis (MPEG 20815 e MPEG 20816) diferem de Liophis lineatus por apresentarem: fileiras de escamas dorsais em 19-19-15 (vs 1919-17 em L. lineatus); presença de linhas laterais marrons, que se iniciam no segundo terço do corpo (vs linhas laterais marrons, que se iniciam na extremidade anterior da cabeça em L. lineatus). Esta espécie está presente no norte do Estado do Pará e no Estado do Amazonas (Dixon, 1989; Cunha e Nascimento, 1993; Yuki e Barros, 1997). Assim, este estudo amplia a distribuição de L. meridionalis para a Ilha de Marajó. Nascimento et al. (1991) e Yuki e Santos (1996) citaram a presença de três espécies de Eunectes para a Ilha de Marajó: E. barbouri, E. deschauenseei e E. murinus. No entanto, após a sinonimização de Eunectes barbouri com E. murinus, proposta por Strimple et al. (1997), estão presentes na Ilha E. deschauenseei e E. murinus. Número de Espécimes Entre os exemplares depositados nas coleções do MPEG e MZUSP, Liophis poecilogyrus foi a que apresentou a maior frequência (n= 94; 21,41%), seguida por Bothrops atrox (n= 36; 8,2%), Liophis taeniogaster (n= 34; 7,74%), Helicops leopardinus (n= 25; 5,69%), Epicrates maurus (n= 21; 4,78%) e Liophis almadensis (n= 20; 4,55%). Dezesseis espécies (Atractus schach, Chironius exoletus, C. flavolineatus, 35 C. multiventris, Clelia clelia, Dendrophidion dendrophis, Drepanoides anomalus, Drymarchon corais, Epicrates cenchria, Helicops hagmanni, Hydrops martii, Micrurus surinamensis, Oxyrhopus melanogenys, Philodryas viridissima, Siphlophis cervinus e Siphlophis compressus) tiveram apenas um registro em Marajó (Figura 2). Figura 2. Frequência das 55 espécies provenientes da Ilha de Marajó, Estado do Pará, Brasil, depositadas no MPEG e MZUSP entre os anos de 1958 e 2009. É difícil mensurar a abundância de serpentes de uma determinada área, geralmente, em função da limitação humana em detectar serpentes em certos habitats (espécies fossoriais, criptozóicas e aquáticas, por exemplo). Segundo Maschio (2008), mesmo estudos utilizando-se de métodos e esforço de coletas equivalentes, há de se obter resultados diferentes devido às diferentes capacidades de percepção dos coletores nos ambientes amostrados. Desta forma, a abundância apresentada em estudos herpetológicos pode, algumas vezes, ser reflexo grosseiro da abundância real da região. 36 Assim, a comparação entre estudos, mesmo quando abordam o mesmo tipo de bioma e procedimentos metodológicos, deve ser analisada com cautela. Embora seja comum a utilização dos mesmos procedimentos metodológicos (como procura limitada por tempo e armadilha de interceptação e queda (pitfalls), além de acrescentar espécimes coletados ocasionalmente e por terceiros), os diversos estudos geralmente apresentam horários e intervalos de coletas diferenciados, além de utilizarem diferentes números de coletores durante as atividades de campo. Desta forma, é necessário levar em consideração esses fatores, principalmente ao se comparar a abundância entre diferentes áreas. Considerando os pontos discutidos acima, as espécies mais frequentes neste estudo diferiram das espécies mais frequentes de outras regiões da Amazônia brasileira. Por exemplo, na FLONA de Caxiuanã, Bothrops atrox (17,71%), Imantodes cenchoa (8,96%), Corallus hortulanus (6,71%), Dipsas catesbyi (3,99%) e Leptodeira annulata (3,87%) foram as espécies que apresentaram maior abundância (dados unificados de Santos-Costa, 2003 e Maschio, 2008); enquanto que no Espigão do Oeste (região sul da Amazônia) Liophis reginae (18,6%), Oxyrhopus melanogenys (8,4%), Chironius exoletus (6,0%), Boa constrictor (5,8%) e Dipsas catesbyi (5,6%) foram as espécies que apresentaram maior abundância (Bernarde e Abe, 2006). O grande número de registros de Liophis poecilogyrus neste estudo provavelmente seja reflexo de uma expedição realizada pela equipe de Herpetologia do MPEG, em maio de 1989, para a região centro-leste de Marajó em uma área inundada, onde foram coletados 58 espécimes em apenas quatro dias. Nesta expedição, que teve duração de cinco dias, foram coletadas ainda L. almadensis (n= 20), L. taeniogaster (n= 7), Eunectes deschauenseei (n= 6), Epicrates maurus (n= 5), L. lineatus (n= 4), Hydrodynastes gigas (n= 3) e Clelia clelia (n= 1), totalizando 104 espécimes, número 37 considerado elevado para um curto período de tempo. É provável que o elevado número de espécimes de L. poecilogyrus coletados seja em decorrência da área inundada, uma vez que os espécimes tenderiam a concentrar-se em áreas ou abrigos mais elevados, o que teoricamente facilitaria sua visualização. No entanto, embora não se conheça modelo de explosão reprodutiva para serpentes neotropicais, não se deve descartar ainda a possibilidade de que tenha ocorrido um comportamento de explosão reprodutiva da espécie, o que também poderia explicar a grande quantidade de L. poecilogyus coletadas. Bothrops atrox possui uma ampla distribuição na Amazônia, sendo a espécie mais abundante em outras localidades amazônicas situadas ao sul do Rio Amazonas (Martins e Oliveira, 1999; Santos-Costa, 2003; Maschio, 2008), o que pode estar relacionado a sua grande amplitude no uso do habitat, tanto em ambientes preservados como alterados (Martins et al., 2001; Maschio, 2008). Dieta Foram analisados 369 estômagos de 53 espécies, onde apenas 32% (n= 119) apresentaram algum tipo de item alimentar. No entanto, a frequência de itens alimentares observada neste estudo foi relativamente alta. Segundo Maschio et al. (2010), a frequência de itens alimentares em estudos de dieta de serpentes pode variar entre 14% e 30%. Foram obtidos dados alimentares para 28 espécies de serpentes de Marajó. Entre os itens identificados, “anuros” foi o mais frequente, correspondendo 56% entre as espécies que apresentaram conteúdos alimentares identificáveis, sendo acessado por 19 espécies. O segundo item mais acessado pelas serpentes foi “mamíferos” (cinco espécies de serpentes), seguido por “lagartos” (quatro espécies de serpentes), “peixes” e 38 “minhocas” (duas espécies de serpentes) e “serpente” (acessado por uma espécie). Apenas quatro espécies (Bothrops atrox, Helicops angulatus, H. leopardinus e Pseudoboa coronata) apresentaram mais de uma categoria de item alimentar nos estômagos (Tabela 2). Tabela 2. Conteúdos alimentares identificados e respectivos sentidos de ingestão registrados neste estudo, em serpentes da Ilha de Marajó, Pará, Brasil. Legenda: n= quantidade de serpentes com o respectivo conteúdo; A-P = Ântero-posterior; P-A = Póstero-anterior; algarismo arábico entre parêntese= número de presas no mesmo espécime; ?= possivelmente. Família/Espécie BOIDAE Boa constrictor Corallus hortulanus Epicrates maurus COLUBRIDAE Chironius carinatus Chironius exoletus Chironius flavolineatus Chironius fuscus Chironius multiventris Leptophis ahaetulla Mastigodryas boddaerti DIPSADIDAE Atractus natans Helicops angulatus Helicops leopardinus Helicops trivittatus Hydrodynastes gigas Liophis almadensis Liophis lineatus Liophis meridionalis Liophis poecilogyrus n Conteúdos identificados Sentido de ingestão 1 1 1 1 1 Mamífero (Pelos) Mamífero (Pelos) Mamífero (Morcego) Mamífero (Roedor) (2) Mamífero (Roedor) Indeterminado Indeterminado A-P A-P (2) A-P 1 1 1 1 1 1 1 1 1 Anuro (Leptoctylus petersii) (3) Anuro (Hypsiboas geographicus) Anuro (Leptodactylus fuscus) Anuro (Leptodactylus sp.) Anuro (Scinax cf. x-signatus) Anuro (Hylidae) Anuro (Hypsiboas sp.) Artrópodes Lagarto (Ameiva ou Kentropyx) P-A (2); A-P (1) A-P P-A P-A A-P A-P A-P Indefinido Indefinido 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 Minhoca Anuro Anuro (Rhinella margaritifera) Anuro (Rhinella margaritifera) (2) Peixe (Agenciosus sp.) Peixe (Rivulus sp.) Peixe Peixe (Astyanax cf. bimaculatus) Peixe Peixe (Anadora sp.) Anuro (Pseudis boliviana) Anuro (Girinos, possivelmente Bufonidae) Minhoca Anuro (Leptodactylus macrosternum) Anuro (Leptodactylidae, Adenomera ?) +aranha (2) Anuro Anuro Anuro (Rhinella marina) (2) Anuro + aranha Anuro (Leptodactylus fuscus ou L. longirostris) Anuro (Leptodactylidae, Adenomera?) Anuro (Rhinella sp.) Indeterminado P-A P-A P-A (2) A-P P-A Indeterminado A-P A-P A-P P-A Indefinido Indefinido A-P P-A (anuro) 1 1 1 2 1 1 1 Indefinido Indefinido A-P (2) A-P (2 anuros) P-A P-A A-P 39 Liophis reginae Liophis taeniogaster Pseudoboa coronata Psomophis joberti Taeniophallus quadriocellatus Thamnodynastes lanei Thamnodynastes sp. VIPERIDAE Bothrops atrox Crotalus durissus 1 1 1 1 1 1 1 1 1 1 1 Anuro (Leptodactylus petersii) Anuro (Leptodactylus macrosternum) Anuro (Hypsoboas raniceps) Anuro (Leptodactylus sp.) Escamas de serpente Anuro (Girinos) (4) Anuro (Scinax gr. ruber) Anuro Anuro (Girinos) Anuro Lagarto (Leposoma percarinatum) (2) + ovos (2) Anuro (Scinax sp.) Lagarto (Chatogekko amazonicus) Anuro (Hylidae) Insetos Anuro (Leptodactylus sp.) A-P A-P P-A Indefinido Indefinido Indefinido A-P Indefinido Indefinido Indefinido A-P (2 lagartos) 1 Serpente (Bothrops atrox) + dedos e escamas de Kentropyx 1 1 1 Lagarto (Tretioscincus agilis) Mamíferos (Pelos) + Anuro Lagarto (Gymnophthalmidae, Tretioscincus?) + 3 presas de serpente Lagarto (Anolis sp.) + 1 presa de serpente Mamífero (Roedor) Lagarto (Thecadactylus rapicauda) Mamífero (Roedor) (3) Mamífero (Pelos) + presa de serpente Serpente: A-P; Lagarto: indeterminado A-P Indeterminado Indeterminado 1 1 1 1 1 1 2 1 1 1 A-P A-P P-A Indefinido A-P A-P A-P (2) A-P 3 A-P Indefinido A maior frequência de serpentes que utilizam anuros como item alimentar também foi observada por Duellman (1978) e Bernarde e Abe (2010), mas não por Martins e Oliveira (1999), Bernarde e Abe (2006) e Maschio (2008), sendo lagarto o iten registrado mais frequentemente nestes três últimos trabalhos. Segundo Bernarde e Abe (2010), a porcentagem de serpentes que utilizam anuros são maiores nas regiões do Pantanal e nas regiões Sul e Sudeste do Brasil, sendo que na região Amazônica há uma maior proporção de espécies que utilizam lagartos como item alimentar. A diferença na proporção entre os tipos de itens consumidos em diferentes taxocenoses são consideradas, por alguns autores, como reflexo das linhagens evolutivas em cada localidade (Cadle e Greene, 1993; Martins e Oliveira, 1999; Bernarde e Abe, 2010). 40 Foi observada a ocorrência apenas de mamíferos como item alimentar para os boídeos (Tabela 2). No entanto, as serpentes deste grupo podem alimentar-se de peixes, anuros, lagartos, aves e mamíferos (Martins e Oliveira, 1999; Starace, 1998; Rodrigues, 2007; Maschio, 2008). A presença de apenas um único tipo de item alimentar nestas serpentes pode ter sido reflexo da baixa frequência de ocorrência de itens nos estômagos, evento considerado comum em serpentes. Dentre quatorze espécimes de boídeos aquáticos analisados, nenhum apresentou conteúdo identificável. Exceto por Mastigodryas boddaerti, que apresentou um lagarto no estômago, todos os colubrídeos apresentaram anuros como item alimentar. As cinco espécies do gênero Chironius registradas neste estudo apresentaram apenas anuros no estômago, corroborando os dados obtidos por Dixon et al. (1993), que afirmaram o comportamento batracófago para o gênero (Tabela 2). Entre as espécies de dipsadídeos que apresentaram conteúdo alimentar identificável foi observado: dez espécies que alimentaram exclusivamente de anuros (não contabilizando os itens considerados como secundários, veja comentário abaixo); duas (Helicops angulatus e H. leopardinus) de anuros e peixes; duas (Atractus natans e Helicops trivittatus) que alimentaram exclusivamente de minhocas; uma (Taeniophallus quadriocellatus) exclusivamente de lagartos; e uma (Pseudoboa coronata) de lagartos e ovos (possivelmente de lagartos), sendo que a ingestão de ovos não é habitual para esta espécie que geralmente alimenta-se de aves, lagartos e mamíferos (Duellman, 1978; Cunha e Nascimento, 1978; Martins e Oliveira, 1999) (Tabela 2). A ingestão de minhocas também não é conhecida para Helicops trivittatus, sendo uma espécies potencialmenent especialista em peixes (Maschio, 2008). 41 A ofiofagia para Liophis poecilogyrus também não é conhecida, sugerindo que as escamas encontradas no intestino de um exemplar sejam da própria serpente ingerida durante a troca de pele, como é observado em alguns lagartos (Sousa et al., 2000). Dentre as duas espécies de viperídeos que tiveram conteúdos alimentares identificáveis, Crotalus durissus apresentou apenas mamíferos no estômago, conteúdo também registrado para Bothrops atrox, sendo que esta última apresentou ainda lagartos e serpente no estômago. Presas de serpentes também foram registradas no intestino de Bothrops atrox e Crotalus durissus, não sendo descartada a possibilidade de que possam ser das próprias serpentes analisadas, embora a ofiofagia seja evidente para B. atrox (Cunha e Nascimento, 1993; este estudo). Os artrópodes registrados neste estudo nos estômagos de Leptophis ahaetulla, Liophis almadensis, L. lineatus e Thamnodynastes sp. provavelmente sejam conteúdos secundários. Para Martins e Oliveira (1999), os artrópodes registrados por Beebe (1946) em Anilius scytale, Liophis typhlus e Erythrolamprus aesculapii, além dos registrados por Cunha e Nascimento (1978) em Dendrophidion dendrophis, tratam-se de ingestão acidental ou conteúdos secundários. Reforçando essa hipótese, Prudente et al. (1998) citaram que artrópodes podem estar associados a outras presas maiores (anuros e lagartos). Assim, pode-se considerar que os artrópodes registrados no trato digestivo das serpentes façam parte da dieta de suas presas (anuros), e que durante a digestão são liberados para o interior do estômago da serpente. Embora a maior frequência de ingestão de determinado tipo de presa pareça ter componentes geneticamente fixados, conforme citado por Sazima e Martins (1990), alguns itens alimentares considerados não habituais, como minhoca em Helicops trivittatus, ovos em Pseudoboa coronata e Bothrops atrox em B. atrox, foram registrados para algumas serpentes presentes na Ilha de Marajó. Os registros destes itens 42 podem evidenciar a falta de conhecimento sobre os hábitos alimentares da maioria das espécies amazônicas ou refletir uma complexidade ambiental da Ilha com a oferta de uma grande variedade de recursos alimentares para as serpentes. Entre os itens que foram possíveis avaliar o sentido de ingestão, observou-se a prevalência do sentido ântero-posterior (n= 36; 71%) em relação ao póstero-anterior (n= 15; 29%) (Tabela 2). A prevalência do sentido de ingestão ântero-posterior observada neste estudo, assim com em serpentes de um modo geral, está relacionada, principalmente, ao tipo de presa ingerida, que geralmente apresentam estruturas rígidas, pontiagudas ou cortantes, podendo causar injúrias ao predador (Maschio et al., 2010). Além disso, a ingestão ântero-posterior pode ainda proporcionar um menor esforço e tempo desprendido à deglutição, minimizando assim o custo energético e o período de vulnerabilidade da serpente a possíveis predadores (Pinto e Lema, 2002). É provável que o sentido de ingestão dependa, além das características morfológicas tanto da presa como do predador, também de comportamentos específicos de cada espécie. Erythrolamprus aesculapii, por exemplo, é uma serpente ofiófaga que tende a ingerir as presas inicialmente pela cauda (Marques e Puorto, 1994), comportamento contrário observado na maioria das serpentes que possuem esse hábito alimentar (Greene, 1976). Segundo Marques e Puorto (1994), esse comportamento pode ser explicado pelo modo como E. aesculapii manipula suas presas vivas (aliviando a mordida repetidas vezes, permitindo curtas progressões da serpente capturada até que suas mandíbulas se aproximem da região caudal da presa). Presas como alguns anfisbenídeos são capazes de produzir fortes mordidas, o que é suficiente para garantir que elas sejam ingeridas pela cabeça por espécies como Anilius scytale, por exemplo (Maschio et al., 2010). 43 Morfologia e uso do substrato Das serpentes da área de estudo possíveis de serem analisadas (24 espécies), as que utilizam o substrato “solo” tenderam a apresentar menor razão entre o Comprimento da Cauda (COCD) e o Comprimento Total (COTO). Em posição intermediária aparecem duas espécies aquáticas (Eunectes deschauenseei e Hydrodynastes gigas), que eventualmente, forrageiam em ambiente terrestre, outra espécie semi-arborícola (Leptodeira annulata) e outra terrestre que, ocasionalmente, frequenta o ambiente aquático para atividades de forrageio (Liophis taeniogaster). Numa posição intermediária com valores maiores aparecem as espécies aquáticas (Helicops trivittatus, H. leopardinus, H. polylepis e H. angulatus) e, por último, as espécies semi-arborícolas e as arborícolas (Oxybelis fulgidus, Chironius fuscus, Leptophis ahaetulla e Philodryas argentea) com os maiores valores (Figura 3). Typhlops reticulatus apresentou o menor tamanho relativo da cauda. Esta espécie possui hábitos fossoriais e, ocasionalmente, frequenta o solo desnudo durante suas atividades. Espécies de hábitos fossoriais tendem a apresentar cauda relativamente menor em relação às espécies com hábitos terrícolas, aquáticas e arborícolas (Sawaya, 2003; Maschio, 2008). As espécies terrestres apresentam uma maior variação entre COCD/COTO indicando que a pressão adaptativa no meio terrestre, referente ao tamanho da cauda, não é tão intensa quanto as espécies arborícolas (Maschio, 2008). 44 45% S-V 40% A A 35% A 30% 22 18 19 A S 25% 16 17 S S-A 15 S 13 S 20% A S S 15% 14 12 9 10 11 S S 7 8 S 3 4 10% 20 S S-A S-V 24 23 21 A COCD/COTO S-V V V 6 5 S 2 5% Média Erro Padrão Desvio Padrão 1 0% Espécies Figura 3. Variação da razão entre Comprimento da Cauda (COCD) e Comprimento Total (COTO) de 24 espécies presentes na Ilha de Marajó, Estado do Pará, Brasil. Legenda: Letras acima das barras verticais referem-se ao substrato utilizado: S= Solo (terrestres, criptozóicas e fossoriais); V= Vegetação (arborícolas); e A= aquático (aquáticas). Os números abaixo referem-se a espécie: 1= Typhlops reticulatus; 2= Atractus natans; 3= Bothrops atrox; 4= Epicrates maurus; 5= Crotalus durissus; 6= Boa constrictor; 7= Liophis poecilogyrus; 8= Eunectes deschauenseei; 9= Leptodeira annulata; 10= Liophis taeniogaster; 11= Psomophis joberti; 12= Liophis almadensis; 13= Hydrodynastes gigas; 14= Thamnodynastes sp.; 15= Liophis reginae; 16= Liophis lineatus; 17= Helicops trivittatus; 18= Helicops leopardinus; 19= Helicops polylepis; 20= Helicops angulatus; 21= Oxybelis fulgidus; 22= Chironius fuscus; 23= Leptophis ahaetulla; 24= Philodryas argentea. Entre as espécies aquáticas, Helicops angulatus foi a que apresentou maior tamanho relativo da cauda. Os maiores tamanhos relativos da cauda das espécies aquáticas em relação às espécies terrestres provavelmente esteja relacionado com a facilidade no deslocamento que a cauda pode proporcionar em meio aquático. Leptodeira annulata foi a única espécie semi-arborícola que apresentou o tamanho relativo da cauda proporcionalmente baixo em relação às demais espécies. O 45 maior tamanho relativo da cauda observado em espécies arborícolas pode estar relacionado à instabilidade e descontinuidade do substrato arbóreo, sendo o comprimento da cauda e o corpo comprimido lateralmente uma das maiores adaptações destas serpentes para o equilíbrio e locomoção sobre a vegetação (Lillywhite e Smits,1992; Lillywhite e Henderson, 1993). Analisando uma grande quantidade de fêmeas adultas na região de Cerrado em Itirapina, Estado de São Paulo, Sawaya (2003) observou que as espécies fossoriais apresentam cauda relativamente menor, as espécies terrícolas apresentam cauda de comprimento intermediário e as espécies arborícolas e semi-arborícolas apresentam cauda relativamente maior. Resultado semelhante foi encontrado por Maschio (2008) analisando as serpentes da FLONA de Caxiuanã, sendo as espécies com hábitos fossoriais apresentaram valores mais baixos, espécies com hábitos tanto terrestres quanto arborícolas apresentaram valores intermediários, assim com as espécies de hábitos aquáticos e as espécies arborícolas apresentaram valores mais altos. No entanto, a espécie que apresentou a maior proporção da cauda foi Dendrophidion dendrophis, uma espécie considerada arborícola por Cunha e Nascimento (1978), porém contestada por Martins e Oliveira (1999). Martins e Oliveira (1999) afirmaram que a grande proporção da cauda estaria relacionada ao comportamento de defesa da espécie e Prudente et al. (2007), assim como A. Dourado (no prelo), concluíram que o grande comprimento da cauda desta espécie está relacionado ao comportamento de autotomia. Algumas espécies podem não corresponder exatamente ao padrão esperado o que pode estar relacionado aos diferentes grupos filogenéticos encontrados (Sawaya, 2003). Corallus hortulanus, por exemplo, é uma espécie primariamente arborícola, porém apresenta o tamanho da cauda relativamente pequeno, sendo menor que muitas espécies terrestres (Maschio, 2008). 46 Segundo Maschio (2008), a análise não criteriosa pode levar a conclusões erradas a respeito de alguns aspectos de história natural das espécies. Corallus hortulanus, assim como Oxybelis fulgidus pode ser encontrada no solo após a ingestão de presas relativamente grandes (Maschio, 2008). Desta forma, segundo ainda o mesmo autor, encontrar determinada espécie em determinado substrato não significa que se possa classificar de imediato esse substrato na categoria de uso da espécie, devendo-se ter cautela, principalmente em análises com uma quantidade pequena de indivíduos observados. Uso do substrato e atividade diária Ao considerar os principais substratos utilizados dentre as 61 espécies, é possível inferir que na Ilha de Marajó predominam serpentes primariamente ou exclusivamente terrestres (36%; n= 22), seguidas por serpentes de hábitos arborícolas ou semiarborícolas (31%; n= 19), aquáticas ou semi-aquáticas (20%; n= 12), fossoriais (11%; n= 7) e criptozóicos (2%; n= 1), embora algumas espécies possam utilizar mais de um tipo de subtrato. Na Ilha de Marajó, 30 (49%) espécies são primariamente diurna, 17 (28%) são primariamente noturna e 14 (23%) são diurnas e noturnas (Tabela 3). Quanto à utilização do substrato, é importante salientar que o predomínio de serpentes primaria ou exclusivamente terrestres, seguido por serpentes de hábitos arborícolas ou semi-arborícolas, aquáticas ou semi-aquáticas, fossoriais e criptozóicas observado em Marajó, pode ser o reflexo de uma subamostragem de alguns substratos. No entanto, estes resultados são semelhantes ao observado na FLONA de Caxiuanã, onde predominam espécies terrestres, seguido por arborícolas, aquáticas ou semiaquáticas, criptozóicas e fossoriais (Maschio, 2008). 47 Tabela 3. Dieta, habitat e período de atividade para as espécies de serpentes presentes na Ilha de Marajó, Pará, Brasil, incluindo informações da literatura. Letras maiúsculas indicam que os itens alimentares, habitat e atividade são referidos como primários. Letras minúsculas indicam que os itens alimentares, habitat e atividade são referidos como ocasionais. Legenda: ave= aves, oav= ovos de aves, lag= lagartos, ola= ovos de lagartos, mol= moluscos, mam= mamíferos, pei= peixes, ser= serpentes, anu= anuros adultos, gir= girinos, sal= salamandras, afb= anfisbenas, cen= centopéias, art= artrópodes (exceto centopeias), min= minhocas, oni= onicóforos, aq= aquático, fo= fossorial, cr= criptozóico, te= terrestre, ar= arborícola, d= diurno, n= noturno, ?= suposição, traço= sem informação. FAMÍLIA Espécie BOIDAE Boa constrictor Corallus hortulanus Epicrates cenchria Epicrates maurus Eunectes deschauenseei Eunectes murinus COLUBRIDAE Chironius carinatus Chironius exoletus Chironius flavolineatus Chironius fuscus Chironius multiventris Dendrophidion dendrophis Drymarchon corais Leptophis ahaetulla Mastigodryas bifossatus Mastigodryas boddaerti Oxybelis aeneus Oxybelis fulgidus Spilotes pullatus Tantilla melanocephala DIPSADIDAE Atractus natans Atractus schach Clelia clelia Dipsas indica Drepanoides anomalus Helicops angulatus Helicops hagmanni Helicops leopardinus Helicops polylepis Helicops trivittatus Hydrodynastes gigas Hydrops martii Imantodes cenchoa Leptodeira annulata Liophis almadensis Liophis lineatus Liophis meridionalis DIETA USO DO SUBSTRATO ATIVIDADE DIÁRIA AVE, LAG, MAM ANU, AVE, LAG, MAM AVE, LAG, MAM, anu, oav AVE, LAG, MAM AVE, MAM, PEI AVE, LAG, MAM, PEI, TE, ar AR, te TE, ar TE, ar AQ, te AQ, te D, N N D, N N N N, d ANU, ave, lag, MAM ANU, lag, sal ANU ANU, lag, mam, sal ANU, LAG, ave, mam ANU, ave, lag ANU, LAG, SER, MAM, oav ANU, LAG ANU, LAG, MAM ANU, LAG, MAM ANU, LAG, ave AVE, LAG AVE, ANU, LAG, MAM, OAVE CTP, art TE, AR TE, AR TE, AR TE, AR TE, AR TE TE TE, AR TE TE, ar AR, te AR, te TE, AR CR, te D D, n D D D D D D D D D D D D, n MIN MIN SER, lag, pma MOL LAG, OLAG PEI, GIR, anu, lag PEI PEI, ANU PEI, anu PEI, min ANU, MAM, PEI PEI LAG, anu ANU, gir, lag ANU ANU ANU FO FO TE AR TE, ar AQ AQ, te AQ AQ AQ AQ, TE AQ, te AR TE, AR, aq TE TE, AQ, ar TE D? D, N D, N N N, d N, d N,d D, N D, N D, N D D, N N N, D D D D 48 Liophis poecilogyrus Liophis reginae Liophis taeniogaster Liophis typhlus Oxyrhopus melanogenys Oxyrhophus trigeminus Philodryas argentea Philodryas viridissima Pseudoboa coronata Psomophis joberti Siphlophis cervinus Siphlophis compressus Taeniophallus quadriocellatus Thamnodynastes lanei Thamnodynastes sp. ELAPIDAE Micrurus filiformis Micrurus hemprichii Micrurus ibiboboca Micrurus spixii Micrurus surinamensis TYPHLOPIDAE Typhlops reticulatus VIPERIDAE Bothrops atrox Bothrops marajoensis Crotalus durissus Lachesis muta ANU, gir, lag ANU, gir, lag ANU, gir, PEI ANU, lag LAG, MAM LAG, MAM ANU, LAG AVE, ANU, LAG, MAM AVE, LAG, MAM ANU, LAG LAG, anu, ave, mam LAG LAG ANU ANU TE, cr TE TE, AQ TE TE, ve TE AR AR, te TE TE, ar VE, te VE, te TE TE, VE, aq? TE, AQ? D, n D D D, n D, n D, N D D D, N D N N, d D N N? AFB, SER AFB, ONI, SER ANF, SER AFB, LAG, SER PEI, lag FO CR, FO, te TE, FO CR, FO, TE AQ,te N D, N D, N D D, N ART FO N? ANU, LAG, MAM, ave, ser, cen MAM, ave, lag MAM TE, ve, aq TE TE D, N N, d N Segundo Martins e Oliveira (1999), essas diferenças podem simplesmente refletir diferenças na composição de espécies nas taxocenoses, relativas à contribuição de cada linhagem filogenética, embora algumas dessas diferenças possam ser, também, consequência das diferenças na pressão de predadores e/ou disponibilidade de presas em cada substrato. Apesar de praticamente metade da Ilha de Marajó ser constituída por áreas abertas (Projeto RADAM, 1974), há um predomínio de espécies com atividade primariamente diurna, assim como em outras taxocenoses amazônicas (Duellman, 1978; Martins e Oliveira, 1999; Bernarde e Abe, 2006; Maschio, 2008). Martins e Oliveira (1999) apresentaram o período de atividade de 62 espécies para a região de Manaus, o mesmo 49 número de espécies registradas em Marajó, das quais 41% são estritamente diurnas, 21% estritamente noturnas e 38% ativas em ambos os períodos, estas últimas, com frequência superior a observada na Ilha de Marajó. Santos-Costa (2003) registrou, para a Estação Científica Ferreira Pena, Pará, a atividade diária de 51 espécies de serpentes, das quais 47% foram diurnas, 30% noturnas e 23% diurnas e noturnas. Bernarde e Abe (2006) registram o período de atividade de 55 espécies de serpentes do Município de Espigão do Oeste, Rondônia, das quais 45,5% foram diurnas, 32,7% noturnas e 21,8% diurnas e noturnas. Maschio (2008) registrou o período de atividade de 50 espécies presentes na FLONA de Caxiuanã, das quais 60% foram diurnas, 24% noturnas e 16% noturnas e diurnas. Desta forma, exceto pelos resultados obtidos por Martins e Oliveira (1999), o padrão de atividade registrado para as serpentes da Ilha de Marajó é semelhante ao de outras taxocenoses amazônicas, com serpentes diurnas sendo mais frequentes que as noturnas, que por sua vez são mais frequentes que as espécies ativas em ambos os períodos. Sabe-se que algumas espécies podem manter seu padrão de atividade diária independentemente da estação do ano ou da temperatura, sugerindo que este pode ser determinado geneticamente (Gibbons e Semlitsch, 1987). No entanto, Shine (1979) sugeriu que os padrões de atividade diária podem estar associados ao tipo de presa utilizado e à estratégia de forrageio empregada pela espécie. A complexidade em mensurar os fatores responsáveis pelos padrões de atividade diária observada, aliada a insuficiência de informações a respeito da dieta da maioria das espécies de serpentes amazônicas, exige que esta questão seja melhor estudada para que os reais fatores responsáveis pelos padrões de atividade diária das espécies possam ser compreendidos. 50 Ciclo reprodutivo Foram obtidos dados de reprodução de 37 espécies de serpentes da Ilha de Marajó (Tabela 4). De forma geral, a maior proporção de jovens e filhotes foram registrados de outubro a abril, sendo em menor proporção, entre os meses de maio a setembro. Fêmeas contendo ovos e/ou embriões foram registradas em maior proporção entre os meses de maio a setembro (Figura 4). Filhotes, juvenis e fêmeas com ovos ou embriões foram capturados em quase todos os meses do ano (exceto janeiro) para as espécies aquáticas ou encontradas frequentemente em ambientes alagados, enquanto que para as demais espécies foram capturados filhotes, juvenis e fêmeas em fase reprodutiva principalmente durante a estação chuvosa (Tabela 4). Ainda que poucos, os dados de reprodução observados na Ilha de Marajó sugerem que, de um modo geral, o recrutamento de juvenis das espécies terrestres e arborícolas parecem iniciar no final da estação seca, enquanto que das espécies aquáticas ou semiaquáticas parecem ocorrer ao longo do ano. 51 Tabela 4. Distribuição temporal da ocorrência de folículos vitelogênicos secundários (Fo), ovos (Ov), embriões (Em), filhotes (Fi) e jovens (Jo) imaturos de 37 espécies de serpentes coletadas entre os anos de 1958 e 2009 na Ilha de Marajó, Pará, Brasil. Mais de uma ocorrência é indicada entre parênteses pelo respectivo algarismo arábico. Ocorrência de filhotes em destaque. ESPÉCIE Espécies terrestres, arborícolas ou semiarborícolas Espécies associadas com ambientes aquáticos Bothrops atrox Chironius carinatus Chironius exoletus Chironius flavolineatus Chironius fuscus Clelia clelia Corallus hortulanus Crotalus durissus Dendrophidion dendrophis Epicrates cenchria Epicrates maurus Imantodes cenchoa Leptodeira annulata Leptophis ahaetulla Liophis almadensis Liophis meridionalis Liophis reginae Mastigodryas boddaerti Micrurus filiformis Oxybelis fulgidus Philodryas argentea Pseudoboa coronata Psomophis joberti Siphlophis cervinus Siphlophis compressus Taeniophallus quadriocellatus Thamnodynastes lanei Thamnodynastes sp. Eunectes deschauenseei Helicops angulatus Helicops leopardinus Helicops polylepis Helicops trivittatus Hydrodynastes gigas Liophis lineatus Liophis poecilogyrus Liophis taeniogaster Dez Jo(4) Jan Em ESTAÇÃO CHUVOSA Fev Mar Abr Fi/Jo Jo Ov Mai Jun Jul ESTAÇÃO SECA Ago Jo Set Out Fi(2) Nov Jo Jo Ov Jo Fi Fo/Ov Jo Jo Fi Ov Fi Jo Fi Fi/Jov/Ov(2) Jo/Ov Ov Fi(10) Jo Jo(2) Fi/Jo Ov Ov Fo Fi Ov Fo/Ov Jo Fo Ov(2) Fi Fo Ov Fi Fi Ov Ov Fo Jo Fi/Ov Jo Fo Jo Ov Ov Ov Ov Fi(4) Fo(3) Fi(2) Fi Fi/Jo(2) Fi(4)/Jo/Ov(2) Fi Jo/Ov Fo/Ov Jo(2) Fi(4) Fi(4) Jo Fo Fo(3) Jo Fi(2)/Fo/Jo/Ov(6) Fi/Fo/Ov Fi/Jo(2)/Ov(2) Em/Jo/Ov(2) Em Jo(2) Jo(2) Jo Jov Ov Fi Fi(2)/Fo Fi(2)/Jo(3)/Ov Fi(2) Fo Fo 52 Figura 4. Distribuição temporal da ocorrência de folículos em vitelogênese secundária, ovos, embriões, filhotes e jovens de 37 espécies de serpentes presentes na Ilha de Marajó, Pará. Duellman (1978) sugeriu um padrão de reprodução não sazonal para as serpentes amazônicas. No entanto, para uma mesma localidade, algumas espécies parecem apresentar padrão reprodutivo não sazonal, enquanto outras espécies o padrão parece ser sazonal (Martins e Oliveira, 1999). Desta forma, para obter resultados mais precisos para o padrão de reprodução de uma espécie é necessário analisar um volume considerável de exemplares e com capturas relativamente homogêneas ao longo dos meses. Embora algumas espécies tenham sido relativamente bem estudadas, como por exemplo Tantilla melanocephala e Anilius scytale (ver Santos-Costa et al., 2006; Maschio et al., 2007), o padrão reprodutivo das serpentes amazônicas ainda é pouco documentado. Muitas informações disponíveis provêm de estudos de taxocenoses, nos quais o número de espécimes analisado geralmente é baixo (e. g.: Duellman, 1978; 53 Martins e Oliveira, 1999; Santos-Costa, 2003; Maschio, 2008) impossibilitando uma discussão segura sobre o assunto (Maschio, 2008). Segundo Martins e Oliveira (1999), a escassez de alimentos na estação seca, em ambientes amazônicos, pode ser uma restrição para que ocorra o recrutamento durante este período, especialmente para aquelas espécies cujos jovens alimentam-se de presas sazonais como, por exemplo, anuros. Embora não tenha sido testado neste estudo, é provável que a distribuição de filhotes de espécies terrestres, arborícolas e semiarborícolas, concentrando-se principalmente na estação chuvosa, e a distribuição ao longo do ano dos filhotes de espécies aquáticas ou associadas a ambientes aquáticos, observados neste estudo, esteja relacionado com a disponibilidade de alimentos. As espécies de Eunectes, Helicops e Hydrodynastes, registradas neste estudo, podem utilizar, além de anuros, peixes como item alimentar (Starace, 1998; López e Giraudo, 2003; Ávila et al., 2006). Liophis taeniogaster e L. poecilogyrus além de utilizarem anuros adultos em sua dieta fazem uso de girinos, indicando o forrageio na água. Em tese, espécies relacionadas com ambiente aquático podem capturar presas tanto terrestres quanto aquáticas (peixes e anfíbios, por exemplo) como visto anteriormente. Não existem estudos que relatem o aumento da abundância de presas ou a sazonalidade das mesmas (como anuros, lagartos e roedores) em Marajó. No entanto, na FLONA de Caxiuanã a abundância de anfíbios está relacionada ao aumento da precipitação (Maschio, 2008). Considerando este fato, é provável que na Ilha de Marajó, por estar sujeita a inundações sazonais (Goulding et al., 2003), essas espécies de serpentes sofram menor influência da disponibilidade de alimento em relação às 54 espécies terrestres e arborícolas. No entanto, os dados obtidos neste estudo são insuficientes para elaborar tais conclusões. Estrutura da taxocenose A partir da matriz de recursos, baseada em informações de dieta, período de atividade e substrato de forrageio (Tabela 3), observa-se no dendrograma a formação de seis grupos contendo espécies que em geral possuem hábitos diários, períodos de atividade e/ou substrato de forrageio semelhante (Figura 5; Tabela 5). Nessa análise, Bothrops marajoensis não foi incluída por não existirem informações suficientes sobre a espécie. O grupo A é formado exclusivamente por espécies primariamente noturnas e arborícolas, que se alimentam primariamente de lagartos (exceto Dipsas indica que é especialista em moluscos). Dois xenodontíneos (Siphlophis cervinus e S. compressus) e dois dipsadíneos (Dipsas indica e Imantodes cenchoa) integram este grupo (Tabela 5; Figura 5). O grupo B é formado exclusivamente por espécies que utilizam primariamente o substrato aquático para atividades de forrageio, são noturnas e que incluem peixes em sua dieta. Este grupo, que representa 15% das espécies da Ilha de Marajó, é constituído por duas espécies de Eunectes, Micrurus surinamensis, cinco espécies de Helicops e Hydrops martii (Tabela 5; Figura 5) O grupo C é formado exclusivamente por serpentes que forrageiam primariamente no substrato solo, sendo em sua maioria espécies com hábitos diurnos e noturnos, alimentando-se de serpentes ou presas serpentiformes. É constituído por um 55 colubrídeo (Tantilla melanocephala) especializado em artrópodes, dois dipsadíneos (Atractus natans e A. schach) especializados em predar minhocas, três elapídeos (Micrurus filiformis, M. ibiboboca e hemprichii,) especializados em predar anfisbenas e serpentes e um xenodontíneo (Clelia clelia) especializado em predar serpentes (Tabela 5; Figura 5) O grupo D é formado por espécies que possuem hábitos primariamente noturnos, que utilizam primariamente o substrato o solo, com atividades de forrageio, com espécies que alimentam de mamíferos, lagartos, anuros e insetos. Este grupo inclui três espécies exclusivamente terrestres (Crotalus durissus, Lachesis muta e Typhlops reticulatus), três xenodontíneos terrestres e semi-arborícolas (Drepanoides anomalus, Thamnodynastes lanei e Thamnodynastes sp.) e um dipsadíneo (Leptodeira annulata) que pode forragear tanto no solo como na vegetação (Tabela 5; Figura 5) O grupo E é formado por espécies que utilizam o substrato solo e/ou vegetação e/ou água primariamente durante o dia, sendo que todas utilizam anuros como item alimentar. É o grupo mais diverso, com 31% das espécies presentes na Ilha de Marajó, sendo constituído exclusivamente por xenodontíneos e colubríneos primariamente diurnos, que utilizam diversos substratos para o forrageio, deste o aquático (Hydrodynastes gigas) ao arbóreo (Oxybelis aeneus e Philodryas argentea) (Tabela 5; Figura 5) Finalmente, o grupo F é formado por espécies que em sua maioria forrageiam primariamente no substrato solo, durante o dia, e apresentam dieta mais diversificada em relação aos demais grupos, incluindo itens como anuros, lagartos, aves e mamíferos (Tabela 5). É constituído por boídeos, colubrídeos, elapídeos, viperídeos e xenodontíneos (Figura 5). 56 O uso de recursos pelas espécies de serpentes está estreitamente relacionado à sua morfologia (Cadle e Greene, 1993. Martins et al., 2001; Sawaya, 2003). Serpentes fossoriais apresentam crânio com ossos reforçados, geralmente possuem corpo cilíndrico e pequeno, cauda curta e olhos também pequenos (Savitzky, 1983). As serpentes criptozóicas também apresentam o tamanho do corpo reduzido enquanto que as serpentes terrestres são morfologicamente variáveis apresentando-se com tamanhos dos corpos de médio a grande (Cadle e Greene, 1993). As serpentes que utilizam primariamente o substrato aquático, geralmente, possuem adaptações morfológicas como narinas e olhos deslocados para a posição dorsal do crânio, corpo mais pesado e a cauda curta que auxilia o deslocamento (Scartozzoni, 2005). Já as serpentes arborícolas tendem a ter caudas longas, corpos alongados e comprimidos dorsoventralmente como também tendem a ser mais leves (Lillywhite e Henderson, 1993). 57 Figura 5. Dendrograma de agrupamento de uso de recursos baseado em informações de dieta, período de atividade e uso do substrato de forrageio de 61 espécies registradas para a Ilha de Marajó, Estado do Pará, Brasil. 58 Tabela 5. Grupos formados a partir do dendrograma de agrupamento de uso de recursos, baseado em informações de dieta, período de atividade e uso do substrato de forrageio de 61 espécies registradas para a Ilha de Marajó, Estado do Pará, Brasil. Legenda: BOI= Boidae, COL= Colubridae, DIP= Dipsadidae, ELA= Elapidae, TYP= Typhlopidae e VIP= Viperidae. GRUPO FAMÍLIA ESPÉCIE PRINCIPAIS ITENS ALIMENTARES SUBSTRATO DE FORRAGEIO PERÍODO DE ATIVIDADE DIP DIP DIP DIP Dipsas indica Imantodes cenchoa Siphlophis cervinus Siphlophis compressus Moluscos Lagartos Lagartos Lagartos Vegetação Vegetação Vegetação Vegetação Noite Noite Noite Noite B BOI BOI DIP DIP DIP DIP DIP DIP ELA Eunectes deschauenseei Eunectes murinus Helicops angulatus Helicops hagmanni Helicops leopardinus Helicops polylepis Helicops trivittatus Hydrops martii Micrurus surinamensis Aves, Mamíferos, Peixes Aves, Mamíferos, Peixes, Lagartos Peixes, Girinos Peixes Peixes, Anuros Peixes Peixes Peixes Peixes Água Água Água Água Água Água Água Água Água Noite Noite Noite Noite Dia/Noite Dia/Noite Dia/Noite Dia/Noite Dia/Noite C DIP ELA ELA ELA COL DIP DIP Clelia clelia Micrurus hemprichii Micrurus ibiboboca Micrurus filiformis Tantilla melanocephala Atractus natans Atractus schach Serpentes Anfisbenas, Onicóforos, Serpentes Anfisbenas, Serpentes Anfisbenas, Serpentes Centopeias Minhocas Minhocas Solo Solo Solo Solo Solo Solo Solo Dia/Noite Dia/Noite Dia/Noite Noite Dia Dia Dia/Noite D VIP VIP TYP DIP DIP DIP DIP Crotalus durissus Lachesis muta Typhlops reticulatus Leptodeira annulata Thamnodynastes lanei Thamnodynastes sp. Drepanoides anomalus Mamíferos Mamíferos Insetos Anuros Anuros Anuros Lagartos, Ovos de lagartos Solo Solo Solo Solo/Vegetação Solo/Vegetação Solo Solo Noite Noite Noite Noite Noite Noite Noite COL COL COL COL COL DIP DIP DIP DIP DIP COL DIP COL DIP COL COL DIP DIP DIP Chironius carinatus Chironius exoletus Chironius flavolineatus Chironius fuscus Dendrophidion dendrophis Liophis almadensis Liophis meridionalis Liophis poecilogyrus Liophis reginae Liophis typhlus Oxybelis aeneus Philodryas argentea Mastigodryas boddaerti Psomophis joberti Chironius multiventris Leptophis ahaetulla Hydrodynastes gigas Liophis taeniogaster Liophis lineatus Anuros Anuros Anuros Anuros Anuros Anuros Anuros Anuros Anuros Anuros Anuros, Lagartos Anuros, Lagartos Anuros, Lagartos Anuros, Lagartos Anuros, Lagartos Anuros, Lagartos Anuros, Peixes, Mamíferos Anuros, Peixes Anuros Solo/Vegetação Solo/Vegetação Solo/Vegetação Solo/Vegetação Solo Solo Solo Solo Solo Solo Vegetação Vegetação Solo Solo Solo/Vegetação Solo/Vegetação Água/Solo Água /Solo Água/Solo Dia Dia Dia Dia Dia Dia Dia Dia Dia Dia Dia Dia Dia Dia Dia Dia Dia Dia Dia BOI BOI DIP BOI DIP DIP VIP COL COL ELA DIP BOI DIP COL Boa constrictor Epicrates cenchria Pseudoboa coronata Epicrates maurus Oxyrhopus melanogenys Oxyrhophus trigeminus Bothrops atrox Drymarchon corais Mastigodryas bifossatus Micrurus spixii Taeniophallus quadriocellatus Corallus hortulanus Philodryas viridissima Spilotes pullatus Solo Solo Solo Solo Solo Solo Solo Solo Solo Solo Solo Vegetação Vegetação Solo/Vegetação Dia/Noite Dia/Noite Dia/Noite Noite Dia Dia/Noite Dia/Noite Dia Dia Dia Dia Noite Dia Dia COL Oxybelis fulgidus Aves, Lagartos, Mamíferos Aves, Lagartos, Mamíferos Aves, Lagartos, Mamíferos Aves, Lagartos, Mamíferos Lagartos, Mamíferos Lagartos, Mamíferos Anuros, Lagartos, Mamíferos Anuros, Lagartos, Mamíferos, Serpentes Anuros, Lagartos, Mamíferos Anfisbenas, Lagartos, Serpentes Lagartos Anuros, Aves, Lagartos, Mamíferos Anuros, Aves, Lagartos, Mamíferos Anuros, Aves, Lagartos, Mamíferos, Ovos de aves Aves, Lagartos Vegetação Dia A E F 59 Cadle e Greene (1993) analisaram a influência de fatores históricos em 15 taxocenoses neotropicais, através da distribuição de três linhagens filogenéticas (colubríneos, xenodontíneos centroamericanos e xenodontíneos sulamericanos). Segundo os autores, os xenodontíneos sulamericanos são mais diversos na América do Sul, os xenodontíneos centroamericanos são mais diversos na América Central e os colubríneos são mais diversos na América do Norte. Assim, os autores sugeriram que a composição diferenciada dessas três linhagens, ao longo da região Neotropical, exerce forte influência nos padrões morfológicos, de atividade, uso do ambiente e dieta das taxocenoses. O padrão encontrado na Ilha de Marajó é semelhante ao sugerido por Cadle e Greene (1993) para taxocenoses Neotropicais, sendo a maioria das espécies xenodontíneos (27 espécies; 44% do total de espécies), seguido pelos colubríneos (14 espécies, 23%) e dos dipsadíneos (5 espécies, 8,1%). O alto número de xenodontíneos associado ao alto número de colubrídeos talvez explique o maior consumo de anuros em relação às outras taxocenoses Amazônicas como na FLONA de Caxiuanã (Amazônia oriental), Manaus (Amazônia central) e Espigão do Oeste (Sudeste da Amazônia). A maioria das espécies de serpentes da Ilha de Marajó apresenta hábito terrestre e diurno, padrão observado para os xenodontíneos (Cadle e Greene, 1993), o que talvez explique o padrão observado em Marajó. Comparação entre a riqueza de espécies da Ilha de Marajó e da FLONA de Caxiuanã (continente) Na Ilha de Marajó foram registradas 62 espécies (17 exclusivas em relação a FLONA de Caxiuanã; 27,4%), 34 gêneros e seis famílias; enquanto que na FLONA de Caxiuanã foram registradas 70 espécies (25 exclusivas em relação a Ilha de Marajó; 60 35,7%), 40 gêneros e oito famílias (Santos-Costa, 2003; Maschio, 2008). Destas, quarenta e cinco espécies são comuns às duas áreas (64,3%). (Tabela 6). Tabela 6. Relação das espécies registradas para a Ilha de Marajó, depositadas nas coleções herpetológicas do Museu Paraense Emílio Goeldi (MPEG), Museu de Zoologia da Universidade de São Paulo (MZUSP) e em registros de literatura, com indicação das espécies registradas na FLONA de Caxiuanã (Santos-Costa, 2003; Maschio, 2008). Legenda: n= número de espécimes; %= porcentagem do total do número de espécimes; - (traço)= sem registro; ?= registro de literatura. Família Espécie Ilha de Marajó n % FLONA de Caxiuanã (continente) n % ANILIIDAE Anilius scytale - - 7 0,85 Boa constrictor Corallus caninus Corallus hortulanus Epicrates cenchria Epicrates maurus Eunectes deschauenseei Eunectes murinus 6 4 1 21 13 6 1,37 0,91 0,23 4,78 2,96 1,37 7 2 51 8 8 0,85 0,24 6,17 0,97 0,97 Chironius carinatus Chironius exoletus Chironius flavolineatus Chironius fuscus Chironius multiventris Chironius scurrulus Dendrophidion dendrophis Drymarchon corais Drymoluber dichrous Leptophis ahaetulla Mastigodryas bifossatus Mastigodryas boddaerti Oxybelis aeneus Oxybelis fulgidus Pseustes poecilonotus Pseustes sulphureus Rhinobothryum lentiginosum Spilotes pullatus Tantilla melanocephala 4 2 1 5 1 1 1 17 3 3 2 5 ? ? 0,91 0,45 0,23 1,14 0,23 0,23 0,23 3,87 0,68 0,68 0,45 1,14 ? ? 1 5 30 2 5 10 1 9 11 16 7 19 13 15 1 7 20 0,12 0,61 3,63 0,24 0,61 1,21 0,12 1,09 1,33 1,94 0,85 2,3 1,57 1,82 0,12 0,85 2,42 4 1 1 ? 0,91 0,23 0,23 ? 3 3 2 1 6 3 3 33 1 0,36 0,36 0,24 0,12 0,73 0,36 0,36 4,0 0,12 BOIDAE COLUBRIDAE DIPSADIDAE Apostolepis pymi Atractus caxiuana Atractus major Atractus natans Atractus schach Atractus snethlageae Clelia clelia Dipsas catesbyi Dipsas indica 61 Drepanoides anomalus Erythrolamprus aesculapii Helicops angulatus Helicops hagmanni Helicops leopardinus Helicops polylepis Helicops trivittatus Hydrodynastes gigas Hydrops martii Hydrops triangularis Imantodes cenchoa Leptodeira annulata Liophis almadensis Liophis meridionalis Liophis lineatus Liophis poecilogyrus Liophis reginae Liophis taeniogaster Liophis typhlus Oxyrhopus formosus Oxyrhopus melanogenys Oxyrhopus petolarius Oxyrhopus trigeminus Philodryas argentea Philodryas viridissima Pseudoboa coronata Pseudoeryx plicatilis Psomophis joberti Siphlophis cervinus Siphlophis compressus Taeniophallus brevirostris Taeniophallus occipitalis Taeniophallus quadriocellatus Thamnodynastes lanei Thamnodynastes sp. Xenodon rabdocephalus Xenopholis scalaris 1 12 1 25 4 8 7 1 4 8 20 2 16 94 8 34 2 1 ? 4 1 4 6 1 1 2 3 13 - 0,23 2,73 0,23 5,69 0,91 1,82 1,59 0,23 0,91 1,82 4,55 0,45 3,64 21,41 1,82 7,74 0,45 0,23 ? 0,91 0,23 0,91 1,37 0,23 0,23 0,45 0,68 2,96 - 6 11 21 1 1 5 7 8 1 4 74 32 21 13 5 20 2 20 7 1 3 9 6 4 19 5 13 6 0,73 1,33 2,54 0,12 0,12 0,6 0,85 0,97 0,12 0,48 8,96 3,87 2,54 1,57 0,61 2,42 0,24 2,42 0,85 0,12 0,36 1,09 0,73 0,48 2,3 0,61 1,57 0,73 Micrurus filiformis Micrurus hemprichii Micrurus ibiboboca Micrurus lemniscatus Micrurus spixii Micrurus surinamensis 4 2 ? ? 1 0,91 0,45 ? ? 0,23 1 5 9 2 12 0,12 0,61 1,09 0,24 1,45 Siagonodon septemstriatus - - 1 0,12 Typhlops reticulatus 4 0,91 - - 36 ? 5 2 439 62 8,2 ? 1,14 0,45 138 16 3 4 826 70 16,7 1,94 0,36 0,48 ELAPIDAE LEPTOTYPHLOPIDAE TYPHLOPIDAE VIPERIDAE Bothrops atrox Bothrops brazili Bothrops marajoensis Bothriopsis taeniata Crotalus durissus Lachesis muta Total de espécimes Riqueza de espécies 62 Considerando os exemplares depositados nas coleções Herpetológicas do MPEG e MZUSP o estimador de riqueza Jackknife de primeira ordem indicou que podem ocorrer entre 66 e 74 espécies na Ilha (Tabela 7). Acrescentando um registro para cada espécie presente em Marajó, mas que não estão presentes nessas coleções, o estimador de riqueza utilizado indicou que podem ocorrer entre 79 e 88 espécies em Marajó (Tabela 7). O mesmo estimador indicou que podem ocorrer em Caxiuanã entre 78 e 84 espécies (Tabela 7). O método de rarefação (Mao Tau) estimou para Marajó entre 53 e 71 espécies e para Caxiuanã entre 64 e 76 espécies (Tabela 7). Considerando tanto 439 espécimes (que corresponde ao número de espécimes depositados no MPEG e MZUSP; 55 espécies) como 446 (que corresponde ao número de espécimes depositados no MPEG e MZUSP, acrescidos de um registro para cada uma das sete espécies inseridas neste estudo por meio da literatura; 62 espécies), o método de rarefação estimou para Caxiuanã 63 espécies, com intervalo de confiança variando entre 59 e 67 espécies (Tabela 7). Esses valores novamente encontram-se sobrepostos. A curva de rarefação também mostrou sobreposição na riqueza de espécies entre a FLONA de Caxiuanã e a Ilha de Marajó (Figura 6). Tabela 7. Número de espécimes, riqueza observada, riqueza estimada de serpentes, na Ilha de Marajó e FLONA de Caxiuanã, Estado do Pará, Brasil e riqueza esperada por rarefação para n= 439 (A) e n= 446 (B) espécimes para a FLONA de Caxiuanã. Entre parênteses, intervalo de confiança de 95%. Ilha de Marajó A B Número de espécimes Riqueza observada Riqueza estimada (Jackknife1) Riqueza estimada (Mao Tau) Riqueza esperada (rarefação; n= 439) Riqueza esperada (rarefação; n= 446) 439 55 70±3,8 55 (48-62) - 446 62 84±4,6 62 (53-71) - Caxiuanã (continente) 824 70 81±3,3 70 (64 – 76) 63 (59 – 67) 63 (59 – 67) 63 Figura 6. Curvas de rarefação da Ilha de Marajó e FLONA de Caxiuanã (continente). Linhas de cores claras representam variações com intervalo de confiança de 95%. As espécies registradas em Marajó correspondem a 16,5% de todas as espécies registradas para o Brasil (Bérnils e Costa, 2011) e 41,6% das espécies registradas para a Amazônia brasileira (Ávila-Pires et al., 2007). A grande riqueza da Ilha segue o mesmo padrão de outras regiões amazônicas (Martins e Oliveira, 1999; Santos-Costa, 2003; Maschio, 2008). O número elevado de espécies estimado em relação à riqueza observada, provavelmente, seja consequência da base de cálculo para os estimadores de riqueza de espécies, que é a presença de espécies raras. Este fator se torna problemático quando se analisa taxocenoses de animais caracteristicamente inconspícuos e com utilização de uma grande diversidade de hábitos, como as serpentes, por exemplo, que na maioria das vezes espécies consideradas raras são aquelas que não foram devidamente acessadas pelo procedimento metodológico empregado (Maschio, 2008). Independente desses 64 fatores, os valores obtidos pelo estimador de riqueza Jackknife de primeira ordem e pelo método de rarefação indicam não haver diferença significativa na riqueza de espécies de serpentes entre a FLONA e Ilha de Marajó, sendo que a maior riqueza observada em Caxiuanã, provavelmente, esteja relacionada ao maior número de espécimes coletado na FLONA (Santos-Costa, 2003; Maschio, 2008). Mesmo estando relativamente próxima da Ilha (cerca de 60 km em linha reta), a FLONA de Caxiuanã apresentou um número relativamente alto de espécies exclusivas. Desta forma, o maior número de espécimes coletado também pode estar influenciando o número de espécies exclusivas na FLONA de Caxiuanã. Espera-se que com um maior esforço de coleta em Marajó, um número maior de espécies seja registrado, tendência observada na inclinação da curva de rarefação (Figura 6), com consequente diminuição do percentual de espécies exclusivas. Por outro lado, o percentual de espécies exclusivas na Ilha de Marajó em relação à FLONA de Caxiuanã pode estar sendo influenciado pela heterogeneidade ambiental da Ilha de Marajó. Além de apresentar espécies que ocorrem em outras regiões amazônica, Marajó apresenta espécies restritas a áreas de Savanas como Bothrops marajoensis, Chironius flavolineatus, Crotalus durissus, Liophis almadensis, Liophis meridionalis, Micrurus spixii e Psomophis joberti (França et al., 2006), além de outras espécies que habitam principalmente áreas abertas como Epicrates maurus (Passos e Fernandes, 2008) e Liophis lineatus (Cunha e Nascimento, 1978). Geralmente, a riqueza de espécies em ilhas está diretamente relacionada a sua extensão e a sua fonte de colonização, assim, quanto maior for o seu tamanho e sua proximidade com a fonte de colonização maior será o número de espécies registradas (MacArthur e Wilson, 1967). Centeno et al. (2008) compararam a riqueza da Ilha de 65 São Sebastião, Estado de São Paulo, com a riqueza da região continental próxima (Município de São Sebastião), sendo que a menor riqueza observada na Ilha de São Sebastião foi atribuída ao efeito insular e menor área em relação a região continental. A Ilha de Marajó, além de ser muito extensa, é circundada por fontes de colonização relativamente próximas. As regiões sul e leste da Ilha estão próximas da região norte do Estado do Pará, enquanto que, a região sudoeste está próxima de Caxiuanã e das regiões oeste e noroeste do estado do Amapá (Figura 1). A Foz do Rio Amazonas parece não ser uma barreira geográfica eficiente entre o continente e a Ilha, permitindo a dispersão de espécies. Algumas espécies podem ser levadas pelas correntezas ao forragear ou, de forma acidental, caírem em corpos d’água. Reforçando essa hipótese, Maschio et al. (2009) observaram, na região de Caxiuanã, um exemplar de Amphisbaena amazonica, espécie estritamente fossorial, atravessando o Igarapé Marinaú e, na mesma região, um exemplar de Amphisbaena alba a aproximadamente 3 km das margens da Baía de Caxiuanã. Situação semelhante foi relatada por Martins e Oliveira (1999), que observaram um espécime de Chironius fuscus nadando no Rio Pitinga (localizado aproximadamente a 250 km em linha reta ao norte de Manaus, Amazonas) e outro de Dendrophidion dendrophis atravessando o Rio Jau (foz localizada a aproximadamente 200 km em linha reta a noroeste de Manaus, Amazonas). Estando a Ilha de Marajó muito próxima do continente, praticamente inserida na massa continental (Figura 1), é provável que os efeitos insulares não estejam atuando significativamente na riqueza de espécies de serpentes. Além disso, pelo fato de Marajó ser uma ilha recente (Rossetti e Toledo, 2006), talvez não tenha transcorrido tempo suficiente para os efeitos insulares atuarem sobre as espécies de serpentes da Ilha. 66 História natural das espécies Aqui são apresentadas informações, organizadas em ordem alfabética de família, gênero e espécie, sobre habitat, hábito, atividade diária, dieta, reprodução e distribuição geográfica, das 61 espécies descritas e registradas na Ilha de Marajó, com adição de comentários taxonômicos, quando necessário. Além disso, são apresentadas ilustrações de algumas das espécies de serpentes presentes na Ilha de Marajó (Figura 7). Família BOIDAE Gray, 1842 As serpentes desta família são restritas, principalmente, no Novo Mundo (Austin, 2000), sendo que na região neotropical encontram-se quatro gêneros com as seguintes distribuições: espécies de Boa ocorrem no México, América Central e América do Sul, Antilhas, Ilhas Dominica e Santa Lucia; espécies de Corallus ocorrem na América Central e do Sul, Arquipélago de Grenada e Ilha São Vicente; espécies de Epicrates estão presentes na América Central, América do Sul e Antilhas; e espécies de Eunectes ocorrem exclusivamente na América do Sul (Chippaux, 1986; Starace, 1998; Cunha e Nascimento, 1993; Passos e Fernandes, 2008). No Brasil, ocorrem 12 espécies distribuídas em quatro gêneros (Bérnils e Costa, 2011), estando quatro gêneros e seis espécies presentes na Ilha de Marajó. Boa constrictor Linnaeus, 1758 (Figura 7-a) Boa constrictor é encontrada em diversos tipos da habitats como florestas primárias e secundárias, áreas abertas, muitas vezes encontradas próximas às habitações 67 humanas (Cunha e Nascimento, 1978; Strüssmann e Sazima, 1993; Martins e Oliveira, 1999; Maschio, 2008). Nesse estudo, cinco espécimes foram registrados em áreas abertas e apenas um foi registrado em área de floresta. Um dos espécimes coletados em área aberta estava numa área alta coberta por vegetação baixa e com poucas árvores, a aproximadamente 4 m do solo. Martins e Oliveira (1999) relataram um espécime de grande porte descansando em uma árvore a 5 m do solo, por três dias consecutivos. Dados da literatura (Strüssmann e Sazima, 1993; Martins e Oliveira, 1999; Marques et al., 2001; Santos-Costa, 2003; Marques et al., 2005; Rocha e Prudente, 2010; Rodrigues, 2007; Maschio, 2008) acrescidos aos deste estudo indicam que B. constrictor é uma serpente terrestre, ocasionalmente utiliza a vegetação, com atividade diurna e noturna. Apresenta dieta generalizada, incluindo itens como lagartos, aves e mamíferos de pequeno e médio porte (Henderson et al., 1995; Marques et al., 2001; Santos-Costa, 2003; Marques et al., 2005; Rodrigues, 2007; Rocha e Prudente, 2010). É uma serpente vivípara (Marques et al., 2005), porém poucas são as informações sobre a reprodução desta espécies na Amazônia. Dixon e Soini (1986) mencionaram duas fêmeas parindo em janeiro (24 e 28 filhotes respectivamente), uma em fevereiro (20 filhotes) e outra em novembro (seis filhotes) indicando que a ninhada é relativamente numerosa. Duellman (1978), em Santa Cecília no Equador, registrou um juvenil no mês de novembro (COTO= 538 mm) e Maschio (2008) no mês de agosto. Nesse estudo, uma fêmea coletada em maio apresentou 20 folículos maiores que 5 mm. Quando perturbada pode produzir um som prolongado, retrair a cabeça juntamente com o corpo em forma de “S”. Quando manipulada, raramente morde (Cunha e Nascimento, 1978), pratica constrição e expele descarga cloacal (Martins e Oliveira, 1999). 68 Ocorre em toda a região Neotropical desde o México, Trinidad, Tobago e Ilha Margarita, Colômbia, Venezuela, Guiana, norte da Argentina, Paraguai, e Brasil sendo que está presente na Amazônia nas regiões Nordeste, Centro-Oeste e Sul (Cunha e Nascimento, 1978, 1993; Frota et al., 2005; Silva et al., 2011). Corallus hortulanus (Linnaeus, 1758) (Figura 7-b) Embora esta espécie seja relativamente comum na região leste do Pará (Cunha e Nascimento, 1978) e relativamente bem coletada em Caxiuanã (n= 14 em Santos-Costa, 2003; n= 37 em Maschio, 2008), apenas quatro espécimes foram coletados (1990, 1992, 1998 e 2004) na Ilha de Marajó. Um deles em área de várzea (próximo ao Rio Quiaparanã; Ponta de Pedras) e outro em árvore baixa na beira de estrada na comunidade de Tancredo Neves em Breves. Esta espécie pode ser frequentemente, encontrada tanto na vegetação alta como baixa, sobre rios e igapós (Martins e Oliveira, 1999). Corallus hortulanus habita floresta primária, mas também pode ser encontrada em áreas perturbadas, como capoeiras e roçados, sendo algumas vezes encontradas em residências (Cunha e Nascimento, 1978; Martins e Oliveira, 1999; Bartlett e Bartlett, 2003; Maschio, 2008). Quando em atividade usa primariamente a vegetação (Martins e Oliveira, 1999; Marques et al., 2001; Santos-Costa, 2003; Marques et al., 2005; Maschio, 2008) porém pode ser ocasionalmente encontrada sobre o solo (Martins e Oliveira, 1999; Santos-Costa, 2003). Apresenta período de atividade exclusivamente noturno, sendo que durante o dia pode ser encontrada dormindo protegida de predadores em brácteas de palmeiras (Maschio, 2008) e troncos ocos (Martins e Oliveira, 1999). Um dos espécimes registrado neste estudo continha pelos no intestino e outro apresentou um morcego no estômago, item também registrado por Maschio (2008). 69 Dados de literatura (Martins e Oliveira, 1999; Marques et al., 2001; Marques et al., 2005; Santos-Costa, 2003; Maschio, 2008) indicam que é uma espécie generalista, alimentando-se de itens como sapos, lagartos, aves e mamíferos. Dois jovens machos foram coletados em Marajó nos meses de dezembro e janeiro (COTO: 625 mm e 557 mm, respectivamente). Em Caxiuanã, Santos-Costa (2003) registrou filhotes nos meses de janeiro, março, abril e maio e folículos vitelogênicos também em maio. Também em Caxiuanã, Maschio (2008) registrou jovens em fevereiro e novembro e folículos secundários em março. Sua reprodução é vivípara (Marques et al., 2005). Ao ser perturbada mantêm a região anterior do corpo em forma de “S” (Martins e Oliveira, 1999). Quando manipulada pode morder, contorcer e enrolar o corpo mantendo a cabeça e a cauda voltadas para dentro e expelir descarga cloacal (Martins e Oliveira, 1999). Pode ainda, em situação de estresse, regurgitar presas recém-ingeridas, o que segundo Maschio (2008), permite recuperar a habilidade perdida pela serpente após ingerir itens de tamanho relativamente grande. Possui ampla distribuição, ocorrendo na América Central, desde a Nicarágua até a América do Sul incluindo Colômbia, Venezuela, Guiana Francesa, Equador, Bolívia, Peru, Ilhas Trindade e Windward e Brasil, na região Amazônica até o Nordeste do Maranhão (Cunha e Nascimento, 1993; Silva et al., 2011). Epicrates cenchria (Linnaeus, 1758) (Figura 7-c) O espécime registrado neste estudo foi capturado em área de floresta na metade ocidental da Ilha e segundo Cunha e Nascimento (1993), E. cenchria é encontrada apenas na região ocidental da Ilha. Habita a floresta tropical Amazônica e a Mata Atlântica (Passos e Fernandes, 2008), ocorrendo em florestas primárias como também 70 em áreas perturbadas (Martins e Oliveira, 1999). É encontrada principalmente no solo sobre a serapilheira (Santos-Costa, 2003; Marques et al., 2005; Rocha e Prudente, 2010; Rodrigues, 2007; Maschio, 2008). No entanto, Martins e Oliveira (1999) relataram um juvenil forrageando a noite em uma árvore a 3 m do solo, o que pode ser considerado evento ocasional. As informações disponíveis em Martins e Oliveira (1999), SantosCosta (2003), Rocha e Prudente (2010), Rodrigues (2007) e Maschio (2008) indicam que esta espécie apresenta período de atividade tanto diurno quanto noturno. Sua dieta é constituída primariamente de aves, mamíferos (incluindo morcegos) e ocasionalmente ovos de aves (Martins e Oliveira, 1999; Santos-Costa, 2003; Marques et al., 2005; Rodrigues, 2007). Em Marajó, um filhote foi coletado no mês de dezembro (COTO: 488 mm). Martins e Oliveira (1999) relataram para a região de Manaus, dois pequenos juvenis (502 e 606 mm) em dezembro e março e uma fêmea com folículos desenvolvidos no mês de outubro (maior com 335 mm). Santos-Costa (2003) registrou a presença de embriões em agosto e um filhote em novembro. Segundo Martins e Oliveira (1999), é provável que, pelo menos na região de Manaus, o recrutamento desta espécie ocorra durante a estação chuvosa. Esta espécie é vivípara (Marques et al., 2005). Quando manipulada, pode morder fortemente e constringir (Martins e Oliveira, 1999; Maschio, 2008). Quando perturbada mantêm o terço anterior do corpo em forma de “S”, juvenis e adultos ficam “em forma de bola”, fortemente apertadas, onde matem a cabeça escondida e protegida (Martins e Oliveira, 1999). Distribui-se na América do Sul pela Floresta Amazônica, Bacia da Colômbia, Equador, Peru, Bolívia, Venezuela, Guiana, Suriname, Guiana Francesa e Brasil (Passos e Fernandes, 2008; Silva et al., 2011). 71 Epicrates maurus Gray, 1849 Todos os espécimes registrados neste estudo foram coletados em áreas de campos na região oriental da Ilha de Marajó. Esta espécie habita enclaves de Savana da América Central ao norte da América do Sul, como as Savanas da Guiana (Starace, 1998; Passos e Fernandes, 2008). É encontrada principalmente no solo, porém os jovens podem ocupar ramos baixos de arbustos (Starace, 1998). Atividade no período noturno (Starace, 1998). Dois espécimes presentes em Marajó apresentaram pequenos mamíferos nos estômagos. Epicrates maurus alimenta-se de pequenos mamíferos, aves, lagartos, e provavelmente anuros também fazem parte da dieta dos filhotes (Starace, 1998). Por ser uma espécie de Savanas, não compartilha o mesmo nicho trófico que E. cenchria (Chippaux, 1986; Starace, 1998). Neste estudo, foram registradas duas fêmeas com ovos em maio (12 ovos, maior com 16,78 mm; 18 ovos, maior com 28,17 mm), uma em agosto (9 ovos, maior com 44,89 mm), já com embriões em desenvolvimento e outra em setembro (8 ovos, maior com 51,47 mm). Um filhote foi coletado em maio (COTO: 441 mm). Dois jovens foram coletados em maio e agosto respectivamente. Uma fêmea coletada em maio pariu 10 filhotes em novembro. Na Guiana Francesa, Starace (1998) informou período de gestação de quatro a cinco meses com partos de 10 a 15 filhotes. Lourdais et al. (2006), na Colômbia, informaram período de gestação de 2 a 3 meses, com partos de cinco a 10 filhotes. É uma espécie pouco agressiva, porém pode morder quando manipulada. Às vezes enrola-se procurando esconder a cabeça (Starace, 1998). Ocorre na América Central e América do Sul, da Nicarágua, Costa Rica, Panamá, Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa e Norte do Brasil (Roraima, 72 Amapá e extremo Norte do Pará até a Ilha de Marajó), ocorrendo também nas ilhas Trindade, Tobago e Margarita (Passos e Fernandes, 2008). Eunectes deschauenseei Dunn e Conant, 1936 Foram registrados 13 espécimes de Eunectes deschauenseei na Ilha de Marajó, sua localidade tipo, sendo que todos foram coletados em áreas de campos. Pouco se sabe sobre o habitat desta espécie, sendo considerada uma espécie rara por Chippaux (1986) e Starace (1998). Sabe-se que habita cursos d’água e regiões pantanosas (Starace, 1998), podendo ser encontrada próxima as residências (este estudo). Segundo Starace (1998), Eunectes deschauenseei é uma serpente semi-aquática de hábitos noturnos e que alimenta-se de mamíferos, pássaros e peixes (Starace, 1998). No entanto, Reed e Rodda (2009) contestam o período de atividade afirmando que os dados disponíveis ainda são insuficientes para esta conclusão. Uma fêmea coletada em Marajó no mês de março apresentou 35 folículos maiores que 5 mm (maior com 9,61 mm). Outras oito jovens fêmeas (CRC médio= 1225 mm) foram coletadas nos meses de maio, sendo que sete delas apresentaram folículos maiores que 5 mm, das quais três apresentaram folículos em vitelogênese secundária, com 1, 2 e 3 folículos respectivamente (maior: 13,91 mm). Pizzato e Marques (2007), sugeriram que a vitelogênese ocorre nos meses de agosto a fevereiro, com gestação nos meses de junho e abril, com base em dados obtidos a partir de cinco fêmeas preservadas em coleção. O período de reprodução prolongado pode estar associado aos períodos não sazonais da Floresta Amazônica (Reed e Rodda, 2009). Sua reprodução é vivípara (Starace, 1998). 73 Não foram encontrados dados sobre o comportamento defensivo de E. deschauenseei, porém, Starace (1998) mencionou que os hábitos são semelhantes aos da E. murinus (veja abaixo). Sua distribuição é restrita ao norte da América do Sul, ocorrendo na Guiana Francesa, Suriname e Brasil (Amapá e Pará) (Starace, 1998; Dirksen, 2002; França et al., 2006; Reed e Rodda, 2009). Eunectes murinus (Linnaeus, 1758) (Figura 7-d) Eunectes murinus geralmente é encontrada em grandes e pequenos rios e igarapé (Cunha e Nascimento, 1993), e também, próxima a habitações humanas (Maschio, 2008). É uma espécie que forrageia primariamente na água, porém eventualmente, forrageia no solo próximo aos corpos d’água (Cunha e Nascimento, 1978; Martins e Oliveira, 1999; Marque et al., 2005; Rocha e Prudente, 2010; Maschio, 2008). Algumas vezes é vista sobre rochas aquecendo-se durante o dia (Martins e Oliveira, 1999). Dados da literatura indicam que esta espécie apresenta período de atividade noturno, eventualmente diurno (Cunha e Nascimento, 1978; Martins e Oliveira, 1999; Marque et al. 2005; Rocha, 2007). Sua dieta constitui-se de vertebrados aquáticos e terrestres, principalmente lagartos, aves, mamíferos e peixes (Martins e Oliveira, 1999; Santos-Costa, 2003; Marques et al., 2005; Maschio, 2008). Durante a reprodução, eventualmente as mães podem comer os filhotes logo após o nascimento (Cunha e Nascimento, 1978). Neste estudo, uma fêmea (COTO: 2739 mm) coletada em maio apresentou quatro folículos maior que 5 mm (maior com 6,91 mm). Martins e Oliveira (1999) relataram uma fêmea no mês de maio contendo 50 embriões em desenvolvimento e um juvenil encontrado em setembro. É uma espécie vivípara apresentando período de gestação 74 variando de seis a sete meses (Starace, 1998). Os partos apresentam uma prole numerosa, variando de 20 a 40, podendo alcançar até 70 filhotes (Cunha e Nascimento, 1978; Starace, 1998). Quando perturbada mantêm a região anterior do corpo em forma de “S”, podendo liberar ar dos pulmões produzindo som característico (Martins e Oliveira, 1999). Quando manipulada pode constringir, morder e expelir descarga cloacal (Martins e Oliveira, 1999), podendo ainda dar bote e tentar fugir (este estudo). Sua distribuição é restrita ao norte da América do Sul, ocorrendo na Guiana Francesa, Suriname (provavelmente) e Brasil, no Estado do Amapá e na Ilha de Marajó (Starace, 1998; França et al., 2006). COLUBRIDAE Oppel, 1811 Entre os Caenophidia, a família Colubridae é considerada a mais diversa, com mais de 60% das espécies descritas (Dowling e Duellman, 1978; Uetz, 2010). Recentes análises filogenéticas, baseadas em caracteres moleculares, foram propostas para os Caenophidia (Vidal et al., 2007; Vidal e Hedges, 2009; Zaher et al., 2009), tendo como resultado mais significativo o desmembramento da família Colubridae, definindo diferentes linhagens monofiléticas. Contudo, recentes publicações não utilizaram estes novos arranjos taxonômicos e mantiveram as categorias de subfamília para os Colubridae (e.g. Myers, 2011; Pyron et al., 2011). Considerando as propostas de Vidal et al. (2007) e Zaher et al. (2009), com o reconhecimento das famílias Colubridae e Dipsadidade, na Ilha de Marajó estão presentes 14 espécies e gêneros de Colubridae. 75 Chironius carinatus (Linnaeus, 1758) (Figura 7-e) Os quatro espécimes registrado neste estudo foram coletados em áreas de campo, todos na metade oriental da Ilha. Esta espécie habita ambientes como florestas tropicais, Savanas e campos de Cerrados (Dixon et al., 1993). Segundo Cunha e Nascimento (1993), esta espécie é bastante rara no Leste do Pará e bem comum no Oeste do Maranhão, principalmente nos babaçuais e capoeiras. Um espécime foi coletado sobre o folhiço no chão pela manhã na Ilha de Marajó. É uma serpente muito ágil, com ativa diurna, hábitos terrestre e semi-arborícola (Cunha e Nascimento, 1978; Dixon et al. 1993; Starace, 1998;). Um espécime analisado neste estudo continha três anuros (Leptodactylus petersii) no estômago. Informações disponíveis em Cunha e Nascimento (1978), Dixon et al., (1993) e Starace (1998) indicam que C. carinatus alimenta-se de anuros (Pseudis paradoxa), mas pode alimentar-se de aves, lagartos (Cnemidophorus lemniscatus) e pequenos mamíferos. Segundo Starace (1998), Leptodactylidae são as presas mais consumidas por C. carinatus, seguido por Hylidae e em menor proporção lagartos, filhotes de aves e pequenos mamíferos. Em Marajó, uma fêmea com ovos foi coletada em março (11 ovos, maior com 45,2 mm). Dados obtidos por Dixon et al. (1993) indicaram a não sazonalidade reprodutiva desta espécie, relatando que sua ninhada pode variar de 5 a 12 ovos. Segundo Starace (1998) quando perturbada esta serpente ergue a metade anterior do corpo, elevando a cabeça em direção ao agressor, vibra a cauda, pode ainda achatar a cabeça e inflar a lateral do corpo. Esse comportamento agressivo (bote, seguido de fuga) foi observado um espécime coletado em Marajó. 76 Distribui-se pelas Pequenas Antilhas (São-Vicente e Guadalupe) e Trindade, pela América Central, região tropical da América do Sul até a Argentina (Cunha e Nascimento, 1993; Dixon et al., 1993; Starace, 1998; Frota et al., 2005). Chironius exoletus (Linnaeus, 1758) (Figura 7-f) Dois espécimes foram registrados neste estudo, sendo um coletado em área de floresta e outro em área de campo. Esta espécie habita florestas primárias, capoeiras, roçados, igapós, campos, Cerrados e áreas de pastagens (Cunha e Nascimento, 1993; Bernarde, 2004; Maschio, 2008), sendo muito comum na Amazônia (Cunha e Nascimento, 1993). Em Marajó, um espécime foi coletado sob tronco podre durante a noite. Os registros de literatura indicam que C. exoletus é terrestre e semi-arborícola, apresentando período de atividade primariamente diurno e ocasionalmente noturno (Dixon et al., 1993; Starace, 1998; Marque et al., 2001; Santos-Costa, 2003; Marque et al., 2005; Maschio, 2008). Um anuro (Hypsiboas geographicus) foi registrado no estômago de um espécime coletado em Marajó. Chironius exoletus parece alimentar-se primariamente de anuros e ocasionalmente de salamandras (Bolitoglossa altamazonica) e lagartos (Anolis sp., Hemidactylus mabouia), conforme dados de literatura (Cunha e Nascimento, 1993; Dixon et al., 1993; Starace, 1998; Marques et al. 2001; Santos-Costa, 2003; Marques et al., 2005). Neste estudo, uma fêmea coletada em agosto apresentava apenas pequenos folículos (maior com 4,7 mm). Dixon et al. (1993) registraram fêmeas com ovos nos meses de janeiro, fevereiro, abril e julho. Starace (1998) registrou uma fêmea com oito ovos no mês de maio. Maschio (2008) registro folículos desenvolvidos também no mês de maio (maior com 7,38 mm). Esta serpente é ovípara, cujas posturas podem variar de 77 4 a 12 ovos (Dixon et al., 1993; Starace, 1998). Com base em espécimes de coleção Dixon et al., (1993), afirmaram que devem haver dois picos de atividade desta espécie na Bacia Amazônica, um de abril a maio e outro de agosto a setembro. Quando acuada, a serpente achata a cabeça adquirindo um aspecto triangular, infla o corpo para aparecer o branco entre as escamas dorsais e ataca, pode ainda levantar a região anterior do corpo e abrir a boca, intimidando o agressor até que surja possibilidade de fuga (Starace, 1998). Distribui-se na Amazônia brasileira, Nordeste da Argentina, Bolívia, Peru, Equador, Sudeste da Colômbia, Sudeste e Leste da Venezuela, Guiana, Suriname e Guiana Francesa (Starace, 1998). Chironius flavolineatus (Boettger, 1885) (Figura 7-g) Segundo Dixon et al., (1993), em Marajó, C. flavolineatus habita estepes de gramíneas na metade oriental da Ilha, sendo que em outras regiões da América do Sul habita também áreas de Caatinga e Cerrado. Um espécime foi coletado na Ilha de Marajó, à tarde, numa capoeira com palmeiras. As poucas informações sobre a ecologia dessa espécie indicam que C. flavolineatus é diurna, forrageando tanto no solo como na vegetação (Marques et al., 2005). O único espécime coletado em Marajó continha um anuro (Leptodactulus fuscus) no estômago. Dixon et al. (1993) registraram apenas anuros como item alimentar desta espécie (hilídeos e leptodactylídeos), ou que sugere uma especialização alimentar. Uma fêmea registrada neste estudo, continha ovos em fevereiro (três ovos, maior com 33,33 mm). Dixon et al., (1993) registraram fêmeas contendo de três a oito ovos e mencionaram uma possível sazonalidade desta espécie nos meses de verão, com fêmeas apresentando ovos nos meses de novembro e dezembro. Ao ser perturbada C. 78 flavolineatus achata o corpo, exibe a mucosa bucal, expele descarga cloacal e pode dar botes (Marques et al., 2005). Esta espécie ocorre no Nordeste do Paraguai, região central da Bolívia, sendo que no Brasil é registrada nos estados do Mato Grosso, Bahia, Goiás, Minas Gerais, São Paulo e Pará, metade oriental da Ilha de Marajó (Dixon et al., 1993). Chironius fuscus (Linnaeus, 1758) (Figura 7-h) Todos os espécimes registrados neste estudo (n= 5) foram coletados em áreas florestadas. As informações da literatura indicam que Chironius fuscus habita as florestas tropicais em vários tipos de ambientes como florestas primárias, vegetação secundária, roçados e igapós (Dixon et al., 1993; Cunha e Nascimento, 1993; Martins e Oliveira, 1999). Neste estudo, um espécime foi coletado dentro de um igarapé, o que também foi registrado por Maschio (2008) em Caxiuanã. Outro exemplar foi coletado à tarde sob um tronco podre na beira de uma estrada. Dados da literatura indicam que C. fuscus pode ser encontrada ativa no solo e sobre a vegetação, forrageando exclusivamente durante o dia (Dixon et al., 1993; Martins e Oliveira, 1999; SantosCosta, 2003; Maschio, 2008). À noite, utiliza a vegetação para dormir (Santos-Costa, 2003; Martins e Oliveira, 1999). Um espécime registrado neste estudo continha um anuro do estômago (Leptodactylus sp.). Os registros em Dixon et al., 1993; Martins e Oliveira, 1999; Santos-Costa, 2003; Maschio, 2008, indicam que C. fuscus alimenta-se primariamente de anuros (e.g.: Dendrobates, Adelophryne, Eleutherodactylus, Leptodactylus, Hyla), ocasionalmente de lagartos (Anolis, Kentropyx) e salamandras (Bolitoglossa). Neste estudo um filhote foi registrado em setembro (COTO: 429 mm) e um jovem em dezembro (COTO: 543 mm). Martins e Oliveira (1999) relatam uma fêmea com 79 grandes folículos no mês de dezembro e outra com ovos também em dezembro (quatro ovos, maior com 20,3 mm). Maschio (2008) observou fêmeas com folículos desenvolvidos em julho e Santos-Costa (2003) cita folículos vitelogênicos em fevereiro e ovos em março. Ao ser manuseada, C. fuscus pode girar-se e debater, vibrar a cauda, inflar a região gular (Martins e Oliveira, 1999) ou ainda apresentar descarga cloacal (Maschio, 2008). Martins e Oliveira (1999) relatam que, ao ser abordada, durante o dia, C. fuscus permanente imóvel e, segundo os autores, a cor marrom avermelhada associada à ausência de movimentos da serpente, a torna muito difícil de ser detectada na vegetação. Duellman (1978) relatou que os espécimes que dormem a noite sob vegetação, ao caírem, rapidamente afastaram-se para longe ao menor sinal de perturbação. Esta espécie ocorre na costa leste do Brasil nos estados da Bahia, Espírito Santo, Rio de Janeiro e São Paulo e na América do Sul equatorial, incluindo Amazônia brasileira, norte da Bolívia, leste do Equador e Peru, sudeste da Colômbia, sul da Venezuela, Guiana, Suriname e Guiana Francesa (Dixon et al., 1993; Martins e Oliveira, 1999; Frota et al., 1995). Chironius multiventris Schmidt e Walker, 1943 (Figura 8-a) O espécime registrado neste estudo foi coletado numa capoeira numa área de campo. Segundo Martins e Oliveira (1999) Chironius multiventris habita florestas, podendo ser ocasionalmente encontrada em áreas perturbadas. Informações na literatura indicam que possui hábitos terrestre e semi-arborícola, tendo atividade durante o dia (Duellman, 1978; Starace, 1998, Marques et al., 2001, Bernarde e Abe, 2006; Maschio, 2008). Segundo Martins e Oliveira (1999) C. multiventris usa a vegetação durante o dia para descansar e a noite para dormir. 80 Neste estudo, foi registrado um hilídeo (Scinax cf. x-signatus) no estômago de um espécime. Informações disponíveis em Cunha e Nascimento (1993), Martins e Oliveira (1999) e Starace (1998) indicaram que esta espécie alimenta-se primariamente de anuros (Hyla, Phrynohyas, Eleutherodactylus, Leptodactylus), lagartos (Anolis, Polychrus, Tropidurus) e ocasionalmente de pequenos mamíferos e pássaros. Poucos são os dados reprodutivos para esta espécie. Martins e Oliveira (1999) mencionaram uma fêmea do Rio Cuieiras, com quatro folículos em desenvolvimento no mês de dezembro e um juvenil coletado em março. Duellman (1978) registra uma fêmea com sete ovos (comprimento médio: 28,5 mm). Não foram registrados dados neste estudo informações sobre comportamento defensivo, porém Dixon et al. (1993) comentam que essa espécie é inquieta e agressiva. Chironius multiventris distribui-se pela Guiana, Guiana Francesa, Suriname, Peru, Colômbia e Amazônia brasileira (Dixon et al., 1993; Cunha e Nascimento 1993; Starace, 1998; Frota et al., 2005). Dendrophidion dendrophis (Schlegel, 1837) (Figura 8-b) O único exemplar registrado neste estudo foi coletado em área de floresta. Segundo Cunha e Nascimento (1978) e Martins e Oliveira (1999), esta espécie habita florestas, porém pode ser encontrada, também, em capoeiras e roçados. O espécime registrado neste estudo foi coletado em um tronco caído, durante a tarde. Starace (1998) mencionou um espécime a dois metros do solo, porém não informou dados sobre horário de atividade. Dados disponíveis em Martins e Oliveira (1999), Santos-Costa (2003) e Bernarde e Abe (2006) indicam que D. dendrophis é terrestre, diurna e usa a vegetação à noite para dormir. 81 Sua dieta constitui-se de anuros como Leptodactylus andreae, Eleutherodactylus fenestratus e ocasionalmente de aves e lagartos (Martins e Oliveira, 1999; Starace, 1998; Santos-Costa, 2003; Prudente et al., 2007). Neste estudo, um juvenil foi coletado em março (COTO: 500 mm). Martins e Oliveira (1999) registraram um juvenil em fevereiro (COTO: 452 mm) e a presença de folículos vitelogênicos em janeiro, uma ninhada de quatro ovos em janeiro, uma fêmea com ovos em agosto (seis ovos, maior com 16 mm) e uma fêmea do Rio Pitinga, com ovos em novembro. Santos-Costa (2003) registrou folículos vitelogênicos em abril e ovos em outubro. Martins e Oliveira (1999) sugeriram que na região de Manaus, o recrutamento de juvenis pode ocorrer durante a estação chuvosa. Segundo Prudente et al., (2007) a reprodução desta espécie não é sazonal e os machos atingem a maturidade sexual com um menor comprimento rostro-cloacal que as fêmeas, sendo que estas atingem a maturidade sexual com cerca de três vezes o tamanho dos recém-nascidos. Dendrophidion dendrophis não morde quando manipulada, porém, expele descarga cloacal, vibra o corpo e a cauda, infla o corpo expondo a pele amarela entre as escamas dorsais e algumas vezes quebra a cauda voluntariamente (Martins e Oliveira, 1999; Prudente et al., 2007; Hoogmoed e Ávila-Pires, 2011; A. Dourado, no prelo). Ocorre desde a região sul da América Central até a América do Sul na Colômbia, Equador, Peru, Venezuela, Guiana Francesa e Amazônia brasileira (Cunha e Nascimento, 1993; Freire et al., 2010; Silva et al., 2011). Drymarchon corais (Boie, 1827) (Figura 8-c) 82 O exemplar registrado neste estudo foi coletado numa área de campo. Esta espécie habita áreas de campos aberto como na Serra Norte em Carajás e vários tipos de ambientes como áreas florestadas, Cerrado, roçado e capoeiras (Cunha e Nascimento, 1993; Strüssmann e Sazima, 1993). Informações disponíveis em Strüssmann e Sazima (1993), Starace (1998), Marques et al. (2005) e Rocha e Prudente (2010) indicam que Drymarchon corais é exclusivamente terrestre e diurna. Apresenta dieta diversificada, alimentando-se primariamente de vertebrados como mamíferos, serpentes, lagartos e anuros (Cunha e Nascimento, 1993; Strüssmann e Sazima, 1993; Starace, 1998; Marques et al., 2005, Maschio, 2008), ocasionalmente de ovos de aves que nidificam no solo como verificado por Cunha et al. (1985) e de anfisbena (Amphisbaena alba) registrado por Campos et al. (2010). Geralmente a ninhada é de 12 ovos (Starace, 1998). Na região da Guiana, os ovos são depositados entre outubro/novembro (final da estação seca), sendo que os filhotes eclodem em dezembro/janeiro (Starace, 1998). Ocorrem nas Ilhas de Trinidad, Tobago, Colômbia, Venezuela, Guiana Francesa, Peru, Equador, Bolívia, norte da Argentina, Paraguai, sendo que no Brasil ocorre na região central e nordeste da Amazônia com registro para o Mato Grosso (Cunha e Nascimento, 1993; Frota et al., 2005; Campos et al., 2010). Leptophis ahaetulla (Linnaeus, 1758) (Figura 8-d) Em Marajó, foram coletados espécimes tanto em áreas de florestas como em áreas de campo. Dois espécimes foram coletados em beira de estrada e outro no interior de uma capoeira. Habita florestas primárias, áreas perturbadas e áreas abertas, com registro nos campos rupestres em Carajás e nas Savanas de Roraima e Marajó (Cunha e Nascimento, 1993; Strüssmann e Sazima, 1993; Martins e Oliveira, 1999; Bernarde e 83 Abe, 2006). Em Marajó, dois espécimes foram coletados entre bambus pela manhã, um deles encontrava-se inativo. Outro foi coletado entre folhas caídas de palmeira também pela manhã. Informações disponíveis em Strüssmann e Sazima (1993), Starace (1998), Martins e Oliveira (1999), Santos-Costa (2003), Marques et al. (2005) e Rocha e Prudente (2010) indicam que Leptophis ahaetulla é exclusivamente diurna forrageando tanto no solo como na vegetação. A noite dorme sobre a vegetação baixa (Martins e Oliveira, 1999). Neste estudo, dois espécimes apresentaram anuros no estômago, sedo um hilídeo e um Hypsiboas sp. Outro espécime apresentou apenas insetos, o que provavelmente deve ser conteúdo secundário como observado em outras espécies de serpentes (Martins e Oliveira, 1999; Maschio, 2008). Esta espécie alimenta-se exclusivamente de anuros (Hyla sp. Hyla alboguttata, Hypsiboas sp. Scinax sp., Osteocephalus taurinus e O. leprieuri) e lagartos (Anolis sp e Thecadactylus), como indicam os registros da literatura (Strüssmann e Sazima, 1993; Martins e Oliveira, 1999; Santos-Costa, 2003; Marques et al., 2005; Bernarde e Abe, 2006; Maschio, 2008). Em Marajó, duas fêmeas contendo folículos vitelogênicos desenvolvidos foram coletadas em maio (três folículos, maior com 10,19 mm) e janeiro (quatro folículos, maior com 14, 42 mm). Um filhote foi coletado em abril (COTO: 631 mm) e outro em dezembro (COTO: 480 mm). Um jovem também foi coletado em dezembro (COTO: 834 mm). Santos-Costa (2003) e Maschio (2008) registraram folículos vitelogênicos em maio. Segundo Martins e Oliveira (1999), a ninhada pode variar de 1 a 8 ovos. Quando abordada, mantém a parte anterior do corpo em forma de “S”, a boca aberta, ataca e, ocasionalmente, morde (Martins e Oliveira, 1999). Quando manuseada, agita o corpo podendo morder (Martins e Oliveira, 1999) e expelir descarga cloacal 84 (Maschio, 2008). Segundo Martins e Oliveira (1999) e Maschio (2008), seu padrão de coloração a torna mimética, eficaz quando a serpente está ativa entre a vegetação. Leptophis ahaetulla ocorre na Venezuela, Colômbia, Guiana, Suriname, Guiana Francesa e Brasil com registros na região Amazônica, região Nordeste e faixa litorânea do Atlântico até a Bahia (Cunha e Nascimento, 1993; Albuquerque, 2009; Silva et al., 2011). Mastigodryas bifossatus (Raddi, 1820) Os espécimes registrados neste estudo foram coletados apenas em áreas de campos. Mastigodryas bifossatus habita florestas primárias e secundárias ocorrendo também em regiões de Savana (Strüssmann e Sazima, 1993; Starace, 1998). Segundo Montingelli e Zaher (2011), esta serpente geralmente é encontrada em locais úmidos, como regiões inundáveis e lagoas, associados com florestas ou áreas abertas. As informações disponíveis em Strüssmann e Sazima (1993), Starace (1998) e Rodrigues (2007) indicam que M. bifossatus é terrestre, forrageando exclusivamente durante o dia. Dados da literatura (Cunha e Nascimento, 1993; Strüssmann e Sazima, 1993; Starace, 1998; Marques et al., 2001; Marques et al., 2005; Marque e Muriel, 2007) indicam que esta espécie alimenta-se de vertebrados como mamíferos, aves, serpentes (Philodryas patagoniensis, Tantilla melanocephala), lagartos (Ameiva, Gonatodes, Kentropyx, Mabuya) e anuros (Leptodactylus). Segundo Marques e Muriel (2007), esta espécie se reproduz ao longo de todo o ano, porém, com oviposição, principalmente, no início a metade da estação chuvosa com recrutamento no final estação. 85 Ocorre no norte da América do Sul na Colômbia, Venezuela, Guianas e Brasil com registros nos estados do Pará, Maranhão e Piauí (Cunha e Nascimento, 1993; Starace, 1998). Mastigodryas boddaerti (Sentzen, 1796) (Figura 8-e,f) Mastigodryas boddaerti ocorre tanto no lado ocidental como no lado oriental da Ilha. Um dos espécimes foi coletado na beira de uma estrada e outro em uma área de capoeira. Segundo Martins e Oliveira (1999) e Cunha e Nascimento (1993), M. boddaerti é encontrada em florestas primárias, áreas perturbadas e áreas de campos. Em Marajó, dois espécimes foram coletados em tronco de palmeiras, no chão, um de manhã e outro no início da tarde. As informações disponíveis (Martins e Oliveira, 1999; Starace, 1998; Santos-Costa, 2003; Marques et al., 2005; Bernarde e Abe, 2006; Rodrigues, 2007; Maschio, 2008) indicam que esta espécie é primariamente terrestre, ocasionalmente arborícola, forrageando exclusivamente durante o dia. Um espécime registrado neste estudo apresentou dígitos e escamas de pequenos lagartos no estômago. Os itens registrados para esta espécie (Cunha e Nascimento, 1978; Santos-Costa, 2003; Marques et al., 2005; Bernarde e Abe, 2010) constitui-se principalmente de anuros (Leptodactylus longirostris e Scinax sp.) e lagartos (Ameiva ameiva, Arthrosaura sp, Cnemidophorus lemniscatus. Gonatodes humeralis, Kentropyx calcarata). Cunha e Nascimento (1978) citaram mamíferos e Beebe (1946) mencionou gafanhotos e ovos de répteis. Mamíferos e ovos podem ser considerados conteúdos ocasionais para esta espécie e os artrópodes provavelmente são conteúdos secundário. Em Marajó, uma fêmea com folículo em vitelogênese secundária (11,91 mm) foi coletada em março e uma jovem fêmea em fevereiro (COTO: 923 mm). Maschio (2008) registrou três fêmeas contendo folículos maiores que 10 mm em março e maio (quatro, 86 seis e 11 folículos respectivamente). Santos-Costa (2003) registrou filhotes em março. Martins e Oliveira (1999) registraram um recém-nascido em abril e uma fêmea do leste da Amazônia com ovos sem data fornecida (seis ovos, maior com 38,2 mm). Starace (1998) registrou um jovem macho em fevereiro (COTO: 368 mm) e uma fêmea ainda com cicatriz umbilical em junho (COTO: 420 mm). Segundo Starace (1998), na região da Guiana o acasalamento ocorre no início da estação chuvosa. Esta serpente é muito ágil, e pode desprender fuga rapidamente (Martins e Oliveira, 1999). Ao ser manipulada, agita e gira o corpo, vibra a cauda, forma um “S” com o corpo, atacando e mordendo insistentemente (Martins e Oliveira, 1999). Distribui-se pelo Equador a leste dos Andes, Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa, Bolívia e Brasil com registros na Amazônia, Mato Grosso, Ceará e provavelmente uma população isolada na Bahia (Cunha e Nascimento, 1993; Bernarde e Abe, 2006; Silva et al., 2011). Oxybelis aeneus (Wagler, 1824) (Figura 8-g) Oxybelis aeneus é registrada tanto nos campos como nas florestas de Marajó. Neste estudo, um espécime foi registrado em beira de estrada. As informações disponíveis indicam que esta espécie habita ambientes diversificados da Amazônia ocidental e oriental, como florestas primárias e vegetação secundária, sendo encontrada também nos campos rupestres da Serra Norte em Carajás e nas Savanas de Roraima (Cunha e Nascimento, 1993; Martins e Oliveira, 1999). Informações em Cunha e Nascimento (1993), Martins e Oliveira (1999), Marques et al. (2001), Santos-Costa (2003), Marques et al. (2005), Bernarde e Abe (2006) e Maschio(2008) indicam que O. aeneus é primariamente arborícola, ocasionalmente terrestre, forrageia durante o dia e dorme sobre a vegetação baixa durante a noite. 87 Alimenta-se primariamente de anuros, lagartos (Gonatodes humeralis, Alopoglossus e Gonatodes) e ocasionalmente de pássaros (Cunha e Nascimento, 1993; Marque et al., 2001; Santos-Costa, 2003; Marques et al., 2005; Rocha e Prudente, 2010). Uma fêmea madura coletada em Marajó no mês de novembro apresentou apenas folículos primários (maior com 4,27 mm). Maschio (2008) registrou folículos secundários em junho e Martins e Oliveira (1999) registraram um juvenil em março (COTO: 582 mm). Ao ser perturbada, mantêm o terço anterior do corpo em forma de “S”, abre a boca expondo uma coloração cinza escuro a preto e, às vezes ataca, com mordidas. Quando manipulada pode debater e girar o corpo, além de expelir descarga cloacal (Martins e Oliveira, 1999). Esta espécie tem ampla distribuição, ocorrendo desde o sul dos Estados Unidos, México, através da América Central, América do Sul até o norte da Argentina e Paraguai (Cunha e Nascimento, 1993; Martins e Oliveira, 1999; Frota et al., 2005; Silva et al., 2011. Oxybelis fulgidus (Daudin, 1803) (Figura 8-h) Em Marajó, Oxybelis fulgidus foi coletado tanto em área de floresta como também em área de campos, porém numa região de transição com manchas de florestas. Neste estudo foram registrado espécimes em mata terciária, capoeira e próximo a habitações humanas. Esta espécie é associada a florestas, mas é capaz de ocupar áreas degradadas, sendo vista principalmente nas bordas e em trilhas de áreas cultivadas (Starace, 1998; Martins e Oliveira, 1999). Neste estudo, é registrado um espécime coletado a noite em uma árvore a aproximadamente 4 m do solo. Outros dois foram coletados durante o dia 88 em arbusto, a aproximadamente 1,5 m do solo. Informações disponíveis (Martins e Oliveira, 1999; Santos-Costa, 2003; Maschio, 2008) indicam que esta espécie é primariamente arborícola, com hábitos terrestres e diurnos. Durante a noite dorme sobre a vegetação (Martins e Oliveira, 1999). Informações obtidas em Martins e Oliveira (1999), Santos-Costa (2003) e Maschio (2008) indicam que O. fulgidus alimenta-se de lagartos (Ameiva, Anolis, Mabuya sp.) e aves (Pripa, Thraupis, Volatinia). Em Marajó, uma fêmea contendo ovos foi coletada em maio (10 ovos, maior com 38 mm). Martins e Oliveira (1999) registraram uma fêmea com ninhada em outubro (10 ovos, maior com 38 mm), dos quais seis filhotes eclodiram após 78 dias. Santos-Costa (2003) registrou folículos vitelogênicos em abril. Segundo Martins e Oliveira (1999), esta serpente foge rapidamente quando é abordada. No entanto, em alguns casos, pode enfrentar o observador, atacando-o insistentemente através de falsos-botes. Além disso, infla o corpo, alarga a cabeça, e mantém a região do corpo em forma de “S”. Quando manuseada, além de tentar morder, agita e gira o corpo (Martins e Oliveira, 1999). Distribui-se pelo México, América Central e América do Sul a leste dos Andes através das regiões equatorial e tropical (Cunha e Nascimento, 1993; Frota et al., 2005; Silva et al., 2011). Spilotes pullatus (Linnaeus, 1758) (Figura 9-a) Spilotes pullatus habita diferentes ambientes, como florestas primárias, secundárias, Cerrados e babaçuais (Cunha e Nascimento, 1993; Martins e Oliveira, 1999). Aparentemente, é mais comum em áreas degradadas, possivelmente devido à adaptação e presas que ocorrem nestes ambientes (Cunha e Nascimento, 1978). Martins 89 e Oliveira (1999) mencionam três espécimes aquecendo-se às margens de um campo inundado. Informações disponíveis em Martins e Oliveira (1999), Marques et al., (2001), Marques et al., (2005), Rodrigues (2007) e Rocha (2007) indicam que esta espécie é terrestre e semi-arborícola, com hábitos diurnos. Possui dieta diversificada, incluindo aves, anuros, mamíferos (Proechimys gardneri), lagartos, ovos de aves, inclusive animais doméstico de habitações rurais (Cunha e Nascimento, 1978, 1993; Starace, 1998; Martins e Oliveira, 1999; Rocha e Prudente, 2010; Marques e Sazima, 2004; Maschio, 2008; Mendonça et al., 2011). Poucas são as informações disponíveis sobre a reprodução desta espécie. Amaral (1930) apud Martins e Oliveira (1999), relatou fêmeas contendo de oito a 12 ovos e Maschio (2008) registrou folículos desenvolvidos em novembro. Quando abordada, faz ameaças exibindo a cabeça ao elevar o pescoço, infla a região gular e mantêm a região anterior do corpo em forma de “S”, chegando, a em alguns casos, a perseguir o observador por alguns metros podendo em seguida, desviar e fugir rapidamente (Martins e Oliveira, 1999). Se manipulada, agita e gira o corpo, podendo morder (Martins e Oliveira, 1999). Ocorre na Costa Rica, Panamá, Trindade, Tobago, Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa, Equador, Peru, Bolívia, Paraguai, norte da Argentina e Brasil, com registros na Amazônia, e nas regiões Centro-Oeste, Nordeste e Sudeste (Cunha e Nascimento, 1993; Rocha e Prudente, 2010; Silva et al., 2011). Tantilla melanocephala (Linnaeus, 1758) (Figura 9-b) Tantilla melanocephala habita tanto florestas primárias como áreas alteradas, associadas a áreas cultivadas, podendo ser também, encontrada em capoeiras e roçados (Dixon e Soini, 1986; Cunha e Nascimento, 1993; Martins e Oliveira, 1999). Possui 90 hábitos primariamente criptozóicos, eventualmente terrestre (Cunha e Nascimento, 1978; Martins e Oliveira, 1999; Santos-Costa, 2003; Maschio, 2008) forrageando primariamente durante o dia, podendo, eventualmente ser encontrada em atividade de forrageio durante a noite. Informações disponíveis indicam que Tantilla melanocephala alimenta-se primariamente de centopeias e, ocasionalmente, de outros artrópodes (Cunha e Nascimento, 1978; Santos-Costa, 2003; Rocha, 2007; Maschio, 2008). Vinte espécimes analisados por Martins e Oliveira (1999) continham apenas centopeias no trato digestivo evidenciando sua especialização alimentar. Dixon e Soini (1986) registraram uma fêmea com ovos em novembro (três ovos, maior com 29 mm). Martins e Oliveira (1999) registraram uma fêmea com dois ovos. Rocha (2007) registrou uma fêmea com folículos desenvolvidos em janeiro (maior com 14, 25 mm). Santos-Costa (2003) registrou folículos vitelogênicos em novembro. Segundo Santos-Costa et al. (2006) a reprodução desta espécie na Amazônia não e sazonal, com produção de uma a três ovos por fêmeas. Segundo Martins e Oliveira (1999), Tantilla melanocephala agita o corpo vigorosamente quando manuseada, mas não morde. Distribui-se pela América Central, Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa, Peru, Argentina, Uruguai e Brasil, com registros na Amazônia e nas regiões Centro-Oeste e Nordeste (Cunha e Nascimento, 1978; Wilson e Mena, 1980; Vanzolini et al., 1980; Martins e Oliveira, 1999; Strüssmann, 2000; Lema, 2002; Frota et al., 2005; Silva et al., 2011). 91 DIPSADIDAE Bonaparte 1840 A família Dipsadidae contém mais de 700 espécies distribuídas em 92 gêneros, sendo a maior família nas Américas (Vidal et al., 2010b). Os dipsadídeos são essencialmente tropicais, com a maioria das espécies ocorrendo na América Central (Dipsadinae), América do Sul e Índias ocidentais (Xenodontinae) (Hedges et al., 2009; Vidal et al., 2010a). Apresentam ampla variação no tamanho do corpo (10 – 280 cm) e na ecologia (Hedges et al., 2009). A maioria das espécies se alimenta de sapos e/ou lagartos, mas algumas são especialistas em serpentes, lesmas, caracóis e minhocas (Cadle e Greene, 1993). As espécies de serpentes pertencentes a essa família estavam recentemente alocadas na família Colubridae. No entanto, Vidal et al. (2007), com base em dados moleculares, propuseram uma nova organização dos grupos superiores de serpentes, propondo a família Dipsadidae. Na Ilha de Marajó foram registrados 17 gêneros e 32 espécies de Dipsadidae. Atractus natans Hoogmoed e Prudente, 2003 Poucas são as informações disponíveis para esta espécie, o que pode ser atribuído a sua recente descrição. Os quatro espécimes coletados em Marajó encontravam-se no interior de capoeiras com vegetação intercalada por palmeiras. Estas informações agregadas as de Hoogmoed e Prudente (2003) indicam que A. natans habita tanto áreas de floresta primária como áreas perturbadas. Os espécimes de Marajó foram coletados durante o dia em troncos de palmeiras apodrecidos no chão, dois no mês de fevereiro (estação chuvosa) e dois em outubro (estação seca) de 1991. Hoogmoed e Prudente (2003) mencionaram alguns espécimes no período de cheia (agosto de 1994), em Mamirauá, a aproximadamente 12 m de coluna d’água sobre troncos podres flutuantes. 92 Nestes troncos, que abrigavam ainda anuros, lagartos e ovos, havia grande quantidade de húmus, utilizado pelos espécimes para suas atividades de forrageio. Os mesmos autores relatam ainda que posteriormente quando a região já não se encontrava inundada (dezembro de 1994), troncos podres foram examinados sobre o chão da floresta, porém nenhum exemplar foi encontrado. Estas informações indicam que Atractus natans é provavelmente uma serpente diurna de hábito fossorial, que utiliza principalmente troncos apodrecidos para se abrigar. Um dos espécimes registrados neste estudo continha minhoca no trato digestivo, observado também em um espécime depositado no MPEG coletado na Ilha Mexiana localizada a aproximadamente 10 km em linha reta de Marajó, o que indica que esta espécie, assim como outras do gênero, seja especialista em anelídeos. Duas fêmeas, contendo apenas pequenos folículos foram coletadas em Marajó no mês de fevereiro (maiores com 2,27 e 3,37 mm respectivamente). Não há encontradas informações sobre aspectos reprodutivos e comportamento defensivo para A. natans. As poucas informações disponíveis sobre a distribuição desta espécie indicam uma distribuição ao longo do Rio Amazonas, nos estados do Amazonas (Mamirauá) e Pará na região de Caxiuanã e nas Ilhas de Marajó e Mexiana (Hoogmoed e Prudente, 2003. Atractus schach (Boie, 1827) (Figura 9-c) Atractus schach é registrada em área de floresta na Ilha de Marajó. Segundo Martins e Oliveira (1999), A. schach ocorre tanto em florestas primária como em áreas perturbadas. Cunha e Nascimento (1978) mencionaram que esta espécie possui hábitos fossoriais e Martins e Oliveira (1999) relataram um espécime forrageando sobre a liteira, durante a noite e outros quatro capturados em pitfall. Santos-Costa (2003) 93 registrou um espécime no chão, sobre a liteira, durante o dia em uma área de inundação. Maschio (2008) registrou espécimes no chão, durante o dia e espécimes coletados em pitfall. Aparentemente, A. schach é uma serpente com hábitos diurno e noturno, sendo primariamente fossorial. Esta espécie é especialista em anelídeos (Cunha e Nascimento, 1978; Martins e Oliveira, 1999; Santos-Costa, 2003; Maschio, 2008). Martins e Oliveira (1999) citaram uma fêmea contendo cinco ovos no oviduto em outubro e um juvenil coletado em junho. Santos-Costa (2003) e Maschio (2008) mencionaram filhotes coletados em outubro. Estas poucas informações indicam que o recrutamento desta espécie deve ocorrer no início da estação chuvosa (outubrodezembro). Quando perturbada, esta serpente pode esconder a cabeça sob o corpo e achatar o corpo dorsoventralmente (Martins e Oliveira, 1999; Maschio, 2008) e quando manipulada agita o corpo sem morder (Martins e Oliveira, 1999). Distribui-se pela Guiana, Suriname e Brasil sendo registrada na Amazônia ocidental, Amazônia oriental e Maranhão (Hoogmoed, 1980; Cunha e Nascimento, 1993). Clelia clelia (Daudin, 1803) (Figura 9-d) Em Marajó, Clelia clelia foi coletada apenas em área aberta, sujeitas a inundações periódicas. Esta espécie habita tanto áreas abertas como áreas florestadas (Cunha e Nascimento, 1978; Duellman, 1978; Strüssmann e Sazima, 1993; Martins e Oliveira, 1999), sendo, aparentemente mais frequente em áreas úmidas ou alagadas (Cunha e Nascimento, 1978; Duellman, 1978; Maschio, 2008). Neste estudo, um espécime é registrado pela manhã, em campo aberto. Informações da literatura (Cunha e 94 Nascimento, 1978; Duellman, 1978; Strüssmann e Sazima, 1993; Martins e Oliveira, 1999; Santos-Costa, 2003) indicam que esta espécie é tipicamente terrestre, podendo ser encontrada ativa tanto durante o dia como a noite. Não houve registro de itens alimentares neste estudo, no entanto, as informações disponíveis (Cunha e Nascimento, 1978; Duellman, 1978; Martins e Oliveira, 1999) indicam que C. clelia alimenta-se primariamente de outras serpentes (Boa constrictor, Drymarchon corais, Bothrops, Liophis reginae), ocasionalmente de lagartos (Ameiva, Gonatodes) e pequenos mamíferos (ratos). Uma fêmea coletada em Marajó apresentou ovos no mês de maio (oito ovos, maior com 39,98 mm) e 12 folículos maiores que 5 mm, sedo dois em vitelogênese secundária (maior com 16,56 mm). Duellman (1978) mencionou uma fêmea com 20 ovos, e reprodução ovípara. Quando manipulada raramente morde, porém possui forte constrição, especialmente os adultos (Martins e Oliveira, 1999). Esta espécie distribui-se desde o México, ao sul pela América Central e sul da América do Sul até a Argentina e Paraguai (Scott Jr. et al., 2006). No Brasil, distribui-se pela região mais oriental da Amazônia, incluindo as Ilhas Mexiana e Marajó, sul do Pará e oeste do Maranhão (Cunha e Nascimento, 1993) Dipsas indica Laurenti, 1768 (Figura 9-e) Os registros indicam que Dipsas indica habita tanto florestas primárias como secundárias com hábito arborícola, sendo que muito raramente é vista sobre o solo (Duellman, 1978; Martins e Oliveira, 1999). Possui hábitos noturnos (Cunha e Nascimento, 1978; Duellman, 1978; Martins e Oliveira, 1999; Marques et al., 2001) 95 Sua dieta é exclusivamente composta por moluscos (lesmas e caracóis) (Cunha e Nascimento, 1978, Duellman, 1978; Martins e Oliveira, 1999; Sazima, 1989; Marques et al., 2001). Neste estudo, não foram obtidos dados reprodutivos para esta espécie além da sua oviparidade (Duellman, 1978). Quando manipulada, triangula a cabeça, expele descarga cloacal e não morde (Martins e Oliveira, 1999). Sua distribuição restringe-se ao Equador, Peru, Colômbia, Guiana e Brasil na região Amazônica com registros nos estados de Rondônia, Pará e Goiás (Cunha e Nascimento, 1993; Vaz-Silva et al., 2007; Ávila-Pires et al., 2009). Drepanoides anomalus (Jan, 1863) (Figura 9-f) O único espécime registrado para Marajó foi coletado em área de campo no interior de uma capoeira. Segundo Cunha e Nascimento (1978, 1993), esta espécie é bastante rara em qualquer região da Amazônia e muito pouco conhecida. Pode ser encontrada tanto em florestas primárias e áreas perturbadas (Cunha e Nascimento, 1978, 1993; Maschio, 2008). Neste estudo, o espécime capturado encontrava-se entre troncos podres de palmeiras no período da tarde. Drepanoides anomalus forrageia primariamente no solo e ocasionalmente sobre a vegetação (Cunha e Nascimento, 1978; Martins e Oliveira, 1999; Santos-Costa, 2003). Segundo Starace (1998), apresenta, também, hábito semi-fossorial. Informações disponíveis (Martins e Oliveira, 1999; Santos-Costa, 2003) indicam que D. anomalus apresenta hábitos primariamente noturno, podendo ser ocasionalmente encontrada ativa durante o dia. Alimenta-se primariamente de ovos de pequenos lagartos como Gonatodes e microteídeos (Cunha e Nascimento, 1978,1993; Martins e Oliveira, 1999; Maschio, 96 2008). Santos-Costa (2003) registrou ovos de aves, que segundo Maschio (2008) pode se tratar de um equívoco, sendo na realidade ovos de Squamata. O espécime coletado em dezembro registrado neste estudo continha apenas folículos primários (maior com 3,58 mm). Maschio (2008) registrou folículos desenvolvidos em junho e agosto e Santos-Costa (2003) em novembro e filhotes em agosto. Martins e Oliveira (1999) registraram duas fêmeas contendo dois e três ovos cada. Maschio (2008) relatou ter encontrado quatro ovos de D. anomalus sob tronco podre, envoltos de terra, no final do mês de agosto, os ovos eclodiram em laboratório praticamente um mês depois, sendo a média dos CRC dos neonatos igual a 95 mm e média dos COCD igual a 43,75 mm. Quando manipulada, Drepanoides anomalus treme o corpo insistentemente, podendo expelir descarga cloacal, mas não morde (Martins e Oliveira, 1999). Segundo Cunha e Nascimento (1993) esta espécie distribui-se pela região central da Bolívia, Colômbia, Equador, Peru e região amazônica brasileira, porém os autores ressaltaram que a distribuição desta espécie ainda é incerta, não sabendo se a distribuição seria contínua ou descontínua. Helicops angulatus (Linnaeus, 1758) (Figura 9-h) Em Marajó, foram coletados espécimes tanto em florestas como em áreas de campo. Segundo Cunha e Nascimento (1978) e Martins e Oliveira (1999) esta espécie pode ser encontrada em florestas primárias, áreas abertas e perturbadas como também nas zonas suburbanas habitando rios, igarapés, várzeas e igapós. Geralmente é encontrada em águas rasas com até 20 cm de profundidade, algumas vezes pouco mais profundas em grandes corpos d’água (Martins e Oliveira, 1999). Dados de recaptura de Martins e Oliveira (1999) indicaram que espécimes desta espécie podem permanecer em 97 uma determinada área (como pequenas barragens ou pequenos lagos) por longos períodos ou alternativamente visitar as mesmas áreas em diferentes períodos. Nove espécimes foram coletados no interior de igarapés, todos durante a noite. É uma espécie primariamente noturna (Martins e Oliveira, 1999; Santos-Costa, 2003; Marques et al., 2005), eventualmente encontrada ativa durante o dia (Martins e Oliveira, 1999). Esta espécie forrageia na água como atesta os conteúdos estomacais registrados neste estudo que foram anuros (Rhinella margaritifera) e peixes (Agenciosus sp., Rivulus sp., Astyanax cf. bimaculatus). Um dos exemplares continha dois espécimes de Rhinella. Foram encontrados ainda restos de anuros e peixes não identificados. Martins e Oliveira (1999) citaram alguns espécimes se alimentando de girinos (Hyla geografica, Leptodactylus riveroi, Osteocephalus taurinus) além de um espécime com um lagarto semi-aquático (Neusticurus bicarinatus) no estômago. Cunha e Nascimento (1993) citaram peixes (Callithrys, Hoplias e Erythrinus) na dieta da espécie. Estes dados indicam que H. angulatus alimenta-se primariamente de peixes, girinos e ocasionalmente de anuros e lagartos. Neste estudo, foram registrados seis fêmeas, duas em janeiro, apresentando apenas folículos primários (maior com 6,98 mm) e quatro em outubro, sendo duas ainda filhotes (COTO: 240 e 271 mm) e duas juvenis ( COTO: 462 e 486 mm). Segundo Cunha e Nascimento (1981), o número de ovos em cada fêmea pode variar de sete a 20. Martins e Oliveira (1999) registraram dois filhotes em janeiro (COTO: aproximadamente 244 mm em ambos), Santos-Costa (2003) registrou ovos em abril e filhotes em janeiro, outubro e novembro e Maschio (2008) registrou um filhote em novembro. Quando manuseada, pode se mostrar dócil e, também, muito agressiva, com mordidas, além de girar e debater-se vigorosamente. Quando abordada fora d’água 98 podem constringir o corpo dorsoventralmente e “ampliar” a cabeça (Martins e Oliveira, 1999). Ocorre na Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa, Equador, Peru, Bolívia e Brasil, com registros na Amazônia, região Nordeste e região CentroOeste no Estado do Mato Grosso (Cunha e Nascimento, 1993; Roberto et al., 2009). Helicops hagmanni Roux, 1910 (Figura 10-a) Na Ilha de Marajó, foi registrado apenas um espécime, coletado em área de floresta. É uma serpente aquática, que habita florestas primárias, principalmente igarapés, várzeas, valas, igapós e áreas inundadas (Cunha e Nascimento, 1978; Martins e Oliveira, 1999). Helicops hagmanni é encontrada, principalmente, na água e eventualmente, no solo próximo aos corpos d’água (Martins e Oliveira, 1999; SantosCosta, 2003). Informações obtidas por Martins e Oliveira (1999) e Santos-Costa (2003) indicam que esta espécie é primariamente noturna, podendo ser, eventualmente encontrada ativa durante o dia. As informações disponíveis (Cunha e nascimento, 1978; Martins e Oliveira, 1999) indicam que esta espécie alimenta-se exclusivamente de peixes, porém é possível que outros vertebrados aquáticos possam fazer parte de sua dieta. Uma fêmea madura coletada na Ilha de Marajó no mês de dezembro apresentava apenas folículos em vitelogênesis primária (maior com 3,58 mm). Martins e Oliveira (1999) mencionaram uma fêmea com 16 folículos em desenvolvimento (maior com 16 mm) e outra com 35 (maior com 13 x 11 mm). As fêmeas grávidas podem apresentar de quatro a 20 ovos (Cunha e Nascimento, 1981). Cunha e Nascimento (1993) relataram fêmeas com embriões entre os meses de junho e novembro. Segundo estes autores, a 99 oviposição deve ocorrer no fim da estação seca para o início da estação chuvosa (dezembro/janeiro). Quando manipulada, Helicops hagmanni debate-se, gira o corpo e geralmente não morde (Martins e Oliveira, 1999). Ocorre na Colômbia, Peru e Amazônia brasileira, com maior ocorrência aparentemente na região mais oriental do Estado do Pará (Cunha e Nascimento, 1978, 1993). Helicops leopardinus (Schlegel, 1837) (Figura 10-b) Neste estudo, 25 espécimes foram registrados na Ilha de Marajó, exceto por um exemplar que não foi possível constatar a fitofisionomia do local de coleta devido à insuficiênica de informações, todos os outros espécimes foram coletados em áreas de campos. Helicops leopardinus é uma serpente aquática que habita vegetação ribeirinha, sempre associada a igarapés (Strüssmann e Sazima, 1993; Starace, 1998). Poucos são os dados sobre atividade diária desta espécie. Informações disponíveis (Strüssmann e Sazima, 1993; Santos-Costa, 2003; Marques et al., 2005, este estudo) indicam que esta serpente aquática é encontrada ativa tanto durante o dia como durante a noite. Neste estudo, foram encontrados restos de peixes não identificados, espécime de Anadora sp. (Siluriformes), girinos (possivelmente de Bufonidae) e anuro (Pseudis boliviana). Esta serpente forrageia em diversas profundidades, capturando tanto presas bentônicas como presas mais ativas da zona pelágica (Ávila et al., 2006). A dieta é composta basicamente de peixes (Anadora, Lepidosiren, Gymnotus, Hypopomus, Eigenmania, Pimelodus, Synbranchus) e anfíbios (Leptodactylus, Scinax) (Strüssmann e Sazima, 1993; Santos-Costa, 2003; Marques et al., 2005; Ávila et. al., 2006). Segundo 100 Ávila et al. (2006) peixes são os itens predominantes na dieta desta espécie, chegando até a 70% dos itens consumidos, sendo os da família Gymnotidae os mais frequentes. Neste estudo, foram registradas cinco fêmeas contendo de 3 a 17 ovos (maior com 26,2 mm), sendo que uma delas, coletada no mês de julho, possuía ainda três embriões em estágio intermediário de desenvolvimento. As outras quatro foram coletadas em maio, junho e julho. Foram registrados ainda dois filhotes, um em fevereiro (COTO: 206 mm) e outro em junho (COTO: 275 mm), cinco jovens, sendo um em maio (COTO: 409 mm), dois em junho (COTO: 317 e 364 mm) e dois em novembro (COTO: 391 e 400 mm). Segundo Marques et al., (2005), esta espécie é vivípara e quando manipulada, achata o corpo e pode morder (Starace, 1998). Distribui-se pela Guiana, Equador, Colômbia, Peru, norte da Argentina, Paraguai e Brasil, Bolívia, Paraguai e Brasil (Starace, 1998; Cisneros-Heredia, 2006), com registros na região amazônica, Centro-Oeste (Mato Grosso) e Nordeste (Bahia) (Boulenger, 1893; Strüssmann e Sazima, 1993; Frota et al., 2005; França et al., 2006). Helicops polylepis Günther, 1861 (Figura 10-c) Neste estudo, foram registrados quatro espécimes, um coletado em área de floresta, outro em área de campos e outros dois na área urbana do Município de Chaves, sendo um em área de praia. Segundo Cunha e Nascimento (1978), esta espécie habita as margens de igarapés, várzeas e igapós. Em Marajó, uma grande fêmea grávida (COTO: 993 mm) foi coletada no igarapé Tijucaquara em um buraco feito por uma raiz, no período da manhã. Registros da literatura indicam que H. polylepis é primariamente aquática (Cunha e Nascimento, 1978, Maschio, 2008). As informações disponíveis (Santos-Costa, 2003; Marques et al., 2005, Maschio, 2008) indicam que esta espécie pode ser encontrada ativa durante o dia e durante a noite. 101 Neste estudo, dois espécimes apresentaram restos alimentares no estômago, porém não foi possível identificar o conteúdo. Informações na literatura indicam que H. polylepis alimenta-se primariamente de peixes e ocasionalmente de anuros (Cunha e Nascimento, 1978, 1993; Marques et al. 2005). Neste estudo, uma fêmea coletada em julho apresentou 31 embriões em estágio avançado de desenvolvimento. Foram coletados ainda dois jovens em agosto (COTO: 429 e 354 mm, o último com cauda fraturada) e um em setembro (COTO: 382 mm). Cunha e Nascimento (1981) registraram uma fêmea com 12 ovos em desenvolvimento (maior com 23 mm) e Cunha e Nascimento (1993) uma fêmea com ovos coletada entre agosto e setembro. Ao ser manipulada, expele descarga cloacal e mordida (Maschio, 2008). Ocorre na Colômbia, Peru, Bolívia e região amazônica brasileira (Cunha e Nascimento, 1993; Frota et al., 2005; Silva et al., 2011). Helicops trivittatus (Gray, 1849) Todos os espécimes registrados neste estudo foram coletados em áreas de campos, um deles coletado muito próximo a uma residência. Helicops trivittatus é endêmica da Amazônia Oriental (Rossman, 2010). Segundo Cunha e Nascimento (1978,1993), habita áreas alagadas, igarapés, várzeas e igapós na região Amazônica, podendo ser encontrada no Cerrado, do norte do Estado de Goiás. As poucas informações disponíveis (Cunha e Nascimento 1978, 1993; Santos-Costa, 2003; Bernarde e Abe, 2006; Maschio, 2008; este estudo) indicam que é uma espécie primariamente aquática, encontrada ativa tanto durante o dia quanto a noite. Dados da literatura (Cunha e Nascimento 1978, 1993; Santos-Costa, 2003; Maschio, 2008) indicam que esta espécie alimenta-se exclusivamente de peixes 102 (Acaronia nasa, Plagioscion squamosisimus). Um dos espécimes analisados neste estudo continha minhocas no estômago, o que pode ser considerado como item ocasional. Neste estudo, uma fêmea com folículos bem desenvolvidos foi registrada em maio (13 folículos, maior com 28,27 mm) e uma jovem em junho (COTO: 350 mm). Maschio (2008) registrou uma fêmea com 26 folículos bem desenvolvidos em março (maior com 26,16 mm). Segundo Cunha e Nascimento (1993), o ciclo reprodutivo parece variar de espécime para espécime, ocorrendo recrutamentos nos períodos de chuva, de verão e período intermediários. Segundo Cunha e Nascimento (1981), esta espécie é vivípara. Não foram obtidas informações sobre comportamento defensivo para esta espécie. Helicops trivittatus ocorre na Guiana e Brasil, com registros na Amazônia oriental no Estado do Amapá, Marajó, leste e sul do Estado do Pará e região central a partir das cabeceiras do Rio Xingu no Mato Grosso, Rio Araguaia no Tocantins, até a foz do Rio Amazonas (Cunha e Nascimento, 1993; Rossman, 2010). Hydrodynastes gigas (Duméril, Bibron e Duméril, 1854) (Figura 10-d) Neste estudo, são registrados sete espécimes, todos coletados em áreas de campos. Segundo Bartlett e Bartlett (2003), esta espécie habita as águas lentas e calmas da Amazônica oriental. Neste estudo, quatro espécimes foram coletados no chão pela manhã. Maschio (2008) relatou a presença de espécimes na sombra da vegetação, descansando a poucos metros dos corpos d’água. As informações (Strüssmann e Sazima, 1990, 1993; Santos-Costa, 2003; Marques et al., 2005; Maschio, 2008; este estudo) indicam que esta é uma espécie semi-aquática encontrada ativa exclusivamente durante o dia. 103 Neste estudo, um espécime apresentou anuro (Leptodactylus macrosternum) no estômago. Strüssmann e Sazima (1990) registraram espécimes que utilizavam a cauda com movimentos de um lado para o outro para sondar diferentes locais do substrato circundante, provocando a fuga de Leptodactylus e assim os capturando. Esta espécie possui uma dieta diversificada alimentando-se de peixes, anuros (Adenomera, Leptodactylus) e mamíferos (Strüssmann e Sazima, 1990, 1993; Santos-Costa, 2003; Marques et al., 2005; Maschio, 2008). Em Marajó, foram registradas três fêmeas com folículos secundários no mês de maio (três, 10 e 18 folículos respectivamente, maior com 13,66 mm), outra com ovos e folículos secundários em março (3 ovos, maior com 63,66 mm) e outra com ovos em agosto (11 ovos, maior com 75,83 mm). Santos-Costa (2003) registrou folículos vitelogênicos em outubro e Maschio (2008) registrou folículos secundários em outubro e jovens em março e maio. Maschio (2008) registrou fuga, bote e mordida para esta espécie. Ocorre na Bolívia, Argentina, Paraguai e Brasil na região do Pantanal, Amazônia, e região Sudeste (Cunha e Nascimento, 1993; López e Giraudo, 2003; Frota et al., 2005). Hydrops martii (Wagler, 1824) (Figura 10-e) O único espécime registrado neste estudo foi coletado em uma área de floresta no Rio Preto. É abundante em locais como igarapés, igapós e áreas alagadas (Cunha e Nascimento, 1978). Segundo Bartlett e Bartlett (2003) esta espécie parece ser mais comum em águas rasas e lênticas. Informações disponíveis (Cunha e Nascimento, 1978,1993; Maschio, 2008; este estudo) indicam que esta espécie é primariamente 104 aquática podendo ser encontrada eventualmente forrageando no solo. O período de atividade pode ser tanto diurno quanto noturno (Maschio, 2008). As poucas informações disponíveis (Cunha e Nascimento, 1978, 1993) sobre os hábitos alimentares desta espécie indicam uma dieta exclusiva de peixes (Callicthys callictys, Erythrinus erythrinus, Hoplias malabaricus, Pimelodella cristata). Neste estudo, uma fêmea jovem foi registrada no mês de dezembro (COTO: 421 mm), com maior folículo com 1,8 mm de comprimento. Dados reprodutivos para esta espécie são pouco documentados, com registro de um filhote no mês de novembro (Dixon e Soini,1986). Não há informações disponíveis sobre comportamento de fuga para esta espécie. Distribui-se na região amazônica, incluindo a zona de floresta da hileia do Maranhão (Cunha e Nascimento 1993; Scrocchi et al.; 2005). Imantodes cenchoa (Linnaeus, 1758) (Figura 10-f) Quatro espécimes foram registrados neste estudo, tanto em áreas de florestas como em área de campo. Segundo Costa et al. (2010), esta espécie habita florestas densas (como a Amazônica e Mata Atlântica) como também áreas de Cerrado, podendo ser encontrada tanto em florestas primárias como áreas perturbadas (Maschio, 2008). Imantodes cenchoa é primariamente arborícola, sendo, geralmente, encontrada em vegetação de sub-bosque e apresenta hábitos exclusivamente noturnos (Martins e Oliveira, 1999; Marques et al., 2001; Santos-Costa, 2003; Marques et al., 2005; Maschio, 2008). Ocasionalmente, pode ser vista movendo-se sobre o solo enquanto acessa outro substrato arbóreo (Costa et al., 2010). Durante o dia pode ser encontrada em brácteas de palmeiras onde costuma esconder-se para dormir (Santos-Costa, 2003; Maschio, 2008). Dados de Martins e Oliveira (1999) sugerem que espécimes desta 105 espécie permanecem em uma mesma área por relativamente longos períodos (29 dias pelo menos). As informações obtidas em Cunha e Nascimento (1978, 1993), Martins e Oliveira (1999), Santos-Costa (2003) e Maschio (2008) indicam que Imantodes cenchoa alimenta-se primariamente de lagartos (Gonatodes e Anolis, principalmente o último) e ocasionalmente de anuros (Eleutherodactylus fenestratus). Apenas machos foram registrados neste estudo, incluindo um jovem coletado no mês de outubro (COTO: 552 mm). Pizzato et al., (2008) registraram folículos em desenvolvimento no mês de setembro e fêmeas ovadas nos meses de novembro e janeiro. Martins e Oliveira (1999) registraram uma fêmea ovada em março e outra com dois ovos bem desenvolvidos em fevereiro, além de filhotes em janeiro, fevereiro, junho e novembro. Segundo Martins e Oliveira (1999) o nascimento deve ocorrer durante todo o ano na região de Manaus. Santos-Costa (2003) registrou folículos secundários em março e Maschio (2008) registrou três fêmeas como folículos secundários em março, abril e maio respectivamente, além de duas fêmeas como dois ovos em novembro. Segundo Martins e Oliveira (1999), espécimes podem permanecer imóveis quando abordados. Quando manuseado podem expelir descarga cloacal, debater e girar o corpo e, eventualmente everter o hemipênis (Martins e Oliveira, 1999). Distribui-se pelo México, região tropical da Ilha de Trindade, Panamá, Colômbia, Guiana, Suriname, Guiana Francesa, Bolívia, Paraguai, Argentina e Brasil com registros na Amazônia, região Centro-oeste e Nordeste (Cunha e Nascimento, 1993). 106 Leptodeira annulata (Linnaeus, 1758) (Figura 10-g) Neste estudo são registrados espécimes em áreas de florestas, de campos, como também em área urbana (Município de Chaves). Segundo Martins e Oliveira (1999) e Cunha e Nascimento (1993), esta espécie habita diversos ambientes como florestas primárias, campos e áreas perturbadas como capoeiras e roçados. É encontrada com certa frequência nos campos rupestres da Serra Norte em Carajás, Pará (Cunha et al., 1985) e nos campos e Savanas, Roraima (Cunha e Nascimento, 1980). Em Marajó, um espécime foi coletado no chão à noite, nas margens de um lago. Outro espécime foi coletado em área de residência humana no período da tarde. As informações obtidas em Martins e Oliveira (1999), Santos-Costa (2003), Rocha (2007), Rodrigues (2007) e Maschio (2008) indicam que L. annulata é primariamente noturna, eventualmente diurna, sendo encontrada ativa tanto no solo como na vegetação. Starace (1998) menciona o hábito semi-aquático o pode ser considerado um evento ocasional. Os registros da literatura (Cunha e Nascimento, 1993; Starace 1998; Martins e Oliveira, 1999; Rodrigues, 2007) indicam que esta espécie alimenta-se primariamente de anuros (Leptodactylus, Osteocephalus, Phyllomedusatarsius) e ocasionalmente de girinos e lagartos. Segundo Martins e Oliveira (1999), é geralmente encontrada na Reserva Duke próximas às poças permanentes onde se observa agregações de anuros. Neste estudo, foi registrada uma fêmea com cinco ovos no mês de agosto. Foram registradas ainda duas jovens fêmeas em fevereiro (COTO: 486 e 540 mm). Duellman (1978) registrou uma fêmea com seis ovos e Martins e Oliveira (1999) registraram uma fêmea com ovos em fevereiro (seis ovos, maior com 18 mm), uma ninhada em setembro (cinco ovos), dois juvenis, sendo um em maio (COTO: 346 mm) e outro em dezembro (COTO: 265 mm). Santos-Costa (2003) registrou um filhote em agosto e Maschio 107 (2008) registrou uma fêmea com ovos em desenvolvimento em janeiro (seis ovos), além de duas jovens fêmeas nos meses de agosto e outubro. Quando perturbada L. annulata triangula a cabeça, mantêm a parte anterior do corpo em forma de “S” e realiza botes com a boca fechada (Martins e Oliveira, 1999). Quando manipulada tenta fugir e expele descarga cloacal (Maschio, 2008). Seu padrão de coloração pode torná-la críptica quando forrageia no solo (Maschio, 2008). Ocorre na Colômbia, sul da Venezuela, Guiana, Suriname, Guiana Francesa, Equador, Peru, Bolívia e Brasil com registros na Amazônia, nas regiões Nordeste e Centro-oeste; e faixa litorânea do Atlântico até o Estado de São Paulo (Cunha e Nascimento, 1993). Liophis almadensis (Wagler, 1824) (Figura 10-h) Vinte espécimes foram coletados em Marajó, todos de uma mesma localidade (Fazenda Aruã), em uma área de campo onde ocorrem inundações periódicas. Esta espécie é frequente em áreas perturbadas e ambientes alagadiços, como lagos, lagoas e rios (Strüssmann e Sazima, 1993; Leynaud e Brucher 1999). Os vinte espécimes registrado em Marajó foram coletados pela manhã. Poucas são as informações de história natural desta espécie. Segundo Strüssmann e Sazima (1993) e Marques et al. (2005), L. almadensis é uma serpente terrestre e diurna. Neste estudo, um espécime apresentou um anuro (Leptodactylidae, possivelmente Adenomera) e duas aranhas no estômago. Outro apresentou um anuro não identificado. Estas informações, agregadas às de Strüssmann e Sazima (1993) e Marques et al., (2005), indicam que a dieta desta espécie constitui-se basicamente de anuros. Aranhas podem ser caracterizados como conteúdos secundários. 108 Duas fêmeas coletadas no mês de maio em Marajó apresentaram ovos (dois e quatro ovos respectivamente, maior com 12,38 mm). Não foram obtidas informações sobre comportamento defensivo para esta espécie. A distribuição desta espécie é restrita ao baixo Rio Amazonas, da Ilha de Marajó ao sul para a região Centro-Oeste, Sudeste e Sul, além de registros ao longo da costa atlântica na região Nordeste, Chaco boliviano e Chaco paraguaio (Dixon et al., 1989) Liophis lineatus (Linnaeus, 1758) (Figura 11-a) Exceto por um espécime coletado no Município de Chaves, todos os espécimes registrado neste estudo foram coletados no lado oriental de Marajó. A extensão territorial do referido Município estende se até a região oriental da Ilha. Levando-se em consideração a distribuição dos espécimes apresentada neste estudo, a procedência do espécime referenciado em Chaves deve ser visto com cautela, pois os dados deste exemplar mostram que ele foi coletado por “morador local” na “área urbana de Chaves”, o que levantam dúvidas quanto à precisão do local de coleta. Esta espécie vive em solos úmidos, em vegetação baixa, ciliar, Savanas e áreas alagadas, ocorrendo também em áreas de cultivo (Cunha e Nascimento 1978; Starace, 1998). Pelo menos cinco espécimes coletados em Marajó foram capturados no período da manhã, sendo que um deles foi coletado sobre a vegetação a uma altura aproximada de 1,7 m. Cunha e Nascimento (1978) afirmaram que a espécie vive no folhiço de solos úmidos e alagados. Starace (1998) afirmou que a espécie é semi-aquática e terrestre. Essas informações indicam que a espécie é diurna, primariamente terrestre e semi-aquática, ocasionalmente encontrada sobre a vegetação. Neste estudo, foram observados anuros (Rhinella marina, Leptodactylus sp.) e aranhas. Estas informações, agregadas às de Cunha e Nascimento (1978, 1993) e 109 Starace (1998), mostraram que L. lineatus alimenta-se basicamente de anfíbios, sendo o registro de aranhas, provavelmente, conteúdo secundário. Neste estudo, foi registrado um filhote em fevereiro (COTO: 256 mm), jovens em fevereiro (n= 2), março (n= 2), abril (n= 1) e maio (n= 1) e uma fêmea com ovos em maio (11 ovos, maior com 26,45 mm). No MPEG encontram-se ainda dois recémnascidos (COTO: 192 e 202 mm), coletados no mês de dezembro, provenientes da Ilha Mexiana, localizada a aproximadamente 10 km em linha reta de Marajó. Não foram obtidas informações sobre comportamento defensivo para esta espécie, no entanto, quatro (38,8%) dos espécimes apresentaram fraturas na cauda. Esta espécie, assim como Dendrophidion dendrophis, provavelmente frature a cauda quando ameaçada (Martins e Oliveira, 1999; A. Dourado, no prelo). Liophis lineatus ocorre na região central do Panamá, Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa e Brasil no baixo Amazonas, Ilha de Marajó, leste do Pará até o Rio Gurupi; com probabilidade para toda a região norte do Estado do Pará, leste do Estado do Amazonas e Amapá, bem como da embocadura do Rio Amazonas e Estado de Roraima (Cunha e Nascimento, 1993). Liophis meridionalis (Schenkel, 1901) (Figura 11-b) Dois espécimes foram coletados em área de campo na Ilha de Marajó. Cunha e Nascimento (1993) citaram exemplares coletados em áreas de campos e Cerrado nas proximidades do Município de São Felix do Xingu. Yuki e Barros (1997) mencionaram um exemplar coletado em “região de savana amazônica” no Município de Humaitá, Amazonas. Neste estudo, um espécime foi registrado no período da manhã. As escassas informações indicam que esta espécie apresenta hábitos terrestres e diurnos (Marques et al. 2005; este estudo). 110 Um dos espécimes analisados neste estudo apresentou um anuro (Leptodactylus) em seu trato digestório. Marques et al. (2005) mencionam anuros e lagartos como itens alimentares desta espécie. Neste estudo, uma fêmea apresentou ovos no mês de janeiro (sete ovos, maior com 19,87 mm). Não há informações sobre comportamento defensivo para esta espécie. Ocorre no Estado do Pará, sul do Estado do Amazonas e Brasil-central até o extremo sul da região Sudeste (Dixon, 1989; Cunha e Nascimento, 1993; Yuki e Barros, 1997). Liophis poecilogyrus (Wied, 1825) (Figura 11-c,d) Todos os espécimes registrados neste estudo (n= 94) foram coletados na porção oriental de Marajó, concentrando-se principalmente no centro-leste da Ilha em regiões onde ocorrem inundações periódicas. Exceto por quatro espécimes coletados em Salvaterra que não tiveram a fitofisionomia constatada por insuficiência de informações, todos os demais foram coletados em áreas de campos. Liophis poecilogyrus habita áreas florestadas, desmatadas e áreas sazonalmente inundadas (Strüssmann e Sazima, 1993) podendo estar associada a riachos, lagos e outros corpos d’água (Dixon e Markezich, 1992). Em Marajó, 13 espécimes foram coletados entre as folhas, no chão, no período da tarde. Outros dois espécimes foram coletados sob capim seco e tronco caído. Rodrigues (2007) registrou um espécime sob a serapilheira e Rocha (2007) registrou um espécime abrigado durante o dia no interior de um tronco em decomposição. Informações disponíveis em Strüssmann e Sazima (1993), Maciel et al. (2003), Rocha (2007) e Rodrigues (2007) indicam que L. poecilogyrus é uma serpentes terrestre, eventualmente criptozóica, diurna, sendo eventualmente encontrada ativa a noite. 111 Sete espécimes registrados neste estudo continham anuros no estômago (Leptodactylus macrosternum, Leptodactylus sp., Hypsoboas raniceps, Rhinella sp., dentre outros não identificados), girinos e escamas de serpentes. Possivelmente, as escamas encontradas sejam da própria serpente, ingerida durante a troca de pele. Pinto e Fernandes (2004) registraram anuros (Thoropa miliaris, Leptodactylus ocellatus, Rhinella crucifer, além de hilídeos) como dieta da espécie. Segundo Pinto e Fernandes (2004), L. poecilogyrus pode capturar hilídeos vocalizando ou ovipositando, momentos em que alguns espécimes encontram-se próximos ao chão ou da água. Informações disponíveis em Marques et al., (2001), Pinto e Fernandes (2004), Marques et. al. (2005), Rodrigues (2007) e este estudo indicam que esta espécie alimenta-se, primariamente, de anuros e ocasionalmente de lagartos e girinos. Em Marajó, foram registradas fêmeas com folículos em vitelogênese secundária em maio (maior com 11,04 mm) e novembro (maior com 10,55 mm), sete fêmeas com ovos no mês de maio (três a sete ovos, maior com 36,1 mm apresentando embrião), uma em agosto (cinco ovos, maior com 28,5 mm) e duas em dezembro (seis e oito ovos respectivamente, maior com 16,62 mm). Foram registrados ainda quatro recémeclodidos em dezembro (COTO médio: 178,7 mm), quatro filhotes em março, sendo três recém-eclodidos (COTO médio dos recém-eclodidos: 153,3 mm), dois filhotes em maio (COTO: 267 e 272 mm), um em julho (COTO: 255 mm), dois em agosto (COTO: 218 mm em ambos) e ainda um jovem em maio (COTO: 284 mm com cauda fraturada), três em agosto (COTO médio: 313 mm) e um em dezembro (COTO: 393 mm). Rocha (2007) mencionou folículos secundários em junho e dezembro. Não foram obtidas informações sobre o comportamento defensivo para esta espécie. 112 Liophis poecilogyrus ocorre no sudeste e grande parte do leste da América do Sul, do leste da Venezuela ao sul por meio do Brasil até a Bolívia central e nordeste da Argentina (Dixon, 1989). Liophis reginae (Linnaeus, 1758) (Figura 11-e) Em Marajó, esta espécie habita tanto áreas de florestas como áreas de campos, ocupando inclusive áreas desmatadas, como roçados. Segundo Strüssmann e Sazima (1993) e Martins e Oliveira (1999), esta espécie habita florestas primárias, florestas perturbadas e áreas sazonalmente inundadas. Alguns espécimes de Marajó foram coletados sobre o folhiço e em troncos podres caídos no chão, sempre durante o dia. Informações disponíveis em Strüssmann e Sazima (1993), Martins e Oliveira (1999), Santos-Costa (2003) e Maschio (2008) indicam que esta espécie é estritamente diurna e terrestre, podendo usar a vegetação baixa para dormir. Registros de literatura (Strüssmann e Sazima, 1993; Martins e Oliveira, 1999; Marques et al., 2001; Santos-Costa, 2003; Marques et al., 2005; Maschio, 2008, Albarelli e Santos-Costa, 2010) e este estudo indicam que L. reginae alimenta-se principalmente de anuros (Adenomera sp., Bufo sp., Colostethus sp., Scinax gr. ruber ), ocasionalmente de girinos e lagartos (Leposoma sp.). Em Marajó, uma fêmea apresentou um folículo em vitelogênese secundária (10,7 mm) no mês de janeiro. Foram registradas ainda fêmeas com ovos nos meses de janeiro, agosto e dezembro (quatro a cinco ovos, maior com 23,17 mm) e ainda um recémeclodido em março (COTO: 144 mm). Martins e Oliveira (1999) registraram juvenis em janeiro, março, junho, setembro e novembro (COTO: 273 - 321 mm); uma fêmea com ovos em fevereiro (cinco ovos, maior com aproximadamente 10 mm) e outra com um ovo em maio (ovo com 20 mm). Santos-Costa (2003) registrou folículos em outubro e 113 novembro; ovos em outubro e filhotes em agosto. Maschio (2008) registrou folículos desenvolvidos em junho e agostos e ovos no mês de junho e segundo Martins e Oliveira (1999) a incubação pode ocorrer durante todo o ano. Ao ser abordada, esta espécie pode comprimir dorso-ventralmente o terço anterior do corpo. Quando manuseada, esta espécie pode expelir descarga cloacal (Martins e Oliveira, 1999). Martins e Oliveira (1999) mencionaram um espécime abordado a noite que caiu propositalmente de onde dormia, a 0,5 m acima do solo, e tentou fugir. Ocorre na Colômbia, Venezuela, Equador, Bolívia, Peru e Brasil com registros na Amazônia e faixa Atlântica até o Estado de São Paulo (Cunha e Nascimento, 1993). Liophis taeniogaster Jan, 1863 (Figura 11-f) Em Marajó é encontrada tanto em florestas como áreas de campos e ambientes alagados. Habita florestas primárias, áreas alteradas, roçados além de ambientes úmidos como igapós, igarapés e campos alagados (Cunha e Nascimento, 1993; Maschio, 2008; este estudo). Neste estudo, foram registrados espécimes sobre a liteira, em campos alagados e no interior de poças d’água, durante o dia. Um espécime foi coletado no início da noite. Santos-Costa (2003) registrou espécimes coletados na água e sobre a liteira durante o dia. Maschio (2008) mencionou quatro espécimes coletados no interior de igarapés, durante o dia. Estes dados, agregados às informações de Cunha e Nascimento (1978; 1993), indicam que L. taeniogaster é uma serpente diurna que forrageia tanto na água como no solo. Dois espécimes registrados neste estudo apresentaram anuros não identificados no estômago e outro apresentou vários girinos. Informações obtidas em Cunha e Nascimento (1978,1993), Marques et al. (2005) e Albarelli (2007) indicam que L. taeniogaster alimenta-se de primariamente de peixes Synbranchus marmoratus, 114 Synbranchus sp., Gymnotus carapo, Callichthys callichthys, Rivulus sp.,) e anuros. Dados de Albarelli (2007) mostram uma prevalência de 84,8% de peixes em relação aos anfíbios (15,2%). Neste estudo, foram registradas três fêmeas com folículos secundários em maio, julho e novembro; uma fêmea com cinco ovos em maio; quatro recém-eclodidos em março (COTO médio: 145,5 mm), outro em julho (COTO: 166 mm) e outro em agosto (COTO: 168 mm); um filhote em maio (COTO: 214 mm), dois em julho (COTO: 173 e 228 mm), outro em agosto (COTO: 245 mm) e outro em dezembro (COTO: 207 mm). Cunha e Nascimento (1993) registraram fêmeas com sete e dez ovos em fevereiro e outubro. É ovípara (Marques et al., 2005). Não há informações sobre comportamento defensivo para esta espécie. Aparentemente Liophis taeniogaster possui duas populações disjuntas, sendo uma na Bacia Amazônica, Colômbia, sul de Buena Vista na Bolívia e Brasil nos estados de Amapá, Amazonas, Pará, Maranhão, Rondônia, Mato Grosso; e outra na região Nordeste nos estados de Pernambuco, Paraíba até o sul da Bahia (Dixon, 1989; Fernandes et al., 2002; França e Bezerra, 2010). Liophis typhlus (Linnaeus, 1758) (Figura 11-g,h) Dois espécimes são registrados para Marajó, um coletado em área de campo e outro em um roçado. Esta espécie habita diversos tipos de ambientes com áreas florestais, Cerrados, chacos e áreas perturbadas (Dixon, 1987; Martins e Oliveira, 1999). Em Marajó, um espécime foi coletado durante o dia em um tronco podre caído. Starace (1998) informou que a espécie é terrestre, diurna e crepuscular. Martins e Oliveira (1999) mencionaram vários espécimes ativos no solo durante o dia e apenas um ativo durante a noite. Estes autores mencionam ainda que L. typhlus pode utilizar a vegetação 115 rasteira para dormir. Essas poucas informações indicam que L. typhlus é uma espécie terrestre com hábitos primariamente diurnos, podendo, ocasionalmente, estar ativa durante à noite. Informações disponíveis (Cunha e Nascimento, 1978; Martins e Oliveira, 1999) indicam que esta espécie alimenta-se de anuros (Bufonidae, Leptodactylus). Starace (1999) mencionou também, lagarto e artrópodes. Neste caso, lagartos, podem ser considerados itens ocasionais na dieta dessa espécie e artrópodes provavelmente são conteúdos secundários. Martins e Oliveira (1999) registraram folículos desenvolvidos em setembro (maior com 17 mm); fêmeas contendo ovos em janeiro, abril, junho e outubro (dois a cinco ovos, maior com 35 mm); e juvenis em janeiro, março, agosto, outubro e novembro (COTO: 184 – 266 mm), indicando que o período reprodutivo ocorre ao longo do ano. Quando abordada, muitas vezes comprime o corpo dorsoventralmente (principalmente no terço anterior) e esconde a cabeça sob o corpo (Martins e Oliveira, 1999). Quando manipulado, pode expelir descarga cloacal e debater o corpo (Martins e Oliveira, 1999). Ocorre na Colômbia, Norte e Leste da Venezuela, Guianas, Suriname, Equador, Peru a Leste dos Andes, Bolívia, Paraguai e Brasil, na região Amazônica até o Maranhão, regiões Centro-Oeste, Sudeste e costa Atlântica da região Nordeste (Dixon, 1987; Outeiral et al., 1995; Pinto e Yuki, 1999). Oxyrhopus melanogenys (Tschudi, 1845) (Figura 12-a,b) Apenas um espécime foi registrado neste estudo, o qual foi coletado em área de campo. Oxyrhopus melanogenys habita florestas primárias e áreas perturbadas como 116 capoeiras e roçados (Cunha e Nascimento, 1993; Martins e Oliveira, 1999). As informações disponíveis (Duellman, 1978; Cunha e Nascimento, 1978, 1993; Starace, 1998; Martins e Oliveira, 1999; Santos-Costa, 2003) indicam que esta espécie forrageia primariamente no solo e ocasionalmente sobre a vegetação, sendo primariamente noturna, podendo, ocasionalmente, estar ativa durante o dia. As informações existentes (Duellman, 1978; Cunha e Nascimento, 1978; 1993; Starace, 1998) evidenciam uma dieta composta por lagartos (Arthrosaura, Cnemidophorus, Iphisa, Gymnophtalmus, Leposoma,Tropidurus), pequenos roedores e marsupiais (Monodelphis americana). Poucas são as informações sobre reprodução para esta espécie. Duellman (1978) citou uma fêmea com 12 ovos. Martins e Oliveira (1999) mencionaram dois jovens coletados em março (COTO: 196 e 230 mm). Quando perturbada tenta esconder-se sob a liteira e quando manuseada, não morde, agita o corpo e vibra a cauda (Martins e Oliveira, 1999). Ocorre no Equador, Peru, Bolívia e Amazônia brasileira até o Estado Maranhão (Cunha e Nascimento, 1993). Oxyrhophus trigeminus Duméril, Bibron e Duméril, 1854 (Figura 12-c) Oxyrhophus trigeminus habita áreas de Caatinga, Cerrado e campos simples e arbóreos (Cunha e Nascimento, 1993), ocorrendo também em mata ciliar (Vaz-Silva et al.; 2007). As informações disponíveis em Marques et al. (2005), Rocha (2007), Rodrigues (2007), indicam que O. trigeminus é terrestre, com período de atividades tanto diurno quanto noturno. Assim como O. melanogenys, sua dieta parece ser composta basicamente de lagartos (Ameiva, Mabuya, Tropidurus) e mamíferos (Vitt e Vangilder, 1983; Marques 117 et al., 2005; Rocha e Prudente, 2010; Rodrigues, 2007; França et al., 2008). Rocha (2007) registrou folículos secundários em setembro e fêmeas imaturas nos meses de maio e setembro. Segundo Marques et al. (2005), trata-se de uma serpente ovípara. Há poucas informações a respeito de comportamento defensivo para esta espécie. Rocha (2007) registrou comportamento de imobilidade na captura de cinco espécimes, enquanto apenas três esboçaram fuga. A distribuição desta espécie ainda parece incerta, visto que algumas vezes exemplares de Oxyrhopus melanogenys são confundidos com O. trigeminus como verificado por Cunha e Nascimento (1993), Martins e Oliveira (1999) e MacCulloch et al. (2009). Segundo MacCulloch et al. (2009), Oxyrhopus trigeminus não ocorre na região das Guianas como indicavam estudos anteriores. Outros estudos indicam a ocorrência O. trigeminus no Peru, Venezuela e Brasil com registros nos estados do Pará, Maranhão, Piauí, Paraíba, Pernambuco, Bahia, Goiás e Mato Grosso (Vitt e Vangilder, 1983; Dixon e Soini, 1986; Cunha e Nascimento, 1993; Carvalho e Nogueira 1998; Arzabe et al. , 2005; Ávila-Pires, 2005; França e Araújo 2007; Ávila-Pires et al., 2009; Bertoluci et al., 2009; Lambertz, 2010; Rodrigues e Prudente, 2011). Philodryas argentea (Daudin, 1803) (Figura 12-d) Em Marajó foram coletadas apenas em área de floresta. Philodryas argentea vive em florestas primárias, sendo às vezes encontrada em capoeiras contíguas às florestas (Cunha e Nascimento, 1978; Martins e Oliveira, 1999). Neste estudo, foram registrados espécimes coletados durante o dia. As informações disponíveis (Dixon e Soini, 1986; Martins e Oliveira, 1999; Santos-Costa, 2003; Maschio, 2008) indicam que P. argentea é estritamente diurna e arborícola, podendo descer bem próxima ao chão para capturar presas terrestres. 118 Informações disponíveis em Cunha e Nascimento (1978, 1993), Martins e Oliveira (1999) e Maschio (2008) indicam que P. argentea alimenta-se de várias espécies de rãs (Leptodactylus (=Adenomera), Allophryne, Dendrophryniscus, Chiasmocleis, Colostethus, Eleutherodactylus, Physalaemus) e lagartos (Alopoglossus, Ameiva, Anolis, Gonatodes, Leposoma, Prionodactylus). Neste estudo, foram registradas fêmeas com folículos em vitelogênese secundária em março (maior com 12,4 mm) e contendo ovos em fevereiro (quatro ovos, maior: 38,1mm). Maschio (2008) registrou folículos vitelogênicos em maio e fêmea com quatro ovos em junho. Martins e Oliveira (1999) registraram recém-eclodidos em janeiro, fevereiro e março. Informações em Dixon e Soini (1986) e Martins e Oliveira (1999) indicam que a ninhada pode conter de dois a oito ovos com tamanho médio de 31 mm. Martins e Oliveira (1999) e Maschio (2008) citaram comportamento de imobilidade e exposição da língua quando a serpente é abordada. Quando manuseada, raramente morde, agita o corpo e expele descarga cloacal (Martins e Oliveira, 1999). Philodryas argentea ocorre na Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa, Equador, Peru, Bolívia a leste dos Andes, Paraguai e Brasil, ocorrendo na região Amazônica e nos estados do Mato Grosso e Goiás (Cunha e Nascimento, 1993). Philodryas viridissima (Linnaeus, 1758) Apenas um espécime foi registrado para a Ilha de Marajó, este, coletado em área de floresta. Esta espécie habita florestas primárias e áreas perturbadas (Martins e Oliveira, 1999). Cunha e Nascimento (1993) mencionaram a ocorrência desta espécie em áreas de transição Amazônia-Cerrado (Norte de Goiás e Maranhão) e um espécime coletado em área de Cerrado no Mato Grosso. Segundo ainda os mesmos autores, a 119 adaptação desta espécie a ambientes diversificados deve estar condicionada ao tipo de presa (rãs, pássaros e pequenos roedores) que é mais abundante nesses ambientes, principalmente aqueles mais alterados para fins agrícolas. Informações obtidas a partir de Martins e Oliveira (1999) e Santos-Costa (2003) indicam que P. viridissima é uma serpente diurna, primariamente arborícola vivendo em níveis mais elevados da vegetação, embora eventualmente possa ser encontrada no solo. Segundo Cunha e Nascimento (1978, 1993) e Martins e Oliveira (1999) esta espécie alimenta-se de rãs, lagartos, pássaros e pequenos mamíferos. Aparentemente ocorre mudança ontogenética na dieta de ectotérmicos (rãs e lagartos) para endotérmicos (mamíferos) (Martins e Oliveira, 1999). Maschio (2008) registrou folículos desenvolvidos em março (seis folículos, maior com 12,4 mm). Martins e Oliveira (1999) registraram fêmeas do leste da Amazônia (MPEG) contendo de 9 a 13 ovos (maior com 26,9 mm). Santos-Costa (2003) registrou filhote em novembro. Quando abordada e/ou manuseada, Philodryas viridissima tenta fugir ou comprime lateralmente o terço anterior do corpo, formando um “S” e morde (Martins e Oliveira, 1999). Ocorre na Colômbia, sul da Venezuela, Guiana, Suriname, Guiana Francesa, Peru, Bolívia, Paraguai, Argentina e Brasil na região Amazônica até o Estado do Maranhão e Mato Grosso (Cunha e Nascimento, 1993). Pseudoboa coronata Schneider, 1801 Quatro espécimes foram registrados neste estudo para a Ilha de Marajó, sendo três coletados em áreas florestadas, um deles próximo à habitação humana e quarto em área de campo numa capoeira. Segundo Martins e Oliveira (1999), Pseudoboa coronata é 120 uma espécie florestal encontrada, também, em áreas perturbadas. Aparentemente é uma espécie rara no leste do Pará e outras regiões Amazônicas (Cunha e Nascimento, 1993). Em Marajó, dois espécimes foram coletados a noite. Informações disponíveis (Duellman, 1978; Cunha e Nascimento, 1978; Martins e Oliveira, 1999, este estudo) indicam que P. coronata é terrestre, podendo ser encontrada ativa tanto durante o dia como durante a noite. Neste estudo, foi registrado um espécime com dois lagartos (Leposoma percarinatum) no estômago e dois ovos (provavelmente de lagarto) medindo 8,49 e 7,98 mm cada. Estes dados, agregados aos da literatura (Duellman, 1978; Cunha e Nascimento, 1978, 1993; Martins e Oliveira, 1999) indicam que P. coronata alimentase de lagartos (Ameiva sp., Mabuya sp.), aves, pequenos roedores e ocasionalmente, de ovos. Em Marajó, foi registrada uma fêmea contendo ovos no mês de outubro (maior ovo com 18,07 mm) e um jovem no mês de janeiro (COTO: 405 mm). Duellman (1978) registrou uma fêmea em setembro, contendo quatro ovos. Martins e Oliveira (1999) registraram uma fêmea com cinco ovos (maior com 34 mm). É ovípara (Marques et al., 2005). Ao ser manipulada, pode debater o corpo e constringir (Martins e Oliveira, 1999). Ocorre nas regiões Amazônicas da Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa, Equador, Peru, Bolívia e Brasil até o Estado do Maranhão (Cunha e Nascimento, 1993). Psomophis joberti (Sauvage, 1884) (Figura 12-e) Seis espécimes foram registrados para Marajó, todos coletados na porção oriental da Ilha. Psomophis joberti habita ambientes preservados e desmatados (Strüssmann e Sazima, 1993) ocorrendo na Mata Atlântica, Caatinga e Cerrado (Myers e Cadle, 1994). 121 Em Marajó, um espécime foi coletado pela manhã numa “ilha” de bambu em um tronco caído. Informações disponíveis em Strüssmann e Sazima (1993), Rodrigues (2003), Rocha (2007) e Rodrigues e Prudente (2011) indicam que P. joberti é diurna, primariamente terrestre, podendo em rara ocasião ser encontrada sobre a vegetação. Neste estudo, um espécime apresentou um anuro no estômago (Scinax sp.). Existem poucas informações disponíveis sobre sua dieta. Segundo Strüssmann e Sazima (1993), P. joberti alimenta-se de anuros e lagartos. Uma fêmea (COTO: 386 mm) contendo cinco ovos foi coletada em Marajó no mês de janeiro, como também um filhote (COTO: 142 mm). Rocha (2007) registrou folículos em desenvolvimento no mês de janeiro. Não foram obtidos dados sobre comportamento defensivo para esta espécie. Os registros obtidos neste estudo indicam que em Marajó, P. joberti distribui-se apenas pela metade oriental da Ilha (sua localidade tipo). Segundo Myers e Cadle (1994), esta espécie possui uma população disjunta na Ilha e outra que se distribui de forma irregular parecendo excluir a floresta Amazônica, ocorrendo nos estados do Ceará, Pernambuco, Paraíba, Bahia, Minas Gerais, Goiás e Mato Grosso. Siphlophis cervinus (Laurenti, 1768) (Figura 12-f) Não foi possível obter informações sobre o hatitat para o espécime registrado neste estudo, uma vez que o exemplar tinha como procedência apenas “Ilha de Marajó”. No entanto, informações em Martins e Oliveira (1999) indicam que esta espécie ocorre em floresta primária e áreas perturbadas. Informações disponíveis em Duellman (1978), Cunha e Nascimento (1978, 1993), Martins e Oliveira (1999), Santos-Costa (2003) e Maschio (2008) indicam que S. 122 cervinus é estritamente noturna, sendo primariamente arborícola e ocasionalmente terrestre. Registros da literatura (Duellman, 1978; Nascimento et al., 1987; Cunha e Nascimento, 1993; Prudente et al., 1998; Martins e Oliveira, 1999) indicam que esta serpente alimenta-se primariamente de lagartos (Mabuya bistriata, Thecadactylus rapicauda, Gonatodes, Hemidactylus, Polychrus, Plica, Tropidurus) e ocasionalmente de anuros e mamíferos (morcegos inclusive). Cunha e Nascimento (1978, 1993) mencionaram que os espécimes de S. cervinus da coleção do MPEG apresentavam aves como item alimentar, no entanto, Martins e Oliveira (1999) afirmaram que nenhum espécime citado por Cunha e Nascimento (1978, 1993) apresentava este tipo de item alimentar. Prudente et al. (1998) em um estudo de dieta com espécies do gênero Siphlophs não registraram a presença de aves na dieta de S. cervinus. É provável que aves não façam parte da dieta desta espécie. Desta forma, aves serão consideradas como itens ocasionais neste estudo. Em Marajó, uma fêmea jovem foi coletada no mês de janeiro (COTO: 593 mm). Martins e Oliveira (1999) citam uma fêmea procedente de Apeú, Pará, apresentando cinco folículos alargados em março. Quando perturbada, enrola o corpo formando uma “bola” apertada mantendo a cabeça escondida, não morde quando manuseada (Martins e Oliveira, 1999). Ocorre na Ilha de Trinidad, Colômbia, Guiana, Suriname, Guiana Francesa, Peru, Bolívia e Amazônia brasileira até o Estado do Maranhão (Cunha e Nascimento, 1993). Siphlophis compressus (Daudin, 1803) (Figura 12-g) Em Marajó, um espécime foi coletado em área de um roçado, em área de floresta alterada. Siphlophis compressus habita áreas florestadas (Martins e Oliveira, 1999), 123 ocorrendo na floresta Amazônica e Mata Atlântica (Vilela et. al., 2011). No entanto, pode ocorrer em áreas relativamente mais secas (Guedes et al., 2011). Segundo Guedes et al. (2011) a ocorrência desta espécie na Caatinga de baixa altitude no Município de Fortaleza pode estar associada à vegetação arbórea presente na área típica da ecorregião da Depressão Sertaneja Setentorial (veja Velloso et al., 2002), que fornece um habitat adequado para esta espécie. Em Marajó, um espécime foi coletado no chão em um roçado ao final da tarde. Informações disponíveis em Cunha e Nascimento (1978, 1993), Martins e Oliveira (1999), Prudente et al. (1998), Marques et al. (2001), SantosCosta (2003) e Maschio (2008) indicam que S. compressus é primariamente noturna e arborícola, ocasionalmente encontrada ativa durante o dia, inclusive no solo. Segundo ainda Martins e Oliveira (1999), S. compressus descansa durante a noite de forma exposta na vegetação e durante o dia dorme escondida na vegetação. Informações obtidas em Cunha e Nascimento (1978, 1993), Martins e Oliveira (1999), Marques et al. (2001), Santos-Costa (2003) e Maschio (2008) evidenciam uma dieta exclusivamente composta de lagartos (Ameiva ameiva, Alopoglossus, Anolis nitens, Enyalioides laticeps festae, Gonatodes humeralis, Kentropyx calcarata, Neusticurus, Tropidurus). Em Marajó, um macho jovem foi coletado em maio (COTO: 606 mm). Maschio (2008) registrou folículos secundários em janeiro. Santos-Costa (2003) registrou ovos em maio. Martins e Oliveira (1999) citaram, sem informar a data, duas fêmeas contendo nove ovos cada e um recém-eclodido em março (COTO: 367 mm). Quando abordada, S. compressus apresenta comportamento de fuga e vibração da cauda (Maschio, 2008). Quando manuseada, expele descarga cloacal, agita o corpo e a cabeça, forma um “S” com o corpo, pode dar botes com a boca fechada sem morder (Martins e Oliveira, 1999; Maschio, 2008). 124 Aparentemente, a distribuição de Siphlophis compressus é descontínua, ocorrendo na Costa Rica, Trinidad e Tobago e região amazônica da Bolívia central até a foz do Rio Amazonas, além de apresentar populações na Mata Atlântica (Vilela et al., 2011; Guedes et al., 2011). Na Amazônia brasileira, esta espécie é registrada no Amapá, Pará, Amazonas, Acre, Rondônia, Mato Grosso e Tocantins, ocorrem no Ceará, ao longo da Mata Atlântica, da Paraíba até o Rio de Janeiro (Guedes et al., 2011). Taeniophallus quadriocellatus Santos-Jr, Di-Bernardo e Lema, 2008 Em Marajó, dois espécimes são registrados neste estudo, ambos coletados em áreas de floresta. Pouco se sabe sobre a ecologia e distribuição desta espécie. Sabe-se que ocorre em áreas florestadas no Estado do Pará e áreas de Savana no sudeste do Estado do Amazonas (Santos-Jr et al., 2008; Santos-Jr, 2009). Em Marajó, um espécime foi coletado no chão atravessando uma estrada de areia (sem informação de horário), outro foi coletado pela manhã dormindo em um tronco de árvore caído. Estas informações, agregadas às de Santo-Costa (2003) indicam que T. quadriocellatus é uma espécie diurna e terrestre, provavelmente criptozóica. Um espécime analisado neste estudo continha um lagarto (Chatogekko amazonicus) no estômago. Informações em Cunha e Nascimento (1978, 1993) e SantosCosta (2003) e este estudo, indicam que esta espécie alimenta-se de anuros e lagartos. Neste estudo, foi registrada uma fêmea (COTO: 452 mm) com ovos no mês de março (dois ovos, maior com 12,5 mm). Não foram obtidas informações sobre comportamento defensivo para esta espécie. Taeniophallus quadriocellatus ocorre nos estados do Pará e sudeste do Estado do Amazonas (Santos-Jr. et al. 2008; Santos-Junior, 2009). 125 Thamnodynastes lanei Bailey, Thomas e Silva-Jr, 2005 Três espécimes são registrados para áreas de campos em Marajó, sendo um em área de várzea. Segundo Bailey et al. (2005), esta espécie habita áreas associadas a grandes fluxos d’água podendo ser encontrada na água, em áreas sazonalmente inundadas ou ao longo de grandes cursos d´água. Em Marajó, um espécime foi coletado à aproximadamente 2 m do solo, em uma árvore durante o dia, sem informação de atividade. Bailey et al. (2005) mencionaram três espécimes provenientes do Pantanal, um coletado em arbusto baixo, outro subindo um capim alto na borda de um lago seco em área de Cerrado e um terceiro sob uma tábua, no período da tarde. Griffin (1916) (apud Bailey et al., (2005)) registrou um espécime coletado dentro d’água, no Município de Santarém, Estado do Pará. As poucas informações disponíveis (Bailey et al., 2005; este estudo) indicam que T. lanei, provavelmente, seja uma espécie noturna, terrestre e semi-arborícola. Um dos espécimes analisados tinha um anuro hilídeo no estômago. Não há registros disponíveis na literatura sobre a dieta desta espécie. No entanto, Bailey et al. (2005) acreditam que sua dieta deva ser composta por rãs trepadeiras. Neste estudo, foram registradas três fêmeas contendo ovos em julho (sete ovos, maior com 14,2 mm), agosto (oito ovos, maior com 17,82 mm) e dezembro (cinco ovos, maior com 19,2 mm) respectivamente. Não foram obtidas informação sobre comportamento defensivo para esta espécie. A distribuição de T. lanei estende-se desde Formosa, Norte da Argentina, através da região da alta bacia Paraguaia, principais bacias hidrográficas do Norte e Leste da Bolívia e no Baixo Amazonas a partir de Óbitos até a Ilha de Marajó (Bailey et al., 2005). Não há registro de Thamnodynastes lanei a partir do Rio Madeira até a região de 126 Óbitos, o que talvez seja consequência do pouco conhecimento da fauna de serpentes desta região (Bailey et al., 2005). Thamnodynastes sp. Devido à complexidade deste gênero e a escassez de material comparativo não foi possível indentificar 13 espécimes de Thamndodynastes provenientes de Marajó. Exceto por um espécime que não foi possivel constatar a fitofisionomia do ambiente em que foi coletado, todos foram capturados em áreas de campos. O gênero Thamnodynastes é composto por serpentes que ocupam uma ampla variedade de hábitats e ambientes (Franco e Ferreira, 2002). Poucos espécimes analisados neste estudo tinham informações de atividade disponíveis. Um foi coletado entre esteios no chão no quintal de uma residência durante a tarde e outro foi coletado no “caminho do campo” à noite. Com base nessas informações e no item alimentar encontrado (veja parágrafo abaixo), provavelmente esta seja uma espécie terrestre e noturna, assim como T. pallidus e T. strigilis (Cunha e Nascimento, 1978; Starace 1998). Um dos espécimes analisados tinha um anuro (Leptodactylus fuscus) no estômago indicando uma dieta anurofágica. Entre os espécimes analisados, foram registrados quatro filhotes em janeiro (COTO médio: 186,8 mm). Não foram obtidas informação sobre comportamento defensivo para os espécimes analisados. ELAPIDAE Boie, 1827 A família Elapidae é composta por aproximadamente 61 gêneros e 300 espécies, distribuídas através dos trópicos e subtrópicos, incluindo as Américas, África, Ásia, melanésia e Austrália. Elapídeos marinhos podem ser encontrados nos oceanos Índico e 127 Pacífico (Keogh, 1999). São principalmente definidas pelo seu sistema único de veneno proteróglifo composto por duas pequenas presas eretas e canalizadas no final do maxilar (Keogh, 1999). Estas serpentes ocorrem nas Américas, África, Ásia, Malásia, Austrália e regiões oceânicas (Keogh, 1999; Zaher et al., 2009). Entre as 80 espécies reconhecidas atualmente para as Américas, 75 pertencem ao gênero Micrurus, quatro ao gênero Leptomicrurus e uma a Micruroides (Di Bernardo et al., 2007). No Brasil, ocorrem dois gêneros: Leptomicrurus com três espécies e Micrurus com 24 espécies (Bérnils e Costa, 2011). Na Ilha de Marajó foram registradas cinco espécies de Micrurus. Micrurus filiformis (Günther, 1859) (Figura 12-h) Quatro espécimes foram registrados neste estudo, todos ocorrendo em áreas florestadas, um deles na beira de uma estrada. Micrurus filiformis ocorre em florestas primárias e secundárias e, eventualmente em florestas abertas e Savanas neotropicais (Feitosa et al. 2007). Um filhote foi coletado no final da tarde. Informações em Dixon e Soini (1986) e Cunha e Nascimento (1978) e este estudo, indicam que M. filiformis é uma serpente fossorial de hábitos noturnos, ocasionalmente vista durante o dia. Segundo Cunha e Nascimento (1993) M. filiformis alimenta-se de anfisbenas e pequenos ofídios. Neste estudo, foram encontrados filhotes em janeiro (COTO: 260 mm) e novembro (COTO: 262 mm). Maschio (2008) registrou folículos vitelogênicos desenvolvidos no mês de outubro. Não foram obtidas informações sobre comportamento defensivo para esta espécie. 128 Micrurus filiformis é amplamente distribuída no Alto da Bacia Amazônica da Colômbia ao Peru na vertente oriental da Cordilheira dos Andes e Amazônia brasileira (Roze, 1996; Feitosa et al., 2007). Micrurus hemprichii (Jan, 1858) (Figura 13-a) Dois espécimes foram coletados em áreas de floresta em Marajó. Esta espécie habita o chão úmido das florestas primárias e secundárias como também em áreas de transição para capoeiras antigas (Cunha e Nascimento, 1993; Starace, 1998; Martins e Oliveira, 1999). Informações disponíveis em Cunha e Nascimento (1978,1993), Martins e Oliveira (1999), Santos-Costa (2003) e Maschio (2008) indicam que M. hemprichii é primariamente criptozóica e fossorial, ocasionalmente terrestre podendo ser encontrada ativa tanto durante o dia como durante a noite. Alimenta-se de anfisbenas (Amphisbaena mitchelli), onicóforos (Peripatus), lagartos (Leposoma parietale) e serpentes (Atractus, Tantilla) (Cunha e Nascimento, 1978,1993; Starace, 1998; Martins e Oliveira, 1999). Maschio (2008) registrou folículos em vitelogênese em novembro. Martins e Oliveira (1999) citaram ninhadas com dois ovos em maio e abril. Quando perturbada Micrurus hemprichii tenta fugir para a serapilheira. Em algumas ocasiões eleva a cauda enrolada, escondendo a cabeça sob o corpo também enrolado (Martins e Oliveira, 1999; Maschio, 2008). Quando manuseada, agita o corpo e morde insistentemente (Martins e Oliveira, 1999). Ocorre nas regiões amazônicas da Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa e Amazônia oriental brasileira (Cunha e Nascimento, 1993; Roze, 1996). 129 Micrurus ibiboboca (Merrem, 1820) (Figura 13-b) Habita uma variedade de ambientes de várzea úmida, matas da Caatinga e florestas de terra firme semidecídua; penetra apenas marginalmente em áreas de Cerrado (Roze, 1996). Informações disponíveis em Vitt e Vangilder (1983), Rocha (2007), Rodrigues e Prudente (2011) indicam que M. ibiboboca é um serpente que pode ser encontrada ativa tanto durante o dia quanto durante a noite, possuindo hábitos terrestres e fossoriais. Informações em Vitt e Vangilder (1983), Roze (1996) e Rodrigues (2007) mostram que M. ibiboboca alimenta-se de anfisbenas (Anphisbaena vermicularis) e serpentes (Liophis lineatus, L. poecilogyrus, L. viridis, Sibynomorphus mikanii). Não foram obtidas informações reprodutivas para M. ibiboboca além de sua ovíparidade (Marques et al., 2001). Não foram obtidas informações sobre comportamento defensivo para esta espécie. Ocorre na região Nordeste do Brasil nos estados do Pará, Maranhão, Piauí, Ceará para os estados de Goiás e Rio de Janeiro (Nascimento et al., 1991; Roze, 1996). Micrurus spixii Wagler, 1824 (Figura 13-c) Habita floresta primária, áreas alteradas como capoeiras antigas úmidas, áreas de transição babaçual-cerrado e também áreas de Cerrado típico (Cunha e Nascimento, 1993; Martins e Oliveira, 1999). Informações disponíveis em Cunha e Nascimento (1978, 1993), Martins e Oliveira (1999), Bernarde e Abe (2006, 2010) indicam que M. spixii é uma serpente diurna com hábitos fossorias, criptozóicos e terrestres. Informações disponíveis em Cunha e Nascimento (1993) e Bernarde e Abe (2010) indicam que M. spixii alimenta-se de serpentes (Apostolepis, Liophis reginae, Micrurus 130 spixii, Typhlops reticulatus), lagartos (Arthrosaura reticulata) anfisbenas (Aulura anomala). Neste estudo, não foram obtidas informações reprodutivas para esta espécie. Martins e Oliveira (1999) registraram acasalamento no mês de junho. Micrurus spixii possui um padrão de cor aposemática evidente. Quando perturbada comprime o corpo dorsoventralmente, debate-se sutilmente, realiza ataques falsos e verdadeiros e eleva a cauda enrolada (Martins e Oliveira, 1999). Se manipulada debate o corpo e raramente morde (Martins e Oliveira, 1999). Ocorre na região Amazônica da Colômbia, Venezuela, Equador, Peru, Brasil, Bolívia, e norte do Paraguai (Cunha e Nascimento, 1993; Roze, 1996). Micrurus surinamensis (Cuvier, 1817) (Figura 13-d) O espécime registrado neste estudo foi coletado em uma área de floresta. Micrurus surinamensis habita lugares alagados e igarapés (Cunha e Nascimento, 1993), ocorrendo tanto em florestas como áreas abertas e áreas perturbadas (Martins e Oliveira, 1999). Neste estudo, um espécime foi registrado no folhiço de um terreno bastante úmido durante a tarde. Registros da literatura (Cunha e Nascimento, 1978; Martins e Oliveira, 1999; Santos-Costa, 2003) e este estudo indicam que M. surinamensis possui hábitos diurnos e noturnos, sendo primariamente aquática, eventualmente encontrada no solo. Informações obtidas em Duellman (1978), Cunha e Nascimento (1978, 1993), Martins e Oliveira (1999), Santos-Costa (2003) e Maschio (2008) indicam que M. surinamensis alimenta-se primariamente de peixes (Gymnotus carapo, Callichthys callichthys, Synbranchus marmoratus) e ocasionalmente de lagartos. Maschio (2008) registrou folículos bem desenvolvidos no mês de março. Santos-Costa (2003) registrou 131 duas fêmeas com folículos vitelogênicos em março e um filhote em novembro. Martins e Oliveira (1999) registraram duas fêmeas com cinco e 12 ovos cada (sem data informada) e dois recém-eclodidos em abril. Quando perturbada, esta espécie executa ataques (falsos e verdadeiros), enrola o corpo e esconde a cabeça sob do corpo enrolado, pode ainda comprimir o corpo dorsoventralmente (Martins e Oliveira, 1999). Quando manipulada debate o corpo e raramente morde (Martins e Oliveira, 1999). Distribui-se ao longo da floresta equatorial da América do Sul na região das Guianas, Colômbia, leste do Equador, Peru, Bolívia e Brasil nos estados do Acre, Amazonas, Roraima, Rondônia, Pará, Maranhão, Tocantins e Mato Grosso (Roze, 1996; Passos e Fernandes, 2005). TYPHLOPIDAE Gray 1825 Esta família é composta por serpentes de tamanho pequeno (Chippaux, 1986). As espécies apresentam corpo cilíndrico com o pescoço indistinto da cabeça, simulando perfeitamente a cauda que é truncada (Chippaux, 1986). As escamas são relativamente pequenas e idênticas, com exceção, em alguns casos, das escamas cefálicas. Os olhos são atrofiados e poucos visíveis no centro de escamas não diferenciadas (Chippaux, 1986). Presente em todos os continentes (Chippaux, 1986), esta família contém aproximadamente 260 espécies (Vidal et al., 2010a), das quais seis ocorrem no Brasil (Bérnils e Costa, 2011). Para a Ilha de Marajó foi registrada apenas a espécie Typhlops reticulatus. 132 Typhlops reticulatus (Linnaeus, 1758) (Figura 13-e) Em Marajó, é registrada tanto em área de floresta como em área de campo. Habita floretas primárias e florestas secundárias, sendo registrada também em área de Savana (Martins e Oliveira, 1999; França et al., 2006). Neste estudo, um dos espécimes foi coletado no final da manhã no interior de um tronco podre (Astrocaryum sp.). Segundo Cunha e Nascimento (1978), esta espécie habita galerias, principalmente sauveiros, onde possui hábitos subterrâneos. Typhlops reticulatus provavelmente encontra-se ativa durante noite e início do dia (Starace, 1998), no entanto, o período de atividade desta espécie ainda está incerto. Nenhum item alimentar foi registrado neste estudo. Beebe (1946) registrou formigas (Atta sp.), cupins e besouros. Cunha e Nascimento (1978) registraram operárias e larvas de saúvas (Atta sexdens). Dixon e Soini (1986) registraram ovos de formigas. Estes registros indicam que T. reticulatus alimenta-se de artrópodes (insetos) e suas larvas. Martins e Oliveira (1999) mencionam que um espécime procedente do Rio Jamari, em Rondônia, ovopositou 10 ovos no início do mês de março, posteriormente eclodindo três juvenis 52 dias depois. Ao ser manipulada esta espécie agita o corpo, pressiona a ponta afiada da cauda contra a mão do coletor e expele descarga cloacal (Martins e Oliveira, 1999). Typhlops reticulatus ocorre na Venezuela oriental e meridional e toda zona setentrional da América do Sul e leste dos Andes com registros no Brasil na região Amazônica e no Estado do Mato Grosso (Cunha e Nascimento, 1993; Rodrigues e Juncá, 2002). 133 VIPERIDAE Boie, 1827 Os representantes desta família são distribuídos em duas subfamílias: Viperinae (sem fosseta loreal), que habitam quase toda a Europa, Ásia e África e Crotalinae (apresentam fosseta loreal localizada em ambos os lados da cabeça) que habitam os continentes asiático e americano (Boulenger, 1913). A fosseta loreal tem função sensorial equipada com receptores infravermelhos que permitem detectar o movimento da presa mesmo estando relativamente longe (Chippaux, 1986). No Brasil ocorrem 28 espécies distribuídas em sete gêneros (Bérnils e Costa, 2011), sendo a família que mais ocasiona acidentes ofídicos no país, principalmente na região amazônica (Campbell e Lamar (2004). Na Ilha de Marajó foram registradas quatro espécies e três gêneros. Bothrops atrox (Linnaeus, 1758) (Figura 13-f) Bothrops atrox ocorre habita tanto no lado oriental como o ocidental da Ilha de Marajó. No entanto, aparentemente ocorre com baixa frequência nos campos de Marajó. Bothrops atrox é uma das serpentes mais comuns na região amazônica, ocorrendo em alta densidade na maioria dos habitats (como florestas primárias, secundárias e roçados), ocorrendo principalmente em regiões florestadas, muita vezes encontrada próximas a habitações humanas, onde podem causar graves acidentes por envenenamento (Cunha e Nascimento, 1978; Duellman, 1978; Martins e Oliveira, 1999). Em Marajó, vários espécimes foram coletados durante o dia sobre folhiço, outro foi coletado pela manhã sobre arbustos a aproximadamente 40 cm do solo. Outro espécime foi coletado pela manhã, inativo a 13 cm acima do solo, enrodilhado sobre um tronco caído. Esta serpente é encontrada ativa principalmente durante a noite, mas pode ser encontrada ativa durante o dia, possuindo hábitos primariamente terrestres, porém 134 algumas vezes é observada sobre a vegetação ou em corpos d’água (Cunha e nascimento, 1978, 1993; Martins e Oliveira, 1999; Santos-Costa, 2003; Maschio, 2008). Neste estudo, foram registrados principalmente roedores e lagartos. Um dos espécimes apresentou três pequenos roedores no estômago. Os lagartos registrados foram Anolis fuscoauratus,Thecadactylus rapicauda, Tretioscincus agilis e outros não identificados. Foram registrados ainda um anuro e um espécime com outro exemplar de B. atrox no estômago, indicando canibalismo. Esta espécie forrageia principalmente através da estratégia “senta e espera”, porém pode forragear ativamente (Martins e Oliveira, 1999). Possui um dieta generalista, alimentando-se de animais de diversos grupos, desde centopeias, peixes (Symbrachus sp.), anuros (Adenomera, Eleutherodactylus, Osteocephalus, Leptodactylus, Phyllomedusa), lagartos (Anolis, Ameiva ameiva, Kentropyx, Leposoma, Thecadactylus), serpentes (Atractus torquatus, Bothrops atrox), aves e pequenos mamíferos (Marmosa sp.) (Cunha e Nascimento, 1978, 1993; Martins e Oliveira, 1999; Oliveira e Martins, 2003; Santos-Costa, 2003; Maschio, 2008, este estudo). Neste estudo, foram registrados embriões em janeiro; filhotes em fevereiro e outubro; jovens em fevereiro, março, novembro e dezembro. Maschio (2008) registrou folículos desenvolvidos nos meses de outubro e novembro. Santos-Costa (2003) registrou filhotes em praticamente todos os meses do ano. Martins e Oliveira (1999) citaram fêmeas parindo de 11 a 43 filhotes. Maschio (2008) cita fuga, bote e vibração da cauda. Martins e Oliveira (1999) relata um juvenil escondendo a cabeça sob do corpo enrolado ao ser insistentemente perturbado. Ocorre na Colômbia, leste e sul da Venezuela, Guiana, Suriname, Equador, norte da Bolívia, Peru a leste dos Andes e Brasil, ocorrendo Amazônia, Mato grosso, extremo 135 norte do Tocantins e oeste do Maranhão (Cunha e Nascimento, 1993; Oliveira, 2003; Wuster et al., 1996). Crotalus durissus (Linnaeus, 1758) (Figura 13-g) Crotalus durissus é registrada apenas na metade oriental de Marajó. É uma espécie que habita ambientes secos, rochosos, com vegetação baixa e raramente ambientes florestados (Silva, 2000), sendo encontrada, tanto em áreas florestadas como desmatadas (Strüssmann e Sazima, 1993). Em Marajó, foram coletados espécimes tanto durante o dia como durante a noite. Informações disponíveis em Strüssmann e Sazima (1993); Marques et al. (2005); Rocha (2007) demonstram que Crotalus durissus é uma serpente primariamente noturna, eventualmente diurna, encontrada exclusivamente no solo. Neste estudo um espécime apresentou pelos no intestino e presas de serpente. Alimenta-se primariamente de pequenos a médios mamíferos (Calomys, Bolomys, Oligoryzomys, Akodon, Holochilus, Pseudoryzomys), mas pode eventualmente predar aves e lagartos (Ameiva ameiva) (Strüssmann e Sazima, 1993; Rocha e Prudente, 2010; Sant’Anna e Abe, 2007). Neste estudo, foi registrada uma fêmea contendo 34 folículos com medidas entre 5-10 mm (maior com 9,34 mm); um filhote em fevereiro e outro em outubro (COTO aproximado: 302 mm) e uma fêmea com ovos em setembro (12 ovos, maior com 33,13 mm). Ao ser perturbada C. durissus mantêm a parte anterior do corpo em forma de “S”, vibra o guizo na ponta da cauda e pode dar botes. 136 Tem uma distribuição ampla e descontínua na América do Sul, desde a Colômbia até a Argentina em todos os países do continente, exceto no Equador e Chile (Campbell e Lamar, 2004). Lachesis muta (Linnaeus, 1766) (Figura 13-h) Apenas dois espécimes são registrados para Marajó, ambos em áreas de florestas. Lachesis muta habita principalmente florestas densas, não sendo registrada em floresta secundária, área de campo ou alterada (Cunha e Nascimento, 1978, 1993; Martins e Oliveira, 1999). È uma serpente estritamente noturna e terrestre, buscando esconder-se durante o dia em ocos de troncos apodrecidos e entre raízes de grandes árvores (Cunha e Nascimento, 1978; Martins e Oliveira, 1999; Murphy, 1997, Marque et al., 2001). Alimenta-se exclusivamente de mamíferos (como Monodelphis, Dasyprocta, Proechimys, Sciurus) (Cunha e nascimento, 1978; Martins e Oliveira, 1999; SantosCosta, 2003; Maschio, 2008; Bernarde e Abe, 2010). Registros de Beebe (1946) e Duellman (1978) indicam que a ninhada desta espécie pode conter de sete a 13 ovos. Souza (2007) registrou a postura dos ovos, 100 dias após o acasalamento de um casal desta espécie em cativeiro. Ao ser perturbada, esta serpente mantém a parte anterior do corpo em forma de “S” e pode dar botes. Lachesis muta ocorre na Ilha Trinidad, Colômbia, Venezuela, Guiana, Suriname, Guiana Francesa, Equador, Peru, Bolívia e Brasil na região amazônica até hiléia do Maranhão e mata Atlântica nos incluindo os estados do Ceará, Paraíba, Rio Grande do Norte, Pernambuco, Bahia, Minas Gerai e Rio de Janeiro (Cunha e Nascimento, 1993; Borges, 1999; Silva, 2001; Fernandes et al., 2004). 137 Figura 7. Espécies registradas na Ilha de Marajó. a) Boa constrictor, Juruti, PA (Foto: Alessandro Menks); b) Corallus hortulanus, Itaituba, PA (Foto: Ângelo Dourado); c) Epicrates cenchria, Juruti, PA (Foto: Alessandro Menks); d) Eunectes murinus, Município de Abaetetuba, PA (Foto: Augusto Jarthe); e) Chironius carinatus, Município de Igarapé Mirim, PA (Foto: Augusto Jarthe); f) Chironius exoletus, Imbassaí, Município de Mata de São João, BA (Foto: Ricardo Marques); g) Chironius flavolineatus, Região Metropolitana de Salvado, BA (Foto: Hugo Coelho); h) Chironius fuscus (juvenil), Rondônia (Foto: Fagner Delfim). 138 Figura 8. Espécies registradas na Ilha de Marajó. a) Chironius multiventris, Porto Velho, RO (Foto: Monteiro Leonel); b) Dendrophidion dendrophis, Rondônia (Foto: Fagner Delfim); c) Drymarchon corais, Rondônia (Foto: Fagner Delfim); d) Leptophis ahaetulla, Município de Santa Barbara, PA (Foto: Augusto Jarthe); e) Mastigodryas boddaerti, Rondônia (Foto: Fagner Delfim); f) Mastigodrias boddaerti (Juvenil), Juruti, PA (Foto: Alessandro Menks); g) Oxybelis aeneus, Porto Velho, RO (Foto: MonteiroLeonel); h) Oxybelis fulgidus, Porto Tronbetas, PA (Foto: Henrique Costa). 139 Figura 9. Espécies registradas na Ilha de Marajó. a) Spilotes pullatus, Parque Metropolitano de Pituaçu, BA (Foto: Ricardo Marques); b) Tantilla melanocephala, Caetité, BA (Foto: Magno Travassos); c) Atractus schach, Porto Velho, RO (Foto: Renato Gaiga); d) Clelia clelia, São Geraldo do Araguaia, PA (Foto: Monteiro-Leonel); e) Dipsas indica, Rondônia, (Foto: Fagner Delfim); f) Drepanoides anomalus, Rondônia (Foto: Fagner Delfim); g) Helicops angulatus, Aripuanã, MT, (Foto: Henrique Costa); h) Helicops angulatus (Juvenil), Município de Abaetetuba, PA (Foto: Augusto Jarthe). 140 Figura 10. Espécies registradas na Ilha de Marajó. a) Helicops hagmanni, Rondônia, (Foto: Fagner Delfim); b) Helicops leopardinus, Porto Velho, RO (Foto: Diego Meneghelli); c) Helicops polylepis, Rondônia, (Foto: Fagner Delfim); d) Hydrodynastes gigas (Cabeça em detalhe), Porto Velho, RO (Foto: Monteiro-Leonel); e) Hydrops martii, Município de Abaetetuba, PA, (Foto: Augusto Jarthe); f) Imantodes cenchoa, Porto Velho, RO (Foto: Renato Gaiga); g) Leptodeira annulata, Rondônia (Foto: Fagner Delfim); h) Liophis almadensis, Parque Metropolitano de Tupiaçu, BA, (Foto: Ricardo Marques). 141 Figura 11. Espécies registradas na Ilha de Marajó. a) Liophis lineatus, Cedro, CE (Foto: Fagner Delfim); b) Liophis meridionalis, Porto Velho, RO (Foto: Renato Gaiga); c) Liophis poecilogyrus, Santa Fé do Araguaia, TO, (Foto: Monteiro-Leonel); d) Liophis poecilogyrus (juvenil), Paraíba, (Foto: Fagner Delfim); e) Liophis reginae, Santa Fé do Araguaia, TO (Foto: Monteiro-Leonel); f) Liophis taeniogaster, Município de Abaetetuba, PA, (Foto: Augusto Jarthe); g) Liophis typhlus (padrão marrom), Rondônia, (Foto: Fagner Delfim); h) Liophis typhlus (padrão verde), Rondônia, (Foto: Fagner Delfim). 142 Figura 12. Espécies registradas na Ilha de Marajó. a) Oxyrhopus melanogenys, São Geraldo do Araguaia, PA (Foto: Monteiro-Leonel); b) Oxyrhopus melanogenys (Cabeça em detalhe), Porto Velho, RO (Foto: Renato Gaiga); c) Oxyrhopus trigeminus, Paraíba, (Foto: Fagner Delfim); d) Philodryas argentea, Aripuanã, MT (Foto: Henrique Costa); e) Psomophis joberti, Cedro, CE (Foto: Fagner Delfim); f) Siphlophis cervinus, Porto Velho, RO (Foto: Renato Gaiga); g) Siphlophis compressus, Porto Velho, RO (Foto: Renato Gaiga); h) Micrurus filiformis, FLONA de Caxiuanã, PA (Foto: Gleomar Maschio). 143 Figura 13. Espécies registradas na Ilha de Marajó. a) Micrurus hemprichii, Belém, PA (Foto: Ângelo Dourado); b) Micrurus ibiboboca, Parque Metropolitano de Pituaçú, BA (Foto: Ricardo Marques); c) Micrurus spixii, Rondônia (Foto: Fagner Delfim); d) Micrurus surinamensis (Juvenil), Porto Velho, RO (Foto: Diego Meneghelli); e) Typhlops reticulatus, Juruti, PA, (Foto: Alessandro Menks); f) Bothrops atrox, Porto Velho, RO (Foto: Renato Gaiga); g) Crotalus durissus, Porto-Velho, RO (Foto: Monteiro-Leonel); h) Lachesis muta, Porto Velho, RO (Foto: Renato Gaiga). 144 REFERÊNCIAS BIBLIOGRÁFICAS Albarelli, L. P. P. 2007. Biologia reprodutiva e alimentar de Liophis reginae semilineatus (Wagler, 1824) e Liophis taeniogaster Jan, 1863 (Serpentes, Colubridae, Xenodontinae) da Amazônia Oriental, Brasil. Ms. Dissertação. Museu Paraense Emílio Goeldi, Belém, 100 pp. Albarelli, L. P. P. e M. C. Santos-Costa. 2010. Feeding ecology of Liophis reginae semilineatus (Serpentes: Colubridae: Xenodontinae) in Eastern Amazon, Brazil. Zoologia, 27: 87-91. Albuquerque, N. R. 2009. New records of Leptophis ahaetulla ahaetulla (Serpentes, Colubridae) for Venezuela, Colombia and the placement of L. a. copei into the synonymy of L. a. ahaetulla. Biota Neotropical, 9: 293:297. Amaral, A. 1930. Notes on Spilotes pullatus. Bulletin of the Antivenin Institute of America, 3: 96-99. Arzabe, C., G. O. S. Skuk, G. G. Santana, F. R. Delfim, Y. C. C. Lima e S. H. F. Abrantes. 2005. Herpetofauna da área do Curimataú, Paraíba; pp. 261-276. Em: F. S. Araújo, M. J. N. Rodale M. R. V. Barbosa (Eds.), Análise das variações da biodiversidade do bioma Caatinga: suporte a estratégias regionais de conservação, Ministério do Meio Ambiente, Brasília. Austin, C. C. 2000. Molecular Phylogeny and Historical Biogeography of Pacific Island Boas (Candoia). Copeia, 2:341–352. Ávila, R. W., V. L. Ferreira e J. A. O. Arruda. 2006. Natural History of the South American Water Snake Helicops leopardinus. (Colubridae: Hydropsini) in the Pantanal, Central Brazil. Journal of Herpetology, 40: 274–279. Ávila-Pires, T. C. S. 2005. Reptiles; pp. 25-40. Em: Hollowell, T., e R. P. Reynolds (Eds.), Checklist of the Terrestrial Vertebrates of the Guiana Shield, Bulletin of the Biological Society of Washington, n.13, Washington. 145 Ávila-Pires, T. C. S., M. S. Hoogmoed e L. Vitt. 2007. Herpetofauna da Amazônia; pp. 13-43. Em: L. B. Nascimento e M. E. Oliveira (Eds.). Herpetologia no Brasil II. Sociedade Brasileira de Herpetologia, Belo Horizonte. Ávila-Pires, T. C. S., L. J. Vitt, S. S. Sartorius e P. A. Zani. 2009. Squamata (Reptilia) from four sites in southern Amazonia, with a biogeographic analysis of Amazonian lizards. Boletim do Museu Paraense Emílio Goeldi, 4: 99-118. Bailey, J. R., R. A. Thomas e N. J. Silva Jr. 2005. A revision of the South American snake genus Thamnodynastes Wagler, 1830 (Serpentes, Colubridae, Tachymenini). I. Two new species of Thamnodynastes from Central Brazil and adjacent areas, with a redefinition of and neotype designation for Thamnodynastespallidus (Linnaeus, 1758). Phyllomedusa, 4: 83-102 Bailey, J. R. e R. A. Thomas. 2007. A revision of the South American snake genus Thamnodynastes Wagler, 1830 (Serpentes: Colubridae, Tachymenini). II. Three new species from northern South America, with further descriptions of Thamnodynastes gambotensis Pérez-Santos and Moreno and Thamnodynastes ramonriveroi Manzanilla and Sánchez. Memoria de la Fundación La Salle de Ciencias Naturales, 166: 7-27. Bartlett, R. D. e P. Bartlett. 2003. Reptiles and amphibians of the Amazon: an ecotourist’s guide. University Press of Florida, Florida, 291 pp. Beebe, W. 1946. Field notes on the snakes of Kartabo, British Guiana, and Caripito, Venezuela. Zoologica, 31: 11-52. Bernarde, P. S. 2004. Composição faunística, ecologia e história natural de serpentes em uma região no sudoeste da Amazônia, Rondônia, Brasil. Tese. Instituto de Biociências, Universidade Estadual Paulista “Júlio de Mesquita Filho”, Rio Claro. 139 pp. 146 Bernarde, P. S. e A. S. Abe. 2006. A snake community at Espigão do Oeste, Rondônia, southwestern Amazon, Brazil. South American Journal of Herpetology, 1: 102113. Bernarde, P. S. e A. S. Abe. 2010. Hábitos alimentares de serpentes em Espigão do Oeste, Rondônia, Brasil. Biota Neotropical, 10: 167-173. Bérnils, R. S. e H. C. Costa (Eds.). 2011. Brazilian reptiles. List of species. Disponível em http://www.sbherpetologia.org.br/. Sociedade Brasileira de Herpetologia. Acessado em Fevereiro de 2012. Bertoluci, J., M. A. S. Canelas, C. C. Eisemberg, C. F. S. Palmuti e G. G. Montingelli. 2009. Herpetofauna da Estação Ambiental de Peti, um fragmento de Mata Atlântica do estado de Minas Gerais, sudeste do Brasil. Biota Neotropical, 9: 147155. Borges, R.C. 1999. Serpentes peçonhentas brasileiras. Atheneu, São Paulo, 148 pp. Boulenger, G. A. 1893. Catalogue of the snakes in the British Museum (Natural History) I. London, 448 pp. Boulenger, G. A. 1913. The Snakes of Europe. Methuen and Co. Ltda, London, 269pp. Burnham, K. P. e W. S. Overton. 1979. Robust estimation of population size when capture probabilities vary among animals. Ecology, 60: 927-936. Cadle, J. E. e H. W. Greene. 1993. Phylogenetic patterns, biogeography, and ecological structure of neotropical snake assemblages; pp. 281-293. Em: R. E. Ricklefs e D. Schluter (Eds.), Species diversity in ecological communities. Historical and geographical perspectives. University of Chicago Press, Chicago. Campbell, J. A. e W. W. Lamar. 2004. The venomous reptilies of the western hemisphere. 2 Volumes. Cornell University Press, Ithaca, 898 pp. 147 Campos, V.A., F. H. Oda, A. F. Curcino e A. Curcino. 2010. An unusual prey item for the yellow tail cribo Drymarchon corais Boie 1827, in the Brazilian Savannah. Herpetology Notes, 3: 229-231. Carvalho, M. A. e F. Nogueira. 1998. Serpentes da área urbana de Cuiabá, Mato Grosso: aspectos ecológicos e acidentes ofídicos associados. Cadernos de Saúde Pública, 14: 753-763. Centeno, F. C., R. J. Sawaya e O. A. V. Marques. 2008. Snakes assemblage of Iha de São Sebastião, southeastern Brazil: comparasion to mainland. Biotaneotropica, 8: 63-68. Chippaux, J. P. 1986. Les serpents de la GuyaneFrançaise. ORSTOM, Paris. 165 pp. Cisneros-Heredia. 2006. Reptilia, Colubridae, Helicops angulatus and Helicops leopardinus: Distribution extension, new country record. Check List 2: 36-37. Colwell, R. K. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8.2. User's Guide and application published at: http://purl.oclc.org/estimates. Costa, H. C., A. B. Barros, L. R. Sueiro e R. N. Feio. 2010. The blunt-headed vine snake, Imantodes cenchoa (Linnaeus, 1758), in Minas Gerais, southeastern Brazil. Biotemas, 23: 173-176. Cunha, O. R. e F. P. Nascimento. 1978. Ofídios da Amazônia X - As cobras da região leste do Pará. Boletim do Museu Paraense Emílio Goeldi, 31: 1–218. Cunha, O. R. e F. P. Nascimento. 1980. Ofídios da Amazônia XI - Ofídios de Roraima e notas sobre Erythrolamprus bauperthuisii Duméril, Bibron & Duméril, 1954, sinônimo de Erythrolamprus aesculapii (Linnaeus, 1758). Boletim do Museu Paraense Emílio Goeldi, 102: 1-21. 148 Cunha, O. R. e F. P. Nascimento. 1981. Ofídios da Amazônia XII – Observações sobre a viviparidade em ofídios do Pará e Maranhão (Ophidia: Aniliidae, Boidae, Colubridae e Viperidae). Boletim do Museu Paraense Emílio Goeldi, 109:1–20. Cunha, O. R. e F. P. Nascimento. 1993. Ofídios da Amazônia. As cobras da região leste do Pará. Boletim do Museu Paraense Emílio Goeldi, 9: 1–191. Cunha, O. R. F. P. Nascimento, e T. C. Ávila-Pires. 1985. Os répteis da área de Carajás, Pará, Brasil (Testudines e Squamata). Publicações Avulsas. Museu Paraense Emílio Goeldi, 40: 9-85. Dirksen, L. 2002. Anakondas: Monographische Revision der Gattung Eunectes Wagler, 1830 (Serpentes, Boidae): Münster, Natur-und-Tier-Verl, Germany, 189 pp. Dixon, J. R. 1987. Taxonomy and geographic variation of Liophis typhlus and related “green” species of South America (Serpentes: Colubruidae). Annals of Carnegie Museum, 56: 173-191. Dixon, J. R. 1989. A key and checklist of the neotropical snake genus Liophis with country list and maps. Smithsonian Herpetological Information Service, 79: 1-28. Dixon, J. R. e A. L. Markezich. 1992. Taxonomy and geographic variation of Liophis poecilogyrus (Wied) from South America (Serpentes: Colubridae). The Texas Journal of Science, 44:131–166. Dixon, J. R., J. A. Wiest-Jr. e J. M. Cei. 1993. Revision of the Neotropical Snake Genus Chironius Fitzinger (Serpentes, Colubridae). Monografie XIII. Museo Regionale di Scienze Naturali, 279 pp. Dixon, J. R., e P. Soini. 1986. The reptiles of the upper Amazon Basin, Iquitos region, Peru. Milwaukee Public Museum, Milwaukee, 154 pp. 149 Di-Bernardo, M. 1998. História natural de uma comunidade de serpentes da borda oriental do Planalto das Araucárias, Rio Grande do Sul, Brasil. Tese, Universidade Estadual Paulista, Rio Claro, 123pp. Di-Bernardo, M., M. Borges-Martins e N. J. Silva. 2007. A new species of coralsnake (Micrurus: Elapidae) from Southern Brazil. Zootaxa 1447: 1-26. Dowling, H. G. e W. E. Duellman. 1978. Systematic Herpetology: a synopsis of families and higher categories. Herpetological Information Search Systems Publication. New York. 240pp. Duellman, W. E. 1978. The biology of an equatorial herpetofauna in Amazonian Ecuador. University of Kansas Museum Natural History, Miscellaneous Publication, 65: 1-352. Duellman, W. E. 1989. Tropical Herpetofaunal Communities: Patterns of Community Structure in Neotropical Rainforests. Herpetological Studies, 69:61-88. Duellman, W. E. 1990. Herpetofaunas in Neotropical rainforests: comparative composition, history, and resource use; pp. 455-505. Em: A. H. Gentry (ed.). Four Neotropical Rainforests. Yale University Press, New Haven. Feitosa, D. T., P. P. Passos e A. L. C. Prudente. 2007. Taxonomics status and geographic variation of the slender coral snake, Micrurus filiformis (Günther, 1859) (Serpentes, Elapidae). South American Journal of Herpetology, 2: 149-156. Fernandes, D. S., V. J. Germano, R. Fernandes e F. L. Franco. 2002. Taxonomic status of the lowland species of the Liophis cobella group with comments on the species of the Venenzuelan Tepuis (Serpentes, Colubridae). Boletim do Museu Nacional, Rio de Janeiro, 481: 1-14. Fernandes, D. S., F. L. Franco, e R. Fernandes. 2004. Systematic revision of the genus Lachesis Daudin, 1803 (Serpentes: Viperidae) Herpetologica, 60: 245-260. 150 França, F. G. R. e A. F. B. Araújo. 2007. Are there co-occurrence patterns that structure snake communities in Central Brazil? Brazilian Journal of Biology, 67: 33-40. França, F. G. R., D. O. Mesquita, C. C. Nogueira e A. F. B. Araújo. 2008. Phylogeny and Ecology Determine Morphological Structure in a Snake Assemblage in the Central Brazilian Cerrado. Copeia, 1: 23-38. França, F. G. R., D. O. Mesquita e R. Colli. 2006. A checklist of snakes from Amazonian savannas in Brazil, housed in the Coleção Herpetológica da Universidade de Brasília, with new distribution records. Occasional Papers, Oklahoma Museum of Natural History, University of Oklahoma, 1-13 pp. França, F. G. R. e E. S. Bezerra. 2010. Reptilia, Serpentes, Dipsadidae, Liophis taeniogaster Jan, 1863: Distribution extension, new state Record and geographic distribution map. Check List, 6: 614-615. Franco, F. L. e T. G. Ferreira. 2002. Descrição de uma nova espécie de Thamnodynastes Wagler, 1830 (Serpentes, Colubridae) do nordeste brasileiro, com comentários sobre o gênero. Phyllomedusa, 1: 57-74. Freire, E. M. X., U. Caramaschi e U. Gonçalves. 2010. A new species of Dendrophidion (Serpentes: Colubridae) from the Atlantic Rain Forest of Northeastern Brazil, Zootaxa 2719: 6268. Frota, J. G. 2005. Nova espécie de Helicops Wagler, 1830 (Serpentes, Colubridae) do rio Tapajós, Amazônia, Brasil. Phyllomedusa, 4: 61-68. Furtado, A. M. M., C. F. França e M. A. S. Pimentel. 2009. Relação Relevo-SoloVegetação da Ilha de Marajó. Em: XI Simpósio Nacional e Geografia Física Aplicada, Viçosa, Minas Gerais. Anais do XI Simpósio Nacional e Geografia Física Aplicada. Viçosa, Minas Gerais, Brasil. 151 Gibbons, J. W. e R. D. Semlitsch. 1987. Activity patterns; pp. 396-421. Em: R. A. Seigel, J. T. Collins e S. S. Novak (Eds.), Snakes. Ecology and Evolutionary Biology. McMillan, New York. Gotelli, N. J. e G. L. Entsminger. 2010. EcoSim: Null models software for ecology. Version 7. Acquired Intelligence Inc. e Kesey-Bear. Jericho, VT 05465. Disponível em: http://garyentsminger.com/ecosim.htm. Acessado em janeiro de 2011. Goulding, M., R. Barthem e E. Ferreira. 2003. The Smithsonian atlas of the Amazon. Smithsonian Institution. Washington, 253 pp. Griffin, L. E. 1916. A catalog of the ophidian from South America at present (June, 1916) contained in the Carnegie Museum, with descriptions of some new species. Memoirs of the Carnegie Museum Pittsburgh, 7: 163: 277. Guedes, T. B., G. S. S. Nunes, A. L. C. Prudente e O. A. V. Marques. 2011. New records and geographical distribution of the Tropical Banded Treesnake Siphlophis compressus (Dipsadidae) in Brazil. Herpetology Notes, 4: 341-346. Hammer, Ø. , D. A. T. Harper e P. D. Ryan. 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica 4: 9 pp. Hartmann, P. A., M. T. Hartmann e M. Martins. 2009. Ecology of a snake assemblage in the Atlantic Forest of southeastern Brazil. Papéis Avulsos de Zoologia, 49: 343360. Hedges, S. B., A. Couloux e N. Vidal. 2009. Molecular phylogeny, classification, and biogeography of West Indian racer snakes of the Tribe Alsophiini (Squamata, Dipsadidae, Xenodontinae). Zootaxa,2067: 1–28. 152 Henderson, R.W, T. W. P. Micucci, G. Puorto e R. W. Bourgeois. 1995. Ecological correlates and patterns in the distribution of Neotropical boines (Serpentes, Boidae): a preliminary assessment. Herpetological Natural History, 3:15-27. Henderson, R. W., P. Passos e D. Feitosa. 2009. Geographic Variation in the Emerald Treeboa, Corallus caninus. Copeia, 3: 572-582. Hoge, A. R. 1966. Preliminary account on Neotropical Crotalinae (Serpentes: Viperidae). Memórias do Instituto Butantan, 32: 109-184. Hoogmoed, M.S. 1980. Revision of the genus Atractus in Surinam, with the ressurection of two species (Colubridae, Reptilia). Notes on the herpetofauna of Surinam VII. Zoologische Verhandelingen, 175: 1-47. Hoogmoed, M. e A. L. C. Prudente. 2003. A new species of Atractus Reptilia, Ophidia, Colubridae) from the Amazon region in Brazil. Zoologische Verhandelingen, 77: 1-16. Hoogmoed, M. S. e T. C. S. Ávila-Pires. 2011. A case of voluntary tail autotomy in the snake Dendrophidion dendrophis (Schlegel, 1837) (Reptilia: Squamata: Colubridae). Boletim do Museu Paraense Emílio Goeldi. 6: 113-117. Keogh, J. S. 1999. Evolutionary implications of hemipenial morphology in the terrestrial Australian elapid snakes. Zoological Journal of the Linnean Society, 125: 239-278. Krebs, C. J. 1989. Ecological Methodology. Harper Collins Publishers, New York, 654 pp. Lambertz, M. 2010. Kommentierte Liste der squamaten Reptilien des Sanddünengebietes am mittleren Rio São Francisco (Bahia, Brasilien) unter besonderer Berücksichtigung endemischer Faunenelemente. Ophidia, 4: 2-17. 153 Leynaud, G. C. e E. H. Bucher. 1999. La fauna de serpientes del chaco sudamericano : diversidad, distribucion geografica y estado de conservacion. Academia Nacional de Ciencias, Córdoba, 46pp. Lema, T. 2002. Répteis recentes do Rio Grande do Sul. pp. 35-91. Em: T. Lema (Ed.). Os répteis do Rio Grande do Sul: atuais e fósseis - biogeografia - ofidismo. EDIPUCRS, Porto Alegre. Lillywhite, H. B. e R. W. Henderson. 1993. Behavioral and functional ecology of arboreal snakes; pp. 1-48. Em R. A. Seigel, e J. T. Collins (Eds.), Snakes: Ecology and Behavior, McGraw-Hill, Inc., New York. Lillywhite, H. B. e A. W. Smits. 1992. The cardiovascular adaptations of viperid snakes. pp. 143-153. Em: J. A. Campbell e E. D. Brodie. (Eds.). Biology of pitvipers. Tyler, Selva. López, M. S. e A. R. Giraldo. 2003. Diet of the large water snake Hydrodynastes gigas (Colubridae) from northeast Argentina. Amphibia-Reptilia, 25: 178-184. Lourdais, O., R. Shine, X. Bonnet e F. Brischoux. 2006. Sex differences in body composition, performance and behavior in the Colombian rainbow boa (Epicrates cenchria maurus, Boidae). Journal of Zoology, 175-182. MacArthur, R. H. e E. O. Wilson, 1967. The theory of island biogeography. Princeton University Press, Princeton. 203 pp. MacCulloch, R. D., A. Lathrop, P. J. R. Kok, R. Ernst e M. Kalamandeen. 2009. The genus Oxyrhopus (Serpentes: Dipsadidae: Xenodontinae) in Guyana: morphology, distributions and comments on taxonomy. Papéis Avulsos de Zoologia, 49: 487495. Maciel, A. P., M. Di-Bernardo, S. M. Hartz e R. B. Oliveira. 2003. Seasonal and daily activity patterns of Liophis poecilogyrus (Serpentes: Colubridae) on the North coast of Rio Grande do Sul, Brazil. Amphibia-Reptilia, 24: 189-200. 154 Manly, B. F. J. 1994. Multivariate Statistical Methods: a primer. Chapman and Hall. London, 215 pp. Marques, O. A. V. 1998. Composição Faunística, História Natural e Ecologia de Serpentes da Mata Atlântica, na Região da Estação Ecológica Juréia-Itatins. Tese, Universidade de São Paulo, São Paulo, 135 pp. Marques, O. A. V., A. Eterovic e I. Sazima. 2001. Serpentes da Mata Atlântica: Guia ilustrado para a Serra do Mar. Ribeirão Preto, Holos, 184 pp. Marques, O. A. V. e I. Sazima. 2004. História natural dos répteis da estação ecológica Juréia-Itatins. pp. 257-277. Em O. A. V. Marques e W. Duleba. Estação ecológica Juréia-Itatins: ambiente físico, flora e fauna . Holos, Ribeirão Preto. Marques, O. A. V., A. Eterovic, C. Strüssmann e I. Sazima. 2005. Serpentes do Pantanal: Guia ilustrado. Ribeirão Preto, Holos, 179 pp. Marques, O. A. V. e A. P. Muriel. 2007. Reproductive biology and food habits of the swamp racer Mastigodryas bifossatus from southeastern South America. Herpetological Journal, 17: 104-108. Marques, O. A. V. e G. Puorto. 1994. Dieta e comportamento alimentar de Erythrolamprus aesculapii, uma serpente ofiófaga. Revista Brasileira de Biologia, 54: 253-259. Martins, M. e M. E. Oliveira. 1999. Natural history of snakes in forests of the Manaus region, Central Amazonia, Brazil. Herpetological Natural History, 6: 78-150. Martins, M. S., Araujo. S. R. J. Sawaya e R. Nunes. 2001. Diversity and evolution of macrohabitat use, body size and morphology in a monophyletic group of neotropical pitvipers (Bothrops). Journal of Zoolgy, 254: 529-538. 155 Maschio, G. F. 2008. História natural e ecológica das serpentes da Floresta Nacional de Caxiuanã e áreas adjacentes, Pará, Brasil. Tese. Museu Paraense Emílio Goeldi, Belém, 214 pp. Maschio, G. F., A. L. C. Prudente, A. C. Lima e D. T. Feitosa. 2007. Reproductive biology of Anilius scytale (Linnaeu, 1758) (Serpentes, Aniliidae) from eastern Amazonia, Brazil. South American Journal of Herpetology, 2: 179-183. Maschio, G. F., A. L. C. Prudente e Mott, T. 2009. Water dispersal of Amphisbaena alba and Amphisbaena amazonica (Squamata: Amphisbaenia: Amphisbaenidae) in Brazilian Amazonia. Zoologia, 26: 567-570. Maschio, G. F., A. L. C. Prudente, F. S. Rodrigues e M. S. Hoogmoed. 2010. Food habits of Anilius scytale (Serpentes: Aniliidae) in the Brazilian Amazonia. Zoologia 27: 184-190. Maschio, G. F. , M. C. Santos-Costa e A. L. C. Prudente. 2009 . Comunidades de serpentes da Região de Caxiuanã com avaliação da Eficiência dos Métodos de Captura, 589–603 pp. En: P. L. B. Lisboa (Eds.). Caxiuanã: Desafios Pará a Conservação de Uma Floresta Nacional na Amazônia. Museu Paraense Emilio Goeldi, Belém. Melo, A. S., R. A. S. Pereira, A. J. Santos, G. J. Shepherd, G. Machado, H. F. Medeiros e R. J. Sawaya. 2003. Comparing species richness among assemblages using sample units: why not use extrapolation methods to standardize different sample sizes? Ikos, 101: 398-410. Mendonça, P. P., P. Cobra, L. R. Bernardo e T. Silva-Soares. 2011. Predation of the snake Spilotes pullatus (Squamata: Serpentes) upon the rodent Proechimys gardneri (Rodentia: Echimyidae) in the Amazonian basin, northwestern Brazil. Herpetology Notes, 4: 425-427. 156 Montingelli, G. G. e H. Zaher. 2011. New Species of Mastigodryas Amaral, 1934 from Brazilian Amazonia and Guyana (Serpentes: Colubridae). Journal of Herpetology, 45: 111-119. Moraes, R. A., R. J. Sawaya e W. Barrella. 2007. Composição e diversidade de anfíbios anuros em dois ambientes de Mata Atlântica no Parque Estadual Carlos Botelho, São Paulo, sudeste do Brasil. Biota Neotropical, 7: 27-36. Myers, C. W. 2011. A New Genus and New Tribe for Enicognathus melanauchen Jan, 1863, a Neglected South American Snake (Colubridae: Xenodontinae), with Taxonomic Notes on Some Dipsadinae. American Museum Novitates, 3715: 1-33 Myers, C. W. e J. E. Cadle. 1994. A new genus for South American snakes related to Rhadinaea obtusa Cope (Colubridae) and Resurrection of Taeniophallus Cope for the “Rhadinaea” brevirostris group. American Museum Novitates, 3484: 1-22. Murphy, J.C. 1997. Amphibians and Reptiles of Trinidad and Tobago. Krieger Publishing Company, Malabar, 245 pp. Nascimento, F.P., T. C. S. Ávila-Pires, e O. R. Cunha. 1987. Os répteis da área de Carajás, Pará, Brasil (Squamata) II. Boletim do Museu Paraense Emílio Goeldi, 3: 33–65. Nascimento, O. R., T. C. S. Ávila-Pires, I. N. F. Santos e A. C. M. Lima. 1991. Répteis de Marajó e Mexiana, Pará, Brasil. I. Revisão bibliográfica e novos registros. Boletim do Museu Paraense Emílio Goeldi, 7: 25-41. Oliveira, M. E. 2003. História natural de jararacas brasileiras do grupo Bothrops atrox (Serpentes: Viperidae). Tese. Universidade Estadual Paulista, Rio Claro. 123 pp. Oliveira, M. E. e M. Martins. 2003. Bothrops atrox (Common Lancehead). Prey. Herpetological Review, 34: 61-62. 157 Outeiral, A. R., A. N. Quiroz, V. L. F. Yuki e R. N. Yuki. 1995. Ocorrência de Liophis typhlus (Linnaeus, 1758) no nordeste do Brasil (Serpentes, Colubridae, Xenodontinae, Xenodontini). Biociências, 3: 223-229. Passos, P., e D. S. Fernandes. 2005. Variation and taxonomic status of the aquatic coral snake Micrurus surinamensis (Cuvier, 1817) (Serpentes: Elapidae). Zootaxa, 953: 1-14. Passos, P. e R. Fernandes. 2008. Revison of the Epicrates cenchria complex (Serpentes: Boidae). Herpetological Monographs. 22: 1-30. Pinto, C. C. e T. Lema. 2002. Comportamento alimentar e dieta de serpentes do gênero Boiruna e Clelia (Serpentes, Colubridae). Iheringia, Série Zoologia,92: 9-19. Pinto, G. S. e R. N. Yuki. 1999. Ocorrência de Liophis typhlus (Linnaeus, 1758) no Estado do Espírito Santo, Brasil (Serpentes: Colubridae: Xenodontinae). Boletim do Museu Paraense Emílio Goeldi, 15: 113-118. Pinto, R. R. e R. Fernandes. 2004. Reproductive biology and diet of Liophis poecilogyrus poecilogyrus (Serpentes, Colubridae) from southeastern Brazil. Phyllomedusa 3: 9-14. Pizzatto, L., M. Cantor, J. L. Oliveira, O. A. V. Marques, V. Capovilla e M. Martins. 2008. Reproductive ecology of dipsadine snakes, with emphasis on South American species. Herpetologica, 64:168–179. Pizzato, L. e O. A. V. MARQUES. 2007, Reproductive biology of boine snakes with emphasis on Brazilian species and a comparison to pythons. South American Journal of Herpetology, (2): 107–122. Pyron, R. A., F. T. Burbrink, G. R. Colli, A. N. M. Oca, L. J. Vitt, C. A. Kuczynski e J. J. Wiens. 2011. The phylogeny of advanced snakes (Colubroidea), with discovery of a new subfamily and comparison of support methods for likelihood trees. Molecular Phylogenetics and Evolution, 58: 329-342. 158 Projeto RADAM, Brasil. 1974. Folha SA.22. Levantamento de recursos naturais. geologia, geomorfologia, solos, vegetação e uso potencial da terra. Departamento Nacional de Produção Mineral, Rio de Janeiro, Volume 5. Prudente, A. L. C., J. C. Moura-Leite e S. A. A. Morato. 1998. Alimentação das espécies de Siphlophis Fitzinger (Serpentes, Colubridae, Xenodontinae, Pseudoboini). Revista Brasileira de Zoologia, 15: 375-383. Prudente, A. L. C., G. F. Maschio, C. E. Yamashina e M. C. Santos-Costa. 2007. Morphology, Reproductive Biology and diet of Dendrophidion dendrophis (Schlegel, 1837) (Serpentes, Colubridae) in Brazilian Amazon. South American Journal of Herpetology, 2: 53-58. Roberto, I. J., S. C. Ribeiro, M. M. S. Delfino e W. O. Almeida. 2009. Reptilia Colubridae, Helicops angulatus: distribution extension and rediscovery in the state of Ceará. Check List, 5: 118-121. Reed, R. N. e G. H. Rodda. 2009. Giant constrictors: Biological and management profiles and an establishment risk assessment for nine large species of Pythons, Anacondas, and the Boa Constrictor: U.S. Geological Survey Open-File Report 2009–1202. Virginia, 302 pp. Rocha, W. A. 2007. Taxocenose de serpentes em grupos fitofisionômicos de cerrado no Parque Nacional de Sete Cidades, Piracuruca, Piauí, Brasil. Ms. Dissertação. Museu Paraense Emílio Goeldi, Belém, 77pp. Rocha, W. A. e A. L. C. Prudente. 2010. The snake assemblage of Parque Nacional de Sete Cidades, State of Piauí, Brazil. South American Journal of Herpetology 5: 132-142. 159 Rodrigues, F. S. 2007. Taxocenose de serpentes (Squamata, Serpentes) em uma área de transição Cerrado-Caatinga no Município de Castelo do Piauí, Piauí, Brasil. Ms. Dissertação. Museu Paraense Emílio Goeldi, Belém, 103 pp. Rodrigues, F. S. e A. L. C. Prudente. 2011. The snake assemblage (Squamata: Serpentes) of a Cerrado-Caatinga trasition area in Castelo do Piauí, state of Piauí, Brazil. Zoologia, 28: 440-448. Rodrigues, M. T. 2003. Herpetofauna da Caatinga; pp. 181-236. Em: I. R. Leal, M. Tabarelli e J. M. C. Silva (Eds.), Ecologia e Conservação da Caatinga. Universidade Federal de Pernambuco, Recife. Rodrigues, M. T. e F. A. Juncá. 2002. Herpetofauna of the Quartenary sand dunes of the middle Rio São Francisco: Bahia: Brazil. VII. Typhlops amoipira sp nov. a possible relative of Typhlops yonenagae (Serpentes: Typhlopidae). Papéis Avulsos de Zoologia, 42: 325-333. Rossetti, D. F. e M. M. Valeriano. 2007. Evolution of the lowest amazon basin modeled from the integration of geologica and SRTM topographic data. Catena, 70: 253265. Rossetti, D. F. e Toledo, P. M. 2006. Biodiversity from a historical geology perspective: a case study from Marajó Island, lower Amazon. Geobiology, 4: 215-223. Rossman, D. A. 2010. Morphologica variation in the striped water snake Helicops trivittatus (Gray, 1849) (Reptilia: Serpentes: Xenodontidae) of eastern Amazonia. Boletim do Museu Paraense Emílio Goeldi, 5: 271-278. Roze, J. A. 1996. Coral snakes of the Americas: Biology, Identification, and Venoms. Krieger Publishing Company, Malabar, 328 pp. Sanders, H. L. 1968. Marine benthic diversity: a comparative study. The American Naturalist, 102: 243-282. 160 Sant’Anna, S. S. e A. S. Abe. 2007. Diet of the rattlesnake Crotalus durissus in southeastern Brazil (Serpentes, Viperidae), Studies on Neotropical Fauna and Environment, 42: 169-174. Santos-Costa, M. C. 2003. História natural das serpentes da Estação Científica Ferreira Penna, Floresta Nacional de Caxiuanã, Melgaço, Pará, Brasil. Tese. Pontifícia Universidade Católica do Rio Grande do Sul, Porto Alegre, 87 pp. Santos-Costa, M. C., A. L. C. Prudente, e M. Di-Bernardo. 2006. Reproductive Biology of Tantilla melanocephala (Linnaeus, 1758) (Serpentes, Colubridae) from Eastern Amazonia, Brazil. Journal of Herpetology, 40: 553-556. Santos-Jr, A. P. 2009. Revisão taxonômica do grupo Taeniophallus occipitalis e o relacionamento filogenético da tribo Echinantherini (Serpentes, Dipsadidae, Xenodontinae). Tese. Pontifíca Universidade Católica do Rio Grande do Sul. Porto Alegre, 247 pp. Santos-Jr, A. P., M. Di-Bernardo e L. Thales. 2008. New species of the Taeniophallus occipitalis group (Serpentes, Colubridae) from eastern Amazonia, Brazil. Journal of Herpetology, 42: 419–427. Savitzky, A. 1983. Coadapted character complexes among snakes; fossoriality, piscivory and durophagy. American Society Zoologist, 23: 397-409. Sawaya, R. J. 2003. História natural e ecologia das serpentes de cerrado da região de Itirapina, SP. Tese. Universidade Estadual de Campinas, Campinas, 145 pp. Sazima, I. 1989. Feeding Behavior of the Snail-eating Snake, Dipsas indica. Journal of Herpetology, 23: 464-468. Sazima, I. e M. Martins. 1990. Presas grandes e serpentes jovens: quando os olhos são maiores que a boca. Memórias do Instituto Butantan, 52:73-79. 161 Scartozzoni, R. R. 2005. Morfologia de serpentes aquáticas neotropicais: um estudo comparativo. Ms. Dissertação. Universidade de São Paulo, São Paulo, 102 pp. Scott-Jr, N. J., A. R. Giraudo, G. Scrocchi, A. L. Aquino, P. Cacciali e M. Motte. 2006. The genera Boiruna e Clelia (Serpentes: Pseudoboini) in Paraguay and Argentina. Papéis Avulsos de Zoologia, Museu de Zoologia da Universidade de São Paulo, 46: 77-105. Scrocchi, G. J., V. L. Ferreira, A. R. Giraudo, R. W. Ávila e M. Motte. 2005. A new species of Hydrops (Serpentes: Colubridae: Hydropsini) from Argentina, Brazil and Paraguay. Herpetologica, 61: 468-477. Shine, R. 1977a. Reproduction in Australian Elapid Snakes I. Testicular Cycles and Mating Season. Australian Journal of Zoology, 25: 647-653. Shine, R. 1977b. Reproduction in Australian Elapid Snakes II. Female Reproductive Cycles. Australian Journal of Zoology, 25: 655-666. Shine, R. 1979. Activity patterns in australian elapid snakes (Squamata: Serpentes: Elapidae). Herpetologica, 35:1-11. Silva, D. F. 2001. Revisão sistemática do gênero Lachesis Daudin, 1803 (Serpentes: Viperidae: Crotalinae). Tese de Pós Doutorado. Universidade Federal do Rio de Janeiro, 59 pp. Silva, R. J. 2000. As serpentes. FUNEP – Fundação de Estudos e Pesquisas em Agronomia, Medicina Veterinária e Zootecnia. Jaboticabal, 141 pp. Silva, F.M., A. C. Menks, A. L. C. Prudente, J. C. L. Costa, A. E. M. Travassos e U. Galatti. 2011. Squamate Reptiles from municipality of Barcarena and surroundings, state of Pará, north of Brazil. Checklist, 7:3. Sneath, P. H. A. e R. R. Sokal. 1973. Numerical Taxonomy: the principles and practice of numerical classification. Freeman. San Francisco, 573 pp. 162 Souza, R. C. G. 2007. Reproduction of the Atlantic Bushmaster (Lachesis muta rhombeata) for the First Time in Captivity Serra Grande Center for Lachesis muta Breeding Itacaré/Bahia, Brazil. Bulletim Chicago Herpetological Society, 42:4143. Sousa, B. M., C. A. G. Cruz, R. M. H. Carvalho e M. N. Silva. 2000. Descrição do processo de muda em Enyalius perditus Jackson (Reptilia, Sauria, Polychrotidae). Revista brasileira de Zoologia, 17: 225-228. Starace, F. 1998. Guide dês serpents et amphisbènes de Guyane. Ibis Rouge Editions, Paris, 449pp. Strimple, P. D., G. Puorto, W. E. Holmstrom, R. W. Henderson e R. Conant. 1997. On the status of the anaconda Eunectes barbouri Dunn & Conant. Journal of Herpetology 31: 607-608. Strüssmann, C. 2000. Herpetofauna; pp. 153-189. Em: Ministério do Meio Ambiente, Fauna Silvestre na região do Rio Manso – MT. IBAMA, Centrais Elétricas do Norte do Brasil, Brasília. Strüssmann, C. e I. Sazima. 1990. Esquadrinhar com a cauda: Uma tática de caça de serpente Hydrodynastes gigas no Pantanal, Mato Grosso. Memórias do Instituto Butantan, 52: 57-61. Strüssmann, C. e I. SAZIMA. 1993. The snake assemblage of the Pantanal at Poconé,western Brazil. Studies on Neotropical Fauna and Environment, 28: 157168. Uetz, P. 2010. The original description of reptiles. Zootaxa, 2334: 59-68. Vanzolini, P. E., A. M. M. Ramos-Costa e L. J. Vitt. 1980. Répteis das Caatingas. Academia Brasileira de Ciências, RJ. 163 Vaz-Silva, W., A. G. Guedes, P. L. Azevedo-Silva, F. F. Gontijo, R. S. Barbosa, G. R. Aloísio e F. C. G. Oliveira. 2007. Herpetofauna, Espora Hydroelectric Power Plant, state of Goiás, Brazil. Check List, 3: 338-345. Velloso, A. L., E. V. B. Sampaio e F. G. C. Pareyn. 2002. Ecorregiões propostas para o bioma Caatinga. Instituto de Conservação Ambiental The Nature Conservance do Brasil, Associação Plantas do Nordeste, Recife, 76 pp. Vidal, N. e S. B. Hedges. 2009. The molecular evolutionary tree of lizards, snakes, and amphisbaenians. Comptes Rendus Biologies, 332: 129–139. Vidal, N., A. S. Delmas, P. David, C. Cruaud, A. Couloux e B. S. Hedges. 2007. The phylogeny and classification of caenophidian snakes inferred from seven nuclear protein-coding genes. Comptes rendus-Biologies, 330, 182-187. Vidal, N., J. Marin, M. Morini, S. Donnellan, W. R. Branch, R. Thomas, M. Vences, A. Wynn, C. Cruaud e S. B. Hedges. 2010a. Blindsnake evolutionary tree reveals long history on Gondwana. Biology Letters, 6:558-561. Vidal, N., M. Dewynter e D. Gower. 2010b. Dissecting the major American snake radiation: A molecular phylogeny of the Dipsadidae Bonaparte (Serpentes, Caenophidia). Comptes Rendus Biologies, 333: 48–55. Vilela, B., M. G. Lima, U. Gonçalves e G. O. Skuk. 2011. Siphlophis compressus (Daudin, 1803) (Squamata: Dipsadidae): First Record for the Atlantic Forest North of the São Francisco river, northeastern Brazil. Cuadernos de Herpetologia 25: 23-24. Vitt, L.J. 1983. Ecology of an anuran-eating guild of terrestrial tropical snakes. Herpetologica 39: 52-56 Vitt, L. J. e L. D. Vangilder. 1983. Ecology of a snakes community in northeastern Brazil. Amphibia-Reptilia, 4:273-296. 164 Wilson, L. D. e C. E. Mena. 1980. Systematics of the melanocephala group of the colubrid snake genus Tantilla. San Diego Society of Natural History, Memoir, 11: p. 1-5. Wüster, W., J. A., Thorpe, G. Puorto, G. e BBBSP. 1996. Systematics of the Bothrops atrox complex (Reptilia: Serpentes: Viperidae) in Brazil: A multivariate analysis. Herpetologica, 52:263-271. Yuki, R. N. e A. A. M. Barros 1997. Contribuição ao conhecimento de Liophis meridionalis (Schenkel, 1901) (Serpentes: Colubridae: Xenodontinae). Boletim do Museu Paraense Emílio Goeldi, 13: 3-10. Yuki, R. N. e R. M. Santos. 1996. Snakes from Marajó and Mexiana islands, Pará state, Brazil. Boletim do Museu Paraense Emílio Goeldi, 12: 41-53. Zaher, H., F. G. Grazziotin, J. E. Cadle, R. W. Murphy, J. C. Moura-Leite e S. L. Bonatto. 2009. Molecular phylogeny of advanced snakes (Serpentes, Caenophidia) with an emphasis on South American Xenodontines: A revised classification and description of new taxa. Papéis Avulsos de Zoologia. Museu de Zoologia da Universidade de São Paulo, 49: 115-153. 165 ANEXO I Lista de espécimes com seus respectivos números de tombamento depositados nas coleções Herpetológicas do MPEG e MZUSP. Atractus natans: MPEG 18340, MPEG 18342, MPEG 18420, MPEG 18421; Atractus schach: MPEG 24960; Boa constrictor: MPEG 15187, MPEG 18018, MPEG 19634, MPEG 19635, MZUSP 3652, MZUSP 3653; Bothrops atrox: MPEG 17337, MPEG 17338, MPEG 17341, MPEG 17342, MPEG 17344, MPEG 17347, MPEG 17350, MPEG 17352, MPEG 17353, MPEG 17354, MPEG 17355, MPEG 17356, MPEG 17357, MPEG 17369, MPEG 18282, MPEG 18283, MPEG 18319, MPEG 18323, MPEG 18414, MPEG 18425, MPEG 18493, MPEG 18644, MPEG 18797, MPEG 18798, MPEG 18799, MPEG 19262, MPEG 19645, MPEG 20814, MPEG 20817, MPEG 21175, MPEG 21178, MPEG 23528, MPEG 24408, MPEG 24410, MPEG 24954, MAR* 1588; Chironius carinatus: MPEG 8666, MPEG 17716, MZUSP 3600, MZUSP 3601; Chironius exoletus: MPEG 16381, MPEG 18281; Chironius flavolineatus: MPEG 18341; Chironius fuscus: MPEG 319, MPEG 17349, MPEG 17363, MPEG 18280, MPEG 19327; Chironius multiventris: MPEG 18318; Clelia clelia: MPEG 18045; Corallus hortulanus: MPEG 18636; MPEG 18801, MPEG 19336**, MPEG 20812; Crotalus durissus: MPEG 17780, MPEG 18415, MPEG 18810, MPEG 20820, MPEG 24041; Dendrophidion dendrophis: MPEG 17364; Drepanoides anomalus: MPEG 18315; Drymarchon corais: MPEG 18185; Epicrates cenchria: MPEG 17345; Epicrates maurus: MPEG18043, MPEG 18044, MPEG 18130, MPEG 18131, MPEG 18164, MPEG 18175, MPEG 18192, MPEG 18193, MPEG 18194, MPEG 18254, MPEG 18255, MPEG 18256, MPEG 18261**, MPEG 18262, MPEG 18263, MPEG 18264, MPEG 18362, MPEG 18601, MPEG 19625, MPEG 19648, MZUSP 3599; Eunectes deschauenseei: MPEG 18019, MPEG 18029, MPEG 18068, MPEG 18126, MPEG 18127, MPEG 18128, MPEG 18129, MPEG 19632, MPEG 19633, MPEG 19638, MPEG 19639, MPEG 19640, MPEG 19641; Eunectes murinus: MPEG 19411**, MPEG 19412**, MPEG 19637, MZUSP 3654, MZUSP 3655, MZUSP 3656; Helicops angulatus: MPEG 18416, MPEG 18417, MPEG 18418, MPEG 18419, MPEG 18423, MPEG 18424, MPEG 19337 MPEG 19617, MPEG 21197, MPEG 21198, MPEG 21199, MPEG 21205; Helicops hagmanni: MAR*1492; Helicops leopardinus: MPEG 284, MPEG 285, MPEG 636, MPEG 637, MPEG 638, MPEG 639, MPEG 640, MPEG 641, MPEG 642, MPEG 17717, MPEG 17718, MPEG 17719, MPEG 17721, MPEG 18014, MPEG 18325, MPEG 18488, MPEG 18489, MPEG 18490, MPEG 18491, MPEG 18683, MPEG 19618, MPEG 19619, MPEG 19620, MPEG 19621, MZUSP 3605; Helicops polylepis: MPEG 321, MPEG 17720, MPEG 21177, MPEG 21179; Helicops trivittatus: MPEG 644**, MPEG 645, MPEG 8665, MPEG 18013, MPEG 19629, MPEG 19630, MPEG 19631, MPEG 20813; Hydrodynastes gigas: MPEG 18012, MPEG 18046, MPEG 18070, MPEG 18071, MPEG 18184, MPEG 19636, MPEG 21487; Hydrops martii: MAR* 1547; Imantodes cenchoa: MPEG 320, MPEG 16461, MPEG 18317, MPEG 20674**; Lachesis muta: MPEG 19335, MPEG 19338; Leptodeira annulata: MPEG 166 17724, MPEG 17785, MPEG 18338, MPEG 18339, MPEG 19263, MPEG 21181, MAR* 1503, MZUSP 3607; Leptophis ahaetulla: MPEG 17348, MPEG 17351, MPEG 17714**, MPEG 17722, MPEG 18016, MPEG 18326, MPEG 18637, MPEG 18638, MPEG 19330, MPEG 19332, MPEG 19333, MPEG 19334, MPEG 19626, MPEG 19627, MPEG 19628, MPEG 23529, MZUSP 3619; Liophis almadensis: MPEG 18054, MPEG 18057, MPEG 18059, MPEG 18060, MPEG 18061, MPEG 18065, MPEG 18066, MPEG 18078, MPEG 18080, MPEG 18081, MPEG 18082, MPEG 18083, MPEG 18084, MPEG 18085, MPEG 18086, MPEG 18089, MPEG 18096, MPEG 18108, MPEG 18109, MPEG 18124; Liophis lineatus: MPEG 286, MPEG 287, MPEG 288, MPEG 768, MPEG 3261**, MPEG 3262, MPEG 16935, MPEG 17723, MPEG 18058, MPEG 18072**, MPEG 18073, MPEG 18074, MPEG 18684, MPEG 19616, MPEG 21180, MPEG 24411; Liophis meridionalis: MPEG 20815, MPEG 20816; Liophis poecilogyrus: MPEG 643, MPEG 766, MPEG 767, MPEG 3266, MPEG 16534, MPEG 16535, MPEG 16536, MPEG 16825, MPEG 16826, MPEG 16934, MPEG 18010, MPEG 18030, MPEG 18031, MPEG 18032, MPEG 18033, MPEG 18034, MPEG 18035, MPEG 18036, MPEG 18037, MPEG 18038, MPEG 18039, MPEG 18040, MPEG 18041, MPEG 18042, MPEG 18047, MPEG 18048, MPEG 18049, MPEG 18050, MPEG 18051, MPEG 18052, MPEG 18053, MPEG 18055, MPEG 18056, MPEG 18062, MPEG 18063, MPEG 18064, MPEG 18067, MPEG 18069, MPEG 18075, MPEG 18076, MPEG 18079, MPEG 18087, MPEG 18088, MPEG 18090, MPEG 18091, MPEG 18092, MPEG 18093, MPEG 18094, MPEG 18095, MPEG 18097, MPEG 18098, MPEG 18099, MPEG 18101, MPEG 18102, MPEG 18106, MPEG 18110, MPEG 18111, MPEG 18112, MPEG 18113, MPEG 18114, MPEG 18116, MPEG 18117**, MPEG 18118, MPEG 18119, MPEG 18120, MPEG 18121, MPEG 18122, MPEG 18123, MPEG 18125, MPEG 18149, MPEG 18150, MPEG 18151, MPEG 18166, MPEG 18167, MPEG 18168, MPEG 18169, MPEG 18170, MPEG 18171, MPEG 18172, MPEG 18173, MPEG 18174, MPEG 18312, MPEG 18314, MPEG 18316, MPEG 18322, MPEG 18324, MPEG 18640, MPEG 18641, MPEG 18642, MPEG 18643, MPEG 19644, MPEG 21204, MPEG 24064, MZUSP 3617; Liophis reginae: MPEG 3263, MPEG 17366, MPEG 18165, MPEG 18321, MPEG 24959, MPEG 17365, MPEG 18287, MPEG 19331; Liophis taeniogaster: MPEG 322, MPEG 769, MPEG 3264, MPEG 17346, MPEG 18077, MPEG 18100, MPEG 18103, MPEG 18104, MPEG 18105, MPEG 18107, MPEG 18115, MPEG 18132, MPEG 18148, MPEG 18152, MPEG 18153, MPEG 18154, MPEG 18288, MPEG 18361, MPEG 19328, MPEG 19622, MPEG 19623, MPEG 19624, MPEG 19643, MPEG 21173, MPEG 21174, MPEG 21176, MPEG 21748, MPEG 21749, MPEG 21750, MPEG 21751, MPEG 24955, MPEG 24956, MZUSP 3603, MZUSP 3604; Liophis typhlus: MPEG 18422, MPEG 19329; Mastigodryas bifossatus: MPEG 770**, MPEG 16531**, MPEG 16936**; Mastigodryas boddaerti: MPEG 17367, MPEG 18343, MPEG 18345; Micrurus filiformis: MPEG 17340, MPEG 18136, MPEG 24958, MZUSP 5095; Micrurus hemprichii: MPEG 20042, MPEG 24957; Micrurus surinamensis: MPEG 17336; Oxybelis aeneus: MPEG 17335, MZUSP 3608; Oxybelis fulgidus: MPEG 17339, MPEG 17368, MPEG 18285, MPEG 18344, MPEG 21206, Oxyrhopus melanogenys: 167 MPEG 3265; Philodryas argentea: MPEG 17343, MPEG 17359, MPEG 17360, MPEG 17361; Philodryas viridissima: MPEG 17358**; Pseudoboa coronata: MPEG 18284**, MPEG 18313**, MPEG 24409, MPEG 24961; Psomophis joberti: MPEG 18320, MPEG 20795, MPEG 20796, MPEG 20818, MPEG 20819, MPEG 21203; Siphlophis cervinus: MPEG 19841; Siphlophis compressus: MPEG 18286; Taeniophallus quadriocellatus: MPEG 17362, MPEG 20487; Thamnodynastes lanei: MPEG 16532, MPEG 17715, MPEG 18311; Thamnodynastes sp: MPEG 16422**, MPEG 16533**, MPEG 18310**, MPEG 18327**, MPEG 18639**, MPEG 19615**, MPEG 20808, MPEG 20809, MPEG 20810, MPEG 20811, MPEG 21200, MPEG 21201, MPEG 21202; Typhlops reticulatus: MPEG 18011, MPEG 18015, MPEG 23581, MPEG 23582. * Espécime ainda não tombado na coleção Herpetológica do Museu Paraense Emílio Goeldi. ** Espécime não localizado na coleção Herpetológica do Museu Paraense Emílio Goeldi. 168 CAPÍTULO II COMPOSIÇÃO E DISTRIBUIÇÃO DE SERPENTES NA ILHA DE MARAJÓ: UMA QUESTÃO FITOECOLÓGICA? 169 DISTRIBUIÇÃO DE SERPENTES NA ILHA DE MARAJÓ: UMA QUESTÃO FITOECOLÓGICA? Gerson M. Rodrigues1 ¹ Programa de Pós-Graduação em Zoologia da Universidade Federal do Pará/Museu Paraense Emílio Goeldi. Avenida Perimetral, 1901. Caixa Postal 399, Terra Firme, Belém, Pará, CEP 66017-970, Brasil. E-mail: [email protected] Resumo: Para uma melhor avaliação dos fatores históricos e ecológicos envolvidos na biogeografia de serpentes na região amazônica é necessário um conhecimento mais detalhado sobre os padrões de distribuição das serpentes que ocorrem nessa região. Na Ilha de Marajó, a distribuição de algumas espécies parece estar associada a duas fitofisionimias principais: campos naturais (campos aluviais e Cerrado), na região oriental, abarcando um terço da área; e florestal, na região ocidental, distribuídos nos outros dois terços. Neste contexto, este estudo propõe testar se a distribuição de serpentes da Ilha está relacionada às duas principais fitofisionomias, avaliar a composição e a riqueza de serpentes entre as áreas florestadas e áreas de campo, bem como a avaliar a similaridade destas duas áreas da Ilha com outras taxocenoses de serpentes de áreas fisionomicamentes semelhantes no Brasil. A distribuição de serpentes na Ilha de Marajó foi analisada com base em 439 espécimes depositados nas coleções herpetológicas do Museu Paraense Emílio Goeldi e Museu de Zoologia da Universidade de São Paulo. Os pressupostos de normalidade e de homocedasticidade dos dados (teste de Levene) foram calculados e testados. O teste t de Student foi utilizado para verificar se existem diferenças na abundância entre as duas fitofisionomias da Ilha. A análise de similaridade (Anosim) foi utilizada para avaliar a variação da composição de espécies entre as fitofisionimias. A comparação da riqueza entre as áreas (florestada ou aberta) foi realizada usando a riqueza de espécies estimada pelo procedimento de rarefação. Para avaliar a composição de espécies de serpentes da Ilha com outras taxocenoses amazônicas e de áreas abertas foram realizadas Análises de Coordenadas Principais e Análises de Agrupamento. Apesar do maior número de espécies observado nas áreas abertas (36 espécies) em relação às áreas florestadas (30 espécies), as análises estatísticas indicaram uma maior riqueza nos ambientes florestados, o que talvez esteja relacionado com a maior heterogeneidade ambiental da floresta. Foi verificado que dezesseis espécies são exclusivas para as áreas florestadas, 22 para áreas abertas e 14 presentes tanto em florestas com em áreas abertas. A composição geral das espécies de serpentes de Marajó possui maior similaridade com outras taxocenoses Amazônicas, no entanto, a composição de serpentes da área aberta possui maior similaridade com a região do Pantanal do que as outras taxocenoses de áreas abertas analisadas. Palavras chaves: Ilha de Marajó; Serpentes; Amazônia; Composição. 170 Abstract: To better assess the factors involved in the historical and ecological biogeography of snakes in the Amazon region requires a more detailed knowledge about the distribution patterns of snakes that occur in this region. On the Marajó Island, the distribution of some species seems to be associated with two main ecosystems: natural grasslands (alluvial fields and Cerrado) in the eastern region, covering a third of the area, and forest in the western region, distributed in the other two thirds. In this context, this study proposes to test whether the distribution of snakes from the island is related to two main vegetation types, to analyze the composition and richness of snakes from forested areas and areas of the field, and to assess the similarity of these two areas of the island with other snake assemblages fisionomicamentes similar areas in Brazil. The snakes distribution of the Marajó Island were analyzed based on 439 specimens deposited in the herpetological collections of the Museu Paraense Emílio Goeldi (MPEG) and Museu de Zooologia da Universidade de São Paulo (MZUSP). The assumptions of normality and homoscedasticity (Levene test) were calculated and tested. The Student´s t-test was used to verify differences in abundance among the two forest types. The analysis of similarity (Anosim) were used to evaluate the variation of the species composition among the forest types. The comparison of the richness among the areas (forested or open) was performed using the species richness estimated by rarefaction procedure. To evaluate the snakes composition of the island with others amazon assemblages and with open areas, were performed the Principal Coordinate Analysis and Clustering. Despite to the great number of species observed in open areas (n = 36) over forested areas (30 species), statistical analysis indicated a greater richness for the forested areas, which may be related to the greater environment heterogeneity of the forest. Sixteen species were exclusive to forested areas, 22 were exclusive to open areas and 14 were recorded in both forests and open areas. The general composition of the snake species of Marajó has greater similarity with other Amazon assemblages, however, the snakes composition of the Marajó´s open areas has greater similarity with Pantanal region than the other assemblages of open areas analyzed. Keywords: Marajó Island; Snakes; Amazon; Composition. 171 INTRODUÇÃO O entendimento dos padrões de biodiversidade, abundância e distribuição das espécies amazônicas torna-se possível através da integração de várias disciplinas, combinando dados sobre eventos geológicos e biológicos (Rossetti e Toledo, 2006). Na ausência de observações diretas de eventos passados, uma compreensão ecológica e ambiental mais completa da atual Amazônia é necessária para avaliar os papéis relativos aos fatores históricos e ecológicos envolvidos na biogeografia e diversidade da Amazônia (Rossetti e Toledo, 2006). O padrão de distribuição observado para algumas espécies de serpentes Neotropicais parece restringir-se a determinadas fitofisionomias ou ambientes particulares. Por exemplo, Thamnodynastes lanei é restrita às matas ciliares de grandes sistemas fluviais (Bailey et al., 2005); Corallus caninus e C. batesii estão associadas a ambientes amazônicos que apresentam florestas com dossel alto, com copas atingindo até 30 metros de altura (Henderson et al., 2009); enquanto que, Psomophis joberti apresenta uma distribuição associada a vários tipos de habitat como Mata Atlântica, Cerrado e Caatinga, com uma distribuição no Brasil que parece excluir a floresta Amazônica densa (Myers e Cadle, 1994; França et al., 2006); e, finalmente, Siphlophis compressus parece restringir-se a ambientes mais úmidos como a Floresta Amazônica e Mata Atlântica (Guedes et al., 2011). Na Amazônia, dentre as 180 espécies de serpentes presente, 149 estão no território brasileiro (Ávila-Pires et al., 2007) e, segundo França et al. (2006), 48 espécies estariam relacionadas aos enclaves de Savanas dos estados do Amapá, Amazonas, Pará, Rondônia e Roraima. 172 Localizada na foz do Rio Amazonas, a Ilha de Marajó, com uma extensão aproximada de 49.000 Km2 (Goulding et al., 2003), apresenta características flúviomarinhas que a subdivide em dois ecossistemas principais: campos naturais, na metade oriental, abrangendo um terço da área; e florestal, ocupando dois terços da Ilha, na metade ocidental (Furtado et al., 2009; ver Introdução Geral). A fisionomia atual da Ilha de Marajó reflete mudanças ocorridas na geologia, onde a vegetação aberta está presente em áreas com sedimentação mais recente (Holoceno) e as florestas fechadas estão em áreas mais antigas (Quaternário e, provavelmente, Plioceno) (Rossetti e Toledo, 2006). Entre as 62 espécies de serpentes presentes na Ilha de Marajó (Ver Capítulo 1), algumas distribuem-se de forma irregular ao longo da Ilha, estando, algumas, limitadas à região oriental e outras à região ocidental. Aparentemente, a distribuição de serpentes na Ilha reflete os padrões fitoecológicos lá observados, como citado por Müller (1969) e Nascimento et al. (1991). Segundo esses autores, a composição de espécies na região florestada, provavelmente, seria mais semelhante a da região de Belém, enquanto que nos campos a composição seria mais próxima a de outras áreas de campo da América do Sul e Central (Müller, 1969; Nascimento et al., 1991). Neste contexto, este estudo propõe testar se a distribuição de serpentes da Ilha está relacionada às duas principais fitofisionomias, avaliar a composição e a riqueza de serpentes entre as áreas florestadas e áreas de campo, bem como avaliar a similaridade destas duas áreas da Ilha com outras taxocenoses de serpentes de áreas fisionomicamentes semelhantes no Brasil. 173 MATERIAL E MÉTODOS Coleta de dados O estudo foi realizado a partir da análise de 439 espécimes coletados entre os anos de 1958 e 2010, provenientes da Ilha de Marajó, Estado do Pará (ver Descrição da Área de Estudo) e depositados nas coleções herpetológicas do Museu Paraense Emílio Goeldi (MPEG), Estado do Pará e Museu de Zoologia da Universidade de São Paulo (MZUSP). As coordenadas geográficas das 82 localidades de coleta na Ilha de Marajó foram obtidas a partir da literatura, consulta a Unidade de Análises Espaciais do MPEG e consulta a mapas da região por meio do Software Google Earth. As áreas de floresta densa foram categorizadas como “área florestada” e os campos aluviais e áreas de Cerrado constituíram a categoria “área aberta”. Informações disponíveis na coleção herpetológica do MPEG, bem como mapas da área de estudo, foram utilizados para verificar a fitofisionomia dos pontos de coleta, sendo contabilizados 24 em área florestada, 46 em área aberta e 12 com fitofisionomias não constatadas devido à insuficiência de informações (Figura 1). 174 Figura 1. Mapa da Ilha de Marajó indicando as principais formações vegetais* e os pontos** onde os exemplares analisados neste estudo foram coletados. * Modificado de Projeto RADAM (1974), **Cada ponto pode representar mais de uma localidade. 175 Análise de dados Sobre o mapa das principais formações vegetais da Ilha de Marajó foram confeccionados quadrantes medindo 16,5 x 16,5 km utilizando o software ArcMap. Cada quadrante foi considerado uma unidade amostral e categorizado em área florestada ou área aberta. Espécimes não associados aos quadrantes, devido à insuficiência de informações, assim como aqueles que apresentavam procedência somente “Ilha de Marajó”, foram utilizados apenas na análise de comparação com outras taxocenoses. Os pressupostos de normalidade e de homocedasticidade (teste de Levene) foram calculados e testados. Para testar se houve diferença na abundância amostral entre área florestada e área aberta foi usado o teste t de Student. Para avaliar a variação da composição de espécie entre as fisionomias foi usada a análise de similaridade (Anosim). Considerando que a riqueza de espécies observada é frequentemente um estimador viciado para a riqueza de espécies real (Santos, 2003), a comparação da riqueza entre as áreas da Ilha de Marajó (florestada ou aberta) foi feita usando a riqueza estimada pelo procedimento de rarefação (Sanders, 1968). A comparação de riqueza de espécies entre áreas com tamanhos de amostras diferentes pode produzir conclusões equivocadas, devido à forte relação positiva entre a riqueza e o número de espécimes coletados (Melo et al., 2003). Uma das formas de lidar com a comparação de riqueza de espécies entre comunidades, utilizando tamanhos de amostras diferentes, é padronizar o tamanho da amostra para o tamanho da menor amostra em estudo (Melo et al., 2003). Assim, devido ao maior número de espécimes coletados em área aberta (304) em relação à área florestada (92), foi utilizado o método de rarefação (Sanders, 1968) para comparar a riqueza. A análise foi realizada com o 176 programa EcoSim 7.72 ( Gotelli e Entsminger, 2010) e cada espécime foi considerado uma amostra. A rarefação também foi padronizada por amostra utilizando-se cada quadrante como unidade amostral, pois conforme sugeriu Courtemanch (1996), não é aconselhável comparar amostras padronizadas por uma certa quantidade de indivíduos, visto que se perde muita informação quanto à abundância/densidade das espécies nas comunidades. A técnica de rarefação utilizada foi a “baseada em momentos” (Mao Tau) (Gotelli e Colwell, 2001), que elimina completamente a necessidade de réplica, permite a comparação direta de riqueza entre amostras e é menos computacionalmente intensiva do que o Jackknife (Colwell et al., 2004). A análise foi realizada no programa EstimateS 8.2. (Colwell, 2009). Para avaliar a composição de espécies de serpentes da Ilha de Marajó com outras formações vegetais abertas e formações florestadas no Brasil, foram utilizados dados da literatura sobre a composição de dez localidades, sendo quatro da região amazônica, uma de transição Amazônia-Cerrado, duas de Cerrado, uma de transição CerradoCaatinga, uma da Caatinga e uma do Pantanal Mato-grossense (Figura 2). Para essa análise, todas as espécies inicialmente registradas na Ilha de Marajó foram tratadas como um conjunto único de informações na forma de presença ou ausência. Nessa etapa, além dos espécimes depositados nas coleções do MPEG e MZUSP, foram incluídas informações da literatura. Posteriormente, a análise foi realizada separando as espécies coletadas em área florestada das espécies coletadas em área aberta. Assim, a matriz de dados de presença e ausência foi formada com duas colunas distintas para as serpentes da Ilha de Marajó. Espécimes que apresentaram dúvidas em relação a sua origem (área florestada ou área aberta) não foram incluídos nesta segunda etapa da análise. 177 Figura 2. Localização da área florestada (1) e área aberta (2) da Ilha de Marajó e outras taxocenoses de diferentes formações vegetais usadas para avaliar a similaridade na composição de serpentes da Ilha: (3) Amazônia Oriental (Floresta Nacional de Caxiuanã e áreas adjacentes, Estado do Pará - Maschio, 2008); (4) Norte da Amazônica (Guiana Francesa - Starace, 1998); (5) Amazônia Central (Manaus, Estado do Amazonas Martins e Oliveira, 1999); (6) Sudoeste da Amazônia (Espigão do Oeste, Estado de Rondônia - Bernarde e Abe, 2006); (7) Transição Amazônia-Cerrado (Querência, Estado do Mato Grosso - Abe, 2010); (8) Cerrado (Sete Cidades, Estado do Piauí – Rocha e Prudente, 2010); (9) Cerrado (Itirapina, Estado de São Paulo - Sawaya et al., 2008); (10) Transição Cerrado-Caatinga (Castelo do Piauí, Estado do Piauí - Rodrigues e Prudente, 2011); (11) Caatinga (Exu, PE; Vitt e Vangilder, 1983); (12) Pantanal (Paconé, MT; Strüssmann e Sazima, 1993). Foram listadas, no total, 177 espécies (Anexo I), com as quais foram feitas Análises de Coordenadas Principais (ACoP) e de Agrupamento (Manly, 1994), utilizando o coeficiente de similaridade de Jaccard’s. Para a análise de agrupamento, foi utilizado o método UPGMA (Unweighted Pair Group Method with Arithmatic Mean) 178 ou “média de grupo” (Sneath e Sokal, 1973). As análises foram realizadas utilizando-se do programa PAST 2.12 (Hammer et al., 2001). RESULTADOS E DISCUSSÃO Composição de serpentes nas áreas florestada e aberta da Ilha de Marajó Foram obtidas as coordenadas geográficas de 396 espécimes, sendo 92 referenciados em área florestada e 304 em área aberta. Quarenta e três espécimes não foram referenciados devido à insuficiênica nos dados de coleta. Entre o total de espécies, 52 foram referenciadas, constatando-se um menor número de espécies na área florestada (30 espécies) em relação à área aberta (36 espécies). Entre estas espécies, 42,3% (22 espécies) foram exclusivas para a área aberta, 30,8% (16 espécies) foram exclusivas para área florestada e apenas 26,9% (14 espécies) foram comuns para as duas fitofisionomias (Tabela 1). Tabela 1. Lista das espécies, abundância absoluta amostral (n) e porcentagem do total do número de espécimes (%) na área florestada e área aberta da Ilha de Marajó, Estado do Pará, Brasil, depositados nas coleções herpetológicas do MPEG e MZUSP, entre os anos de 1958 e 2009. Legenda: Traço (-)= sem registro. Área florestada n % Área aberta n % Não referenciados nas fitofisionomias Abundância amostral geral BOIDAE Boa constrictor Linnaeus, 1758 Corallus hortulanus (Linnaeus, 1758) Epicrates cenchria (Linnaeus, 1758) Epicrates maurus Gray, 1849 Eunectes deschauenseei Dunn e Conant, 1936 Eunectes murinus (Linnaeus, 1758) 1 2 1 - 1,1 2,2 1,1 - 5 21 13 4 1,6 6,9 4,3 1,3 2 2 (51) 6 4 1 21 13 6 COLUBRIDAE Chironius carinatus (Linnaeus, 1758) Chironius exoletus (Linnaeus, 1758) Chironius flavolineatus (Boettger, 1885) Chironius fuscus| (Linnaeus, 1758) Chironius multiventris Schmidt e Walker, 1943 Dendrophidion dendrophis (Schlegel, 1837) Drymarchon corais (Boie, 1827) Leptophis ahaetulla (Linnaeus, 1758) Mastigodryas bifossatus (Raddi, 1820) 1 5 1 6 - 1,1 5,4 1,1 6,5 - 4 1 1 1 8 3 1,3 0,3 0,3 0,3 2,6 1,0 1 3 - (45) 4 2 1 5 1 1 1 17 3 179 Mastigodryas boddaerti (Sentzen, 1796) Oxybelis aeneus (Wagler, 1824) Oxybelis fulgidus (Daudin, 1803) 1 1 3 1,1 1,1 3,2 1 1 0,3 0,3 2 1 3 2 5 1 7 1 1 - 1,1 7,5 1,1 1,1 - 1 1 5 24 1 8 7 0,3 0,3 1,6 7,9 0,3 2,6 2,3 4 1 2 - (289) 4 1 1 1 12 1 25 4 8 7 1 2 2 5 6 4 1 3 1 2 1,1 2,2 2,2 5,4 6,5 4,3 1,1 3,2 1,1 2,2 2 4 20 15 2 90 3 27 1 1 1 2 - 0,7 1,3 6,6 4,9 0,7 30,0 1,0 8,9 0,3 0,3 0,3 0,7 - 2 1 4 1 1 4 1 - 1 4 8 20 16 2 94 8 34 2 1 4 1 4 6 1 1 2 - - 3 1,0 - 3 - - 11 3,9 2 13 ELAPIDAE Micrurus filiformis (Günther, 1859) Micrurus hemprichii (Jan, 1858) Micrurus surinamensis (Cuvier, 1817) 4 2 1 4,3 2,2 1,1 - - - (7) 4 2 1 TYPHLOPIDAE Typhlops reticulatus (Linnaeus, 1758) 2 2,2 2 0,7 - (4) 4 VIPERIDAE Bothrops atrox (Linnaeus, 1758) Crotalus durissus (Linnaeus, 1758) Lachesis muta (Linnaeus, 1766) Total de espécies Total de espécimes 23 1 30 92 25 2,2 7 3 36 304 2,3 1,0 - 6 2 1 DIPSADIDAE Atractus natans Hoogmoed e Prudente, 2003 Atractus schach (Boie, 1827) Clelia clelia (Daudin, 1803) Drepanoides anomalus (Jan, 1863) Helicops angulatus (Linnaeus, 1758) Helicops hagmanni Roux, 1910 Helicops leopardinus (Schlegel, 1837) Helicops polylepis Günther, 1861 Helicops trivittatus (Gray, 1849) Hydrodynastes gigas (Duméril, Bibron e Duméril, 1854) Hydrops martii (Wagler, 1824) Imantodes cenchoa (Linnaeus, 1758) Leptodeira annulata (Linnaeus, 1758) Liophis almadensis (Wagler, 1824) Liophis lineatus (Linnaeus, 1758) Liophis meridionalis (Schenkel, 1901) Liophis poecilogyrus (Wied, 1825) Liophis reginae (Linnaeus, 1758) Liophis taeniogaster Jan, 1863 Liophis typhlus (Linnaeus, 1758) Oxyrhopus melanogenys (Tschudi, 1845) Philodryas argentea (Daudin, 1803) Philodryas viridissima (Linnaeus, 1758) Pseudoboa coronata Schneider, 1801 Psomophis joberti (Sauvage, 1884) Siphlophis cervinus (Laurenti, 1768) Siphlophis compressus (Daudin, 1803) Taeniophallus quadriocellatus Santos-Jr, DiBernardo e Lema, 2008 Thamnodynastes lanei Bailey, Thomas e Silva-Jr, 2005 Thamnodynastes sp. 43 (43) 36 5 2 55 439 Os registros das localidades dos espécimes indicaram que, de um modo geral, a área aberta possui um maior número de pontos de coleta que a área florestada, concentrando-se, principalmente, ao longo dos cursos dos rios (Figura 1). O maior número de espécies e espécimes registrado em área aberta em relação à área florestada 180 pode ser reflexo de um maior número de pontos/localidades amostrados nessas áreas (Tabela 1). Não diferente de outras regiões amazônicas, o principal meio de deslocamento na Ilha de Marajó é o transporte fluvial, o que explicaria a maior concentração do pontos de coleta ao longo dos cursos dos rios e a concentração destes, principalmente na região oriental (região mais inundada durante o período chuvoso). A dificuldade de acesso a muitas de suas regiões, especialmente ao interior de floretas, pode ter ocasionado de certa forma, uma menor amostragem e, consequentemente, um menor número de espécies registrado em relação a área aberta, relativamente mais fácil de acessar. Outro fator que deve ser considerado, também, é que as serpentes em área aberta teoricamente podem ser relativamente mais fáceis de serem visualizadas em relação às que se encontram em ambientes florestados. A distribuição de algumas espécies registradas tanto em florestas como em área aberta, como de espécies exclusivas de floresta e exclusivas de área aberta podem ser observada na Figura 3. Boa constrictor, Bothrops atrox, Chironius exoletus, Helicops angulatus, H. polylepis, Imantodes cenchoa, Leptodeira annulata, Leptophis ahaetulla, Liophis reginae, L. taeniogaster, Oxybelis aeneus, O. fulgidus, Pseudoboa coronata e Typhlops reticulatus foram registradas em ambas as áreas (floresta e aberta) na Ilha de Marajó. Bothrops atrox foi a que apresentou o maior número de pontos/localidades registrados (24 localidades), abrangendo praticamente toda a Ilha de Marajó, sendo coletada em Chaves, Anajás, em vários pontos nas proximidades de Breves e ao longo da costa leste da Ilha. A presença de B. atrox ao longo da Ilha pode estar relacionada ao seu sucesso ecológico e grande amplitude no uso do habitat (Martins et al., 2001). No entanto, há apenas um registro desta espécie nas áreas dos campos aluviais (Figura 3A) 181 (veja Projeto RADAM, 1974 para detalhes da área). No total, foram coletados 23 espécimes em floresta densa, sete em área aberta e seis não foram possíveis constatar a fitofisionomia dos locais de coleta, devido à insuficiência de informações. Desta forma, é provável que Bothrops atrox ocorra com pouca frequência nas áreas abertas de Marajó. Leptodeira annulata é encontrada em diversos ambientes como florestas primárias, áreas abertas e áreas alteradas (Cunha e Nascimento, 1993), sendo encontrada com certa frequência nos campos rupestres da Serra Norte em Carajás (Cunha et al., 1985) e nos campos e savanas em Roraima (Cunha e Nascimento, 1980). A presença da espécie tanto em áreas de floresta quanto em áreas abertas na Ilha ocorreu apenas ao longo da costa norte (Figura 3B). Liophis taeniogaster tem ampla distribuição na Ilha (Figura 3B), porém parece ser mais frequente nas áreas abertas. Cunha e Nascimento (1993) fizeram o registro de 12 espécimes provenientes de Marajó, sendo a maioria (n= 7) de área aberta e o restante de área florestada. Neste estudo foram registrados 34 espécimes, sendo 27 em área aberta, seis em área de floresta e um não foi possível constatar a fitofisionomia devido à insuficiência de informações. Dezesseis espécies (Atractus schach, Chironius fuscus, Corallus hortulanus, Dendrophidion dendrophis, Epicrates cenchria, Helicops hagmanni, Hydrops martii, Lachesis muta, Mastigodryas boddaerti, Micrurus filiformis, M. hemprichii, M. surinamensis, Philodryas argentea, P. viridissima, Siphlophis compressus e Taeniophallus quadriocellatus) foram registradas exclusivamente em área florestada de Marajó. 182 Os registros de Atractus schach, Chironius fuscus, Helicops hagmanni, Hydrops martii, Lachesis muta, Micrurus hemprichii, M. filiformis e Siphlophis compressus são mostrados na Figura 3B e 3C. Vinte e uma espécies (Chironius carinatus, C. multiventris, Clelia clelia, Crotalus durissus, Drepanoides anomalus, Drymarchon corais, Epicrates maurus, Eunectes deschauenseei, E. murinus, Helicops leopardinus, H. trivittatus, Hydrodynastes gigas, Liophis almadensis, L. lineatus, L. meridionalis, L. poecilogyrus, Liophis typhlus, Mastigodryas bifossatus, Oxyrhopus melanogenys, Psomophis joberti e Thamnodynastes lanei) foram registradas exclusivamente em área aberta de Marajó. Mesmo não tendo a fitofisionomia do local de coleta constatada para dois espécimes de Crotalus durissus, foi possível perceber que todos os cinco exemplares desta espécie foram coletados na metade oriental da Ilha de Marajó (Figura 3E). A possibilidade de que estes dois exemplares tenham sido coletados, da mesma forma, em áreas abertas deve ser considerada, pois sabe-se que Crotalus durissus é comumente encontrada em ambientes secos e rochosos com vegetação baixa, sendo rara em ambientes florestados (Silva, 2000). Segundo Passos e Fernandes (2008), Epicrates maurus é encontrada em florestas áridas e formações vegetais abertas, habitando enclaves de Savanas Neotropicais (Passos e Fernandes, 2008). Neste estudo E. maurus foi registrada apenas em área aberta, enquanto E. cenchria foi registrada na área florestal (Figura 3E) corroborando os resultados de Nascimento et al. (1991) e Cunha e Nascimento (1993). Exceto por um espécime, cuja procedência estava referida ao Município de Chaves, todos os outros espécimes de Liophis lineatus registrados também foram coletados no lado oriental da Ilha. Levando-se em consideração a distribuição dos espécimes apresentado neste estudo, e que a extensão territorial do referido Município 183 estende-se até a região oriental da Ilha, a procedência do espécime referenciado em Chaves (Figura 3G) deve ser visto com cautela, pois os dados deste exemplar informam que ele foi coletado por “morador local” na “área urbana de Chaves”, o que levantam dúvidas quanto à precisão do local de coleta, considerando que algumas vezes moradores locais podem ser imprecisos ao referenciar um exemplar coletado. As informações disponíveis neste estudo, agregadas às de Cunha e Nascimento (1993), Yuki e Barros (1997) e França et al. (2006) indicam que Liophis meridionalis habita apenas formações vegetais abertas na região Amazônica. Segundo Dixon e Markezich (1992) e Strussmann e Sazima (1993), Liophis poecilogyrus habita áreas sazonalmente inundadas, podendo estar associada a riachos, lagos e outros corpos d’água. França et al. (2006) relatam esta espécie em áreas de Savanas dos estados do Amapá e Roraima. Todos os espécimes registrados de L. poecilogyrus foram coletados na metade oriental da Ilha, concentrando-se principalmente no centro-leste, em regiões que estão sujeitas a inundações sazonais (Figura 3F). Segundo Myers e Cadle (1994), Psomophis joberti distribui-se na porção da Floresta Atlântica, florestas de enclave, Caatinga e Cerrado e uma população disjunta amazônica, na Ilha de Marajó. Embora não tenha sido possível associar a fitofisionia do local de coleta a quatro espécimes analisados, foi possível verificar que eles foram coletados em Salvaterra, ou seja, lado oriental da Ilha. Desta forma, a possibilidade de que estes exemplares tenham sido coletados em área aberta deve ser considerada (Figura 3G). Embora Eunectes deschauenseei seja considerada rara na Guiana Francesa (Chippaux, 1986; Starace, 1998), o número de espécimes registrado na Ilha de Marajó é 184 relativamente alto, todos na metade oriental da Ilha (Figura 3H). Esta espécie foi registrada para áreas abertas dos estados do Amapá e Pará por França et al. (2006). O número de espécimes de Helicops leopardinus coletado na Ilha de Marajó é relativamente alto e, exceto por um exemplar que não foi possível constatar a fitofisionomia do local de coleta, todos os demais foram coletados em área aberta. Na Guiana Francesa, H. leopardinus parece limitar-se à faixa costeira (Starace, 1998), no entanto, na Ilha de Marajó, habita, além da faixa costeira, regiões mais ao centro, porém apenas no lado oriental (Figura 3H), região mais baixa da Ilha onde a topografia não ultrapassa os 4 m (Lima et al., 2005). Atractus natans (n= 4), Chironius flavolineatus (n= 1) e Siphlophis cervinus (n= 1) são espécies cujos espécimes não puderam ser referenciados por insuficiência de dados. Desta forma, a fitofisionomia de ocorrência destas espécies na Ilha de Marajó não foi definida. No entanto, foi possível verificar que A. natans foi coletada apenas na metade oriental da Ilha, pois foram coletadas no Município de Salvaterra, sendo dois na localidade Caldeirão e dois em Taperiaçu. Embora não tenha sido possível constatar a fitofisionomia (floresta ou área aberta), sabe-se que são áreas altas que não sofrem grandes inundações periódicas que normalmente ocorrem na Ilha (R. Rocha, com. pess.). A ilustração apresentada por Dixon et al. (1993), referente à distribuição de Chironius flavolineatus, mostra dois pontos na Ilha de Marajó, um no lado oriental e outro no lado ocidental. No texto, os referidos autores mencionaram que C. flavolineatus ocorre na metade oriental da Ilha, sendo encontrada nos estepes e gramíneas. Estes autores não associaram os espécimes por eles analisados (n= 3) às fitofisionomias pela imprecisão das informações referentes à localidade de coleta (localidade Caldeirão- situada no extremo leste da Ilha - ZIMH 674; “Marajó Island” - 185 BNMH 1923.11.9.113, 1923.11.9.114). Embora não tenha sido determinada a fitofisionomia do local de coleta do espécime registrado neste estudo (MPEG 18341), foi possível verificar que o mesmo foi coletado na localidade Caldeirão, Município de Salvaterra, região definida como de área aberta. Com relação à abundância dos espécimes coletados em Marajó, os pressupostos de normalidade e homocedasticidade para os espécimes referenciados foram atendidos e não houve diferença na abundância de serpentes entre áreas florestada e aberta, uma vez que a variação observada pode ser explicada pelo acaso (t= 0,648; p= 0,521). Considerando a distribuição dos exemplares referenciados nas fitofisionomias e o resultado da análise de similaridade, pode se verificar que em Marajó, mesmo se tratando de uma ilha, a composição de serpentes da área florestada é significativamente diferente da composição da área aberta (Anosim R= 0,145; p= 0,011). A composição entre as áreas de floresta e aberta da Ilha de Marajó parece ser diferente não só com o grupo das serpentes, mas também com outros grupos animais (e.g. Henrique e Orean,1997; Silva-Junior et al., 2005). 186 Figura 3. (A e B) Distribuição de espécies registradas, tanto em área florestada como em área aberta, na Ilha de Marajó, Pará: A) Bothrops atrox; B) Liophis taeniogaster (círculos) e Leptodeira annulata (quadrados). (C e D) Distribuição de espécies registradas apenas em áreas de floresta na Ilha de Marajó, Pará: C) Helicops hagmanni (quadrado), Chironius fuscus (triângulos), Lachesis muta (losangos), Atractus schach (círculo); D) Hydrops martii (círculo negro), Micrurus hemprichii (círculos preto/branco), Micrurus filiformis (triângulos), Siphlophis compressus (quadrado); (H, F, G e H) Distribuição de espécies registradas na metade oriental da Ilha de Marajó, Pará: E) Epicrates maurus (círculos), Crotalus durissus (triângulos); F) Liophis poecilogyrus; G) Psomophis joberti (círculos preto/branco), Liophis lineatus (quadrados claros), Chironius carinatus (quadrados negros); H) Eunectes deschauenseei (círculos), Helicops leopardinus (triângulos). 187 Possivelmente, características particulares de cada um destes ambientes (florestas e áreas abertas) determinam e limitam a distribuição das espécies de serpentes em Marajó. A região oriental da Ilha, onde se concentra a maior parte da área aberta, apresenta os menores índices pluviométricos, as maiores temperaturas e os menores índices de umidade relativa do ar (ver descrição da área de estudo), todos fatores influenciados, segundo Lima et al. (2005), pela cobertura vegetal. Além disso, a maior parte da área aberta permanece alagada durante os meses de maior intensidade de chuvas (Nascimento et al., 1991). Espécies que habitam, principalmente, áreas de Savanas, como Crotalus durissus, Liophis meridionalis e Psomophis joberti, foram coletadas apenas na região oriental da Ilha, assim como algumas espécies associadas à áreas inundadas, como Helicops leopardinus, Liophis lineatus, Liophis poecilogyrus e Thamnodynastes lanei. Da mesma forma, espécies primariamente florestais, como Philodryas argentea, P. viridissima e Siphlophis compressus, foram coletadas apenas na região ocidental. Comparação da riqueza entre a área florestada e a área aberta da Ilha de Marajó A riqueza observada para a área aberta foi maior (36 espécies) em relação à florestada (30 espécies) na Ilha de Marajó. O método de rarefação indicou valores maiores para a área aberta (entre 28 e 44 espécies) em relação à florestada (entre 24 e 36 espécies) (Tabela 2). Considerando o mesmo número de espécimes nas duas áreas (n= 92), o método de rarefação estimou para a área aberta entre 19 e 27 espécies. 188 Tabela 2. Número de espécimes, riqueza observada, riqueza estimada de serpentes, para área florestada e área aberta da Ilha de Marajó e riqueza esperada por rarefação para n= 92 espécimes para área aberta da Ilha de Marajó, Estado do Pará, Brasil. Em parêntese, 95% de intervalo de confiança. Número de espécimes Riqueza observada Riqueza estimada (Mao Tau) Riqueza esperada (rarefação; n= 92) Área florestada 92 30 30 (24-36) - Área aberta 304 36 36 (28 – 44) 23 (19 – 27) Utilizando-se os quadrantes como unidade amostral, o estimador de riqueza Jackknife de primeira ordem indicou uma riqueza maior para a área florestada em relação à área aberta na Ilha (Figura 4). O mesmo foi observado pelo método de rarefação, havendo uma menor variação no intervalo de confiança em relação ao estimador de riqueza Jackknife 1 (Figura 4). Segundo Maschio (2008), o uso de estimadores de riqueza deve ser utilizado com cautela nas análises de taxocenose de serpentes, pois muitas vezes espécies consideradas raras são aquelas que não foram devidamente acessadas pelo método empregado, em função da grande diversidade de hábitos utilizados por esses animais. A inclinação da curva de acumulação de espécies, gerada pelo método de rarefação, também indicou uma riqueza maior para a área florestada, utilizando tanto espécimes como unidade amostral (Figura 5a) quanto os quadrantes (Figura 5b). 189 65 Rarefação (Mao Tau) Riqueza de espécies estimadas 60 Jackknife 55 50 45 40 35 30 25 20 Área aberta Área de mata Figura 4. Riqueza de espécie de serpentes, estimada pelo procedimento de Rarefação e Jackknife de primeira ordem, controlada pelo tamanho do esforço amostral de 12 quadrantes, Ilha de Marajó, Estado do Pará, Brasil. As barras representam um intervalo de confiança de 95%. Figura 5. Curvas de acumulação de espécies usando a riqueza de espécie de serpentes estimada pelo procedimento de Rarefação, Ilha de Marajó, Estado do Pará, Brasil. a) Espécimes como unidade amostral; b) Quadrantes como unidade amostral. Legenda: as linhas pontilhadas e barras representam um intervalo de confiança de 95%. 190 Apesar do método de rarefação por espécimes indicar valores ligeiramente maiores para a área aberta (maior amostragem) em relação à área florestada (menor amostragem), a riqueza esperada para a área de floresta é maior, tanto pelo método de rarefação (considerando o mesmo número de espécimes) quanto pelo método utilizando os quadrantes como unidade amostral. A inclinação da curva de rarefação também mostrou que deve ocorrer um maior número de espécies em área florestada do que na área aberta. A riqueza de serpentes em áreas florestadas tende a ser maior que em ecossistemas de áreas abertas (Vitt e Vangilder, 1983; Strussmann e Sazima, 1993; Martins e Oliveira, 1999; Bernarde e Abe, 2006; Sawaya et al., 2008; Maschio, 2008; Rodrigues e Prudente, 2011), o que pode estar relacionado com a maior heterogeneidade ambiental, conforme mencionado por Pianka (1967). As florestas são ambientes com maior diversidade estrutural de habitats, propiciando maior possibilidade de ocupação em substratos verticais, maior quantidade de abrigos, maior riqueza de presas potenciais e, consequentemente, maior riqueza de espécies (Shine, 1995; Pough et al., 2004; Oliveira, 2005). Desta forma, é provável que a riqueza da área de floresta e da área aberta da Ilha de Marajó esteja relacionada tanto a fatores históricos (origem e interação entre os organismos) quanto ecológicos contemporâneos. Similaridade da composição de espécies serpentes da Ilha de Marajó com outras localidades Quando consideradas todas as espécies de presentes na Ilha de Marajó, os dois primeiro eixos da Análise de Coordenada Principais explicaram juntos 51,46% da variância dos dados (eixo 1: autovalor 1,23 e 36,26% de variância; eixo 2: autovalor 191 0,51 e 15,20% de variância). A análise ordenou as taxocenoses analisadas em dois grupos: 1) formado por taxocenoses de áreas abertas (Cerrado, Caatinga, Pantanal e Transição Cerrado-Caatinga) ordenados da seguinte forma: Itirapina (Poconé (Exú (Castelo do Piauí e Sete Cidades))); e o segundo grupo formado por taxocenoses florestais e área de Transição Floresta-Cerrado, ordenados da seguinte forma: Querência (Ilha de Marajó (Espigão do Oeste (Guiana (Caxiuanã e Manaus)))) (Figuras 6a e 7a). Quando as taxocenoses são analisadas separando-se a composição de espécies de Marajó da área aberta e da área florestada, os dois primeiros eixos da Análise de Coordenada Principal explicaram juntos 46,31% da variância dos dados (eixo 1: autovalor 1,24 e 32,69% de variância; eixo 2: autovalor 0,52 e 13,62 de variância). A análise ordenou as taxocenoses em dois grupos: 1) formado por taxocenoses de áreas florestadas abertas (Cerrado, Caatinga e Transição Cerrado-Caatinga) ordenados da seguinte forma: Itirapina (Exú (Castelo do Piauí e Sete Cidades)); e o segundo grupo formado por taxocenoses predominantemente florestais e área de Transição FlorestaCerrado, ordenados da seguinte forma: (Poconé e áreas abertas de Marajó) (Querência (áreas florestadas de Marajó (Espigão do Oeste (Guiana (Caxiuanã e Manaus))))) (Figuras 6b e 7b). Assim, a grande diferença entre os dois resultados da análise de agrupamento está relacionada à posição da taxocenose da área aberta da Ilha de Marajó, que ficou agrupada com a taxocenose do Pantanal, quando as taxocenoses da ilha são tratadas separadamente (Figura 7b). 192 Figura 6. Diagrama de ordenação da Análise de Coordenadas Principais resultantes da composição de espécies de serpentes (presença ou ausência de 178 espécies). a) Entrada de dados de Marajó inserida em coluna única. Eixo 1: autovalor 1,23 e 36,26% de variância; Eixo 2: autovalor 0,51 e 15,20% de variância. b) Entrada de dados de Marajó inserida em duas colunas: área florestada e área aberta de Marajó. Eixo 1: autovalor 1,24 e 32,69% de variância; Eixo 2: autovalor 0,52 e 13,62% de variância 193 Figura 7. Dendrograma da análise de agrupamento resultante da composição de espécies de serpentes (presença ou ausência de 178 espécies). a) Composição de serpentes da Ilha de Marajó analisada como um único conjunto de dados; b) Composição de serpentes da Ilha de Marajó analisada separando-se as duas unidades fisionômicas (área florestada e área aberta). 194 Quando a Ilha de Marajó é considerada como uma unidade geográfica única observa-se que apresenta maior similaridade faunística com as outras taxocenoses presentes em áreas de floresta Amazônica, enquanto que a menor similaridade faunística ocorre entre taxocenoses de regiões de Cerrado e Caatinga (Tabela 3). Tabela 3. Matriz de similaridade (Coeficiente de Jaccard) entre 10 localidades analisadas e a Ilha de Marajó. Valores de similaridade (em %) entre as localidades, número de espécies registradas nas localidades (em negrito) e número de espécies comuns entre as taxocenoses analisadas (sublinhado). Valores representando maiores similaridade (>45%) estão destacados em cinza. Legenda: (1 e 2) MARJ= Ilha de Marajó (toda a ilha); (3) AORI= Amazônia oriental (FLONA de Caxiuanã e áreas adjacentes, PA, Maschio, 2008); (4) AGUI= Amazônia Guianense (Guiana Francesa, Starace, 1998); (5) ACEN= Amazônia central (Reserva Duke, AM, Martins e Oliveira, 1999); (6) ASUD= Sudeste da Amazônia, RO, Espigão do Oeste, Bernarde e Abe, 2006); (7) TACE= Transição Amazônia-cerrado (Querência, MT, Abe, 2010); (8) CEPI= Cerrado no Nordeste do Brasil (Parque Nacional de Sete Cidades, PI, Rocha e Prudente, 2010); (9) CEIT= Cerrado no Sudeste do Brasil (Itirapina, SP, Sawaya et al., 2008); (10) TCCA= Transição Cerrado-caatinga (Castelo do Piauí, PI, Rodrigues e Prudente, 2011); (11) CAAT= Caatinga (Exu, PE, Vitt e Vangilder, 1983); (12) PANT= Pantanal brasileiro (Poconé, MT, Strussmann e Sazima, 1993). (1 e 2) MARJ (1 e 2) MARJ (3) AORI (4) AGUI (5) ACEN (6) ASUD (7) TACE (8) CEPI (9) CEIT (10) TCCA (11) CAAT (12) PANT 62 0,52 0,38 0,39 0,35 0,22 0,20 0,08 0,11 0,13 0,17 ( 3) (4) (5) (6) (7) (8) AORI AGUI ACEN ASUD TACE CEPI (9) CEIT (10) (11) (12) TCCA CAAT PANT 39 70 0,51 0,56 0,49 0,24 0,12 0,04 0,04 0,05 0,09 5 4 6 3 5 6 7 35 0,06 0,15 0,09 5 3 5 3 3 4 13 3 17 0,31 0,14 39 56 95 0,49 0,46 0,22 0,11 0,05 0,05 0,09 0,09 30 48 52 64 0,49 0,20 0,10 0,03 0,04 0,05 0,05 26 41 47 39 55 0,29 0,15 0,06 0,04 0,06 0,08 15 20 23 16 20 34 0,19 0,09 0,09 0,11 0,12 10 10 12 8 10 9 22 0,14 0,50 0,44 0,18 7 4 9 4 4 5 12 7 8 17 0,14 195 12 8 10 4 6 6 7 5 5 5 23 O resultado da análise de similaridade evidenciou que, quando as duas fisionomias da Ilha de Marajó são consideradas separadamente, a similaridade faunística entre as áreas florestada e aberta é baixa (0,27). A maior similaridade é vista entre área florestada da Ilha com outras taxocenoses pertencentes ao Bioma Amazônia (Tabela 4). Apesar da menor distância geográfica entre Marajó e Caxiuanã, os valores de similaridade foram maiores entre a área aberta da Ilha e as regiões da Guiana e do Pantanal (Tabela 4). Tabela 4. Matriz de similaridade (Coeficiente de Jaccard) entre 10 localidades analisadas e a Ilha de Marajó, considerando dois conjuntos de dados (área florestada e área aberta de Marajó). Valores de similaridade (em %) entre as localidades, número de espécies registradas nas localidades (em negrito) e número de espécies comuns entre as taxocenoses analisadas (sublinhado). Valores representando maiores similaridade (>45%) estão destacados em cinza. Legenda: (1) FLMJ= Área florestada de Marajó; (2) CAMJ= Área aberta de Marajó; (3) AORI= Amazônia oriental (FLONA de Caxiuanã e áreas adjacentes, Maschio, 2008); (4) AGUI= Amazônia Guianense (Guiana Francesa, Starace, 1998); (5) ACEN= Amazônia central (Reserva Duke, AM, Martins e Oliveira, 1999); (6) ASUD= Sudeste da Amazônia (Espigão do Oeste, RO, Bernarde e Abe, 2006); (7) TACE= Transição Amazônia-cerrado (Querência, MT, Abe, 2010); (8) CEPI= Cerrado no Nordeste do Brasil (Parque Nacional de Sete Cidades, PI, Rocha e Prudente, 2010); (9) CEIT= Cerrado no Sudeste do Brasil (Itirapina, SP, Sawaya et al., 2008); (11) CAAT= Caatinga (Exu, PE, Vitt e Vangilder, 1983); (10) TCCA= Transição Cerrado-caatinga (Castelo do Piauí, PI, Rodrigues e Prudente, 2011); (12) PANT= Pantanal brasileiro (Poconé, MT, Strussmann e Sazima, 1993). (1) FLMJ (2) CAMJ (3) AORI (4) AGUI ( 5) ACEN (6) ASUD (7) TACE (8) CEPI (9) CEIT (10) TCCA (11) CAAT (12) PANT (1) FLMJ 30 0,27 0,41 0,24 0,34 0,29 0,23 0,11 0,03 0,04 0,09 0,06 (2) CAMJ 14 36 0,28 0,26 0,21 0,23 0,17 0,19 0,06 0,11 0,13 0,26 (3) AORI (4) AGUI ( 5) ACEN (6) ASUD (7) TACE (8) CEPI (9) CEIT (10) TCCA (11) CAAT (12) PANT 29 24 27 24 17 19 17 12 10 5 9 2 4 2 5 4 6 3 12 56 95 0,49 0,46 0,22 0,11 0,05 0,05 0,09 0,09 48 52 64 0,49 0,20 0,10 0,03 0,04 0,05 0,05 41 47 39 55 20 23 16 20 34 0,19 0,09 0,09 0,11 0,12 10 12 8 10 9 22 0,14 0,50 0,44 0,18 4 6 3 5 6 7 35 0,06 0,15 0,09 3 5 3 3 4 13 3 17 0,31 0,14 4 9 4 4 5 12 7 8 17 0,14 8 10 4 6 6 7 5 5 5 23 23 70 0,51 0,56 0,49 0,24 0,12 0,04 0,04 0,05 0,09 0,29 0,15 0,06 0,04 0,06 0,08 196 Considerando as 61 espécies (excluindo Thamnodynastes sp.) presentes na Ilha de Marajó, 35 espécies (Atractus natans, A. schach, Bothrops atrox, Chironius carinatus, C. exoletus, C. fuscus, C. multiventris, Corallus hortulanus, Dendrophidion dendrophis, Dipsas indica, Drepanoides anomalus, Epicrates maurus, Eunectes deschauenseei, Helicops angulatus, H. hagmanni, H. polylepis, H. trivittatus, Hydrops martii, Imantodes cenchoa, Lachesis muta, Liophis taeniogaster, L. typhlus, Micrurus filiformis, M. hemprichii, M. spixii, M. surinamensis, Oxybelis fulgidus, Oxyrhopus melanogenys, Philodryas argentea, P. viridissima, Pseudoboa coronata, Siphlophis cervinus, S. compressus, Taeniophallus quadriocellatus e Typhlops reticulatus) foram registradas em outras taxocenoses amazônicas analisadas, incluído a área de transição Amazônia-Cerrado (Querência, MT). Dezoito espécies (Boa constrictor, Clelia clelia, Crotalus durissus, Drymarchon corais, Epicrates cenchria, Eunectes murinus, Helicops leopardinus, Hydrodynastes gigas, Leptodeira annulata, Leptophis ahaetulla, Liophis almadensis, L. lineatus, L. reginae, Mastigodryas bifossatus, M. boddaerti, Oxybelis aeneus, Spilotes pullatus e Tantilla melanocephala) foram registradas tanto nas taxocenoses florestais quanto em áreas abertas. Somente seis espécies (Chironius flavolineatus, Liophis meridionalis, L. poecilogyrus, M. ibiboboca, Oxyrhopus trigeminus e Psomophis joberti) foram registradas unicamente em áreas abertas tanto da Ilha de Marajó quanto de outras taxocenoses analisadas. Duas espécies (Bothrops marajoensis e Thamnodynastes lanei) foram exclusivamente registradas em Marajó. A proximidade da Ilha de Marajó com outras taxocenoses amazônicas na ACoP e na análise de agrupamento, provavelmente, tenha sido em função do elevado número de espécies presentes na Ilha e comuns as outras taxocenoses amazônicas (53 espécies). Da mesma forma, na ACoP e na análise de agrupamento, a maior distância da Ilha em relação ao grupo formado pelas outras taxocenoses amazônicas foi influenciado pelas 197 oito espécies presentes em Marajó e que não foram registradas nas taxocenoses amazônicas analisadas. Entre as 35 espécies (excluindo Thamnodynastes sp.) registradas na área aberta da Ilha de Marajó, quatro (Liophis meridionalis, L. poecilogyrus, Psomophis joberti e Thamnodynastes lanei) não ocorrem nas taxocenoses amazônicas analisadas, quatro (Epicrates maurus, Eunectes deschauenseei, Liophis lineatus e Mastigodryas bifossatus) são registradas apenas para a Guiana Francesa e quatro espécies (Crotalus durissus, Bothrops marajoensis, Psomophis joberti e Thamnodynastes lanei) são registradas em enclaves de áreas abertas amazônicas. Segundo França et al. (2006), das 79 espécies de serpentes registradas para os enclaves de savanas amazônicas, 21 são amplamente distribuídas no Brasil e 19 ocorrem em toda a Amazônia. Quinze espécies ocorrem em outros biomas abertos, como a Caatinga e Cerrado, com populações disjuntas nas savanas amazônicas, como por exemplo, Chironius flavolineatus, Micrurus ibiboboca e Oxyrhophus trigeminus (Nascimento et al., 1991; Dixon et al.,1993; Roze, 1996; Rodrigues e Prudente, 2011). Somente cinco espécies são consideradas por França et al. (2006) como endêmicas das savanas amazônicas (Atractus riveroi, Bothrops marajoensis, Liophis carajasensis, Phimophis guianensis e Thamnodynastes chimanta). Os registros para Ilha de Marajó ampliam esse número de espécies, com o acréscimo de Thamnodynastes lanei. A proximidade na similaridade entre as taxocenoses de serpentes da Ilha de Marajó e as outras quatro taxocenoses amazônicas analisadas, principamente a região de Caxiuanã, provavelmente, esteja relacionada a sua fonte de colonização (MacArthur e Wilson, 1967). No entanto, a estrutura ambiental das áreas abertas de Marajó fornecem condições para a presença de espécies características de outras formações abertas no 198 Brasil, como por exemplo, a Caatinga do Nordeste e o Cerrado do Brasil Central e Nordeste. Os resultados aqui obtidos indicam que a Ilha de Marajó apresenta características únicas em relação à sua composição de serpentes. A existência de espécies endêmicas, espécies de áreas abertas em conjunto com espécies florestais, espécies com distribuição restrita à um de seus ecossistemas, especialmente nas áreas abertas da Ilha, evidenciam a necessidade de se proteger amostras de cada um desses ecossistemas. Assim, este estudo contribue de forma significativa para o conhecimento e conservação da taxocenoses de serpentes da Ilha de Marajó, bem como para as taxocenoses de serpentes amazônicas. Além disto, fornece base para compreensão dos padrões gerais de distribuição das diferentes espécies de serpentes amazônicas. 199 REFERÊNCIAS BIBLIOGRÁFICAS Abe, P. S. 2010. Composição e História Natural das Serpentes de uma região de transição Amazônia-Cerrado, Querência, Mato Groso, Brasil. Ms. Dissertação (Mestrado em Zoologia). Museu Paraense Emílio Goeldi, Belém, Pará, Brasil, 60 pp. Bailey, J. R., R. A. Thomas e N. J. Silva Jr. 2005. A revision of the South American snake genus Thamnodynastes Wagler, 1830 (Serpentes, Colubridae, Tachymenini). I. Two new species of Thamnodynastes from Central Brazil and adjacent areas, with a redefinition of and neotype designation for Thamnodynastes pallidus (Linnaeus, 1758). Phyllomedusa, 4: 83-102. Bernarde, P. S. e A. S. Abe. 2006. A snake community at Espigão do Oeste, Rondônia, southwestern Amazon, Brazil. South American Journal of Herpetology, 1: 102113. Cadle, J. E. e H. W. Greene. 1993. Phylogenetic patterns, biogeography, and ecological structure of neotropical snake assemblages; pp. 281-293. Em: R. E. Ricklefs e D. Schluter (Eds.), Species diversity in ecological communities. Historical and geographical perspectives. University of Chicago Press, Chicago. Chippaux, J. P. 1986. Les serpents de la Guyane Française. ORSTOM, Paris. 165 pp. Colwell, R. K. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8.2. User's Guide and application published at: http://purl.oclc.org/estimates. Colwell, R. K., C. X. Mao e J. Chang. 2004. Interpolating, extrapolating, and comparing incidence-based species accumulation curves. Ecology, 85: 2717-2727. 200 Courtemanch, D. L. 1996. Commentary on the sub-sampling procedures used for rapid bioassessments. Journal of the North American Benthological Society ,15: 381385. Cunha, O. R. e F. P. Nascimento. 1980. Ofídios da Amazônia XI - Ofídios de Roraima e notas sobre Erythrolamprus bauperthuisii Duméril, Bibron & Duméril, 1954, sinônimo de Erythrolamprus aesculapii (Linnaeus, 1758). Boletim do Museu Paraense Emílio Goeldi, 102: 1-21. Cunha, O. R. e F. P. Nascimento. 1993. Ofídios da Amazônia. As cobras da região leste do Pará. Boletim do Museu Paraense Emílio Goeldi, 9: 1–191. Cunha, O. R., F. P. Nascimento e T. C. Ávila-Pires. 1985. Os répteis da área de Carajás, Pará, Brasil (Testudines e Squamata). Publicações Avulsas. Museu Paraense Emílio Goeldi, 40: 9-85. Dixon, J. R. e A. L. Markezich, 1992. Taxonomy and geographic variation of Liophis poecilogyrus (Wied) from South America (Serpentes: Colubridae). The Texas Journal of Science, 44:131-166. Dixon, J. R., J. A. Wiest-Jr. e J. M. Cei. 1993. Revision of the Neotropical Snake Genus Chironius Fitzinger (Serpentes, Colubridae). Monografie XIII. Museo Regionale di Scienze Naturali, 279 pp. França, F. G. R., D. O. Mesquita e R. Colli. 2006. A checklist of snakes from Amazonian savannas in Brazil, housed in the Coleção Herpetológica da Universidade de Brasília, with new distribution records. Occasional Papers, Oklahoma Museum of Natural History, University of Oklahoma, 1-13 pp. Furtado, A. M. M., C. F. França e M. A. S. Pimentel. 2009. Relação Relevo-SoloVegetação da Ilha de Marajó. Em: XI Simpósio Nacional e Geografia Física Aplicada, Viçosa, Minas Gerais. Anais do XI Simpósio Nacional e Geografia Física Aplicada. Viçosa, Minas Gerais, Brasil. 201 Gotelli, N. J. e G. L. Entsminger. 2010. EcoSim: Null models software for ecology. Version 7. Acquired Intelligence Inc. e Kesey-Bear. Jericho, VT 05465. Disponível em: http://garyentsminger.com/ecosim.htm Acessado em janeiro de 2011. Gotelli, N. J. e R. K. Colwell. 2001. Quantifying biodiversity: procedures and pitfalls in the measurement and comparasion of species richeness. Ecology Letters, 4: 379391. Goulding, M., R. Barthem e E. Ferreira. 2003. The Smithsonian atlas of the Amazon. Smithsonian Institution. Washington, 253 pp. Guedes, T. B., G. S. S. Nunes, A. L. C. Prudente e O. A. V. Marques. 2011. New records and geographical distribution of the Tropical Banded Treesnake Siphlophis compressus (Dipsadidae) in Brazil. Herpetology Notes, 4: 341-346. Hammer, Ø., D. A. T. Harper e P. D. Ryan. 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica 4: 9 pp. Henderson, R. W., P. Passos e D. Feitosa. 2009. Geographic Variation in the Emerald Treeboa, Corallus caninus. Copeia, 3: 572-582 Henrique, L. M. P. e D. C. Orean. 1997. The avifauna of Marajó, Caviana and Mexiana islands, Amazon River estuary, Brazil. Revista Brasileira de Biologia, 57 : 357382. Lima, A. M. M., L. L. Oliveira, R. L. Fontinhas e R. J. S. Lima. 2005. Ilha de Marajó : Revisão Histórica Hidroclimatológica, Bacias Hidrográficas e Propostas de Gestão. Holos Environment, 5: 65-80. Manly, B. F. J. 1994. Multivariate Statistical Methods: a primer. Chapman and Hall. London. 215 pp. 202 Martins, M. e M. E. Oliveira. 1999. Natural history of snakes in forests of the Manaus region, Central Amazonia, Brazil. Herpetological Natural History, 6: 78-150. Martins, M., S. Araújo, R. J. Sawaya e R. Nunes. 2001. Diversity and evolution of macrohabitat use, body size and morphology in a monophyletic group of neotropical pitvipers (Bothrops). Journal of Zoolgy, 254: 529-538. Maschio, G. F. 2008. História natural e ecológica das serpentes da Floresta Nacional de Caxiuanã e áreas adjacentes, Pará, Brasil. Tese. Museu Paraense Emílio Goeldi, Belém, 214 pp. Melo, A. S., R. A. S. Pereira, A. J. Santos, G. J. Shepherd, G. Machado, H. F. Medeiros e R. J. Sawaya. 2003. Comparing species richness among assemblages using sample units: why not use extrapolation methods to standardize different sample sizes? Ikos, 101: 398-410. Müller, P. 1969. Herpetologische Beobachtungen auf der Insel Marajó.(Amazonasdelta) DATZ, 22: 117-121. Myers, C. W. e J. E. Cadle. 1994. A new genus for South American snakes related to Rhadinaea obtusa Cope (Colubridae) and Resurrection of Taeniophallus Cope for the “Rhadinaea” brevirostris group. American Museum Novitates, 3484: 1-22. Nascimento, O. R., T. C. S. Ávila-Pires, I. N. F. Santos e A. C. M. Lima. 1991. Répteis de Marajó e Mexiana, Pará, Brasil. I. Revisão bibliográfica e novos registros. Boletim do Museu Paraense Emílio Goeldi, 7: 25-41. Oliveira, R. B. 2005. História natural da comunidade de serpentes de uma região de dunas do litoral norte do Rio Grande do Sul, Brasil. Tese. Pontifica Universidade Católica do Rio Grande do Sul, Porto Alegre, 108 pp. Passos, P. e R. Fernandes. 2008. Revison of the Epicrates cenchria complex (Serpentes: Boidae). Herpetological Monographs. 22: 1-30. 203 Pianka, E. 1967. On lizard species diversity: North American flatland deserts. Ecology, 48: 333-351. Pough, F. H., R. M. Andrews, J. E. Cadle, M. L. Crump, A. H. Savitzky e K. D. Wells. 2004. Herpetology. Pearson Prentice-Hall, Upper Saddle River, New Jersey, 724 pp. Projeto RADAM, Brasil. 1974. Folha SA.22. Levantamento de recursos naturais. geologia, geomorfologia, solos, vegetação e uso potencial da terra. Departamento Nacional de Produção Mineral, Rio de Janeiro, Volume 5. Rocha, W. A. 2007. Taxocenose de serpentes em grupos fitofisionômicos de cerrado no Parque Nacional de Sete Cidades, Piracuruca, Piauí, Brasil. Ms. Dissertação. Museu Paraense Emílio Goeldi, Belém, 77pp. Rodrigues, F. S. e A. L. C. Prudente. 2011. The snake assemblage (Squamata: Serpentes) of a Cerrado-Caatinga trasition area in Castelo do Piauí, state of Piauí, Brazil. Zoologia, 28: 440-448. Rodrigues, F. S. e A. L. C. Prudente. 2011. The snake assemblage (Squamata: Serpentes) of a Cerrado-Caatinga trasition area in Castelo do Piauí, state of Piauí, Brazil. Zoologia 28: 440-448. Rossetti, D. F. e P. M. Toledo. 2006. Biodiversity from a historical geology perspective: a case study from Marajó Island, lower Amazon. Geobiology, 4: 215-223. Roze, J. A. 1996. Coral snakes of the Americas: Biology, Identification, and Venoms. Krieger Publishing Company, Malabar, 328 pp. Sanders, H. L. 1968. Marine benthic diversity: a comparative study. The American Naturalist, 102: 243-282. Santos, A. J. 2003. Estimativas de riqueza em espécies; pp. 14-91. Em: L. Cullen Jr, R. Rudrane C. Valladares-Padua. (Eds). Métodos de Estudos em Biologia da 204 Conservação & Manejo da Vida Silvestre. Universidade Federal do Paraná, Fundação O Boticário de Proteção à Natureza. Curitiba. Sawaya, R. J., O. A. V. Marques e M. Martins. 2008. Composição e história natual das serpentes de Cerrado de Itirapina, São Paulo, sudeste do Brasil. Biota Neotropical, 8: 127-149. Shine, R. 1995. Australian Snakes – A Natural History. Cornell University Press. Ithaca. 223pp. Silva, R. J. 2000. As serpentes. FUNEP – Fundação de Estudos e Pesquisas em Agronomia, Medicina Veterinária e Zootecnia. Jaboticabal, 141 pp. Silva-Junior, J. S., S. A. Marques-Aguiar, G. F. S. Aguiar, L. N. Saldanha, A. A. Avelar e E. M. Lima. 2005. Mastofauna nao voadora das savanas doMarajo. Em: Resumos do III Congresso Brasileiros de Mastozoologia, Aracruz,131 pp. Sneath, P. H. A. e R. R. Sokal. 1973. Numerical Taxonomy: the principles and practice of numerical classification. Freeman. San Francisco, 573 pp. Starace, F. 1998. Guide dês serpents et amphisbènes de Guyane. Ibis Rouge Editions, Paris, 449 pp. Strüssmann, C. e I. Sazima. 1993. The snake assemblage of the Pantanal at Poconé, western Brazil. Studies on Neotropical Fauna and Environment, 28: 157-168. Vitt, L. J. e L. D. Vangilder. 1983. Ecology of a snakes community in northeastern Brazil. Amphibia-Reptilia, 4:273-296. Yuki, R. N. e A. A. M. Barros 1997. Contribuição ao conhecimento de Liophis meridionalis (Schenkel, 1901) (Serpentes: Colubridae: Xenodontinae). Boletim do Museu Paraense Emílio Goeldi, 13: 3-10. 205 ANEXO I Atractus natans (n= 4): SALVATERRA: Caldeirão, MPEG 18340, MPEG 18342, 0° 43' 52" S, 48° 31' 36" W; Taperiaçú, MPEG 18420, MPEG 18421, 0° 45' 37" S, 48° 31' 27" W**; Atractus schach (n= 1): CHAVES: Fazenda Tauari (Baixo rio Cururu), MPEG 24960, 0° 24,72' 0" S, 49° 58,41' 0" W; Boa constrictor (n=6): CACHOEIRA DO ARAÍ: Teso dos Bichos, MPEG 18018, 0° 51' 52" S, 48° 54' 59" W; CHAVES: Igarapé Taperebá, MZUSP3652, MZUSP3653, 0° 13' 34" S, 48° 59' 6" W; MUANÁ: MPEG 15187, 1° 31' 41" S, 49° 13' 2" W; SANTA CRUZ DO ARAÍ: MPEG 19634, MPEG 19635, 0° 39' 54" S, 49° 10' 22" W; Bothrops atrox (n= 36): AFUÁ: Rio Preto, MAR1588*, 0° 26' 54" S, 50 38' 8" W; ANAJÁS: MPEG 19645, 0° 59' 14" S, 49° 56' 26" W; BREVES: MPEG 18797, 1° 40' 56" S, 50 28' 50" W; Estrada Breves-Anajás: Km 5 da PA-159, MPEG 17356, 1° 39' 4" S, 50 26' 54" W; Km 6 da PA-159, MPEG 17338, MPEG 17347, MPEG 17350, MPEG 17352, MPEG 17353, MPEG 17357, MPEG 17369, 1° 38' 35" S, 50 27' 16" W; Km 7 da PA-159, MPEG 17354, MPEG 17355, 1° 38' 7" S, 50 27' 28" W; Km 8 da PA-159, MPEG 17341, MPEG 17344, 1° 37' 45" S, 50 27' 1" W; Km 10 da PA-159, MPEG 17337, MPEG 17342, 1° 36' 51" S, 50 26' 22" W; Sítio do Sr. Valdir, MPEG 24410 1° 33,819' 0" S, 50° 23,632' 0" W; Comunidade Tancredo Neves, MPEG 18282, MPEG 18283, MPEG 18798, 1° 34' 16" S, 50 25' 0" W; CACHOEIRA DO ARAÍ: Comunidade de Jabuti (Fazenda Curupatura), MPEG 18799, MPEG 18323, 0° 57' 12" S, 48° 41' 45" W; Localidade da Sé(Campinha), MPEG 18319, 1° 0' 49" S, 48° 40' 7" W; CHAVES: MPEG 21175, 0° 9' 40" S, 49° 59' 18" W; Caminho Para o Retiro Murici, MPEG 21178, 0° 9' 40" S, 49° 59' 18" W**; Fazenda Tauari (Baixo rio Cururu), MPEG 24954, 0° 25,065' 0" S, 49° 58,09' 0" W; CURRALINHO: Caminho Breves-Anajás, MPEG 24408, 1° 29' 43" S, 50 22' 57" W; MUANÁ: Fazenda São João, MPEG 23528, 1° 5' 44" S, 49° 19' 18" W; PONTA DE PEDRAS: Sítio Castanhal (Rio Quiãparaná), MPEG 20817, 1° 20' 36" S, 48° 58' 17" W; Sítio Chapéu Virado (Rio Quiãparaná), MPEG 20814, 1° 20' 36" S, 48° 58' 17" W; SALVATERRA: MPEG 18644, 0° 45' 37" S, 48° 31' 27" W; Caldeirão, MPEG 18493, 0° 43' 52" S, 48° 31' 36" W; Marauá, MPEG 18425, 0° 45' 37" S, 48° 31' 27" W**; SOURE: Fazenda Boa Esperança, MPEG 19262, 0° 25' 19" S, 48° 29' 33" W; MUNICIPALITY UNREGISTERED: Boa Vista, MPEG 18414, coordenada não obtida; Chironius carinatus (n= 4): CACHOEIRA DO ARAÍ: Fazenda Vencedora, MPEG 8666, 1° 12' 0" S, 48° 50' 0" W; CHAVES: Fazenda Tijucaquara (Igarapé Tijucaquara), MPEG 17716, 0° 14' 16" S, 49° 20' 8" W; Igarapé Taperebá, MZUSP3600, MZUSP3601, 0° 13' 34" S, 48° 59' 6" W; Chironius exoletus (n= 2): BREVES: Comunidade Tancredo Neves, MPEG 18281, 1° 34' 16" S, 50 25' 0" W; CACHOEIRA DO ARAÍ: Bairro da Sé, MPEG 16381, 1° 0' 15" S, 48° 57' 26" W; Chironius flavolineatus (n= 1): SALVATERRA: Caldeirão, MPEG 18341, 0° 43' 52" S, 48° 31' 36" W; Chironius fuscus (n= 5): ANAJÁS: MPEG 19327, 0° 59' 14" S, 49° 56' 26" W; Vila Aramá, MPEG 319, 0° 56' 10" S, 50 16' 9" W; BREVES: Comunidade Tancredo Neves, MPEG 18280, 1° 34' 16" S, 50 25' 0" W; Km 6 da PA-159 (Estrada BrevesAnajás), MPEG 17349, MPEG 17363, 1° 38' 35" S, 50 27' 16" W; Chironius multiventris (n= 1): CACHOEIRA DO ARAÍ: Comunidade Bacuri (Marajateua), 206 MPEG 18318, 1° 1' 9" S, 48° 40' 54" W; Clelia clelia (n= 1): SOURE: Fazenda Aruã, MPEG 18045, 0° 38' 24" S, 48° 51' 16" W; Corallus hortulanus (n= 4): ANAJÁS: MPEG 19336, 0° 59' 14" S, 49° 56' 26" W; BREVES: Comunidade Tancredo Neves, MPEG 18801, 1° 34' 16" S, 50 25' 0" W; PONTA DE PEDRAS: Sítio Chapéu Virado (Rio Quiãparaná), MPEG 20812, 1° 20' 36" S, 48° 58' 17" W; SALVATERRA: MPEG 18636, 0° 45' 37" S, 48° 31' 27" W; Crotalus durissus (n= 5): PONTA DE PEDRAS: MPEG 24041, 1° 23' 26" S, 48° 52' 13" W; SALVATERRA: Caldeirão, MPEG 18415, MPEG 20820, 0° 43' 52" S, 48° 31' 36" W; Mangabal, MPEG 18810, 0° 51' 58" S, 48° 39' 26" W; Povoado de Condeixa, MPEG 17780, 0° 53' 58" S, 48° 35' 17" W; Dendrophidion dendrophis (n= 1): BREVES: Km 5 da PA-159 (Estrada BrevesAnajás), MPEG 17364, 1° 39' 4" S, 50 26' 54" W; Drepanoides anomalus (n= 1): CACHOEIRA DO ARAÍ: Localidade da Sé(Campinha), MPEG 18315, 1° 0' 49" S, 48° 57' 7" W; Drymarchon corais (n= 1): CACHOEIRA DO ARAÍ: Fazenda Santa Maria (Rio Ararí), MPEG 18185, 0° 53' 14" S, 49° 5' 3" W; Epicrates cenchria (n= 1): BREVES: Km 8 da PA-159 (Estrada Breves-Anajás), MPEG 17345, 1° 37' 45" S, 50 27' 1" W; Epicrates maurus (n= 21): CACHOEIRA DO ARAÍ: Fazenda Tuyuyu (Rio Ararí), MPEG 18164, MPEG 18192,MPEG 18193, MPEG 18194, MPEG 18254, MPEG 18255, MPEG 18256, MPEG 18261, MPEG 18262, MPEG 18263, MPEG 18264, MPEG 18362, MPEG 18601, 0° 49' 12" S, 49° 8' 59" W; CHAVES: Igarapé Taperebá, MZUSP3599, 0° 13' 34" S, 48° 59' 6" W; SANTA CRUZ DO ARAÍ: MPEG 19625, 0° 39' 54" S, 49° 10' 22" W; Fazenda São Miguel (Lago Ararí), MPEG 19648, 0° 37' 35" S, 49° 5' 59" W; SOURE: Fazenda Aruã, MPEG 18043, MPEG 18044, MPEG 18130, MPEG 18131, MPEG 18175, 0° 38' 24" S, 48° 51' 16" W; Eunectes deschauenseei (n= 13): CACHOEIRA DO ARAÍ: Fazenda Boa Esperança (Ilha da Roça), MPEG 18019, 0° 52' 3" S, 48° 57' 55" W; SANTA CRUZ DO ARAÍ: MPEG 19638,MPEG 19632, MPEG 19640, MPEG 19641, MPEG 19633, MPEG 19639, 0° 39' 54" S, 49° 10' 22" W; SOURE: Fazenda Aruã, MPEG 18029, MPEG 18068, MPEG 18126, MPEG 18127, MPEG 18128, MPEG 18129, 0° 38' 24" S, 48° 51' 16" W; Eunectes murinus (n= 6): CHAVES: Igarapé Taperebá, MZUSP3654, MZUSP3655, MZUSP3656, 0° 13' 34" S, 48° 59' 6" W; SANTA CRUZ DO ARAÍ: MPEG 19637, 0° 39' 54" S, 49° 10' 22" W; MUNICIPALITY UNREGISTERED MPEG 19411, MPEG 19412, coordenada não obtida; Helicops angulatus (n= 12): ANAJÁS: Margem do Rio Anajás-mirim, MPEG 19337, 1° 7' 24" S, 49° 34' 45" W; MUANÁ: Berta Grande, Fazenda Socorro (Rio Atuá), MPEG 21205, 1° 15,594' 0" S, 49° 19,093' 0" W; Propriedade do Sr. Moisés, Bacurituba (Rio Tauá), MPEG 21197, MPEG 21198, MPEG 21199, 1° 15' 51" S, 49° 22' 45" W; SALVATERRA: Igarapé que atravessa a estrada de acesso a Reserva Ecológica Bacurizal, MPEG 18423, MPEG 18424, 0° 46' 24" S, 48° 31' 0" W**; Igarapé que atravessa a estrada Salvaterra-Caldeirão, MPEG 18416, MPEG 18417,MPEG 18418, MPEG 18419, 0° 44' 46" S, 48° 32' 10" W; SANTA CRUZ DO ARAÍ: MPEG 19617, 0° 39' 54" S, 49° 10' 22" W; Helicops hagmanni (n= 1): AFUÁ: Rio Preto, MAR1492, 0° 26' 54" S, 50 38' 8" W; Helicops leopardinus (n= 25): CACHOEIRA DO ARAÍ: Baixa do Alecrim, MPEG 284, MPEG 285, 1° 10' 0" S, 48° 50' 0" W; Foz do rio Goiapi, MPEG 18488, MPEG 18489, MPEG 18490, MPEG 18491, 0° 58' 0" S, 48° 57' 0" W**; Ilha da Tia Bita, MPEG 636, MPEG 207 637, MPEG 638, MPEG 639, MPEG 640, MPEG 641, MPEG 642, 1° 1' 0" S, 48° 58' 0" W; Localidade da Sé(Campinha), MPEG 18325, 1° 0' 49" S, 48° 40' 7" W**; Retiro Anjo da Guarda, MPEG 18014, 0° 54' 52" S, 48° 54' 41" W; Taperebá, Fazenda Santa Maria (Rio Goiapi), MPEG 18683, 0° 58' 0" S, 48° 57' 0" W**; CHAVES: Fazenda Tijucaquara (Igarapé Tijucaquara), MPEG 17717, MPEG 17718, MPEG 17719, 0° 14' 16" S, 49° 20' 8" W; Igarapé Taperebá, MZUSP3605, 0° 13' 34" S, 48° 59' 6" W; Rio Cajú, MPEG 17721 0° 9' 40" S, 49° 59' 18" W**; SANTA CRUZ DO ARAÍ: MPEG 19618, MPEG 19619, MPEG 19620, MPEG 19621, 0° 39' 54" S, 49° 10' 22" W; Helicops polylepis (n= 4): ANAJÁS: Vila Aramá, MPEG 321, 0° 59' 0" S, 49° 57' 0" W; CHAVES: Área urbana de Chaves, MPEG 21177, MPEG 21179, 0° 9' 40" S, 49° 59' 18" W; Fazenda Tijucaquara (Igarapé Tijucaquara), MPEG 17720, 0° 14' 16" S, 49° 20' 8" W; Helicops trivittatus (n= 8): CACHOEIRA DO ARAÍ: Fazenda Santa Angela, MPEG 18013, 0° 55' 21" S, 49° 18' 32" W; Fazenda Vencedora, MPEG 8665 1° 12' 0" S, 48° 50' 0" W; Ilha da Tia Bita, MPEG 644, MPEG 645, 1° 1' 0" S, 48° 58' 0" W; PONTA DE PEDRAS: Sinailabu-Marajoite, MPEG 20813, 1° 20' 29" S, 48° 58' 27" W**; SANTA CRUZ DO ARAÍ: MPEG 19629,MPEG 19630, MPEG 19631, 0° 39' 54" S, 49° 10' 22" W; Hydrodynastes gigas (n= 7): CACHOEIRA DO ARAÍ: Fazenda Santa Maria (Rio Ararí), MPEG 18184, 0° 53' 14" S, 49° 5' 3" W; Fazenda Tia Bita, MPEG 18012, 1° 1' 0" S, 48° 58' 0" W; MUANÁ: Fazenda São João, MPEG 21487, 1° 5' 44" S, 49° 19' 18" W; SANTA CRUZ DO ARAÍ: MPEG 19636, 0° 39' 54" S, 49° 10' 22" W; SOURE: Fazenda Aruã, MPEG 18046, MPEG 18070, MPEG 18071,0° 38' 24" S, 48° 51' 16" W; Hydrops martii (n= 1): AFUÁ: Rio Preto, MAR1547, 0° 26' 54" S, 50 38' 8" W; Imantodes cenchoa (n= 4): ANAJÁS: Margem do Rio Anajás-mirim, MPEG 20674, 1° 7' 24" S, 49° 34' 45" W; Vila Aramá, MPEG 320, 0° 59' 0" S, 49° 57' 0" W; CACHOEIRA DO ARAÍ: Localidade da Sé(Campinha), MPEG 18317, 1° 0' 49" S, 48° 40' 7" W**; PONTA DE PEDRAS: MPEG 16461, 1° 23' 26" S, 48° 52' 13" W; Lachesis muta (n= 2): ANAJÁS: Margem do Rio Anajás-mirim, MPEG 19335, 1° 7' 24" S, 49° 34' 45" W; MUANÁ: Fazenda São Miguel (Rio São Miguel), MPEG 19338, 1° 12' 40" S, 49° 27' 4" W; Leptodeira annulata (n= 8): AFUÁ: Rio Preto, MAR1503*, 0° 26' 54" S, 50 38' 8" W; CHAVES: Área urbana de Chaves, MPEG 21181, 0° 9' 40" S, 49° 59' 18" W; Igarapé Taperebá, MZUSP3607, 0° 13' 34" S, 48° 59' 6" W; SALVATERRA: MPEG 18339, 0° 45' 37" S, 48° 31' 27" W; Reserva Ecológica Bacurizal, MPEG 18338, 0° 46' 24" S, 48° 31' 0" W**; SOURE: Fazenda Bacuri, MPEG 17724, MPEG 17785, 0° 15' 54" S, 48° 29' 37" W; Fazenda Boa Esperança, MPEG 19263, 0° 25' 19" S, 48° 29' 33" W; Leptophis ahaetulla (n= 17): ANAJÁS: Rio Anajás-Mirim, MPEG 19332, MPEG 19333, MPEG 19334, 1° 7' 24" S, 49° 34' 45" W; BREVES: Estrada Breves-Anajás: Km 3 da PA-159, MPEG 17348, 1° 39' 47" S, 50 27' 41" W; Km 8 da PA-159, MPEG 17351, 1° 37' 45" S, 50 27' 1" W; CACHOEIRA DO ARAÍ: Fazenda Tia Bita, MPEG 18016, 1° 1' 0" S, 48° 58' 0" W; Localidade da Sé(Campinha), MPEG 18326, 1° 0' 49" S, 48° 40' 7" W**; CHAVES: Fazenda Marajá, MPEG 17722, 0° 9' 40" S, 49° 59' 18" W**; Fazenda Tijucaquara (Igarapé Tijucaquara), MPEG 17714, 0° 14' 16" S, 49° 20' 8" W; Igarapé Taperebá, MZUSP3619, 0° 13' 34" S, 48° 59' 6" W; MUANÁ: MPEG 23529, 1° 31' 41" S, 49° 13' 2" W; Fazenda São Miguel (Rio São Miguel), MPEG 19330, 1° 12' 40" S, 49° 27' 4" W; 208 SALVATERRA: MPEG 18637, MPEG 18638, 0° 45' 37" S, 48° 31' 27" W; SANTA CRUZ DO ARAÍ: MPEG 19626, MPEG 19627, MPEG 19628, 0° 39' 54" S, 49° 10' 22" W; Liophis almadensis(n= 20): SOURE: Fazenda Aruã, MPEG 18054, MPEG 18057, MPEG 18059, MPEG 18060, MPEG 18061, MPEG 18065, MPEG 18066, MPEG 18078, MPEG 18080, MPEG 18081, MPEG 18082, MPEG 18083, MPEG 18084, MPEG 18085, MPEG 18086, MPEG 18089, MPEG 18096, MPEG 18108, MPEG 18109, MPEG 18124, 0° 38' 24" S, 48° 51' 16" W; Liophis lineatus ( n= 16): CACHOEIRA DO ARAÍ: Baixa do Alecrim, MPEG 286, MPEG 287,MPEG 288, MPEG 3261, MPEG 3262, 1° 10' 0" S, 48° 50' 0" W; Fazenda Curralinho, MPEG 16935, 0° 32' 10" S, 49° 11' 3" W; Ilha de Santa Cruz, MPEG 768, 0° 48' 42" S, 49° 0' 8" W; Taperebá, Fazenda Santa Maria (Rio Goiapi), MPEG 18684, 0° 58' 0" S, 48° 57' 0" W**; CHAVES: Área urbana de Chaves, MPEG 21180, 0° 9' 40" S, 49° 59' 18" W; Fazenda Tijucaquara (Igarapé Tijucaquara), MPEG 17723, 0° 14' 16" S, 49° 20' 8" W; SANTA CRUZ DO ARAÍ: MPEG 19616, 0° 39' 54" S, 49° 10' 22" W; Vila dos Mocoons, MPEG 24411, 0° 38,848' 0" S, 49° 27,964' 0" W; SOURE: Fazenda Aruã, MPEG 18058, MPEG 18072, MPEG 18073, MPEG 18074, 0° 38' 24" S, 48° 51' 16" W; Liophis meridionalis (n= 2): PONTA DE PEDRAS: Sítio Santana (Rio Quiãparaná), MPEG 20815, MPEG 20816, 1° 20' 36" S, 48° 58' 17" W; Liophis poecilogyrus (n= 94): CACHOEIRA DO ARAÍ: Comunidade do Jabuti, MPEG 18324, 0° 57' 12" S, 48° 41' 45" W; Fazenda Boa Esperança (Ilha da Roça), MPEG 18010, MPEG 18149, MPEG 18150, MPEG 18151, 0° 52' 3" S, 48° 57' 55" W; Fazenda Curralinho, MPEG 16934, 0° 32' 10" S, 49° 11' 3" W; Fazenda Santo Antônio (Rio da Sé), MPEG 16534, MPEG 16535, MPEG 16536, 1° 0' 49" S, 48° 40' 7" W; Fazenda Tia Bita, MPEG 643, 1° 1' 0" S, 48° 58' 0" W; Fazenda Tuyuyu (Rio Ararí), MPEG 18166, MPEG 18167, MPEG 18168, MPEG 18169, MPEG 18170, MPEG 18171, MPEG 18172, MPEG 18173, MPEG 18174, 0° 49' 12" S, 49° 8' 59" W; Ilha de Santa Cruz, MPEG 766, MPEG 767, 0° 48' 42" S, 49° 0' 8" W; Localidade da Sé(Campinha), MPEG 18312, MPEG 18314, MPEG 18316, MPEG 18322, 1° 0' 49" S, 48° 40' 7" W**; CHAVES: Igarapé Taperebá, MZUSP3617, 0° 13' 34" S, 48° 59' 6" W; MUANÁ: Berta Grande, Fazenda Socorro (Rio Atuá), MPEG 21204, 1° 15,407' 0" S, 49° 19,033' 0" W; Fazenda São João, MPEG 24064 1° 5' 44" S, 49° 19' 18" W; Fazenda São Miguel (Rio São Miguel), MPEG 19644, 1° 12' 40" S, 49° 27' 4" W; PONTA DE PEDRAS: São Joaquim (Rio Ararí), MPEG 3266, 0° 53' 47" S, 49° 3' 44" W; SALVATERRA: MPEG 18640, MPEG 18641, MPEG 18642, MPEG 18643, 0° 45' 37" S, 48° 31' 27" W; SOURE: Fazenda Aruã, MPEG 18030, MPEG 18031, MPEG 18032, MPEG 18033, MPEG 18034, MPEG 18035, MPEG 18036, MPEG 18037, MPEG 18038, MPEG 18039, MPEG 18040, MPEG 18041, MPEG 18042, MPEG 18047, MPEG 18048, MPEG 18049, MPEG 18050, MPEG 18051, MPEG 18052, MPEG 18053, MPEG 18055, MPEG 18056, MPEG 18062, MPEG 18063, MPEG 18064, MPEG 18067, MPEG 18069, MPEG 18075, MPEG 18076, MPEG 18079, MPEG 18087, MPEG 18088, MPEG 18090, MPEG 18091, MPEG 18092, MPEG 18093, MPEG 18094, MPEG 18095, MPEG 18097, MPEG 18098, MPEG 18099, MPEG 18101, MPEG 18102, MPEG 18106, MPEG 18110, MPEG 18111, MPEG 18112, MPEG 18113, MPEG 18114, MPEG 18116, MPEG 18117, MPEG 18118, MPEG 18119, MPEG 18120, MPEG 18121, 209 MPEG 18122, MPEG 18123, MPEG 18125, 0° 38' 24" S, 48° 51' 16" W; Fazenda Bacuri, MPEG 16825, MPEG 16826, 0° 15' 54" S, 48° 29' 37" W; Liophis reginae (n= 9): BREVES: Km 4 da estrada Breves-Corcovado, MPEG 17366, 1° 38' 22" S, 50 29' 29" W; Km 6,5 da PA-159 (Estrada Breves-Anajás), MPEG 17365, 1° 38' 35" S, 50 27' 16" W; Comunidade Tancredo Neves, MPEG 18287, 1° 34' 16" S, 50 25' 0" W; CACHOEIRA DO ARAÍ: Comunidade Bacuri (Marajateua), MPEG 18321, 1° 1' 9" S, 48° 40' 54" W; Fazenda Tuyuyu (Rio Ararí), MPEG 18165, 0° 49' 12" S, 49° 8' 59" W; CHAVES: Fazenda Tauari (Baixo rio Cururu), MPEG 24959, 0° 24,72' 0" S, 49° 58,41' 0" W; PONTA DE PEDRAS: São Joaquim (Rio Ararí), MPEG 3263, 0° 53' 47" S, 49° 3' 44" W; ANAJÁS: Rio Anajás-Mirim, MPEG 19331, 1° 7' 24" S, 49° 34' 45" W; Liophis taeniogaster (n= 34): ANAJÁS: Sitio Caracarai, MPEG 19328, 0° 59' 14" S, 49° 56' 26" W**; Vila Aramá, MPEG 322, 0° 59' 0" S, 49° 57' 0" W; BREVES: Comunidade Tancredo Neves, MPEG 18288, 1° 34' 16" S, 50 25' 0" W; Km 6 da PA159 (Estrada Breves-Anajás), MPEG 17346, 1° 38' 35" S, 50 27' 16" W; CACHOEIRA DO ARAÍ: Fazenda Boa Esperança (Ilha da Roça), MPEG 18148, MPEG 18152, MPEG 18153, MPEG 18154, 0° 52' 3" S, 48° 57' 55" W; Ilha de Santa Cruz, MPEG 769, 0° 48' 42" S, 49° 0' 8" W; CHAVES: Fazenda Tauari (Baixo rio Cururu), MPEG 24955, MPEG 24956, 0° 24,72' 0" S, 49° 58,41' 0" W; Igarapé Taperebá, MZUSP3603, MZUSP3604, 0° 13' 34" S, 48° 59' 6" W; Trilha do Campo Arapapá, MPEG 21173, MPEG 21174, MPEG 21176, 0° 12' 18" S, 49° 59' 1" W**; MUANÁ: Fazenda São João, MPEG 21748, MPEG 21749, MPEG 21750, MPEG 21751, 1° 5' 44" S, 49° 19' 18" W; Manguba do Branco Velho, MPEG 19643, 1° 31' 40" S, 49° 13' 2" W**; PONTA DE PEDRAS: São Joaquim (Rio Ararí), MPEG 3264, 0° 53' 47" S, 49° 3' 44" W; SANTA CRUZ DO ARAÍ: MPEG 19622, MPEG 19623, MPEG 19624, 0° 39' 54" S, 49° 10' 22" W; SOURE: Fazenda Aruã, MPEG 18077, MPEG 18100, MPEG 18103, MPEG 18104, MPEG 18105, MPEG 18107, MPEG 18115, 0° 38' 24" S, 48° 51' 16" W; Fazenda São Lourenço (Rio Paracauari), MPEG 18132, 0° 39' 27" S, 48° 38' 21" W; Praia do Pesqueiro, MPEG 18361 0° 39' 23" S, 48° 29' 20" W; Liophis typhlus (n= 2): MUANÁ: Fazenda São Miguel (Rio São Miguel), MPEG 19329, 1° 12' 40" S, 49° 27' 4" W; SALVATERRA: Taperiaçú, MPEG 18422, 0° 45' 37" S, 48° 31' 27" W; Mastigodryas bifossatus (n= 3): CACHOEIRA DO ARAÍ: Fazenda Curralinho, MPEG 16936, 0° 32' 10" S, 49° 11' 3" W; Fazenda Santo Antônio (Rio da Sé), MPEG 16531, 1° 0' 49" S, 48° 40' 7" W; Ilha de Santa Cruz, MPEG 770, 0° 48' 42" S, 49° 0' 8" W; Mastigodryas boddaerti (n= 3): BREVES: Km 3 da Estrada Breves-Corcovado, MPEG 17367, 1° 39' 47" S, 50 27' 41" W; SALVATERRA: Caldeirão, MPEG 18343,MPEG 18345, 0° 43' 52" S, 48° 31' 36" W; Micrurus filiformis(n= 4): BREVES: MZUSP5095, 1° 41' 0" S, 50 28' 0" W; Km 5 da estrada Breves-Corcovado, MPEG 17340, 1° 38' 34" S, 50 29' 59" W; CACHOEIRA DO ARAÍ: Pedras (Rio Caracará), MPEG 18136, 1° 7' 6" S, 48° 44' 5" W; CHAVES: Fazenda Tauari (Baixo rio Cururu), MPEG 24958, 0° 24,72' 0" S, 49° 58,41' 0" W; Micrurus hemprichii (n= 2): ANAJÁS: Igarapé Mirundé (Rio Guajará), MPEG 20042, 0° 40' 41" S, 49° 59' 4" W**; CHAVES: Fazenda Tauari (Baixo rio Cururu), MPEG 24957, 0° 25,065' 0" S, 49° 58,09' 0" W; Micrurus surinamensis (n= 1): BREVES: Km 6 da PA-159 (Estrada Breves-Anajás), MPEG 17336, 1° 38' 35" S, 50 27' 16" W; Oxybelis aeneus (n= 2): BREVES: Km 6 da 210 PA-159 (Estrada Breves-Anajás), MPEG 17335, 1° 38' 35" S, 50 27' 16" W; CHAVES: Igarapé Taperebá, MZUSP3608, 0° 13' 34" S, 48° 59' 6" W; Oxybelis fulgidus (n= 5): BREVES: Comunidade Tancredo Neves, MPEG 18285, 1° 34' 16" S, 50 25' 0" W; Km 6 da PA-159 (Estrada Breves-Anajás), MPEG 17339, MPEG 17368, 1° 38' 35" S, 50 27' 16" W; MUANÁ: Berta Grande, Fazenda Socorro (Rio Atuá), MPEG 21206, 1° 15' 43" S, 49° 18' 59" W; SALVATERRA: Caldeirão, MPEG 18344, 0° 43' 52" S, 48° 31' 36" W; Oxyrhopus melanogenys (n= 1): PONTA DE PEDRAS: São Joaquim (Rio Ararí), MPEG 3265, 0° 53' 47" S, 49° 3' 44" W; Philodryas argentea(n= 4): BREVES: Estrada Breves-Anajás: Km 5 da PA-159, MPEG 17359, MPEG 17360, MPEG 17361, 1° 39' 4" S, 50 26' 54" W; Km 6 da PA-159, MPEG 17358, 1° 38' 35" S, 50 27' 16" W; Km 7 da PA-159, MPEG 17343, 1° 38' 7" S, 50 27' 28" W; Pseudoboa coronata (n= 4): BREVES: Comunidade Tancredo Neves, MPEG 18284, 1° 34' 16" S, 50 25' 0" W; Sítio do Sr. Valdir, MPEG 24409, 1° 33' 49" S, 50 23' 37" W; CACHOEIRA DO ARAÍ: Localidade da Sé, MPEG 18313, 1° 0' 49" S, 48° 40' 7" W**; CHAVES: Fazenda Tauari (Baixo rio Cururu), MPEG 24961, 0° 24,72' 0" S, 49° 58,41' 0" W; Psomophis joberti (n= 6): CACHOEIRA DO ARAÍ: Comunidade Bacuri (Marajateua), MPEG 18320, 1° 1' 9" S, 48° 40' 54" W; MUANÁ: Berta Grande, Fazenda Socorro (Rio Atuá), MPEG 21203, 1° 15,728' 0" S, 49° 18,985' 0" W; SALVATERRA: MPEG 20795, MPEG 20796, 0° 46' 5" S, 48° 30' 43" W; Pousada dos Guarás, MPEG 20818, MPEG 20819, 0° 46' 5" S, 48° 30' 43" W**; Siphlophis cervinus (n= 1): MUNICIPALITY UNREGISTERED, MPEG 19841, coordenada não obtida; Siphlophis compressus (n= 1): BREVES: Comunidade Tancredo Neves, MPEG 18286, 1° 34' 16" S, 50 25' 0" W; Taeniophallus quadriocellatus (n= 2): BREVES: MPEG 20487, 1° 40' 56" S, 50 28' 50" W; Km 6 da PA-159 (Estrada Breves-Anajás), MPEG 17362, 1° 38' 35" S, 50 27' 16" W; Thamnodynastes lanei (n= 3): CACHOEIRA DO ARAÍ: Fazenda Santo Antônio (Rio da Sé), MPEG 16532, 1° 0' 49" S, 48° 40' 7" W; Localidade da Sé, MPEG 18311, 1° 0' 49" S, 48° 40' 7" W**; CHAVES: Fazenda Tijucaquara (Igarapé Tijucaquara), MPEG 17715, 0° 14' 16" S, 49° 20' 8" W; Thamnodynastes sp. (n= 13): PONTA DE PEDRAS: Sítio Chapéu Virado (Rio Quiãparaná), MPEG 20808, MPEG 20809, 1° 20' 36" S, 48° 58' 17" W; Sítio Santa Maria (Rio Quiãparaná), MPEG 20810, MPEG 20811, 1° 20' 36" S, 48° 58' 17" W; SALVATERRA: MPEG 18639, 0° 45' 37" S, 48° 31' 27" W; SANTA CRUZ DO ARAÍ: MPEG 19615, 0° 39' 54" S, 49° 10' 22" W; CACHOEIRA DO ARAÍ: MPEG 16422, 1° 0' 15" S, 48° 57' 26" W; Comunidade do Jabuti, MPEG 18327, 0° 57' 12" S, 48° 41' 45" W; Fazenda Santo Antônio (Rio da Sé), MPEG 16533, 1° 0' 49" S, 48° 40' 7" W**; Localidade da Sé(Campinha), MPEG 18310, 1° 0' 49" S, 48° 40' 7" W**; MUANÁ: Caiçara (Rio Atuá), MPEG 21200, MPEG 21201, 1° 14,358' 0" S, 49° 22,329' 0" W; Parque de Nazaré Ramos, Igarapé Tuerananduba (Rio Atuá), MPEG 21202, 1° 12' 50" S, 49° 19' 25" W; Typhlops reticulatus (n= 4): CACHOEIRA DO ARAÍ: Fazenda Boa Esperança (Ilha da Roça), MPEG 18011, MPEG 18015, 0° 52' 3" S, 48° 57' 55" W; Fazenda Tauari (Baixo rio Cururu), MPEG 23581, MPEG 23582,0° 24,72' 0" S, 49° 58,41' 0" W. * Exemplar ainda não tombado na Coleção Herpetológica do MPEG. ** Coordenada aproximada. 211 ANEXO II Composição de espécies (presença e ausência) das taxocenoses incluídas nas análises de coordenadas principais e de agrupamento. Legenda: FLMJ= Área florestada de Marajó; AAMJ= Área aberta de Marajó; MARJ= Ilha de Marajó (toda a ilha); AORI= Amazônia oriental (FLONA de Caxiuanã e áreas adjacentes, PA, Maschio, 2008); ACEN= Amazônia central (Reserva Duke, AM, Martins e Oliveira, 1999); ASUD= Sudeste da Amazônia, RO, Espigão do Oeste, Bernarde e Abe, 2006); AGUI= Amazônia Guianense (Guiana Francesa, Starace, 1998); TACE = Transição Amazôniacerrado (Querência, MT, Abe, 2010); CEIT= Cerrado no Sudeste do Brasil (Itirapina, SP, Sawaya et al., 2008); CAAT= Caatinga (Exu, PE, Vitt e Vangilder, 1983); CEPI= Cerrado no Nordeste do Brasil (Parque Nacional de Sete Cidades, PI, Rocha e Prudente, 2010); TCCA= Transição Cerrado-caatinga (Castelo do Piauí, PI, Rodrigues e Prudente, 2011); PANT= Pantanal brasileiro ( Poconé, MT, Strussmann e Sazima, 1993). MARJ AORI ACEN ASUD AGUI TACE CEIT CAAT TCCA CEPI PANT Anilius scytale Apostolepis cearensis Apostolepis dimidiata Apostolepis flavotorquata Apostolepis nigrolineata Atractus albuquerquei Atractus alphonsehogei Atractus badius Atractus caxiuana Atractus flammigerus Atractus latifrons Atractus major Atractus natans Atractus pantostictus Atractus poeppigi Atractus schach Atractus snethlageae Atractus torquatus Atractus trilineatus Atractus zidoki Boa constrictor Boiruna maculata Bothriopsis bilineata Bothriopsis taeniata Bothropoides lutzi Bothropoides neuwiedi Bothropoides pauloensis Bothrops alternatus Bothrops atrox Bothrops brazili AAMJ Espécies FLMJ Taxocenoses 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 1 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 1 0 0 0 0 1 0 0 0 0 0 0 0 1 0 1 0 0 0 1 0 0 0 1 0 0 1 1 0 0 1 1 0 0 0 1 0 0 1 0 0 0 0 1 1 1 0 0 0 0 0 1 0 0 0 1 1 0 0 1 1 1 1 1 0 1 0 0 0 0 0 0 0 1 0 1 0 0 0 0 1 0 0 0 0 1 0 0 0 0 0 1 0 0 0 1 0 1 0 0 0 0 0 1 0 1 0 0 0 0 0 0 1 0 1 1 0 0 0 0 1 0 0 0 1 1 0 1 1 0 0 0 0 1 1 1 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 1 0 0 1 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 1 1 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 1 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 1 0 0 0 0 212 Bothrops marajoensis Bothrops moojeni Chironius carinatus Chironius exoletus Chironius flavolineatus Chironius fuscus Chironius laurenti Chironius multiventris Chironius quadricarinatus Chironius scurrulus Clelia bicolor Clelia clelia Corallus caninus Corallus hortulanus Crotalus durissus Dendrophidion dendrophis Dipsas catesbyi Dipsas copei Dipsas indica Dipsas pavonina Dipsas variegata Drepanoides anomalus Drymarchon corais Drymobius rhombifer Drymoluber dichrous Epictia tenellus Epicrates cenchria Epicrates cenchria assis Epicrates maurus Epictia collaris Epictia diaplocius Erythrolamprus aesculapii Eunectes deschauenseei Eunectes murinus Eunectes notaeus Helicops angulatus Helicops hagmanni Helicops leopardinus Helicops modestus Helicops polylepis Helicops trivittatus Hydrodynastes bicincutus Hydrodynastes gigas Hydrops martii Hydrops triangularis Imantodes cenchoa Imantodes lentiferus Lachesis muta Leptodeira annulata Leptomicrurus collaris Leptophis ahaetulla Liophis almadensis 0 0 0 1 0 1 0 0 0 0 0 0 0 1 0 1 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 1 1 0 0 1 0 0 0 1 0 1 0 1 1 0 1 0 0 0 1 1 0 0 0 1 0 0 0 1 0 0 1 0 0 0 0 0 0 1 1 0 0 0 0 0 1 0 0 0 1 1 0 1 0 1 0 1 1 0 1 0 0 1 0 0 1 0 1 1 1 0 1 1 1 1 0 1 0 0 0 1 0 1 1 1 0 0 1 0 0 1 1 0 0 0 1 0 1 0 0 0 1 1 0 1 1 1 0 1 1 0 1 1 0 1 0 1 1 0 1 1 0 0 1 1 0 1 0 1 0 1 0 1 1 1 0 1 1 0 1 0 0 1 1 0 1 0 1 0 0 0 0 1 0 1 0 1 1 1 0 1 1 0 1 1 1 1 0 1 1 0 1 0 0 0 0 0 0 1 0 1 0 1 0 1 1 1 0 1 0 0 1 1 0 1 0 0 1 0 1 0 0 0 1 1 0 1 0 1 1 0 0 0 0 0 0 0 0 1 0 1 1 1 1 0 0 0 0 1 0 0 0 1 0 1 0 0 1 1 0 1 1 0 1 1 0 1 1 1 1 0 1 0 0 0 0 1 0 1 0 1 0 0 0 0 0 0 1 0 0 1 0 1 1 0 1 1 0 0 1 1 0 1 0 1 0 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 0 1 1 1 0 1 0 1 0 0 0 1 1 0 1 1 1 1 1 1 1 0 0 1 0 1 0 0 1 0 0 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 1 0 0 0 0 0 0 0 0 1 1 0 1 0 0 0 1 0 1 0 0 1 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 1 0 0 0 0 1 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 1 0 213 0 1 0 0 0 0 0 0 1 0 1 1 0 0 1 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 1 0 0 1 0 0 0 0 1 0 0 0 0 0 0 0 1 1 Liophis breviceps Liophis cobella Liophis jaegeri Liophis lineatus Liophis meridionalis Liophis miliaris Liophis mossoroensis Liophis paucidens Liophis poecilogyrus Liophis reginae Liophis taeniogaster Liophis typhlus Liophis viridis Liotyphlops beui Masticophis mentovarius Mastigodryas bifossatus Mastigodryas boddaerti Micrurus averyi Micrurus filiformis Micrurus frontalis Micrurus hemprichii Micrurus ibiboboca Micrurus lemniscatus Micrurus lemniscatus diutos Micrurus paraensis Micrurus psyches Micrurus spixii Micrurus surinamensis Micrurus tricolor Ninia hudsoni Oxybelis aeneus Oxybelis fulgidus Oxyrhopus formosus Oxyrhopus guibei Oxyrhopus melanogenys Oxyrhopus petolarius Oxyrhopus rhombifer Oxyrhopus trigeminus Phalotris lativittatus Phalotris mertensi Phalotris multipunctatus Phalotris nasutus Philodryas aestiva Philodryas argentea Philodryas laticeps Philodryas livida Philodryas nattereri Philodryas olfersii Philodryas patagoniensis Philodryas viridissima Phimophis guerini Phimophis guianensis 0 0 0 0 0 0 0 0 0 1 1 0 0 0 0 0 1 0 1 0 1 0 0 0 0 0 0 1 0 0 1 1 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 1 0 0 0 0 0 1 1 0 0 0 1 1 1 1 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 1 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 1 0 0 0 1 1 1 1 0 0 0 1 1 0 1 0 1 1 0 0 0 0 1 1 0 0 1 1 0 0 1 0 0 1 0 0 0 0 0 1 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 1 1 0 0 0 0 0 1 0 1 0 1 0 1 0 0 0 1 1 0 0 1 1 1 0 1 1 0 0 0 0 0 0 0 1 0 0 0 0 0 1 0 0 1 0 0 0 0 0 0 0 0 1 0 1 0 0 0 0 1 1 0 0 1 0 1 0 0 0 1 1 0 0 1 1 1 0 1 0 0 0 0 0 0 0 0 1 0 0 0 0 0 1 0 0 1 0 0 0 0 0 0 0 0 1 0 0 0 0 1 0 1 0 0 0 1 0 0 0 0 0 1 1 0 1 0 1 0 0 1 1 0 0 0 0 0 0 0 1 0 0 0 1 0 0 0 0 1 1 0 1 0 1 0 0 0 1 0 1 0 0 0 1 1 0 0 0 1 0 1 1 0 1 0 1 0 0 1 1 1 0 1 1 0 0 0 0 0 0 0 1 1 0 0 1 0 1 0 1 0 0 0 0 0 0 0 0 0 1 1 0 0 1 0 0 1 0 0 0 0 0 0 0 1 0 0 1 0 0 0 0 0 0 0 1 0 0 0 0 0 1 0 0 0 0 1 1 0 1 0 0 0 0 1 0 1 0 0 0 1 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 1 0 1 1 1 0 1 0 0 1 0 1 1 0 1 0 0 0 0 1 0 0 1 0 1 0 0 0 1 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 0 0 1 1 0 0 0 1 0 0 1 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 1 0 0 0 1 0 0 0 0 1 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 1 1 0 0 0 0 214 0 0 0 0 0 0 0 0 1 1 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 Phimophis Iglesias Pseudablades agassizii Pseudoboa coronata Pseudoboa neuwiedii Pseudoboa nigra Pseudoeryx plicatilis Pseustes poecilonotus Pseustes sulphureus Psomophis joberti Rhachidelus brazili Rhinobothrium lentiginosum Rhinocerophis itapetiningae Siagonodon septemstriatus Sibon nebulata Sibynomorphus mikanii Simophis rhinostoma Siphlophis cervinus Siphlophis compressus Siphlophis worontzowi Spilotes pullatus Taeniophallus brevirostris Taeniophallus nicagus Taeniophallus occipitalis Taeniophallus quadriocellatus Tantilla melanocephala Thamnodynastes hypoconia Thamnodynastes lanei Thamnodynastes pallidus Thamnodynastes strigilis Tomodon dorsatus Tricheilostoma macrolepis Trilepida koppesi Typhlophis squamosus Typhlops brongersmianus Typhlops reticulatus Umbrivaga pygmaea Xenodon merremii Xenodon nattereri Xenodon rhabdocephalus Xenodon severus Xenodon werneri Xenopholis scalaris Xenopholis undulatus Total de espécies 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 30 35 0 0 1 0 0 0 0 0 1 0 0 0 0 0 0 0 1 1 0 1 0 0 0 1 1 0 1 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 61 0 0 0 0 1 1 0 1 0 0 1 0 1 1 1 1 0 0 0 0 1 1 0 0 1 0 0 0 0 0 0 0 1 1 1 1 0 0 1 1 1 1 0 1 1 0 1 0 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 1 0 1 0 0 0 0 1 1 0 0 0 0 1 1 0 0 70 64 0 0 0 0 0 0 1 0 0 0 1 0 0 0 0 0 0 1 1 1 0 0 1 0 1 0 0 0 0 0 1 0 0 0 1 0 0 0 1 1 0 1 0 55 0 0 0 0 1 0 1 0 0 1 1 0 1 1 1 0 0 0 0 0 1 0 0 0 1 0 1 0 0 1 0 0 1 0 1 0 0 0 1 1 1 0 0 0 0 0 0 0 1 1 0 0 0 0 1 0 1 0 1 0 1 0 0 0 1 0 0 0 1 1 0 0 1 0 0 0 1 1 1 1 1 0 1 0 0 0 95 34 0 1 0 0 0 0 0 0 0 1 0 1 0 0 1 1 0 0 0 0 0 0 1 0 1 1 0 0 0 0 0 1 0 0 0 0 1 1 0 0 0 0 0 36 0 1 0 0 0 0 0 0 1 1 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 0 0 0 17 17 0 0 0 0 0 0 0 0 1 1 0 1 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 1 0 0 0 1 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 1 22 23 215
Download