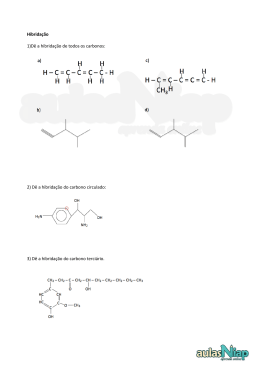
Moléculas deficientes em e-’s TEV BeCl2 Be 2s2 2px0 2py0 2pz0 Be (sp)1(sp)1py0pz0 Cl 3s2 3py2 3pz2 3px1 Duas ligações σ: (sp)Be1 – (px)Cl1 TRPECV: 2 pares de e-’s em volta do Be (2×1 + 2)/2 2 orbitais p vazias (Be) z Geometria linear y pz py 2 direcções com pares de e-’s x sp sp sp px sp px sp x Cl T elevadas (750 ºC) Be Cl BeCl2 a T inferiores… Cl 3s2 3py 3pz 3px 2 2 TEV 1 Be (sp2)1(sp2)1(sp2)0px0 Para cada Be: Cl Duas ligações σ: (sp2)Be1 – (px)Cl1 p Cl Uma ligação σ: Be (sp2)Be0 – (pz)Cl2 (dativa) Cl Cl Cl Cl Be Cl Be sp 2 Be Cl Cl O Be ainda fica com uma orbital p vazia… Cl Be Be Cl Cl BeCl2 No estado sólido… 3s2 Cl 3py 3pz 3px 2 2 TEV 1 Be (sp3)1(sp3)1(sp3)0(sp3)0 Para cada Be: Duas ligações σ: (sp3)Be1 – (px)Cl1 Duas ligações σ: (sp3)Be0 – (pz)Cl2 (dativas) Cl Cl Cl Be Cl Be Be Cl Cl Be Cl Be Cl Moléculas deficientes em e-’s TEV “BH3” B 2s2 2px1 2py0 2pz0 H 1s1 TRPECV: 3 pares de e-’s em volta do B (3×1 + 3)/2 B (sp2)1(sp2)1(sp2)1pz0 Três ligações σ: (sp2)B1 – (1s)H1 1 orbital p vazia (B) z Geometria triangular plana 2pz H 3 direcções com pares de e-’s H 1s sp2 H sp2 BH3 + H− → BH4− (tetraédrico: sp3) xy … ou dimerização: B2H6 TEV B (sp3)1(sp3)1(sp3)1(sp3)0 B tetraédrico (sp3) 1s 1,192A H 96,5º B H H 1,329A 1s sp3 H H B sp3 sp3 H 1s sp3 1s Ligações deficientes em e-’s: 2 e-’s para 2 ligações B–H está melhor, mas continua deficiente… … muito reactivo: ácido de Lewis. B2H6 TEV Formas canónicas (contributores de ressonância): H H H B B H H (~3:1) H H H B H IV B - H III + H H H H H V + H H B- B- B H H H H II + H - H H H B+ B H H H H B I H B H H H H B H IV etc H B2H6 TEV Reacção ácido-base H H B 2 L H H H B B H H H + 2L p.e. L = N(CH3)3 (cisão simétrica) H ou + H B H L H L H H − B H (cisão não simétrica) p.e. L = NH3 B2H6 – ácido de Lewis L – base de Lewis (L:) BX3 TEV B 2s2 2px1 2py0 2pz0 B (sp2)1(sp2)1(sp2)1pz0 X ns2 npy2 npz2 npx1 Três ligações σ: (sp2)B1 – (px)X1 TRPECV: 3 pares de e-’s em volta do B (3×1 + 3)/2 1 orbital p vazia (B) 2pz Geometria triangular plana 3 direcções com pares de e-’s sp2 z sp2 X tem orbitais p completamente preenchidas (perp. ao eixo B–X) z π X σ X B x X BX3 TEV B 2s2 2px1 2py0 2pz0 B (sp2)1(sp2)1(sp2)1pz0 X ns2 npy2 npz2 npx1 Três ligações σ: (sp2)B1 – (px)X1 Uma ligação π (dativa): (pz)X2 – (pz)B0 2pz sp2 z z π X tem orbitais p completamente preenchidas (perp. ao eixo B–X) X σ X B x X Qual dos X? BX3 TEV … são todos equivalentes… Ressonância X X + B + X X - - X B X X B X X + Ligação B–X : 1 σ + 1/3 π X X - + B X X X - + X X B X (X muito electronegativo…) B + X - BX3 TEV … continua a ser deficiente em e-’s: Ácido de Lewis F F F B + F- B F F H F B B F - F F F + N H H H F F F B N H H ligações π são mais fracas que as σ C3H5 molécula plana H H 1,386 A H 117,46º C H C C 125,08º H H H sp2 H C 1s 3 direcções – sp2 sp2 C (sp2)1(sp2)1(sp2)1pz1 C sp2 C 1s H H 2 lig. σ (sp2)C1 – (1s)H1 1 lig. σ (sp2)C1 – (sp2)C1 H H C H TEV 1 lig. σ (sp2)C1 – (1s)H1 2 lig. σ (sp2)C1 – (sp2)C1 C H C H 1 orbital p em cada C (perp. ao plano da molécula) C3H5 TEV Ressonância C C C C C Lig. C–C: 1 σ + ½ π H H C H C H C H 1 orbital p em cada C (perp. ao plano da molécula) C C6H6 TEV molécula plana H H C C H H H C C H H C C C H H H H H 3 direcções – sp2 C (sp2)1(sp2)1(sp2)1pz1 1 lig. σ (sp2)C1 – (1s)H1 2 lig. σ (sp2)C1 – (sp2)C1 1 orbital p em cada C (perp. ao plano da molécula) C6H6 TEV Dewar Kekulé Iónicas (c/ separação de cargas) - - + + + Lig. C–C: 1 σ + ½ π Ligações π: deslocalizadas pelos 6 C’s! Método de escrita de formas canónicas para sistemas π conjugados “Fluir” de e-’s muito usado em Química Orgânica − + − − + + Método de escrita de formas canónicas para sistemas π conjugados “Fluir” de e-’s muito usado em Química Orgânica − − + + + − Ligações π e pares não partilhados NH2 NH2 Não tem significado físico para as formas canónicas, mas vai ter nos mecanismos de reacções!!! Compostos hipervalentes TEV “Regra do octeto” PCl5 SF6 BrF5 PF6− I3− Grupo 15 X ns2 np3 Pirâmide trigonal A sp3 ex.: NH3 X ns X np X ns1 np3 nd1 X X A X X ns np nd Bipirâmide trigonal dsp3 ex.: PCl5 Grupo 16 ns2 np4 Angular A sp3 ex.: H2O X ns np X X ns2 np3 nd1 Tetraédrica irregular X A ns np nd X ex.: SF4 dsp3 X ns1 np3 nd2 X Octaédrica X ns np nd X A X X X d2sp3 ex.: SF6 … resumindo e baralhando… Estruturas de Lewis 1. Definir a estrutura da molécula (2D) TEV õ Ät vtÜàx TRPECV 2. Prever a geometria em torno de cada átomo não periférico (3D) - Não esquecer os pares de e-’s não partilhados. - Determinar os ângulos de ligação. TEV 3. Caracterizar completamente todos os e-’s de valência 3.1 Localizar os pares não partilhados 3.2 Caracterizar cada ligação A-B, na molécula: - hibridação dos átomos não periféricos - orbitais envolvidas, para cada átomo (orbX)A- (orbY)B - proveniência dos e-’s - simetria da ligação (σ ou π) 3.3 Verificar a existência de ressonância e escrever as respectivas estruturas. ex.: C4H6O (metilvinilcetona)
Download