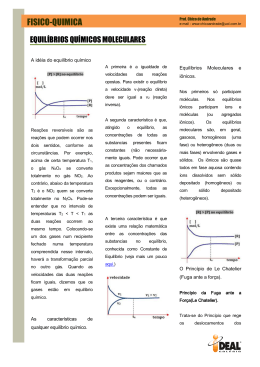
Deslocamento de Equilíbrio QF - 11 Para deslocar o equilíbrio químico de uma reação, podemos alterar a temperatura, a concentração das substâncias e a pressão, e consequentemente, a velocidade das reações envolvidas. Variação da concentração No estudo cinético das reações químicas, vimos que a Vreação depende da concentração das espécies envolvidas. Portanto, se alterarmos a concentração das alteraremos a Vreação. substâncias presentes, Adição de um participante (reagente ou produto) O aumento da [N2], aumenta o número de colisões efetivas com o gás hidrogênio, consequentemente, a velocidade da reação direta (V1) também aumenta. Sendo assim, a formação da amônia é maior que a decomposição da mesma (V2). Posteriormente, V2 será maior que V1, até que as velocidades das reações direta e inversa se igualem. GRÁFICO, PÁGINA 46 Princípio de Le Chatelier Sempre que um fator externo perturbar um equilíbrio, este se modificará minimizar essa perturbação, de até modo que a seja atingido um novo estado de equilíbrio. “Princípio da fuga ante a força.” Nenhum dos deslocamentos de equilíbrio é capaz de alterar o valor numérico da constante de equilíbrio (Kc). O resultado é semelhante se, em vez de adicionarmos alguma substância, retirássemos algumas de suas moléculas. O equilíbrio sempre age de modo a compensar a perturbação sofrida. Variação da temperatura Quando estudamos cinética química, vimos que a variação da temperatura provoca alterações na energia cinética das moléculas. O aumento da temperatura resulta em maior frequência de choques e aumento da velocidade tanto da reação direta quanto da inversa. Após a alteração da temperatura, uma das duas reações (V1 ou V2) será mais acelerada que a outra, produzindo um deslocamento de equilíbrio. Variação da temperatura OBS 1: Se em um sentido a reação é exotérmica, no outro sentido será endotérmica. OBS 2: O aumento da temperatura desloca o equilíbrio no sentido da reação endotérmica e vice-versa. GRÁFICO, PÁGINA 47 1000 2,4.10-3 500 6,2.10 400 4,5.104 298 4,2.108 OBS 1: Nos equilíbrios em que a reação direta é endotérmica, um aumento da temperatura leva a um aumento no Kc. OBS 2: Nos equilíbrios em que a reação direta é exotérmica, um aumento da temperatura leva a uma diminuição no Kc. Variação de pressão Se aplica somente a sistemas em que há componentes gasosos. Pode-se alterar a pressão ao alterar o volume do sistema. Se diminuirmos o volume, a pressão aumenta e vice-versa. Variação de pressão Pelo princípio de Avogadro, quantidades iguais de quaisquer gases, nas mesmas condições de temperatura e pressão, ocupam volumes iguais. Variação de pressão Pelo princípio de Le Chatelier, se em um estado gasoso, a pressão sofrer um aumento, o equilíbrio deslocará para o lado com menor quantidade (em mols) de gás, isto é, com menor volume gasoso, a fim de compensar a elevação da pressão. Somente a variação de temperatura pode alterar o valor de uma constante de equilíbrio!!! Adição de catalisador Aumenta a velocidade das reações químicas; Diminuir a energia de ativação; Energia necessária para formar o complexo ativado é menor; O complexo ativado é o mesmo para reações direta e inversa, aumentando a velocidade de ambas reações. Portanto, o CATALISADOR NÃO DESLOCA EQUILÍBRIO!!! Resumindo Alteração de Operação executada Deslocamento Add reag 1 Concentração Retira reag 2 Não Add prod 2 altera Retira prod 1 Aumenta 1 (< V gasoso) Não Diminui 2 (> V gasoso) altera Aumenta 1 (endotérmico) aumenta Diminui 2 (exotérmico) diminui Pressão Temperatura Kc
Download