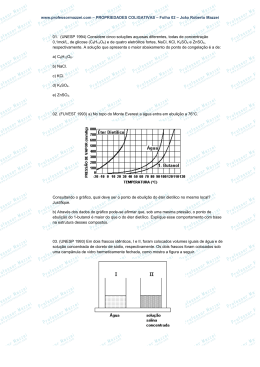
QUÍMICA Prof. Lessa AULA 01 – SÉRIE AULA 1. Sabendo que a pressão de vapor do solvente puro (água) é 0,18 mmHg e que a pressão de vapor do solvente na solução é Glicose 0,16 mmHg , pede-se: a) O abaixamento absoluto da pressão de vapor: Água pura Solução b) O abaixamento relativo da pressão de vapor: c) A fração molar da glicose na solução. d) O efeito coligativo (abaixamento relativo da pressão de vapor) pode ser calculado por Ecolig = Kt · W, onde Kt é a constante tonométrica e W a molalidade da solução. Calcule a Constante tonométrica e a molalidade para a solução anterior. 2. O abaixamento da pressão de vapor faz com que seja necessária uma temperatura mais elevada, para que um líquido entre em ebulição. A essa elevação de temperatura chamamos de efeito coligativo (ebuliometria ou ebulioscopia) e é calculado pela fórmula Ecolig = Ke · W. a) Calcule a elevação no ponto de ebulição e o novo ponto de ebulição, quando em nível do mar dissolvese 90g de glicose em 2L de água (2Kg). Dado: Ke = 0,52ºC/molal O abaixamento da temperatura de congelamento chamamos de efeito coligativo (criometria ou crioscopia) e é calculado pela fórmula Ecolig = Kc · W. b) Calcule abaixamento da temperatura de fusão/congelação e o novo ponto de fusão, quando em nível do mar dissolve-se 90g de glicose em 2 L de água (2Kg). Dado: Kc = 1,86 ºC/molal. 3. Os efeitos coligativos servem como métodos de determinação de pesos moleculares. 3,42 g de um soluto não iônico são dissolvidos em 100g de água. A solução ferveu a 100,052ºC. Qual o peso molecular do soluto? (dado: Ke = 0,52 ºC/molal) 4. (Unicamp - SP) As pressões de vapor dos líquidos A e B, em função da temperatura, estão representadas no gráfico. Pergunta-se: a) Sob pressão de 1,0 atm, qual a temperatura de ebulição de cada um desses líquidos? b) Qual dos líquidos apresenta maior pressão de vapor a 50 ºC ? Pressão (atm) A B 1,0 0,8 0,6 0,4 0,2 Temperatura (ºC) 0 5. (Fuvest - SP) As curvas de pressão do vapor éter dietílico (A) e do etanol (B) são dadas abaixo. a) Quais os pontos de ebulição dessas substâncias na cidade de São Paulo? (Dado: pressão atmosférica = 700 mmHg) b) A 500 mmHg a 50 ºC, qual é o estado físico de cada um dessas substâncias? Justifique. 800 700 10 20 30 40 50 60 70 A B 600 500 400 300 200 100 -10 0 10 20 30 40 50 60 70 80 1 Temperatura (ºC) AULA 02 – SÉRIE AULA 1. Como já vimos, solutos iônicos se dissociam produzindo um maior número de partículas em solução e aumentando o efeito coligativo. Para isso existe um fator de correção de Van’t Hoff (i), pelo qual se multiplica o resultado obtido para se ter o valor real. Para soluções iônicas a fórmula seria E colig = K·W·i Calcule o fator de correção de VAN’T HOFF [ i = 1 + (q – 1)] para as soluções abaixo: a) NaCl 80% dissociado. b) Ca3(PO4)2 0,3 % dissociado. c) Al2(SO4)3 d) C6H12O6 2. Para uma solução 2W de Ca(OH)2 30% dissociado, pede-se: a) O ponto de ebulição. (dado: Ke = 0,52 ºC/molal) b) O ponto de congelação. (dado: Kc = 1,86 ºC/molal) Pressão 3. (Fuvest - SP) O diagrama de fases abaixo se refere à água. Com base nesse diagrama, explique por que: a) O aumento de pressão favorece a fusão do gelo. b) Supõe-se que a água contida no cometa Halley passe diretamente de sólida a gasosa quando ele se aproxima do sol. líquido sólido vapor Temperatura(ºC) 4. (Fuvest - SP) Duas soluções aquosas, uma de glicose e outra de sacarose, contêm a mesma massa, em gramas, de soluto por litro de solução. a) Compare os valores dos pontos de congelamento dessas duas soluções com o da água pura. b) Qual das duas soluções apresentará o menor ponto de congelamento? Explique sua resposta. (Dado as massas molares: glicose = 180 g/ mol; sacarose = 342 g/mol) 5. (Fuvest - SP) Da mistura de soluções contendo igual número de mols de cloreto de bário e sulfato de sódio, obtém-se um precipitado de sulfato de bário e um líquido sobrenadante. a) Qual a composição do líquido sobrenadante? b) Compare sua temperatura de ebulição com a da água. AULA 03 – SÉRIE AULA 1. Sabe-se que osmose é a passagem de solvente de um meio menos concentrado para um meio mais concentrado através de uma membrana semipermeável, até que as soluções se tornem isotônicas. A pressão necessária para evitar a osmose chama-se pressão osmótica. Calcule a pressão osmótica de uma solução não iônica 0,1 mol/L a 227 ºC. Qual seria a diferença se o soluto fosse iônico? (Dado: R = 0,082) 2. Uma solução 0,3 mol/L de glicose é isotônica de uma solução 0,2 mol/L de KCl. Qual o grau de dissociação do KCl supondo as soluções na mesma temperatura? 3. (Fuvest - SP) Acredita-se que os cometas sejam “bolas de gelo” que, ao se aproximarem do sol, volatilizam-se parcialmente à baixa pressão do espaço. Qual das flechas do diagrama ao lado corresponde à transformação citada? Pressão a b H2O (líquido) d H2O (sólido) e H2O (gás) c Temperatura(ºC) 2 4. (Fuvest - SP) Qual das seguintes soluções aquosas, todas 1 mol/L, apresentaria o menor ponto de fusão: glicose, ácido acético ou cloreto de sódio? Justifique. 5. (Vunesp - SP) Em dois frascos idênticos, I e II, foram I II colocados volumes iguais de água e de solução concentrada de cloreto de sódio, respectivamente. Os dois frascos foram colocados sob uma campânula de vidro hermeticamente fechada, como mostra a figura. Após algum tempo, observou-se que o frasco I estava totalmente vazio e que no frasco II o volume havia dobrado, água solução salina contendo, portanto, uma solução diluída de cloreto de sódio. concentrada a) Explique por que ocorreu esse fenômeno. b) Explique o que acontece com o ponto de congelamento das soluções inicial e final de cloreto de sódio. Justifique sua resposta. GABARITO - AULA 01 – SÉRIE AULA 1. a) 0,02 b) 0,11 c) 0,11 2. a) 0,26 ºC b) 0,93 ºC 3. 342 u 4. a) aproximadamente 40 ºC e 60 ºC 5. a) 32 ºC e 70 ºC b) Líquido d) 0,018 e 6,11 b) Líquido “A” GABARITO - AULA 02 – SÉRIE AULA 1. a) 1,8 b) 1,012 c) 5 d) 1 2. a) 101,664 ºC b) –5,952 ºC 3. Em sala 4. a) as duas soluções apresentam ponto de congelamento inferior ao da água pura. b) solução de glicose. 5. + – a) no líquido sofrenadante existem íons Na e Cl , então trata-se de uma solução aquosa de NaCl. b) a temperatura de ebulição do líquido sobrenadante é maior que o da água pura. GABARITO - AULA 03 – SÉRIE AULA 1. 4,1 atm 2. 50% 3. a flecha “C”. 4. cloreto de sódio. 5. a) efeito tonométrico. b) o ponto de congelamento final será maior que o de congelamento inicial, pois a solução será mais diluída. SÉRIE CASA – AULA 01 TEXTO PARA A PRÓXIMA QUESTÃO: Conservação de alimentos é o conjunto dos métodos que evitam a deterioração dos alimentos ao longo de um determinado período. O objetivo principal desses processos é evitar as alterações provocadas pelas enzimas próprias dos produtos naturais ou por micro-organismos que, além de causarem o apodrecimento dos alimentos, podem produzir toxinas que afetam a saúde dos consumidores. Mas também existe a preocupação em manter a aparência, o sabor e conteúdo nutricional dos alimentos. Uma das técnicas utilizadas é a desidratação, em que se remove ou se diminui a quantidade de água no alimento, para evitar que sejam criadas condições propícias para o desenvolvimento dos micro-organismos, já que a água é essencial para que eles existam. O bacalhau e a carne-seca, por exemplo, são assim conservados com adição prévia de sal de cozinha, que desidrata o alimento por osmose. 3 1. G1 - cps 2012) Sobre o texto e o processo descrito é correto afirmar que a) o sal de cozinha apresenta fórmula molecular SoC. b) o alimento desidratado deve ser conservado em geladeira. c) a desidratação é um processo desaconselhável para conservação de peixes. d) na osmose ocorre passagem de água apenas para o meio menos concentrado. e) a osmose cria um ambiente desfavorável à sobrevivência dos micro-organismos. 2. (Fuvest 2013) A porcentagem em massa de sais no sangue é de aproximadamente 0,9%. Em um experimento, alguns glóbulos vermelhos de uma amostra de sangue foram coletados e separados em três grupos. Foram preparadas três soluções, identificadas por X, Y e Z, cada qual com uma diferente concentração salina. A cada uma dessas soluções foi adicionado um grupo de glóbulos vermelhos. Para cada solução, acompanhou-se, ao longo do tempo, o volume de um glóbulo vermelho, como mostra o gráfico. Com base nos resultados desse experimento, é correto afirmar que a) a porcentagem em massa de sal, na solução Z, é menor do que 0,9%. b) a porcentagem em massa de sal é maior na solução Y do que na solução X. c) a solução Y e a água destilada são isotônicas. d) a solução X e o sangue são isotônicos. e) a adição de mais sal à solução Z fará com que ela e a solução X fiquem isotônicas. 3. (Upe 2013) Leia. – Bom dia, disse um senhor ao se sentar em um banco de um quiosque à beira-mar. Depois, ele pediu: – Um caldinho de feijão, uma porção de salada, uma caipirinha e um pão de alho. Enquanto saboreava o seu pedido, puxou uma conversa com o pessoal e, ao longo do papo, fez os comentários indicados a seguir: I. As verduras de uma salada temperada com sal tendem a perder água e a murchar por causa do efeito osmótico. II. O açúcar (C12H22O11) adicionado nessa bebida é batido com cachaça, fatias de limão e gelo. Além de adoçá-la, por osmose, ele auxilia na extração do suco da fruta. III. O fermento biológico utilizado na preparação de pães, como esse, tem, em sua composição, bicarbonato de sódio, que libera CO2 no aquecimento do produto e faz a massa crescer. IV. O uso de panela de pressão faz, na produção do caldinho, o cozimento do feijão ser mais rápido, porque, ao se aumentar a pressão do sistema, ocorre a redução do ponto de ebulição da água. Após consumir todos os produtos, o cliente perguntou ao dono do quiosque: – Gostou da aula? Como sabe, estou me preparando para entrar na universidade. (E emendou...) Posso deixar no pendura, dessa vez? O dono do bar sorriu de ladinho e disse: – Eu até poderia deixar no fiado, principalmente pelo fato de o senhor, como sempre, só ter tomado uma caipirinha. Mas, como nem todas essas suas afirmativas estão corretas, ou o senhor paga a conta ou chamo aquele policial ali! (E deu uma risada) Depois, pegou uns livros, pediu que uma pessoa da cozinha assumisse o quiosque e, sorrindo, falou para o cliente: até mais, te espero na universidade. Boa sorte! Quais dos comentários do cliente do quiosque, citados acima, estão CORRETOS? a) I e II. b) I e III. c) I e IV. d) II e III. e) II e IV. 4 4. (Mackenzie 2012) A tabela contém os valores dos pontos de ebulição (P.E.) e a massa molar de alguns compostos orgânicos, todos sob a mesma pressão. Composto Nomenclatura P.E. Massa Molar (g/mol) A propano – 42,0 44 B metil-propano C dimetil-propano D n-butano 0,0 E metil-butano 30,0 F pentano 36,0 – 12,0 9,5 58 72 58 72 72 Observando a tabela, considere I, II, III e IV abaixo. I. A –45°C o composto A apresenta maior pressão de vapor em relação ao composto B. II. Quanto maior a massa molar de um alcano não-ramificado, maior será o seu ponto de ebulição. III. São isômeros de cadeia os compostos B, C e D. IV. A presença de ramificações diminui o ponto de ebulição dos compostos orgânicos que são isômeros de cadeia. Estão corretas, somente, a) I, II e III. b) II, III. c) I, II e IV. d) III e IV. e) II, III e IV. 5. (Enem 2012) Osmose é um processo espontâneo que ocorre em todos os organismos vivos e é essencial à manutenção da vida. Uma solução 0,15 mol/L de NaC (cloreto de sódio) possui a mesma pressão osmótica das soluções presentes nas células humanas. A imersão de uma célula humana em uma solução 0,20 mol/L de NaC tem, como consequência, a + a) absorção de íons Na sobre a superfície da célula. + b) difusão rápida de íons Na para o interior da célula. c) diminuição da concentração das soluções presentes na célula. + d) transferência de íons Na da célula para a solução. e) transferência de moléculas de água do interior da célula para a solução. SÉRIE CASA – AULA 02 1. (Uftm 2012) Três soluções aquosas de nitrato de sódio, nitrato de alumínio e glicose, com concentrações 0,5 mol/L, foram aquecidas em três béqueres, sob as mesmas condições ambientes, até a ebulição. As temperaturas das três soluções foram monitoradas com três termômetros devidamente calibrados. A solução que a 25 ºC apresenta maior pressão de vapor e a solução que apresenta maior temperatura de ebulição são, respectivamente, a) glicose e nitrato de alumínio. b) glicose e nitrato de sódio. c) nitrato de alumínio e glicose. d) nitrato de alumínio e nitrato de alumínio. e) nitrato de sódio e glicose. 5 2. (Ufrgs 2012) Assinale a alternativa que completa corretamente as lacunas do enunciado abaixo, na ordem em que aparecem. Uma sopa muito salgada é aquecida numa panela aberta. Nessas condições, a sopa deve entrar em ebulição numa temperatura ......... .. 100°C. Assim, à medida que a água da sopa evapora, a temperatura da sopa ............... . a) acima de – aumenta b) acima de – diminui c) abaixo de – aumenta d) igual a – permanece constante e) igual a – aumenta 3. (Ufsj 2012) Considere as soluções aquosas abaixo a uma pressão de 1,0 atm Solução A: 0,6 mol/L de glicose. Solução B: 0,1 mol/L de ácido nítrico. Solução C: 0,2 mol/L de cloreto de magnésio. Sobre essas soluções, é CORRETO afirmar que: a) as soluções A e C apresentam o mesmo ponto de congelamento. b) as três soluções apresentam ponto de ebulição abaixo de 100°C. c) a solução B apresenta o maior ponto de ebulição. d) a solução C é a que apresenta menor pressão de vapor. 4. (Uern 2012) Sabe-se que a concentração de uma solução aquosa de cloreto de magnésio MgC 2 é 70g/1000g, fervendo a uma temperatura de 100,76°C e com a constante ebuliométrica molal da água igual a 0,52°C. Qual o grau de ionização desta solução? a) 2. b) 1. c) 0,7. d) 0,5. 5. (Ufrn 2012) Sorvete em cinco minutos. Uma receita rápida, prática e que parece mágica para o preparo de um sorvete de morango recomenda o seguinte procedimento: Despeje o leite, o açúcar e a essência de morango num saco de plástico de 0,5 litro e certifique-se de que ele fique bem fechado. Coloque 16 cubos de gelo e 6 colheres de sopa de sal comum NaC num outro saco plástico de 1 litro. Insira o saco de 0,5 litro dentro do saco de 1 litro e feche muito bem. Agite as bolsas de plástico por 5 minutos e, após esse tempo, remova o saco de 0,5 litro de dentro do outro. Em seguida, corte um dos bicos inferiores do saco de 0,5 litro e despeje o sorvete no recipiente de sua preferência. O que parece mágica, ou seja, o congelamento do sorvete a uma temperatura (-20°C) mais baixa que 0°C, pela solução aquosa de NaC , é explicado pela propriedade coligativa de diminuição da temperatura de início de solidificação. Outro soluto que pode produzir a mesma diminuição da temperatura que o NaC é a) cloreto de potássio KC . b) cloreto de cálcio CaC 2 . c) glicose C6H12O6 . d) glicerina C3H8O3 . SÉRIE CASA – AULA 03 1. (Ufu 2011) O estudo das propriedades coligativas das soluções permite-nos prever as alterações nas propriedades de seu solvente. A respeito das propriedades coligativas, assinale a alternativa correta. a) Se for colocada água com glutamato de monossódio dissolvido para congelar em uma geladeira, a temperatura de fusão da água na solução permanecerá a mesma que a da água pura. b) As propriedades coligativas independem do número de partículas do soluto na solução, da natureza das partículas e de sua volatilidade. c) Se forem preparadas duas soluções aquosas de mesma concentração, uma de glutamato de monossódio e outra de açúcar, a temperatura de ebulição da água na solução será maior que a da água na solução de açúcar. d) Em uma panela tampada, a pressão de vapor da solução aquosa de glutamato de monossódio é maior do que a pressão de vapor da água pura porque a presença do sal facilita a evaporação do solvente. 6 2. (Ufrgs 2010) Assinale a alternativa que completa corretamente as lacunas no texto a seguir, na ordem em que aparecem. Dois copos contendo igual volume de líquido são colocados sob uma campânula impermeável, como na figura que segue. O copo 1 contém água do mar e o copo 2 água pura. Com o tempo, o líquido do copo 1 apresentará um volume............... líquido do copo 2. Esse fato se explica pelo efeito............... . a) maior que o tonoscópico b) menor que o tonoscópico c) igual ao osmótico d) maior que o osmótico e) menor que o osmótico 3. (Uece 2010) A garrafa de cerveja está no freezer, com temperatura abaixo de zero, perfeita para saciar a sede. Mas quando você a tira do freezer, segurando no meio da garrafa, a cerveja passa de líquido para sólido, congelando. Isso acontece por que a) o gás carbônico presente na cerveja se prende mais firmemente nas paredes da garrafa, reduzindo a agitação interna. b) ao serem estimuladas, por fatores como calor ou movimento, as moléculas das substâncias que compõem a cerveja permanecem inertes. c) antes de segurar a garrafa, as moléculas das substâncias que compõem a cerveja já estavam agitadas. d) quando você encosta na garrafa, sua mão esquenta o vidro aumentando o movimento das moléculas das substâncias que compõem a cerveja. ° 4. (Pucmg 2009) Considere as seguintes soluções aquosas a 25 C e a 1 atm: -1 X - 0,25 mol.L de glicose (C6H12O6) -1 Y - 0,50 mol.L de sulfato de potássio (K2SO4) -1 Z - 0,25 mol.L de ácido nítrico (HNO3) Sobre essas soluções, é INCORRETO afirmar que: a) a solução X apresenta maior temperatura de solidificação. b) a solução Y apresenta maior temperatura de ebulição. c) a ordem crescente de pressão de vapor é: X < Z < Y. d) as soluções X, Y e Z apresentam temperaturas de ebulição superiores à da água. ° 5. (Pucmg 2009) Considere as seguintes soluções aquosas a 25 C e a 1 atm: -1 X - 0,3 mol.L de sacarose ( C12H22O11 ) -1 Y - 0,5 mol.L de hidróxido de sódio ( NaOH ) -1 Z - 0,2 mol.L de sulfato de potássio ( K2SO4) Sobre essas soluções, é INCORRETO afirmar que: a) a solução X apresenta maior pressão de vapor. b) a solução Z apresenta menor temperatura de ebulição. c) a solução Y apresenta menor temperatura de solidificação. d) as soluções X, Y e Z têm temperatura de solidificação inferior à da água. GABARITO - SÉRIE CASA – AULA 01 Resposta da questão 1: E [Resposta do ponto de vista da disciplina de Química] A osmose cria um ambiente desfavorável à sobrevivência dos micro-organismos, pois o solvente (água) migra da região de maior pressão de vapor (alimento) para a de menor pressão de vapor (sal). [Resposta do ponto de vista da disciplina de Biologia] Em meio hipertônico, os micro-organismos decompositores perdem água, por osmose, e morrem. Dessa forma, os alimentos salgados são mais conservados do que o alimento fresco. 7 Resposta da questão 2: B Teremos: Com o tempo: Volume do glóbulo vermelho em X > Volume do glóbulo vermelho em Y > Volume do glóbulo vermelho em Z. Quanto maior o número de partículas presentes no soluto, maior a concentração e consequentemente menor a pressão de vapor. Concentração da solução X < Concentração da solução Y < Concentração da solução Z. Pressão de vapor em X > Pressão de vapor em Y > Pressão de vapor em Z. Conclui-se que a porcentagem em massa de sais é maior na solução Y do que na solução X. Resposta da questão 3: A Comentários sobre as afirmativas: I. Verdadeira. O efeito osmótico ocorre porque o meio extracelular torna-se hipertônico (mais concentrado) em função dos temperos, o que provoca a perda de água das células. II. Verdadeira. O açúcar torna o meio extracelular também hipertônico, favorecendo a perda de líquido pelo limão. III. Falsa. O bicarbonato de sódio é componente do fermento químico, e não do biológico que é constituído por microrganismos (leveduras) que, ao realizarem a fermentação, liberam gás carbônico. IV. Falsa. O aumento da pressão interna provoca um aumento na temperatura de ebulição do líquido, o que acelera o cozimento do feijão. Resposta da questão 4: C Análise das afirmações: I. Correta. A –45°C o composto A apresenta maior pressão de vapor em relação ao composto B, pois nele existem forças intermoleculares menos intensas. II. Correta. Quanto maior a massa molar de um alcano não-ramificado, maior será o seu ponto de ebulição, pois com o aumento da superfície de contato ocorre intensificação do dipolo induzido. III. Incorreta. São isômeros de cadeia os compostos B (cadeia ramificada) e D (cadeia normal). IV. Correta. A presença de ramificações diminui o ponto de ebulição dos compostos orgânicos que são isômeros de cadeia, pois ocorre diminuição da superfície de contato e de forças atrativas. Resposta da questão 5: E Na osmose, o solvente migra da região de menor pressão de vapor para a de menor pressão de vapor. Solução 1 de cloreto de sódio (0,15 mol/L; mesma pressão osmótica das soluções presentes nas células humanas): Em 1 litro de solução : NaC 0,15 mol Na C 0,15 mol 0,15 mol 0,30 mol de partículas Solução 2 de cloreto de sódio (0,20): 8 Em 1 litro de solução : NaC 0,20 mol Na C 0,20 mol 0,20 mol 0,40 mol de partículas Conclusão: A pressão de vapor é maior na solução 1, pois apresenta menor número de partículas, consequentemente o solvente vai migrar da célula humana para a solução salina (0,20 mol/L). GABARITO - SÉRIE CASA – AULA 02 Resposta da questão 1: A Teremos: NaNO3 Na NO3 0,5 M 0,5 M 0,5 M Número de partículas por litro A 3 A(NO3 )3 0,5 M 0,5 M 0,5 M 1,0 mol 0,5 1,5 2,0 mol 3NO3 3 0,5 M Número de partículas por litro (C6H12O6 )1 0,5 0,5 1C6H12O6 0,5 M Número de partículas por litro 0,5 mol Quanto menor o número de partículas, maior a pressão de vapor: C6H12O6 (glicose). Quanto maior o número de partículas, maior a temperatura de ebulição: A(NO3 )3 (nitrato de alumínio). Resposta da questão 2: A Vamos considerar que a sopa salgada comporta-se como uma solução quanto às suas propriedades físico químicas. Quando se adiciona solutos não voláteis (como o sal, por exemplo) aos solventes, observa-se um aumento no ponto de ebulição desse solvente. Esse efeito é chamado de ebulioscopia. Durante o processo de ebulição da sopa, também é possível observar um aumento na temperatura de ebulição, ao contrário do que se observa na ebulição de um líquido puro. Isto se deve porque, do ponto de vista químico, podemos considerar a sopa salgada como uma mistura (como foi sugerido acima), e, durante as mudanças de estado, a maioria das misturas apresentam aumento de temperatura. Resposta da questão 3: A Devemos considerar que a intensidade de um efeito coligativo observado numa solução depende diretamente do numero de partículas dispersas. Assim, vamos calcular esse número para todas as soluções. Solução A: A glicose não sofre dissociação ou ionização. Assim, na solução há 0,6 mol/L de partículas dispersas. Solução B: O ácido nítrico é um eletrólito forte, que consideraremos 100% ionizado. HNO3 (aq) H (aq) 3 (aq) NO 0,1mol/L 0,1 mol/L Apresenta no total, 0,2 mol/L de partículas dispersas. 9 Solução C: O cloreto de magnésio é um eletrólito, que vamos considerar 100 dissociado. MgC 2 (aq) Mg 2 (aq) 2C (aq) 0,2mol/L 0,4mol/L MgC 2 95 g / mol; K buliométrica 0,52 oC Apresenta no total, 0,6 mol/L de partículas dispersas. MgC 2 Mg2 2C Concluímos que as soluções A e C apresentam manifestam os efeitos coligativos (abaixamento de 70 g / 95 70 g / 95 3; W osmótica e aumento de 0,7368; temperatura de congelamento, de pressão de vapor,qpressão ponto de ebulição) em 1000 g 1 kg mesma intensidade. ΔTebulição (100,76 100) 0,76 oC Resposta da questão 4: D ΔTebulição K ebuliométrica W i Este aumento é calculado pela seguinte fórmula: K msoluto 0,76 i o msolvente (kg) Msoluto MgC 2 95 g / mol; K buliométrica 0,52 C MgC 2 Mg2 q 70 g / 95 1000 g 3; W 2C 0,52 70 i 1 95 0, 76 0,383 i i 1,984 i 1 α(q 1) 1,984 1 α(3 1) α 0,49 0,50 0,76 70 g / 95 1 kg ΔTebulição (100,76 100) ΔTebulição K ebuliométrica 0,7368; 0,76 oC W i K msoluto 0,76 i Resposta da questão A M msolvente5:(kg) soluto Assumindo que os dois compostos têm 100% de solubilidade em água, o KC pode produzir a mesma 0,52 70 que o NaC NaC apresenta Na C o mesmo número de mols de partículas (dissolução , pois diminuição de temperatura 0,76 i 1 95 (2 mols de partículas) iônica) e consequentemente o mesmo efeito crioscópico. 0, 76 0,383 i i 1,984 NaC Na C KC K C i 1 α(q 1) (2 mols de partículas) (2 mols de partículas) 1,984 1 α(3 1) KC K C α 0,49 0,50 GABARITO - SÉRIE CASA – AULA 03 (2 mols de partículas) Resposta da questão 1: C Alternativa [A] está incorreta, pois a presença de um soluto não-volátil num solvente promove o abaixamento da temperatura de fusão do solvente, efeito conhecido como crioscópico. Alternativa [B] está incorreta. As propriedades coligativas são proporcionais ao número de partículas nãovoláteis presentes no meio. Alternativa [C] está correta, já que a o glutamato de monossódio sofre dissociação gerando duas partículas em solução, íon glutamato e íon sódio, enquanto o açúcar não sofre dissociação nem ionização. Como o efeito coligativo é proporcional ao número de partículas não-voláteis presentes no meio, então a solução de glutamato de monossódio irá provocar um aumento na temperatura de ebulição maior que o aumento gerado por uma solução de açúcar de mesma concentração. Alternativa [D] está incorreta, pois a pressão de vapor da solução aquosa de glutamato de monossódio é menor do que a pressão de vapor da água pura, porque a presença do sal dificulta a evaporação do solvente. A redução da pressão de vapor do solvente devido à presença de um soluto não-volátil é conhecida como efeito tonoscópico. Resposta da questão 2: A O copo 1 contém água do mar e o copo 2 água pura. Com o tempo, o líquido do copo 1 apresentará um volume maior que o líquido do copo 2. Esse fato se explica pelo efeito tonoscópico, já que a pressão de vapor no copo 2 será maior do que no copo 1. Resposta da questão 3: D Quando você encosta na garrafa, sua mão transfere energia para o vidro aumentando a energia cinética das moléculas das substâncias que compõem a cerveja. A temperatura de solidificação da mistura é atingida. Resposta da questão 4: C Resposta da questão 5: B 10
Download