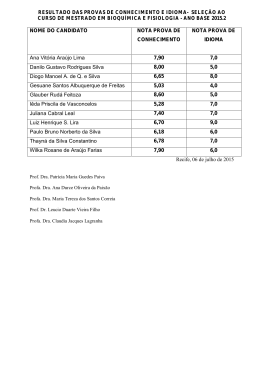
Capítulo 4: Análise de Sistemas: 1ª e 2ª Leis da Termodinâmica Revisão Exercícios EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Primeira lei da termodinâmica • O balanço de energia pode ser escrito na forma diferencial: dE = δQ - δW • Como energia E é uma propriedade termodinâmica, sua integral não depende do caminho: – Depende só do estado inicial e final do sistema. E2 − E1 =1 Q2 −1W2 EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Energia total do sistema • A propriedade E representa toda a energia contida em um sistema num determinado estado e será considerada apenas as influências da energia interna, energia cinética e energia potencial. E = Energia interna(U ) + Energia cinética( Ec ) + Energia potencial ( Ep ) 1 Ec = Mv 2 2 Ep = Mgz onde: v = velocidade do sistema g = aceleração gravitacional z = elevação do sistema a partir de um referencial EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Energia Interna (U) • A energia interna refere-se à energia que a molécula possui como resultado dos movimentos de translação, rotação e vibração em nível microscópico. • A energia interna está associada ao estado termodinâmico do sistema e seus valores são tabelados em função deste. • Pode ser obtida através de equação de estado ou através da tabela termodinâmica. • Na região de saturação uma mistura líquido-gás terá: u = ul + x(ug – ul) EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Primeira lei da termodinâmica • Há muitos processos reais que dependem do tempo. • Se as propriedades mudam a uma pequena taxa em relação ao tempo, a hipótese de processo quase-estático é válida: Onde: dE • • dE = Q −W dt dt = variação da energia total • Q = taxa de transferência de calor • W = potência EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Alguns casos particulares da aplicação da primeira lei • Num sistema isolado não há interação com as imediações e desta forma: 1 Q2 = 0 e W2 = 0 1 • Assim: E 2 = E1 EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Alguns casos particulares da aplicação da primeira lei • Em sistemas estacionários não há movimentação do sistema como um todo (ou são desprezíveis) e por isto: ∆Ec = 0 Logo: e ∆ Ep = 0 dE = dU • Integrando a primeira lei tem-se: U 2 − U1 =1 Q2 −1W2 EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Alguns casos particulares da aplicação da primeira lei • Processo de expansão quase-estático a pressão constante (processo isobárico): – Assumindo que o sistema seja estacionário e que o único trabalho realizado durante o processo seja o associado ao movimento da fronteira, a primeira lei da termodinâmica se reduz a: 1Q2 1 - 1W2 = U2 – U1 Q2 = (U 2 + P2 V2 ) − (U 1 + P1 V1 ) 1 Q2 = ∆(U + PV) = ∆H = H 2 - H 1 EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Alguns casos particulares da aplicação da primeira lei • Processo de expansão quase-estático a pressão constante (processo isobárico): – Sendo ainda um gás ideal: 2 1 Q 2 = M ∫ c p dT 1 – Em sendo um gás perfeito: cp constante 1 EM-524 Fenômenos de Transporte Q 2 = Mc p (T2 − T1 ) Profa. Dra. Carla K. N. Cavaliero Alguns casos particulares da aplicação da primeira lei • Processo isotérmico reversível de um gás perfeito em um sistema estacionário: – No sistema estacionário: E = U – No processo reversível: δW = PdV – No processo isotérmico de um gás ideal: E conseqüentemente u = cte. dE d ( Mu ) = =0 1 Q2 − 1W 2 = dT dT EM-524 Fenômenos de Transporte 1 T = cte Q2 =1W2 Profa. Dra. Carla K. N. Cavaliero Alguns casos particulares da aplicação da primeira lei • Processo adiabático reversível de um gás perfeito em um sistema estacionário (processo politrópico): – No processo adiabático: δQ = 0 – No processo reversível: δW = PdV – Para um gás ideal: PV = MRgT – Relação de propriedades: P1 V2 = P2 V1 EM-524 Fenômenos de Transporte γ P1 P2 1- γ T2 = T1 du = cv dT dh = cp dT cp – cv = Rg γ Profa. Dra. Carla K. N. Cavaliero Primeira lei aplicada a um ciclo • Quando um sistema perfaz um ciclo, o valor de qualquer propriedade do sistema ao final é idêntico ao seu valor no estado inicial. Portanto: ∫ dY = 0 onde Y é qualquer propriedade • Como E é uma propriedade tem-se: ∫ dE = 0 = ∫ δQ − ∫ δW • Logo: ∫ δQ = ∫ δW Qciclo = Wciclo O calor efetivo transmitido é igual ao trabalho efetivo realizado para um sistema perfazendo um ciclo. EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Enunciado de Clausius É impossível construir um dispositivo que opere em um ciclo termodinâmico e não produza outros efeitos além da transferência de calor de um corpo frio para um corpo quente • Naturalmente, calor não pode fluir de um corpo à temperatura mais baixa para outro à temperatura mais alta; • Para a transferência de calor ocorrer neste sistema, devem haver “outros efeitos”que o permitam. • Por exemplo: a refrigeração de alimentos é realizada por refrigeradores movidos a motores elétricos que necessitam de trabalho de sua vizinhança para operar. • Logo o enunciado de Clausius indica que é impossível construir um ciclo de refrigeração que opere sem um aporte de trabalho. EM-524 Fenômenos de Transporte Por Prof. Ricardo Mazza Profa. Dra. Carla K. N. Cavaliero Enunciado de Kelvin-Planck É impossível construir um dispositivo que opere em um ciclo termodinâmico e não produza outros efeitos além da produção de trabalho e troca de calor com um único reservatório térmico • Calor não pode ser convertido em trabalho completamente e continuamente em um único reservatório térmico operando em um ciclo termodinâmico; • A experiência mostra que o processo reverso é o processo natural: trabalho pode ser completa e continuamente convertido em calor. EM-524 Fenômenos de Transporte Por Prof. Ricardo Mazza Profa. Dra. Carla K. N. Cavaliero Máquina térmica • É um dispositivo que opera num ciclo termodinâmico e que produz trabalho líquido positivo, trocando calor líquido também positivo. • Um exemplo é o utilizado em grandes centrais de geração elétrica para produção de potência elétrica. EM-524 Fenômenos de Transporte Por Prof. Ricardo Mazza Profa. Dra. Carla K. N. Cavaliero Máquina térmica Reservatório de alta temperatura TH QH Máquina térmica QL Reservatório de baixa temperatura TL ∫ dE = 0 = ∫ δQ − ∫ δW ⇒ Q ciclo Q H − Q L = Wciclo • Eficiência é a relação W = Wlíq do que se obtém pelo que se gasta: W QH − QL QL η= = = 1− QH QH QH • η= EM-524 Fenômenos de Transporte = Wciclo W • QH • = • QH − QL • QH • = 1− QL • QH Profa. Dra. Carla K. N. Cavaliero Sistema de refrigeração Reservatório de alta temperatura TH QH Máquina térmica revertida QL Reservatório de baixa temperatura TL EM-524 Fenômenos de Transporte • Seu objetivo é remover o calor de um reservatório de baixa temperatura. • O coeficiente de desempenho ou de eficácia de um refrigerador pode ser escrito W como: QL QL 1 βR = = = W QH − QL QH − 1 QL Por Prof. Ricardo Mazza Profa. Dra. Carla K. N. Cavaliero Bomba de calor Reservatório de alta temperatura TH QH Máquina térmica revertida QL W • Como o objetivo é fornecer calor a um reservatório de alta temperatura, seu coeficiente de desempenho será (β βBC): β BC QH QH = = = W QH − QL Reservatório de baixa temperatura TL EM-524 Fenômenos de Transporte Por Prof. Ricardo Mazza 1 QL 1 − QH Profa. Dra. Carla K. N. Cavaliero Processos ideais ou reversíveis • Devido à segunda lei, nenhuma máquina térmica pode apresentar teoricamente rendimento de 100%. O maior rendimento será o obtido de uma máquina térmica reversível. • No entanto, na prática não existem máquinas reversíveis. • Nos casos reais, existem várias causas de irreversibilidade. • Um ciclo externamente reversível é aquele em que todos os processos são externamente reversíveis. Um exemplo é o Ciclo de Carnot. EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Ciclo de Carnot • A máquina térmica que opera num Ciclo de Carnot consiste em 4 processos externamente reversíveis: – Processo isotérmico reversível de transferência de calor, QH, do reservatório TH para o sistema; – Um processo adiabático reversível de abaixamento de temperatura (TH→TL); – Processo isotérmico reversível de transferência de calor, QL, do sistema ao reservatório TL; – Um processo adiabático reversível de aumento de temperatura (TL→TH). EM-524 Fenômenos de Transporte Reservatório Quente TH QH Gerador de Vapor Bomba Turbina W Condensador QL Reservatório Frio TL Profa. Dra. Carla K. N. Cavaliero Ciclo de Carnot TL = máquina térmica: o sistema realiza trabalho EM-524 Fenômenos de Transporte TL = Bomba de calor e refrigerador: o sistema realiza trabalho Profa. Dra. Carla K. N. Cavaliero Escala termodinâmica de temperatura • Como a razão das transferências de calor em um ciclo de potência reversível depende apenas das temperaturas dos reservatórios, existirá uma escala de temperatura independente das propriedades de qualquer substância. • Esta escala é denominada Escala Kelvin e expressa: QL QH EM-524 Fenômenos de Transporte TL = ciclo TH ciclo Profa. Dra. Carla K. N. Cavaliero Eficiência do ciclo de Carnot • Assim, todas as máquinas térmicas externamente reversíveis operando entre dois reservatórios possuem a eficiência máxima: η Carnot W QH − QL QL TL = 1− = 1− = = QH QH QH TH η máx TL = 1− TH • Em bombas de calor e refrigeradores o coeficiente de desempenho máximo será: β Rmáx QL QL TL = = = W Q H − Q L TH − TL EM-524 Fenômenos de Transporte β BCmáx TH = TH − TC Profa. Dra. Carla K. N. Cavaliero Segunda lei da termodinâmica: Desigualdade de Clausius Para uma máquina reversível: Prova que a δQ ≥ 0 =0 Desigualdade de T Clausius é Para uma máquina térmica irreversível: válida para δQ QUALQUER δQ ≥ 0 <0 máquina térmica T (reversível ou Desigualdade de Clausius para irreversível) qualquer máquina: ∫ ∫ ∫ ∫ δQ δQ ∫ T ≤ 0 EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Entropia • Desta forma, define-se entropia em processos reversíveis como sendo: δQ dS ≡ T rev onde: δQ é a transferência de calor para (+) ou do (-) sistema; T é a temperatura absoluta do sistema. • A variação de entropia de um sistema entre um estado e outro pode ser obtida como: 2 δQ ∆S = S 2 − S1 = ∫ T rev 1 EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Entropia de uma substância pura • Os valores da entropia específica podem ser obtidos de forma similar às outras propriedades: S s= M • Para a região de saturação o título deve ser usado para se calcular a entropia. s = sl + x( sv − sl ) EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Variação de entropia no ciclo de T Carnot 2 SSSS 1111 2222 SSSS TH − 1 1Q2 = δQ = TH ∫1 TH 1 2 Área = Trabalho líquido do ciclo 0000 3 ∫ S3 − − S 2 == ∫ 2222 3333 SSSS = Processo adiabático reversível SSSS 4444 SSSS 1111 SSSS − Processo isotérmico reversível 2 2 3 Processo isotérmico reversível 4 TL δδQ Q == 00 T T 4 3333 SSSS 4444 SSSS − 1 3 Q4 = δQ = ∫ TL 3 TL Wliq área 1 - 2 - 3 - 4 - 1 η = = QH área 1 - 2 - b - a - 1 a EM-524 Fenômenos de Transporte b S Profa. Dra. Carla K. N. Cavaliero Variação de entropia • Para um caso geral (processos reversíveis e irreversíveis), pode-se escrever que: dS ≥ δQ T 2 ou S 2 − S1 ≥ ∫ 1 δQ T A variação de entropia em um processo irreversível é maior que num reversível com o mesmo δQ e T; • De forma genérica, pode-se escrever que: dS = δQ T + δS ger EM-524 Fenômenos de Transporte onde δSger = 0 Processo reversível δSger > 0 Processo irreversível Profa. Dra. Carla K. N. Cavaliero O termo δSger dS = δQ T + δS ger • S de um sistema aumenta por adição de calor ou pela presença de irreversibilidade. • S de um sistema diminui apenas por remoção de calor. • Todos os processos adiabáticos reversíveis são isoentrópicos (∆ ∆S=0, ou seja, S2=S1). • Nem todos processos isoentrópicos são obrigatoriamente adiabáticos reversíveis (a remoção de calor pode compensar a irreversibilidade). EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Duas relações termodinâmicas importantes • Primeira equação TdS: TdS = dU + PdV Tds = du + Pdν • Segunda equação TdS: TdS = dH − VdP Tds = dh −νdP EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Variação de entropia para um gás perfeito • Pela primeira equação TdS: T2 ν2 s2 − s1 = c v cte ln + R g ln T1 ν1 • Usando a segunda equação TdS: T2 P2 s2 − s1 = cp cteln − R g ln T1 P1 EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Processo isentrópico para um gás perfeito • Da equação de estado para gases perfeitos e da de processos politrópico, pode-se escrever que: P2 V1 = P1 V2 e: T2 P2 = T1 P1 EM-524 Fenômenos de Transporte ( γ −1) γ γ V1 = V2 γ −1 Profa. Dra. Carla K. N. Cavaliero Moto perpétuo São considerados motos perpétuos os sistemas que violam alguma lei termodinâmica. • Moto perpétuo da 1ª. lei – Um exemplo deste sistema pode ser um sistema adiabático que fornece trabalho sem que haja mudanças na energia interna, potencial ou cinética. • Moto perpétuo da 2ª. lei – Um exemplo seria uma máquina térmica que recebesse calor de uma reservatório mais quente e realizasse apenas trabalho (eficiência 100%). EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Exercícios - Capítulo 4 Análise de sistemas: 1ª e 2ª leis da termodinâmica Proposição de exercícios: 4.1/ 4.3/ 4.6/ 4.7E/ 4.8/ 4.10/ 4.13/4.14/ 4.15/ 4.16/ 4.17/ 4.18/ 4.22/ 4.23/ 4.24/ 4.27/ 4.31/ 4.32/ 4.34/ 4.37/ 4.38 EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Exercício 1: Água contida em uma montagem pistão-cilindro é submetida a dois processos em série partindo de um estado inicial onde a pressão é 10 bar (1 MPa) e a temperatura é 400 oC: Processo 1-2: a água é resfriada à medida que é comprimida à pressão cte de 10 bar até o estado de vapor saturado; Processo 2-3: a água é resfriada a volume cte até 150 oC. Esboce os processos no diagrama T-ν ν e determine o trabalho (kJ/kg) e a quantidade de calor transferida (kJ/kg) para o processo global. EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Exercício 2: Vapor d’água saturado a 0,40 MPa é expandido reversivelmente e adiabaticamente em um dispositivo pistãocilindro, atingindo a pressão de 0,10 MPa. Esboce esse processo em um diagrama T-s. Determine o título da água no estado final. Considerando que as variações de energia cinética e potencial são desprezíveis ao longo do processo, determine o trabalho realizado (kJ/kg). EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Exercício 3: Uma central de potência opera hipoteticamente segundo um ciclo de Carnot com água/vapor como fluido de trabalho. A adição de calor isotérmica reversível ocorre em uma caldeira à pressão de 2 MPa e, durante este processo, água líquida saturada é convertida em vapor d’água saturado. A rejeição de calor isotérmica reversível ocorre em um condensador à 1 atm. a) Calcule a transferência de calor em cada etapa do ciclo. b) Qual é o trabalho líquido realizado pela máquina? c) Qual é a eficiência térmica da máquina? Compare este valor com o valor máximo teórico. Ciclo de Carnot: T P=2MPa TH=212,42 oC TL=99,63 oC 1 4 2 P=0,1MPa 3 1-2: isotérmico reversível (TH) 2-3: adiabático reversível (isoentrópico) 3-4: isotérmico reversível (TL) 4-1: adiabático reversível (isoentrópico) Pela 2a lei da termodinâmica: δQ EM-524 Fenômenos de Transporte s Q2 dS = ∴ s2 − s1 = T T Profa. Dra. Carla K. N. Cavaliero 1 Exercício 4: O projeto da termoelétrica de Carioba II (AmericanaSP 2000) prevê uma geração de 950 MW queimando gás natural e operando num ciclo Rankine (vapor) a uma pressão máxima de 6 MPa. Determine a mínima taxa de calor que ela rejeitará ao rio Piracicaba. Se ela tomar do rio 4 m3/s de água para fins de resfriamento, calcule qual o aumento na temperatura dessa água ao retornar ao rio (considere desprezível esse aumento de temperatura em função do tempo). W=950 MW P=6MPa Ciclo a vapor TH=276oC (vapor saturado a 6 MPa) TL=25oC QL ? Retirando 4 m3/s de água do rio, ∆T ? EM-524 Fenômenos de Transporte 6MPa e 276oC 950 MW oC Dra. Carla K. N. Cavaliero 25Profa. Exercício 4: O projeto da termoelétrica de Carioba II (AmericanaSP 2000) prevê uma geração de 950 MW queimando gás natural e operando num ciclo Rankine (vapor) a uma pressão máxima de 6 MPa. Determine a mínima taxa de calor que ela rejeitará ao rio Piracicaba. Se ela tomar do rio 4 m3/s de água para fins de resfriamento, calcule qual o aumento na temperatura desta água ao retornar ao rio (considere desprezível esse aumento de temperatura em função do tempo). TH=276oC = 549K ηCarnot TL=25oC = 298K TL 298 = 1− = 1− = 0,457 TH 549 • ηCarnot • 950 = • ⇒ QH = = 2079MW 0,457 QH • W • • QL = QH − W = 2079 − 950 = 1129 MW EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero Exercício 4: O projeto da termoelétrica de Carioba II (AmericanaSP 2000) prevê uma geração de 950 MW queimando gás natural e operando num ciclo Rankine (vapor) a uma pressão máxima de 6 MPa. Determine a mínima taxa de calor que ela rejeitará ao rio Piracicaba. Se ela tomar do rio 4 m3/s de água para fins de resfriamento, calcule qual o aumento na temperatura desta água ao retornar ao rio (considere desprezível esse aumento de temperatura em função do tempo). TH=276oC = 549K TL=25oC = 298K Tomando água do rio a 4 m3/s, o aumento da temperatura será: • QL = Mc∆T ∆T = QL • ρV c Considerando ρ = 1000 kg/m3 e c = 4190 J/kg.K, tem-se 1129 ∗106 ∆T = = 67 K = 67 o C 1000 ∗ 4 ∗ 4190 EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero FIM! EM-524 Fenômenos de Transporte Profa. Dra. Carla K. N. Cavaliero
Download