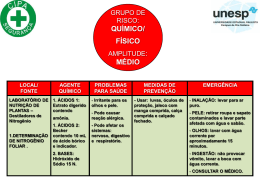
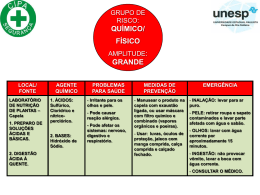
0341 – QUÍMICO Leia o texto e responda às questões 03 e 04: LÍNGUA PORTUGUESA Leia a tirinha abaixo para responder às questões 01 e 02: “Quando me amei de verdade, comecei a perceber como é ofensivo tentar forçar alguma situação ou alguém apenas para realizar aquilo que desejo, mesmo sabendo que não é o momento ou a pessoa não está preparada, inclusive eu mesmo. Hoje sei que o nome disso é... Respeito.” Charles Chaplin Ao ler esse pensamento, podemos concluir que: A) A nossa vontade deve prevalecer sempre; B) Devemos estar sempre preparados para a exigência de quem amamos; C) Respeito não tem nenhuma relação com amor; D) Respeitar alguém é uma demonstração de amor; E) Mesmo que não estejamos preparados, devemos fazer qualquer coisa por amor. De acordo com a conclusão da tira, podemos afirmar que Calvin: A) B) C) D) E) Preocupa-se com o futuro do seu país; Concorda com o fato de não poder votar; Faz uma crítica à política do país; Não entende nada de política; É um menino mimado e quer fazer tudo que um adulto faz. O verbo amar, destacado logo no início do texto, de acordo com sua transitividade é: A) B) C) D) E) Intransitivo; De ligação; Transitivo indireto; Transitivo direto; Transitivo direto e indireto. ANOTAÇÕES Observe o período do terceiro quadrinho. Morfologicamente, a palavra preocupado é classificada como: A) B) C) D) E) Advérbio; Adjetivo; Verbo; Substantivo; Conjunção. Página 1 de 12 0341 – QUÍMICO Observe o documento para responder às questões 05 e 06: Cada gênero textual é elaborado tendo em vista um propósito comunicativo. O texto que você leu é um documento oficial. De acordo com suas características, podemos afirmar que se trata de um(a): A) B) C) D) E) Requerimento; Telegrama; Ofício; Certidão; Carta oficial. A palavra imprudência, localizada no terceiro parágrafo do texto, é acentuada porque é: A) B) C) D) E) Oxítona terminada em A; Paroxítona terminada em A; Paroxítona terminada em ditongo crescente; Oxítona terminada em ditongo crescente; Proparoxítona. Página 2 de 12 0341 – QUÍMICO A música que você vai ler é do cantor e compositor Lenine, ela servirá de base para as questões 07 e 08: Lavadeira do rio A lavadeira do rio, muito lençol pra lavar Fica faltando uma saia quando o sabão se acabar Mas corra pra beira da praia, veja a espuma brilhar Ouça o barulho bravio das ondas que batem na beira do mar Ouça o barulho bravio das ondas que batem na beira do mar O vento soprou, a folha caiu, cadê meu amor, que a noite chegou fazendo frio O vento soprou, a folha caiu, cadê meu amor, que a noite chegou fazendo frio Oh, Rita, tu sai da janela, deixa esse moço passar Quem não é rica e é bela não pode se descuidar Ah, Rita, tu sai da janela que as moça desse lugar Nem se demora donzela nem se destina a casar Nem se demora donzela nem se destina a casar O vento soprou, a folha caiu, cadê meu amor, que a noite chegou fazendo frio O vento soprou, a folha caiu, cadê meu amor, que a noite chegou fazendo frio Ah, lavadeira do rio, muito lençol pra lavar Fica faltando uma saia quando o sabão se acabar Mas corra pra beira da praia, veja a espuma brilhar Ouça o barulho bravio das ondas que batem na beira do mar Ouça o barulho bravio das ondas que batem na beira do mar O vento soprou, a folha caiu, cadê meu amor, que a noite chegou fazendo frio O vento soprou, a folha caiu, cadê meu amor, que a noite chegou fazendo frio Há nessa música, de acordo com a norma culta gramatical, um erro de concordância observado em: A) “Fica faltando uma saia quando o sabão se acabar”; B) “Ouça o barulho bravio das ondas que batem na beira do mar”; C) “Quem não é rica e é bela não pode se descuidar”; D) “Ah, Rita, tu sai da janela que as moça desse lugar”; E) “Ah, lavadeira do rio, muito lençol pra lavar”. Na música, a palavra folha, que está presente no refrão exerce função de: A) B) C) D) E) Núcleo do Sujeito; Predicado; Adjetivo; Núcleo do predicado; Sujeito. Leia a tira, depois responda às questões 09 e 10: A palavra moral, presente na fala de Mafalda, significa: A) B) C) D) E) Autoridade; Estado de espírito; Domínio; Conjunto de regras de conduta; Ética. A palavras para, por ter a função de unir palavras estabelecendo relações de sentido, é um(a): A) B) C) D) E) Conjunção; Artigo; Preposição; Interjeição; Advérbio. Página 3 de 12 0341 – QUÍMICO ATUALIDADES Recentemente, o prefeito de São Paulo, Gilberto Kassab, capitaneou a criação de um novo partido político. A nova legenda é denominada: A) B) C) D) E) PSD – Partido Socialista Democrático; PSB – Partido Social Brasileiro; PSB – Partido Socialista Brasileiro; PSD – Partido Social Democrático; PSB – Partido Socialista Democrata. Em 07 de novembro de 2011, a Presidente Dilma Rousseff indicou um novo integrante para compor o Supremo Tribunal Federal. Assinale a alternativa que aponta corretamente o nome do novo indicado: A) B) C) D) E) Nancy Andrigui; Rosa Maria Weber; Teori Zavascki; Ellen Gracie; Celso de Mello. Assinale a alternativa que aponta corretamente o rio onde será construída a usina hidrelétrica de Belo Monte: A) B) C) D) E) Rio Amazonas; Rio Negro; Rio Xingu; Rio Solimões; Rio Guaíba. O Senado Federal é uma das casas do Congresso Nacional, ao lado da Câmara dos Deputados. Representa a Federação e, por isso, há o mesmo número de representantes para cada um dos 26 Estados e o Distrito Federal, totalizando: A) B) C) D) E) 27 senadores; 54 senadores; 81 senadores; 108 senadores; 135 senadores. Assinale a alternativa que aponta corretamente o país onde se situa o vulcão Puyehue, cujas cinzas, recentemente, foram responsáveis pelo fechamento dos aeroportos de Buenos Aires, Bariloche e Montevidéu: A) B) C) D) E) Chile; Argentina; Paraguai; Uruguai; Equador. Assinale a alternativa que aponta corretamente o filme que representará o Brasil no Oscar 2012: A) B) C) D) E) Malu de Bicicleta; Mulatas! Um Tufão nos Quadris; Quebrando o Tabu; Trabalhar Cansa; Tropa de Elite 2. A chamada camada pré-sal é uma faixa que se estende ao longo de 800 quilômetros entre três bacias sedimentares. Assinale a alternativa que aponta o estado não abrangido pela camada do pré-sal: A) B) C) D) E) Rio de Janeiro; Santa Catarina; Espírito Santo; Ceará; São Paulo. O “Acquario Ceará”, um imenso aquário que será o maior equipamento do tipo na América Latina, será erigido na cidade de Fortaleza no bairro: A) B) C) D) E) Meireles; Aldeota; Praia de Iracema; Barra do Ceará; Mucuripe. Página 4 de 12 0341 – QUÍMICO Assinale a alternativa que aponta corretamente o atual Presidente do Banco Central do Brasil: A) B) C) D) E) Alexandre Tombini; Delfim Neto; Henrique Meirelles; José Eduardo Cardozo; Tarso Genro. A Presidente da República, Dilma Rousseff, é natural de: A) B) C) D) E) Passo Fundo-RS; Porto Alegre-RS; Montes Claros-MG; Belo Horizonte-MG; Rio de Janeiro-RJ. CONHECIMENTOS ESPECÍFICOS O Reveillon do Rio de Janeiro transformou-se num dos principais eventos de final de ano do mundo, recebendo mais de dois milhões de pessoas que juntos celebram o novo ano. A festa da virada deste ano também contou com o lançamento da logomarca oficial dos Jogos Olímpicos de 2016, no Rio. O momento mais aguardado da festa foi a contagem regressiva que culminou com o queima de fogos de artifício na orla de Copacabana, com duração de quase vinte minutos. Em fogos de artifício, as diferentes colorações são obtidas quando se adicionam sais de diferentes metais às misturas explosivas, esta característica pode ser explicada considerando o modelo atômico proposto por: A) B) C) D) E) Dalton; Thomson; Rutherford; Bohr; Lavoisier. Por volta do ano de 1800, já se conheciam aproximadamente 33 elementos químicos, uma quantidade suficiente que justificava uma busca pela organização. Várias tentativas de organização de acordo com vários critérios, algumas delas sem muito sucesso, foram utilizadas. Dentre as principais podemos destacar: A) O parafuso telúrico de Mendeleev, as oitavas Chancourtois e a tabela de Lothar Meyer; B) O parafuso telúrico de Chancourtois, as oitavas Dobereiner e a tabela de Mendeleev; C) As tríades de Dobereiner, o parafuso telúrico Chancourtois e as oitavas de Newlands; D) As tríades de Chancourtois, o parafuso telúrico Dobereiner e as oitavas de Newlands; E) As tríades de Lothar Meyer e as tabelas Chancourtois e Mendeleev. de de de de de Observe o fragmento de texto abaixo: Antes do desenvolvimento da teoria dos microorganismos como causadores de doenças (1880), acreditava-se que estas eram transmitidas através de odores. A desinfecção, tanto da água de abastecimento como dos esgotos, surgiu como uma tentativa da eliminação desses odores. [...] Adaptado: Cadernos de Saúde Pública – 1994. Marque a alternativa que contém o nome do agente desinfetante mais utilizado no tratamento da água, sabendo que o mesmo é um dos elementos mais eletronegativos na tabela periódica: A) B) C) D) E) Iodo; Mercúrio; Cloro; Sódio; Arsênio. ANOTAÇÕES Página 5 de 12 0341 – QUÍMICO As ligas metálicas e os metais são cada vez mais importantes em nosso dia-a-dia. O cobre é usado em fios elétrico e na construção de alambiques, o magnésio é empregado em rodas de automóveis e em partes de aviões. O aço é muito empregado em construções, na produção de veículos, geladeiras, fogões, entre outros. Sobre os metais podemos afirmar que: A amônia pode ser preparada em laboratório aquecendose um sal de amônio com hidróxido de sódio. Na verdade, é um teste comum para identificação de compostos de amômio. A produção mundial de amônia é praticamente feita por meio da reação entre os gases N2 e H2, pelo processo denominado Haber-Bosch: A) Apresentam-se no estado gasoso em baixas temperaturas; B) Possuem baixíssima ductibilidade; C) Em geral, os átomos dos metais têm 4, 5 ou 6 elétrons na camada de valência; D) Possuem boa condutividade térmica, mas baixa condutividade elétrica; E) Se agrupam em formas geometricamente ordenada, dando origem a reticulados cristalinos. O volume de amônia obtido a partir de 31,2 L de N2, supondo ambos nas mesmas condições de temperatura e pressão, equivale a: Os ácidos estão presentes em nosso cotidiano de uma maneira tão intrínseca que não nos damos conta. Nos automóveis, nos produtos de limpeza, na salada e até nos refrigerantes. Alguns destes ácidos, mesmo sob condições normais de temperatura e pressão, se decompõem total ou parcialmente, formando quase sempre, como produtos de decomposição, um gás e água líquida, estes ácidos são conhecidos como ácidos instáveis. Marque a alternativa que contém apenas ácidos instáveis. O álcool etílico ou etanol possui um extenso uso doméstico. No Brasil, o álcool é obtido pela fermentação da cana-de-açúcar, outra forma de obter o álcool etílico é utilizar como matéria-prima o milho, a beterraba ou o arroz. Em uma amostra de 200,0 g de álcool etílico, encontramos aproximadamente: A) B) C) D) E) HCl e HBr; H3PO4 e HNO2; H4SiO4 e HF; H2SO3 e H2CO3; H2SO4 e HI; De acordo com a reação e considerando a teoria ácido-base, podemos afirmar que: A) Segundo a teoria de Arrhenius o NH3 possui caráter ácido; B) Segundo a teoria protônica o OH – é ácido cuja base conjugada é o H2O; C) Segundo a teoria protônica o NH3 é base conjugada do ácido NH4+; D) Segundo a teoria de Arrhenius o NH3 é base conjugada do ácido NH4+; E) De acordo com o conceito de Lewis o H2O é uma base pelo fato de doar um par eletrônico ao OH –. A) B) C) D) E) A) B) C) D) E) 15,6 L; 22,4 L; 31,2 L; 64,2 L; 124,8 L. 1,80 . 1023 átomos de hidrogênio; 1,80 . 1025 átomos de hidrogênio; 1,80 . 1024 átomos de hidrogênio; 6,02 . 1023 moléculas de C2H6O; 3,01 . 1025 moléculas de C2H6O. O elemento químico enxofre possui uma coloração amarelada, é insípido, mal condutor de calor e eletricidade, além de ser insolúvel em água. Um de seus compostos mais conhecidos é o dióxido de enxofre (SO2), juntamente com outras substâncias, é responsável pelo surgimento de chuvas ácidas. Nas indústrias petroquímicas, o enxofre pode ser obtido pela reação: 2 H2S + SO2 3 S + 2 H2O Qual a quantidade máxima, em gramas, de enxofre, que pode ser obtida partindo-se de 10 mol de H2S e 4 mol de SO2? A) B) C) D) E) 168g; 226g; 2896; 384g; 448g. Página 6 de 12 0341 – QUÍMICO O sulfato de alumínio [Al2(SO4)3] é um sal obtido pela reação entre o ácido sulfúrico [H2SO4] e o hidróxido de alumínio [Al(OH3)] ou entre o mesmo ácido e o alumínio metálico. É usado para o tratamento de água, tratamento de efluentes, limpeza de piscina, manufatura de papel, decantação de partículas mais densas que a água por ação da gravidade e ajuste do pH da água. A dissociação deste sal segue a seguinte reação não balanceada: Supondo que dissolvemos 3 mol de Al2(SO4)3 em água suficiente para totalizar 2.10–3 m3 de solução, as concentrações dos íons Al 3+ e SO42 – são, respectivamente: A) B) C) D) E) 1,5 M e 4,5 M; 3,0 M e 4,5 M; 0,5 M e 1,5 M; 0,25 M e 1,32 M; 0,02 M e 0,05M. O gráfico abaixo mostra a solubilidade de alguns sais em função da temperatura. Os icebergs são formados de água doce e são considerados a maior reserva de água potável do planeta. Os icebergs permanecem congelados enquanto a água do oceano ao seu redor se mantém líquida, praticamente o ano inteiro, mesmo estando na mesma temperatura que os icebergs. Isso pode ser explicado: A) Pelo efeito crioscópico, ocorrendo à diminuição da temperatura de início de congelamento em decorrência da adição de soluto não volátil, ou seja, o sal da água; B) Pelo efeito ebulioscópico, ocorrendo o aumento da temperatura de início da ebulição em decorrência da adição de soluto não volátil, ou seja, o sal da água; C) Pelo efeito tonoscópico, ocorrendo à diminuição da pressão do vapor em decorrência da adição de soluto não volátil, ou seja, o sal da água; D) Pelo efeito elétrico, ocorrendo uma força de atração maior entre as moléculas de água no estado sólido, se comparado a força de atração das moléculas no estado líquido; E) Pelo efeito termoquímico, uma vez que em baixas temperaturas a força de coesão das moléculas de água aumenta. O nitrato de amônio, um composto químico de fórmula NH4NO3, é um sólido cristalino branco à temperatura ambiente e pressão normal. É comumente utilizado na agricultura como fertilizante rico em nitrogênio, também é usado como oxidante e para dispositivos explosivos improvisados. Explosivos contendo o nitrato de amônio foram usados no atentado de Oklahoma City em 19 de abril de 1995 e no de Nova Deli em setembro deste ano. A reação ocorrida pode ser representada pela equação: 2 NH4NO3 (s) 2 N2 (g) + O2 (g) + 4 H2O (l) ∆H = – 411,2 Kj De acordo com o gráfico podemos afirmar que a alternativa falsa é: Nesse processo, quando há decomposição de 1,0 mol do sal, ocorre: A) A 50 ºC a solubilidade do NH4Cl é igual a 40 g/ 100g de água; B) O sal mais solúvel a 50 ºC é o NaNO3; C) A solução de NaNO3, que tem 60 g desse sal dissolvidos em 100 g de água a 30 º C é saturada; D) À medida que a temperatura aumenta, a solubilidade do Ce2(SO4)3 diminui; E) A temperatura pouco influi na solubilidade do NaCl, se comparado aos outros sais do gráfico. A) B) C) D) E) Liberação de 411,2 kj; Liberação de 205,6 kj; Liberação de 315,6 kj; Absorção de 411,2 kj; Absorção de 205,6 kj. Página 7 de 12 0341 – QUÍMICO Os fenômenos de oxidação e redução são caracterizados pela transferência de elétrons. Estes fenômenos são simultâneos e constituem a chamada reação de oxiredução ou redox. Marque a alternativa que contém, respectivamente, os números de oxidação do enxofre nas espécies SO32–, SO42–, S2– e Na2S. A) B) C) D) E) Foram efetuadas diversas experiências, num laboratório, para a reação: 2 H2 (g) + 2 NO (g) N2 (g) + 2 H2O (g) Com os resultados das velocidades iniciais obtidos, montou-se a tabela abaixo: + 4, + 6, – 2, + 2; – 4, – 2, 0, + 2; – 4, + 6, – 2, – 2; + 2, + 4, 0, +1; – 4, + 6, + 2, – 2. Assinale a afirmação correta em relação ao que vai ocorrer quando a chave C é ligada, no teste de elemento galvânico esquematizado a seguir: Baseando-se na tabela acima, podemos afirmar que a lei da velocidade para a reação é: A) v = K [H2]; B) v = K [NO]²; C) v = K [H2] [NO]; D) v = K [H2] [NO]²; E) v = K [H2]2 [NO]²; A) A concentração de ZnSO4 ,que está do lado esquerdo, vai aumentar; B) Haverá a migração dos cátions de zinco, através da membrana porosa, da esquerda para a direita; C) Haverá a migração dos ânions nitrato, através da membrana porosa, da esquerda para a direita; D) No sentido horário haverá a circulação da corrente elétrica convencional; E) Elétrons irão circular pelo fio da direita para a esquerda. Depois de iniciada e antes que se termine qualquer reação química, seus reagentes e produtos coexistem. Em uma reação química reversível, à medida que os produtos são formados, parte deles reage formando, novamente, os reagentes. Com relação ao equilíbrio químico, marque a opção correta: A) O equilíbrio químico só pode ser atingido em sistemas abertos; B) O equilíbrio químico não é dinâmico; C) O estado de equilíbrio é alcançado quando a velocidade da reação inversa é maior que a velocidade da reação direta; D) Num sistema em equilíbrio as propriedades microscópicas e macroscópicas permanecem constantes; E) Em sistemas em equilíbrio químico, a concentração dos reagentes é alterada para que a reação ocorra continuamente. Página 8 de 12 0341 – QUÍMICO Em um recipiente fechado com 2,5 L de capacidade, foram colocados 6,5 mol de NO2 e 5,5 mol de CO. O equilíbrio foi atingido na temperatura de 100 ºC e verificou-se a formação de 2,5 mol de CO2. Para o equilíbrio dessa reação o valor de Kc é aproximadamente: A) B) C) D) E) 0,19; 0,52; 0,96; 2,14; 2,75. O Japão experimentou mais uma vez o terror nuclear em seus domínios, exatamente no dia 13 de março deste ano na região onde está a central nuclear de Fukushima I, houve uma grande explosão, na sequência do sismo que abalou o Japão no dia anterior, resultando no pior acidente nuclear desde Chernobyl na ex-URSS. O sismo causou uma avaria no sistema de refrigeração na central e um corte de eletricidade impediu a recuperação deste sistema. Observe a figura abaixo que mostra, de maneira simplória, o interior de um reator nuclear: O controle do pH de é importante em diversos aspectos. Na indústria de alimentos, tal controle significa maior tempo de conservação dos alimentos. Na agricultura, seu controle no solo pode significar maior ou menor produtividade. Sobre o equilíbrio iônico, marque a alternativa correta: A) As chuvas ácidas são prejudiciais ao meio ambiente pelo fato de aumentar o valor do Ph; B) O valor do pH não varia com a temperatura; C) Na água pura o pH é diferente do pOH; D) Os sistemas que possuem a capacidade de evitar variações bruscas de pH são denominadas tampões; E) A intensidade da ionização sofrida por um ácido independe do valor da constante de equilíbrio do ácido (Ka). ANOTAÇÕES Sobre o funcionamento do reator nucelar podemos afirmar que: A) A fusão nucelar é controlada pela introdução de varetas de boro ou cádmio junto às barras de combustível nuclear ativas no núcleo da usina; B) A introdução das varetas consome o urânio utilizado como combustível, impedindo a continuidade do processo; C) A introdução das varetas de controle absorve os nêutrons emitidos pela reação em cadeia, impedindo a continuidade do processo; D) A água que entra no sistema permite que os bastões de combustível continuem a aquecer, aumentando a pressão interna no reator; E) O urânio usado em usinas nucleares é conhecido como urânio enriquecido, sendo assim natural, encontrado facilmente no meio ambiente. Página 9 de 12 0341 – QUÍMICO O petróleo não é uma substância pura, mas, sim, uma mistura de várias substâncias. Para transformar o petróleo em seus vários derivados é preciso aplicar métodos de desdobramento de misturas e o método aplicado é o da destilação fracionada. O processo é realizado numa torre de fracionamento do petróleo, como a da figura abaixo: O gengibre, muito utilizado na medicina oriental, é rico em óleos voláteis, shogaol e gingerol. O shogaol é um produto da quebra do gingerol e este é que dá o sabor característico do gengibre. Pesquisas recentes comprovaram que o gingerol diminui a velocidade de crescimento de tumores cancerígenos. A estrutura do [6]gingerol está representada abaixo. Assinale a alternativa correta sobre o [6]-gingerol: A ordem de destilação desses componentes do petróleo está justificada pela seguinte afirmação: A) Os hidrocarbonetos são todos sólidos de alto peso molecular; B) A substância indicada por X pode ser o gás metano; C) O aumento da massa molar dos hidrocarbonetos provoca menor volatilidade; D) O ponto de ebulição dos hidrocarbonetos diminui com o aumento da massa molar; E) somente compostos orgânicos com até 12 carbonos podem ser separados por este processo. ANOTAÇÕES A) Apresenta hidroxila ligada ao anel aromático configurando a função álcool; B) A hidroxila, da parte acíclica da cadeia, está ligada em um carbono com hibridação sp; C) Apresenta as funções nitrogenadas cetona e álcool; D) Apresenta as funções oxigenadas éter e fenol; E) Possui 3 carbonos terciários e a função enol. Uma das características dos ácidos carboxílicos é o odor. Ácidos carboxílicos com seis, oito e dez carbonos são exalados pelos caprinos, tratando-se do popular “cheiro de bode” e por este motivo recebem nomes que remetem a esse animal, ácidos caproico, caprílico e cáprico, respectivamente. Outros ácidos estão presentes em nosso cotidiano veja alguns exemplos: I. Veneno da picada de formigas contém ácido fórmico; II. O vinagre é uma solução aquosa de ácido acético; III. Benjoim, uma erva utilizada em defumações, deu nome ao ácido benzóico; IV. O ácido oxálico do grego oxys, que significa “bem ácido”. Os nomes sistemáticos para os ácidos fórmico, acético, benzóico e oxálico, são, respectivamente: A) Ácido metanóico, ácido etanóico, ácido fenilmetanóico e ácido etanoico; B) Ácido metanóico, ácido etanóico, ácido fenilmetanóico e ácido etanodioico; C) Ácido etanóico, ácido metanóico, ácido benzilmetanóico e ácido etanoico; D) Ácido etanóico, ácido propanóico, ácido toluilmetanóico e ácido etanodioico; E) Ácido butanóico, ácido etanódioico, ácido fenólico e ácido etanoico. Página 10 de 12 0341 – QUÍMICO Os alcoóis estão presentes em certos produtos do cotidiano, no combustível, em bolos e panetones industrializados, que contém glicerina como umictante e no corpo humano onde o álcool é encontrado no colesterol. Observe as COLUNAS I e II abaixo: Louis Pasteur é lembrado por suas notáveis descobertas no ramo da Biologia, ficou mais conhecido no público em geral por inventar um método para impedir que o leite causasse doenças, um processo que veio a ser chamado de pasteurização. Sua contribuição mais importante para o desenvolvimento da química foi: COLUNA I – NOME DO COMPOSTO I. Metanol; II. Etanol; III. Propan-2-ol (álcool isopropílico); IV. Propano-1, 2, 3-triol (glicerol). COLUNA II – APLICAÇÃO ( ) Produtos de limpeza à base de álcool. ( ) Fabricação de polímeros, explosivos e emolientes para os cosméticos. ( ) Solvente industrial e combustível muito tóxico. ( ) Combustível, solvente e ingrediente de bebidas alcóolicas. A sequência, de cima para baixo, que preenche corretamente a coluna II é: A) B) C) D) E) I, II, III, IV; IV, I, III, II; II, IV, I, III; III, IV, II, I; III, IV, I, II. A solubilidade de uma substância é uma propriedade física muito importante, na qual se baseiam certos métodos de separação de misturas, de extração de produtos naturais e de recristalização de substâncias. Assinale a alternativa que possuía substância mais solúvel em água: A) B) C) D) E) A) A separação mecânica das formas dextro e levo de cristais do ácido tartárico; B) A descoberta da isomeria espacial; C) A proposta da simetria molecular para a atividade óptica de um composto; D) A isolamento da substância química responsável pela raiva; E) A proposta das conformações cadeira e barco para o ciclo-hexano. O formol ou formalina é uma solução aquosa contendo cerca de 40% de formaldeído. É utilizado como desinfetante, na conservação de cadáveres e de peças anatômicas, entre outras coisas. O acetaldeído, dependendo da temperatura do ambiente, pode ser um gás ou um líquido. É um dos responsáveis pela “ressaca” decorrente da ingestão de bebidas alcoólicas, tanto o formol como o acetaldeído são aldeídos. Um aldeído sofreu uma adição do brometo de etilmagnésio seguido de uma hidrólise produzindo o butan-2-ol. O nome do aldeído em questão é: A) B) C) D) E) Ácido etanoico; 2 – metil – propano; Propanona; Butanal; Etanal. ANOTAÇÕES H2C = CH2; H3C – CH2 – CH3; H2C = CH – CH3; H3C – CH2 – CH2 – OH; H3C – O – CH2 – CH3; Página 11 de 12 0341 – QUÍMICO O método utilizado para análise de elementos simples, da estrutura química de compostos inorgânicos ou grupos funcionais de uma substância orgânica utilizando radiação electromagnética é a espectroscopia. Sobre ela é correto afirmar que: A) A base da espectroscopia é a natureza especular das amostras, cuja variável é a freqüência fundamental; B) A espectroscopia de absorção correlaciona à quantidade da energia dispersa também em função do comprimento de onda da radiação incidente; C) A espectroscopia de emissão analisa a quantidade de energia emitida por uma amostra contra o comprimento de onda da radiação absorvida. Consiste fundamentalmente na reemissão de energia previamente absorvida pela amostra; D) A espectroscopia de espalhamento determina a quantidade da energia absorvida também em função de parâmetros tais como o comprimento de onda e o ângulo de incidência; E) Quando se excita uma substância com uma fonte de energia, esta sempre emite radiação ultravioleta em determinado comprimento de onda. Um solvente de baixíssima polaridade, o didecilftalato, foi utilizado numa cromatografia gás-líquido como líquido estacionário. Caso fosse utilizado óleo de silicone, um líquido apolar, o tempo de retenção para n-pentano: A) Seria menor, já que o óleo de silicone é apolar e teria maior afinidade com a fase estacionária que também é apolar; B) Seria maior, já que o óleo de silicone é apolar e teria maior afinidade com a fase estacionária que também é apolar; C) Seria menor, já que o óleo de silicone é polar e teria maior afinidade com a fase estacionária que é apolar; D) Seria maior, já que o óleo de silicone é polar e teria maior afinidade com a fase estacionária que também é polar; E) Não sofreria alteração, uma vez que o óleo de silicone sendo apolar não interfere em nada no processo. Leia abaixo o fragmento de texto sobre a Usina de Belo Monte: Com projeto para ser instalada na região conhecida como Volta Grande do Rio Xingu, no Pará, a usina de Belo Monte deve ser a terceira maior do mundo em capacidade instalada, atrás apenas das usinas de Três Gargantas, na China, e da binacional Itaipu, na fronteira do Brasil com o Paraguai. De acordo com o governo, a usina terá uma capacidade total instalada de 11.233 megawatts (MW), mas com uma garantia assegurada de geração de 4.571 MW, em média. Adaptado: BBC Brasil - 20/04/2010 A Limnologia é a ciência responsável pelos estudos em água interiores ou continentais, a construção de represas constitui provavelmente, um dos mais expressivos exemplos de pressão e capacidade de interferência que o homem exerce sobre a natureza. Sobre os ensinamentos da Limnologia, assinale a alternativa falsa: A) A água é uma substância única, a essência da vida na terra e domina por completo a composição química de todos os organismos; B) As condições térmicas dentro das colunas de água variam muito lentamente, devido ao alto calor específico da água, são mais estáveis e permitem uma estação de crescimento mais longa do que é frequente encontrar nos habitas aéreos; C) Mares e oceanos estão incluídos nos ecossistemas de água salgada, já o ecossistema de água doce pode ser dividido em lêntico e lótico; D) Zona fótica é caracterizada pela zona profunda da água com total ausência de luz; E) A tensão superficial decresce com o aumento da temperatura, da salinidade e da concentração de compostos orgânicos. Página 12 de 12
Download