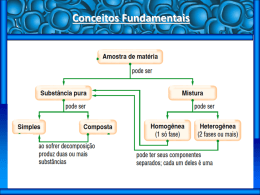
Exerc ícios de Revisão Disciplina: __________ Prof(a).: _____________ Data: _____ de agosto de 2009 Aluno(a): __________________________________________________ Nº: _______ 6º Ano (5ª Série) do Ensino Fundamental ♦ Turma: _____ ♦Unidade: 1- Um sistema heterogêneo bifásico é formado por três líquidos diferentes A ,B ,e C .Sabe-se que: Nilópolis A e B são miscíveis entre si; C é miscível com A e com B ; A é mais volátil que B . Com base nessas informações,os métodos mais adequados para separar os três líquidos são: a) centrifugação e decantação; d) decantação e fusão fracionária; b) filtração e destilação fracionada; e) filtração e centrifugação; c) decantação e destilação fracionada. 2- Os diferentes tipos de matéria podem ser classificados em dois grupos: · substâncias puras; · misturas. As substâncias puras podem ser simples ou compostas.. Considerando-se esse modo de classificação, pode-se afirmar: (01) O ar atmosférico é uma substância pura. (02) A água é uma substância simples. (04) O sangue é uma mistura. (08) Uma solução de açúcar é uma mistura. (16) O oxigênio e o ozônio são substâncias distintas, embora constituídas por átomos de um mesmo elemento químico. (32) A matéria que contém três tipos de molécula é uma substância composta. (64) A matéria que contém apenas um tipo de molécula é uma substância simples, mesmo que cada molécula seja formada por dois átomos diferentes. Soma ( ) 3- Com base na tabela a seguir, que apresenta exemplos de substâncias químicas e seus respectivos pontos de fusão (P.F.)e pontos de ebulição (P.E.),em ºC a 1 atm. Substâncias P.F. P.E. Clorofórmio -63 61 Fenol 43 182 Éter etílico -116 34 Pentano -130 36 a) Determine o estado físico das substâncias em um dia muito quente, cuja temperatura é 39 ºC. b) Determine o estado físico das substâncias em um dia muito frio, cuja temperatura é 10 ºC. 4- Se em um copo contendo água for colocado uma bolinha de naftalina (naftaleno), observa-se que a mesma afunda. Acrescentando-se a esse sistema sal de frutas, a naftalina passa a boiar. Esse fenômeno se deve ao fato de que: a) a naftalina torna-se menos densa, pois começa a se dissolver na água; b) há formação de gás carbônico, o qual interage com a naftalina, deixando-a menos densa; c) com a adição do sal de frutas, gera-se uma solução mais densa que a naftalina, fazendo com que esta bóie; d) a naftalina tem uma grande facilidade para sofrer o processo de sublimação. e) forma-se uma mistura heterogênea instável que tende a se tornar homogênea com a expulsão da naftalina do meio, facilitando sua sublimação. 5- Dentre as transformações a seguir, aquela que não representa um exemplo de fenômeno químico é: a) efervescência do sal de fruta em água; b) ação do fermento na massa do pão; c) eletrólise da água; d) escurecimento de um anel de prata; e) obtenção do nitrogênio a partir da destilação fracionada do ar. 6- Em condições ambientes, a densidade do mercúrio é de aproximadamente 13 g/cm³. A massa desse metal, da qual um garimpeiro de Poconé- MT necessita para encher completamente um frasco de meio litro de capacidade, é de : a) 2.600 g b) 3.200 g c) 4.800 g d) 6.500 g e) 7.400 g 7- Classifique os fenômenos abaixo em físicos ou químicos : a) luz da luab) queima da madeirac) evaporação da naftalinad) gelo derretendo- e) aço enferrujandof) digestão da comidag) mercúrio congelandoh) avalanche- 8- Considere as seguintes características de um sistema material : I- Os componentes do sistema podem ser separados por métodos físicos. II- Os componentes do sistema mantêm a sua identidade química. III. O sistema não apresenta temperatura constante durante mudanças de estado físico. De acordo com essas informações, os sistema pode ser : a) um elemento b) uma substância simples e) uma mistura c) uma substância pura d) uma substância pura 9- Um corpo contém uma mistura de água, acetona, cloreto de sódio e cloreto de prata. A água, a acetona e o cloreto de sódio estão numa mesma fase líquida, enquanto o cloreto de prata se encontra em uma fase sólida. Descreva como podemos realizar, em um laboratório de química, a separação dos componentes dessa mistura: 10- Isótopos radioativos de iodo são utilizados no diagnóstico e tratamento de problemas de tireóide, e são, em geral, ministrados na forma de sais de iodeto. O número de prótons, nêutrons e elétrons no isótopo 131 do ânion monovalente iodeto ¹³¹I₅₃ são respectivamente: a) 53,78 e 52 b) 53,78 e 54 c) 53,131 e 53 d) 131, 53 e 131 e) 52,78 e 53 11- Analise as seguintes afirmativas: I. Isótopos são átomos de um mesmo elemento que possuem mesmo número atômico e diferente número de massa. II. O número atômico de um elemento corresponde ao número de prótons no núcleo de um átomo. III. O número de massa corresponde à soma do número de prótons e do número de elétrons de um elemento. Está (ão) correta(s) : • a) apenas I b) apenas II c) apenas III d) apenas I e II e) apenas II e III
Download