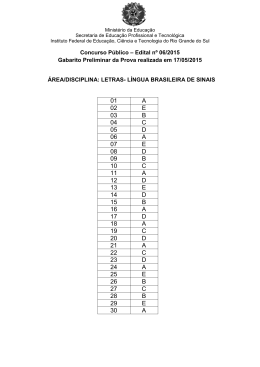
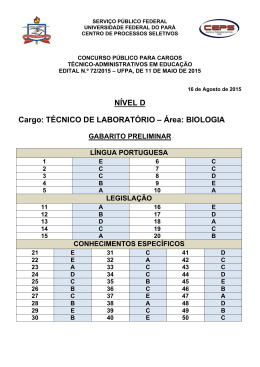
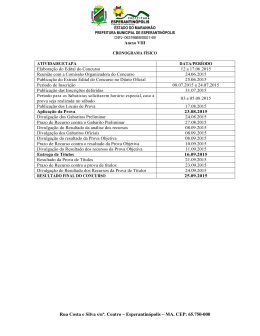
Ministério da Educação – Secretaria de Educação Profissional e Tecnológica Instituto Federal de Educação, Ciência e Tecnologia Catarinense Concurso Público – Edital 080/2012 – Prova Objetiva PROVA - CARGO DE PROFESSOR DA CARREIRA DE MAGISTÉRIO DO ENSINO BÁSICO, TÉCNICO E TECNOLÓGICO QUÍMICA INSTRUÇÕES PARA O CANDIDATO 1. O caderno de prova contém 40 (quarenta) questões objetivas, numeradas de 1 (um) a 40 (quarenta). Confira-o, se ele não estiver completo, chame o fiscal. 2. Verifique, também, seus dados no cartão de respostas e assine no espaço indicado no cartão de respostas. 3. Para evitar possíveis enganos no preenchimento do cartão de respostas oficial, anote, primeiramente no caderno de provas, as alternativas corretas para, somente, então, proceder ao preenchimento definitivo. Observe atentamente as instruções de preenchimento. 4. Somente serão consideradas, para avaliação, as questões respondidas no cartão de respostas que deverá ser preenchido com caneta esferográfica de tinta preta ou azul. 5. Durante a prova, não é permitida a comunicação entre candidatos, nem a utilização de calculadoras, dicionários, telefone celular e de outros recursos didáticos e/ou eletrônicos, bem como portar armas de qualquer tipo. IMPORTANTE A. O CARTÃO DE RESPOSTAS NÃO PODE SER SUBSTITUÍDO. Portanto, somente marque a resposta quando você tiver certeza de que ela é a correta. B. O cartão de respostas não pode ser rasurado, sob pena de anulação das respostas. C. Você deve marcar uma e apenas uma letra em cada questão objetiva no cartão de respostas. Devendo as demais letras ficar sem marcação. D. Não é permitido usar qualquer outro material estranho ao caderno de prova, mesmo para rascunho. E. Você dispõe de até 4 (quatro) horas para concluir a prova, incluindo o preenchimento do cartão de respostas. F. Você somente poderá se retirar da sala de prova objetiva 2 (duas) horas após o início da mesma. G. Ao finalizar a prova você deverá devolver ao fiscal este caderno de prova e o cartão de respostas devidamente assinado, sob pena de caracterização de sua desistência no Concurso. H. Não se esqueça de assinar a lista de presença. I. Os três últimos candidatos deverão entregar a respectiva prova e cartão de respostas e retirar-se da sala simultaneamente. J. O gabarito das provas objetivas desse concurso será divulgado a partir das 18 horas de hoje, conforme prevê o edital. K. O Instituto Federal de Educação, Ciência e Tecnologia Catarinense deseja-lhe BOA PROVA. TEXTO MANEIRA DE AMAR O jardineiro conversava com as flores e elas se habituaram ao diálogo. Passava manhãs contando coisas a uma cravina ou escutando o que lhe confiava um gerânio. O girassol não ia muito com sua cara, ou porque não fosse homem bonito, ou porque os girassóis são orgulhosos de natureza. Em vão o jardineiro tentava captar-lhe as graças, pois o girassol chegava a voltar-se contra a luz para não ver o rosto que lhe sorria. Era uma situação bastante embaraçosa, que as outras flores não comentavam. Nunca, entretanto, o jardineiro deixou de regar o pé de girassol e de renovar-lhe a terra, na devida ocasião. O dono do jardim achou que seu empregado perdia muito tempo parado diante dos canteiros, aparentemente não fazendo coisa alguma. E mandou-o embora, depois de assinar a carteira de trabalho. Depois que o jardineiro saiu, as flores ficaram tristes e censuravam-se porque não tinham induzido o girassol a mudar de atitude. A mais triste de todas era o girassol, que não se conformava com a ausência do homem. "Você o tratava mal, agora está arrependido?" "Não, respondeu, estou triste porque agora não posso tratá-lo mal. É a minha maneira de amar, ele sabia disso, e gostava". (Carlos Drummond de Andrade - Contos Plausíveis) 1. Os textos podem ser classificados de acordo com sua tipologia. Neste texto de Carlos Drummond de Andrade predomina o tipo: A) B) C) D) E) jornalístico. descritivo. argumentativo. narrativo. expositivo. 2. O texto de Drummond apresenta linguagem figurada. Uma delas é a “Personificação” que atribui características humanas a seres inanimados. Qual das alternativas abaixo apresenta esta figura de linguagem? A) B) C) D) E) “ O jardineiro conversava com as flores”. “... ou porque não fosse homem bonito...”. “...o jardineiro deixou de regar o pé de girassol...”. “... e mandou-o embora...”. “... que não se conformava com a ausência do homem...”. Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 2 3. Em qual dos enunciados abaixo o vocábulo luz NÃO está empregado no sentido DENOTATIVO: A) B) C) D) E) As plantas filtram a luz solar. O girassol movimenta-se direcionado pela luz do sol. A luz do sol ofuscou os olhos do jardineiro. A luz de seus olhos ilumina meu caminho. A luz da vela iluminava o ambiente sombrio. 4. Indique a alternativa que traz o elemento que funciona como sujeito do verbo assinalado neste trecho: “Passava manhãs contando coisas a uma cravina ou escutando o que lhe confiava um gerânio.” A) B) C) D) E) cravina gerânio jardineiro manhãs girassol 5. No trecho: “E mandou-o embora, depois de assinar a carteira de trabalho”, termo em destaque tem a função de: A) B) C) D) E) conjunção artigo substantivo adjetivo pronome 6. Qual das orações abaixo NÃO possui o verbo conjugado no tempo pretérito? A) B) C) D) E) “O jardineiro conversava com as flores...” ... “os girassóis são orgulhosos de natureza”. ... “seu empregado perdia muito tempo parado...” ...“as flores ficaram tristes...” ... “A mais triste de todas era o girassol...” Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 3 7. Na oração “A mais triste de todas era o girassol” houve um ajuste dos termos da oração para que se relacionassem adequadamente em gênero e número com o substantivo, neste caso, o substantivo flores. De acordo com as normas gramaticais, temos um caso de: A) B) C) D) E) concordância nominal concordância verbal regência verbal regência nominal paralelismo 8. ...“ou porque os girassóis são orgulhosos de natureza”. Neste trecho o vocábulo porque está grafado junto. Assinale a alternativa que apresenta erro na grafia do vocábulo porque. A) B) C) D) E) O patrão o despediu porque não realizava o trabalho corretamente. Ninguém sabia porque o patrão o despediu. O girassol era orgulhoso porque era o mais bonito. O jardineiro ficou triste porque o girassol o tratou mal. Fazia aquilo porque gostava muito. 9. Ambiguidade é a possibilidade de uma mensagem ter dois sentidos. Assinale a alternativa que apresenta ambiguidade: A) B) C) D) E) O jardineiro falou com o patrão parado no jardim. O jardineiro foi despedido pelo patrão. As flores ficaram tristes depois da saída do jardineiro. A flor que mais sofreu foi o girassol. O girassol foi a flor que mais sofreu. 10. Qual dos enunciados abaixo NÃO é uma oração? A) B) C) D) E) Não pise na grama! Vendem-se mudas de flores. Cuidado, cão bravo! Façam silêncio! Não joguem lixo aqui! Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 4 11. Segundo a Lei nº 11.892/08, os Institutos Federais têm por finalidades e características, exceto: A) ofertar educação profissional e tecnológica, em todos os seus níveis e modalidades, formando e qualificando cidadãos com vistas na atuação profissional nos diversos setores da economia, com ênfase no desenvolvimento socioeconômico local, regional e nacional. B) desenvolver a educação profissional e tecnológica como processo educativo e investigativo de geração e adaptação de soluções técnicas e tecnológicas às demandas sociais e peculiaridades regionais. C) desenvolver programas de extensão e de divulgação científica e tecnológica. D) realizar e estimular a pesquisa aplicada, a produção cultural, o empreendedorismo, o cooperativismo e o desenvolvimento científico e tecnológico. E) promover a reestruturação da educação básica, adequando a infra-estrutura física, quadros de pessoal e os recursos de gestão. 12. Segundo a Constituição Federativa do Brasil o ensino será ministrado com base nos seguintes princípios, exceto: A) igualdade de condições para o acesso e permanência na escola. B) liberdade de aprender, ensinar, pesquisar e divulgar o pensamento, a arte e o saber. C) pluralismo de idéias e de concepções pedagógicas, e coexistência de instituições públicas e privadas de ensino. D) gratuidade do ensino público em estabelecimentos particulares. E) gestão democrática do ensino público, na forma da lei. 13. Ao entrar em exercício, o servidor nomeado para cargo de provimento efetivo ficará sujeito a estágio probatório, durante o qual a sua aptidão e capacidade serão objeto de avaliação para o desempenho do cargo, observados os seguinte fatores, exceto: A) B) C) D) E) discricionariedade. Assiduidade. Disciplina. capacidade de iniciativa. Produtividade. Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 5 14. Em todos os órgãos e entidades da Administração Pública Federal direta, indireta autárquica e fundacional, ou em qualquer órgão ou entidade que exerça atribuições delegadas pelo poder público, deverá ser criada uma Comissão de Ética, encarregada de orientar e aconselhar sobre a ética profissional do servidor, competindo-lhe aplicar penas de: A) B) C) D) E) Advertência. Censura. Suspensão. Demissão. Cassação. 15. Com relação a estrutura organizacional dos Institutos Federais, a única afirmação verdadeira é: A) A administração dos Institutos Federais terá como órgãos superiores o Colégio de Dirigentes e o Conselho Superior. B) O Colégio de Dirigentes, de caráter consultivo e deliberativo, será composto pelo Reitor, pelos Pró-Reitores e pelo Diretor-Geral de cada um dos campi que integram o Instituto Federal. C) O Conselho Superior, de caráter consultivo, será composto por representantes dos docentes, dos estudantes, dos servidores técnico-administrativos, dos egressos da instituição, da sociedade civil e do Ministério da Educação, assegurando-se a representação paritária dos segmentos que compõem a comunidade acadêmica. D) Cada Instituto Federal é organizado em estrutura multicampi, com proposta orçamentária anual identificada para cada campus e a reitoria, inclusive no que diz respeito a pessoal, encargos sociais e benefícios aos servidores. E) O regimento interno do Instituto Federal disporá sobre a estruturação, as competências e as normas de funcionamento do Colégio de Dirigentes e do Conselho Superior. 16. Segundo Luckesi (2010) a avaliação, ao contrário da verificação, é um ato dinâmico no processo de aprendizagem, tendo como objetivo final, uma tomada de decisão que direcione o aprendizado e, consequentemente, o desenvolvimento do aluno. Nesse sentido a avaliação pode ter a função somativa, formativa ou diagnóstica. Considerando o enunciado, analise as afirmativas e marque V para as VERDADEIRAS e F para as FALSAS. ( ) A avaliação somativa tem como objetivo, determinar o grau de domínio do aluno em uma área de aprendizagem, o que permite conceder uma qualificação que, por sua vez, pode ser utilizada como um sinal de credibilidade da aprendizagem realizada. Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 6 ( ) Avaliação formativa é toda prática de avaliação contínua que pretenda contribuir para melhorar as aprendizagens em curso. ( ) A avaliação diagnóstica deve ser assumida como um instrumento de compreensão do estágio de aprendizagem em que se encontra o aluno, tendo em vista tomar decisões suficientes e satisfatórias para que possa avançar no seu processo de aprendizagem. ( ) Tanto a avaliação formativa como a avaliação somativa devem ser utilizadas ao longo do processo pedagógico no sentido de averiguar a posição do aluno face as novas aprendizagens propostas e as aprendizagens anteriores que servem de base àquelas. Assinale a alternativa CORRETA: A) B) C) D) E) V–V–V–V F–V–V–V V–F–V–F V–V- V–F F–V–V–F 17. “A prática escolar tem atrás de si condicionantes sociopolíticos que configuram diferentes concepções de homem e de sociedade”. Libâneo (1985) classifica e agrupa as correntes teóricas utilizando como critério a posição que as tendências pedagógicas adotam em relação às finalidades sociais da escola. Considerando o enunciado, quais tendências pedagógicas estão presentes na pedagogia liberal? Assinale a alternativa CORRETA. A) B) C) D) E) libertadora, libertária, crítico-social dos conteúdos, renovada progressivista tecnicista, renovada progressivista, tradicional, libertária tradicional, renovada progressivista, renovada não-diretiva, tecnicista renovada não-diretiva, libertadora, crítico-social dos conteúdos, libertária Libertária, tecnicista, tradicional, conservadora 18. Segundo Luckesi (2010) a atividade de planejar em todos os níveis – educacional, curricular e de ensino – tem implícito um ato decisório político, científico e técnico. O planejamento que tem por finalidade dimensionar os conteúdos socioculturais que serão transmitidos e assimilados pelos alunos de forma que possibilite atingir os objetivos pedagógicos, corresponde ao: Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 7 Assinale a alternativa CORRETA. A) B) C) D) E) planejamento curricular planejamento político pedagógico planejamento de ensino planejamento educacional planejamento participativo 19. O currículo do ensino médio observará as seguintes diretrizes: (Art. 36 da LDB 9.394/96) Assinale a alternativa INCORRETA. A) destacará a educação tecnológica básica, a compreensão do significado da ciência, das letras e das artes; o processo histórico de transformação da sociedade e da cultura; a língua portuguesa como instrumento de comunicação, acesso ao conhecimento e exercício da cidadania. B) será incluído como tema transversal, o estudo sobre os símbolos nacionais. C) adotará metodologias de ensino e de avaliação que estimulem a iniciativa dos estudantes. D) será incluída uma língua estrangeira moderna, como disciplina obrigatória, escolhida pela comunidade escolar, e uma segunda, em caráter optativo, dentro das disponibilidades da instituição. E) serão incluídas a Filosofia e a Sociologia como disciplinas obrigatórias em todas as séries do ensino médio. 20. Tendo como base a Resolução CNE/CEB nº 2 de 30 de janeiro de 2012 que define as Diretrizes Curriculares para o Ensino Médio, são obrigatórios com tratamento transversal e integradamente, permeando todo o currículo, no âmbito dos demais componentes curriculares os seguintes conteúdos: Assinale a alternativa INCORRETA. A) B) C) D) E) Educação alimentar e nutricional. Processo de envelhecimento, respeito e valorização do idoso. Educação Ambiental. Educação para o trânsito. Educação Inclusiva. Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 8 21. Abaixo estão representados gráficos que descrevem as transformações dos gases: (I) ( II ) ( III ) De acordo com os gráficos e com os conhecimentos sobre as leis dos gases, assinale a alternativa correta: A) O gráfico I obedece à Lei de Boyle, que propõe que a pressão de uma quantidade fixa de gás em temperatura constante é inversamente proporcional ao volume. B) Um gás ideal sofre uma transformação isobárica e sua pressão varia de P para 2P enquanto que sua temperatura varia de T para 2T, esta transformação é representada pelo gráfico II. C) O gráfico III é representado pela Lei de Charles e Gay-Lussac, que descreve a mudança de pressão e temperatura que ocorre em uma amostra de gás ideal à volume constante. D) Analisando o gráfico I, percebe-se que o volume e a temperatura são diretamente proporcionais, então, uma amostra de gás ideal que ocupa um volume de 2,0 L a 27,0ºC, duplicando a temperatura para 54,0ºC, o volume ocupado pelo gás é de 2,2 L. E) Segundo a Lei de Boyle, à pressão constante, o volume ocupado por uma massa fixa de gás é diretamente proporcional à temperatura absoluta Kelvin, esta transformação é chamada de isocórica. 22. Sabe-se que a densidade de um gás depende de sua massa molar, considerando que a densidade de um gás, de comportamento ideal, é de 2,009 g.L-1 a 20°C e 1 atm, qual é a massa molar desse gás? Dado: R = 0,0820574 L.atm.K-1.mol-1 A) 30,1 g/mol B) 48,3 g/mol C) 44,2 g/mol D) 32,8 g/mol E) 58,7 g/mol Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 9 23. A indústria e muitos laboratórios de pesquisas usam gases sob alta pressão, condição em que as leis dos gases ideais não são exatamente obedecidas. Sobre gases ideais e reais é correto afirmar que: A) Os gases ideais são formados por átomos ou moléculas sujeitos a forças intermoleculares, ou seja, sofrem atrações e repulsões intermoleculares, e o volume ocupado pelos átomos ou moléculas individuais não é desprezível em relação ao volume total ocupado pelo gás. B) O comportamento dos gases reais parece obedecer muito bem as leis dos gases ideais nas condições ambientais, mas em elevadas pressões ou elevadas temperaturas, o comportamento foge muito do previsto pela lei dos gases ideais. C) A equação de estado mais conhecida dos gases reais é a equação de Van der Waals: , onde os parâmetros de Van der Waals, a e b, devem ser determinados experimentalmente para cada gás. D) O desvio do comportamento ideal nos gases ocorre à medida que a temperatura aumenta, com o volume constante, a energia cinética média das moléculas aumenta e as forças intermoleculares se tornam cada vez mais efetivas porque o tempo de colisão aumenta. E) Os gases reais não têm a capacidade de se condensarem, para formar um líquido, mesmo alterando a pressão ou a temperatura não se pode provocar a condensação destes gases. 24. A termodinâmica define os efeitos energéticos em duas categorias: W e Q sendo assim a energia de um sistema varia quando há uma variação de trabalho e/ou calor. Sobre a primeira lei da termodinâmica é correto afirmar que: A) Um sistema que libera 10 kJ de calor para as vizinhanças e realiza 2 kJ de trabalho sobre as mesmas, apresenta uma variação de energia interna de - 8 kJ. B) Se o trabalho é realizado pelo ou sobre o sistema e não há calor absorvido ou liberado, então, a energia interna do sistema é nula. C) Quando ocorre uma compressão do sistema, significa que o sistema realiza trabalho sobre as vizinhanças, por isso, a energia interna do sistema tende a diminuir. D) A energia de um sistema pode diminuir adicionando calor ao sistema ou realizando trabalho sobre ele. E) Se nenhum trabalho é realizado sobre ou pelo sistema, o aumento da energia do sistema simplesmente iguala-se a qualquer calor absorvido (ΔU=Q). Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 10 25. O açúcar comum, conhecido como sacarose, é composto de moléculas de glicose e frutose. Se aquecermos o açúcar na presença de água ocorrerá a reação química chamada hidrólise. Já a fermentação alcoólica é um fenômeno através do qual os açúcares, são transformados em álcool e gás carbônico, por ação de leveduras. Com base nas seguintes reações a 25°C e 1 atm, C6H12O6 (s) + C6H12O6 (s) → C12H22O11 (s) + H2O (l) (glicose) (sacarose) (frutose) 4 C2H5OH (l) + 4 CO2 (g) → C6H12O6 (s) + C6H12O6 (s) (etanol) (gás carbônico) (glicose) ∆H = + 26,17 kJ (água) ∆H = + 150,80 kJ (frutose) Assinale a alternativa que forneça o valor da entalpia para 0,5 mol de etanol produzido: A) + 22,12 kJ B) - 176,97 kJ C) - 22,12 kJ D) + 176,97 kJ E) + 88,48 kJ 26. A segunda lei da termodinâmica é a chave para compreender por que certas reações químicas apresentam uma tendência natural de ocorrer e outras não. Para aplicar a segunda lei, usamos dois conceitos muito importantes, a entropia e a energia livre. Sobre a 2ª lei da termodinâmica é correto afirmar que: A) No caso de uma reação exotérmica com uma entropia de reação positiva, a energia livre será negativa e o processo espontâneo. B) A entropia não é uma função de estado, pois o processo não depende somente dos estados inicial e final, e depende do caminho ou sequência de etapas, que conduz um estado para o outro. C) A entropia de um sistema isolado diminui no decorrer de qualquer mudança espontânea. D) A entropia de um sistema diminui quando a água é misturada ao álcool à temperatura constante e aumenta com o congelamento da água. E) A entropia de um sistema diminui quando o volume aumenta, à temperatura constante, aumentando assim a desordem do sistema. Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 11 27. Calcule a energia livre de Gibbs padrão de formação da amônia a 25°C, considerando que a entalpia padrão de formação é - 46,11 kJ.mol-1 e as entropias padrão das substâncias envolvidas na sua formação são: S° N2(g) = 191,61 J.K-1.mol-1, S° H2(g) = 130,68 J.K-1.mol-1 e S° NH3(g) = 192,45 J.K-1.mol-1. 1 N2 (g) + 3 H2 (g) → 2 NH3 (g) A) - 43,6 kJ.mol-1 B) - 75,7 kJ.mol-1 C) + 13,1 kJ.mol-1 D) - 41,1 kJ.mol-1 E) - 16,5 kJ.mol-1 28. A equação química abaixo ilustra a combustão completa do gás metano, principal constituinte do gás natural, e sua entalpia padrão de combustão, a 25°C. CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l) ΔH°c = - 890 kJ.mol-1 Pode-se dizer a respeito da reação de combustão do gás metano: A) Os reagentes absorvem calor ao se converterem nos produtos. B) A entalpia de combustão de ½ mol de metano é - 445 kJ. C) A reação de combustão do metano é um processo endotérmico. D) A energia dos produtos é maior que a dos reagentes. E) A entalpia de combustão de 3 mol de metano é - 297 kJ. 29. Determine o valor da energia livre de Gibbs padrão molar de formação do trióxido de enxofre na seguinte reação: 2 SO2 (g) + O2 (g) → 2 SO3 (g), sabendo-se que o valor da constante de equilíbrio (Kp) para esta reação é igual a 7,0.1024 a 25°C. Dados: R = 8,315 J.K-1.mol-1, ln 7.1024 = 57,2 A) - 70,9 kJ.mol-1 B) + 11,9 kJ.mol-1 C) + 47,6 kJ.mol-1 D) - 141,7 kJ.mol-1 E) - 5,9 kJ.mol-1 Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 12 30. Determine a tensão produzida pela célula galvânica apresentada abaixo e indique se a seguinte reação de célula ocorre espontaneamente ou não a 25°C: Cr(s) + 3 Fe+3 (aq) → Cr+3 (aq) + 3 Fe+2(aq) Dados: Semi-reação: Fe+3 (aq) + e- → Fe+2 (aq) Cr+3 (aq) + 3 e- → Cr (s) ξ° = + 0,77 V ξ° = - 0,74 V A) + 1,04 V, reação não-espontânea. B) + 0,30 V, reação espontânea. C) + 1,51 V, reação espontânea. D) - 1,82 V, reação não-espontânea. E) - 1,29 V, reação não-espontânea. 31. A pilha de Daniell é exemplo antigo de célula galvânica. Seu diagrama de célula é mostrado a seguir: Zn(s) I Zn+2 (aq) II Cu+2 (aq) I Cu(s) Calcule a tensão, em 25°C, de uma pilha de Daniell na qual a concentração de íons Cu+2 é 1,0.10-3 mol.L-1 e a de íons Zn+2 é 1,0.10-1 mol.L-1. Dados: ln 1.102 = 4,6; log 1.102 = 2 Semi-reação: Zn+2 (aq) + 2 e- → Zn (s) Cu+2 (aq) + 2 e- → Cu(s) ξ° = - 0,76 V ξ° = + 0,34 V A) – 1,10 V B) + 1,25 V C) – 1,16 V D) + 1,10 V E) + 1,04 V 32. Quando dois gases ideais A e B se misturam a uma dada temperatura e pressão, pode-se dizer sobre a termodinâmica de misturas que: A) A ΔG mist = n.R.T.(XA.lnXA + XB.lnXB), como ln X é sempre negativo (0<X<1), então a ΔG mist < 0. B) Ocorre uma diminuição na entropia, pois a mistura dos gases é mais desordenada que os gases não misturados. Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 13 C) O aumento na entropia do sistema independe do número de moles dos gases componentes e independe da composição do gás. D) Há variação de entalpia quando dois gases ideais se misturam, o que reflete o fato de que, nesse caso, há interações entre as moléculas. E) As moléculas de um gás podem se misturar com as moléculas de um outro gás, assim, todos os gases se misturam espontaneamente, logo, ΔG mist > 0. 33. Muitas mudanças de fase são fenômenos cotidianos e a sua descrição é uma parte importante da Físico-Química. A energia de Gibbs molar (Gm) depende da fase da substância. O gráfico da variação da energia de Gibbs molar com a pressão está representado abaixo: De acordo com o gráfico e com os conhecimentos sobre mudanças de fase, assinale a alternativa CORRETA: A) Quanto maior a energia de Gibbs molar, maior a estabilidade termodinâmica, logo, a fase mais estável é a que exibe o maior valor de Gm. B) Uma substância tem uma tendência espontânea de mudar para a fase com a menor energia de Gibbs molar. C) Quanto maior for a pressão, maior a energia de Gibbs e mais fácil será a existência de fases gasosas e líquidas. D) Com a diminuição da pressão, a substância condensa-se num líquido e, com a diminuição posterior da pressão, pode ocorrer a formação de um sólido. E) Em baixas pressões, a fase gasosa é a menos estável, e a pressões bem mais altas, a fase sólida se torna a menos estável. Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 14 34. Com base no diagrama de fases do dióxido de carbono, pode-se afirmar que: A) O ponto F no diagrama de fases está na linha que limita as fases líquida e sólida, neste ponto as duas fases estão em equilíbrio. B) No ponto C as três fases coexistem em equilíbrio dinâmico, qualquer mudança de temperatura ou pressão resulta na perda de uma das fases. C) Na pressão de 5,1 atm, o dióxido de carbono é líquido em -58oC e é sólido em 0oC. D) O líquido só pode existir em pressões acima de 5,1 atm. E) O ponto crítico, representado pela letra B no diagrama de fases, marca a menor temperatura em que o líquido pode existir. 35. “Um soluto ideal não produz nenhum efeito na entalpia de uma solução. Entretanto, ele afeta a entropia da solução, introduzindo um grau de desordem que não está presente num solvente puro. Podemos, portanto, esperar que um soluto modifique as propriedades físicas da solução.” (Atkins, Peter. Físico- Química: fundamentos, 3. ed. LTC, 2003.) Com base no texto acima e nos conhecimentos sobre propriedades coligativas, é correto afirmar que: A) Iguais quantidades em mols de diferentes solutos não eletrólitos e não voláteis, dissolvidas numa mesma quantidade de solvente, a uma mesma temperatura, não causam o mesmo abaixamento na pressão de vapor do solvente na solução quando comparado ao solvente puro. B) No laboratório, os químicos usam a elevação do ponto de congelamento para avaliar o grau de pureza de composto sólido, pois se o composto estiver impuro, seu ponto de fusão é mais alto do que o valor considerado na literatura. C) O aumento da temperatura de ebulição provocado pela presença de um soluto não eletrólito e não volátil depende do número de partículas do soluto dissolvidas Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 15 em certa quantidade de solvente. Assim, quanto mais concentrada for a solução, maior será a temperatura de ebulição do solvente. D) A osmose se processa em uma membrana semipermeável, que deixa passar moléculas de solvente, retendo o soluto. Ao colocarmos em contato, por meio de uma membrana semipermeável, duas soluções de diferentes concentrações, o solvente se desloca do meio mais concentrado para o meio menos concentrado. E) A adição de certos aditivos na água dos radiadores de carros, como o etilenoglicol, evita que ocorra o congelamento da mesma porque o aditivo aumenta a pressão de vapor do solvente, causando assim uma diminuição do ponto de congelamento. 36. As soluções que seguem a Lei de Raoult são chamadas de soluções ideais. Utilize a Lei de Raoult para determinar a pressão de vapor, a 20°C, de uma solução preparada pela dissolução de 18,0 g de glicose (C6H12O6) em 90,0 g de água, sabendo que a pressão de vapor da água pura, a 20°C, é 17,54 Torr. Dados: Massa molar: C = 12 g/mol; H = 1 g/mol; O = 16 g/mol. A) 17,82 Torr B) 17,19 Torr C) 17,34 Torr D) 17,51 Torr E) 17,98 Torr 37. Sobre a teoria cinética dos gases, pode-se dizer que: A) Um gás é composto por partículas minúsculas (átomos, íons ou moléculas), que devido ao seu tamanho faz com que a soma de seus volumes individuais seja desprezível se comparado com o volume do recipiente que contém o gás. B) As moléculas de um gás se chocam entre si e com as paredes do recipiente, mas não exercem uma força sobre estas paredes, logo, não há pressão do gás sobre este recipiente. C) A energia total de uma amostra de um gás é, portanto, a soma das energias cinéticas de todas as moléculas presentes nesta amostra, logo, quanto mais lento as moléculas se deslocarem, maior a energia total do gás. D) As moléculas de um gás se deslocam sempre em linha reta e não mudam sua direção quando colidem com outras moléculas ou com as paredes do recipiente. E) As moléculas de um gás não influenciam umas sobre as outras, exceto durante as colisões, logo, ocorrem forças de atração ou repulsão entre as moléculas de um gás ideal. Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 16 38. A dualidade onda-partícula proposta pelo cientista francês Louis de Broglie, constitui uma propriedade básica da mecânica quântica e consiste na capacidade das partículas subatômicas de se comportarem ou terem propriedades tanto de partículas como de ondas. Partindo deste princípio, é possível calcular o comprimento de onda do elétron do átomo de hidrogênio, cuja massa é 9,11.10 -28 g e percorre numa velocidade de 3,0.105 m/s. Admitindo que o valor da constante de Planck é de 6,626.10-34 J.s, pode-se afirmar que o comprimento de onda deste elétron é: A) 4,58 nm. B) 3,67 pm. C) 2,42 nm. D) 5,21 pm. E) 7,98 nm. 39. Resolvendo a equação de Schrödinger chegou-se a três parâmetros necessários para caracterizar os orbitais atômicos, estes foram designados por números quânticos, que são: n (número quântico principal), ℓ (número quântico de momento angular) e mℓ (número quântico magnético). Um outro parâmetro está relacionado com o spin do elétron, ms (número quântico magnético de spin). Com os quatro números quânticos, pode-se determinar a região do espaço em torno do núcleo onde é mais provável se encontrar um elétron. Com base no texto e nos conhecimentos sobre números quânticos, é correto afirmar que: A) Inicialmente, o elétron está no menor nível de energia, isto é, o estado fundamental do átomo, em que n = 1. No átomo de hidrogênio, o valor de n define a forma de um orbital. B) O elétron do átomo de hidrogênio no estado fundamental é descrito por quatro números quânticos cujos valores são: n = 1; ℓ = 1; mℓ = 0; ms = -1/2 ou +1/2, ambos os estados de spins são permitidos. C) Os valores dos números quânticos, do elétron de um átomo de hidrogênio quando ele adquire energia, para os orbitais do subnível 2p podem ser n = 2; ℓ = 2; mℓ = -1. D) Quando um átomo de hidrogênio passa para um estado de maior energia e apresenta como números quânticos n = 3 e ℓ = 2, irão existir sete valores para mℓ, que correspondem a sete orbitais d e estes orbitais têm a mesma energia. E) A distância média de um elétron ao núcleo quando ele ocupa um dos orbitais da camada n = 2 é maior do que quando n = 1, portanto, o átomo aumenta de tamanho quando é excitado energeticamente. Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 17 40. A isoterma de Langmuir é o modelo mais conhecido e empregado para determinar os parâmetros de adsorção. Este modelo foi proposto por Langmuir para adsorções homogêneas. A equação de Langmuir é representada pela equação 1: (1) Onde: q é a quantidade soluto adsorvido, qmax é a quantidade máxima ou a monocamada de adsorvato no adsorvedor, Ceq é a concentração de adsorvato na solução em equilíbrio e KL é a constante de Langmuir. Os parâmetros de adsorção, qmax e KL, podem ser determinados transformando a equação de Langmuir para a forma linear. A Equação 2 representa a melhor regressão linear da isoterma. (2) A figura abaixo ilustra a linearização da isoterma de adsorção de cobre (II) utilizando microesferas de quitosana: Utilizando as fórmulas e o gráfico, determine o valor para a capacidade máxima de adsorção deste material: A) 604 mg.g-1 B) 9 mg.g-1 C) 147 mg.g-1 D) 35 mg.g-1 E) 281 mg.g-1 Concurso Público – Edital 080/2012 – Instituto Federal Catarinense Página 18
Download