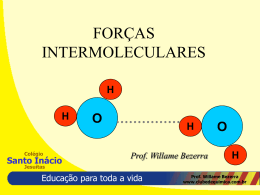
LIGAÇÕES IÔNICAS E COVALENTES Colégio Prof. Willame Bezerra Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Noções sobre Ligações Químicas •Regra do Octeto •Ligação Iônica ou Eletrovalente •Ligação Covalente ou Molecular •Ligação Metálica Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Teoria do Octeto Todos os elementos buscam formas de adquirir distribuições eletrônicas iguais às dos gases nobres para conseguir estabilidade química. Gás nobre Colégio Z Distribuição por Camadas K L M N O Hélio 2 2 Neônio 10 2 8 Argônio 18 2 8 8 Criptônio 36 2 8 18 8 Xenônio 54 2 8 18 18 8 Radônio 86 2 8 18 32 18 P Q 8 Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Ligação Iônica Ligação iônica ou eletrovalente é aquela que se estabelece por meio da transferência definitiva de elétrons entre átomos. Exemplo: Formação do cloreto de sódio (sal de cozinha), a partir do sódio e do cloro. Vejamos: O sódio : Na (Z = 11) = 1s2 , 2s2 , 2p6 , 3 s1 ou 2 – 8 - 1 O cloro : Cl (Z = 17) = 1s2 , 2s2 , 2p6 , 3 s2 3p5 ou 2 – 8 - 7 Dizemos que a eletrovalência do Na + é + 1 e a do Cl - é –1, NaCl é a fórmula do composto e cloreto de sódio, o seu nome. Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br IÔNICA: : caracterizada pela transferência de elétrons. Ocorre entre: METAL e AMETAL METAL e HIDROGÊNIO Propriedades dos compostos iônicos: São sólidos nas condições ambiente Apresentam altos pontos de fusão e ebulição São condutores de eletricidade quando no estado liquido (fundidos) ou quando dissolvidos em água. A maioria dos compostos são solúveis em água. Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br DETERMINAÇÃO DA FÓRMULA DE UM COMPOSTO IÔNICO Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Formação do Fluoreto de Cálcio a partir do 20 Ca e 9F: ATENÇÃO: Após a ligação, continuamos tendo os mesmos elementos e, portanto, os mesmos símbolos, já que não houve alteração dos núcleos. Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Composto iônico é o nome dado às estruturas cujos átomos estão unidos por meio de ligações iônicas. Na fórmula de um composto iônico, escreve-se em primeiro lugar o cátion e posteriormente o ânion. Um composto iônico AB qualquer, formado pelos íons A + a e B – b, o índice de A é igual à carga de B, e o índice de B é igual à carga de A . (Não é preciso levar em conta o sinal desse valores). Em todo composto iônico, a soma das cargas positivas é sempre igual à das negativas. Conseqüentemente, a soma total das cargas do composto é zero. Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br A unidade elementar de uma substância que apresenta ligação iônica é o aglomerado iônico caracterizado pela sua fórmula. Na ligação iônica o doador de elétrons é um METAL, enquanto o receptor é NÃOMETAL ou HIDROGÊNIO. Esses arranjos de íons, formando figuras geométricas definidas, são chamados redes cristalinas ou retículos cristalinos. Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Ligação Covalente ou Molecular Ligação covalente é aquela que envolve um par eletrônico que é compartilhado pelos dois átomos. Ligação entre dois átomos de hidrogênio (1H) Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br LIGAÇÃO COVALENTE: formação de pares eletrônicos Ocorre entre: AMETAL e AMETAL AMETAL e HIDROGÊNIO Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Propriedades dos compostos moleculares: São sólidos, líquidos ou gasosos nas condições ambiente Apresentam baixos pontos de fusão e ebulição (comparados aos iônicos) São maus condutores de eletricidade, alguns podem conduzir quando em meio aquoso (ionização). A maioria dos compostos são solúveis em solventes orgânicos. Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Molécula de amônia. Colégio Santo Inácio Jesuítas Prof. Willame Bezerra Moléculas são as unidades elementares que exibem Educação para toda a vida das substâncias www.clubedequimica.com.br apenas ligações covalentes. Ligação Metálica Ligação metálica é aquela realizada entre átomos e cátions de metais cujos elétrons mais externos migram do átomo para o cátion e vice-versa. Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Ligas Metálicas Ligas metálicas são uniões de dois ou mais metais, podendo ainda incluir não-metais, mais sempre com predominância dos elementos metálicos. Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br Colégio Santo Inácio Jesuítas Educação para toda a vida Prof. Willame Bezerra www.clubedequimica.com.br
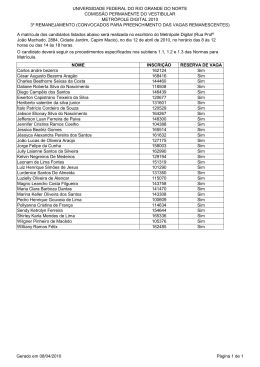
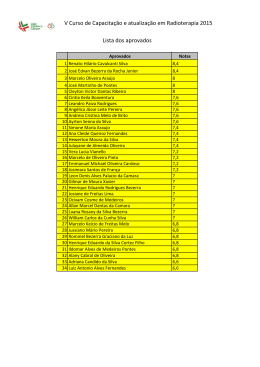
Download