Fundamentos de fermentação
1. Introdução
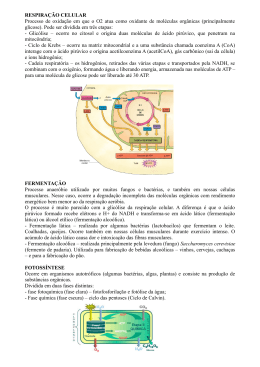
Pasteur definiu o conceito de fermentação como o fenómeno que descreve a
existência de vida na ausência de oxigénio. Assim, e por razões históricas, o termo
fermentação define os processos biológicos desenvolvidos por microrganismos, que
ocorrem na ausência de luz e não envolvem cadeias respiratórias com o oxigénio ou o
nitrato. Todavia alguns destes microrganismos, como por exemplo as enterobactérias,
também podem crescer na presença de oxigénio e, por isso, hoje em dia utiliza-se o termo
fermentação de um modo mais lato.
Os microrganismos mais utilizados na produção industrial de enzimas são os
heterótrofos aeróbios. O seu metabolismo, caracteriza-se genericamente pela oxidação de
substratos orgânicos e, concomitantemente, redução de oxigénio, convertendo o substrato
em material celular, dióxido de carbono e água [111].
Os microrganismos selvagens produzem o(s) bioproduto(s) em quantidades
absolutamente necessárias ao seu crescimento, por exemplo enzimas, como resposta de
adaptação metabólica ao meio de cultura [114]. Ácidos nucleicos, proteinas, aminoácidos,
nucleótidos e outros bioprodutos classificam-se, em geral, como produtos primários
produzidos durante a fase exponencial essenciais ao crescimento celular. No caso de
enzimas podem distinguir-se as enzimas catabólicas e anabólicas que estão, em geral,
sujeitas a regulação metabólica. Por isso, o microrganismo não os sintetiza todos ao mesmo
tempo mas apenas, os absolutamente necessários ao seu crescimento, de acordo com as
condições fisiológicas do meio de cultura.
A nível industrial, o que se procura é condicionar este microrganismo, de modo a
aumentar a produtividade de um dado bioproduto, por formulação adequada do meio e
condições de fermentação ou manipulação genética da estirpe produtora. Deste modo,
ultrapassa-se o controlo metabólico da biossíntese desse bioproduto, por exemplo um dado
enzima ou grupo de enzimas. Basicamente pode-se distinguir três tipos de fermentação ou
cultura, todos usados na biossíntese de bioprodutos:
-Descontínua ("batch") em que os microrganismos são inoculados num vaso "fechado"
contendo o meio líquido de cultura previamente esterilizado. As células multiplicam-se,
aumentando desse modo a população microbiana, até que se esgote uma ou mais das fontes
nutricionais essenciais ao seu crescimento.
- Contínua consiste num sistema biológico em que o meio de cultura é constantemente
renovado a uma determinada velocidade, mantendo aproximadamente constante o volume e
1
as concentrações de biomassa e dos nutrientes.
- Descontínua com alimentação ("fed-batch") é um tipo de cultura intermédia entre as duas
anteriores. Numa primeira fase processa-se como a cultura descontínua e em seguida,
alimenta-se contínua ou gradualmente o fermentador com nutrientes a uma velocidade
adequada, sem retirar meio de cultura, aumentando a partir desse instante o volume total do
meio líquido. Esta alimentação é efectuada antes que nutrientes fundamentais se esgotem
ou evitando, que um deles atinja uma concentração muito elevada.
1.1. Regulação metabólica na biossíntese de um dado bioproduto
O DNA das células microbianas, genótipo, define em detalhe as suas
potencialidades de biossíntese de um dado bioproduto. Todavia a sua biossíntese, depende
da natureza e composição do meio de cultura, assim como, das próprias condições de
crescimento do microrganismo produtor. O meio não modifica o mapa genético da célula,
mas afecta apreciavelmente a expressão dos genes, através de mecanismos regulatórios que
controlam o metabolismo das células, de modo, a não desperdiçar nutrientes na síntese de
metabolitos ou outros bioprodutos, que naquele ambiente, não são essenciais ao seu
crescimento [112]. Contudo, convêm lembrar que são as enzimas que levam à transcrição
dos genes e à biossíntese de um dado bioproduto e, indirectamente, a sua biossíntese está
dependente da actividade enzimática dessas enzimas envolvidas na sua síntese.
1.1.1 Indução
Dos milhares de proteinas e enzimas codificados no genótipo de uma célula, só um
certo número de enzimas é inicialmente sintetizado pelas células em quantidades
significativas, independentemente do meio de crescimento. Estas enzimas, são designadas
por constitutivas, diferenciando-se desse modo, das induzidas, que são produzidas quando o
indutor (co-factores, moléculas de substrato, de produto ou compostos análogos) está
presente no meio de crescimento [112].
O modelo de regulação metabólica por indução, foi proposto e aplicado com bons
resultados na síntese da maioria das enzimas catabólicas, distinguindo-se no entanto, dois
tipos de mecanismos (figura 3.1.) [113]:
- Indução coordenada em que o indutor induz a síntese de todas as enzimas requeridas para
a sua degradação (ex. enzimas envolvidos no ciclo metabólico de Entner-Doudoroff e de
arabinose).
- Indução sequencial em que o indutor promove a síntese da enzima para a degradação de
2
vários substratos (ex. enzimas intervenientes na degradação de compostos aromáticos).
Stainer e Ornston, 1973, referidos em [118], verificaram que uma estirpe de Pseudomonas
putida sintetiza cerca de 10 enzimas induzidos por um substrato aromático, transformandoo, num intermediário metabólico como o "catechol" que posteriormente é degradado em
sucinato e acetil-coA.
O modelo regulatório de indução de enzimas, hoje em dia, mais largamente aceite
foi proposto por Jacob e Monod, 1961 [119], tendo sido posteriormente confirmado pela
interpretação de dados genéticos e fisiológicos. Segundo este modelo (figura 3.2.) existem
4 genes no cromossoma (DNA) que regulam a síntese de uma enzima particular.
Figura 3.1. Mecanismos de indução coordenada (a) ou sequencial (b) [118].
Figura 3.2. Modelo de Jacob e Monod, num sistema de controlo negativo de uma enzima
induzida [112].
3
No caso de controlo negativo, o gene regulador R codifica a produção da proteína
repressora (repressor), que se liga ao gene operador O e inibe a transcrição do DNA do
gene estrutural S que contem, por sua vez, a informação genética da enzima. A RNA
polimerase (sintetizada no gene promotor P) ao mover-se ao longo do gene estrutural S,
desde que o repressor tenha sido inactivado com o indutor, transcreve para o RNA
mensageiro (mRNA) a informação genética, de cuja tradução posterior tem origem a
enzima. Outros autores [120] encontraram mais tarde, mecanismos regulatórios com
controlo positivo, isto é, o repressor na presença do indutor era convertido num activador
de transcrição do gene estrutural S da enzima.
Mutantes resultantes da modificação positiva dos genes R ou O interferem
respectivamente, com a formação da proteína repressora, ou ao nível da sua ligação com o
gene operador, eliminando desse modo, a necessidade do indutor e, por isso, são
classificados como estirpes que sofreram mutações constitutivas.
1.1.2 Repressão por produtos finais ("Feedback regulation")
Repressão por produtos finais ("feedback regulation"), ocorre por exemplo, quando
o meio de crescimento possui determinados monómeros intervenientes na estrutura de
macromoléculas. Neste caso, estes monómeros vão reprimir a formação pelos
microrganismos, das enzimas anabólicas envolvidas na biossíntese desses constituintes. As
bactérias, com vias metabólicas para a síntese de aminoácidos aromáticos (ex. histidina e
triptofano), podem dispensar a sua produção, desde que eles existam no meio de
crescimento. Neste caso, estes monómeros são co-repressores, que se acumulam na célula e
ao combinarem-se com uma proteína repressora apo-repressora, também com origem no
gene R, dão origem a um repressor activo, que se liga ao gene operador O e não permite a
transcrição do gene estrutural S da enzima (figura 3.3.).
1.1.3. Repressão catabólica
A repressão catabólica é normalmente associada ao consumo de glucose e outros
hidratos de carbono, presentes no meio de crescimento. Estes substratos são rapidamente
metabolizados como fonte de carbono, reprimindo a síntese de certas enzimas do tipo
catabólico induzido. Este fenómeno, também foi observado para o ião amónio reprimindo,
neste caso concreto, a síntese de enzimas envolvidas na produção de metabolitos
secundários [121]. Por outro lado, este fenómeno é, parcial ou totalmente ultrapassado,
quando a concentração destes nutrientes (hidratos de carbono ou ião amónio), é muito baixa
4
usando uma estratégia de fermentação em “fed-bacth”, ou quando se adiciona, ao meio de
fermentação, o nucleótido cicloadenosina monofosfato (C-AMP).
Figura 3.3. Modelo de regulação por produtos finais ("feedback regulation") [112].
Actualmente sabe-se, que o consumo de nutrientes rapidamente metabolizados
provoca uma diminuição apreciável na concentração intracelular do C-AMP, que é segundo
alguns autores [122], essencial no estímulo da activação dos genes estruturais de um grande
número de enzimas, assim como também é necessário na síntese do mRNA, associado a
enzimas induzíveis da Escherichia coli [112]. No primeiro caso, o nucleótido liga-se ao
gene promotor P por intermédio de uma proteína especial, a proteína de ligação do C-AMP
(CRP), aumentando a afinidade do RNA polimerase pelo gene P e, consequentemente, a
frequência de transcrição do gene estrutural S da enzima.
Estes aspectos da regulação da expressão de genes na célula e sua compreensão são
muito importantes pois a biossíntese de um dado bioproduto dependente muito da
actividade das enzimas envolvidas na sua síntese, e, por isso, com o intuito de aumentar
significativamente os níveis de síntese desse bioproduto, regra geral, só é possível por
desregulação metabólica, por mutação aleatória ou desenhada dos genes, das enzimas
envolvidas na sua biossíntese.
5
2. Crescimento celular
O crescimento celular e a formação de um dado bioproduto são resultantes da
actividade fisiológica dos microrganismos e uma resposta às condições ambientais de
crescimento. No caso das bactérias, que se dividem por fissão, a célula mãe dá origem a
duas células filhas que crescem exactamente como a progenitora. A primeira célula, antes
de se dividir, duplica a sua massa e a quantidade de todos os seus constituintes e ainda,
sintetiza a membrana celular.
A curva de crescimento, em cultura descontínua, é caracterizada genericamente por
quatro fases principais distintas (figura 3.4.).
Figura 3.4. Cinética de crescimento celular numa cultura descontínua caracterizada por,
fase latência, fase exponencial, fase estacionária (a) e fase de declínio ou morte (b) [112].
- A fase de latência (lag), que ocorre após a inoculação do meio, é um período de adaptação
do microrganismo, devido à reorganização dos seus constituintes micro- e
macromoleculares necessários à sua manutenção e divisão celular. Este período, quando se
prolonga durante muito tempo, devido a um pequeno inóculo ou células com baixa
viabilidade, é muito desfavorável em termos de produtividade (g biomassa/L.h) do
fermentador num processo industrial. Por outro lado, conduz ao dispêndio de nutrientes
energéticos, na manutenção das células.
- A fase exponencial (log), durante o crescimento do microrganismo, expresso pelo
aumento da massa celular (X) ou do número de células (N), é caracterizada por uma
velocidade (dX/dt ou dN/dt) exponencial e um tempo de duplicação (td) constante,
6
descritos em termos matemáticos respectivamente por,
dX/dt = µ * X
ou
e
dN/dt = µ * N
td = ln 2 / µ
em que, a constante cinética µ é a taxa específica de crescimento. Se durante este período
não ocorrem limitações nutricionais, o crescimento é balanceado, também designado por
alguns autores por "estado estacionário", em que a taxa específica de crescimento µ é
máxima e constante.
- A fase estacionária, acontece quando as células viáveis atingem um equilíbrio com as
células que morrem. Neste caso, a taxa de crescimento aparente é nula, isto é, a taxa
específica de crescimento é igual à taxa de morte celular.
- A fase de declínio ou morte, ocorre quando a massa celular ou o número de células, no
meio de cultura, diminuem devido à lise das células.
O crescimento celular, numa cultura descontínua, é acompanhado pela variação da
concentração de alguns nutrientes no fermentador devido ao seu consumo, para a formação
de micro e macromoléculas (ex: DNA, proteína, mRNA, outras) resultantes da actividade
metabólica celular. A concentração intracelular, dessas macromoléculas nas células, varia
ao longo da fermentação (figura 3.5.).
Figura 3.5. Composição macromolecular e crescimento celular durante a fermentação
descontínua [112].
7
2.1. Definição de rendimentos de bioconversão do substrato em biomassa e bioproduto
O crescimento celular (X) e a formação do bioproduto (P) são resultantes da
bioconversão, pelos microrganismos, dos nutrientes presentes no meio de fermentação em
biomassa e bioprodutos. Estas conversões podem ser quantificadas, num dado período de
tempo, pelos coeficientes de rendimento em massa celular Yx/s ou produto formado Yp/s
por unidade de massa do nutriente limitante consumido (S) e expressos, respectivamente,
por:
Yx/s = ∆ X / ∆ S
e
Yp/s = ∆ P / ∆ S
2.2. Taxa específica de crescimento
2.2.1. Efeito da concentração do substrato limitante
A quantidade de biomassa resultante do crescimento, em cultura descontínua, está
intimamente relacionada com a quantidade inicial de substrato limitante disponível, como
se pode ver na figura 3.6.
Figura 3.6. Influência da concentração inicial do substrato limitante no crescimento celular
[113].
Na zona A-B, a biomassa total (X) é proporcional à concentração inicial de substrato
limitante expressa por:
X = Yx/s * (So - S)
em que So e S, são as concentrações de substrato inicial e final e Yx/s , o coeficiente de
8
rendimento (g células / g substrato). Na zona A-B, no ponto em que pára o crescimento,
pode-se considerar que S ~ 0. Na zona B-C e na zona C-D, um aumento da concentração
inicial de substrato, não produz um incremento proporcional na quantidade final de
biomassa, porque o crescimento está controlado pela produção de uma toxina que afecta a
utilização do substrato.
Monod, 1949 [123] observou que a variação da taxa específica de crescimento (µ)
em função da concentração do substrato limitante no meio de cultura (fonte de carbono ou
azoto, sais inorgânicos, nitrato, fosfato, sulfato, aminoácidos, vitaminas, outros) era
formalmente semelhante à cinética de Michaelis-Menten, expressa pela actividade de
enzimas em relação à concentração de substrato e por isso, aquele autor propôs
µ = µmax * S / (Ks + S)
Sendo, neste caso, Ks inversamente proporcional à afinidade do microrganismo pelo
substrato. Na tabela 2 apresenta-se valores típicos de Ks para diferentes estirpes e
substratos.
Tabela 2 – Alguns valores da constante de saturação Ks relativamente
a diferentes substratos para diferentes estirpes microbianas.
Estirpe microbiana
Klebsiella
Lactobacillus
Pseudomonas
Escherichia coli
Candida
Saccharomyces
Hansenula
Aspergillus
Substrato
Dióxido de carbono
Magnésio
Potássio
Glucose
Metanol
Metano
Glucose
Lactose
Manitol
Glicerol
Triptofano
Fosfato
Glucose
Glicerol
Glucose
Metanol
Arginina
Glucose
KS (mg L-1)
0,4
0,6
0,4
5
0,4
0,7
2–4
20
2
2
0,001
1,6
25 – 75
4,5
25
120
0,5
5
dados retirados de Pirt (1975), Atkinson e Mavituna (1991), Yeh et al. (1991), Doran (1995).
Vários autores, propuseram posteriormente algumas variantes ao modelo de Monod,
entre elas, pode-se destacar [124]:
- A taxa específica de crescimento, é função de 2 ou mais substratos limitantes (substratos
presentes no meio de crescimento a baixas concentrações).
9
µ = µmax * [S1/(Ks1+S1)] * [S2/(Ks2+S2)]
- O substrato inibe o crescimento acima de um determinado valor de concentração.
µ = µmax * S / [Ks + S + (S/Ki)2]
em que, Ki é o coeficiente de inibição do substrato.
- A biomassa celular, para valores muito elevados de concentração, pode também inibir a
velocidade de crescimento e neste caso, µ diminui com o aumento da concentração da
biomassa de acordo com a equação.
µ = µmax * S / (Ks*X+ S)
2.2.2. Crescimento em meio complexos
O crescimento do microrganismo, em cultura descontínua e na presença de várias
fontes de carbono e energia, é caracterizado por uma série de fases de crescimento, cada
uma delas, com taxas específicas de crescimento sucessivamente mais pequenas (figura
3.7.).
Figura 3.7. Evolução da biomassa e das taxas específicas de crescimento representadas por
tangentes à curva de desenvolvimento celular [112].
No caso de um meio complexo, existe uma multiplicidade de fontes de carbono,
mas também, uma grande variedade de compostos, tais como: aminoácidos, nucleótidos,
vitaminas, outros que só são sintetizados, pelos microrganismos, após o seu esgotamento do
meio de cultura. Em face da abundância, de fontes de carbono e de metabolitos presentes
neste meio, a célula passa por uma série de fases de transição, durante o crescimento,
caracterizadas por diferentes valores da taxa específica de crescimento.
10
2.2.3. Efeito da temperatura
A temperatura afecta, a velocidade das reacções químicas e enzimáticas de acordo
com a equação empírica de Arrehenius
K = A * exp[-E/(R*T)]
em que, E é a energia de activação, R a constante dos gases, T a temperatura absoluta e A
uma constante característica do sistema. Como o metabolismo celular envolve reacções
enzimáticas complexas, é natural, que a taxa específica de crescimento também seja
afectada pela temperatura [124],
µ = µmax(T) * S / [Ks(T) + S]
em que
µmax(T) = A * exp[-E1/(R*T)]
e
Ks(T) = K3 * exp[-E2/(R*T)]
2.2.4. Efeito do pH
A variação do pH, durante a fermentação, deve-se essencialmente à natureza dos
nutrientes que estão a ser metabolizados pelo microrganismo. Este caso é relevante, pois a
assimilação do ião amónio, provoca em geral, diminuição do valor de pH no meio de
cultura, enquanto os aminoácidos, quando utilizados, são desaminados aumentando o valor
de pH. No caso da metabolização de hidratos de carbono, segundo o ciclo EmbdenMeyerhof, ocorre principalmente com a produção de ácidos orgânicos, como ácido láctico,
acético ou pirúvico.
A actividade biológica é menos afectada pelo pH, do que pela temperatura, devido
as células terem capacidade de regulação interna da concentração de hidrogeniões. Como o
pH, afecta a estrutura e a permeabilidade da membrana celular, alguns autores propuseram
factores de correcção na taxa específica de crescimento, que corrija esse efeito, através da
concentração do hidrogenião H+ no meio de cultura [124].
µmax(pH) = µmax / (1+Kj/H+ + K*H+)
2.2.5. Efeito do oxigénio
O crescimento de microrganismos aeróbios em fermentadores, pouco arejados e/ou
agitados e com elevada concentração de células, são os casos típicos em que o oxigénio, é o
substrato limitante. Por isso, a taxa específica de crescimento é, nestes casos, função da
concentração de oxigénio dissolvido O2.
µ = µmax * O2 / (Ko + O2)
11
ou
rO2/x = µ . X = [µ max O2 / ( Ko + O2)] . X
(1.6)
em que O2 é a concentração de oxigénio dissolvido no seio da fase líquida e Ko a
“constante” de saturação em relação ao oxigénio.
Os valores Ko são, em geral, muito pequenos quando comparados com valores de KS
(ver Tabelas 2 e 4). Como se pode ver pela comparação dos valores, no caso de células não
agregadas, as concentrações diminutas de oxigénio dissolvido, da ordem de 30% de
saturação (cerca de 2 mg L-1 a 30°C) são, em geral, suficientes para que o oxigénio não seja
o nutriente limitante.
Tabela 4 – Alguns valores da constante de saturação relativamente
ao oxigénio, Ko para diferentes estirpes microbianas.
Espécie
Acetobacter suboxydans
Azotobacter indicum
Bacillus megaterium
Escherichia coli
Candida utilis
Saccharomyces cerevisiae
Penicillium chrysogenum
Temperatura (°C)
19
20
21
19
19
24
Ko (mg L-1)
0,06
0,1
2,8
0,06
41 - 450
2
7
dados retirados de Pirt (1975), Atkinson e Mavituna (1991).
Contudo, em culturas desprovidas de controlo da concentração de oxigénio
dissolvido, pode acontecer, num intervalo de tempo da ordem de alguns minutos, passar-se
de uma situação em que existia oxigénio em excesso no meio, para outra, cineticamente
distinta, em que o oxigénio é fortemente limitante da velocidade reaccional. O mesmo se
verifica em reactores de grandes dimensões com um grau de mistura insuficiente quando as
células são forçadas a movimentar-se de regiões bem arejadas para regiões onde a mistura e
a concentração do oxigénio são reduzidas.
12
3. Cinética de fermentação
3.1. Método de cálculo
As cinéticas de fermentação procuram traduzir matematicamente, as velocidades de
produção e consumo dos vários bioprodutos e nutrientes presentes no meio de cultura. Num
fermentador descontínuo, considera-se então, que as variações de concentrações desses
compostos, num dado intervalo de tempo, correspondem em 1ª aproximação, às respectivas
velocidades de formação e consumo, admitindo desprezável as variações de volume
provocadas pela amostragem, a evaporação de água do meio e correcções do pH.
As velocidades (rc) calculam-se, num dado instante, pelas variações das
concentrações ∆C, dos diferentes compostos biológicas e químicos, num intervalo de tempo
∆t
rc = ∆C / ∆ t
ou num intervalo de tempo infinitesimal ∆ t > 0 .
rc = dC/dt
O método mais rigoroso do cálculo, dessas velocidades é aplicar um ajuste
("fitting") a três ou quatro pontos experimentais, em redor do instante considerado, sendo a
velocidade igual ao respectivo declive. No caso de um procedimento de modelação de um
processo de fermentação, recorre-se a um programa ("software") e testa-se aos pontos
experimentais obtidos. No entanto, nem sempre o melhor ajuste, com um coeficiente de
correlação mais elevado entre os dados simulados e os dados experimentais, é o mais
adequado mas sim verificar também se o modelo permite uma interpretação biológica dos
dados experimentais.
3.1.2 Cinética de crescimento celular
A velocidade de crescimento da massa celular (rx = dX/dt) é expressa por uma
equação de 1ª ordem, em relação ao nível da concentração em biomassa (X) e quantificada
através de uma constante cinética, a taxa específica de crescimento µ.
rx = µ * X
Se a taxa específica de crescimento segue o modelo de Monod, vem então
rx = µmax * S / (Ks + S) * X
em que, os parâmetros cinéticos do crescimento celular, µmax e Ks, podem ser
determinados pela linearização da equação anterior 1/µ = f(1/S). Estes parâmetros são
13
função da temperatura, do pH, da concentração do substrato limitante inicial, do oxigénio
dissolvido, da concentração inicial do indutor, da fase de indução e de outras condições
operatórias.
3.1.3. Cinética do consumo da fonte de carbono
O crescimento celular implica consumo de substratos que fornecem matéria-prima
e energia para a formação de novas células. Nas culturas de organismos heterotróficos, um
determinado nutriente, S, serve, em geral, simultaneamente de fonte de carbono e de
energia. Assim, para formar uma quantidade de biomassa ∆X, é consumida a quantidade de
∆S de substrato, de acordo com a equação:
∆S = (∆S) assimilação + (∆S)energia
(1:14)
em que (∆S) assimilação e (∆S)energia representam respectivamente as fracções de substrato
consumido e incorporado na biomassa formada e a fracção que foi oxidada de modo a gerar
a energia necessária à biossíntese.
A velocidade do consumo de substrato fonte de carbono (rs = -dS/dt), depende da sua
velocidade de incorporação na massa celular, ou seja, da velocidade de crescimento celular
(rx) e também do consumo desse substrato na energia de manutenção das células (ms),
sendo por isso quantificada matematicamente por,
rs = rx / Yx/s + ms * X
ou
σs = rs / X = µ / Yx/s + ms
Em que σs é a taxa específica de consumo do substrato, sendo os parâmetros; Yx/s
(coeficiente de rendimento da formação da biomassa em relação ao consumo de substrato)
e ms estimados pela relação linear entre σs = f1(µ). A energia de manutenção preserva a
célula viável, ao regenerar os seus constituintes e controlar os gradientes de concentração
entre, o interior e o exterior da célula (pressão osmótica).
Contudo, a obtenção dos dados experimentais para a obtenção destes parâmetros
cinéticos nem sempre são fáceis para sistemas biológicos muito simples e com um só
substrato. No caso particular de sistemas de fermentação a partir de meios complexos então
as dificuldades ainda são maiores. Por exemplo, nestas condições, o valor do coeficiente de
rendimento, representado pelo quociente ∆X/(∆S)assimilação, e abreviado por Yx/s, está, na
maior parte dos casos inacessível, quer por cálculo, quer experimentalmente.
Na prática, a razão quantificável ∆X/(∆S) seria idêntica a rx/rSx , razão das
velocidades específicas de formação de biomassa (rx) e consumo de substrato (rSx) para a
14
formação da biomassa num determinado período de tempo, i.e., o factor de rendimento
biomassa / substrato (Yx/s) que exprime-se em kg kg-1 ou mol mol-1 poderia também ser
calculado pela razão das taxas específicas de crescimento celular (µ) e consumo específico
do substrato (σSx) obtidos nesse período de tempo.
Yx/s = µ/(σSx)
(l:15a)
Como não é possível identificar exactamente o substrato incorporado na formação da
biomassa então, em abordagens preliminares, é prática corrente calcular-se, os rendimentos
directamente a partir dos dados experimentais, isto é, a biomassa formada em relação ao
substrato total consumido ∆S, e calcula-se, assim, o chamado rendimento observado (ou
rendimento experimental) (Y´x/s)obs, i.e., rx/rs e tendo em conta as taxas específicas, é
naturalmente legítimo escrever:
(Y´x/s)obs = µ/(σS)
(1.16)
3.1.4. Cinética de consumo da fonte de azoto
A velocidade de consumo de fonte de azoto (rn = -dN/dt) depende, tal como o
substrato fonte de carbono, da sua velocidade de incorporação na massa celular e, por isso,
pode também ser expresso por:
rn = rx / Yx/n
ou
σn = rn / X = µ / Yx/n
O coeficiente de rendimento da formação de biomassa em relação à fonte de azoto, Yx/n e,
num modelo biológico muito simples, obtém-se da relação linear entre σn = f2(µ) em que,
σn é a taxa específica de consumo da fonte de azoto.
3.1.5. Cinética de consumo do oxigénio
Num determinado intervalo de tempo, as velocidades de consumo de oxigénio
(dO2/dt), em que O2 é concentração do oxigénio dissolvido no meio de cultura, para a
formação de biomassa, para a manutenção e a formação de bioproduto (respectivamente
rO2x , rO2m e rO2p) correlacionam-se com rx , rsm e rp da seguinte forma:
rO2x = rx / Yx/o
(1.17)
rO2m = rsm / Ys/o
(1.18)
rO2p = rp / Yp/o
(1.19)
e, em que Yx/o, Ys/o e Yp/o são, respectivamente, os rendimentos biomassa/oxigénio,
fonte de carbono/oxigénio e produto/oxigénio. A velocidade de consumo do oxigénio
global, rO2, também conhecida por oxygen uptake rate (OUR), é o somatório das
velocidades de consumo de oxigénio parciais.
15
Por sua vez, a velocidade de transferência de oxigénio (OTR) é descrita por:
OTR = kLa * (C* - CL)
em que, kLa é o coeficiente global de transferência do oxigénio, C* e CL as concentrações
de oxigénio de equilíbrio e dissolvido no meio liquido. Se esta última concentração é mais
baixa do que um valor crítico, característico de cada microrganismo, do meio e das
condições de fermentação, o oxigénio é o substrato limitante que controla o crescimento
(ver tabela 4).
A velocidade de consumo de oxigénio pelo microrganismo (OUR) é expressa em
termos da concentração de células (X), da taxa específica de crescimento µ e do coeficiente
de rendimento do consumo do oxigénio em relação à formação da biomassa ao oxigénio,
Yo/x , pela equação.
OUR = µ * X / Yo/x
Na circunstância do crescimento ser limitado pelo oxigénio, a taxa de consumo é,
neste caso, igual à taxa de transferência do oxigénio.
OUR = OTR
Observa-se então, uma dependência da taxa específica de crescimento, com o mecanismo
de transferência de oxigénio, expresso por
µ = Yo/x * kLa * (C* - CL) / X
Em termos da velocidade de crescimento (dX/dt), vem
dX/dt = Yo/x * kLa * (C* - CL)
e, consequentemente, verifica-se que o crescimento do microrganismo é função linear da
força motriz da transferência de oxigénio (C* - CL).
3.1.6. Cinética de formação do bioproduto
A formação do bioproduto (P), com origem microbiana, está de alguma maneira
associada ao crescimento celular.
Durante os períodos de crescimento celular activo, o principal produto da reacção
biológica é a própria biomassa. As reacções biológicas são autocatalíticas, i.e., quanto
maior concentração das células em estado reprodutivo, mais elevada será a velocidade de
formação de biomassa (g cel/L.h). Para além da biomassa formada, designam-se por
“produtos metabólicos” os compostos biossintetizados nas reacções intracelulares que são
excretadas para a fase abiótica (produtos extracelulares) e aqueles que a célula armazena
(produtos intracelulares). Incluem-se nesta última categoria os materiais de reserva (ex:
glicogénio, polifosfato, polihidroxialcanoatos, etc), enzimas intracelulares (ex: glucose16
isomerase) e proteínas recombinantes na forma de corpos de inclusão, entre outros. Em
culturas desenhadas para a produção de metabolitos intracelulares a separação das células, a
sua desintegração e o posterior isolamento do produto são etapas básicas do processo.
Quando se trata de um produto extracelular há que proceder à sua separação das células
presentes no meio de cultura e ao seu posterior isolamento e, eventual, purificação.
Assim, alguns autores propuseram várias classificações de acordo com a biossíntese
do bioproduto com o crescimento celular. A classificação de Gaden, 1959 [125] é a mais
usual e muito utilizada na modelação da biossíntese do produto durante a fermentação. Esta
classificação baseia-se em 3 tipos de cinéticas distintas de formação do produto em relação
à biomassa, como se pode observar na figura 3.8.
Figura 3.8. Evolução do crescimento celular (X) e formação do produto (P) em cultura
descontínua : (a) produto associado ao crescimento, (b) formação do produto mista e
(c) produto não associado ao crescimento [112].
A relação entre a velocidade de formação do produto (rp = dP/dt) com as
velocidades de formação da biomassa (rx) e própria concentração de biomassa (X) foi
quantificada por Luedeking e Piret, 1959 [126] de acordo com a seguinte relação
matemática:
rp = α * rx + β * X
Esta equação permite distinguir 3 tipos de formação do produto:
- Tipo I cinética associada com o crescimento (ex. metabolitos primários)
rp = α * rx
em que, β = 0 e α > 0, sendo este calculado da relação linear rp = f3 (rx).
-Tipo II cinética mista (ex. biossíntese do ácido acético, cuja formação só está parcialmente
associada com o crescimento)
rp = α * rx + β * X
17
em que, α e β > 0, sendo obtidos da relação linear entre a taxa específica de formação do
produto (Π = rp/X) com a taxa específica de crescimento (µ).
Π=α*µ+β
- Tipo III cinética não associada com o crescimento (ex. metabolitos secundários)
rp = β * X
em que, α = 0 e β > 0, sendo este obtido directamente da relação linear rp = f4(X).
3.2.7. Conceitos de modelação
Ao propor-se um modelo de fermentação, pretende-se com ele descrever o processo
de crescimento do microrganismo, a síntese de um dado bioproduto e se possível, prever os
respectivos efeitos ao variar a composição do meio e as condições operacionais da
fermentação. Para isso, o modelo estabelecerá relações de causa e efeito entre as variáveis
da fermentação, tais como; as concentrações dos substratos (fontes de carbono, azoto,
outros), da biomassa e do produto. Os processos biológicos são extremamente complexos,
por isso, os modelos estruturados usados, ao nível dos componentes moleculares e
macromoleculares intracelulares, na interpretação pormenorizada dos mecanismos
metabólicos de biossíntese de bioprodutos (ex: proteínas, enzimas, antibióticos, etc) são
muito difíceis de aplicar.
A nível industrial, o que se procura é maximizar a produção de um dado bioproduto,
sendo assim, é, em geral, mais conveniente optar por um modelo simples não estruturado,
que descreva macroscopicamente o processo da sua biossíntese no fermentador. Este
modelo baseia-se em fundamentos bioquímicos e físicos-químicos, que interpretam a célula
como uma unidade, capaz de realizar reacções do tipo das esquematizadas na figura 3.9.
Figura 3.9. Modelo não estruturado [124].
O modelo não estruturado considera as propriedades médias da célula, não tendo em
18
conta as suas diferenças individuais e desprezando por isso, a sua estrutura e diferenças
biológicas. Neste modelo a célula responde em uníssono, ao estado e modificações das
variáveis de fermentação no meio de cultura. O desenvolvimento de um modelo não
estruturado, exige essencialmente três grupos de relações básicas, aplicadas ao volume de
controlo coincidente com o fermentador, como sejam [124]:
- Os balanços, envolvendo a massa total, os componentes individuais e a energia.
- As velocidades de consumo (substratos), formação (bioprodutos) e ainda, de transferência
de massa, energia e componentes individuais através da interface do meio circundante com
o volume de controlo.
- Relações termodinâmicas ou de equilíbrio.
Neste caso, os balanços de massa e energia, as cinéticas bioquímicas tradicionais de
crescimento celular, de consumo dos substratos e formação do bioproduto são muito
utilizadas no modelo não estruturado. Assim, os respectivos parâmetros são coeficientes
estequiométricos e/ou rendimento, constantes de velocidade de consumo dos substratos
e/ou formação do bioproduto, constantes de saturação e de inibição, entre outros.
Para os modelos mais complexos, estas cinéticas traduzem sistemas dinâmicos,
descritos por equações diferenciais intimamente interligadas e, por isso, tem de recorrer-se
a técnicas computacionais de resolução simultânea das diferentes equações, a partir dos
dados experimentais, para a estimativa dos parâmetros do modelo. A solução encontrada
para as diferentes equações é a que conduz à minimização da soma dos mínimos
quadráticos do desvio entre os valores experimentais e os valores previstos pelo modelo.
Todavia, um bom ajuste do modelo aos dados experimentais, não é razão suficiente para
tornar o modelo aceitável, nem prova a sua aplicabilidade ou validade.
19
4. Microrganismos e meios de cultura de utilização industrial
4.1 Introdução
A produção de bioprodutos por microrganismos heterótrofos aeróbios efectua-se por
uma fermentação típica que se caracteriza pelos seguintes passos [113]:
- Formulação dos meios para o inóculo, para o fermentador de sementeira, para o préfermentação e para a biossíntese do bioproduto.
- Esterilização dos meios, fermentadores e outros equipamentos auxiliares.
- Preparação de uma cultura pura a partir de um balão e multiplicada em quantidade
suficiente em fermentadores de sementeira (“seed”) até ao pré-fermentador para inocular o
fermentador de produção industrial.
- Crescimento do microrganismo e biossíntese do bioproduto num meio e em condições
favoráveis à sua formação.
- Extracção do bioproduto do meio de fermentação exausto ou das células, no caso de ser
um bioproduto intracelular, e sua posterior purificação.
- Tratamento dos efluentes resultantes do processo fermentativo.
Fig. 4.1 — Esquema geral de um processo fermentativo industrial.
A Fig. 4.1 apresenta um esquema geral deste processo fermentativo de forma
20
simplificada e o seu sucesso depende muito de uma correcta definição de quatro pontos
básicos: o microrganismo, o meio de cultura, a forma de condução do processo
fermentativo e as etapas de recuperação do bioproduto.
Na verdade, estes quatro pilares de um processo biológico industrial estão
intimamente interligados e interagem entre si, sendo, por isso, necessário a sua optimização
de forma conjunta levando em consideração aspectos biológicos e económicos, o que nem
sempre é fácil de encontrar o compromisso ideal e mais adequado. Por exemplo, pode-se
mencionar que pretende-se sempre empregar meios de cultura baratos, mas deve-se lembrar
que o microrganismo deve encontrar neste meio condições adequadas para realizar
eventualmente o seu crescimento e a biossíntese ou bioconversão pretendida e, assim,
conseguir produzir o bioproduto alvo em biorreactores que podem atingir volumes de
dezenas de milhares de litros.
As operações finais para a recuperação do bioproduto alvo (operações de
“downstream”), são igualmente de enorme importância pois se o bioproduto não tiver as
especificações em termos de propriedades físico-químicas, actividade biológica, pureza, etc
não terá valor comercial, por melhor e mais optimizado que tiver sido o processo
fermentativo. No entanto, a importância de uma adequada definição das operações de
recuperação do produto, fica mais clara quando se aborda a produção de bioprodutos de
alto valor acrescentado, como a produção de antibióticos, enzimas, ou outras proteínas
(insulina, hormonas de crescimento, vacinas, etc.). Para esses casos, as operações de
recuperação do bioproduto podem ser responsáveis por 50 a 70% do custo do final,
indicando, claramente, a importância em termos de uma adequada optimização global do
bioprocesso.
Os aspectos relacionados com a forma de operação de biorreactores, assim como as
operações de recuperação de bioprodutos, serão abordados nos capítulos seguintes. Cabe,
agora, abordar alguma reflexão e discussão sobre microrganismos e meios de cultura que
podem ser eventualmente empregados em uma operação industrial.
4.2 Fontes de microrganismos de interesse
Microrganismos que possam ter interesse industrial, podem ser obtidos basicamente
das seguintes formas:
- Isolamento a partir de recursos naturais,
- Compra em colecções de culturas,
- Obtenção de mutantes naturais,
- Obtenção de mutantes induzidos por métodos convencionais,
21
- Obtenção de microrganismos recombinantes por técnicas de engenharia genética.
O isolamento de microrganismos a partir de recursos naturais, tais como solo, água,
plantas etc., sempre foi uma actividade de grande importância para a obtenção de novas
estirpes produtoras de interesse industrial. Trata-se de uma actividade que envolve muito
trabalho experimental e, logo, um custo relativamente elevado, porém pode conduzir ao
isolamento de estirpes com maior capacidade produtora de um dado bioproduto, mas, mais
importante do que isto, pode conduzir à descoberta de novos bioprodutos, o que confere a
esta actividade industrial uma importância fundamental.
Cumpre lembrar que as grandes empresas produtoras de antibióticos, ou enzimas,
mantêm programas de isolamento de estirpes com origem em recursos naturais, justamente
com o objectivo de incrementar a produção de certos bioprodutos, ou com o objectivo, por
exemplo, de encontrar estirpes produtoras de novos antibióticos. Contudo, o isolamento de
novas estirpes deve ter início com certas premissas, definindo-se o que se pretende obter,
pois o simples isolamento poderá levar à disponibilidade de um número inimaginável de
culturas, o que dificulta a sua utilização vantajosa no bioprocesso existente na fábrica ou o
bioproduto que se pretende produzir.
A compra de estirpes em colecções de culturas é presentemente bastante viável, tendo
em vista a existência de muitas colecções de culturas em vários países. Nesse sentido,
Stanbury et al.1 listam nada menos do que 11 colecções de culturas em vários países (tabela
1). Contudo, este número aumentou significativamente nos anos mais recentes. O contacto
com essas colecções é actualmente muito facilitado, podendo-se utilizar os recursos da
Internet para tal tarefa.
Tabela 1. Exemplo de alguns centros internacionais que possuem coleção de culturas ou centros onde é
possível obter informações.
Coleção de culturas
ATCC
American Type Culture Collection, USA
NCIMB National Collections of Industrial and Marine Bacteria, UK
NRRL
Northern Regional Research Laboratories, Agricultural Research Service, USA
CBS
Centraal Bureau voor de Schimmelcultures,, The Netherlands
DSMZ
Deutsche Sammlung fur Mikroorganismen und Zellkulmrcn, Germany
IFO
Institute for Fermentation Osaka, Japan
IAM
Institute of Applied Microbiology, University of Tokyo, Japan
CMI
Commonwealth Mycological Institute, UK
CCT
Coleção de Culturas Tropical de Campinas, Brasil
Centros de informação
WDC
Worldwide Directory of Culture Collections, Japan
MSDN
Microbial Strain Data Network, Institute of Biotechnology Cambridge University, UK
ICECC
Information Center for European Culture Collections, Germany
22
Na produção industrial de um dado antibiótico, o microrganismo utilizado não estará
disponível em uma colecção de culturas mas, em geral, será oriundo de programas de
melhoramento genético realizado na própria empresa.
Quando uma dada célula prolífera, em meios de cultura sólidos ou líquidos, há
sempre uma pequena possibilidade de surgimento de mutantes naturais. Contudo, estas
mutações naturais não são, de forma alguma, interessantes do ponto de vista de um
processo fermentativo industrial e devem ser evitadas ou minimizadas a todo o custo. Por
esse motivo, convêm isolar e ensaiar as células durante a preparação do inóculo no
laboratório várias vezes com o objectivo de verificar e certificar da sua potencialidade na
biossíntese de um dado bioproduto específico. E só uma vez garantida a reprodutibilidade
da biossíntese do bioproduto, de acordo com um protocolo de caracterização previamente
estabelecido, a estirpe é, então, seleccionada na preparação do inóculo num balão a ser
usado na fábrica.
Contudo, estas mutações naturais podem, eventualmente, gerar novas estirpes
produtoras que apresentem interesse prático mas poderá significar o dispêndio de muito
tempo, razão pela qual prefere-se, há já várias décadas, lançar mão de métodos que forcem
o aparecimento de células mutantes, como é o caso de submeter suspensões de células ou
esporos a radiações ultravioleta ou a substâncias químicas mutagénicas, como a
nitrosoguanidina. Ao se permitir essa exposição ou contacto com agentes mutagénicos,
ocorre uma drástica destruição da maioria das células, recuperando-se, a seguir, aquelas que
sobreviveram, verificando-se se sofreram mutação em alguma direcção desejada, como
seja, aumento na capacidade de biossíntese do bioproduto alvo.
Esta técnica para a obtenção de mutantes é obviamente aleatória, tratando-se de
recuperar as células sobreviventes em meios ou condições específicas, de forma a dirigir
este isolamento para obter células com novas capacidades que se pretende. Tais programas
de mutação/selecção costumam ser bastante dispendiosos, mas levaram a várias condições
de sucesso descritas na literatura.
Um caso bem relatado foi a significativa melhoria da estirpe mutante de Penicillium
chrysogenum para a produção de penicilina. De fato, na década de 40 obtinha-se teor de
penicilina no caldo fermentado da ordem de 100 unidades/cm3, passando-se a obter, já por
volta de 1976, teores da ordem de 51.000 unidades/cm3. Acréscimos da ordem de 4 vezes
foram obtidos entre 1970 e 19851, o que indica que este progresso costuma ser muito
interessante, especialmente quando se parte de estirpes naturais.
Outra direcção na obtenção de novas estirpes mutantes com interesse industrial pode
ser, por exemplo, minimização da biossíntese de impurezas que acompanham
concomitantemente a biossíntese do antibiótico alvo e, respectivos, epímeros.
23
Neste caso, pode-se ilustrar o exemplo das estirpes mutantes industriais de
Streptomyces aureofaciens usadas na biossíntese de desmetilclorotetraciclina (DMCT),
também designada por demeclociclina (Deme). Durante a fermentação e biossíntese de
demeclociclina ocorre a formação simultânea de desmetiltetraciclina (DMT) em
quantidades relativas que têm a haver com o próprio microrganismo produtor e as
condições de fermentação. Por outro lado, em solução, as tetraciclinas sofrem também
reacções reversíveis de epimerização dando origem a um produto menos activo (epis). O
grau de extensão desta reacção está directamente relacionado com o tempo de exposição a
um determinado pH e temperatura e com a presença ou não de iões fosfato ou citrato. O
teor em epis aumenta com a exposição prolongada a temperaturas elevadas e a valores de
pH extremos. Deste modo na produção de demeclociclina podem formar-se, em maior ou
menor quantidades, os respectivos epímeros da desmetiltetraciclina como o
4epidesmetiltetraciclina (epiDMT), e o epímero da desmetilclorotetraciclina como por
exemplo o 4- epidesmetilclorotetraciclina (epiDMCT) (Fig. 4.2).
As agências reguladoras de produtos farmacêuticos como o FDA definem os teores
máximos dessas impurezas e epímeros e podem considerar um dado bioproduto, neste
exemplo antibiótico, sem valor farmacêutico e, logo, comercial se não se conseguir limitar
a biossíntese dessas impurezas e reacções de epimerização durante o isolamento e
purificação do antibiótico alvo.
Outra direcção interessante neste procedimento de pesquisa de novas estirpes
mutantes é o bloqueamento de algumas vias metabólicas, por exemplo minimização da
biossíntese de ácidos orgânicos a partir de hidratos de carbono beneficiando directamente o
rendimento em biomassa e/ou bioproduto em relação ao nutriente limitante existente no
meio de cultura, por exemplo, fonte de carbono.
Tais progressos, realmente significativos, costumam ser atribuídos apenas a esses
programas de mutação/selecção da nova estirpe mutante, mas é conveniente lembrar o
trabalho necessário de selecção mais adequada da estirpe durante a preparação do inóculo
do balão ao pré-fermentador, da adaptação da estirpe ao meio de produção do bioproduto
alvo, a forma e estratégias do modo de operação do processo fermentativo, e as alterações
nas etapas de recuperação e purificação do produto, a fim de proporcionar o real
surgimento das vantagens, ao nível de produção industrial.2
Outra estratégia de modificação genética de um microrganismo é a introdução de
fragmentos de DNA de certas células bacterianas, animais, vegetais, e humanas em célula
de outros microrganismos hospedeiros, via vectores virais ou plasmídeos de DNA, que
permite a obtenção de células modificadas geneticamente, porém de forma muito mais
inteligente e dirigida, do que as metodologias de mutação convencionais anteriormente
24
mencionadas, sendo possível ser executada em bactérias, leveduras, e fungos mas
igualmente com células animais e vegetais.
Fig. 4.2. Fórmulas estruturais de impurezas (desmetiltetraciclina) e epis que acompanham
concomitantemente
(demeclociclina).
biossíntese
do
antibiótico
alvo,
a
desmetilclorotetraciclina
25
Nas últimas décadas, estas técnicas de engenharia genética trouxeram sem dúvida um
imenso avanço nas possibilidades de se obter células mais produtivas, por exemplo,
introdução de mais cópias do gene de uma enzima específica que limita a velocidade de um
determinado fluxo metabólico. Com esse procedimento, aumenta-se o número de cópias do
gene responsável pela síntese da enzima específica, o que permite aumentar a velocidade da
reacção limitante, pela presença de uma maior concentração da enzima responsável na
biossíntese de um determinado bioproduto. Esta estratégia foi empregada, por exemplo, no
incremento da produção de cefalosporina C por Cephalosporium acremonium.1
Outra situação poderia ser identificar a enzima de mais baixa actividade ou
estabilidade e, por algum desses motivos, responsável do passo de catálise limitante da
reacção global de uma via metabólica. Esta enzima poderia ser manipulada, através do
conhecimento da sua estrutura e alteração de determinados aminoácidos, por técnicas de
engenharia de proteínas, com o objectivo de obter uma nova enzima recombinante com
actividade e/ou estabilidade aumentada. O gene correspondente a essa nova enzima
recombinante seria adicionado, por exemplo, através de um plasmídeo de DNA usado para
transformar a célula produtora, se possível, caracterizado também com capacidade de
replicação multicópia.
A potencialidade dessas técnicas é realmente enorme, pois, uma vez identificado e
solucionado o problema de uma dada reacção limitante, outra reacção da sequência
metabólica passará a ser limitante, o que permite imaginar a realização de igual estratégia
para esta nova reacção. Claro está que tais procedimentos não são de simples execução,
pois inclusive exigem um amplo conhecimento do metabolismo celular da estirpe produtora
utilizada, mas apresentam um enorme interesse prático.
Outra situação muito comum é a introdução de plasmídeo para tornar as células
recombinantes produtoras de substâncias que naturalmente não são por elas produzidas, em
virtude da ausência de codificação genética no seu(s) cromossoma(s). Neste grupo de
substâncias, também designadas por heterólogas, podem-se destacar muitos exemplos,
como sejam, enzimas, proteínas terapêuticas, anticorpos, hormonas e outros factores de
crescimento, vitaminas, vacinas, DNA plasmídeo, etc.
Nesse caso, genes de certas células são transferidos, via vectores virais ou plasmídeos
de DNA adequados, a outras células hospedeiras, como é o caso de introduzir a codificação
para a síntese de glucoamilase de Aspergilius em células de Saccharomyces cerevisiae, o
que passa a permitir a realização da fermentação alcoólica de matérias-primas amiláceas,
pela levedura geneticamente alterada.3,4
Com esse objectivo, a tecnologia do DNA recombinante tem sido utilizada para a
obtenção de proteínas heterólogas de alto valor acrescentado, em particular, para uso em
26
saúde humana, como é o caso da produção de hormonas de crescimento humano, insulina,
interferons, Factor VIII (tratamento da hemofilia), etc.
Como microrganismos hospedeiros e receptores da codificação genética empregamse bactérias (ex: Escherichia coli, Bacilius subtilis), leveduras (ex: Saccharomyces
cerevisiae) ou fungos filamentosos (ex: Aspergillus niger). Igualmente são empregadas
células animais (ex: BHK - “Baby Hamster Kidney”, CHO - “Chinese Hamster Ovary”),
particularmente para a produção de proteínas mais complexas e de maior valor
acrescentado, o que explica o crescente interesse das grandes empresas do sector no cultivo
de células animais.
4.3 Características desejáveis do microrganismo e do meio em aplicações industriais
Apresenta-se agora algumas características gerais e desejáveis do microrganismo
produtor, do meio de cultivo e condições de fermentação, lembrando que o desempenho de
um dado microrganismo depende muito da composição do meio de cultura em que é
cultivado no processo produtivo em larga escala.
4.3.1 Características desejáveis do microrganismo
Para uma aplicação industrial, espera-se que os microrganismos apresentem as
seguintes características gerais:
• Elevada eficiência na conversão do substrato em bioproduto;
• Permitir a expressão e acumulação do bioproduto no meio, de forma a haver logo
elevada concentração no caldo fermentado e, também maior produtividade,
expresso em g produto / L.h;
• Não produzir substâncias e impurezas incompatíveis com a qualidade final do
bioproduto;
• Apresentar reprodutibilidade quanto ao comportamento;
• Estabilidade durante o desenvolvimento do inóculo desde o balão até à préfermentação na fábrica;
• Não ser patogénico;
• Não exigir condições de processo fermentativo muito complexas;
• Não exigir meios de cultura dispendiosos;
• Permitir uma rápida expressão e, por exemplo se for produto extracelular, excreção
do bioproduto para o meio de fermentação.
27
De fato, uma célula deve permitir elevada conversão do substrato em bioproduto,
pois, com muita frequência, as matérias-primas incidem pesadamente no custo do produto
final, uma vez que pode-se mencionar uma incidência de 38 a 73% do custo total de
produção como sendo devido às matérias-primas, em particular a fonte orgânica de
carbono.1
Por outro lado, é sempre desejável que o microrganismo permita uma elevada
acumulação do bioproduto no meio, sem sofrer inibição mais acentuada, em virtude desta
acumulação, pois isto concorre para uma redução nos custos de recuperação, os quais
também podem ser muito acentuados.
Tome-se como exemplo o caso da fermentação alcoólica, aqui representada
simplificadamente pela equação química final (glucose sendo convertida em anaerobiose
em etanol e dióxido de carbono):
C6H12O6 2 C2H5OH + 2 CO2
Como se pode observar, o fator estequiométrico mássico teórico é igual a 0,511, ou
seja, cada grama de glucose convertida gera 0,511g de etanol. Como a Saccharomyces
cerevisiae é usada, normalmente, nesta fermentação com rendimento da ordem de 90%
deste valor estequiométrico. Esta facto torna este microrganismo o mais importante para
realizar esta conversão em termos industriais uma vez que outros microrganismos também
podem acumular etanol no meio de fermentação, a partir da glucose, porém não com este
que rendimento tão elevado.
Obviamente, não se consegue manter um processo de fermentação alcoólica obtendose 100% de rendimento, pois as células produtoras têm de proliferar, o que significa a
biossíntese de muitos outros compostos intermediários, sendo a acumulação de etanol a via
metabólica, em condições de anaerobiose, que permite a geração de energia na forma de
ATP (glicólise). Claro está que este é um ponto fundamental, pois a matéria-prima (custo
da glucose 0,1 - 0,35 $/Kg) incide em algo como 60% do custo do etanol (0,2 – 0,8 $/kg) e,
desta forma, baixos rendimentos tornariam inviável a produção deste bioproduto de baixo
valor acrescentado.
Por outro lado, sabe-se que quando se atinge 8 a 10% (em volume) em etanol no
vinho fermentado, já ocorre uma clara inibição da levedura, o que faz com que a velocidade
da bioconversão do açúcar em etanol fique prejudicada, razão pela qual procura-se não
ultrapassar estes valores, pelo menos na produção de álcool combustível. Isso significa a
necessidade de destilar um líquido que contém apenas 10% de etanol, o que, além de exigir
o dispêndio significativo de energia, ainda irá gerar 90% de resíduo que necessita encontrar
um destino adequado, em princípio, a estação de tratamento de efluentes líquidos.
De qualquer forma, fica claro que a conversão da matéria-prima em produto já é
28
muito elevada, o que não permite visualizar grandes incrementos, lembrando, novamente, a
necessidade de manter a viabilidade celular para que a fermentação não seja interrompida.
O ideal seria encontrar leveduras mais resistentes ao etanol e, logo, sem diminuição da
velocidade da fermentação alcoólica (sem queda na produtividade, i.e., g etanol/L.h), o que
não é tarefa simples.
Uma situação bem diversa é a que ocorre com os processos aeróbios, por exemplo,
na produção de enzimas ou antibióticos. Nesse caso, a conversão do açúcar pode ser
representada esquematicamente da seguinte forma:
Açúcar + Fonte azoto + O2 Células + CO2 + H2O + Intermediários + Produto
Neste caso, por se operar em aerobiose, a quantidade de células geradas costuma
ser muito intensa, em relação ao açúcar consumido, ao lado de uma quantidade
relativamente pequena do bioproduto alvo (antibiótico ou enzima). Se, por um lado, o custo
da matéria-prima incide menos pesadamente no custo do produto final, as operações de
recuperação do produto são necessariamente mais onerosas (chega-se a valores da ordem de
70%), mas compensado pelo fato de o bioproduto alvo ser de alto valor acrescentado.
Assim, ao se encontrar estirpes produtoras que cresçam relativamente menos ou conduzam
à biossíntese muito maior do bioproduto alvo, isto é, estirpes caracterizadas com maiores
rendimentos de formação do bioproduto por biomassa (Yp/x). Este exemplo está conforme
o plano de mutações e optimização do meio já mencionado anteriormente para o caso da
produção de penicilina.
Mesmo permitindo a acumulação do produto no meio, a célula produtora deve, ainda,
contar com a característica de não produzir substâncias que sejam incompatíveis com o
bioproduto alvo, pois isto pode levar a uma situação de desinteresse comercial do processo
produtivo como o caso dos limites baixos exigidos de impurezas e epis discutida
anteriormente na biossíntese da demeclociclina.
Esta situação também pode ser muito bem ilustrada, por exemplo, na produção de
uma dada enzima, ou proteína, mas se utilizar uma estirpe produtora que também seja
simultaneamente uma boa produtora de proteases extracelulares. Assim, durante, a
biossíntese da enzima, na sua excreção e acumulação no meio de fermentação, no passo de
separação das células, nos vários passos de isolamento e purificação da enzima e durante o
próprio armazenamento do produto, pode-se ter uma redução significativa da actividade
enzimática em virtude da acção das proteases. Portanto, neste exemplo, é fulcral minimizar
ou eliminar a biossíntese das proteases pela estirpe produtora ou eliminar, logo no início do
bioprocesso, a sua presença nos extractos enzimáticos usados nos diferentes passos de
29
isolamento e purificação da enzima.
Outro exemplo mais específico, é sobre a produção de glucoamilase por Aspergilius.
Como se sabe, a glucoamilase é a enzima que hidrolisa o amido gerando glucose, sendo
pois de muito interesse em várias aplicações, destacando-se a preparação de xaropes de
glucose para a indústria alimentar. Ocorre que alguns microrganismos produtores de
glucoamilase também sintetizam a transglucosidase, enzima esta que, quando na presença
de glucose, volta a polimerizá-la, gerando moléculas que não são mais hidrolisadas pela
glucoamilase. Portanto, neste caso, deve-se procurar e seleccionar uma estirpe produtora
que não onduza à biossíntese ou minimize a produção da transglucosidase.
Além destas características desejáveis, o microrganismo ideal deve também produzir
o mínimo de outras substâncias ou impurezas, ao mesmo tempo em que biossintetiza o
bioproduto alvo. Isso leva a uma maior disponibilidade de nutrientes para a biossíntese do
bioproduto, mas também permite vislumbrar um processo mais fácil na recuperação deste
bioproduto.
Uma outra característica, também importante, refere-se à estabilidade fisiológica da
estirpe produtora a ser usada industrialmente. Isso significa que não basta que se tenha uma
estirpe hiperprodutora de uma dada substância de interesse, mas que se conheça as técnicas
mais adequadas para a sua conservação e, mais ainda, que ela se mantenha como excelente
produtora do bioproduto de interesse ao longo de todas as etapas envolvidas desde sua
proliferação ao nível de laboratório, nos fermentadores de propagação (sementeira e préfermentação) e biorreactor principal na escala industrial (Fig. 4.1).
Por esse motivo, o estudo constante das formas de conservação mais adequadas das
estirpes produtoras de uso industrial é uma tarefa muito importante, conservando-se, na
indústria, aquelas realmente de interesse, assim como o imediato descarte dos lotes que
demonstrem alguma tendência à perda da capacidade de biossíntese do bioproduto,
aumento da biossíntese de impurezas, diminuição da produtividade devido à inibição do
bioproduto acumulado no meio de fermentação, ou atenuação quanto à excreção e
acumulação do produto no meio extracelular. Assim, em termos de metodologias de
conservação há sempre a tendência em verificar o crescimento da célula mas também deve
verificar se a estirpe continua a biossintetizar o produto alvo, e a excretar e acumular o
produto no meio de fermentação.
Como o processo fermentativo típico, normalmente parte de uma massa muito
reduzida de células produtoras nas etapas iniciais de preparação do inóculo (Fig. 4.1) e
pretende-se chegar a biorreactores de dezenas de milhares de litros, contendo concentrações
celulares com frequência acima de 10 g de matéria seca de células/L, o que significa gerar,
em termos de massa de matéria seca, algo em torno de toneladas de células.
30
A propagação da estirpe produtora tem de passar, em geral, por vários estágios de
propagação, nomeadamente, em um ou dois fermentadores de sementeira e pelo menos uma
pré-fermentação, antes da sua utilização no fermentador industrial. O elevado número
destes passos aumenta o risco de contaminação e a estirpe pode, entretanto, sofrer mutações
naturais ou pode ocorrer alguma contaminação ou alguma outra deficiência que conduza à
perda da estirpe antes atingir em quantidade suficiente para inocular o fermentador
industrial. A estirpe produtora quando vai inocular o meio no fermentador industrial tem,
em geral, de satisfazer os seguintes critérios [113]:
- Encontrar-se num estado activo, de modo a minimizar a duração ou ser inexistente a fase
de latência (lag).
- Estar disponível em quantidade suficiente para um volume de inóculo óptimo, entre 3 e 10
% (v/v).
- Estar numa forma morfologicamente adequada.
- Estar livre de contaminações.
- Reter as capacidades metabólicas de biossíntese do bioproduto alvo.
Assim, a estabilidade material genético da estirpe produtora durante o
desenvolvimento do inóculo, desde o balão até à pré-fermentação na fábrica, é um factor de
maior importância pois um mau procedimento pode levar a elevadas perdas relacionadas
com o custo dos nutrientes, mão-de-obra, energia, etc. Para disso pode também conduzir à
paragem da fábrica, um ou mais dias, por perda de um lote do bioproduto a nível industrial
e pode representar centenas ou milhares de kg de produto que vão atrasar a entrega de
futuras encomendas.
Este fenómeno da perda de estabilidade genética quer da capacidade de biossíntese
ou de acumulação do bioproduto de interesse no meio de fermentação pode ocorrer tanto
com estirpes naturais, como com as estirpes mutantes.
Por isso, na fábrica, por exemplo, o departamento de investigação e desenvolvimento
testa e monitoriza permanentemente as características das estirpes produtoras ao nível do
laboratório e da escala piloto antes de seleccionar a estirpe a ser usada a nível industrial.
Outra prática corrente no processo a nível industrial é duplicar todos os inóculos desde o
simples balão até ao pré-fermentador e escolher o que tiver em melhor situação, de acordo
com parâmetros morfológicos, bioquímicos, isentos de contaminação, etc para passar ao
passo seguinte diminuindo desta maneira a probabilidade de haver falhas durante o
desenvolvimento do inóculo na fábrica. O outro inóculo não seleccionado seja balão,
fermentador de sementeira ou pré-fermentação será esterilizado, química ou termicamente,
antes de ser encaminhado para a estação de tratamento de efluentes na fábrica.
O emprego de estirpes relativamente instáveis, pode, inclusive, limitar o emprego de
31
sistemas de fermentação mais eficientes, como os processos contínuos, pois poderá ocorrer,
ao longo do tempo, a selecção de células que privilegiem o crescimento em detrimento da
biossíntese e acumulação do bioproduto alvo.
Na literatura1 está bem documentada a viabilidade de projectar e construir fábricas a
partir de mutantes auxotróficos, em processo contínuo, apenas quando se empregam
mutantes auxotróficos em pelo menos dois aminoácidos e não em apenas um, a fim de
evitar os mecanismos de correcção genéticos da célula e obter a acumulação intracelular
intensa do(s) aminoácido(s) de interesse. Nessa condição, é mais difícil o retorno às
características da estirpe original, em virtude de uma maior alteração a que a célula mutante
foi submetida.
Células recombinantes, por via da introdução de plasmídeos, igualmente podem ser
instáveis em virtude da inexistência de replicação do plasmídeo para as células filhas, ou
mesmo devido à destruição do plasmídeo na própria célula hospedeira, ou ainda à expulsão
desse plasmídeo. É necessário lembrar que a introdução de novas codificações genéticas
significa, em geral, um ónus energético adicional para a célula, o que põe em causa o seu
objectivo natural, sobreviver e duplicar o seu crescimento. Inclusive, a integração de uma
codificação genética contida em um plasmídeo no cromossomo da célula, o que poderia
conferir a desejada estabilidade, pode ainda não resultar na obtenção de uma estirpe
hiperprodutora, em virtude da existência de um número limitado de cópias do gene de
interesse.
Adicionalmente, a operação de biorreactores industriais, conforme mencionado
anteriormente, do ponto de vista técnico e económico, praticamente exige o emprego de
microrganismos não patogénicos, os quais possam ser manuseados sem riscos ambientais,
particularmente, nas etapas seguinte, de separação da estirpe produtora do bioproduto alvo.
Mesmo durante a fermentação, caso se manuseasse microrganismos patogénicos em
reactores de dezenas de milhares de litros, os cuidados e a segurança teriam de ser bastante
aumentados, particularmente, com os gases efluentes, o que incidiria em custos adicionais.
O cultivo de patogénicos é efectuado, por exemplo, para a produção de vacinas, em
reactores de pequeno porte (da ordem de centenas ou poucos milhares de litros), porém
confinados em câmaras ou salas assépticas, tomando-se as precauções necessárias para a
não ocorrência de contaminação do meio ambiente. Isso, logicamente, significa custo
adicional, o qual pode ser justificado no caso de produção de vacinas, mas tornaria inviável
a produção um bioproduto com menor valor acrescentado, como uma enzima ou mesmo um
antibiótico.
A obtenção de células recombinantes de Escherichia coli, via a introdução de
plasmídeos, é sempre algo muito atraente, pois esta é uma das bactérias mais conhecidas
32
presentemente, mas encontra resistências em termos de uma utilização em instalações de
grande porte, justamente por ser uma enterobactéria. Essa é uma das razões (não a única),
pelas quais, hoje em dia, para se obter células recombinantes se prefere partir de células de
leveduras ou fungos filamentosos, não patogénicos, ou mesmo de células animais. Apesar
disso, ainda existem discussões a respeito da disposição e tratamento final dessas células
recombinantes mas sempre de molde a não haver nenhum perigo ambiental por libertação
de estirpes viáveis para o meio ambiente.
Um microrganismo também não deve exigir condições de processo muito complexas,
por motivos claros de economia da produção do bioproduto alvo. Pois, como se sabe,
existem sempre valores óptimos do pH e da temperatura, por exemplo, em termos da
biossíntese e acumulação do bioproduto alvo. No entanto, também se sabe que o controlo
preciso do pH e da temperatura apenas é possível em reactores de bancada, sendo que em
biorreactores de grande escala (dezenas de milhares de litros), deverá ocorrer uma certa
heterogeneidade ao longo da altura de líquido dentro do biorreactor, de forma que a célula
deverá manter o seu desempenho, apesar de uma certa flutuação nos valores destas
grandezas. Em outras palavras, o ideal é que o microrganismo tenha uma faixa alargada de
valores óptimos dessas grandezas e não valores pontuais, particularmente, no que se refere
à biossíntese, excreção e acumulação do bioproduto alvo no meio de fermentação.
Neste sentido, são igualmente muito interessantes as estirpes produtoras que
conseguem manter um bom desempenho, quando cultivados em baixas concentrações de
oxigénio dissolvido. Em virtude da necessidade de manutenção de altas concentrações de
oxigénio dissolvido traz problemas bastante sérios no tocante a um maior dispêndio de
energia, em virtude, de uma maior exigência de agitação e arejamento do meio de
fermentação. Assim, também, as estirpes produtoras que crescem de forma aglomerada (por
exemplo, na forma de micélio), são sempre mais complicadas de cultivar, pois a
concentração de oxigénio no meio de cultivo submerso terá de ser mais elevada, a fim de
que as células mais internas desses aglomerados tenham também acesso ao oxigénio,
quando comparadas às células que crescem isoladamente ou no exterior dos aglomerados.
Já foi abordado anteriormente a inconveniência em operar com estirpes que excretem
quantidades exageradas de proteínas para o meio, em particular protéases, mas ainda há
uma questão adicional, pois a geração de espuma frequentemente se atribui à presença de
concentrações excessivas de proteínas e outros polipeptídeos no meio de cultura, situação
ainda mais complexa para os processos aeróbios, devido à necessidade de arejar e agitar
continuamente o conteúdo do biorreactor.
Em geral, a geração de espuma pode ocorrer no início de um processo fermentativo
aeróbio, quando se empregam meios de cultivo contendo extractos de carne ou de levedura,
33
ou água de maceração de milho (“corn steep liquor”), e nas etapas mais avançadas de um
processo fermentativo em virtude da excreção e acumulação de proteínas no meio de
fermentação. Isto causa sérios problemas, como, a necessidade de empregar um menor
volume útil do biorreactor, a fim de ter condições de controlar eficazmente a espuma no seu
interior, além da frequente necessidade de adicionar antiespuma que, além de onerarem o
produto de produção, ainda podem causar dificuldades nas etapas de recuperação do
bioproduto. Como não basta-se, o agente antiespuma provoca, em geral, também uma
redução na eficiência de transferência de oxigénio, o que exige o aumento da agitação e do
arejamento, agravando ainda mais este problema. Assim, é importante a selecção de
estirpes que excretem poucas proteínas juntamente com o bioproduto desejado.
O microrganismo seleccionado para um processo industrial não deve exigir meio de
cultura extremamente dispendioso, claramente por questões de economia do processo
produtivo. Essa é a razão pela qual um maior conhecimento das necessidades nutricionais
de uma estirpe produtora é um estudo de vital importância, com o objectivo de fornecer os
nutrientes apenas necessários. Em algumas circunstâncias esse desconhecimento leva à
necessidade da adição de certas substâncias, como extracto de levedura, extracto de carne,
peptona etc., as quais costumam ser bastante dispendiosas.
Particularmente na área de produção de vacinas, costuma-se utilizar meios de cultura
bastante complexos e dispendiosos, assim como nos cultivos envolvendo células animais,
mas aqui, novamente, os volumes de reacção são relativamente pequenos e os bioprodutos
gerados são considerados de muito alto valor acrescentado e, por isso, compensa o uso
desses nutrientes mais dispendiosos.
Finalmente, com muita frequência, procura-se estirpes produtoras para a produção de
bioprodutos extracelulares, já que há todo o interesse em que a estirpe seleccionada excrete
fácil e rapidamente o bioproduto para o meio de cultura, de onde ele será recuperado nas
etapas seguintes de isolamento e purificação.
Além do aspecto ligado a uma eventual inibição do próprio microrganismo, pela
retenção de um dado bioproduto no meio de cultura, ainda cumpre lembrar que, com
frequência, a primeira etapa de recuperação do produto significa a separação da estirpe
produtora (por centrifugação ou filtração) e, em seguida, trabalhar com o líquido isento de
células (respectivamente sobrenadante clarificado ou filtrado) enquanto as células são
encaminhadas para a estação de tratamento de sólidos na fábrica e, depois de inviabilizadas,
são então descartadas. Assim, se algum bioproduto alvo ainda permanecer no interior ou
associado às células, será perdido diminuindo o rendimento global do bioprocesso.
Sabe-se que a retenção de certos bioprodutos pelas células depende de uma série de
factores, tais como: a estirpe produtora seleccionada, da composição do meio de cultura e
34
das condições de fermentação impostas (pH, temperatura, modo de operação descontínua
ou semi-descontínua, etc.).
Neste sentido, um exemplo interessante foi o apresentado por AGUERO et al.,5
trabalhando no estudo da produção de glucoamilase por Aspergillus niger NRRL 337 e
Aspergillus awamori NRRL 3112, sendo esta segunda estirpe, sem dúvida, melhor
produtora que a primeira. Esses autores indicaram que, a pH 4, o A. niger reteve cerca de
30% da actividade associada às células, enquanto o A. awamori apenas algo em torno de
10%, indicando que a estirpe melhor produtora tende a ser mais eficiente na excreção do
bioproduto de interesse. Já a pH 6, as células de A. niger retiveram cerca de 70% da
actividade enzimática, enquanto nas células de A. awamori esta retenção foi da ordem de
40%, em relação à actividade total (soma da actividade enzimática extracelular, encontrada
no caldo, e a actividade intracelular, ou seja, a actividade encontrada nas células —
actividades enzimáticas expressas por unidade de volume de amostra), mostrando de forma
clara a influência do pH na eficiência da capacidade de excreção pelas duas estirpes
produtoras células. Como as actividades totais obtidas com cada uma das estirpes atingiram
valores muito próximos, tanto a pH 4 como 6, indica que o pH interferiu na excreção, mas
não na biossíntese da enzima.
Esses resultados indicam a necessidade de se verificar, com a devida atenção, a
retenção do bioproduto de interesse pelas células produtoras, quando se procura efectuar
trabalhos de selecção de estirpes, ou se esteja estudando diferentes condições de cultivo,
mesmo que o interesse resida na recuperação de produtos extracelulares. Caso contrário,
corre-se o risco de descartar estirpes, ou condições de fermentação, que poderiam ser
potencialmente interessantes.
4.3.2. Características desejáveis de meios de cultura
É sempre muito difícil mencionar as características da estirpe produtora, sem
associá-los a um determinado meio de cultura. Dessa forma, as características da estirpe
produtora, em muitos casos, dependem do meio utilizado, de maneira que as características
do meio de cultura devem permitir a biossíntese, excreção e a acumulação de bioproduto no
meio de fermentação e, também, não permitir ou minimizar a biossíntese de substâncias
incompatíveis com a qualidade final do bioproduto, etc.
Cada estirpe produtora tem necessidades nutricionais específicas. No entanto, em
todas as culturas microbianas é preciso estar presente no meio de cultura água, fontes de
energia, de carbono, de azoto, sais minerais, vitaminas e oxigénio, este último, no caso de
ser uma fermentação aeróbia. Estes requisitos mínimos são essenciais para que as células
35
comecem a sintetizar todos os compostos necessários à manutenção e divisão celular.
Enquanto em pequena escala, é simples e possível ter um meio constituído por compostos
puros relativamente mais caros, bem pelo contrário, a nível industrial, tem de se recorrer
inevitavelmente a nutrientes mais económicos, mas que obedeçam a alguns ou a todos os
critérios seguintes [113]:
• Ser o mais barato possível e de qualidade consistente;
• Atender às necessidades nutricionais do microrganismo;
• Auxiliar no controlo do processo fermentativo, como é o caso de ser ligeiramente
tamponado, o que evita variações drásticas de pH, ou evitar formação de espuma
excessiva;
• Não provocar problemas na recuperação e purificação do bioproduto;
• Os nutrientes que compõem o meio de cultura quer sejam líquidos, sólidos ou
gasosos devem permitir ser armazenados, durante algum tempo, a fim de estarem
disponíveis a qualquer instante e todo o ano;
• Ter composição razoavelmente fixa e, logo, reprodutível;
• Não causar dificuldades no tratamento final do efluente da fábrica;
• Maximizar o rendimento do bioproduto versus substrato (Yp/s);
• Maximizar concentração do bioproduto [P];
• Maximizar a actividade específica celular (Yp/s);
• Minimizar o rendimento em produtos contaminantes.
Todas estas características são importantes, destacando-se o custo do meio de cultura,
que deve ser o menor possível, desde que atenda às necessidades e exigências nutricionais
do microrganismo seleccionado. Justamente essa combinação de atender às necessidades
nutricionais do microrganismo, a fim de que o bioproduto possa ser biossintetizado, e ser
minimamente dispendioso, é que, com frequência, acaba por causar certas complicações na
optimização do processo fermentativo principalmente a bioprodutos de baixo valor
acrescentado.
No caso de produtos de elevado valor acrescentado (ex. hormonas, anticorpos,
proteínas recombinantes), a selecção dos nutrientes do meio de fermentação está
condicionada pelo rendimento e grau de pureza final desse bioproduto, sendo o custo do
meio de fermentação um factor de menor importância [115]. A formulação correcta do
meio de cultura, é fundamental para a obtenção de um rendimento óptimo e, por isso, a
composição dos meios de fermentação industriais não é usualmente publicada, devido ao
seu enorme valor comercial para a empresa.
A maioria das estirpes produtoras, como os heterótrofos aeróbios, é utilizada na
36
produção de uma grande variedade de bioprodutos e exibe alguma flexibilidade ao nível da
natureza, bem como no número de substratos orgânicos capazes de metabolizar. Contudo, a
principal fonte de energia, para o crescimento aeróbio, provém da oxidação desses
compostos orgânicos presentes no meio de cultura que são, em geral, também fonte de
carbono. A energia produzida ou gerada durante o metabolismo da fonte de carbono, é
armazenada em compostos de fosfato de elevada energia, como a adenosina trifosfato
(ATP) ou pela fosforilação de elevados níveis dos compostos nutrientes, em especial, os
substratos fonte de carbono. Esta energia bioquímica é, posteriormente, utilizada em
reacções biossintéticas e na manutenção das células sendo, contudo, alguma dessa energia
perdida na forma de calor.
As fontes de carbono são inúmeras, mas é possível agrupá-las em; hidratos de
carbono (melaços de cana e beterraba, farinhas de milho e outros cereais, polissacarídeos
como amido ou celulose, glucose, sacarose, fructose, lactose , licor de maceração do milho,
.....); lípidos assimilados na forma de ácidos oleico, linoleico e linolénico provenientes de
óleos vegetais (azeite, milho, soja, ......) e os próprios aminoácidos. Tem também sido
prestado alguma atenção a fontes de carbono definidas e mais simples, tais como; alcóois,
ácidos orgânicos e alcanos (ex: metano, etano, outros) e, mais recentemente, o glicerol.
As fontes de azoto podem ter origem em compostos inorgânicos (gás e sais de
amónio e nitratos), os quais costumam provocar reduções significativas do valor de pH, e
orgânicos (licor de maceração do milho, farinha de soja, soro, Pharmamedia, Proflo,
hidrolisados de proteina, farinha de peixe, extracto de levedura, peptona, .....) assimilados
pelo microrganismo, respectivamente, na forma de iões de amónio e aminoácidos.
A membrana celular é permeável à maior parte dos compostos químicos de baixo
peso molecular. No caso de polímeros orgânicos (ex: amido, celulose, quitano, agarose,
proteína, etc) estarem presentes no meio de cultura e serem potenciais fontes nutricionais, a
sua metabolização só é possível devido à produção, pelo microrganismo, dos chamados
exoenzimas (ex: amilases, celulases, pectinases, chinitases, agarases, xilases, proteases,
......). Estas enzimas são excretadas para o meio de fermentação hidrolisando esses
polímeros nos seus monómeros constituintes que, por sua vez, já são transportados para o
interior da célula.
As exigências da maior parte dos microrganismos em enxofre e iões inorgânicos
(magnésio, manganês, ferro, cobre, molibdénio, cobalto, zinco, cálcio, potássio, sódio,
cloro, .....) são satisfeitas pela adição dos respectivos sais de sulfato e/ou fosfato, existentes
nos meios orgânicos complexos, ou na água de preparação do próprio meio de fermentação.
Os microrganismos aeróbios estão dependentes do mecanismo da respiração para a
geração de energia e, por isso, requerem oxigénio molecular como aceitador de hidrogénio
37
ou electrões. Devido à baixa solubilidade de oxigénio na água (6,99 ppm a 35ºC [116]) é
essencial a transferência contínua do oxigénio para o meio líquido de crescimento. O
arejamento do meio de cultura é efectuado por agitação orbital dos balões em plataformas
mecânicas, enquanto, nos fermentadores de cultura submersa, tem de se injectar ar
comprimido associado a uma agitação adequada do caldo fermentativo.
No caso de fermentação em estado sólido o microrganismo contacta directamente
com o ar e, logo, assimila o oxigénio directamente da fase gasosa.
Alguns microrganismos não possuem vias metabólicas necessárias à síntese de
alguns nutrientes específicos, essenciais ao crescimento celular e, indirectamente, à
produção de proteínas e enzimas. Entre eles, destacam-se alguns aminoácidos, purinas,
pirimidinas, vitaminas e outros compostos. Por isso, eles têm de ser adicionados
directamente ao meio, ou fornecidos por fontes complexas, como o extracto de levedura ou
outros nutrientes complexos. As fontes orgânicas complexas são sem dúvidas, os
constituintes mais utilizados na fermentação industrial como fontes de carbono, de azoto e
de micronutrientes devido a serem subprodutos baratos, resultantes de indústrias de carne,
queijo, cereais, fibras e outras. As tabelas 4.1 a 4.4. mostram, que muitos destes nutrientes
complexos providenciam um número elevado de constituintes essenciais ao crescimento
dos microrganismos.
O pH no caldo fermentativo, durante o desenvolvimento microbiano, está
dependente dos constituintes do meio de cultura e do próprio metabolismo celular da
estirpe produtora. O seu valor pode afectar o crescimento, a formação do produto como já
vistos anteriormente, o metabolismo de vários nutrientes e algumas actividades fisiológicas
celulares. Por outro lado, o pH óptimo de crescimento pode não coincidir com o da
biossíntese de um dado bioproduto.
Por último, convém destacar a adição de compostos especiais ao meio de
fermentação, que funcionam como:
- Percursores quando são incorporados directamente na estrutura do bioproduto (ex: ácido
fenilácetico induz e é incorporado na estrutura da penicilina G ou benzilpenicilina),
- Inibidores quando reduzem o rendimento de formação de produtos indesejáveis e
contaminantes do biproduto e,
- Indutores quando são necessários a sua adição meio de cultura para ocorrer a biossíntese
da maior parte das enzimas envolvidas nas vias metabólicas e essenciais à biossíntese do
bioproduto alvo.
A natureza dos constituintes do meio de fermentação é importante. No entanto, a
sua concentração tem de ser optimizada ao nível do inóculo e nos vários estágios de
desenvolvimento, do meio de crescimento celular e da biossíntese do bioproduto no
38
fermentador industrial.
A técnica clássica de optimização do meio de fermentação consiste no estudo do
efeito de um componente de cada vez, todavia, utiliza-se, hoje em dia, cada vez mais
estratégias de optimização estatística ("factorial design").
4.3 Meios de cultura com nutrientes complexos versus definidos
Quando os meios de cultura são constituídos apenas por estas nutrientes de
composição muito bem definida costumam ser chamados de meios definidos, ou meios
sintéticos, cuja composição química é sempre muito bem conhecida e pode ser reproduzida
a qualquer instante. Por essa razão, para as células que apresentam bom desempenho em
meios desse tipo, espera-se a ocorrência de um sistema produtivo muito estável, além de,
em geral, não apresentarem problemas quanto à recuperação e purificação do produto final.
Esses meios, mesmo sendo mais dispendiosos, podem ser preferidos, caso realmente
permitam uma maior economia nas etapas de recuperação e purificação do bioproduto.
No entanto, para uma grande variedade de estirpes produtoras, há a necessidade da
adição de certos “factores de crescimento”, ou seja, alguns aminoácidos específicos ou
vitaminas (ex: biotina, tiamina, riboflavina, etc.). Claro está que, quando se conhecem essas
necessidades específicas, o que nem sempre é o caso, é possível adicionar essas substâncias
puras, a fim de manter o meio em sua forma mais definida, mas o custo destes meios pode
tornar-se inviável, particularmente, para instalações industriais de grande capacidade
fermentativa, a menos que isto signifique um enorme ganho económico na biossíntese e na
recuperação e purificação do bioproduto, ou preserve alguma característica fundamental
deste bioproduto, necessariamente, de alto valor acrescentado.
Alternativamente, para suprir as necessidades de estirpes mais exigentes e, em geral,
com características nutricionais mal conhecidas, pode-se adicionar certos materiais
complexos como: extracto de levedura (autolisado de leveduras), extracto de carne, extracto
de malte, peptona (hidrolisado de proteínas), etc. Esses materiais (individualmente ou
adicionados conjuntamente) permitem introduzir no meio de cultura os factores ausentes
num meio definido, mas, além de dispendiosos, são complexos e de composição variável ao
longo do tempo de armazenagem e na dependência do fabricante e do lote empregado.
Assim, pode-se imaginar a ocorrência de oscilações no processo fermentativo, além de
possíveis dificuldades nas operações de recuperação e purificação do bioproduto final.
Nos trabalhos básicos de selecção de estirpes, é frequente observar-se, o emprego de
meios de cultura contendo quantidades muito grandes desses extractos ou hidrolisados
(vários gramas por litro, ou mesmo dezenas de gramas por litro). Dessa forma, no
39
desenvolvimento do processo fermentativo para larga escala, uma das tarefas iniciais é
verificar a possibilidade da obtenção de iguais desempenhos, porém em meios isentos
desses materiais, ou com a adição de quantidades mínimas, tendo em vista o custo de
produção envolvido.
Ainda relacionado com os meios mais complexos e, igualmente, menos dispendiosos,
razão pela qual são empregados na maioria dos processos fermentativos em grande escala,
cumpre mencionar o uso de matérias-primas naturais ou subprodutos de outras indústrias,
tais como caldo de cana-de-açúcar, melaços, farinhas diversas (farinha de trigo, milho, soja,
cevada), água de maceração de milho (“corn steep liquor”), etc.
Essas matérias-primas são de composição química desconhecida, podendo-se
conhecer os teores dos açúcares disponíveis, azoto, fósforo, mas não se conhecem os teores
dos sais minerais, pois certamente há sempre um número muito grande de constituintes.
Meios de cultura contendo esses materiais naturais com frequência são completados com
alguns sais (particularmente contendo azoto e fósforo).
Claro está que a composição química estará na dependência de uma série de factores,
tais como solo, variedade do vegetal, colheita, clima, processamento durante a colheita e
armazenagem, etc. Esses factos indicam já a expectativa de que possam ocorrer oscilações
no processo fermentativo que emprega essas matérias-primas, além de obrigarem as
empresas produtoras, por exemplo, de antibióticos, ou enzimas a manterem instalações
piloto para o ajuste da composição do meio a cada novo lote de matéria-prima que a
empresa recebe (particularmente aquelas que usam, por exemplo, a água de da maceração
de milho), a fim de evitar maiores surpresas na biossíntese do bioproduto alvo nos
biorreactores industriais.
Inclusive essas matérias-primas naturais podem causar problemas adicionais na
recuperação e purificação do produto final, assim como problemas nos tratamentos das
águas residuais. No entanto, ainda continuam a ser as matérias-primas preferidas em grande
número de casos, pela simples razão de serem as mais baratas.
40
Tabela 4.1. Exemplo da grande diversão de fonte de carbono a usar nos meios de cultura.
Fonte Carbono
Composição
Definida
Glucose
C6H12O6
Sim
Amido
(C5H10O5)x
Sim
milho Diferentes açucares
(glucose, dextrinas)
Xarope alto teor frutose, glucose, outros
frutose
sacarídeos
Molassos
Principalmente
carbohidratos
Xarope
No
Sim
No
Farinha algodão Principalmente proteínas e No
seed
carbohidratos
Licor maceração Principalmente proteínas e No
de milho (CSL) peptídeos, ácido láctico,
açúcar
Óleo de soja
Gorduras e ácidos gordos
Sim
Óleo de palma
Gorduras e ácidos gordos
Sim
Glicerol
C3H8O3
Sim
Etanol
C2H6O
Sim
Metanol
CH4O
Sim
Gama preço Fonte
($/kg)
0.10—0.35 Amido
Observações
Preço depende da
quantidade e pureza
Com impurezas, proteínas,
gorduras, ácidos gordos.
Cerca de 70-80% peso seco
0.05—0.35 Milho, batata, grão, arroz,
etc
0.35—0.45 Hidrolisado de amido de
milho ou batata
0.45—0.85 Hidrolisado de amido de
Cerca 50% frutose e 50%
milho
glucose, outros sacarídeos
0.08—0.12 Açúcar de cana e beterraba
Cerca 50% açúcares
fermentáveis, 20% água,
10% ácidos orgânicos, fonte
N, vitaminas e minerais
Cerca 40-50% proteínas, 200.12—0.55 Algodão
40% carbohidratos, também
aminoácidos, gorduras,
vitaminas, minerais, fonte N
eP
Subproduto
resultante
do
Cerca de 50% peso seco;
0.05—0.15
processo de hidratação e
teor em proteína variável
maceração do milho
depende da fonte (20-50%);
fonte de N e P
Cerca de 100%
0.15—0.50 Soja
gorduras/ácidos gordos
Cerca de 100%
0.15—0.50 Palmeira
gorduras/ácidos gordos
Óleos naturais
Hoje subproduto da
0.2—0.3
produção do biodiesel
Petróleo / gás natural ou
0.2—0.8
fermentação
0.20—0.25 Petróleo / gás natural
41
Tabela 4.2. Principais constituintes dos meios de fermentação, em especial, presentes em meios orgânicos
complexos [111].
Glucose
comercial
Farinha
milho
Licor Mac.
milho
"Dried dist.
Solubles"
Hidrolisado
proteina
Farinha
de peixe
Melaço de
beterraba
Farmamedia
Proflo
Farinha
de soja
Soro
Levedura
de cerveja
Peso seco
91,5
93,0
50,0
92,0
-
92,0
77,0
99,0
98,8
90,0
95,0
95,0
Proteina
-
22,6
24,0
26,0
7,5
65,0
6,7
59,2
61,1
42,0
12,0
43,0
Carbohidratos
91,5
53,2
5,8
45,0
-
-
65,1
24,1
23,2
29,9
68,0
39,5
Gorduras
-
1,9
1,0
9,0
-
3,8
0,0
4,0
4,1
4,0
1,0
1,5
Fibras
-
9,5
1,0
4,0
-
1,0
0,0
2,6
3,2
6,0
0,0
1,5
Cinzas
-
3,3
8,8
8,0
6,0
21,3
5,2
6,7
6,7
6,5
9,6
7,0
Cálcio
-
0,3
-
0,3
-
4,0
0,16
0,25
0,25
0,25
0,9
-
Magnésio
-
0,16
-
0,65
-
0,25
0,23
0,74
0,75
0,25
0,13
-
Fósforo total
-
0,57
-
1,3
-
2,6
0,02
1,31
1,31
0,63
0,75
-
Fósforo disp.
-
0,16
-
1,2
-
2,6
0,01
0,31
0,35
0,16
0,75
-
Potássio
-
0,34
-
1,75
-
0,74
4,71
1,72
1,73
1,75
1,2
1,48
Enxofre
-
0,32
-
0,37
-
0,54
0,47
0,6
1,56
0,32
1,04
0,49
Constituintes
Macro-Componentes ( % )
Iões Inorgânicos ( % )
42
Tabela 4.2. Principais constituintes dos meios de fermentação, em especial, presentes em meios orgânicos complexos [111] (cont.)
.
Glucose
comercial
Farinha
milho
Licor Mac.
milho
"Dried dist.
Solubles"
Hidrolisado
proteina
Farinha
de peixe
Melaço de
beterraba
Farmamedia
Proflo
Farinha
de soja
Soro
Levedura
de cerveja
Biotina
-
-
0,88
2,86
-
-
-
1,52
0,79
-
-
-
Choline
-
1760
-
4400
-
3740
880
3270
33,4
2420
2420
4840
Niacin
-
41,8
-
110,0
-
93,5
39,6
83,3
83,8
30,4
11,0
498,3
Pantothenic
-
4,4
-
19,8
-
9,7
4,6
12,4
12,5
14,1
48,4
121,4
Pyridoxine
-
-
-
19,4
-
-
-
-
16,4
0,9
2,9
49,7
Riboflavina
-
3,7
15,4
-
9,5
2,2
4,8
5,1
3,1
19,8
35,2
Thiamine
-
-
0,9
5,5
-
-
-
4,0
4,4
-
4,0
74,8
-
1,3
0,4
0,9
0,6
1,1
0,2
-
0,4
0,5
1,1
0,3
0,9
0,1
0,2
0,5
0,3
0,1
0,5
1,0
0,6
1,1
0,7
1,6
2,1
0,9
0,6
1,5
1,0
0,2
0,7
1,5
3,1
2,2
1,7
1,9
5,4
10,0
10,0
1,8
3,4
3,8
2,1
3,3
4,1
3,6
0,6
6,3
1,3
2,4
4,3
4,7
1,9
2,4
2,8
0,7
1,9
2,8
-
12,3
1,5
3,8
3,0
3,3
6,1
4,5
1,5
5,9
3,3
1,0
3,4
4,6
7,2
1,5
2,8
2,0
2,4
6,5
3,3
1,4
4,2
2,5
0,9
2,5
3,3
2,9
0,6
2,8
0,6
1,7
0,6
-
0,4
0,4
0,7
0,2
0,7
1,2
1,0
0,4
0,5
0,6
0,2
0,5
0,6
2,2
0,6
3,4
1,3
2,7
3,3
3,4
1,0
1,8
2,5
0,8
1,9
2,4
Constituintes
Vitaminas
( mg/kg )
Amino ácidos
(%)
Arginina
Ciateina
Glicina
Histidina
Isoleucina
Leucina
Lisina
Meteonina
Fenilalanina
Treonina
Triptofano
Tirosina
Valina
43
Tabela 4.1. Exemplo de um catálogo (Traders Protein) de nutrientes de composição complexa usados em meios de cultura.
44
5. Estequiometria das reacções biológicas
5.1 Composição das células microbianas
A composição das células de uma espécie microbiana depende das condições de
crescimento e dos substratos utilizados na cultura. No entanto, estas diferenças são
pequenas ao comparar valores dentro de uma determinada espécie e é notável que a
composição varia também muito pouco em todo o mundo microbiano (Tabela 1).
A compilação de composições elementares determinadas por inúmeros autores
conduziu Roels (1980) adoptar como “fórmula elementar média da biomassa”
CH1,8O0,5N0,2, considerando apenas os quatro elementos mais abundantes (C, H, O, N).
Acrescentando o teor em enxofre e fósforo, a fórmula média vem então
CH1,8O0,5N0,2S0,0045P0,0055
cujas
massas
moleculares
correspondentes
são
respectivamente, 24,6 e 24,9 g/mol de C, a que é usual adicionar 4 a 10% (mínimo) de
cinzas (matéria incombustível presente na biomassa).
Tabela 5.1 – Composição da biomassa de algumas espécies microbianas em termos dos
elementos químicos maioritários (C, H, O, N) (Livro Prof Manuela)
Condições da cultura
Espécie
Composição
elementar
Escherichia coli
CH1,77O0,49N0,24 Cultura descontínua
Klebsiella aerogenes
CH1,73O0,43 N0,24 Cultura contínua*, D = 0,85 h-1
limitação por ião amónio ou glicerol
Pseudomonas fluorescens
CH1,93O0,55N0,25 Cultura descontínua
Xanthobacter Py2
CH1,80O0,55N0,22 Cultura descontínua em penteno
Candida utilis
CH1,87O0,56No ,20 Cultura contínua*, D = 0,45 h-1,
limitação por ião amónio ou glucose
Saccharomyces cerevisiae
CH1,70 O0,45N0,17 Cultura descontínua
Aspergillus niger
CH1,72O0,55N0,17 Cultura descontínua
Penicillium chrysogenum
CH1,70O0,58N0,15 Cultura descontínua
(dados retirados de Pirt (1975), Atkinson e Mavituna (1991), van Keulen e da Fonseca
(1994), Mene (1996)).
Por sua vez, a fórmula reduzida de uma espécie microbiana ou animal ou vegetal é
o resultado da sua composição nas macromoléculas que compõem os seres vivos.
Tabela 5.2 Composição média da Saccharomyces cerevisiae sem as cinzas
(4-8%) [2.35]. Dados de Kluwer Acadëmic Publishers.
Macromoléculas
Composição elemental
% (p/p) (g/C-mol)
Proteinas
CH1,58O0,31N0,27S0,004
57
22,5
RNA
CH1,25O0,25N0,38P0,11
16
34,0
3
31,6
DNA
CH1,15O0,62N0,39P0,10
Carbohidratos
CH1,67O0,83
10
27,0
Fosfolípidos
CH1,91O0,23N0,02P0,02
10,8
18,5
Gorduras neutras
CH1,84O0,12
2,5
15,8
Outros metabolitos celulares CH1,80O0,30N0,20S0,01
0,7
29,7
45
5.2 Equação macroquímica do crescimento celular microbiano
A falta de uma rigorosa quantificação dos processos microbiológicos não permite
a descrição de acordo com um modelo cinético de crescimento celular e biossíntese de
bioprodutos intra e/ou extracelulares. Por isso, uma reacção microbiológica pode ser
encarada de modo esquematizado e de uma forma simplista de acordo com o modelo na
Figura 1.
Figura 5.1 - Nos processos microbiológicos as células microbianas heterotróficas
utilizam uma fonte de carbono e energia (CAHBOC) e uma fonte de azoto
(CA´HB´OC´ND´) para produzir mais células e o bioproduto alvo.
A célula é representada como uma caixa negra que recebe os substratos,
nomeadamente uma fonte de carbono e energia (CAHBOC), de azoto (CA´HB´OC´ND´) e
oxigénio e, pode ser descrita genericamente pela seguinte esquema de reacção química.
Fonte Carbono + Fonte Azoto + O2 Biomassa + Produto + CO2 + H2O
Com o consumo dos substratos (∆S) disponíveis no meio de fermentação a célula
gera mais células e biossintetiza produtos, i.e., biomassa, “fórmula elementar”
(CαHβOγNδ), bioproduto de interesse (Cα´Hβ´Oγ´Nδ´), água e dióxido de carbono.
Considera-se neste reacção biológica que os três produtos são extracelulares e, neste
caso, a reacção biológica global poderá ser representada em termos dos elementos
“macroquímicos” do crescimento celular com enormes simplificações:
a CAHBOC + b O2 + c CA´HB´OC´ND´ d CαHβOγNδ + e CO2 + f H2O + g Cα´Hβ´Oγ´Nδ´
(1:1)
Quando a biomassa é o produto pretendido, como na produção de levedura de
padeiro (Exemplo 1), o coeficiente g da equação (1.1) é nulo. O mesmo se passa durante
a fase de crescimento quando a produção do produto de interesse surge desfasada do
46
crescimento, i.e., o produto é um metabolito secundário. Tal é ilustrado no Exemplo 2,
referente ao período de desenvolvimento do micélio antecedente à fase de produção de
penicilina.
Exemplos de equações macroquímicas em situações de cultura aeróbia em que o
único produto é a própria biomassa:
Exemplo 1 - Cultura de Saccharomyces cerevisiae em glucose (Battley, 1979):
C6H12O6+ 3,94 O2 + 0,33 NH3 1,93 CH1,703O0,459N0,171 + 4,07 CO2 + 4,85 H2O
Exemplo 2 - Cultura de Penicillium chrysogenum em glucose (Menezes, 1996):
C6H12O6 + 0,6 NH4OH + 1,91 O2 4,0 CH1,70O0,58N0,15 + 2,0 CO2 + 4,1 H2O
Quando para além do crescimento das células num processo aeróbio também há a
biossíntese e excreção, para o meio de fermentação, de bioproduto alvo então a reacção
biológica pode se descrita pela equação 1:1, em que todos os coeficientes
estequiométricos são positivos e superiores a zero.
Então como prosseguir para conseguir obter os coeficientes estequiométricos e
descrever esta reacção biológica mesmo de forma muito simplista como a descrita na
equação macroquímica (1:1)?
A composição em macrocomponentes das fontes de carbono e azoto é, em
princípio, conhecida ou pode ser obtida por análise elementar (C , H , O , N) enquanto a
composição das células pode ser determinada também por análise elementar aos átomos
ou, se não for possível, assumir composições médias de estirpes semelhantes com as
descritas na tabela 5.1.
Da equação macroquímica (1:1) resultam então o desconhecimento do valor dos
sete coeficientes estequiométricos. Se o objectivo é conhecer as relações
estequiométricas, interessa encontrar uma via para acertar a equação macroquímica.
Para tal pode recorrer-se a várias equações independentes, por exemplo, quatro
equações resultantes dos balanços aos átomos (C , H , O , N):
- Balanço ao carbono
- Balanço ao hidrogénio
a.A + c.A´ = d.α + e.1 + g.α´
a.B + c.B´ = d.β + f.2 + g. β´
- Balanço ao oxigénio
- Balanço ao azoto
a.C + b.2 + c.C´ = d.γ + e.2 + f.1 + g.γ´
c.D = d.δ + g.δ´
Contudo, são necessárias pelo menos mais três equações independentes para
resolver o sistema. Uma hipótese é obter informação adicional de carácter experimental
em termos de quantificar o consumo dos substratos (fonte de carbono, azoto, oxigénio)
e a formação de biomassa e de produtos. Com estes valores é, então, possível
quantificar as necessidades em nutrientes e as capacidades de produção de um
microrganismo através dos factores de rendimento, nomeadamente produto/substrato,
47
produto/biomassa, biomassa/oxigénio, etc. Estes valores obtidos experimentalmente
podem ser utilizados no cálculo do(s) chamados rendimento(s) observados, por
exemplo, de biomassa ou produto em relação substrato, em geral, o substrato limitante
presente no meio de fermentação, i.e., produzem-se d “moles de células” ou g “moles de
produto” por a “moles de substrato” consumido de acordo com a equação (1:1).
Neste caso, por exemplo;
- Rendimento Biomassa/Substrato: Y´x/s = (d.PMx)/(a.PMs) = ([X]f - [X]o) / ([S]o - [S]f)
- Rendimento Produto/Substrato: Y´P/s = (g.PMP)/(a.PMs) = ([P]f - [P]o) / ([S]o - [S]f)
em que, PMx, PMs e PMp são respectivamente os pesos moleculares da biomassa, do
substrato e do produto, enquanto [X]f , [S]f , [P]f , [X]o, [P]o e [S]o são respectivamente
as concentrações, medidas experimentalmente, da biomassa, substrato e produto no final
e no inicio da fermentação.
Outro rendimento que também pode ser utilizado, por exemplo, baseado na
relação entre o dióxido de carbono formado e oxigénio consumido, durante um
determinado período de tempo, também designado por quociente respiratório, RQ (razão
molar e/b entre o CO2 produzido e o O2 consumido) e que é, frequentemente, um dado
experimental obtido pela monitorização e quantificação da pressão parcial do O2 e CO2
e, logo, a composição da fase gasosa na entrada e saída do fermentador utilizando para
isso, por exemplo, um espectrómetro de massa.
A título de exemplo refira-se também que é possível usar, numa fase preliminar,
os valores publicados de factores de rendimentos obtidos por outros investigadores em
processos biológicos similares, por exemplo, na cultura aeróbia de Saccharomyces
cerevisiae, em glucose e amoníaco, obtém se, tipicamente, Y´x/o = 1,0 kg.kg-1 e Y´x/N =
0,1 kg.kg-1.
Quando o objectivo da cultura é somente produzir biomassa, o número de
incógnitas reduz-se a seis pois g = 0. Neste caso, no final temos de rectificar os
coeficientes estequiométricos molares obtidos de modo a que as quantidades
consumidas de substratos e geradas de biomassa e produto(s) sejam iguais como se pode
ver no exemplo 1.
Substratos consumidos
Produtos gerados
a.PMs
b.PMO2
=1
x 180
= 3,94 x 32
d.PMx
e.PMCO2
= 1,93 x 23,44
= 4,07 x 44,00
c.PMNH3
Total
= 0,33 x 17
= 311,6 g
f.PMH2O
Total
= 4,85 x 18,00
= 311,6 g
Caso contrário, os cálculos dos coeficientes estequiométricos não estão correctos
ou algumas das equações não são independentes.
Outra equação para resolver o sistema também muito assumida é a normalização
dos coeficientes:
48
a=1
Mas, neste caso específico, temos depois de rectificar se os valores dos coeficientes
estequiométricos estimados conduzem a concentrações de biomassa e/ou produto(s)
iguais aos obtidos experimentalmente. Se não houver coincidência da previsão das
quantidades (biomassa e/ou produtos) com os valores obtidos experimental deve-se
calcular um factor correctivo (FC), por exemplo:
FC = [Biomassa]prevista / [biomassa]experimental
E, com ele, é, então, possível corrigir os coeficientes estequiométricos de todos os
substratos e produtos envolvidos na equação macroquímica de molde a coincidir com os
valores obtidos experimentalmente e conseguir, assim, descrever de forma simplista a
reacção biológica de crescimento celular e biossíntese do(s) produto(s) em relação aos
dados experimentais disponíveis.
Outra ferramenta de análise útil para o estabelecimento da estequiometria de uma
reacção biológica é o balanço ao “grau de redução”, Ψ (Castrilio e Ugalde, 1994;
Vicente et al., 1998). O grau de redução de um composto é definido neste contexto,
como o número “moles de electrões” disponíveis (por átomo-grama de carbono) para
serem transferidas para o oxigénio quando o composto sofre combustão e se obtêm
como produtos finais dióxido de carbono, água e azoto molecular.
Considere-se H como a unidade de potencial redox. Defina-se um composto
neutro para cada elemento. Seja CO2 para o carbono, H2O para o oxigénio, NH3 para o
azoto, H2SO4 para o enxofre e H3PO4 para o fósforo. Então o grau de redução destes
elementos mais comuns em biorreacções virá:
(C, O, N, S, P) = (4, -2, -3, 6, 5)
O grau de redução da fonte de carbono, da biomassa e do produto, em relação à
equação macroquímica (1:1), podem, então, ser calculados pelas seguintes equações:
Ψs = (4.A + 1.B – 2.C) / A
ΨN = (4.A´ + 1.B´ – 2.C´ - 3.D´) / A´
Ψx = (4.α + 1.β - 2.γ - 3.δ) / α
ΨP = (4.α´+ 1.β´ - 2.γ´ - 3.δ´) / α´
Assim o grau de redução da glucose (C6H12O6), do ácido acético (C2H4O2) e do
ácido láctico (C3H6O3) é 4, do etanol (C2H6O) é 6 e glicerol (C3H8O3) é 14/3.
Ao utilizar NH3 como fonte de azoto e com base na conservação do número de
electrões transferíveis para o oxigénio durante o metabolismo, o balanço de electrões à
equação (1.1) vem então:
49
a.A.Ψs + (-2).2.b = d.α.Ψx + e.0 + f.0 + g.α´.ΨP
b = (a.A.Ψs - d.α.Ψx - g.α´. ΨP) / 4
(1.2)
(1.3)
em que os ΨH2O e ΨCO2 tem graus de redução iguais a zero.
A equação (1.3) permite calcular o consumo teórico de oxigénio (b) da reacção da
equação (1:1) desde que os graus de redução de biomassa ((Ψx), substrato (Ψs) e
produto (ΨP), e os coeficientes estequiométricos a, d e g sejam conhecidos. Por
exemplo, no caso do exemplo 1, vem então com base em prossupostos experimentais,
por exemplo, na base de 1 litro:
∆S = 180 g a = 1,00
∆X = 45,24 g d = 1,93
Balanço ao átomo de azoto
∆P = 0,0 g
g = 0,00
c.D = d.δ + g.δ´
Balanço ao átomo de carbono
Balanço ao átomo de hidrogénio
a.A + c.A´ = d.α + e.1 + g.α´
a.B + c.B´ = d.β + f.2 + g. β´
E do grau de redução da transferência de electrões para o oxigénio (equação 1:3) vem:
b = (a.A.Ψs - d.α.Ψx - g.α´. ΨP) / 4
Os graus de redução da glucose e biomassa (CH1,703O0,459N0,171)
Ψgluc = (4.A + 1.B – 2.C) / A = (4 . 6 + 1 . 12 – 2 . 6) /6 = 4
Ψbiom = (4.α + 1.β - 2.γ - 3.δ)/α = (4 . 1 + 1 . 1,703 – 2 . 0,459 – 3 . 0,171) /1 = 4,272
Resolvendo este sistema de equações vem então:
c = 0,33
e = 4,07
f = 4,85
b = (1. 6 . 4 – 1,93 . 1 . 4,272 – 0) / 4 = 3,94
Pode-se pensar em acrescentar mais relações estequiométricas para poder
descrever com mais detalhe os passos bioquímicos envolvidos no processo global de
crescimento celular e biossíntese de produto(s). Contudo, convêm, não esquecer, que
neste caso teria de dispor-se de outras ferramentas analíticas complementares para obter
mais dados experimentais mas no final permitiria desenvolver “modelos metabólicos” e
levar a cabo uma “análise de fluxos metabólicos” (Bailey, 1991).
5.3 Consumo de substratos fornecidos através de uma gasosa
O fornecimento de um substrato gasoso a um biorreactor faz-se normalmente por
injecção do mesmo na forma de gás comprimido (puro ou componente de mistura) na
base do reactor através do dispersor da fase gasosa. A transferência da fase gasosa para
50
o seio da fase líquida poderá ser crítica quando se trata de gases pouco solúveis
(nomeadamente o oxigénio, o hidrogénio e hidrocarbonetos).
O caso do oxigénio é particularmente importante por ser comum a todas as
fermentações aeróbias. Outro substrato gasoso importante é o dióxido de carbono para
os organismos autotróficos. O O2 apresenta uma solubilidade em meio aquoso
consideravelmente superior à do oxigénio e o seu fornecimento é, portanto, menos
problemático.
De facto o valor da constante de Henry correspondente a água pura a 25°C é de
29,7 atm.L.mol-1 para o CO2 e é de 790,6 atm.L.mol-1 para o oxigénio. Em reactores
air-lift o amoníaco é por vezes fornecido através da fase gasosa como fonte de azoto.
EXERCÍCIOS
Exercício 1
Fizeram-se determinações experimentais com uma determinada espécie microbiana e
concluiu-se que as células conseguem converter em biomassa 2/3 do carbono da glucose
presente no meio. Sabendo que a amónia é a fonte de azoto e que a fórmula elementar
da biomassa é C4,4H7,301,2N0,56, calcule:
a) Os coeficientes estequiométricos da equação macroquimica.
b) Os factores de rendimento Y´x/s (kg peso seco/kg glucose) e Y´x/o (kg peso seco/kg
oxigénio).
Exercício 2
Uma cultura mista de microrganismos, presente num tanque arejado de uma estação de
tratamento, degrada um poluente orgânico da água residual de acordo com a equação:
C6H5NO3 + a O2 + b NH3 c CH1,400,4N0,2 + d H2O + e CO2
a) Sabendo que Y´x/s = 0,36 kg kg-1, calcule os coeficientes estequiométricos da
equação.
b) Calcule o grau de redução do substrato e da biomassa.
c) Indique os valores dos factores de rendimento Y´x/o e Y´x/NH3, bem como o quociente
respiratório (RQ) da cultura.
Exercício 3
Considere a produção de um metabolito secundário numa fermentação aeróbia descrita
pela equação:
CH2O + a NH3 + b O2 c CH1,79O0,5N0,2 + d CH2N0,5O1,5 + e CO2 + f H2O
Calcular as quantidades consumidas da fonte de carbono, fonte de azoto e oxigénio e as
quantidades formadas de CO2, H2O e biomassa para uma produção de produto de 25 g/l.
Calcular também a OUR, sabendo que a fermentação dura 200 horas.
51
Sabe-se que Yx/s = 0,400 e Y p/s = 0,300
Depois calcule também a quantidade de fonte de carbono a usar supondo que é amido e
a de fonte de azoto a usar supondo que é uma proteína. Admita que quer a fonte de
carbono quer a fonte de azoto residual no final da fermentação são de 5% do valor
inicial.
Exercício 4
Considere a produção de biomassa num pré-fermentador, para inoculação de um
fermentador industrial, sob condições aeróbias descrita pela equação
CH2O + a NH3 + b O2 c CH1,7900,5N0,2 + d CO2 + e H2O
Calcular as quantidades consumidas da fonte de carbono, fonte de azoto e oxigénio e as
quantidades formadas de CO2 e H2O. Calcular também a OUR. São dados:
1) A quantidade de biomassa a produzir é de 20 g/l
2) O tempo de pré-fermentação é de 30 horas.
Após resolução das questões acima suponha o seguinte:
- A fonte de carbono é o amido e a percentagem não consumida é de 5% do valor total.
- A fonte de Azoto é uma proteína e a percentagem de NH3 não consumida é de 5%.
Admita que o azoto usado é só azoto amoniacal.
Calcular:
1) A quantidade a usar de amido em g/l no meio de fermentação.
2) A quantidade de proteína a usar em g/l no meio de fermentação.
3) Calcular o valor de Y´x/s
4) Calcule as sacas de 25 Kg de amido e proteína a serem necessários para um
fermentador com volume útil de 50m3.
Exercício 5
A Demeclociclina (DCC) (C21H21C1N203, PM = 464,9 g/mol) é um antibiótico da
família das tetraciclinas e é um metabolito secundário produzido via “fermentação”
directa, isto é, resultante da cultura aérobia submersa de estirpes mutantes de
Streptomyces aureofaciens (CH2,800,8N0,2, PM = 30,4 g/mol). A fermentação ocorre a
27°C a um caudal do ar constante equivalente a 0,7 vvm de acordo com a composição
inicial do meio de produção do antibiótico descrita na tabela 1.
A fermentação não decorre a uma temperatura constante mas sim de acordo com
um gradiente de temperatura decrescente (0-36h a 129°C; 37-48h a 128°C; 49-6lh a
127°C; 62 -l95h a 126°C) mas que se admite, neste caso, ser constante e igual a 27°C,
enquanto o caudal do ar é mantido constante entre as 0 e as 26h equivalente a 0,5vvm e
depois aumenta para 0,7vvm e permanece constante até às l95h, mas admite-se ser,
neste caso, sempre 0,7vvm. O fermentador com uma taxa de ocupação máxima de 75%
mantém uma pressão em cúpula de 0,5 Kg/cm2 e um pH na gama de 6,0 a 6,4 pela
adição de NH3 (solução a 25% min) num total de cerca de 11 litros por m3 de caldo de
fermentação que é utilizada como fonte de azoto durante a fase de produção do
antibiótico e considere ser adicionado no tempo zero. Durante a fermentação também há
controlo do nível de espuma através da adição de uma mistura, em partes iguais de óleo
de soja e banha de porco, que se estima em cerca de 16 litros de 6 em 6 horas, entre as
52
95 e 180 horas do período de fermentação e que pode ser utilizado como fonte de
carbono e considere também ser adicionado no tempo zero.
Tabela 1. Constituintes e composição inicial do meio usado na fermentação.
Constituintes
Concentração (g/l)
Amido de milho
60
Dextrina
25
Pharmamédia
22
Caseína
4,25
CaCO3
5,1
NH4C1
2
Farinha de soja
12,8
Levedura de cerveja
1
Óleo de soja
24
Banha de porco
11,2
CuSO4
0,05
NiSO4
0,05
pHinicial
6,40
No final da fermentação atinge-se uma produção de antibiótico (DCC) de 10 Kg/m3 de
caldo que se apresenta na forma de um complexo de cálcio [(DCC)2Ca2+ ou
(C21H20N2O8Cl)2Ca2+ MW 967,9 g/mol], insolúvel e, assim, diminui o seu efeito
inibitório sobre o microrganismo. O meio de cultura caracteriza-se então por uma
densidade 1,04, concentração em micélio de 45,6 gdcw/l e viscosidade de centenas de
cp. O tempo necessário para as operações de lavagem do fermentador, carga,
esterilização e descarga do meio é estimada em cerca de 21horas, o que perfaz um
tempo total de ocupação do fermentador de cerca de 216 horas (9 dias).
Para a produção de 50 ton/ano de Cloridrato de Demeclociclina e um rendimento global
de 72,9%, qual o volume útil do fermentador de modo a ter a área de isolamento de
purificação a trabalhar 24 sobre 24 horas? Qual o consumo de nutrientes por
fermentação e por ano? Balanço à fermentação baseia-se numa reacção de consumo a
63,5; 100 e 50 % respectivamente em relação aos carbohidratos (massa de glucose =
massa de carbohidratos * 1,111), amónia (fonte NH4Cl e amónia a 25% min) e lípidos.
Qual são os coeficientes estequiométricos da equação macroquímica que a descreve a
reacção biológica.
53
Download