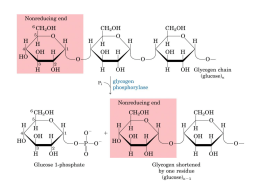
CONCURSO PÚBLICO PARA A CELEBRAÇÃO DE CONTRATOS PÚBLICOS DE APROVISIONAMENTO PARA AQUISIÇÃO MEDICAMENTOS DO FORO ONCOLÓGICO II CONCURSO PÚBLICO N.º 2012/6 Programa de Procedimento SECÇÃO I DISPOSIÇÕES GERAIS Artigo 1.º – Objecto do procedimento Artigo 2.º – Entidade adjudicante Artigo 3.º – Decisão de contratar Artigo 4.º – Concorrentes Artigo 5.º – Critério de adjudicação SECÇÃO II PEÇAS DO PROCEDIMENTO Artigo 6.º – Consulta do procedimento Artigo 7.º – Esclarecimentos e rectificação das peças do procedimento Artigo 8.º – Erros e omissões do Caderno de Encargos SECÇÃO III PROPOSTAS Artigo 9.º – Proposta Artigo 10.º – Propostas variantes Artigo 11.º – Modo de apresentação das propostas Artigo 12.º – Prazo da obrigação de manutenção das propostas Artigo 13.º – Prazo para a apresentação das propostas Artigo 14.º – Lista dos concorrentes e consulta das propostas apresentadas Artigo 15.º – Exclusão das propostas SECÇÃO IV ADJUDICAÇÃO Artigo 16.º – Dever de adjudicação Artigo 17.º – Notificação da decisão de adjudicação Artigo 18.º – Causas de não adjudicação Artigo 19.º – Revogação da decisão de contratar SECÇÃO V CPA Artigo 20.º – Redução dos CPA a escrito Artigo 21.º – Aprovação da minuta dos CPA Artigo 22.º – Ajustamentos ao conteúdo dos CPA Artigo 23.º – Aceitação da minuta dos CPA Artigo 24.º – Reclamações da minuta dos CPA Artigo 25.º – Outorga dos CPA SECÇÃO VI HABILITAÇÃO Artigo 26.º – Documentos de habilitação SECÇÃO VII DISPOSIÇÕES FINAIS Artigo 27.º – Leilão Electrónico Artigo 28.º – Entrada em vigor e divulgação dos CPA Artigo 29.º – Obrigatoriedade Artigo 30.º – Legislação aplicável Secção I Disposições Gerais Artigo 1.º Objecto do procedimento 1. O presente procedimento tem por objecto a selecção das entidades que celebrarão contratos públicos de aprovisionamento (“CPA”) para o fornecimento de Medicamentos do Foro Oncológico II, indicados no Anexo I do Caderno de Encargos, nos termos e condições previstas neste. 2. Os CPA celebrados na sequência do presente procedimento regularão, nos termos que resultam do Caderno de Encargos, as relações contratuais futuras a estabelecer com as entidades adjudicatárias. 3. As condições comerciais resultantes dos CPA poderão aproveitar a quaisquer outras entidades públicas a definir por Despacho do membro do Governo responsável pela área da Saúde. Artigo 2.º Entidade adjudicante A entidade adjudicante é a Serviços Partilhados do Ministério da Saúde, E.P.E. (“SPMS”), na qualidade de Central de Compras, nos termos do estabelecido no nº 5 do art.º 4º do Decreto-Lei nº 19/2010 de 22 de Março, na redacção efectuada pelo Decreto-Lei 108/2011 de 17 de Novembro, com sede na Praça de Alvalade, n.º 6, 8.º piso, 1700-036, Lisboa. Artigo 3.º Decisão de contratar A decisão de contratar foi tomada por despacho de 24/11/2011 do Conselho de Administração da SPMS, EPE, no uso de competência delegada por Despacho de 08/11/2011 do Senhor Secretário de Estado da Saúde. Artigo 4.º Concorrentes 1. Podem ser concorrentes ao presente procedimento as pessoas, singulares ou colectivas, que não se encontrem em qualquer uma das situações impeditivas previstas no artigo 55.º do Código dos Contratos Públicos. 2. Podem ainda ser concorrentes agrupamentos de pessoas singulares ou colectivas, sem que entre as mesmas exista qualquer modalidade jurídica de associação e desde que todas as entidades do agrupamento cumpram os requisitos legais exigidos para efeitos do presente procedimento 3. Os membros do agrupamento concorrente não podem ser concorrentes no mesmo procedimento, nem integrar outro agrupamento concorrente. 4. Todos os membros de um agrupamento são solidariamente responsáveis, perante os SPMS pela manutenção da proposta. 5. Em caso de adjudicação, todos os membros do agrupamento concorrente, e apenas estes, devem associar-se, antes da celebração do contrato público de aprovisionamento, na modalidade jurídica de consórcio externo, em regime de responsabilidade solidária, nos termos da lei. Artigo 5.º Critério de Adjudicação 1. O critério de adjudicação é o do mais baixo preço unitário. 2 A adjudicação será feita separadamente para cada tipo de medicamento (posição), aos três preços mais baixos, ordenados de forma crescente. Secção II Peças do Procedimento Artigo 6.º Consulta do procedimento 1. As peças do procedimento serão integralmente disponibilizadas na plataforma electrónica de contratação pública VortalHEALTH, acessível através do site electrónico http://www.vortalhealth.pt, disponibilizada pela empresa VORTAL – Comércio Electrónico, Consultora e Multimédia, S.A., desde o dia da publicação do anúncio no Diário da República. 2. Sem prejuízo do disposto no n.º 1, o Programa de Procedimento e o Caderno de Encargos encontram-se ainda: a) Disponíveis para consulta e download no endereço da Internet: www.catalogo.min-saude.pt; b) Patentes nas instalações dos SPMS, sita na Praça de Alvalade, n.º 6, 8.º piso, 1700-036, Lisboa, onde podem ser consultados, das 10 horas às 12 horas e das 14h30 horas às 17 horas, desde o dia da primeira publicação até ao termo do prazo fixado para a apresentação das propostas. Artigo 7.º Esclarecimentos e rectificação das peças do procedimento 1. Os esclarecimentos necessários à boa compreensão e interpretação das peças do procedimento são da competência do Júri do Concurso designado pelo órgão que tomou a decisão de contratar. 2. Os esclarecimentos mencionados no número anterior e demais pedidos devem ser solicitados por escrito, no primeiro terço do prazo fixado para a apresentação das propostas, ao Júri do Concurso, através da plataforma electrónica de contratação VortalHEALTH. 3. Os esclarecimentos serão prestados, por escrito, pelo Júri do Concurso, até ao termo do segundo terço do prazo fixado para a apresentação das propostas, através da plataforma electrónica de contratação VortalHEALTH. 4. O órgão competente para a decisão de contratar pode proceder à rectificação de erros ou omissões das peças do procedimento nos termos e no prazo previstos no número anterior. 5. Os esclarecimentos e as rectificações referidos nos números anteriores serão disponibilizados na plataforma electrónica de contratação VortalHEALTH e juntos às peças do procedimento que se encontrem patentes para consulta, devendo todos os interessados que as tenham adquirido ser imediatamente notificados desse facto. 6. Os esclarecimentos e as rectificações referidos nos n.os 2 a 4 fazem parte integrante das peças do procedimento a que dizem respeito e prevalecem sobre estas em caso de divergência. 7. Quando as rectificações ou esclarecimentos sejam comunicados para além do prazo estabelecido para o efeito, o prazo fixado para a apresentação das propostas deve ser prorrogado, no mínimo, por período equivalente ao do atraso verificado. 8. Quando as rectificações referidas, independentemente do momento da sua comunicação, ou a aceitação de erros ou de omissões do Caderno de Encargos, nos termos do disposto no artigo seguinte, implicarem alterações de aspectos fundamentais das peças do procedimento, o prazo fixado para a apresentação das propostas deve ser prorrogado, no mínimo, por período equivalente ao tempo decorrido desde o início daquele prazo até à comunicação das rectificações ou à publicitação da decisão de aceitação de erros ou de omissões. 9. A pedido fundamentado de qualquer interessado que tenha adquirido as peças do procedimento, o prazo fixado para a apresentação das propostas pode ser prorrogado pelo período considerado adequado, o qual aproveita a todos os interessados. 10. As decisões de prorrogação nos termos do disposto nos números anteriores cabem ao órgão competente para a decisão de contratar e devem ser juntas às peças do procedimento e notificadas a todos os interessados que as tenham adquirido, publicando-se imediatamente aviso daquelas decisões. Artigo 8.º Erros e omissões do Caderno de Encargos 1. Até ao termo do quinto sexto do prazo fixado para a apresentação das propostas, os interessados devem apresentar ao órgão competente para a decisão de contratar, através da plataforma electrónica VortalHEALTH, uma lista na qual identifiquem, expressa e inequivocamente, os erros e as omissões do Caderno de Encargos detectados e que digam respeito a: a) Aspectos ou dados que se revelem desconformes com a realidade; ou b) Espécie ou quantidade de prestações estritamente necessárias à integral execução do objecto do contrato a celebrar; ou c) Condições técnicas de execução do objecto do contrato a celebrar que o interessado não considere exequíveis. 2. A apresentação da lista referida no n.º 1, por qualquer interessado, suspende o prazo fixado para a apresentação das propostas desde o termo do quinto sexto daquele prazo até à publicitação da decisão prevista no n.º4 ou, não havendo decisão expressa, até ao termo do mesmo prazo. 3. As listas com a identificação dos erros e das omissões detectados pelos interessados será disponibilizada através da plataforma electrónica VortalHEALTH, pelos SPMS, devendo todos aqueles que tenham adquirido as peças do procedimento ser imediatamente notificados daquele facto. 4. Até ao termo do prazo fixado para a apresentação das propostas, o órgão competente para a decisão de contratar deve pronunciar-se sobre os erros e as omissões identificados pelos interessados, considerando-se rejeitados todos os que não sejam por ele expressamente aceites. 5. A decisão prevista no número anterior é publicitada na plataforma electrónica VortalHEALTH utilizada pelos SPMS e junta às peças do procedimento que se encontrem patentes para consulta, devendo todos os interessados que as tenham obtido ser imediatamente notificados do facto. SECÇÃO III PROPOSTAS Artigo 9.º Proposta 1. A proposta é a declaração pela qual o concorrente manifesta aos SPMS a sua vontade de contratar e o modo pelo qual se dispõe a fazê-lo. 2. A proposta é constituída, sob pena de exclusão, pelos seguintes documentos: 2.1. Declaração do concorrente de aceitação do conteúdo do Caderno de Encargos, elaborada em conformidade com o modelo constante do Anexo I ao presente Programa de Procedimento; 2.2. Formulário em conformidade com o modelo constante do Anexo II ao presente Programa de Procedimento, disponível na plataforma electrónica VortalHEATH; 2.3. Formulário “Anexo A”, disponibilizado no site www.catalogo.min-saude.pt, e cujo preenchimento online minimiza os erros e facilita o preenchimento, uma vez que no caso dos medicamentos, existe ligação directa à base de dados do Autoridade Nacional do Medicamento e Produtos de Saúde, I.P. – INFARMED. 2.3.1 O formulário “Anexo A” disponibilizado no site www.catalogo.minsaude.pt é de preenchimento obrigatório online. Uma vez encriptado e submetido no catálogo, é gerado um ficheiro em formato pdf. , o qual deverá ser anexado na plataforma electrónica da VortalHEALTH. 2.3.2. O formulário, depois de preenchido, deverá ser anexado à proposta e submetido na plataforma electrónica da VortalHEALTH. 2.4 Documento comprovativo de concessão de alvarás, licenças ou autorizações emitido pelo INFARMED, necessário para o fornecimento dos bens objecto do presente procedimento; 2.5 Declaração comprovativa da situação regularizada, quanto a taxas de comercialização de medicamentos, emitida pelo INFARMED, nos termos do Despacho n.º 15247 /2004 II N.º 177 de 29 de Julho; 2.6 No caso dos medicamentos ainda sem AIM em vigor em Portugal, previstos nas alíneas b. e c. do n.º 1 da alínea a) do Anexo III do Caderno de Encargos, documento que comprove a autorização de introdução no mercado no país de origem, no qual conste a composição qualitativa e quantitativa do medicamento, emitido pela entidade competente; 3. No formulário referido nos pontos 2.2. e 2.3. o concorrente deve: a) Inscrever o preço unitário, que constitui o único aspecto da execução do contrato submetido à concorrência pelo Caderno de Encargos, um por cada artigo a que concorre; e b) Preencher os campos relativos a aspectos da execução do contrato não submetidos à concorrência pelo Caderno de Encargos, aos quais os SPMS pretende que o concorrente se vincule, que constam do Anexo III do Caderno de Encargos. 4. Os preços indicados pelos concorrentes nos documentos referidos nos pontos 2.2. e 2.3. devem ser indicados em algarismos e não devem incluir o IVA. 4.1 Só são admitidas as propostas que: a) apresentem preços (líquidos) unitários inferiores aos do último contrato público de aprovisionamento celebrado e/ou que apresentem 28% de desconto face ao preço de referência unitário, isento de IVA. b) cujo preço unitário proposto seja inferior ao preço de venda ao armazenista (“PVA”). O PVA é igual ao preço de venda ao público (“PVP”) deduzido do IVA e das seguintes margens de comercialização: • Medicamentos não comparticipados: 28%; • Medicamentos comparticipados: 28%. 5. A proposta deve mencionar expressamente que aos preços unitários e ao preço contratual propostos acresce o IVA, indicando-se o respectivo valor e a taxa legal aplicável. 6. Caso a proposta seja apresentada por um agrupamento de concorrentes, os documentos que integram a proposta que devam ser subscritos pelo concorrente serão assinados pelo representante comum dos membros do agrupamento ou, não existindo representante comum, por todos os seus membros ou respectivos representantes legais com poderes para os obrigar. 7. Caso os membros do agrupamento sejam representados por um representante comum, nos termos da primeira parte do número anterior, a proposta deve igualmente ser acompanhada dos instrumentos de mandato emitidos por cada um dos membros. Artigo 10.º Propostas variantes 1. São admitidas propostas relativas a um, vários ou a todos os tipos de bens, indicados no Anexo I ao Caderno de Encargos. 2. Só são admitidas propostas variantes relativamente a cada um dos tipos de bens, indicados no Anexo I ao Caderno de Encargos, e desde que não envolvam alterações das cláusulas do Caderno de Encargos relativas às condições de fornecimento. Artigo 11.º Modo de apresentação das propostas 1. A proposta e os documentos que a integram devem ser redigidos em língua portuguesa, dactilografados ou processados informaticamente, sem rasuras ou palavras entrelinhadas. 2. Os documentos que constituem a proposta são apresentados directamente na plataforma electrónica VortalHEALTH acessível no site http://www.vortalhealth.pt, disponibilizada pela empresa VORTAL – Comércio Electrónico, Consultoria e Multimédia, S.A.. 3. Os concorrentes deverão assinar electronicamente (através de assinatura electrónica qualificada) a proposta e todos os documentos que lhe associarem, de acordo com o artigo 27.º da Portaria n.º 701-G/2009, de 29 de Julho. 4. Nos casos em que o certificado digital não possa relacionar directamente o assinante com a sua função e poder de assinatura, deve o concorrente submeter na plataforma um documento electrónico oficial indicando o poder de representação e assinatura do assinante. 5. Após submissão da proposta na vortalHEALTH, o concorrente deve efectuar a consulta e download do recibo comprovativo de submissão no “preview” do procedimento na pasta de “recibos” dando-lhe a garantia de submissão da proposta com sucesso. Artigo 12.º Prazo da obrigação de manutenção das propostas Os concorrentes são obrigados a manter as respectivas propostas pelo prazo de 180 (cento e oitenta) dias contados da data do termo do prazo fixado para a apresentação das propostas. Artigo 13.º Prazo para a apresentação das propostas A proposta deve ser apresentada até às 18:00 horas do 44.º dia, contado da data do envio do anúncio para publicação no Diário da República. Artigo 14.º Lista dos concorrentes e consulta das propostas apresentadas 1. No dia útil seguinte ao termo do prazo para apresentação das propostas, será disponibilizada através da plataforma VortalHEALTH a lista dos concorrentes, bem como as propostas apresentadas pelos mesmos. 2. Os candidatos poderão consultar a lista referida no número anterior, bem como as propostas apresentadas pelos concorrentes na sua área de trabalho. 3. O interessado que não tenha sido incluído na lista dos concorrentes pode reclamar desse facto, no prazo de três dias contados da publicitação da lista, devendo para o efeito apresentar comprovativo da tempestiva apresentação da sua proposta. 4. Após a publicação da lista de concorrentes prevista no n.º 1, o concorrente deve enviar aos SPMS a chave de encriptação do catálogo, nos termos do ponto 2.3.1 do art.º 9.º do Programa de Procedimento. Artigo 15.º Exclusão das propostas 1. São excluídas as propostas cuja análise revele: a) Que não sejam constituídas por todos os documentos exigidos nos termos do disposto no artigo 9.º do presente Programa de Concurso; b) Que não apresentam preenchidos os campos assinalados como obrigatórios no Anexo A referido no artigo 9.º do presente Programa de Concurso; c) Que apresentem atributos que violem os parâmetros base fixados no Caderno de Encargos ou que apresentem quaisquer termos ou condições que violem aspectos da execução do contrato a celebrar por aquele caderno de encargos não submetidos à concorrência, previstos no artigo 9.º d) A impossibilidade de avaliação das mesmas em virtude da forma de apresentação de algum dos respectivos atributos; e) Que o contrato a celebrar implicaria a violação de quaisquer vinculações legais ou regulamentares aplicáveis; f) A existência de fortes indícios de actos, acordos, práticas ou informações susceptíveis de falsear as regras de concorrência; g) Que tenham sido apresentadas depois do termo fixado para a sua apresentação; h) Que sejam apresentadas por concorrentes ou, no caso de agrupamentos de concorrentes, relativamente a qualquer dos seus membros, em violação do disposto no artigo 55.º do Código dos Contratos Públicos; i) Que não cumpram o disposto nos n.os 4 e 5 do artigo 57.º do Código dos Contratos Públicos; j) Que não observem as formalidades do modo de apresentação das propostas fixadas nos termos do disposto no artigo 11.º do Programa de Procedimento; k) Que os documentos que constituem a proposta não estejam redigidos em língua portuguesa; l) Que envolvam alterações das cláusulas do Caderno de Encargos, ou que sejam apresentadas como propostas variantes fora dos termos admitidos no presente Programa de Concurso; m) Que, identificando erros ou omissões das peças do procedimento, não cumpram o disposto no n.º 6 do artigo 8.º; n) Que sejam constituídas por documentos falsos ou nas quais os concorrentes prestem culposamente falsas declarações; o) Que não cumpram os requisitos mínimos estabelecidos no Anexo III do Caderno de Encargos; p) Que não respeitem o preço base estabelecido no ponto 4 do art.º 9º do Programa de Concurso. SECÇÃO IV Adjudicação Artigo 16.º Dever de adjudicação 1. Sem prejuízo do disposto no n.º 1 do artigo 18.º, o órgão competente para a decisão de contratar deve tomar a decisão de adjudicação e notificá-la aos concorrentes até ao termo do prazo da obrigação de manutenção das propostas. 2. Por motivo devidamente justificado, a decisão de adjudicação pode ser tomada e notificada aos concorrentes após o termo do prazo referido no número anterior, sem prejuízo do direito de recusa da adjudicação pelo concorrente cuja proposta foi a escolhida. Artigo 17.º Notificação da decisão de adjudicação 1. A decisão de adjudicação é notificada, em simultâneo, a todos os concorrentes. 2. Juntamente com a notificação da decisão de adjudicação, o órgão competente para a decisão de contratar deve notificar o adjudicatário para apresentar os documentos de habilitação exigidos nos termos do disposto no artigo 26.º. 3. As notificações referidas nos números anteriores devem ser acompanhadas do relatório final de análise das propostas. Artigo 18.º Causas de não adjudicação 1. Não há lugar a adjudicação quando: a) Nenhum concorrente haja apresentado proposta; b) Todas as propostas tenham sido excluídas; c) Por circunstâncias imprevistas, seja necessário alterar aspectos fundamentais das peças do procedimento após o termo do prazo fixado para a apresentação das propostas; d) Circunstâncias supervenientes ao termo do prazo fixado para a apresentação das propostas, relativas aos pressupostos da decisão de contratar, o justifiquem. 2. A decisão de não adjudicação, bem como os respectivos fundamentos, deve ser notificada a todos os concorrentes. Artigo 19.º Revogação da decisão de contratar 1. A decisão de não adjudicação prevista no artigo 18.º determina a revogação da decisão de contratar. 2. Quando as circunstâncias previstas nas alíneas c) e d) do n.º 1 do artigo 18.º ocorrerem entre o início do procedimento e o termo do prazo de apresentação das propostas, a decisão de contratar também pode ser revogada. SECÇÃO V CPA Artigo 20.º Redução dos CPA a escrito Os CPA devem ser reduzidos a escrito através da elaboração de um clausulado em suporte papel. Artigo 21.º Aprovação e notificação da minuta dos CPA A minuta dos CPA é aprovada pelo órgão competente para a decisão de contratar e notificada ao adjudicatário em simultâneo com a decisão de adjudicação, nos termos do disposto no n.º 1 do artigo 17.º. Artigo 22.º Ajustamentos ao conteúdo dos CPA 1. O órgão competente para a decisão de contratar pode propor ajustamentos ao conteúdo dos CPA a celebrar, desde que estes resultem de exigências de interesse público e, tratando-se de procedimento em que se tenha analisado e avaliado mais de uma proposta, seja objectivamente demonstrável que a respectiva ordenação não seria alterada se os ajustamentos propostos tivessem sido reflectidos em qualquer das propostas. 2. Os ajustamentos referidos no número anterior não podem implicar, em caso algum: a) A violação dos parâmetros base fixados no Caderno de Encargos nem a dos aspectos da execução do contrato a celebrar por aqueles não submetidos à concorrência; b) A inclusão de soluções contidas em proposta apresentada por outro concorrente. Artigo 23.º Aceitação da minuta dos CPA A minuta dos CPA a celebrar e os ajustamentos propostos consideram-se aceites pelo adjudicatário quando haja aceitação expressa ou quando não haja reclamação nos 5 (cinco) dias subsequentes à respectiva notificação. Artigo 24.º Reclamações da minuta do CPA 1. As reclamações da minuta dos CPA a celebrar só podem ter por fundamento a previsão de obrigações que contrariem ou que não constem dos documentos que integram o contrato, nos termos do disposto nos n.os 2 e 5 do artigo 96.º do Código dos Contrato Públicos, ou ainda a recusa dos ajustamentos propostos. 2. No prazo de 10 (dez) dias a contar da recepção da reclamação, o órgão que aprovou a minuta do contrato notifica o adjudicatário da sua decisão, equivalendo o silêncio à rejeição da reclamação. 3. Os ajustamentos propostos que tenham sido recusados pelo adjudicatário não fazem parte integrante do contrato. Artigo 25.º Outorga dos CPA 1. A outorga dos CPA terá lugar no prazo de 30 (trinta) dias contados da data da aceitação da minuta ou da decisão sobre a reclamação, mas nunca antes de: a) Decorridos 10 (dez) dias contados da data da notificação da decisão de adjudicação; b) Apresentados todos os documentos de habilitação exigidos; 2. Os CPA serão outorgados pelo Presidente do Conselho de Administração dos SPMS ou por quem detenha poderes delegados para o mesmo, e pelo representante legal do fornecedor. SECÇÃO VI Habilitação Artigo 26.º Documentos de habilitação 1. No prazo de 10 (dez) dias após a notificação da decisão de adjudicação, o adjudicatário deverá apresentar reprodução dos seguintes documentos de habilitação os previstos nas alíneas a) e b) do n.º 1 do artigo 81.º do Código dos Contratos Públicos; 2. Os sobreditos documentos deverão ser apresentados nos termos do artigo 83.º do Código dos Contratos Públicos. 3. Sempre que sejam detectadas irregularidades nos documentos apresentados, que possam levar à caducidade da adjudicação nos termos do disposto no artigo 86.º o Código dos Contratos Públicos, a entidade adjudicante concede um prazo de 3 dias úteis, contados da data de notificação, para que o adjudicatário as possa suprir. 4. Quando o adjudicatário for um agrupamento de pessoas singulares ou colectivas, os diversos membros do agrupamento devem apresentar os documentos referidos na alínea a), do n.º 1 do presente artigo, bem como os documentos referidos nas alíneas b) e c) do artigo 84.º n.º 1 do Código dos Contratos Públicos, caso a actividade por esse membro desenvolvida requeira a titularidade dos referidos alvarás, licenças e autorizações. SECÇÃO VII Disposições Finais Artigo 27.º Leilão Electrónico 1. Para o presente procedimento poderá haver lugar ao leilão electrónico previsto nos artigos 140º a 145º do Código dos Contratos Públicos. 2. O único atributo da proposta objecto de leilão electrónico será o preço. 3. Caso se opte pela sua utilização o mesmo decorrerá na Plataforma electrónica. Artigo 28.º Entrada em vigor e divulgação dos CPA 1. Os CPA entram em vigor no dia seguinte ao da sua divulgação no site www.catalogo.min-saude.pt. 2. A divulgação dos CPA é feita pelos SPMS através do site www.catalogo.min- saude.pt. 3. Todas as alterações às condições iniciais dos contratos efectuadas através de aditamentos serão divulgadas no site www.catalogo.min-saude.pt. Artigo 29.º Obrigatoriedade As aquisições dos bens abrangidos pelo presente concurso são de carácter obrigatório para as Instituições e serviços do Serviço Nacional de Saúde, mediante despacho do membro do governo responsável pela área da saúde, excepto se dispensadas por Despacho do Ministro da Saúde, podendo essa competência ser delegada e subdelegada. Artigo 30.º Legislação aplicável 1. O presente Programa de Procedimento regula os termos a que obedece a fase de formação dos CPA relativos ao fornecimento de Medicamentos do Foro Oncológico II, incluindo a fase da sua celebração. 2. A tudo o que não esteja especialmente previsto no presente Programa de Procedimento aplica-se, nomeadamente, o regime previsto nos seguintes diplomas: a) No Código dos Contratos Públicos, aprovado pelo Decreto-Lei n.º 18/2008, de 29 de Janeiro, alterado, por último, pelo Decreto-Lei n.º 31/2010, de 14 de Dezembro; b) No Decreto-Lei n.º 143-A/2008, de 25 de Julho; c) No Código de Procedimento Administrativo; e d) Em demais legislação aplicável. ANEXO I Modelo de declaração [a que se refere o ponto 2.1. do artigo 9.º] 1 — ... (nome, número de documento de identificação e morada), na qualidade de representante legal de (1) ... (firma, número de identificação fiscal e sede ou, no caso de agrupamento concorrente, firmas, números de identificação fiscal e sedes), tendo tomado inteiro e perfeito conhecimento do Caderno de Encargos relativo à execução do contrato a celebrar na sequência do procedimento de ... (designação ou referência ao procedimento em causa), declara, sob compromisso de honra, que a sua representada (2) se obriga a executar o referido contrato em conformidade com o conteúdo do mencionado Caderno de Encargos, relativamente ao qual declara aceitar, sem reservas, todas as suas cláusulas. 2 — Declara também que executará o referido contrato nos termos previstos nos seguintes documentos, que junta em anexo (3): a) ... b) ... 3 — Declara ainda que renuncia a foro especial e se submete, em tudo o que respeitar à execução do referido contrato, ao disposto na legislação portuguesa aplicável. 4 — Mais declara, sob compromisso de honra, que: a) Não se encontra em estado de insolvência, em fase de liquidação, dissolução ou cessação de actividade, sujeita a qualquer meio preventivo de liquidação de patrimónios ou em qualquer situação análoga, nem tem o respectivo processo pendente; b) Não foi condenado(a) por sentença transitada em julgado por qualquer crime que afecte a sua honorabilidade profissional (4) [ou os titulares dos seus órgãos sociais de administração, direcção ou gerência não foram condenados por qualquer crime que afecte a sua honorabilidade profissional (5)] (6); c) Não foi objecto de aplicação de sanção administrativa por falta grave em matéria profissional (7) [ou os titulares dos seus órgãos sociais de administração, direcção ou gerência não foram objecto de aplicação de sanção administrativa por falta grave em matéria profissional (8)] (9); d) Tem a sua situação regularizada relativamente a contribuições para a segurança social em Portugal (ou no Estado de que é nacional ou no qual se situe o seu estabelecimento principal) (10); e) Tem a sua situação regularizada relativamente a impostos devidos em Portugal (ou no Estado de que é nacional ou no qual se situe o seu estabelecimento principal) (11); f) Não foi objecto de aplicação da sanção acessória prevista na alínea e) do n.º 1 do artigo 21.º do Decreto-Lei n.º 433/82, de 27 de Outubro, no artigo 45.º da Lei n.º 18/2003, de 11 de Junho, e no n.º 1 do artigo 460.º do Código dos Contratos Públicos (12); g) Não foi objecto de aplicação da sanção acessória prevista na alínea b) do n.º 1 do artigo 627.º do Código do Trabalho (13); h) Não foi objecto de aplicação, há menos de dois anos, de sanção administrativa ou judicial pela utilização ao seu serviço de mão-de-obra legalmente sujeita ao pagamento de impostos e contribuições para a segurança social, não declarada nos termos das normas que imponham essa obrigação, em Portugal (ou no Estado de que é nacional ou no qual se situe o seu estabelecimento principal) (14); i) Não foi condenado(a) por sentença transitada em julgado por algum dos seguintes crimes (15) [ou os titulares dos seus órgãos sociais de administração, direcção ou gerência não foram condenados por alguns dos seguintes crimes (16)] (17): i) Participação em actividades de uma organização criminosa, tal como definida no n.º 1 do artigo 2.º da Acção Comum n.º 98/773/JAI, do Conselho; ii) Corrupção, na acepção do artigo 3.º do Acto do Conselho de 26 de Maio de 1997 e do n.º 1 do artigo 3.º da Acção Comum n.º 98/742/JAI, do Conselho; iii) Fraude, na acepção do artigo 1.º da Convenção relativa à Protecção dos Interesses Financeiros das Comunidades Europeias; iv) Branqueamento de capitais, na acepção do artigo 1.º da Directiva n.º 91/308/CEE, do Conselho, de 10 de Junho, relativa à prevenção da utilização do sistema financeiro para efeitos de branqueamento de capitais; j) Não prestou, a qualquer título, directa ou indirectamente, assessoria ou apoio técnico na preparação e elaboração das peças do procedimento. 5 — O declarante tem pleno conhecimento de que a prestação de falsas declarações implica, consoante o caso, a exclusão da proposta apresentada ou a caducidade da adjudicação que eventualmente sobre ela recaia e constitui contra -ordenação muito grave, nos termos do artigo 456.º do Código dos Contratos Públicos, a qual pode determinar a aplicação da sanção acessória de privação do direito de participar, como candidato, como concorrente ou como membro de agrupamento candidato ou concorrente, em qualquer procedimento adoptado para a formação de contratos públicos, sem prejuízo da participação à entidade competente para efeitos de procedimento criminal. 6 — Quando a entidade adjudicante o solicitar, o concorrente obriga -se, nos termos do disposto no artigo 81.º do Código dos Contratos Públicos, a apresentar a declaração que constitui o anexo II do referido Código, bem como os documentos comprovativos de que se encontra nas situações previstas nas alíneas b), d), e) e i) do n.º 4 desta declaração. 7 — O declarante tem ainda pleno conhecimento de que a não apresentação dos documentos solicitados nos termos do número anterior, por motivo que lhe seja imputável, determina a caducidade da adjudicação que eventualmente recaia sobre a proposta apresentada e constitui contra -ordenação muito grave, nos termos do artigo 456.º do Código dos Contratos Públicos, a qual pode determinar a aplicação da sanção acessória de privação do direito de participar, como candidato, como concorrente ou como membro de agrupamento candidato ou concorrente, em qualquer procedimento adoptado para a formação de contratos públicos, sem prejuízo da participação à entidade competente para efeitos de procedimento criminal. ... (local), ... (data), ... [assinatura (18)]. (1) Aplicável apenas a concorrentes que sejam pessoas colectivas. (2) No caso de o concorrente ser uma pessoa singular, suprimir a expressão «a sua representada». (3) Enumerar todos os documentos que constituem a proposta, para além desta declaração, nos termos do disposto nas alíneas b), c) e d) do n.º 1 e nos n.os 2 e 3 do artigo 57.º do Código dos Contratos Públicos; (4) Indicar se, entretanto, ocorreu a respectiva reabilitação. (5) Indicar se, entretanto, ocorreu a respectiva reabilitação. (6) Declarar consoante o concorrente seja pessoa singular ou pessoa colectiva. (7) Indicar se, entretanto, ocorreu a respectiva reabilitação. (8) Indicar se, entretanto, ocorreu a respectiva reabilitação. (9) Declarar consoante o concorrente seja pessoa singular ou pessoa colectiva. (10) Declarar consoante a situação. (11) Declarar consoante a situação. (12) Indicar se, entretanto, decorreu o período de inabilidade fixado na decisão condenatória. (13) Indicar se, entretanto, decorreu o período de inabilidade fixado na decisão condenatória. (14) Declarar consoante a situação. (15) Indicar se, entretanto, ocorreu a sua reabilitação. (16) Indicar se, entretanto, ocorreu a sua reabilitação. (17) Declarar consoante o concorrente seja pessoa singular ou pessoa colectiva. (18) Nos termos do disposto nos n.os 4 e 5 do artigo 57.º do Código dos Contratos Públicos. ANEXO II Modelo de declaração [a que se refere o ponto 2.2. do artigo 9.º] MODELO DE RESPOSTAS DISPONÍVEL NA PLATAFORMA VORTAL HEALTH PARA PREENCHIMENTO ON LINE Formulário de respostas Responda ás questões abaixo indicadas, conforme solicitado pela entidade pública. AS questões indicadas com (*), são de resposta obrigatória Secção Obrigatória (*) 1. Identificação de cada membro do agrupamento de concorrentes (colocar NIF e separar cada inserção com “;”) (*) 2. Código da Proposta (colocar todos os códigos a que esta proposta corresponde e separar cada inserção com “;”). Esta inserção deverá estar de acordo com o Anexo I da Portaria nº 701-G/2008 (*)3. Prazo de execução do contrato/obra/ (*) 4. Valor da Proposta (Colocar o valor da proposta) (*) 5. Discriminação do valor da proposta por cada um dos membros do agrupamento concorrente (colocar o valor da proposta discriminado por cada um dos membros do agrupamento concorrente) CONCURSO PÚBLICO PARA A CELEBRAÇÃO DE CONTRATOS PÚBLICOS DE APROVISIONAMENTO PARA AQUISIÇÃO MEDICAMENTOS DO FORO ONCOLÓGICO II CONCURSO PÚBLICO N.º 2012/6 Caderno de Encargos Capítulo I Disposições gerais Cláusula 1.ª – Objecto Cláusula 2.ª – Contratos Públicos de Aprovisionamento Cláusula 3.ª – Prazo Cláusula 4.ª – Contratos de Fornecimento a celebrar ao abrigo dos contratos públicos de aprovisionamento (CPA) Capítulo II Obrigações contratuais Cláusula 5.ª – Obrigações principais do fornecedor Cláusula 6.ª – Local e prazos de entrega Cláusula 7.ª – Prazo de Pagamento Cláusula 8.ª – Características dos Preços Cláusula 9.ª – Aumento de Preços Cláusula 10.ª – Aditamentos Cláusula 11.ª – Impossibilidade temporária de fornecimento Cláusula 12.ª – Elementos Estatísticos Cláusula 13.ª – Dever de sigilo Capítulo III Penalidades contratuais e resolução Cláusula 14.ª – Incumprimento dos Prazos de Entrega Cláusula 15.ª – Força maior Cláusula 16.ª – Resolução do CPA por parte do contraente público Cláusula 17.ª – Resolução dos contratos de fornecimento por parte do fornecedor Capítulo IV Resolução de litígios Cláusula 18.ª – Foro competente Capítulo V Disposições finais Cláusula 19.ª – Subcontratação e cessão da posição contratual Cláusula 20.ª – Comunicações e notificações Cláusula 21.ª – Contagem dos prazos Cláusula 22.ª – Legislação aplicável ANEXO I – Produtos ANEXO II – Aspectos da execução do contrato submetidos à concorrência: Preço Anexo III – Aspectos da execução do contrato não submetidos à concorrência: requisitos que devem ser observados nas propostas dos concorrentes PARTE I Capítulo I Disposições gerais Cláusula 1.ª Objecto 1. Na sequência do procedimento pré-contratual que tem por objecto a selecção de fornecedores de Medicamentos Anti-psicóticos, o presente Caderno de Encargos compreende as cláusulas a incluir: a) Nos contratos públicos de aprovisionamento (“CPA”), para a área da saúde, a celebrar entre os Serviços Partilhados do Ministério da Saúde, E.P.E. (“SPMS”) e os fornecedores cujas propostas vierem a ser seleccionadas; b) Nas aquisições que venham a ser efectuadas, quer pelas instituições integradas no Serviço Nacional de Saúde, ou pelas Centrais de Compras da Saúde em representação daquelas entidades, quer por quaisquer outras entidades públicas a definir por Despacho do membro do Governo responsável pela área da Saúde. 2. Quaisquer outras entidades de direito público podem aderir aos CPA e efectuar as suas aquisições nas condições de aprovisionamento estabelecidas nos contratos, com a autorização prévia do membro do Governo responsável pela área da Saúde. 3. Os Produtos a fornecer são os constantes do Anexo I ao presente Caderno de Encargos. 4. Os aspectos da execução do contrato submetidos à concorrência e os respectivos parâmetros base constam do Anexo II ao presente Caderno de Encargos. 5. São aspectos não submetidos à concorrência os que constam do Anexo III ao presente Caderno de Encargos, os quais devem ser observados nas propostas dos concorrentes, sob pena de exclusão. Cláusula 2.ª CPA 1. Os CPA são compostos pelo respectivo clausulado contratual e os seus anexos. 2. Os CPA a celebrar integram ainda os seguintes elementos: a) Os suprimentos dos erros e das omissões do Caderno de Encargos identificados pelos concorrentes, desde que esses erros e omissões tenham sido expressamente aceite pelo órgão competente para a decisão de contratar; b) Os esclarecimentos e as rectificações relativos ao Caderno de Encargos; c) O presente Caderno de Encargos; d) Os esclarecimentos sobre as propostas adjudicadas prestados pelos adjudicatários; e) As propostas adjudicadas. 3. Em caso de divergência entre os documentos referidos no número anterior, a respectiva prevalência é determinada pela ordem pela qual aí são indicados. 4. Em caso de divergência entre os documentos referidos no n.º 2 e o clausulado dos CPA e seus anexos, prevalecem os primeiros, salvo quanto aos ajustamentos propostos de acordo com o disposto no artigo 99.º do Código dos Contratos Públicos (“CCP”) e aceites pelos adjudicatários nos termos do disposto no artigo 101.º desse mesmo diploma legal. Cláusula 3.ª Prazo 1. Os CPA são válidos por um período de 12 (doze) meses, a contar da data da sua assinatura, renováveis por períodos de 6 (seis) meses, sendo automaticamente prorrogados, até ao limite adicional máximo de 3 (três) anos, sem prejuízo das obrigações acessórias que devam perdurar para além da cessação dos CPA. 2. Após o período de 12 (doze) meses, qualquer das partes pode denunciar os CPA por carta registada com aviso de recepção, com uma antecedência mínima de 60 (sessenta) dias. Cláusula 4.ª Contratos de Fornecimento a celebrar ao abrigo dos CPA 1. A celebração dos posteriores contratos de fornecimento pelos serviços e estabelecimentos do Serviço Nacional de Saúde e pelas Centrais de Compras da Saúde em representação daquelas entidades ao abrigo dos CPA deve ser precedida de novo procedimento restrito às entidades prestadoras seleccionadas, nos termos do artigo 259.º do CCP, dirigindo a todas as que reúnam as condições necessárias para o fornecimento em causa um convite à apresentação de proposta. 2. Nos procedimentos para a celebração dos contratos de fornecimento referidos no número anterior, o critério de adjudicação adoptado será o do mais baixo preço. Capítulo II Obrigações contratuais Cláusula 5.ª Obrigações principais do fornecedor 1. Sem prejuízo de outras obrigações previstas na legislação aplicável, no presente Caderno de Encargos ou nas cláusulas contratuais, da celebração dos CPA decorrem para o fornecedor as seguintes obrigações principais: a) Entregar ao contraente público os bens objecto do contrato com as características, especificações e requisitos técnicos previstos no Anexo III do presente Caderno de Encargos, que dele faz parte integrante; b) Entregar os bens objecto do contrato em perfeitas condições de serem utilizados para os fins a que se destinam; c) Responsabilizar-se por qualquer defeito ou discrepância dos bens objecto do contrato que existam no momento em que os bens lhe são entregues. 2. Os fornecedores obrigam-se, perante os SPMS a: a) No prazo máximo de 10 (dez) dias, comunicar quaisquer alterações ao pacto social; b) Manter actualizado o endereço da sede social; c) Comunicar qualquer situação de: o Impossibilidade temporária de fornecimento; o Impossibilidade legal de fornecimento; o Substituição de artigos; o Descontinuação definitiva de artigos. d) Não alterar os preços sem a sua prévia autorização; e) Informar de qualquer facto que possa impossibilitar, total ou parcialmente o cumprimento das obrigações contratuais decorrentes dos CPA. 3. O fornecedor deverá ainda informar os SPMS dos factos que possam impossibilitar, total ou parcialmente, o cumprimento das obrigações contratuais a que está adstrito e que possam comprometer a boa execução dos contratos de fornecimento. 4. O fornecedor deverá entregar ao contraente público os documentos de actualização comprovativos de inexistência de dívidas à Segurança Social e à Administração Fiscal. Cláusula 6.ª Local e prazos de entrega 1. As entregas dos bens deverão efectuar-se nos locais e nos prazos indicados pelas entidades adquirentes. 2. Considera-se entrega imediata a entrega no prazo máximo de 24 horas. 3. O prazo de entrega é o estabelecido nos CPA, não devendo ultrapassar 5 (cinco) dias úteis, contados a partir da data de recepção da Nota de Encomenda. 4. Sempre que ocorra um caso de força maior, nos termos previstos na Cláusula 15.ª, devidamente comprovado, e que implique a suspensão da entrega, devem os fornecedores, logo que dele tenham conhecimento, requerer à entidade adquirente que lhes seja concedida uma prorrogação do respectivo prazo. 5. A entidade adquirente pode, por motivo devidamente justificado, prorrogar o prazo de entrega. 6. Da situação referida no n.º 5 devem as instituições e os fornecedores dar imediato conhecimento aos SPMS. Cláusula 7.ª Condições de Pagamento 1. O prazo de pagamento aos fornecedores é de 60 dias. 2. O contrato de fornecimento pode estabelecer prazo diverso do referido no n.º 1 da presente Cláusula, por acordo entre as instituições de saúde e o fornecedor. Cláusula 8.ª Características dos Preços 1. Os preços indicados nos CPA não incluem o IVA e incluem, para além do custo unitário do produto, os seguintes custos: a) Acondicionamento; b) Embalagem. c) Carga, transporte e descarga no local indicado para os locais de consumo, bem como seguros ou quaisquer outras despesas inerentes ao transporte. 2. Para efeitos de apresentação das propostas, o preço unitário deve ser expresso com 4 (quatro) casas decimais, sem necessidade da sua indicação por extenso. Se os concorrentes não apresentarem preços unitários com quatro casas decimais, será assumido que as restantes em falta, à sua direita, serão de valor igual a zero e consideram-se tantos zeros quantas as casas decimais em falta. 3. Para os fornecimentos destinados às Regiões Autónomas dos Açores e da Madeira, deverão os fornecedores indicar na proposta os custos adicionais de transporte, bem como se a distribuição se encontra subcontratada, identificando, em caso afirmativo, o subcontratado. 4. Em sede da celebração dos posteriores contratos de fornecimento, os concorrentes poderão apresentar factores de redução dos preços propostos: a) Por aquisição de quantidades, com indicação do desconto a efectuar sobre o preço unitário, de acordo com as quantidades; b) Por descontos financeiros, com a indicação do desconto face ao prazo de pagamento. 5. Os concorrentes deverão preencher o campo específico no documento que constitui o Anexo A referido no artigo 9.º, n.º 2.3, do Programa do Procedimento relativo ao valor mínimo para cada nota de encomenda, o qual não poderá ser superior a € 50. Caso este campo não seja preenchido, considerar-se-á que o concorrente não estabeleceu qualquer valor mínimo por encomenda. 6. Sem prejuízo do disposto no número anterior, as entidades adjudicantes não poderão proceder a encomendas inferiores a uma embalagem. 7. Não serão seleccionados os medicamentos cujo preço unitário proposto seja superior ao preço de venda ao armazenista (“PVA”). 8. O PVA é igual ao preço de venda ao público (“PVP”) deduzido do IVA e das seguintes margens de comercialização: a) Medicamentos não comparticipados: 28%; b) Medicamentos comparticipados: 28%. 9. Não serão seleccionados os medicamentos cujo preço unitário proposto não cumpra o estabelecido no Decreto-Lei n.º 195/2006, de 3 de Outubro, na sua redacção actual. Cláusula 9.ª Aumento de Preços 1. A renovação dos CPA, nos termos da cláusula 3.ª, pode determinar a revisão dos preços neles fixados, não podendo, em caso algum, serem alteradas as restantes condições de fornecimento e as características constantes dos CPA. 2. O aumento de preços só pode, em princípio, ocorrer 12 (doze) meses contados do dia seguinte à homologação dos CPA, em casos devidamente justificados. 3. O aumento de preços referido nesta cláusula é formalizada mediante o Aditamento referido na alínea a) do n.º 3 da cláusula 10.ª, a qual deverá conter as alterações introduzidas nos CPA. Cláusula 10.ª Aditamentos 1. Quaisquer alterações de ordem financeira e técnica relativamente aos artigos seleccionados que ocorram durante o prazo de vigência dos CPA devem ser obrigatoriamente comunicadas aos SPMS. 2. Para formalização dos aditamentos, deverão os fornecedores proceder ao seu preenchimento on-line, submissão via internet, impressão, e envio via fax para os SPMS, com vista à sua autorização. 3. Para efeitos do n.º 1, consideram-se aditamentos os decorrentes das seguintes situações: a) Aumento de Preços; b) Redução de Preços; c) Inserção de Descontos; d) Descontinuação de artigos; e) Substituição de artigos; f) Redimensionamento da embalagem; g) Interrupção Temporária de Fornecimento; h) Alteração de outros atributos. 4. Os aditamentos tipificados no número anterior deverão ser utilizados da forma e com base nos documentos necessários à comprovação dos requisitos que a seguir se indicam: a) Aumento de Preços: este aditamento deverá ser utilizado para formalização dos pedidos de aumento de preço referido na Cláusula 9.ª, o qual só pode ser praticado após autorização dos SPMS; b) Redução de Preço: este aditamento deverá ser utilizado quando o fornecedor determina a redução de preço, directamente junto dos SPMS; c) Inserção de Descontos: este aditamento deverá ser utilizado sempre que o fornecedor pretenda efectuar descontos no preço em função das quantidades ou de prazos de pagamento ou da localização da instituição. Não são aceites aditamentos que introduzam escalões de desconto menos favoráveis que os que constam do Cat@logo; d) Descontinuação: este aditamento deverá utilizar-se sempre que o artigo deixe de ser comercializado no mercado português, quer a nível público, quer a nível privado, devendo o fornecedor enviar documento original emitido pelo fabricante ou seu representante oficial, logo que do facto tenha conhecimento; e) Substituição: este aditamento deverá utilizar-se quando o fornecedor pretenda substituir um artigo por outro, devendo, cumulativamente, a substituição obedecer aos seguintes requisitos: • O artigo a substituir esteja ou venha a ser descontinuado; • O artigo substituto seja do mesmo fabricante; • O artigo substituto respeite as características previstas neste Caderno de Encargos; • O artigo substituto apresente preços e condições competitivas, proporcionais à qualidade e quantidade do artigo que visa substituir. f) Redimensionamento da embalagem: este aditamento deve ser utilizado quando o fornecedor pretenda alterar o número de unidades por embalagem, em relação à sua proposta inicial; g) Interrupção Temporária de Fornecimento: este aditamento deve ser utilizado sempre que haja uma interrupção de fornecimento nos termos do n.º 2 da Cláusula 11.ª; h) Alteração de Outros Atributos: este aditamento tem carácter residual e deve ser utilizado quando o fornecedor proponha o mesmo artigo, mas pretenda alterar qualquer atributo da sua proposta não contemplado nos restantes tipos de aditamentos, designadamente alteração do prazo de entrega, alteração da taxa do IVA ou alteração de custos de transporte. Cláusula 11.ª Impossibilidade temporária de fornecimento 1. Sempre que o fornecedor se encontre em situação de impossibilidade temporária de fornecimento, deverá comunicar tal facto aos SPMS, fundamentando-o. 2. Considera-se impossibilidade temporária de fornecimento uma interrupção de fornecimento por período não superior a 90 dias. 3. Findo esse prazo sem a situação se regularizar, deverá o fornecedor solicitar a prorrogação do prazo, reservando-se os SPMS, todavia, o direito de resolver o contrato. Cláusula 12.ª Elementos Estatísticos 1. Os fornecedores obrigam-se ao envio semestral dos elementos estatísticos referentes às aquisições efectuadas pelas entidades adquirentes, devendo fazer referência ao código, marca, quantidade e valor global de vendas. 2. Os elementos estatísticos devem ser enviados aos SPMS impreterivelmente até ao dia 20 (vinte) do mês seguinte em relação ao semestre anterior de vigência do contrato. 3. O suporte a utilizar, para o envio dos elementos estatísticos, é a opção fornecida na aplicação do Cat@logo (registo de vendas). 4. Sempre que lhes seja solicitado pelos SPMS, devem os fornecedores facultar fotocópia das Notas de Encomenda emitidas pelas entidades adquirentes, bem como das facturas relativas às encomendas efectuadas no âmbito dos CPA ou elementos estatísticos para prazo inferior ao estipulado no n.º 1. Cláusula 13.ª Dever de sigilo 1. O fornecedor deve guardar sigilo sobre toda a informação e documentação, técnica e não técnica, comercial ou outra, relativa aos SPMS, de que possa ter conhecimento ao abrigo ou em relação com a execução do contrato. 2. A informação e a documentação cobertas pelo dever de sigilo não podem ser transmitidas a terceiros, nem ser objecto de qualquer uso ou modo de aproveitamento que não o destinado directa e exclusivamente à execução do contrato. 3. Exclui-se do dever de sigilo previsto a informação e a documentação que fossem comprovadamente do domínio público à data da respectiva obtenção pelo fornecedor ou que este seja legalmente obrigado a revelar, por força da lei, de processo judicial ou a pedido de autoridades reguladoras ou outras entidades administrativas competentes. Capítulo III Penalidades contratuais e resolução Cláusula 14.ª Incumprimento dos Prazos de Entrega 1. No caso de incumprimento do prazo de entrega estabelecido nos CPA, o fornecedor em falta: a) Ficará obrigado ao pagamento da diferença do valor entre o seu preço unitário e o preço unitário do fornecedor a que a Instituição adquirente tiver de recorrer; b) No caso de se tratar do único fornecedor seleccionado, sofrerá uma penalização de 1% do valor da encomenda, por cada dia de atraso, até ao limite de 30%, cujo valor reverterá a favor da Instituição adquirente. 2. As penalidades devidas nos termos da presente cláusula serão aplicadas por dedução do respectivo montante no pagamento subsequente devido ao abrigo do contrato. 3. As penas pecuniárias previstas na presente cláusula não obstam a que os SPMS exija uma indemnização pelo dano causado. Cláusula 15.ª Força maior 1. Não podem ser impostas penalidades ao fornecedor, nem é havida como incumprimento, a não realização pontual das prestações contratuais a cargo de qualquer das partes que resulte de caso de força maior, entendendo-se como tal as circunstâncias que impossibilitem a respectiva realização, alheias à vontade da parte afectada, que ela não pudesse conhecer ou prever à data da celebração do contrato e cujos efeitos não lhe fosse razoavelmente exigível contornar ou evitar. 2. Podem constituir força maior, se se verificarem os requisitos do número anterior, designadamente, tremores de terra, inundações, incêndios, epidemias, sabotagens, greves, embargos ou bloqueios internacionais, actos de guerra ou terrorismo e motins. 3. Não constituem força maior, designadamente: a) Circunstâncias que não constituam força maior para os subcontratados do fornecedor, na parte em que intervenham; b) Greves ou conflitos laborais limitados às sociedades do fornecedor ou a grupos de sociedades em que este se integre, bem como a sociedades ou grupos de sociedades dos seus subcontratados; c) Determinações governamentais, administrativas, ou judiciais de natureza sancionatória ou de outra forma resultantes do incumprimento pelo fornecedor de deveres ou ónus que sobre ele recaiam; d) Manifestações populares devidas ao incumprimento pelo fornecedor de normas legais; e) Incêndios ou inundações com origem nas instalações do fornecedor cuja causa, propagação ou proporções se devam a culpa ou negligência sua ou ao incumprimento de normas de segurança; f) Avarias nos sistemas informáticos ou mecânicos do fornecedor não devidas a sabotagem; g) Eventos que estejam ou devam estar cobertos por seguros. 4. A ocorrência de circunstâncias que possam consubstanciar casos de força maior deve ser imediatamente comunicada à outra parte. 5. A força maior determina a prorrogação dos prazos de cumprimento das obrigações contratuais afectadas pelo período de tempo comprovadamente correspondente ao impedimento resultante da força maior. Cláusula 16.ª Resolução do CPA por parte do contraente público 1. Sem prejuízo de outros fundamentos de resolução de contrato previstos na lei, as entidades adjudicantes podem resolver o contrato a título sancionatório no caso de o fornecedor violar de forma grave ou reiterada qualquer das obrigações que lhe incumbem, designadamente, no caso de violação sistemática das condições contratuais, atraso, total ou parcial, na entrega dos bens objecto do contrato. 2. O direito de resolução referido no número anterior exerce-se mediante declaração enviada ao fornecedor e não determina a repetição das prestações já realizadas, a menos que tal seja determinado pelos SPMS. 3. Ao determinar a resolução do contrato a título sancionatório nos termos da presente cláusula, pelos SPMS poderão ainda determinar a impossibilidade de o fornecedor se apresentar, como concorrente ou como candidato, em quaisquer procedimentos pré-contratuais por si promovidos pelos SPMS durante um período máximo de 3 (três) anos. Cláusula 17.ª Resolução dos contratos de fornecimento por parte do fornecedor 1. Sem prejuízo de outros fundamentos de resolução previstos na lei, o prestador de serviços pode resolver os contratos de fornecimento quando qualquer montante que lhe seja devido esteja em dívida há mais de seis meses. 2. Nos casos previstos do n.º 1, o direito de resolução é exercido mediante declaração enviada às instituições adquirentes, que produz efeitos 30 (trinta) dias após a recepção dessa declaração, salvo se estas últimas cumprirem as obrigações em atraso nesse prazo, acrescidas dos juros de mora a que houver lugar. 3. A resolução do contrato nos termos dos números anteriores não determina a repetição das prestações já realizadas pelo fornecedor, cessando, porém, todas as obrigações deste ao abrigo do contrato, com excepção daquelas a que se refere o artigo 444.º do CCP. Capítulo IV Resolução de litígios Cláusula 18.ª Foro competente Para resolução de todos os litígios decorrentes do contrato fica estipulada a competência do Tribunal Administrativo de Círculo de Lisboa, com expressa renúncia a qualquer outro. Capítulo V Disposições finais Cláusula 19.ª Subcontratação e cessão da posição contratual Estas matérias regem-se pelo disposto nos artigos 316.º a 324.º do CCP. Cláusula 20.ª Comunicações e notificações 1. Sem prejuízo de poderem ser acordadas outras regras quanto às notificações e comunicações entre as partes do contrato, estas devem ser dirigidas, nos termos do Código dos Contratos Públicos, para o domicílio ou sede contratual de cada uma, identificados no contrato. 2. Qualquer alteração das informações de contacto constantes do contrato deve ser comunicada à outra parte, apenas produzindo efeitos após a data desta comunicação. Cláusula 21.ª Contagem dos prazos A contagem dos prazos é feita nos termos do artigo 471.º do CCP. Cláusula 22.ª Legislação aplicável O contrato é regulado pela legislação portuguesa. ANEXO I Produtos CÓDIGO A1007 A25 A306 A307 A5022 A5023 A5024 A5025 A5026 A5027 A5028 A5037 A562 A564 A637 A706 A707 A920 B14 B188 B191 B193 B240 B242 B366 B367 B368 B370 C1000 C1003 C1004 C1005 C1006 C1007 C1009 DESCRIÇÃO ANAGRELIDA [0.5 MG; CÁP/COMP] CIPROTERONA (ACETATO DE) [100 MG;COMP] ALDESLEUCINA [18 MUI; F/AMP] ALEMTUZUMAB [30MG;F/AMP;IV] ABATACEPT [250 MG; F/AMP] ÁCIDO 5-AMINOLEVULÍNICO [8 MG;EMPL MEDIC] ADALIMUMAB [40 MG/0.8 ML;SERINGA] ALITRETINOÍNA [1 MG/G;GEL] AMINOLEVULINATO DE METILO [1500 MG;SOL INJ] ANACINRA [100 MG/0.67 ML;SOL INJ] AZACITIDINA [25 MG/ML; F/AMP] ACETATO DE ABIRATERONA [250 MG; CÁP/COMP] AZATIOPRINA [25MG; COMP] AZATIOPRINA [50MG; F/AMP] AMSACRINA [50 MG/ ML; 1,5 ML; F/AMP] ACIDO MICOFENÓLICO [180 MG; CÁP/COMP] ACIDO MICOFENÓLICO [360 MG; CÁP/COMP] ACETATO de GLATIRÂMERO [20 MG; F/AMP] BASILIXIMAB [20MG; FRS] BUSERRELINA [9,9MG; IMPL] BUSSULFAM [2MG; COMP] BUSSULFAM [60MG/10ML; F/AMP] BACILLUS CALMETTE-GUÉRIN (BCG instil.vesical) [2x10e8 a 3x10e9;F/AMP] BORTEZOMIB [3,5MG; IV; F/AMP]] BASILIXIMAB [10 MG; F/AMP] BESILESOMAB [1 MG; F/AMP] BEXAROTENO [75 MG;CÁPS] BUSERRELINA [5.5 MG/5.5 ML;F/AMP] CITARABINA [50 MG/ML; 2 ML; F/AMP] CITARABINA [50 MG/ML; 80 ML; F/AMP] CLADRIBINA [2 MG/ML;SOL INJ] CLOFARABINA [1 MG/ML; 20 ML; F/AMP] CLOROMETINA [10 MG; F/AMP] CLOROMETINA [1000 MG; F/AMP] CANACINUMAB [150 MG;PÓ SOL INJ] CÓDIGO C184 C185 C186 C187 C192 C193 C195 C235 C236 C318 C478 C573 C71 C983 C985 C986 C988 C989 C990 C992 C994 C995 C996 C999 D1 D17 D2 D210 D296 D324 D325 D332 D334 D335 D336 D337 D338 D339 D341 D342 D362 D4 E120 E206 DESCRIÇÃO CICLOFOSFAMIDA [1G; F/AMP] CICLOFOSFAMIDA [200MG; F/AMP] CICLOFOSFAMIDA [50MG; COMP] CICLOFOSFAMIDA [500MG; F/AMP] CICLOSPORINA [100MG; CÁP] CICLOSPORINA [25MG; CÁP] CICLOSPORINA [50 MG/ML;1ML; F/AMP] CITARABINA [40MG/2ML; F/AMP] CITARABINA [500MG/25ML; FRS] CLORAMBUCIL [2MG; COMP] CRISANTASPASE [10000UI; F/AMP] CICLOSPORINA [50 MG; CÁP] CARMUSTINA [100MG; F/AMP] CARBOPLATINA [10 MG/ML; 100 ML; F/AMP] CARBOPLATINA [10 MG/ML; 15 ML; SERINGA] CARBOPLATINA [10 MG/ML; 45 ML; SERINGA] CATUMAXOMAB [100 µG/ML; 0,1 ML] CATUMAXOMAB [100 µG/ML; 0,5 ML] CETUXIMAB [2 MG/ML; 50 ML; F/AMP] CICLOSPORINA [50 MG/ML; 5 ML; F/AMP] CISPLATINA [10 MG/20 ML; F/AMP] CISPLATINA [0.5 MG/ML; 100 ML; FRS] CISPLATINA [0.5 MG/ML; 50 ML; FRS] CITARABINA [50 MG/5 ML; F/AMP] DACARBAZINA [100MG; F/AMP] DAUNORRUBICINA (LIPOSSÓMICA) [50MG; F/AMP] DACARBAZINA [1000MG; F/AMP] DOXORRUBICINA [100MG/50ML; F/AMP] DOXORRUBICINA [200 MG; F/AMP] DASATINIB [50 MG;CÁP/COMP] DASATINIB [100 MG; CÁP/COMP] DACTINOMICINA [1.5 MG/3 ML; F/AMP] DASATINIB [70 MG; CÁP/COMP] DEGARRELIX [120 MG; F/AMP] DEGARRELIX [80 MG; F/AMP] DIFTITOX DENILEUCINA [0.15 MG/ML; F/AMP] DOXORRUBICINA [10 MG;PÓ SOL INJ] DOXORRUBICINA [2 MG/ML; 10 ML; F/AMP] DOXORRUBICINA [2 MG/ML; 75 ML; FRS] DOXORRUBICINA [50 MG; F/AMP] DOXORRUBICINA LIPOSSÓMICA PEGUILADA [50 MG; F/AMP] DACARBAZINA [500MG; F/AMP] ESTREPTOZOCINA [1G; F/AMP] EVEROLIMUS [0,75 MG; CÁP/COMP] CÓDIGO E329 E330 E375 E376 E377 E381 E382 E383 E384 E385 E386 E387 E388 E389 E390 E391 F260 F283 F486 F487 F488 F489 G212 G213 G214 G45 G46 H101 H190 H191 I10 I100 I102 I103 I104 I105 I106 I17 I18 I19 I202 I252 I253 I258 DESCRIÇÃO EPIRRUBICINA [150 MG/ 75 ML; F/AMP] ETOPOSIDO [200 MG ;SOL INJ;F/AMP] ECULIZUMAB [300 MG;SOL INJ] EPIRRUBICINA [2 MG/ML; 20 ML; F/AMP] EPIRRUBICINA [2 MG/ML; 50 ML; F/AMP] ETOPOSIDO [20 MG/ML; 2,5 ML; F/AMP] ETOPOSIDO [20 MG/ML; 20 ML; F/AMP] ETOPOSIDO [20 MG/ML; 25 ML; F/AMP] ETOPOSIDO [20 MG/ML; 50 ML; F/AMP] EVEROLÍMUS [0.1 MG;COMP DISP] EVEROLÍMUS [0.25 MG;COMP] EVEROLÍMUS [0.25 MG;COMP DISP] EVEROLÍMUS [0.5 MG;COMP] EVEROLÍMUS [1.0 MG;COMP] EVEROLÍMUS [10 MG;COMP] EVEROLÍMUS [5 MG;COMP] FOTEMUSTINA [200 MG; F/AMP] FOLINATO de CÁLCIO [10 MG/ML; 10ML; F/AMP] FLOXURIDINA [500 MG;SOL INJ] FLUDARABINA [10 MG;COMP] FLUOROURACILO [50 MG;CREME] FINGOLIMOD [0,5 MG; CÁP/COMP] GEMTUZUMAB OZOGAMICINA [5 MG;PÓ SOL INJ] GLICOFOSFOPEPTICAL [500 MG;GRAN] GLICOFOSFOPEPTICAL [500 MG;CÁPS] GEMCITABINA [1G; F/AMP] GEMCITABINA [200MG; F/AMP] HIDROXICARBAMIDA (HIDROXIUREIA) [500MG; CÁP] HIDROXICARBAMIDA [1000 MG;COMP] HISTAMINA [0.5 MG/0.5 ML;SOL INJ] IDARRUBICINA [25MG; CÁP] INTERFERÃO ALFA 2 B [30 MUI; CANETA/CARTUCHO] INTERFERÃO ALFA 2 B [60MUI; CANETA/CARTUCHO] INTERFERÃO BETA 1 A [6MUI; SERI] INTERFERÃO BETA 1 A [6MUI; F/AMP] INTERFERÃO ALFA 2 A [18MUI; CANETA/CARTUCHO] INTERFERÃO BETA 1 B [8MUI; F/AMP] IFOSFAMIDA [1G; F/AMP] IFOSFAMIDA [2G; F/AMP] IFOSFAMIDA [500MG; F/AMP] IMATINIB [100MG;CÁP/COMP] INTERFERÃO ALFA 2 B [10 MUI; F/AMP] INTERFERÃO GAMA 1 B [2 MUI/0,5 ML; F/AMP] IMATINIB [400 MG; CÁP/COMP] CÓDIGO I9 I916 I917 I94 I941 I942 I943 I945 I95 I950 I955 I957 I97 I98 L231 L402 L403 L517 L522 L523 L525 L528 L537 M115 M132 M133 M134 M151 M174 M175 M177 M254 M255 M256 M257 M31 M38 M41 M42 M51 M58 M919 M920 M921 DESCRIÇÃO IDARRUBICINA [10MG; F/AMP] INTERFERÃO ALFA 2 B [3 MUI;FRS] INTERFERÃO ALFA 2 B [5 MUI;FRS] INTERFERÃO ALFA 2 A [3MUI; FRS/SERINGA] IBRITUMOMAB TIUXETANO [1.6 MG/ML; 10 ML; FRS] IDARRUBICINA [20 MG/20 ML; F/AMP] IMATINIB [50 MG;CÁPS] INTERFERÃO ALFA-2B [10 M.U.I./ML; 2,5 ML; F/AMP] INTERFERÃO ALFA 2 A [6MUI; SERI] IRINOTECANO [500 MG/25 ML; F/AMP] INTERFERÃO BETA-1A [12 M.U.I./ML; CARTUXO] INTERFERÃO BETA-1A [6 M.U.I.; CANETA] INTERFERÃO ALFA 2 A [9 MUI; SERI] INTERFERÃO ALFA 2 B [18MUI; CANETA/CARTUCHO] LOMUSTINA [40 MG; CÁP] LEUPRORRELINA(Pò+Solv, Sol.Inj,SC)[7,5 MG;SERIN/FRS] LEUPRORRELINA(Pó+SOLV,SOL.INJ. SC)[22,5 MG;SERIN/FRS] LEFLUNOMIDA [10 MG; CÁP/COMP] LENALIDOMIDA [25 MG; CÁP/COMP] LENALIDOMIDA [15 MG;CÁP/COMP] LENALIDOMIDA [10 MG; CÁP/COMP] LENALIDOMIDA [5 MG; CÁP/COMP] LOMUSTINA [10 MG;CÁPS] METIRAPONA [250MG; CÁP] METOTREXATO [5MG/2ML; F/AMP] METOTREXATO [50MG/2ML; F/AMP] METOTREXATO [500MG/20ML; F/AMP] MICOFENOLATO de MOFETIL (pó p/a susp. oral) [200 MG/ML; FRS] MITOMICINA [2MG; F/AMP] MITOMICINA [20MG; F/AMP] MITOTANO [500MG; CÁP/COMP] MEGESTROL (susp. oral) [40 MG/ML; FRS] MICOFENOLATO de MOFETIL [250 MG; CÁP] MICOFENOLATO de MOFETIL [500 MG; COMP] MICOFENOLATO de MOFETIL [500 MG; IV; F/AMP] MEDROXIPROGESTERONA [1G/5ML; FRS] MEGESTROL [40MG; COMP] MELFALAM [2MG; COMP] MELFALAM [50MG; F/AMP] MERCAPTOPURINA [50MG; COMP] MESNA [400MG/4ML; F/AMP] METOTREXATO [10 MG/ML; 1 ML; SERIN.] METOTREXATO [10 MG/ML; 2 ML; SERIN.] METOTREXATO [10 MG/ML; 1,5 ML; SERIN.] CÓDIGO M922 M965 M967 M969 M970 M971 M972 M973 M975 M976 M977 M978 M981 M982 M983 M984 M985 M986 M988 M990 M991 M992 M993 M999 N123 N124 N127 N56 O34 O911 P1 P1046 P1047 P2 P286 P465 P517 P518 P519 P520 P521 P522 P523 P524 DESCRIÇÃO METOTREXATO [10 MG/ML; 2,5 ML; SERIN.] MEDROXIPROGESTERONA [150 MG/ML; 6,7 ML; F/AMP] METOTREXATO [10 MG;COMP] METOTREXATO [10 MG/ML; 1ML; F/AMP] METOTREXATO [10 MG/ML; 5 ML; F/AMP] METOTREXATO [10 MG/ML; 50 ML; F/AMP] METOTREXATO [10 MG/ML; 0,75 ML; SERINGA] METOTREXATO [100 MG/ML; 5 ML; F/AMP] METOTREXATO [20 MG/ML; 1,25 ML; SERINGA] METOTREXATO [20 MG/ML; 1 ML; SERINGA] METOTREXATO [20 MG/ML; 1,5 ML; SERINGA] METOTREXATO [25 MG/ML; 4 ML; F/AMP] METOTREXATO [50 MG/ML; 0,15 ML; SERINGA] METOTREXATO [50 MG/ML; 0,2 ML; SERINGA] METOTREXATO [50 MG/ML; 0,3 ML; SERINGA] METOTREXATO [50 MG/ML; 0,4 ML; SERINGA]] METOTREXATO [50 MG/ML; 0,5 ML; SERINGA]] METOXSALENO [20 µG/ML;SOL MODIFICAÇÃO FRAC SANG] MILTEFOSINA [50 MG;CÁP/COMP] MITOXANTRONA [2 MG/ML; 12,5 ML; F/AMP] MITOXANTRONA [2 MG/ML; 15 ML; F/AMP] MITOXANTRONA [2 MG/ML; 5 ML; F/AMP] MUROMONAB-CD3 [5 MG/5 ML; F/AMP] MICOFENOLATO DE MOFETIL [500 MG; CÁP/COMP] NILOTINIB [200 MG; CÁP/COMP] NATALIZUMAB [20 MG/ML; 15 ML; F/AMP] NITRATO DE CÉRIO + SULFADIAZINA PRATA [10 MG/G + 22 MG/G;CR] NILUTAMIDA [100MG; CÁP/COMP] OXALIPLATINA [100 MG; F/AMP] OXALIPLATINA [50 MG; F/AMP] PACLITAXEL [100MG/17ML; F/AMP] PAZOPANIB [200 MG; CÁP/COMP] PAZOPANIB [400 MG; CÁP/COMP] PACLITAXEL [30MG/5ML; F/AMP] PROCARBAZINA [50MG; CÁP] PALIVIZUMAB [100 MG/ML; 1 ML; F/AMP] PEGINTERFERÃO ALFA 2A [0,135 MG;SERINGA/FRS] PEGINTERFERÃO ALFA 2A[0,18 MG;SERINGA/FRS] PEGINTERFERÃO ALFA 2 B[0,05 MG;FRS/CANETA] PEGINTERFERÃO ALFA 2 B[0,08 MG;FRS/CANETA] PEGINTERFERÃO ALFA 2 B[0,1 MG;;FRS/CANETA] PEGINTERFERÃO ALFA 2 B[0,12 MG;FRS/CANETA] PEGINTERFERÃO ALFA 2 B[0,15 MG;FRS/CANETA] PACLITAXEL [6 MG/ML;50 ML;F/AMP] CÓDIGO P533 P748 P832 P837 P838 P839 S269 S270 S427 S428 T108 T1113 T1115 T1118 T1121 T1124 T1125 T1126 T1127 T1128 T1129 T1131 T1137 T1138 T1141 T136 T153 T304 T305 T306 T307 T5 T98 U21 V115 V80 V87 V88 V89 V90 V91 V92 V922 V924 DESCRIÇÃO PEMETREXEDO (Sol.InJ) [500 MG; FRS/AMP] PANITUMUMAB [20 MG/ML; 10 ML; F/AMP] PACLITAXEL [5 MG/ML;PÓ SUSP INJ] PLERIXAFOR [20 MG/ML; 1,2 ML; F/AMP] PORFÍMERO SÓDICO [15 MG;PÓ SOL INJ] PORFÍMERO SÓDICO [75 MG;PÓ SOL INJ] SIROLÍMUS [1 MG; CÁP/COMP] SIROLÍMUS [2 MG; CÁP/COMP] SIROLÍMUS [1 MG/ML;SOL ORAL] SIROLÍMUS [5 MG; CÁP/COMP] TIOTEPA [15MG; F/AMP] TRABECTEDINA [1 MG; F/AMP] TRIPTORRELINA [22.5 MG; F/AMP] TACROLÍMUS [0.2 MG;PÓ SUSP ORAL] TACROLÍMUS [1 MG;PÓ SUSP ORAL] TAMOXIFENO [30 MG; CÁP/COMP] TAMOXIFENO [40 MG; CÁP/COMP] TASONERMINA [1 MG; F/AMP] TEMOPORFINA [1 MG/ML; 1 ML; F/AMP] TEMOPORFINA [4 MG/ML; 3,5 ML; F/AMP] TEMOPORFINA [4 MG/ML; 5 ML; F/AMP] TIOTEPA [10 MG; F/AMP] TOPOTECANO [1 MG; F/AMP] TRABECTEDINA [0.25 MG; F/AMP] TRIPTORRELINA [0.1 MG/1 ML;SOL INJ] TOREMIFENO [60 MG; CÁP/COMP] TRETINOINA [10 MG; CÁP/COMP] TEMOZOLOMIDA [100 MG;CAP/COMP] TEMOZOLOMIDA[20 MG; CAP/COMP] TEMOZOLOMIDA [250 MG; CAP/COMP] TEMOZOLOMIDA [5 MG; CAP/COMP] TALIDOMIDA [50 MG; CÁP/COMP] TIOGUANINA [40MG; COMP] USTECINUMAB [90 MG;SOL INJ] VINORRELBINA [10 MG/ML; 4 ML; F/AMP] VERTEPORFINA [15 MG; F/AMP] VINCRISTINA [1MG/1ML; F/SERI] VINCRISTINA [2MG/2ML; F/SERI] VINDESINA [5MG; F/AMP] VINORRELBINA [10MG/1ML; F/AMP] VINORRELBINA [20MG;CÁP] VINORRELBINA [30MG; CÁP] VINBLASTINA [1 MG/ 1 ML;SOL INJ] VINBLASTINA [2 MG/2 ML;SOL INJ] CÓDIGO V925 V926 V927 V93 DESCRIÇÃO VINCRISTINA [1 MG/ML; 5 ML; SOL INJ] VINFLUNINA [25 MG/ML; 10 ML; F/AMP] VINFLUNINA [25 MG/ML; 2 ML; F/AMP] VINORRELBINA [50MG/5ML; F/AMP] ANEXO II Aspectos da execução do contrato submetidos à concorrência: Preço CÓDIGO A1007 A25 DESCRIÇÃO FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A ANAGRELIDA [0.5 MG; CÁP/COMP] CIPROTERONA (ACETATO DE) [100 MG;COMP] GENERIS Farmacêutica, SA 263 2010018/263/0422 0,5660 0,5660 A25 CIPROTERONA (ACETATO DE) [100 MG;COMP] A306 ALDESLEUCINA [18 MUI; F/AMP] A307 ALEMTUZUMAB [30MG;F/AMP;IV] A5022 A5023 ABATACEPT [250 MG; F/AMP] ÁCIDO 5-AMINOLEVULÍNICO [8 MG;EMPL MEDIC] A5024 ADALIMUMAB [40 MG/0.8 ML;SERINGA] A5025 A5026 ALITRETINOÍNA [1 MG/G;GEL] AMINOLEVULINATO DE METILO [1500 MG;SOL INJ] A5027 ANACINRA [100 MG/0.67 ML;SOL INJ] Bayer Portugal SA - 15 2010018/15/1169 0,6000 Genzyme Portugal, SA - 301 2008006/15/0016 513,3300 513,3300 CÓDIGO A5028 DESCRIÇÃO A5037 AZACITIDINA [25 MG/ML; F/AMP] ACETATO DE ABIRATERONA [250 MG; CÁP/COMP] A562 AZATIOPRINA [25MG; COMP] A564 AZATIOPRINA [50MG; F/AMP] A637 AMSACRINA [50 MG/ ML; 1,5 ML; F/AMP] A706 ACIDO MICOFENÓLICO [180 MG; CÁP/COMP] A707 ACIDO MICOFENÓLICO [360 MG; CÁP/COMP] A920 ACETATO de GLATIRÂMERO [20 MG; F/AMP] B14 BASILIXIMAB [20MG; FRS] B188 BUSERRELINA [9,9MG; IMPL] B191 BUSSULFAM [2MG; COMP] B193 B240 BUSSULFAM [60MG/10ML; F/AMP] BACILLUS CALMETTE-GUÉRIN (BCG instil.vesical) [2x10e8 a 3x10e9;F/AMP] BACILLUS CALMETTE-GUÉRIN (BCG instil.vesical) [2x10e8 a 3x10e9;F/AMP] B242 BORTEZOMIB [3,5MG; IV; F/AMP]] B240 FORNECEDOR GlaxoSmithKline - Produtos Farmacêuticos Lda - 68 Novartis Farma-Produtos Farmacêuticos S A - 128 Novartis Farma-Produtos Farmacêuticos S A - 128 Sanofi - Aventis - Produtos Farmacêuticos Lda - 12 Novartis Farma-Produtos Farmacêuticos S A - 128 Sanofi - Aventis - Produtos Farmacêuticos Lda - 12 N.º CPA 2008014/68/1035 PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 0,0772 0,0772 2008014/128/0849 1,0143 1,0143 2008014/128/0850 1,9903 1,9903 2008014/12/0450 25,5221 25,5221 2008006/128/0024 1.172,1700 1.172,1700 2008006/12/0030 257,0800 257,0800 Pierre Fabre Médicament Portugal Lda - 138 2008006/138/0001 270,2500 270,2500 MEDAC - 473 2008014/473/1430 100,0000 Laboratórios Inibsa S.A. - 67 Janssen-Cilag-Farmacêutica Lda - 74 2008014/67/0116 100,2000 2008014/74/1387 1.143,0000 100,0000 1.143,0000 CÓDIGO DESCRIÇÃO B366 BASILIXIMAB [10 MG; F/AMP] B367 BESILESOMAB [1 MG; F/AMP] B368 BEXAROTENO [75 MG;CÁPS] B370 BUSERRELINA [5.5 MG/5.5 ML;F/AMP] C1000 CITARABINA [50 MG/ML; 2 ML; F/AMP] C1003 CITARABINA [50 MG/ML; 80 ML; F/AMP] C1004 CLADRIBINA [2 MG/ML;SOL INJ] C1005 CLOFARABINA [1 MG/ML; 20 ML; F/AMP] C1006 CLOROMETINA [10 MG; F/AMP] C1007 CLOROMETINA [1000 MG; F/AMP] C1009 CANACINUMAB [150 MG;PÓ SOL INJ] C184 CICLOFOSFAMIDA [1G; F/AMP] C185 CICLOFOSFAMIDA [200MG; F/AMP] C186 CICLOFOSFAMIDA [50MG; COMP] C187 CICLOFOSFAMIDA [500MG; F/AMP] FORNECEDOR Baxter-Médico Farmacêutica Lda - 110 Baxter-Médico Farmacêutica Lda - 110 Baxter-Médico Farmacêutica Lda - 110 N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 2003006/110/0175 7,0506 7,0506 2003006/110/0176 0,0752 0,0752 2003006/110/0177 3,8353 3,8353 CÓDIGO DESCRIÇÃO C192 CICLOSPORINA [100MG; CÁP] C192 CICLOSPORINA [100MG; CÁP] C192 CICLOSPORINA [100MG; CÁP] C192 CICLOSPORINA [100MG; CÁP] C193 CICLOSPORINA [25MG; CÁP] C193 CICLOSPORINA [25MG; CÁP] C193 CICLOSPORINA [25MG; CÁP] C193 CICLOSPORINA [25MG; CÁP] C195 CICLOSPORINA [50 MG/ML;1ML; F/AMP] C235 CITARABINA [40MG/2ML; F/AMP] C236 CITARABINA [500MG/25ML; FRS] C318 CLORAMBUCIL [2MG; COMP] C478 CRISANTASPASE [10000UI; F/AMP] FORNECEDOR GENERIS Farmacêutica, SA 263 Overpharma, Produtos Médicos e Farmacêuticos Lda. 247 Novartis Farma-Produtos Farmacêuticos S A - 128 Laboratório Medinfar-Produtos Farmacêuticos SA - 93 GENERIS Farmacêutica, SA 263 Overpharma, Produtos Médicos e Farmacêuticos Lda. 247 Novartis Farma-Produtos Farmacêuticos S A - 128 Laboratório Medinfar-Produtos Farmacêuticos SA - 93 Novartis Farma-Produtos Farmacêuticos S A - 128 Ipsen Portugal -Produtos Farmacêuticos SA - 69 N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 2008014/263/0233 0,5900 2008014/247/0609 0,5900 0,5900 2008014/128/0851 1,1280 2008014/93/1340 1,4200 2008014/263/0235 0,2000 2008014/247/0610 0,2000 0,2000 2008014/128/0852 0,3000 2008014/93/1341 0,3800 2008006/128/0026 1,4430 1,4430 2003006/69/0046 99,7600 99,7600 CÓDIGO DESCRIÇÃO FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A C573 CICLOSPORINA [50 MG; CÁP] C573 CICLOSPORINA [50 MG; CÁP] C573 CICLOSPORINA [50 MG; CÁP] C573 CICLOSPORINA [50 MG; CÁP] Overpharma, Produtos Médicos e Farmacêuticos Lda. 247 GENERIS Farmacêutica, SA 263 Novartis Farma-Produtos Farmacêuticos S A - 128 Laboratório Medinfar-Produtos Farmacêuticos SA - 93 C71 CARMUSTINA [100MG; F/AMP] Bristol-Myers Squibb S.A - 115 2001006/115/0093 33,0354 33,0354 C983 CARBOPLATINA [10 MG/ML; 100 ML; F/AMP] C985 CARBOPLATINA [10 MG/ML; 15 ML; SERINGA] C986 CARBOPLATINA [10 MG/ML; 45 ML; SERINGA] C988 CATUMAXOMAB [100 µG/ML; 0,1 ML] C989 CATUMAXOMAB [100 µG/ML; 0,5 ML] C990 CETUXIMAB [2 MG/ML; 50 ML; F/AMP] C992 CICLOSPORINA [50 MG/ML; 5 ML; F/AMP] C994 CISPLATINA [10 MG/20 ML; F/AMP] C995 CISPLATINA [0.5 MG/ML; 100 ML; FRS] C996 CISPLATINA [0.5 MG/ML; 50 ML; FRS] C999 CITARABINA [50 MG/5 ML; F/AMP] D1 DACARBAZINA [100MG; F/AMP] Sanofi - Aventis - Produtos Farmacêuticos Lda - 12 2003006/12/0111 6,0000 2008014/247/0611 0,2400 2008014/263/0237 0,2900 0,2400 2008014/128/0853 0,5000 2008014/93/1342 0,6600 6,0000 CÓDIGO DESCRIÇÃO D17 DAUNORRUBICINA (LIPOSSÓMICA) [50MG; F/AMP] D2 DACARBAZINA [1000MG; F/AMP] D210 DOXORRUBICINA [100MG/50ML; F/AMP] D296 DOXORRUBICINA [200 MG; F/AMP] D296 DOXORRUBICINA [200 MG; F/AMP] FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A Gilead Sciences, Lda - 229 2001006/229/0012 254,0029 254,0029 MEDAC - 473 GENERIS Farmacêutica, SA 263 GENERIS Farmacêutica, SA 263 2008006/473/0101 55,0000 55,0000 2003006/43/0011 67,3400 2010018/473/1137 140,0000 67,3400 2010018/263/0433 95,0000 D296 DOXORRUBICINA [200 MG; F/AMP] D296 DOXORRUBICINA [200 MG; F/AMP] MEDAC - 473 Sandoz Farmaceutica, Lda 326 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 D324 DASATINIB [50 MG;CÁP/COMP] Bristol-Myers Squibb S.A - 115 2010018/115/0047 64,6000 64,6000 D325 DASATINIB [100 MG; CÁP/COMP] Bristol-Myers Squibb S.A - 115 2010018/115/0048 129,2000 129,2000 D332 DACTINOMICINA [1.5 MG/3 ML; F/AMP] D334 DASATINIB [70 MG; CÁP/COMP] D335 DEGARRELIX [120 MG; F/AMP] D336 DEGARRELIX [80 MG; F/AMP] D337 DIFTITOX DENILEUCINA [0.15 MG/ML; F/AMP] D338 DOXORRUBICINA [10 MG;PÓ SOL INJ] D339 DOXORRUBICINA [2 MG/ML; 10 ML; F/AMP] 95,0000 2010018/326/1543 148,0000 2010018/334/1212 167,0000 CÓDIGO DESCRIÇÃO FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A D341 DOXORRUBICINA [2 MG/ML; 75 ML; FRS] D342 D362 DOXORRUBICINA [50 MG; F/AMP] DOXORRUBICINA LIPOSSÓMICA PEGUILADA [50 MG; F/AMP] D4 DACARBAZINA [500MG; F/AMP] MEDAC - 473 2008006/473/0100 30,0000 30,0000 E120 ESTREPTOZOCINA [1G; F/AMP] 2008006/96/0117 46,8870 E206 EVEROLIMUS [0,75 MG; CÁP/COMP] Laboratórios Pfizer Lda - 96 Novartis Farma-Produtos Farmacêuticos S A - 128 E329 EPIRRUBICINA [150 MG/ 75 ML; F/AMP] E330 ETOPOSIDO [200 MG ;SOL INJ;F/AMP] E375 ECULIZUMAB [300 MG;SOL INJ] E376 EPIRRUBICINA [2 MG/ML; 20 ML; F/AMP] E377 EPIRRUBICINA [2 MG/ML; 50 ML; F/AMP] E381 ETOPOSIDO [20 MG/ML; 2,5 ML; F/AMP] E382 ETOPOSIDO [20 MG/ML; 20 ML; F/AMP] E383 ETOPOSIDO [20 MG/ML; 25 ML; F/AMP] E384 ETOPOSIDO [20 MG/ML; 50 ML; F/AMP] E385 EVEROLÍMUS [0.1 MG;COMP DISP] E386 EVEROLÍMUS [0.25 MG;COMP] E387 EVEROLÍMUS [0.25 MG;COMP DISP] E388 EVEROLÍMUS [0.5 MG;COMP] Sandoz Farmaceutica, Lda 326 46,8870 2008014/128/0858 5,1758 5,1758 2008006/247/0066 11,0000 11,0000 CÓDIGO DESCRIÇÃO E389 EVEROLÍMUS [1.0 MG;COMP] E390 EVEROLÍMUS [10 MG;COMP] E391 EVEROLÍMUS [5 MG;COMP] F260 F283 FOTEMUSTINA [200 MG; F/AMP] FOLINATO de CÁLCIO [10 MG/ML; 10ML; F/AMP] F486 FLOXURIDINA [500 MG;SOL INJ] F487 FLUDARABINA [10 MG;COMP] F488 FLUOROURACILO [50 MG;CREME] F489 G212 FINGOLIMOD [0,5 MG; CÁP/COMP] GEMTUZUMAB OZOGAMICINA [5 MG;PÓ SOL INJ] G213 GLICOFOSFOPEPTICAL [500 MG;GRAN] G214 GLICOFOSFOPEPTICAL [500 MG;CÁPS] FORNECEDOR Sandoz Farmaceutica, Lda 326 N.º CPA PREÇO UNITÁRIO INFERIOR A 2008006/247/0218 8,7000 NOVOS FORNECEDORES PREÇO INFERIOR A 8,7000 CÓDIGO DESCRIÇÃO FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A G45 GEMCITABINA [1G; F/AMP] G45 GEMCITABINA [1G; F/AMP] Fresenius Kabi Pharma Portugal Lda - 51 Laboratórios AzevedosIndústria Farmacêutica SA - 79 G45 GEMCITABINA [1G; F/AMP] Hospira Portugal Lda - 155 G45 GEMCITABINA [1G; F/AMP] G45 GEMCITABINA [1G; F/AMP] G45 GEMCITABINA [1G; F/AMP] MEDAC - 473 2010018/473/1142 30,0000 Ciclum Farma Unipessoal, Lda 248 2010018/248/1437 40,0000 GENERIS Farmacêutica, SA 263 2010018/263/0446 40,0000 G45 GEMCITABINA [1G; F/AMP] G45 GEMCITABINA [1G; F/AMP] G45 GEMCITABINA [1G; F/AMP] G45 GEMCITABINA [1G; F/AMP] G45 GEMCITABINA [1G; F/AMP] G45 GEMCITABINA [1G; F/AMP] G45 GEMCITABINA [1G; F/AMP] 2010018/51/1515 22,0000 2010018/79/0782 22,0000 NOVOS FORNECEDORES PREÇO INFERIOR A 2010018/155/1100 30,0000 Actavis AS Sucursal - 455 Sandoz Farmaceutica, Lda 326 2010018/455/0724 46,0000 Hikma Farmacêutica Lda - 62 Farmoz - Soc. Técnico Medicinal, S.A. - 46 Lilly Portugal - Produtos Farmacêuticos, Lda. - 112 Ratiopharm-Comércio e Indústria de Produtos Farmacêuticos Lda - 147 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 2010018/62/0617 51,0000 2010018/46/0284 58,0000 2010018/326/1554 46,0000 2010018/112/0756 150,4000 2010018/147/1009 155,0000 2010018/334/1232 155,0000 22,0000 CÓDIGO DESCRIÇÃO FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A G46 GEMCITABINA [200MG; F/AMP] G46 GEMCITABINA [200MG; F/AMP] Fresenius Kabi Pharma Portugal Lda - 51 Laboratórios AzevedosIndústria Farmacêutica SA - 79 G46 GEMCITABINA [200MG; F/AMP] Hospira Portugal Lda - 155 2010018/155/1102 10,0000 G46 GEMCITABINA [200MG; F/AMP] MEDAC - 473 2010018/473/1141 10,0000 G46 GEMCITABINA [200MG; F/AMP] 2010018/455/0725 12,0000 G46 GEMCITABINA [200MG; F/AMP] G46 GEMCITABINA [200MG; F/AMP] Actavis AS Sucursal - 455 Sandoz Farmaceutica, Lda 326 GENERIS Farmacêutica, SA 263 G46 GEMCITABINA [200MG; F/AMP] 2010018/62/0618 G46 GEMCITABINA [200MG; F/AMP] G46 GEMCITABINA [200MG; F/AMP] G46 GEMCITABINA [200MG; F/AMP] G46 GEMCITABINA [200MG; F/AMP] Hikma Farmacêutica Lda - 62 Ciclum Farma Unipessoal, Lda 248 Lilly Portugal - Produtos Farmacêuticos, Lda. - 112 Ratiopharm-Comércio e Indústria de Produtos Farmacêuticos Lda - 147 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 2010018/51/1516 7,0000 2010018/79/0783 7,0000 NOVOS FORNECEDORES PREÇO INFERIOR A 2010018/326/1555 12,0000 2010018/263/0447 13,0000 18,0000 2010018/248/1438 20,0000 2010018/112/0757 33,8400 2010018/147/1010 35,0000 2010018/334/1231 35,0000 7,0000 CÓDIGO DESCRIÇÃO FORNECEDOR H101 HIDROXICARBAMIDA (HIDROXIUREIA) [500MG; CÁP] MEDAC - 473 HIDROXICARBAMIDA (HIDROXIUREIA) [500MG; CÁP] Bristol-Myers Squibb S.A - 115 H190 HIDROXICARBAMIDA [1000 MG;COMP] H191 HISTAMINA [0.5 MG/0.5 ML;SOL INJ] I10 IDARRUBICINA [25MG; CÁP] I10 I102 IDARRUBICINA [25MG; CÁP] INTERFERÃO ALFA 2 B [30 MUI; CANETA/CARTUCHO] INTERFERÃO ALFA 2 B [60MUI; CANETA/CARTUCHO] I103 INTERFERÃO BETA 1 A [6MUI; SERI] I104 I105 INTERFERÃO BETA 1 A [6MUI; F/AMP] INTERFERÃO ALFA 2 A [18MUI; CANETA/CARTUCHO] I106 I106 H101 I100 N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 2008006/473/0102 0,3100 0,3100 2008006/115/0074 0,3200 Laboratórios Pfizer Lda - 96 Pharmacia Corporation Laboratórios, Lda - 136 Schering-Plough Farma Lda 163 Schering-Plough Farma Lda 163 2001006/136/0110 166,9700 166,9700 2001006/136/0110 166,9726 2008014/163/1481 162,5000 162,5000 2008014/163/1482 324,6100 324,6100 2008014/119/0330 64,4016 64,4016 INTERFERÃO BETA 1 B [8MUI; F/AMP] Merck SA - 119 Biogen Idec Portugal Sociedade Farmaceutica Unipessoal - 320 Roche-Farmacêutica Química Lda - 150 Novartis Farma-Produtos Farmacêuticos S A - 128 INTERFERÃO BETA 1 B [8MUI; F/AMP] Bayer Portugal SA - 15 2010018/15/1175 2001006/163/0005 215,7301 2008014/150/1173 78,8900 215,7301 78,8900 2010018/128/0546 51,8520 51,8520 55,0900 CÓDIGO DESCRIÇÃO I17 IFOSFAMIDA [1G; F/AMP] I18 IFOSFAMIDA [2G; F/AMP] I19 IFOSFAMIDA [500MG; F/AMP] I202 IMATINIB [100MG;CÁP/COMP] I252 INTERFERÃO ALFA 2 B [10 MUI; F/AMP] I253 INTERFERÃO GAMA 1 B [2 MUI/0,5 ML; F/AMP] I258 IMATINIB [400 MG; CÁP/COMP] I9 IDARRUBICINA [10MG; F/AMP] I916 INTERFERÃO ALFA 2 B [3 MUI;FRS] I917 INTERFERÃO ALFA 2 B [5 MUI;FRS] I94 I941 INTERFERÃO ALFA 2 A [3MUI; FRS/SERINGA] IBRITUMOMAB TIUXETANO [1.6 MG/ML; 10 ML; FRS] I942 IDARRUBICINA [20 MG/20 ML; F/AMP] I943 IMATINIB [50 MG;CÁPS] INTERFERÃO ALFA-2B [10 M.U.I./ML; 2,5 ML; F/AMP] I945 FORNECEDOR Baxter-Médico Farmacêutica Lda - 110 Baxter-Médico Farmacêutica Lda - 110 Novartis Farma-Produtos Farmacêuticos S A - 128 Unilfarma - União Internacional de Laboratórios Farmacêuticos Lda - 176 Novartis Farma-Produtos Farmacêuticos S A - 128 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 Roche-Farmacêutica Química Lda - 150 N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 2003006/110/0178 11,4275 11,4275 2003006/110/0179 20,7500 20,7500 2008006/128/0027 19,3897 19,3897 2008014/176/0818 74,4400 74,4400 2008014/128/0862 77,2380 77,2380 2010018/334/1235 210,0000 210,0000 2008014/150/1174 15,4400 15,4400 CÓDIGO DESCRIÇÃO I95 INTERFERÃO ALFA 2 A [6MUI; SERI] I950 I955 IRINOTECANO [500 MG/25 ML; F/AMP] INTERFERÃO BETA-1A [12 M.U.I./ML; CARTUXO] I957 INTERFERÃO BETA-1A [6 M.U.I.; CANETA] I97 INTERFERÃO ALFA 2 A [9 MUI; SERI] INTERFERÃO ALFA 2 B [18MUI; CANETA/CARTUCHO] I98 L231 L403 LOMUSTINA [40 MG; CÁP] LEUPRORRELINA(Pò+Solv, Sol.Inj,SC)[7,5 MG;SERIN/FRS] LEUPRORRELINA(Pó+SOLV,SOL.INJ. SC)[22,5 MG;SERIN/FRS] L517 LEFLUNOMIDA [10 MG; CÁP/COMP] L402 FORNECEDOR Roche-Farmacêutica Química Lda - 150 N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 2008014/150/1175 32,6100 32,6100 2008014/150/1176 44,7300 44,7300 2008014/163/1480 97,7800 97,7800 MEDAC - 473 2008006/473/0103 19,5600 19,5600 Astellas Farma Lda - 184 2008014/184/1306 100,6700 100,6700 Astellas Farma Lda - 184 Sanofi - Aventis - Produtos Farmacêuticos Lda - 12 2008014/184/1307 271,3000 271,3000 Roche-Farmacêutica Química Lda - 150 Schering-Plough Farma Lda 163 2010018/12/1637 1,5300 1,5300 L517 LEFLUNOMIDA [10 MG; CÁP/COMP] L522 LENALIDOMIDA [25 MG; CÁP/COMP] L523 LENALIDOMIDA [15 MG;CÁP/COMP] L525 LENALIDOMIDA [10 MG; CÁP/COMP] L528 LENALIDOMIDA [5 MG; CÁP/COMP] L537 LOMUSTINA [10 MG;CÁPS] MEDAC - 473 2010018/473/1145 1,8000 CÓDIGO DESCRIÇÃO M115 METIRAPONA [250MG; CÁP] M132 METOTREXATO [5MG/2ML; F/AMP] M133 METOTREXATO [50MG/2ML; F/AMP] M134 M151 METOTREXATO [500MG/20ML; F/AMP] MICOFENOLATO de MOFETIL (pó p/a susp. oral) [200 MG/ML; FRS] M174 MITOMICINA [2MG; F/AMP] M175 MITOMICINA [20MG; F/AMP] M177 MITOTANO [500MG; CÁP/COMP] M254 MEGESTROL (susp. oral) [40 MG/ML; FRS] FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A Hospira Portugal Lda - 155 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 Roche-Farmacêutica Química Lda - 150 UNIFA-União Fabril Farmacêutica SA - 220 GENERIS Farmacêutica, SA 263 2003006/155/0151 1,7200 1,7200 2008006/334/0158 1,9200 1,9200 2008006/334/0157 10,0000 10,0000 2008014/150/1181 224,0900 224,0900 2003006/220/0067 6,5340 6,5340 2003006/43/0018 35,4100 35,4100 Bristol-Myers Squibb S.A - 115 2008006/115/0075 73,3100 73,3100 CÓDIGO DESCRIÇÃO M255 MICOFENOLATO de MOFETIL [250 MG; CÁP] M255 MICOFENOLATO de MOFETIL [250 MG; CÁP] M255 MICOFENOLATO de MOFETIL [250 MG; CÁP] M255 MICOFENOLATO de MOFETIL [250 MG; CÁP] M255 MICOFENOLATO de MOFETIL [250 MG; CÁP] M255 MICOFENOLATO de MOFETIL [250 MG; CÁP] M255 MICOFENOLATO de MOFETIL [250 MG; CÁP] M255 MICOFENOLATO de MOFETIL [250 MG; CÁP] FORNECEDOR Actavis AS Sucursal - 455 GENERIS Farmacêutica, SA 263 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 Sandoz Farmaceutica, Lda 326 Overpharma, Produtos Médicos e Farmacêuticos Lda. 247 Farmoz - Soc. Técnico Medicinal, S.A. - 46 Roche-Farmacêutica Química Lda - 150 Ratiopharm-Comércio e Indústria de Produtos Farmacêuticos Lda - 147 N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 2010018/455/0734 0,7200 2010018/263/0475 0,7200 2010018/334/1253 0,7200 2010018/326/1566 0,7330 0,7200 2010018/247/0863 0,8500 2010018/46/0316 1,0000 2010018/150/1482 1,0254 2010018/147/1034 1,0400 CÓDIGO M256 DESCRIÇÃO FORNECEDOR M257 MICOFENOLATO de MOFETIL [500 MG; COMP] Actavis AS Sucursal - 455 GENERIS Farmacêutica, SA MICOFENOLATO de MOFETIL [500 MG; COMP] 263 Sandoz Farmaceutica, Lda MICOFENOLATO de MOFETIL [500 MG; COMP] 326 TEVA PHARMA - Produtos MICOFENOLATO de MOFETIL [500 MG; COMP] Farmacêuticos Lda - 334 Overpharma, Produtos Médicos e Farmacêuticos Lda. MICOFENOLATO de MOFETIL [500 MG; COMP] 247 Farmoz - Soc. Técnico MICOFENOLATO de MOFETIL [500 MG; COMP] Medicinal, S.A. - 46 Roche-Farmacêutica Química MICOFENOLATO de MOFETIL [500 MG; COMP] Lda - 150 Ratiopharm-Comércio e Indústria de Produtos MICOFENOLATO de MOFETIL [500 MG; COMP] Farmacêuticos Lda - 147 MICOFENOLATO de MOFETIL [500 MG; IV; Roche-Farmacêutica Química F/AMP] Lda - 150 M31 MEDROXIPROGESTERONA [1G/5ML; FRS] M38 MEGESTROL [40MG; COMP] M256 M256 M256 M256 M256 M256 M256 GENERIS Farmacêutica, SA 263 N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 2010018/455/0735 1,1000 2010018/263/0476 1,1000 2010018/326/1567 1,1000 2010018/334/1254 1,1000 1,1000 2010018/247/0864 1,3400 2010018/46/0317 2,0000 2010018/150/1483 2,0508 2010018/147/1035 2,2000 2008014/150/1184 17,7400 2003006/43/0016 17,7400 0,2400 0,2400 M38 MEGESTROL [40MG; COMP] Bristol-Myers Squibb S.A - 115 2003006/115/0090 0,2469 M41 CÓDIGO MELFALAM [2MG; COMP] DESCRIÇÃO M42 MELFALAM [50MG; F/AMP] M51 MERCAPTOPURINA [50MG; COMP] M58 MESNA [400MG/4ML; F/AMP] M919 METOTREXATO [10 MG/ML; 1 ML; SERIN.] M920 METOTREXATO [10 MG/ML; 2 ML; SERIN.] M921 METOTREXATO [10 MG/ML; 1,5 ML; SERIN.] M922 M965 METOTREXATO [10 MG/ML; 2,5 ML; SERIN.] MEDROXIPROGESTERONA [150 MG/ML; 6,7 ML; F/AMP] M967 METOTREXATO [10 MG;COMP] M969 METOTREXATO [10 MG/ML; 1ML; F/AMP] M970 METOTREXATO [10 MG/ML; 5 ML; F/AMP] M971 METOTREXATO [10 MG/ML; 50 ML; F/AMP] METOTREXATO [10 MG/ML; 0,75 ML; SERINGA] M972 M973 M975 METOTREXATO [100 MG/ML; 5 ML; F/AMP] METOTREXATO [20 MG/ML; 1,25 ML; SERINGA] M976 METOTREXATO [20 MG/ML; 1 ML; SERINGA] FORNECEDOR Baxter-Médico Farmacêutica Lda - 110 Laboratório Medinfar-Produtos Farmacêuticos SA - 93 Laboratório Medinfar-Produtos Farmacêuticos SA - 93 Laboratório Medinfar-Produtos Farmacêuticos SA - 93 Laboratório Medinfar-Produtos Farmacêuticos SA - 93 N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 2003006/110/0180 1,0919 1,0919 2008014/93/1358 14,5500 14,5500 2008014/93/1360 18,5800 18,5800 2008014/93/1359 16,3000 16,3000 2008014/93/1361 20,2800 20,2800 M977 CÓDIGO M978 METOTREXATO [20 MG/ML; 1,5 ML; SERINGA] DESCRIÇÃO M981 METOTREXATO [25 MG/ML; 4 ML; F/AMP] METOTREXATO [50 MG/ML; 0,15 ML; SERINGA] M982 METOTREXATO [50 MG/ML; 0,2 ML; SERINGA] M983 M986 METOTREXATO [50 MG/ML; 0,3 ML; SERINGA] METOTREXATO [50 MG/ML; 0,4 ML; SERINGA]] METOTREXATO [50 MG/ML; 0,5 ML; SERINGA]] METOXSALENO [20 µG/ML;SOL MODIFICAÇÃO FRAC SANG] M988 MILTEFOSINA [50 MG;CÁP/COMP] M990 MITOXANTRONA [2 MG/ML; 12,5 ML; F/AMP] M991 MITOXANTRONA [2 MG/ML; 15 ML; F/AMP] M992 MITOXANTRONA [2 MG/ML; 5 ML; F/AMP] M993 MUROMONAB-CD3 [5 MG/5 ML; F/AMP] MICOFENOLATO DE MOFETIL [500 MG; CÁP/COMP] M984 M985 M999 N123 NILOTINIB [200 MG; CÁP/COMP] N124 NATALIZUMAB [20 MG/ML; 15 ML; F/AMP] NITRATO DE CÉRIO + SULFADIAZINA PRATA [10 MG/G + 22 MG/G;CR] N127 FORNECEDOR Novartis Farma-Produtos Farmacêuticos S A - 128 N.º CPA PREÇO UNITÁRIO INFERIOR A 2008006/128/0029 32,2500 NOVOS FORNECEDORES PREÇO INFERIOR A 32,2500 N56 CÓDIGO NILUTAMIDA [100MG; CÁP/COMP] DESCRIÇÃO O34 OXALIPLATINA [100 MG; F/AMP] O34 OXALIPLATINA [100 MG; F/AMP] O34 OXALIPLATINA [100 MG; F/AMP] O911 OXALIPLATINA [50 MG; F/AMP] O911 OXALIPLATINA [50 MG; F/AMP] O911 OXALIPLATINA [50 MG; F/AMP] O911 OXALIPLATINA [50 MG; F/AMP] O911 OXALIPLATINA [50 MG; F/AMP] O911 OXALIPLATINA [50 MG; F/AMP] O911 OXALIPLATINA [50 MG; F/AMP] O911 OXALIPLATINA [50 MG; F/AMP] Sanofi - Aventis - Produtos Farmacêuticos Lda - 12 FORNECEDOR 2001006/12/0123 N.º CPA 3,0566 PREÇO UNITÁRIO INFERIOR A MEDAC - 473 Sandoz Farmaceutica, Lda 326 Sanofi - Aventis - Produtos Farmacêuticos Lda - 12 Fresenius Kabi Pharma Portugal Lda - 51 2010018/473/1149 20,0000 MEDAC - 473 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 2010018/473/1148 10,0000 2010018/326/1569 25,0000 2010018/12/1646 450,0000 2010018/51/1517 10,0000 NOVOS FORNECEDORES PREÇO INFERIOR A 20,0000 2010018/334/1258 10,0000 Hospira Portugal Lda - 155 2010018/155/1108 15,0000 Sandoz Farmaceutica, Lda 326 2010018/326/1570 22,0000 Overpharma, Produtos Médicos e Farmacêuticos Lda. 247 2010018/247/0865 28,0000 Hikma Farmacêutica Lda - 62 Sanofi - Aventis - Produtos Farmacêuticos Lda - 12 3,0566 2010018/62/0622 67,0000 2010018/12/1645 225,0000 10,0000 CÓDIGO DESCRIÇÃO P1 PACLITAXEL [100MG/17ML; F/AMP] P1 PACLITAXEL [100MG/17ML; F/AMP] P1 PACLITAXEL [100MG/17ML; F/AMP] P1 PACLITAXEL [100MG/17ML; F/AMP] P1 PACLITAXEL [100MG/17ML; F/AMP] P1 PACLITAXEL [100MG/17ML; F/AMP] P1046 PAZOPANIB [200 MG; CÁP/COMP] P1047 PAZOPANIB [400 MG; CÁP/COMP] P2 PACLITAXEL [30MG/5ML; F/AMP] P2 PACLITAXEL [30MG/5ML; F/AMP] P2 PACLITAXEL [30MG/5ML; F/AMP] P2 PACLITAXEL [30MG/5ML; F/AMP] P2 PACLITAXEL [30MG/5ML; F/AMP] FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A Actavis AS Sucursal - 455 Fresenius Kabi Pharma Portugal Lda - 51 2010018/455/0738 21,0000 Hospira Portugal Lda - 155 Sandoz Farmaceutica, Lda 326 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 Overpharma, Produtos Médicos e Farmacêuticos Lda. 247 2010018/155/1109 21,0000 Actavis AS Sucursal - 455 Fresenius Kabi Pharma Portugal Lda - 51 2010018/455/0743 7,7000 2010018/51/1518 NOVOS FORNECEDORES PREÇO INFERIOR A 21,0000 2010018/326/1571 21,0000 21,0000 2010018/334/1260 21,0000 2010018/247/0866 40,0000 2010018/51/1520 7,7000 Hospira Portugal Lda - 155 2010018/155/1111 7,7000 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 2010018/334/1259 7,7000 Overpharma, Produtos Médicos e Farmacêuticos Lda. - 2010018/247/0867 17,8000 7,7000 247 CÓDIGO DESCRIÇÃO P286 PROCARBAZINA [50MG; CÁP] P465 PALIVIZUMAB [100 MG/ML; 1 ML; F/AMP] PEGINTERFERÃO ALFA 2A [0,135 MG;SERINGA/FRS] PEGINTERFERÃO ALFA 2A[0,18 MG;SERINGA/FRS] PEGINTERFERÃO ALFA 2 B[0,05 MG;FRS/CANETA] PEGINTERFERÃO ALFA 2 B[0,08 MG;FRS/CANETA] PEGINTERFERÃO ALFA 2 B[0,1 MG;;FRS/CANETA] PEGINTERFERÃO ALFA 2 B[0,12 MG;FRS/CANETA] PEGINTERFERÃO ALFA 2 B[0,15 MG;FRS/CANETA] P517 P518 P519 P520 P521 P522 P523 FORNECEDOR Abbott Laboratórios Lda - 1 Roche-Farmacêutica Química Lda - 150 Roche-Farmacêutica Química Lda - 150 Schering-Plough Farma Lda 163 Schering-Plough Farma Lda 163 Schering-Plough Farma Lda 163 Schering-Plough Farma Lda 163 Schering-Plough Farma Lda 163 N.º CPA 2008014/1/1466 PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 938,9300 938,9300 2008014/150/1151 135,3500 135,3500 2008014/150/1152 168,5100 168,5100 2008014/163/1486 64,6400 64,6400 2008014/163/1487 99,9400 99,9400 2008014/163/1488 125,3500 125,3500 2008014/163/1489 150,3600 150,3600 2008014/163/1490 200,8600 200,8600 CÓDIGO DESCRIÇÃO P524 PACLITAXEL [6 MG/ML;50 ML;F/AMP] P524 PACLITAXEL [6 MG/ML;50 ML;F/AMP] P524 PACLITAXEL [6 MG/ML;50 ML;F/AMP] P524 PACLITAXEL [6 MG/ML;50 ML;F/AMP] P524 PACLITAXEL [6 MG/ML;50 ML;F/AMP] P524 PACLITAXEL [6 MG/ML;50 ML;F/AMP] P533 PEMETREXEDO (Sol.InJ) [500 MG; FRS/AMP] P748 PANITUMUMAB [20 MG/ML; 10 ML; F/AMP] P832 PACLITAXEL [5 MG/ML;PÓ SUSP INJ] P837 PLERIXAFOR [20 MG/ML; 1,2 ML; F/AMP] P838 PORFÍMERO SÓDICO [15 MG;PÓ SOL INJ] P839 PORFÍMERO SÓDICO [75 MG;PÓ SOL INJ] S269 SIROLÍMUS [1 MG; CÁP/COMP] S269 SIROLÍMUS [1 MG; CÁP/COMP] FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A Actavis AS Sucursal - 455 Fresenius Kabi Pharma Portugal Lda - 51 2010018/455/0747 57,0000 Hospira Portugal Lda - 155 Sandoz Farmaceutica, Lda 326 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 Overpharma, Produtos Médicos e Farmacêuticos Lda. 247 Lilly Portugal - Produtos Farmacêuticos, Lda. - 112 Amgen Biofarmacêutica, Ldª. 103 2010018/155/1112 57,0000 Laboratórios Pfizer Lda - 96 Wyeth Lederle Portugal (Farma) Lda - 182 2008014/182/0027 3,5333 2010018/51/1521 NOVOS FORNECEDORES PREÇO INFERIOR A 57,0000 2010018/326/1572 57,0000 57,0000 2010018/334/1261 57,0000 2010018/247/0868 85,0000 2010018/112/0758 977,3000 977,3000 2008006/103/0082 867,9000 867,9000 3,5333 2008014/182/0027 3,5333 CÓDIGO DESCRIÇÃO S270 SIROLÍMUS [2 MG; CÁP/COMP] S270 SIROLÍMUS [2 MG; CÁP/COMP] S427 SIROLÍMUS [1 MG/ML;SOL ORAL] S428 SIROLÍMUS [5 MG; CÁP/COMP] T108 TIOTEPA [15MG; F/AMP] T1113 TRABECTEDINA [1 MG; F/AMP] T1115 TRIPTORRELINA [22.5 MG; F/AMP] T1118 TACROLÍMUS [0.2 MG;PÓ SUSP ORAL] T1121 TACROLÍMUS [1 MG;PÓ SUSP ORAL] T1124 TAMOXIFENO [30 MG; CÁP/COMP] T1125 TAMOXIFENO [40 MG; CÁP/COMP] T1126 TASONERMINA [1 MG; F/AMP] T1127 TEMOPORFINA [1 MG/ML; 1 ML; F/AMP] T1128 TEMOPORFINA [4 MG/ML; 3,5 ML; F/AMP] T1129 TEMOPORFINA [4 MG/ML; 5 ML; F/AMP] T1131 TIOTEPA [10 MG; F/AMP] T1137 TOPOTECANO [1 MG; F/AMP] T1138 TRABECTEDINA [0.25 MG; F/AMP] T1141 TRIPTORRELINA [0.1 MG/1 ML;SOL INJ] T136 TOREMIFENO [60 MG; CÁP/COMP] FORNECEDOR Laboratórios Pfizer Lda - 96 Wyeth Lederle Portugal (Farma) Lda - 182 N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 2008014/182/0028 7,0673 7,0673 2008014/182/0028 7,0673 T153 CÓDIGO TRETINOINA [10 MG; CÁP/COMP] DESCRIÇÃO T304 TEMOZOLOMIDA [100 MG;CAP/COMP] T304 TEMOZOLOMIDA [100 MG;CAP/COMP] T304 TEMOZOLOMIDA [100 MG;CAP/COMP] T304 TEMOZOLOMIDA [100 MG;CAP/COMP] T305 TEMOZOLOMIDA[20 MG; CAP/COMP] T305 TEMOZOLOMIDA[20 MG; CAP/COMP] T305 TEMOZOLOMIDA[20 MG; CAP/COMP] T305 TEMOZOLOMIDA[20 MG; CAP/COMP] T305 TEMOZOLOMIDA[20 MG; CAP/COMP] FORNECEDOR MEDAC - 473 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A 2010018/473/1154 60,0000 2010018/334/1284 60,0000 60,0000 Hospira Portugal Lda - 155 2010018/155/1114 106,5000 Schering-Plough Farma Lda 163 2010018/163/0210 109,2000 Ciclum Farma Unipessoal, Lda 248 2010018/248/1474 6,0000 MEDAC - 473 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 2010018/473/1153 15,0000 Hospira Portugal Lda - 155 Schering-Plough Farma Lda 163 2010018/155/1115 21,5000 2010018/334/1283 15,0000 2010018/163/0222 22,2600 6,0000 CÓDIGO DESCRIÇÃO T306 TEMOZOLOMIDA [250 MG; CAP/COMP] T306 TEMOZOLOMIDA [250 MG; CAP/COMP] T306 TEMOZOLOMIDA [250 MG; CAP/COMP] T306 TEMOZOLOMIDA [250 MG; CAP/COMP] T306 TEMOZOLOMIDA [250 MG; CAP/COMP] T307 TEMOZOLOMIDA [5 MG; CAP/COMP] T307 TEMOZOLOMIDA [5 MG; CAP/COMP] T307 TEMOZOLOMIDA [5 MG; CAP/COMP] T307 TEMOZOLOMIDA [5 MG; CAP/COMP] T307 TEMOZOLOMIDA [5 MG; CAP/COMP] T5 TALIDOMIDA [50 MG; CÁP/COMP] T98 TIOGUANINA [40MG; COMP] U21 USTECINUMAB [90 MG;SOL INJ] V115 VINORRELBINA [10 MG/ML; 4 ML; F/AMP] V80 VERTEPORFINA [15 MG; F/AMP] FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A NOVOS FORNECEDORES PREÇO INFERIOR A Ciclum Farma Unipessoal, Lda 248 2010018/248/1472 48,0000 MEDAC - 473 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 2010018/473/1155 120,0000 2010018/334/1286 120,0000 48,0000 Hospira Portugal Lda - 155 2010018/155/1116 262,5000 Schering-Plough Farma Lda 163 2010018/163/0211 267,7500 Ciclum Farma Unipessoal, Lda 248 2010018/248/1473 4,0000 MEDAC - 473 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 2010018/473/1152 4,0000 Hospira Portugal Lda - 155 Schering-Plough Farma Lda 163 2010018/155/1117 5,4000 Novartis Farma-Produtos 2008014/128/0879 2010018/334/1282 4,0000 2010018/163/0223 5,6700 4,0000 Farmacêuticos S A - 128 CÓDIGO DESCRIÇÃO FORNECEDOR 1.140,7900 N.º CPA PREÇO UNITÁRIO INFERIOR A V87 VINCRISTINA [1MG/1ML; F/SERI] V88 VINCRISTINA [2MG/2ML; F/SERI] V89 VINDESINA [5MG; F/AMP] V90 VINORRELBINA [10MG/1ML; F/AMP] TEVA PHARMA - Produtos Farmacêuticos Lda - 334 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 Lilly Portugal - Produtos Farmacêuticos, Lda. - 112 Laboratórios AzevedosIndústria Farmacêutica SA - 79 V90 VINORRELBINA [10MG/1ML; F/AMP] Actavis AS Sucursal - 455 2010018/455/0754 14,0000 V90 VINORRELBINA [10MG/1ML; F/AMP] Hikma Farmacêutica Lda - 62 2010018/62/0629 1.140,7900 NOVOS FORNECEDORES PREÇO INFERIOR A 2008006/334/0159 3,4800 3,4800 2008006/334/0160 5,5900 5,5900 2001006/112/0022 135,9224 135,9224 2010018/79/0817 6,8600 14,0000 6,8600 V90 VINORRELBINA [10MG/1ML; F/AMP] V90 VINORRELBINA [10MG/1ML; F/AMP] V90 VINORRELBINA [10MG/1ML; F/AMP] V91 VINORRELBINA [20MG;CÁP] V92 VINORRELBINA [30MG; CÁP] V922 VINBLASTINA [1 MG/ 1 ML;SOL INJ] V924 VINBLASTINA [2 MG/2 ML;SOL INJ] V925 VINCRISTINA [1 MG/ML; 5 ML; SOL INJ] MEDAC - 473 Sandoz Farmaceutica, Lda 326 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 Pierre Fabre Médicament Portugal Lda - 138 Pierre Fabre Médicament Portugal Lda - 138 2010018/473/1150 14,0000 2010018/326/1407 14,0000 2010018/334/1293 17,0000 2008014/138/0021 61,7500 61,7500 2008014/138/0022 91,0000 91,0000 V926 CÓDIGO VINFLUNINA [25 MG/ML; 10 ML; F/AMP] DESCRIÇÃO FORNECEDOR N.º CPA PREÇO UNITÁRIO INFERIOR A V927 VINFLUNINA [25 MG/ML; 2 ML; F/AMP] V93 VINORRELBINA [50MG/5ML; F/AMP] Laboratórios AzevedosIndústria Farmacêutica SA - 79 2010018/79/0818 22,5600 V93 VINORRELBINA [50MG/5ML; F/AMP] Hikma Farmacêutica Lda - 62 2010018/62/0630 35,0000 V93 VINORRELBINA [50MG/5ML; F/AMP] Hospira Portugal Lda - 155 2010018/155/1118 35,0000 V93 VINORRELBINA [50MG/5ML; F/AMP] MEDAC - 473 2010018/473/1151 35,0000 V93 VINORRELBINA [50MG/5ML; F/AMP] 2010018/455/0755 48,0000 V93 VINORRELBINA [50MG/5ML; F/AMP] V93 VINORRELBINA [50MG/5ML; F/AMP] Actavis AS Sucursal - 455 Sandoz Farmaceutica, Lda 326 TEVA PHARMA - Produtos Farmacêuticos Lda - 334 2010018/326/1408 48,0000 2010018/334/1277 57,0000 NOVOS FORNECEDORES PREÇO INFERIOR A 22,5600 Anexo III Aspectos da execução do contrato não submetidos à concorrência: requisitos que devem ser observados nas propostas dos concorrentes. a) Que constam do formulário electrónico mencionado no artigo 9.º do Programa de Procedimento: 1. São seleccionados no Procedimento: a. Os medicamentos detentores de Autorização de Introdução no Mercado (“AIM”) emitida pela Autoridade Nacional do Medicamento e Produtos de Saúde, I.P. (“INFARMED”) ou pela Comissão Europeia; b. Os medicamentos com pedido de AIM já submetido ao INFARMED; c. Excepcionalmente, os medicamentos não detentores de qualquer das restantes autorizações previstas no Decreto-Lei n.º 176/2006, de 30 de Agosto, que possam vir a obter Autorização de Utilização Especial (“AUE"). 2. Para os medicamentos que à data da apresentação das propostas ainda não tenham obtido a concessão de AIM pelo INFARMED, IP, através de Procedimento Centralizado, Reconhecimento Mútuo ou de Procedimento Descentralizado, o Contrato Público de Aprovisionamento só será celebrado após a obtenção da AIM em Portugal e nos casos em que não ocorra a adjudicação de cinco AIM, conforme previsto no art.º 5 do Programa de Procedimento. 3. A aquisição por AUE tem carácter excepcional e carece de prévia autorização do INFARMED, ao abrigo do artigo 92.º do Estatuto do Medicamento, aprovado pelo Decreto-Lei n.º 176/2006, de 30 de Agosto, na sua redacção actual. 4. Sempre que possível, a embalagem primária deverá conter, por unidade, as seguintes menções, adaptadas à distribuição em dose unitária: a. Composição qualitativa e quantitativa em Denominação Comum Internacional ou, na sua falta, em nome corrente; b. Marca comercial; c. Prazo de validade; d. Número de lote de fabrico; e. Modo e via de administração; 5. No caso de o produto ser proposto em embalagem hospitalar é igualmente obrigatória a inclusão do folheto informativo na mesma, aquando do seu fornecimento às entidades adquirentes. b) Que não constam do formulário electrónico mencionado no artigo 9.º do Programa de Procedimento: 6. Os produtos devem ser embalados, rotulados e acompanhados de folheto informativo, escritos em língua portuguesa. 7. A indicação do número de lote e período de validade têm que constar nas embalagens primária e secundária. 8. Só poderão ser fornecidos às entidades adquirentes os bens cuja validade seja igual ou superior a 12 (doze) meses, a contar da data de fornecimento, a não ser que seja tecnicamente inviável. 9. As restantes condições de fornecimento previstas no Caderno de Encargos.
Download