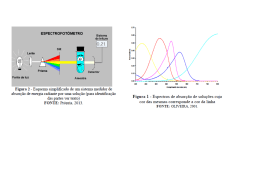
Construção de curva de calibração por padrão externo para determinação de teor de cobre em água potável da cidade Brejo do Cruz – Paraíba por Espectrofotometria de Absorção Molecular Construction of calibration curve by external standard for determination of copper in drinking water of the city of Brejo do Cruz - Paraiba by Molecular Absorption Spectrometry Construcción de la curva de calibración estándar externo para la determinación de cobre en el agua potable de la ciudad de Brejo do Cruz - Paraiba mediante espectrometría de absorción molecular Franklin Kaic Dutra PEREIRA1, Milena Tarciana FACCIO1, Jonh Anderson Macêdo SANTOS1, Cláudia Laís Araújo ALMEIDA1, Maria Lidiane Macêdo de ARAÚJO1, Cosme Silva SANTO1 Rayane de Oliveira SILVA1 Francisca Taíse da Siva ARAÚJO1 1 Curso de Licenciatura em Química, Universidade Federal de Campina Grande, CES, Cuité-PB. E-mail: [email protected]. RESUMO Espectrofotômetros são instrumentos capazes de registrar dados de absorbância ou transmitância em função do comprimento de onda. Este registro é chamado de espectro de absorção ou de espectro de transmissão, segundo o dado registrado for de absorbância ou transmitância, respectivamente. O espectro de absorção é característico para cada espécie química, sendo possível a identificação de uma espécie química por seu “espectro de absorção”. A característica mais importante dos espectrofotômetros é a seleção de radiações monocromáticas, o que possibilita inúmeras determinações quantitativas. O presente trabalho teve como objetivo preparar uma curva de calibração por padrão externo e determinar a concentração de cobre de uma amostra de água potável duma cidade do interior Paraibano, Brejo do Cruz. PALAVRAS CHAVES: Análise Espectrofotométrica, Absorbância e Transmitância, Análise Quantitativa da [Cu +2] em água de Brejo do Cruz. ABSTRACT Spectrophotometers are instruments capable of recording data in absorbance or transmittance as a function of wavelength. This record is called an absorption spectrum or the transmission spectrum, the second data is recorded in absorbance or transmittance, respectively. The absorption spectrum is characteristic for each chemical species, making it possible to identify a chemical species by their "absorption spectrum". The most important feature of spectrophotometers is the selection of monochromatic radiation, which allows numerous quantitative determinations governed by Beer's Law. This study aimed to prepare a calibration curve by external standard to determine the concentration of copper in a sample of drinking water from a city in the interior of Paraíba, of Cross Heath, and ascertain whether it is within the standards of potability in accordance with Ordinance PEREIRA, F. K. P.; FACCIO, M. T.; SANTO, J. A. M; ALMEIDA, C. L. A.; ARAÚJO, M. L. M; SILVA, R. O; ARAUJO, F. T. S. Construção de curva de calibração por padrão externo para determinação de teor de cobre em água potável da cidade Brejo do Cruz – Paraíba por Espectrofotometria de Absorção Molecular. In: 5º Congresso Norte-Nordeste de Química. Natal – RN – UFRN. KEYWORDS: Spectrophotometric Analysis, absorbance and transmittance, Quantitative Analysis of [Cu +2] in water of Brejo do Cruz. Todas as substâncias podem absorver energia radiante, 1 INTRODUÇÃO mesmo o vidro que parece completamente transparente absorve Análises químicas são realizadas cotidianamente para determinação de uma grande variedade de substâncias. Análises clínicas, nutricionais e controle de qualidade são apenas algumas das aplicações da química analítica no nosso dia-a-dia. Em algumas situações, como por exemplo, nas análises preliminares de doping realizadas em atletas, o analista deseja apenas detectar a presença de uma determinada substância. Nesses casos, a determinação é denominada qualitativa. Por outro lado, quando é necessário estabelecer a quantidade exata da substância a ser analisada executa-se uma análise quantitativa. Alguns dos experimentos comumente propostos baseiam-se na capacidade que algumas substâncias apresentam comprimentos de ondas que pertencem ao espectro visível. A água absorve fortemente na região do infravermelho. A absorção das radiações ultravioleta, visíveis e infravermelhas dependem das estruturas das moléculas, e é característica para cada substância química. Quando a luz atravessa uma substância, parte da energia é absorvida (absorbância): a energia radiante não pode produzir nenhum efeito sem ser absorvida. A cor das substâncias se deve a absorção (transmitância) de certos comprimentos de ondas da luz branca que incide sobre elas, deixando transmitir aos nossos olhos apenas aqueles comprimentos de ondas não absorvidos (Harris, 2005). 2.1 Energia radiante para formar compostos coloridos. Segundo VOGEL (1981), o As formas de energia radiante a que estamos ácido ascórbico (vitamina C), reage com hexacianoferrato de habituados é a “luz visível”, produzida pelo sol, ou pelo potássio (K3[Fe(CN)6]) na presença de Fe(III) para formar um aquecimento do filamento de tungstênio de uma lâmpada composto colorido, denominado azul da Prússia. A intensidade da incandescente comum. Ela é designada luz visível, porque coloração azul da solução depende da concentração de ácido impressiona a retina do olho humano. Sabe-se, contudo, que ascórbico presente na amostra. Dessa forma, a medida da outros animais como as abelhas, por exemplo, percebem outras intensidade da coloração possibilita a análise quantitativa desse radiações além daquela. Outras modalidades de energia radiante, composto em uma determinada amostra. Esse procedimento foi contudo, fazem parte do nosso cotidiano: os raios X empregados adaptado por Nóbrega e Lopes em um sistema de injeção em fluxo na medicina, as microondas dos fornos domésticos, as ondas de com detecção espectrofotométrica (KAMOGAWA, 2008). rádio, os raios infravermelhos, radiações eletromagnéticas, entre outros (Friori, 2013). 2 FUNDAMENTAÇÃO TEÓRICA Na Tabela 1 são apresentados os intervalos de comprimento de onda que caracterizam os diferentes tipos de A espectrofotometria é o método de análises óptico mais radiações eletromagnéticas. Observa-se ainda que, mesmo o que O se denomina “luz visível”, pode ser decomposta em uma série de espectrofotômetro é um instrumento que permite comparar a radiações, correspondentes a intervalos de comprimento de onda, radiação absorvida ou transmitida por uma solução que contém diferenciadas pela coloração que exibem. Essas cores podem ser uma quantidade desconhecida de soluto, e uma quantidade percebidas ao se decompor a luz solar por meio de um prisma. usado nas investigações biológicas e fisico-químicas. conhecida da mesma substância. Tabela 1 - Intervalo de comprimento de onda correspondente às várias radiações Radiação Luz Raios X Intervalo de comprimento de onda 10-3 - 10 nm Transiçòes atômicas ou moleculares envolvidas Elétrons das camadas K e L Ultravioleta 10-400 nm Elétrons de camadas intermediárias e de valência violeta azul verde 400-465 nm 465-493 nm 493-559 nm Elétrons de PEREIRA, F. K. P.; FACCIO, M. T.; SANTO, J. A. M; ALMEIDA, C. L. A.; ARAÚJO, M. L. M; SILVA, R. O; ARAUJO, F. T. S. Construção de curva de calibração por padrão externo para determinação de teor de cobre em água potável da cidade Brejo do Cruz – Paraíba por Espectrofotometria de Absorção Molecular. In: 5º Congresso Norte-Nordeste de Química. Natal – RN – UFRN. 559-580 nm amarelo 580-617 nm laranja 617-750 nm vermelho 750 nm-1mm Infravermelho 1 mm - 1 m Microondas 1m-1000 m Ondas de rádio FONTE: HARRIS, 2005. Valência Visível vibrações moleculares rotações moleculares --------- não apresentam níveis de energia rotacional ou vibracional e só A interação da matéria com radiações de comprimento de onda entre 450 e 750 nm, denominada luz podem absorver energia para alterar seu nível de energia eletrônica (HANKEN, 1995). visível, se manifesta através das cores das substâncias (Harris, 0.70 2005). Por que motivo então, uma solução de sulfato de cobre 0.60 tem cor azul esverdeada, enquanto que uma solução de 0.50 Quando a luz solar, ou a de uma lâmpada, incide sobre a solução de sulfato de cobre, radiações de todas as cores penetram no seu interior, mas, praticamente, apenas as radiações de comprimento de onda acima de 600 nm são absorvidas Absorbância permanganato de potássio é vermelho púrpura? 0.40 0.30 0.20 0.10 (Siebald, 2005). As radiações que não são absorvidas, correspondentes basicamente às cores: violeta, azul, verde e 0.00 400 450 500 solução que é percebida pelos nossos olhos. A cor que uma substância exibe corresponde, portanto, à fração da luz visível que ela não absorve. A absorção de radiações ultravioletas 550 600 650 700 750 Figura 1 - Espectros de absorção de soluções cuja cor das mesmas corresponde a cor da linha FONTE: OLIVEIRA, 2001. abaixo de 400 nm não é detectada pelo olho humano, e 2.3.1 Uso analítico da absorção ou emissão de percebemos as radiações infravermelhas como calor (Vogel, energia radiante 1981). 800 Comprimento de onda (nm) amarelo, constitui somada, a coloração azul esverdeada da Os itens discutidos anteriormente servem de base para compreender os fundamentos de métodos analíticos muito 2.3 Espectros importantes: a espectrofotometria, fotometria de chama de Submetendo uma molécula, ou átomo, a radiações eletromagnéticas, cujos comprimentos de onda variam continuamente, e registrando a fração de energia absorvida, emissão e espectrometria de absorção atômica. Para isso, temos que relacionar a absorção de energia radiante com concentração da espécie responsável por esse processo. obtém-se um espectro de absorção. Podem ser obtidos também espectros de emissão, quando se registra a emissão de energia radiante em função do comprimento de onda (Haken, 1995). Na Figura 6, são mostrados dois espectros de absorção na região visível; um para uma solução azul de sulfato de cobre e outro para a solução vermelha do indicador vermelho de metila. Pode-se observar que a solução azul absorve comprimentos de onda correspondentes à cor vermelha, de modo que as cores não absorvidas combinadas, azul, violeta, verde, amarelo e alaranjado resultam na cor azul da solução. Os espectros moleculares se apresentam tipicamente como os exibidos na Figura 1, ou seja, como bandas contínuas. Espectros atômicos são muito mais simples que espectros 2.4 Espectrofotometria na região do visível Voltando ao nosso exemplo da solução de sulfato de cobre, é intuitivo que, quanto mais azul ela for, maior será sua concentração nesse sal. Imagine-se agora, que uma espécie química cuja concentração queremos determinar é colorida, ou pode produzir um composto colorido por uma reação química. Se tivermos um meio de expressar numericamente a intensidade da coloração, estamos a um passo de determinar sua concentração. Isso poderá ser obtido medindo-se a absorção de energia por essa espécie, pois já sabemos que se ela é colorida ela está absorvendo alguma fração da luz visível. moleculares, exibindo em geral algumas linhas, pois os átomos PEREIRA, F. K. P.; FACCIO, M. T.; SANTO, J. A. M; ALMEIDA, C. L. A.; ARAÚJO, M. L. M; SILVA, R. O; ARAUJO, F. T. S. Construção de curva de calibração por padrão externo para determinação de teor de cobre em água potável da cidade Brejo do Cruz – Paraíba por Espectrofotometria de Absorção Molecular. In: 5º Congresso Norte-Nordeste de Química. Natal – RN – UFRN. 2.4.1 Medida da absorção de energia 3. METODOLOGIA Se quisermos quantificar a absorção de energia Para a elaboração da curva de calibração, foi-se radiante, temos primeiramente que dispor de uma fonte de utilizado uma solução padrão de Sulfato de Cobre a 0,1 mol.L-1 radiação (A). Trabalhando na região visível do espectro, com para calibrar o equipamento. O padrão (CuSO4) foi preparado em espécies que produzem soluções coloridas, uma lâmpada balão volumétrico de 100,0 mL. Inicialmente, as amostras foram incandescente de filamento de tungstênio serve perfeitamente aos diluídas para que as concentrações dos analitos de interesse nossos propósitos, pois emite radiações de comprimento de onda estivessem dentro da faixa de linearidade da curva de calibração entre 400 e 750 nm. De todas essas radiações (comprimentos de como mostra a Tabela 2. onda) temos de selecionar aquele que é absorvido preferencialmente pela espécie química de interesse, o que se Tabela 2 - Valor das concentrações de CuSO4 após diluição da solução 0,1M consegue por meio de um sistema monocromador (B). Solução [CuSO4]diluído Direcionado, por exemplo, um feixe luminoso sobre a face de um 1 0,2 mol.L-1 prisma, promovendo a decomposição da luz, podemos coletar 2 0,4 mol.L-1 radiações de comprimento de onda definidas, através de 3 0,6 mol.L-1 mecanismos de lentes e espelhos. Essa seleção de comprimento 4 0,8 mol.L-1 de onda pode ser feita com redes de difração ou com um filtro que nada mais é do que um pedaço de vidro colorido. É claro que Fonte: Própria da Pesquisa, 2013 Para esta análise instrumental empregaram-se os filtros são sistemas selecionadores de comprimento de onda Espectrofotômetro SP-220 (Biospectro), cubeta de quartzo de 10 bem menos eficiente que grades de difração, pois será mm de caminho óptico (Equilab), para validar o método selecionado um intervalo relativamente largo de comprimentos proposto. Em todos os parâmetros foram utilizadas balanças e de onda. A radiação selecionada é então direcionada de modo a vidrarias analíticas. atravessar a solução contida em um tubo de vidro transparente, a Realizado as diluições e calibração do equipamento cubeta (C). A potência do feixe de radiação incidente é diminuída descrito metodologia acima, foram realizadas as leituras em ao atravessar a solução contida na cubeta, devido ao processo de espectrofotômetro a 420 nm, utilizando-se todos os reagentes absorção. Um sistema detector (D), como uma válvula anteriores (padrão) como solução-branco para zerar o aparelho. fotomultiplicadora, é capaz de medir a potência da radiação, Todos os solventes e reagentes utilizados são de grau analítico ou indicando o resultado através de um sistema de leitura (E). Esses adequados são essencialmente os componentes de um espectrofotômetro disponíveis empregado para medidas de absorção na região visível do utilizadas neste estudo foram preparadas com água deionizada. aos métodos espectrofotométricos, comercialmente. Todas as desde soluções que aquosas espectro, esquematizado na Figura 2. Costuma-se designar como Na metodologia utilizada para elaboração da curva de colorímetros os equipamentos onde a seleção de comprimento de calibração e análise das amostras empregou-se uma razão molar onda é feita por meio de filtros (Kamogawa, 2008). de 0,1 mol.L-1 de CuSO4. A identificação e quantificação desconhecida da concentração do metal da alíquota da água foi realizado por comparação entre absorbância e concentração obtidos com padrões previamente injetados. 4. RESULTADOS E DISCUSSÕES Ao utilizar a técnica analítica instrumental, pôde-se obter alguns resultados, principalmente o que estava a procura. Tem-se então uma forma de expressar numericamente a relação da concentração de uma espécie colorida e absorção de luz. Na Tabela 2 são mostrados os valores de absorbância e de % Figura 2 - Esquema simplificado de um sistema medidor de absorção de energia radiante por uma solução (para identificação das partes ver texto) FONTE: Própria, 2013. transmitância para diferentes concentrações de cobre. As medidas foram efetuadas no comprimento de onda de 750 nm, pois é nessa PEREIRA, F. K. P.; FACCIO, M. T.; SANTO, J. A. M; ALMEIDA, C. L. A.; ARAÚJO, M. L. M; SILVA, R. O; ARAUJO, F. T. S. Construção de curva de calibração por padrão externo para determinação de teor de cobre em água potável da cidade Brejo do Cruz – Paraíba por Espectrofotometria de Absorção Molecular. In: 5º Congresso Norte-Nordeste de Química. Natal – RN – UFRN. região que ocorre a máxima absorção de radiação pela solução considerada. Tabela 3. Valores de Transmitância (%T) e da Absorbância de solução de cobre de diferentes concentrações, exceto da amostra de concentração desconhecida Solução Concentração molar de Cu 2+ % Transmitância Absorbância 1 0,000 -- 0,000 2 0,200 93,7 0,214 3 0,400 90,7 0,319 4 0,600 89,0 0,430 5 0,800 86,4 0,266 6 X ? ? FONTE: Própria da Pesquisa, 2013. Analisando num espectrofotômetro a amostra de concentração desconhecida, encontra-se um valor quantitativo para a absorbância e a % Transmitância, no qual está representado na Tabela 3, a concentração, a qual se busca nesta trabalho, será encontrada de acordo com uma Regressão Linear. Tabela 4. Valores de Transmitância (%T) e da Absorbância de solução de cobre de diferentes concentrações. Solução Concentração molar de Cu2+ % Transmitância Absorbância 1 0,000 -- 0,000 2 0,200 93,7 0,214 3 0,400 90,7 0,319 4 0,600 89,0 0,430 5 0,800 86,4 0,566 6 X 79,7 0,640 FONTE: Própria da Pesquisa, 2013. Qual seria o valor da concentração da solução 6? Examinando-se os valores de absorbância, é fácil perceber que 2+, deve estar entre 0,400 0,300 M Cu , mas qual o valor exato? Através interpolação matemática, usando os dados de absorbância, pode-se deduzir que é 0,223 M. Desse exemplo pode-se inferir que, dispôs-se de alguns dados que relacionem concentrações conhecidas e suas respectivas medições de absorção de luz, pode-se determinar permite calcular concentrações graficamente, conforme indicado na Figura 3 (Alcantara, 2012). Com os valores encontrados da absorbância e da % transmitância, descritos na Tabela 3, pode-se calcular a Média, e o Desvio-padrão das soluções conhecidas e da solução desconhecida, que consta na tabela 4, para ajudar a encontrar a concentração do Cu+2 da alíquota. concentrações desconhecidas, se medirmos a absorção de luz dessa solução problema. Em segundo lugar, a absorbância é o parâmetro mais indicado para essa finalidade, porque apresenta uma relação linear com a concentração, e não logarítmica como ocorre com a transmitância. O conjunto de soluções de números 1 a 6 constitui o que se denomina curva de calibração ou curva padrão, e é o nosso referencial indispensável para determinar a concentração de qualquer solução, desde que se conheça sua absorbância. Ela pode ser representada em um gráfico de coordenadas cartesianas Tabela 5. Valores de Transmitância (%T) e da Absorbância de solução de cobre de diferentes concentrações. Solução % Transmitância Absorbância -0,000 1 93,7 0,214 2 90,7 0,319 3 89,0 0,430 4 86,4 0,566 5 79,7 0,640 6 73,25 0,3655 Média 5,2957 0,2359 Desvio-Padrão FONTE: Própria da Pesquisa, 2013. como uma reta, o que já era indicado pela Lei de Beer, que PEREIRA, F. K. P.; FACCIO, M. T.; SANTO, J. A. M; ALMEIDA, C. L. A.; ARAÚJO, M. L. M; SILVA, R. O; ARAUJO, F. T. S. Construção de curva de calibração por padrão externo para determinação de teor de cobre em água potável da cidade Brejo do Cruz – Paraíba por Espectrofotometria de Absorção Molecular. In: 5º Congresso Norte-Nordeste de Química. Natal – RN – UFRN. Para calcular a concentração da alíquota desconhecida, utiliza-se de um cálculo, que vai de acordo com a Lei de Beer. a equação e o valor da absorbância descoberta na análise no espectrofotômetro: Neste cálculo, usa-se uma propriedade estatística que chama-se y = 0,575x + 0,175 regressão linear, que segundo Regazzi (2003), é um método para x= 0,331 mol. L-1 se estimar a condicional (valor esperado) de uma variável y, Por fim, após fazer todos os passos, encontrou-se o dados os valores de algumas outras variáveis x. A regressão, em valor quantitativo ao qual buscava-se, um valor exato, no qual geral, trata da questão de se estimar um valor condicional esperava-se, que é igual a 0,48 mol.L-1, já que a concentração é esperado. dada pela quantidade da matéria dividida pelo volume. Para o cálculo da concentração de Cu da amostra desconhecida, plotou-se um gráfico linear, como mostra a Figura 5 CONCLUSÃO 3 abaixo, pode-se observar que o prepara da diluição das soluções Com base nos resultados obtidos, pôde-se concluir que com concentrações conhecidas, estavam de acordo com os a curva de calibração está de forma linear com os pontos obtidos cálculos, concluindo que houve exatidão no procedimento, já que das concentrações das soluções analisadas, e que a margem de o desvio-padrão resultou em números esperados. O mais erro foi pequena considerando as concentrações, e o desvio- importante deste gráfico, é a equação, que ele nos fornece, pois é padrão, a partir desta equação de 2º grau que podemos calcular a apresentou-se num valor muito próximo de 1, aproximadamente concentração. O gráfico disponibiliza também o valor de R² que é 0,999. Contudo, é imprescindível ressaltar que para se obter uma o valor do coeficiente angular. curva de calibração perfeita, com menor margem de erro considerando também, que o coeficiente linear possível, deve-se estar atento a todos os procedimentos experimentas, tais como, a diluição das soluções, no qual acredita-se que se apresentar pontos desprezados, que estejam muito fora da reta, ocorre-se devido ao acréscimo, ou recuo de água destilada. Esse experimento pode ser adotado em cursos de análise instrumental e possibilita uma discussão mais ampla sobre espectrofotometria de absorção molecular, considerando-se a fonte de radiação e o tratamento de dados. 5 REFERÊNCIAS Gráfico 1 - Curva de calibração por padrão externo dos valores de absorbância versus concentração de Cu+2 das substâncias conhecidas FONTE: Própria da Pesquisa, 2013 Assim, com construção do gráfico, chegou a seguinte equação 2 e ao coeficiente angular (α), respectivamente: y = 0,575x + 0,175 (eq. 2), e α R² = 0,9886 sendo y a absorbância e x a concentração, e α o coeficiente angular, que quanto mais próximo a 1, as soluções estavam bem preparadas, assim para calcular a concentração da amostra usa-se [1] ALCANTARA, Petrus Jr. Espectroscopia Molecular. Disponível em www.universidadefederaldopara.com.br . Acesso em 29/10/2012. [2] BRASIL, Ministério da Saúde. Portaria n.º 2.914, de 12 de Dezembro de 2011. Dispõe sobre normas de potabilidade de água para o consumo humano. Brasília: SVS, 2011; [3] FIORIO, P. R.; MORAES, E. C.; INPE – Fundamento de Sensoriamento Remoto. Disponível no site: http://www.leb.esalq.usp.br/disciplinas/Topo/LEB58 38/Peterson/Fundamentos_energia_pos.pdf, Acessado dia: 22/01/2013. [4] HAKEN, H.; WOLF, H. C. Molecular Physics and Elements of Quantum Chemistry, Springer, Berlin, 1995. [5] HARRIS, C Daniel. Análise Química Quantitativa. Fundamentos da Espectrofotometria. 6ed. Rio de Jabeiro: LTC, 2005. P. 398-423. PEREIRA, F. K. P.; FACCIO, M. T.; SANTO, J. A. M; ALMEIDA, C. L. A.; ARAÚJO, M. L. M; SILVA, R. O; ARAUJO, F. T. S. Construção de curva de calibração por padrão externo para determinação de teor de cobre em água potável da cidade Brejo do Cruz – Paraíba por Espectrofotometria de Absorção Molecular. In: 5º Congresso Norte-Nordeste de Química. Natal – RN – UFRN. [6] KAMOGAWA, M. Y; GOMES, M. S.; TREVIZAN, L. C.; NÓBREGA, J. A. Uso de Scanner em Espectrofotometria de Absorção Molecular: Aplicação em Experimento Didático enfocando a Determinação de Ácido Ascórbico. Quim. Nova, Vol. 31, No. 6, 1577-1581, 2008. [7] OHLWEILER, O. A.; Fundamentos da Análise Instrumental. L. T. C., Rio de Janeiro, 2ª edição, 1972. [8] OLIVERIA, L. F. C. Espectroscopia Molecular. Cadernos Temáticos de Química Nova na Escola. Nº 4. Maio. 2001. [9] REGAZZI, A. J. Teste para Verficiar a Igualdade de Parâmetros e a Identidade de Modelos de Regressão Não-Linear. Revista CERES. Vol. L, Nº 287, p. 9-26, 2003. [10] SALDANHA, T. C. B.; ARAÚJO, M. C. U; NETO, B. B. Análise Multicomponente Simultânea por Espectrofotometria de Absorção Molecular UVVIS. QUÍMICA NOVA, 22(6). 1999. [11] SIEBALD, H. G. L.; PINTO, F. G.; ROCHA, S. S.; CANUTO, M. H.; SILVA, J. B. B. Determinação de Cobre e Zinco em Cachaça por Espectrometria de Absorção Atômica com Chama Usando Calibração por Ajuste de Matriz. Revista Analytica - Junho/Julho. Nº 17, 2005. [12] SKOOG, Douglas A; HOLLER, James F; NIEMAN, Timonthy. Princípios de analise instrumental. 5ed. Porto Alegre: Bookman, 2002. P. 115-137; 275-297. [13] Vogel, A.; Química Analítica Qualitativa, Editora Mestre Jou: São Paulo, 1981. PEREIRA, F. K. P.; FACCIO, M. T.; SANTO, J. A. M; ALMEIDA, C. L. A.; ARAÚJO, M. L. M; SILVA, R. O; ARAUJO, F. T. S. Construção de curva de calibração por padrão externo para determinação de teor de cobre em água potável da cidade Brejo do Cruz – Paraíba por Espectrofotometria de Absorção Molecular. In: 5º Congresso Norte-Nordeste de Química. Natal – RN – UFRN.
Download