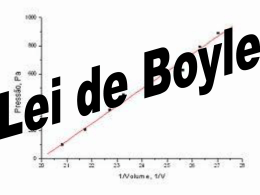
www.Web-Dive.com Química e Física do Mergulho - Parte II Este artigo é o segundo e último artigo de dois que dedicámos ao tema da Física e Química no mergulho.. Flutuabilidade A força responsável pela flutuabilidade dos objectos tem o nome de Impulsão. Impulsão pode ser descrita por uma força vertical com sentido de baixo para cima exercida em todos os objectos submersos total ou parcialmente num fluído. Arquimedes foi o primeiro a explicar este fenómeno. Princípio de Arquimedes Qualquer objecto total ou parcialmente imerso num fluido sofre uma força de impulsão de baixo para cima igual ao peso do fluido deslocado pelo objecto. Este princípio é válido para todos os objectos e todos os fluidos; no mergulho, o fluído é a água. Contudo a diferença de densidade da água pode ser relevante na flutuabilidade de do mergulhador. A densidade da água doce é de 1 (densidade da água pura) e em média a da água salgada é de 1,03, sendo esta a razão para que mergulhadores precisem de mais lastro em água salgada do que em água doce. A tendência de um corpo flutuar ou afundar na água é conhecido por gravidade específica. A gravidade específica da água pura é 1. Se a gravidade específica de um corpo for superior a 1, esse corpo tem flutuabilidade negativa, se for igual a 1 tem flutuabilidade neutra, e se for inferior a 1 terá flutuabilidade positiva. O conceito de flutuabilidade pode ser usado utilizado para resolver problemas práticos encontrados no mergulho. Se um mergulhador necessitar de recuperar um objecto do fundo do mar? Supondo que um objecto pesa 100 Kg fora de água e tem um volume de 20 l. Estando este objecto submerso em água do mar (densidade 1,03) Para que o objecto atinja flutuabilidade neutra, é necessário exercer uma força de 100 Kg – (20 l x 1,03) = 79,4 Kg. Para que o balão exerça uma força de 79,4 Kg é necessário que este esteja cheio com 79,4 Kg / 1,03 = 77,1 litros de ar para deslocar o mesmo volume de água. Pressão Pressão é o termo utilizado para descrever a força exercida sobre uma unidade de área. Matematicamente é expressa como P = F / A onde P é a pressão, F a força exercida e A a área onde a força foi exercida. Experiência de Torricelli Torricelli, um matemático Italiano, pensou que se a atmosfera envolvia tudo e se a humanidade vivia por baixo de todo um “Mar de Ar”, então que o corpo tinha de estar sob uma pressão constante. Para determinar o valor dessa pressão, ele realizou uma experiência baseada num tubo selado de mercúrio invertido demonstrou que uma atmosfera tinha pressão suficiente para prensar 760 milímetros de mercúrio. Esta experiência confirma que o ar tem peso e pressão. Mais tarde Pascal, demonstrou que a pressão exercida pela atmosfera ao nível do mar era equivalente a cerca de 10 metros de água do mar. Quando um corpo se encontra submerso, existem dois tipos de pressão a exercer força sobre ele, o peso da atmosfera sobre a água e o peso da coluna de água sobre o corpo. Pascal demonstrou que a pressão exercida pela atmosfera ao nível do mar é equivalente à pressão exercida por aproximadamente 10m de profundidade de água do mar. Como a pressão da água é o peso da água por unidade de volume, é fácil demonstrar isso. Um litro de água do mar pesa 1,03 Kg, num volume de 1000 cm3 (cubo de 10 cm x 10 cm x 10 cm). A base do cubo, onde a pressão é exercida é de 100 cm2 (10 cm x 10 cm). Logo a pressão exercida é de 1,03 Kg / 100 cm2 = 0,0103 Kg / cm2. Para converter esta pressão por um metro de coluna de água, multiplica-se por 10 (1m = 100cm; 100cm / 10 cm = 10) logo temos 0,103 Kg/cm2 de pressão por metro de profundidade. Como a atmosfera exerce 1,03 Kg / cm2, logo precisamos de 1,03 Kg/cm2 (1 atmosfera) / 0,103 Kg/cm2 (por metro) = 10 m de profundidade para atingirmos uma pressão igual à atmosférica. Pressão e Líquidos Todas as matérias são compressíveis sob uma determinada pressão. Com as pressões atingidas pelo mergulho recreativo, a água é considerada incompressível. Uma vez que o corpo humano é composto maioritariamente por água, o mergulhador apenas sente a pressão nos espaços aéreos do corpo. Durante a descida, a pressão da água aumenta a uma taxa de 1 bar por cada 10m de profundidade. Uma vez que a água é incompressível, esse valor mantém-se constante em todas as profundidades. Por exemplo para determinar a pressão a 30m de profundidade no mar: 30 m / 10 m = 3 bar; 3 bar (pressão água) + 1 bar (pressão atmosférica) = 4 bar. Gases Muitos elementos existem como gás na sua forma natural. Como os gases se misturam facilmente, na natureza, estes encontram-se misturados em vez de isolados. Na Terra, a mistura de gás mais comum é o ar, composto por nitrogénio, oxigénio, árgon, dióxido de carbono, néon, hélio, crípton, hidrogénio, xénon, rádon e monóxido de carbono entre outros. Contudo muitos destes existem em porção muito pequenas que normalmente são desprezados. Os gases que afectam o mergulho são o oxigénio, nitrogénio, dióxido de carbono, monóxido de carbono, hélio, hidrogénio, árgon e néon. Em condições normais, a composição do ar é uniforme e composto por: Tendo em conta estes valores, normalmente o ar é tratado como sendo composto por 79% de nitrogénio e 21% de oxigénio. Comportamento dos Gases A Lei Geral dos Gases é expressa matematicamente por PV = nRT onde P é a pressão absoluta; V é o volume; n é o número de moles; R é a constante universal dos gases (8,314 Joules/ºK); e T a temperatura absoluta. Desta simples lei, derivam a Lei de Boyle e a Lei de Charles, que serão explicadas seguidamente. Lei de Boyle A experiência de Boyle envolve um tudo de vidro em forma de U fechado numa extremidade e aberto na outra. Nesse tubo foi colocado mercúrio até atingir o mesmo nível em ambos os lados. A pressão na extremidade fechada é igual à pressão atmosférica exercida no lado aberto. Posteriormente foi adicionado mercúrio com o objectivo de reduzir o volume do lado fechado para metade, tendo sido necessário adicionar 76 cm de mercúrio. O que foi Boyle demonstrou com esta experiência, foi que se a temperatura se mantivesse constante, o volume de um gás é inversamente proporcional à pressão absoluta, ou seja, que se a pressão for aumentada o volume diminui proporcionalmente e vice-versa. A relação constante entre o volume e a pressão pode ser utilizada para determinar novos volumes a diferentes profundidades / pressões. Matematicamente a Lei de Boyle expressase por P x V = K; P1 x V1 = K = P2 x V2. Enquanto a pressão e o volume do gás são inversamente proporcionais, a pressão e a densidade de um gás são directamente proporcionais. A relação da densidade é similar ao que foi demonstrado com o volume. A 2 atmosferas, um determinado volume de ar tem o dobro da densidade do que à superfície. Sendo esta a razão pela qual o mergulhador usa o ar da garrafa mais rapidamente com a profundidade. A quantidade de moléculas de ar inspiradas a 2 atmosferas é o dobro das inspiradas à superfície. A Lei de Boyle tem inúmeras aplicações no mergulho. Durante todos os mergulhos, os mergulhadores lidam com espaços de ar como BCDs, garrafas, fatos secos, mascaras e espaços aéreos corporais. Até as pequenas bolhas que constituem os fatos de molhados são comprimidas e expandidas de acordo com esta lei. Lei de Charles A experiência de Boyle levou em conta o Volume e a Pressão, mas não explica o que acontece com uma terceira variável, a Temperatura. Através da experimentação, Charles, descobriu que a pressão de um gás se mantinha constante dentro de um recipiente e que o volume aumentava se a temperatura aumentasse. Matematicamente a Lei de Charles expressa-se como P x V = K x T, onde P é o pressão, V o volume, T é a temperatura e K uma constante. Tal como a Lei de Boyle pode ser modificada para alterações de P / V / T, ficando P1 x V1 / T1 = K = P2 x V2 / T2. Altitude e Mergulho Mergulhar em altitude requer considerações especiais. A pressão do ar em altitude é inferior do que ao nível do mar, uma vez que existe uma coluna de ar inferior sobre o nosso corpo. Este facto afecta a Lei Geral dos Gases e por consequência as tabelas de mergulho. Para calcular a pressão absoluta em metros do nível do mar, pode-se usar a seguinte formula P(msw) = 10 x 2,178^(-0,038 x A / 305) ou utilizando uma simplificação subtraindo 0,035 atmosferas por cada 300m de altitude. Lei de Dalton Dalton foi a primeira pessoa a estudar o comportamento individual de um gás presente numa mistura de gases como o ar. De uma forma sumária, a Lei de Dalton diz que “A pressão total exercida por uma mistura de gases é igual à soma da pressão de cada gás, que compõe a mistura, individualmente. Cada gás actua como se estivesse isolado a ocupar o volume total”. Por outras palavras, o que Dalton quis dizer é que cada gás numa mistura gasosa actua independentemente dos outros. A pressão individual exercida por um componente da mistura é proporcional ao número de moléculas do gás dentro da mistura. Essa pressão individual é referida com Pressão Parcial (pp). Matematicamente a Lei de Dalton expressa-se por Ptotal = ppA + ppB + ppC + ... e ppA = Ptotal x %Volume A. Se aplicarmos a Lei de Dalton à mistura do ar (1% CO2, Dióxido de Carbono; 79% N2, Nitrogénio e 20% O2, Oxigénio), a pressão parcial dp N2 a 40m de profundidade é: Ptotal = 5ata (40 / 10 = 4 + 1 = 5ata) ppN2 = 5 x 0,79 = 3,95 ata ppO2 = 5 x 0,20 = 1 ata Com estes valores em mente, facilmente percebemos que fisiologicamente respirar ar a 5 ata é equivalente a respirar O2 puro à superfície. Deve-se ter em conta esta relação principalmente quando estamos a falar de gases tóxicos, como por exemplo o CO. À superfície temos 0,5% de volume de CO no aro que é um valor desprezável quando respirável à superfície, onde temos uma pressão parcial de 0,005 ata (1 ata x 0,005 = 0,005 ata). Contudo a 40m de profundidade será mais preocupante, onde a pressão parcial é de 0,025 ata (5 ata x 0,005 = 0,025 ata), tendo o mesmo efeito fisiológico do que respirar uma mistura com 2,5% (5ata x 0,5% = 2,5%) de CO à superfície, atingindo já um nível tóxico. Ar enriquecido O ar enriquecido “Nitrox” usado pelos mergulhadores, não é mais do ar adicionado de oxigénio de forma a reduzir a proporção do nitrogénio. Existem tabelas específicas para o mergulho com ar enriquecido, contudo podemos aplicar a Lei de Dalton para encontrar uma profundidade de Ar equivalente (EAD – Equivalent Air Depth): EAD = ( (1 - %O2) x (Profundidade + 10) / 0,79 ) – 10 Esta fórmula dá-nos a profundidade equivalente onde a pressão parcial do Nitrogénio é igual se estivermos a respirar ar. A pressão limite do Oxigénio é de 1,4 ata, acima desta pressões passa a ser tóxico tornandose perigoso. Usando a fórmula indicada e este limite, podemos concluir facilmente que nos limites do mergulho recreativo o ar não é um gás tóxico. Podemos também com o auxílio de uma tabela de mergulho com ar, calcular os tempos e profundidades máximas para um mergulho com ar enriquecido. Lei de Henry Uma substância sólida pode ser dissolvida em moléculas de um líquido, como por exemplo açúcar (sólido) em café (líquido). O mesmo também é verdade para os gases. Uma bebida gaseificada é um bom exemplo disso. Quando este fenómeno acontece, diz-se que o gás está dissolvido num líquido ou numa solução. Um aspecto interessante dos gases em soluções é que as moléculas dos gases conservam as suas propriedades. Mesmo completamente envolvidas por moléculas de um líquido, as moléculas do gás continuam a exercer pressão no líquido. Esta pressão tem o nome de Tensão do Gás. O quanto um gás se dissolve num líquido, é dependente de vários factores. A Lei de Henry diz que “A quantidade de gás que se dissolve num líquido a uma determinada temperatura é directamente proporcional à pressão parcial do gás”. De acordo com a Lei de Dalton, que vimos anteriormente, cada gás dissolvido em um líquido, exerce uma pressão parcial da tensão total do gás independentemente dos outros gases presentes. Por exemplo, se uma quantidade de água estiver exposta a nitrogénio puro, este irá se dissolver na solução até que a sua tensão atinja o equilíbrio. Se a pressão total em contacto com a água for aumentada, com a adição de oxigénio puro, não haverá mais nitrogénio a ser absorvido, mantendo a sua pressão parcial igual. Contudo, mais oxigénio pode ser adicionado na água até atingir o equilíbrio. A diferença entre a pressão parcial dos gases em contacto com um líquido e a tensão do gás tem o nome de Gradiente de Pressão. Quando o gradiente de pressão é elevado, a taxa de absorção do gás no líquido também é grande. Quando a tensão de um gás num líquido atinge o equilíbrio com a pressão parcial de todos os gases em contacto com o líquido, nesse ponto diz-se que o líquido está saturado. Se colocarmos o líquido dentro de uma câmara de descompressão, fazendo com que a pressão aumente, a pressão dos gases em contacto com o líquido também irá aumentar. A Lei de Henry explica que nestas condições mais gás irá ser dissolvido no líquido até atingir de novo o equilíbrio. Se a pressão da câmara diminuir, o fenómeno reverte-se. Menos pressão em contacto com a água, significa que o gás dissolvido terá uma tensão superior, obrigando a que o fás flua para fora da água. A água diz-se super saturada, ou que contém mais gás do que pode conter aquela pressão. Se a redução for feita de forma gradual, o gradiente de pressão mão será muito elevado e o gás é libertado da água sem formar bolhas. Caso contrário, se originar um gradiente elevado, o gás formará bolhas (como uma garrafa de uma bebida gaseificada agitada antes de abrir). A Lei de Henry é o princípio que descreve a absorção e libertação de nitrogénio no corpo do mergulhador. À semelhança da pressão, a temperatura também afecta o gás dissolvido num líquido. Contudo no mergulho, a uma escala muito menor do que a pressão, uma vez que a temperatura do corpo se mantém dentro de limites quase constantes. Com o calor, o movimento das moléculas aumenta, necessitando de mais espaço, logo quanto maior a temperatura, mais gás existirá dissolvido no líquido. Este fenómeno pode ser visto em água a ferver, quando bolhas de ar se começam a formar no fundo do recipiente. Bibliografia: Padi Encyclopedia Of Recreational Diving
Download