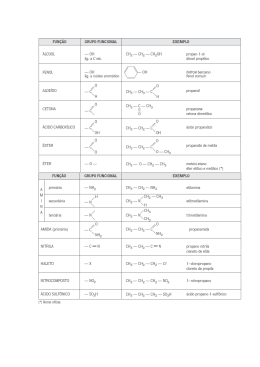
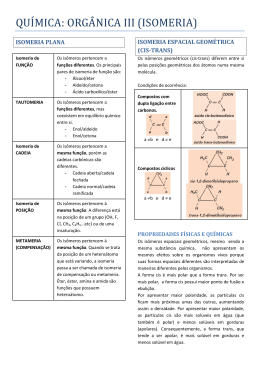
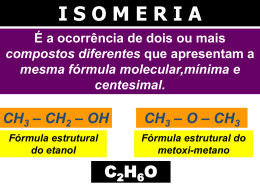
Avaliação: TRABALHO ON LINE 3º Bimestre DISCIPLINA: QUÍMICA 2 PROFESSOR(A): SANDRA DUARTE Curso: 2º EM TURMA: DATA: / / Teste: Prova: Trabalho: Formativo: Média: NOME: Nº.: 1) O 3-cloro-propan-1,2-odiol existe na forma de dois compostos. Um deles é tóxico e o outro tem atividade anticoncepcional. As moléculas de um desses compostos: a) têm um grupo hidroxila e as do outro têm dois grupos hidroxila. b) têm um átomo de carbono assimétrico e as do outro têm dois átomos de carbono assimétricos. c) têm três átomos de cloro ligados ao mesmo átomos de carbono e as do outro têm três átomos de cloro ligados a átomos de carbono diferentes. d) não apresenta isômeros ópticos e) têm a estrutura cis e as do outro têm a estrutura trans 2) Em 1848, Louis Pasteur estudou os sais de potássio e amônio obtidos do ácido racêmico,o qual se depositava nos tonéis de vinho durante a sua fermentação. Após observar que esse ácido era uma mistura de dois outros com a mesma fórmula molecular do ácido tartárico; que, separados, desviavam a luz plano polarizada e juntos, em quantidade iguais, perdiam essa propriedade, nasceu o conceito de mistura racêmica. De acordo com o exposto, assinale a opção correta, com relação aos conceitos de isomeria espacial. a) Uma mistura racêmica é uma mistura equimolecular de dois compostos enantiomorfos entre si. b) O 1-butanol por ser um álcool opticamente ativo pode originar uma mistura racêmica. c) O 2-buteno apresenta dois isômeros ópticos, cis-2-buteno e o trans-2-buteno. d) O 2-butanol apresenta três isômeros ópticos ativos denominados dextrógiro, levógiro e racêmico. e) Quando um composto desvia a luz plano-polarizada para a direita é chamado de levógiro. 3) Isomeria ótica é um caso particular de isomeria espacial em que os isômeros diferem pelo comportamento frente à luz polarizada. Na molécula abaixo: 1 2 3 4 5 CH3 —CH2—CH—CH—CH3 │ │ CH3 CH3 7 6 O átomo de carbono que confere propriedades óticas ao composto é o carbono de número: a) 2 b) 4 c) 3 d) 7 e) 5 4) Sobre o composto: 3-penten-2-ol é correto afirmar : a) não apresenta carbono quiral b) faz isomeria geométrica; c) não possui IOI d) possui 3 isômeros ópticos e) apresenta 2 carbonos assimétricos 5) Qual é o número de carbonos assimétricos da substância : HOCH2—CHOH—CHOH—CHOH—COH a) 1 b) 2 c) 3 d) 4 e) Todos são assimétricos. 6) Quanto isômeros dextrogiros podem apresentar um composto com 2 C* diferentes ? a) 1 b) 2 c) l d) 4 e) 5 7) Quantos isômeros ópticos ativos existem no máximo com a fórmula molecular C4H8 Cl2 ? a) 4 isômeros. b) 3 isômeros. c) 2 isômeros. d) 1 isômero. e) Nenhum. 1-3 8) Anfetamina é utilizada ilegalmente como doping nos esportes. A molécula de anfeta¬mina tem a fórmula geral: Em que X é um grupo amino, Y é um radical metil e Z é um radical benzil. a) Escreva a fórmula estrutural da anfetamina. b) Qual o tipo de isomeria que ocorre na molécula de anfetamina? 9) Em ambientes assolados por predadores é fundamental para a sobrevivência da espécie a capacidade de avisar seus semelhantes sobre a presença de um perigo. Ao ser molestada, a anêmona-do-mar libera na água uma substância denominada antopleurina, que atua como um alarme fazendo com que as outras anêmonas que estejam nas proximidades se contraiam em atitude de defesa. Mais interessante ainda é que, após comer uma anêmona, o nudibrânquio (seu predador natural) conserva em seus tecidos uma concentração de antopleurina suficiente para provocar contrações em anêmonas que estão â distância, impedindo que ele faça uma nova refeição por até 5 dias. A partir da fórmula da antopleurina esquematizada a seguir, indique: a) Os grupos funcionais presentes nessa substância b) O número de isômeros opticamente ativos 10) A análise do nível de glicose de uma amostra de urina é um dos testes clínicos mais comuns. Normalmente, os rins reabsorvem a maior parte de glicose sangüínea, e a urina contém apenas 15 mg de glicose para 100 ml da amostra. Considere a estrutura da glicose: HOOC — CH —CH —CH—CH—CH2 — CH3 │ │ │ │ OH OH OH OH Quantos isômeros opticamente ativos apresenta? 11) Qual o número de isômeros ativos e inativos do composto 3 cloro – 2 bromo – 4 iodo – pentano ? 12) O ácido 2,3-dicloro-3-fenilpropanóico apresenta: a) 4 isômeros sem atividade áptica. b) um total de 6 isômeros, sendo 2 sem atividade óptica. c) um total de 4 isômeros, sendo 2 sem atividade óptica. d) não apresenta isomeria óptica. e) só 2 isômeros ativos e um meso composto. 13) Qual das substancias a seguir pode ter isomeros opticos, ou seja, contem carbono quiral? a) Fluor-cloro-bromo-metano b) 1,2-dicloro-eteno c) Metil-propano d) Dimetil-propano e) Butanol 14) O composto de fórmula: CH3 – CRH – CH2 – CH3 poderá apresentar isomeria óptica quando R for: a) hidrogenio. b) oxigenio c) hidroxila d) metila e) etila 2-3 15) Numa série de Processos Radiativos, o radioisótopo Urânio transforma-se em Polônio, de acordo com a seguinte reação nuclear : 120U 235 1ª ETAPA 126Th 235 2ª ETAPA 126 Po 223 Indique quais e quantas partículas foram emitidas em cada etapa deste processo. 90 A 16) Na transformação do Césio (40Cs ) em Cobalto ( ZCo ) , houve emissão de 2 partículas alfa e 4 . partículas beta. Qual a massa atômica (A) e o número atômico (Z) do Cobalto ? ....... 320 17) Para se transformar em Chumbo (98Pb ) , um radioisótopo inicial emitiu de seu núcleo 7 partículas alfa, e 4 partículas beta. Qual era este radioisótopo inicial ? Z=? X A=? + 7£ + 4β 98Pb 320 18) No Sol ocorre espontaneamente a união de pequenos núcleos formando novos elementos químicos com .liberação significativa de energia, este fenômeno é denominado “ Fusão Nuclear ”. A Fusão Nuclear também pode ocorrer numa usina, considere a seguinte equação: Z Ra A + 2 £ 4 Z Th 228 Quais os valores de A e Z ? 19) A maior aplicação das reações nucleares é destinada à produção de energia elétrica. Numa usina nuclear, o Urânio enriquecido é colocado no reator gerando calor e energia. Este processo ocasiona a quebra deste radioisótopo segundo a reação abaixo. Indique o radioisótopo formado. 92 U 235 - 8£ - 7β ? 20) Explique “Fusão e Fissão Nuclear”. 3-3
Download


![01) [2,0 pontos] A estrutura a seguir: apresenta a seguinte](http://s1.livrozilla.com/store/data/000606747_1-fc539bdcbb1b46c0f7f82e58c07d0a0b-260x520.png)