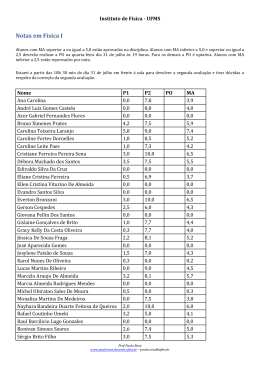
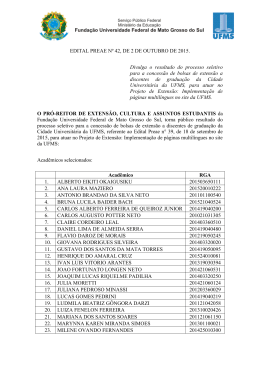
Prof. Antonio B. Pereira - Químico Mestre em Ensino de Química – UFMS e-mail: [email protected] A boa conduta é o inicio do encantamento, já a cultura e o estimulo pessoal é a permanência dessa virtude. Marcos Nunes HIDRÓLISE DE SAIS QUESTÃO 1. (Cefet MG 2014) Um professor de Química propôs a manipulação de um indicador ácido-base que se comportasse da seguinte maneira: pH Cor da solução <7 amarela =7 alaranjada >7 vermelha As cores das soluções aquosas de NaCN, NaC e NH4C , na presença desse indicador, são, respectivamente a) amarela, alaranjada e vermelha. b) amarela, vermelha e alaranjada. c) vermelha, alaranjada e amarela. d) alaranjada, amarela e vermelha. e) alaranjada, amarela e alaranjada. QUESTÃO 2. (Fuvest 2014) Uma jovem estudante quis demonstrar para sua mãe o que é uma reação química. Para tanto, preparou, em cinco copos, as seguintes soluções: Copo Solução 1 vinagre 2 sal de cozinha + água 3 fermento químico (NaHCO3) + água 4 açúcar + água 5 suco de limão Em seguida, começou a fazer misturas aleatórias de amostras das soluções contidas nos copos, juntando duas amostras diferentes a cada vez. Qual é a probabilidade de que ocorra uma reação química ao misturar amostras dos conteúdos de dois dos cinco copos? a) 1/10 b) 1/8 c) 1/5 d) 1/3 e) 1/2 QUESTÃO 3. (G1 - ifce 2014) O sangue humano é uma solução que possui mecanismos que evitam que o valor de pH aumente ou diminua de forma brusca, sendo mantido em torno de 7,3, porém, em algumas situações, como pneumonia ou asma, ocorre uma deficiência no processo de respiração, aumentando a concentração de CO 2 no sangue e consequentemente diminuindo o pH sanguíneo, condição chamada de acidose. Um tratamento que poderia ser utilizado, para controlar essa doença, seria com solução de a) carbonato de sódio. b) c) d) e) ácido clorídrico. cloreto de amônio. cloreto de sódio. sulfato de sódio. TEXTO PARA A PRÓXIMA QUESTÃO: Na apresentação de um projeto de química sobre reatividade de produtos caseiros, vinagre e bicarbonato de sódio (NaHCO3) foram misturados em uma garrafa plástica; em seguida, uma bexiga vazia foi acoplada à boca da garrafa. A imagem apresenta o momento final do experimento. QUESTÃO 4. (Uea 2014) O pH de soluções aquosas de vinagre e o pH de soluções aquosas de bicarbonato de sódio são, respectivamente, a) menor que 7,0 e maior que 7,0. b) maior que 7,0 e maior que 7,0. c) maior que 7,0 e menor que 7,0. d) 7,0 e maior que 7,0. e) menor que 7,0 e 7,0. QUESTÃO 5. (Upe 2013) Em um aquário onde a água apresentava pH igual a 6,0, foram colocados peixes ornamentais procedentes de um rio cuja água tinha pH um pouco acima de 7,0. Em razão disso, foi necessário realizar uma correção do pH dessa água. Entre as substâncias a seguir, qual é a mais indicada para tornar o pH da água desse aquário mais próximo do existente em seu ambiente natural? a) KBr b) NaC c) NH4C d) Na2CO3 e) A 2 SO4 3 QUESTÃO 6. (Ufsm 2013) No lugar de Mg(OH)2, outros compostos da tabela a seguir poderiam ser usados para ter o mesmo efeito antiácido. São eles: Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 * www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected] arquivo: lista_16_química.docx 1 A B C D a) b) c) d) e) Composto NaHCO3 NaC CaCO3 NH4C A e B. A e C. B e C. B e D. C e D. QUESTÃO 10. (Ita 2007) Assinale a opção que apresenta um sal que, quando dissolvido em água, produz uma solução aquosa ácida. a) Na2CO3 b) CH3COONa c) CH3NH3Cℓ d) Mg(CℓO4)2 e) NaF QUESTÃO 7. (Ufsj 2012) Alguns sais apresentam a propriedade de tomar as soluções aquosas ácidas ou básicas quando dissolvidos, enquanto outros não alteram o pH natural da água. O carbonato de sódio (Na2CO3), o cloreto de sódio (NaC ) e o sal amoníaco (NH4C ) produzem, respectivamente, soluções aquosas a) neutra, básica e ácida. b) ácida, neutra e básica. c) básica, neutra e ácida. d) ácida, ácida e neutra. QUESTÃO 8. (Udesc 2012) Um dos principais tipos de solo no Brasil é o latossolo vermelho-amarelo, que apresenta óxidos de ferro e de alumínio na sua composição. Uma amostra deste tipo de solo apresentou pH 4,0. Analise as proposições abaixo em relação a esses dados. I. O aumento do pH pode ser realizado pela adição de calcário, porque o carbonato CO32 em contato com a umidade do solo II. hidrolisa, produzindo bicarbonato, HCO3 e hidróxido, OH . O aumento do pH pode ser realizado pela adição de salitre, que é composto principalmente por nitrato de sódio. III. O íon alumínio (A 3 ) é um dos componentes responsáveis pela acidez no solo, porque na hidrólise gera íons H . Assinale a alternativa correta. a) Somente as proposições II e III são verdadeiras. b) Somente a proposição I é verdadeira. c) Somente a proposição II é verdadeira. d) Somente as proposições I e III são verdadeiras. e) Somente a proposição III é verdadeira. QUESTÃO 9. (Ufpr 2010) A acidez do solo é uma importante propriedade que influencia no plantio e na produtividade de vários produtos agrícolas. No caso de solos ácidos, é necessário fazer uma correção do pH antes do plantio, com a adição de substâncias químicas. Assinale a alternativa que apresenta sais que, ao serem individualmente solubilizados em água destilada, causam a diminuição do pH. a) NaCℓ e K2SO4. b) NH4Br e AℓCℓ3. c) KBr e CaCO3. d) NH4Cℓ e CaCℓ2. e) NaCN e Na2CO3. Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 * www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected] arquivo: lista_16_química.docx 2
Download