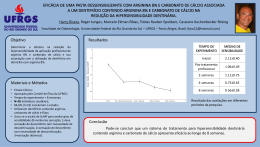
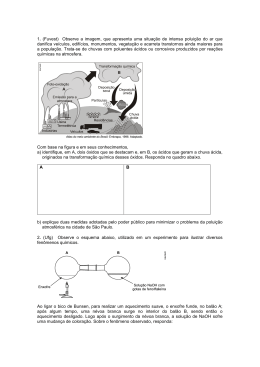
FÓRMULAS QUÍMICAS. ESTEQUIOMETRI A Determinação da Fórmula de um Composto Fórmula Empírica Fórmula Centesimal é a fórmula que exprime a Obtém-se a fórmula empírica dividindo-se, pelas proporção que cada elemento respectivas massas atômicas contribui na molécula. as percentagens que cada Também chamada de elemento participa de uma percentagem em massa. substância, os quocientes obtidos estão entre si na Exemplo mesma razão que os números de átomos de cada elemento A fórmula centesimal da existentes em 100 unidades glicose é de massa dessa substância. No caso da glicose, fica: C ................ 40,00% H ............... 6,66% C3,33H6,66O3,33 O ............... 53,33% Fórmula Mínima Ocorre quando transformamos os números fracionários em números inteiros. É a mínima relação inteira entre os números de átomos dos vários elementos contidos na substância. De maneira geral para transformar os índices fracionários eminteiros, basta dividílos pelo menor C 1H 2O 1 Fórmula Molecular A fórmula molecular nos diz quantos átomos de cada elemento estão presentes em uma molécula de uma substância. Para encontrar o número de vezes que a fórmula mínima está contida na fórmula molecular, basta dividirmos a massamolecular pela massa da fórmula mínima. Exemplo: A massa molecular da glicose é 180. A massa da fórmula mínima é 30. Logo 180/30 = 6...................C6H12O6 Cálculo Estequiométrico Os cálculos estequiométricos baseiam-se nos coeficientes de uma reação química. Eles fornecem as razões nas quais os mols de uma substância reagem com ou formam os mols de outra. Assim, a equação balanceada fornece as relações quantitativas entre todos os reagentes e produtos. Relação Molar 1 mol de qualquer substância é igual à massa molecular expressa em gramas possui 6,02 x 10 23 partículas ocupa 22,4 L, no estado gasoso e nas CNTP TESTES DE VESTIBULARES 1. Os sistemas de comunicação e transporte criados pelo homem foram evoluindo ao longo do tempo. Assim, em fins do século XVIII, apareceram os balões, cujo desenvolvimento ocorreu durante todo o século XIX, chegando ao século XX com os dirigíveis cheios de hidrogênio e, mais recentemente, de hélio. Nesse processo, o brasileiro Santos Dumont contribuiu de modo significativo. Os "Zeppelins", dirigíveis cheios de hidrogênio, estão, ainda, entre as maiores naves aéreas já construídas pelo homem. O mais famoso deles, o "Hindemburg", começou a sua história em 1936, terminando em maio de 1937, num dos maiores acidentes aéreos já vistos e filmados. O seu tamanho era incrível, tendo cerca de 250 metros de comprimento, com um volume de 200 × 106 litros, correspondendo a 8,1 × 106 mols de gás. Se o hidrogênio necessário para encher totalmente o "Hindemburg" fosse obtido a partir da reação de ferro com ácido (dando Fe2+), quantos quilogramas de ferro seriam necessários? (A) 1,12 x 107 (B) 2,30 x 106 (C) 4,53 x 105 (D) 5,35 x 104 (E) 6,28 x 103 2. Observe a figura e leia o texto. 4. Uma indústria solicitou a um laboratório determinada quantidade da substância trifluoreto de fósforo puro, que será utilizada na obtenção de um produto de grande importância. Para atender ao pedido, os técnicos do laboratório realizaram quatro experiências, utilizando fósforo e flúor puros, que, combinados em condições adequadas, formaram o trifluoreto de fósforo, em um sistema fechado. Observe a tabela a seguir. Massa dos Reagentes em gramas Experiência Fósforo Flúor I 31,0 19,0 II 15,5 28,5 III 9,30 19,0 IV 10,0 30,0 Considerando 100% de rendimento, a experiência que atende à especificação solicitada pela indústria é a de número (A) I (B) II (C) III (D) IV (E) I e IV 5. Vidro de janela pode ser produzido por uma mistura de óxido de silício, óxido de sódio e óxido de cálcio, nas seguintes proporções (% m/m): 75, 15 e 10, respectivamente. Os óxidos de cálcio e de sódio são provenientes da decomposição térmica de seus respectivos carbonatos. Para produzir 1,00 kg de vidro, quais são as massas de óxido de silício, carbonato de sódio e carbonato de cálcio que devem ser utilizadas são, respectivamente, No balão A, são adicionados carbonato de sódio e ácido clorídrico em quantidades suficientes para a produção de 11,2 litros de um gás, nas CNTP, sendo que este gás foi borbulhado em 1,0 L de uma solução de hidróxido de cálcio no balão B, cuja concentração é de 37 g/L. Após a absorção total do gás no balão B, formou-se uma substância pouco solúvel que permanece depositada no fundo do referido balão. A massa da substância que se deposita no fundo do balão B, vale (A) 10 g (B) 20 g (C) 30 g (D) 40 g (E) 50 g 3. A combustão completa do gás metano, feita em presença de ar, a temperatura e pressão constantes, pode ser representada pela seguinte equação química não balanceada: CH4(g) + O2(g) = CO2(g) + H2O(l) Admita que: - 60,0 L deste combustível foram queimados por um veículo; - o oxigênio reagente represente 20% do volume total do ar; - o rendimento do processo seja de 90%. Nestas condições, o volume de ar, em litros, necessário à combustão equivale a (A) 810 (B) 540 (C) 480 (D) 270 (E) 120 (A) 565g - 256,5g - 178,5g (B) 324g - 425g - 178,5g (C) 750g - 150g - 100g (D) 750g - 256,5g - 178,5g (E) 425g - 324g - 565g 6. A cal viva, CaO, é um material utilizado no preparo de argamassas para construção civil, em pinturas de baixo custo para muros (caiação), bem como em jardinagem. Ao preparar o material para pintura de caules de árvores, um jardineiro misturou, sob agitação, 28 kg de cal viva com água em excesso, realizando uma reação química. A reação da cal viva com água resulta na formação da cal extinta, hidróxido de cálcio. A quantidade máxima de cal extinta obtida, em kg, foi de (A) 28. (B) 37. (C) 57. (D) 64. (E) 74. 7. Uma amostra de calcário dolomítico, contendo 60% de carbonato de cálcio e 21% de carbonato de magnésio, sofre decomposição quando submetida a aquecimento, segundo a equação a seguir: CaCO 3(s) + MgCO 3(s) = CaO (s) + MgO (s) + 2CO 2(g) A massa de óxido de cálcio e a massa de óxido de magnésio, em gramas, obtidas com a queima de 1 quilo de calcário são, respectivamente, (A) (B) (C) (D) (E) 60 ; 21 100 ; 84 184 ; 96 336 ; 100 600 ; 210 8. Sulfato de cobre pode ser utilizado na agricultura como fungicida e também para transformar o álcool hidratado (mistura azeotrópica contendo 4%, em massa, de água) em álcool anidro. Cu SO4 + 5 H2O = CuSO4 . 5 H2O (pouco solúvel no álcool) Assim, para obter-se 96 kg de álcool anidro a custa de cerca de 100 kg de álcool hidratado, a massa de sulfato de cobre anidro utilizada é, aproximadamente, (A) (B) (C) (D) (E) 20 kg 10 kg 9 kg 7 kg 5 kg 9. O carbeto de silício (SiC) possui uma estrutura idêntica à do diamante e, por isso, apresenta elevada dureza, sendo utilizado, por exemplo, na confecção de esmeril para afiar facas e no corte de vidros. Uma forma de obtenção do carbeto de silício dá-se por meio da reação de aquecimento de coque com areia, conforme expressa a equação a seguir: 3 C + SiO2 = SiC + 2 CO A massa de carbeto de silício, em kg, que se forma a partir da utilização de 1kg de carbono presente no coque é, aproximadamente, (A) 0,33 (B) 0,78 (C) 1,11 (D) 1,44 (E) 3,33 10. O sulfato de bário (BaSO4) é usado como contraste em exames radiológicos e pode ser obtido pela seguinte reação: 13. O sulfato de cálcio (CaSO4) é matéria-prima do giz e pode ser obtido pela reação entre soluções aquosas de cloreto de cálcio e de sulfato de sódio (conforme reação abaixo). Sabendo disso, calcule a massa de sulfato de cálcio obtida pela reação de 2 mols de cloreto de cálcio com excesso de sulfato de sódio, considerando-se que o rendimento da reação é igual a 75 %. CaCl 2 ( a q ) + Na 2 SO 4 ( a q ) = CaSO 4 ( s ) + 2NaC l ( a q ) (A) 56 g. (B) 136 g. (C) 272 g. (D) 204 g. (E) 102 g. 14. Compostos de sal e água combinados em proporções definidas são chamados hidratos e a água a eles associada é água de hidratação. 2,7 g do hidrato FeCl3 . XH2O fornecem, por aquecimento, 1,62 g de FeCl3 anidro. O número de águas de hidratação do hidrato é (A) 2 (B) 6 (C) 1 (D) 3 (E) 5 15. O medicamento Pepsamar Gel, utilizado no combate à acidez estomacal, é uma suspensão de hidróxido de alumínio. Cada mL de Pepsamar Gel contém 0,06 g de hidróxido de alumínio. Assinale a massa de ácido clorídrico do suco gástrico que é neutralizada, quando uma pessoa ingere 6,50 mL desse medicamento, aproximadamente (A) 0,37 (B) 0,55 (C) 0,64 (D) 0,73 (E) 0,98 BaCl2(aq) + H2SO4(aq) = BaSO4(s) + 2HCl(aq) Que volume de solução aquosa de ácido sulfúrico (H2SO4) 1,5 mol L-1 deve ser utilizado para se obter 30 mols de BaSO 4 ? Considere que existe excesso de BaCl 2 . (A) 6 L (B) 12 L (C) 15 L (D) 20 L (E) 25 L 11. Considere 50g de uma amostra de calcário com 80% de pureza em carbonato de cálcio. O volume de gás carbônico, nas CNTP, que se obtém quando essa amostra reage com ácido clorídrico em excesso, sabendo que o rendimento da reação é de 95%, vale (A) 8,512 L (B) 8,960 L (C) 10,31 L (D) 12,14 L (E) 15,21 L 12. Uma amostra de magnesita com 70% de pureza em MgCO3 foi submetida à decomposição térmica, obtendo-se 5,32 litros de CO2, nas CNTP, com um rendimento de 95%. Calcule a massa da amostra de magnesita utilizada. (A) 30 gramas. (B) 25 gramas. (C) 20 gramas. (D) 15 gramas. (E) 10 gramas. GABARITO 1-C 2-E 3-B 4-B 5-D 6-B 7-D 8-D 9-C 10-D 11-A 12-A 13-D 14-B 15-B RESOLUÇÃO DOS TESTES
Download