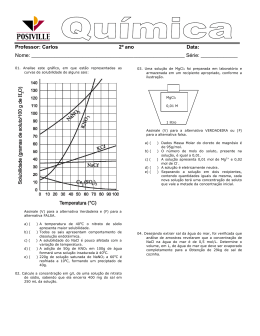
Lista 1 - Ut-1 2º ano Prof. Carlos ALUNO (A): 01. Analise este gráfico, em que estão representadas as curvas de solubilidade de alguns sais: 03. Uma solução de MgCl2 foi preparada em laboratório e armazenada em um recipiente apropriado, conforme a ilustração. MgCl2 0,01 M 1 litro Assinale (V) para a alternativa VERDADEIRA ou (F) para a alternativa falsa . Dados Massa Molar do cloreto de magnésio é de 95g/mol ( ) O número de mols do soluto, presente na solução, é igual a 0,01. ( ) A solução contém mais de 0,95 gramas do soluto. ( ) A solução é eletricamente neutra. ( ) Separando a solução em dois recipientes, contendo quantidades iguais da mesma, cada nova solução terá uma concentração de soluto que vale a metade da concentração inicial. Assinale (V) para a alternativa Verdadeira e (F) para a alternativa FALSA. ( ) A temperatura de 400C o nitrato de sódio apresenta maior solubilidade. ( ) Todos os sais apresentam comportamento de dissolução endotérmica. ( ) A solubilidade do NaCl é pouco afetada com a variação de temperatura. ( ) A adição de 50g de KNO3 em 100g de água formará uma solução insaturada à 400C. ( ) 220g de solução saturada de NaNO3 a 600C é resfriada a 100C, formando um preciptado de 40g. 02. Calcule a concentração em g/L de uma solução de nitrato de sódio, sabendo que ela encerra 20 g do sal em 250 mL da solução. 04. Desejando extrair sal da água do mar , foi verificada que análise de amostras revelaram que a concentração de NaCl na água do mar é de 0,5 mol/L. Determine o volume, em L, de água do mar que deve ser evaporado completamente para a 0btenção de 29kg de sal de cozinha. 05. A sacarose é o açúcar comum e uma das substâncias químicas mais pura do dia a dia. Para adoçar uma xícara de café , uma pessoa usa em média 3,42g de sacarose C12H22O11. Supondo que o volume final do café assim adoçado seja de 100 mL, Dados M(C12H22O11) =342g/mol. I) Determine a concentração em g/L. II) Determine a concentração em mol/L. 06. No tratamento de madeira usada para produzir pequenos embarcações , dentre várias substâncias, usa-se uma solução de ácido bórico H3BO3 a 25% de densidade 1,25g/mL. Determine a concentração em mol/L desta solução. Dados : H=1u, B= 11u e 0 =16u I) Determine a Massa molar do ácido Bórico . 09. Têm-se cinco recipientes contendo soluções aquosas de cloreto de sódio. É correto afirmar que: II) Determine a concentração da Solução de ácido bórico em g/L. III) Determine a concentração da solução de ácido bórico em quantidade de matéria por volume (mol/L) . 07. Entre os diversos hormônios que promovem o equilíbrio das diversas funções no organismo humano, está a adrenalina, que regula o funcionamento do coração, dos brônquios e dos vasos sanguíneos. Secretada pelas glândulas supra-renais, a adrenalina apresenta a estrutura molecular representada a seguir: Dados: massas atômicas C=12u, N=14u, O=16u e H=1u e Fórmula molecular C9H13NO3. Determine a concentração de adrenalina em g/L, sabendo que a densidade da solução é de 1g/mL e que apresenta 2% de soluto. a) o recipiente 5 contém a solução menos concentrada. b) o recipiente 1 contém a solução mais concentrada. c) somente os recipientes 3 e 4 contêm soluções de igual concentração. d) as cinco soluções têm a mesma concentração. e) o recipiente 5 contém a solução mais concentrada. 10. No Brasil, o transporte de cargas é feito quase que totalmente em rodovias por caminhões movidos a diesel. Para diminuir os poluentes atmosféricos, foi implantado desde 2009 o uso do Diesel 50S (densidade média 850 g/L), que tem o teor máximo de 50 ppm (partes por milhão) de enxofre. I) Determine a massa total do Diesel 50S em um tanque de 50L. II) Determine a quantidade máxima de enxofre, em gramas, contida no tanque cheio de um caminhão com capacidade de 100 L, abastecido somente com Diesel 50S, é 08. Nos postos de gasolina é comum o frentista oferecer produtos associados à manutenção interna e externa dos veículos. Um dos produtos oferecidos para evitar o aquecimento excessivo dos radiadores de automóveis apresenta como princípio ativo o eltilenoglicol, que misturado a água provoca alterações nas temperaturas de ebulição e fusão. Sabendo que em um frasco de 500 mL da solução de etilenoglicol apresenta 5 mols de etilenglicol C2H6O2. Determine a concentração em g/L desta solução. Dados: C=12, H=1 e O=16. Faça esta lista com muita atenção Professor Carlos
Download