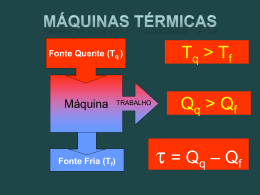
temperatura TERMODINÂMICA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna A TEMPERATURA E A LEI ZERO DA TERMODINÂMICA • Reparar na necessidade de definir uma escala de temperaturas que seja independente dos nossos sentidos (a ideia de quente e frio é uma ideia imprecisa e relativa). • Imagine-se dois objectos colocados num recipiente isolado (os objectos interactuam entre eles, mas não com a sua vizinhança). Se os objectos estiverem a diferentes temperaturas, irão trocar energia entre eles, à qual se dá o nome de calor. • Dois objectos dizem-se em contacto térmico, quando podem trocar calor entre eles. • Dois objectos dizem-se em equilíbrio térmico, quando, estando em contacto térmico, não trocam calor entre eles. • A chamada lei zero da termodinâmica diz que: “Se dois objectos A e B se encontram em equilíbrio térmico com um terceiro objecto, C, então, A e B estarão também em equilíbrio térmico entre eles quando forem colocados em contacto”. • A noção de temperatura é fornecida à custa da noção de equilíbrio térmico… Ou seja: “Dois objectos estão à mesma temperatura quando se encontram em equilíbrio térmico”. TERMÓMETROS E ESCALAS DE TEMPERATURA Os termómetros utilizam propriedades físicas que se modificam com a temperatura: 1) volume de um líquido 2) dimensões de um sólido 3) pressão de um gás a volume constante 4) volume de um gás a pressão constante 5) resistência eléctrica de um condutor 6) cor. …etc. 8 • A calibração de termómetros é feita com base em temperaturas específicas de certos materiais em determinadas circunstâncias. Por exemplo, mistura de água e gelo à pressão atmosférica em equilíbrio térmico e mistura de água e vapor, também em equilíbrio térmico e à mesma pressão (escala Celsius – 0ºC e 100ºC). • Notar que as substâncias de que são feitos os termómetros podem não ter um comportamento linear em toda a gama de temperaturas. E quando ultrapassam determinados limites de temperatura podem mudar de estado. TERMÓMETROS DE GÁS A VOLUME CONSTANTE E ESCALA KELVIN • Os termómetros de gás são dispositivos de medição de temperatura que apresentam leituras praticamente independentes da substância utilizada. • Na figura pode-se observar um esquema de um termómetro de gás a volume constante, o qual poderá ser calibrado de um modo semelhante ao anteriormente explicado, através de uma curva de calibração. 9 • Atente-se nas curvas de calibração para termómetros de gás a volume constante compostos por diferentes gases: • Foi com base nas curvas anteriores que surgiu a escala Kelvin, cuja relação com a Celsius é : TC = TK − 273.15 , onde TC é a temperatura em graus Celsius e TK em graus Kelvin Notar que uma variação de 1ºC equivale a uma variação de 1 K. • Actualmente as escalas são estabelecidas com base num único ponto, chamado triplo ponto da água e que corresponde à temperatura a que vapor, gelo e água líquida coexistem em equilíbrio (273.16 K). • Existe ainda a escala Fahrenheit que se relaciona com a Celsius através da expressão: 9 TF = TC + 32 5 EXPANSÃO TÉRMICA DE SÓLIDOS E LÍQUIDOS • Admitindo que a temperatura dos corpos está intimamente relacionada com a vibração das suas partículas constituintes, facilmente se compreende que, em geral, o aumento da temperatura corresponda a um aumento da distância média entre essas partículas. 10 • Na verdade, um objecto de comprimento L0 que fica sujeito a pequenas variações de temperatura ∆T sofre um acréscimo de comprimento, ∆L, que cumpre: ∆L = αL0 ∆T , a α dá-se o nome de coeficiente de expansão linear • Observando que os objectos se expandem em volume, a equação anterior tem a sua análoga volúmica: ∆V = βV0 ∆T , onde β é o coeficiente de expansão volúmica. • Admitindo que a expansão é igual em todas as direcções do espaço, a expressão anterior ainda pode ser escrita sob a forma: ∆V = 3αV0 ∆T • Para o provar, basta considerar um sólido paralelipipédico com dimensões l, w e h e desenvolver a soma V + ∆V (não esquecer que a quantidade ∆T é considerada pequena). • Através do gráfico pode-se verificar que a água tem, do ponto de vista de expansão térmica, um comportamento muito invulgar a temperaturas próximas de 0ºC. E é graças a esse comportamento que a superfície da água gela e as camadas mais internas não (reparar que a expansão de um corpo implica uma diminuição da sua densidade). 11 DESCRIÇÃO MACROCÓPICA DE UM GÁS IDEAL • Às equações que relacionam as grandezas massa, pressão, volume e temperatura dos gases dá-se o nome de equações de estado. • Define-se nº de moles de uma substância como a razão: n= m 1 M , onde m é a massa da substância e M a sua massa molar • Para deduzir a equação dos gases ideais, considere-se um cilindro hermético que pode variar o seu volume através de um pistão, no interior do qual se encontra um gás a baixa pressão. Nestas condições verifica-se experimentalmente que: 1. A temperatura constante, a pressão do gás é inversamente proporcional ao volume (Lei de Boyle) 2. A pressão constante, o volume é directamente proporcional à temperatura (Lei de Charles e Gay-Lussac) Ou, matematicamente: PV = nRT , onde, P é a pressão do gás, V o volume ocupado, n o número de moles do gás, R2 a constante dos gases reais e T a temperatura absoluta. • Conclui-se, então, que à pressão atmosférica e a 0ºC os gases ocupam 22.4 l. • A equação dos gases toma também a forma: PV = kB = N RT = Nk BT , sendo N o número total de moléculas do gás e NA R = 1.38 x10 −23 J / K a constante de Boltzmann NA • Às variáveis P, V e T dá-se o nome de variáveis termodinâmicas do sistema. A massa molar de uma substância é a massa que corresponde ao nº de Avogadro (NA=6.022 x 1023 ) de átomos ou moléculas constituintes dessa substância. 2 R = 8.31 J / mol K 1 12 calor e 1ª lei da termodinâmicA Energia térmica ou transferência de energia térmica (dependendo do contexto) CALOR 1ª LEI DA TERMODINÂMICA Lei de Conservação da Energia CALOR E ENERGIA TÉRMICA • Energia térmica como uma forma macroscópica de energia cinética. • Reparar que pode existir alterações na temperatura de um sistema sem que tenha havido transferência de energia térmica, mas sim através de trabalho realizado sobre ou pelo sistema. • Antes da analogia entre calor e energia, o calor tinha como unidade a caloria, que é definida como sendo a quantidade de calor necessária para fazer 1 g de água elevar a sua temperatura de 14.5ºC para 15.5ºC. Actualmente a unidade S.I. é, obviamente, o joule. • Foi Joule que, com uma experiência simples, estabeleceu a correspondência entre energia térmica e mecânica. A proporcionalidade entre joule e caloria foi obtida através desta experiência e é: 1 cal = 4.186 J CAPACIDADE CALORÍFICA E CALOR ESPECÍFICO • A troca de energia térmica com um sistema, quando ele se mantém no mesmo estado, implica alterações na sua temperatura. A capacidade calorífica (C´) de uma amostra é definida através da expressão: Q = C ′∆T , onde Q é o calor trocado com a amostra e ∆T a diferença de temperatura. 13 • O calor específico, C, de uma substância, é a sua capacidade calorífica por unidade de massa. Ou seja: C= Q Q = mC∆T , onde m é a massa da amostra. m∆T , e portanto: • Existe ainda a grandeza calor específico molar que será a capacidade calorífica por mole de substância. • Numa situação mais geral, em que se assume que o calor específico depende da temperatura, a sua definição vem: Q = m∫ CdT Tf Ti • O calor específico (particularmente o dos gases) varia com as condições de pressão e volume. Pelo que, para a mesma substância, existe um valor para o calor específico a volume constante e outro para o calor específico a pressão constante. • O elevado calor específico da água é responsável, por exemplo, pelo clima temperado das regiões próximas de grandes massas de água. CALORIMETRIA • Atendendo à conservação de energia é possível determinar o calor específico de sólidos através de experiências de calorimetria. Nestas experiências, o calor específico da substância é dado pela expressão: Cx = mágC ág (T − Ti ,ág ) mx (Ti, x − T ) CALOR LATENTE • A transferência de calor pode implicar mudanças de fase no sistema, cumprindo-se a relação: Q = mL , sendo L o calor latente da substância. • Os calores latentes podem ser de fusão ou de evaporação, consoante a substância se transforme de sólido para líquido (ou vice-versa), ou de líquido para gasoso (ou vice-versa). 14 • Exemplo : qual a energia térmica necessária para converter 1 g de gelo a –30ºC em vapor de água a 120ºC? • As mudanças de fase podem ser explicadas através de rearranjos moleculares que libertam ou consomem energia. TRABALHO E CALOR EM PROCESSOS TERMODINÂMICOS • Considere-se um cilindro delimitado por um pistão e uma expansão quasi-estática, através de deslocamentos, dy, do pistão. O trabalho realizado pelo gás é: dW = Fdy = PA dy = PdV dW é positivo quando o trabalho é realizado pelo sistema. • Numa situação mais geral o trabalho vem dado por: W = ∫ PdV , que tem em conta a forma Vi Vf como a pressão varia no processo. • Quando se representa os estados do sistema num diagrama PV o trabalho realizado nesse processo é dado pela área abaixo da curva que corresponde ao processo. • O trabalho é positivo quando o volume final é maior do que o inicial e negativo quando o volume final é menor do que o inicial. 15 • O trabalho depende, assim, do caminho percorrido. • Aliás, também a energia térmica depende do caminho percorrido e não apenas dos estados inicial e final, conforme se pode observar da figura seguinte: 1ª LEI DA TERMODINÂMICA • Se considerarmos Q a quantidade positiva que corresponde ao calor recebido por um determinado sistema e W a quantidade positiva que corresponde ao trabalho realizado pelo sistema sobre a vizinhança (repare-se que são ambas quantidades energéticas) observa-se que a quantidade Q – W (que corresponde à variação de energia interna do sistema, ∆U) é independente do caminho percorrido, sendo, portanto, uma função de estado. ∆U = U f − U i = Q − W • Ou, em quantidades infinitesimais: dU = dQ − dW • Casos especiais de variações energéticas: I Sistema Isolado: Um sistema isolado é aquele que não interactua com o exterior. Q = 0 ; W = 0 ⇒ ∆U = 0 ⇔ U f = U i “A energia interna de um sistema isolado mantém-se constante” II Processo Cíclico: ∆U = 0 ⇒ Q = W “Num processo cíclico o calo r transferido iguala o trabalho realizado” 16 III Processo Isocórico: Um processo isocórico ou isovolúmico é aquele que ocorre a volume constante. ∆V = 0 ⇒ W = 0 ⇒ ∆ U = Q “Num processo isocórico a variação de energia interna iguala o calor transferido” IV Processo Adiabático: Um processo adiabático é aquele que não troca calor com a sua vizinhança, ou porque se encontra termicamente isolado desta, ou porque ocorre muito rapidamente. Q = 0 ⇒ ∆U = −W “Num processo adiabático a variação da energia interna iguala o trabalho realizado sobre o sistema” V Processo Isobárico: Um processo isobárico é aquele que ocorre a pressão constante. W = P (V f − Vi ) VI Processo Isotérmico: Um processo isotérmico é aquele que ocorre a temperatura constante. Vejamos o que acontece num gás ideal: Como PV = nRT ⇒ PV = c te , então : W= ∫ Vf Vi PdV = ... = nRT ln Vf Vi Mas, como veremos, num gás ideal, quando ∆T = 0 ⇒ ∆U = 0 ⇒ Q = W TRANSFERÊNCIAS DE CALOR Radiação Condução Seja ∆x a espessura de um material cujas faces, que se encontram às temperatura T1 e T2, têm área A. A taxa de transferência de calor é dada por: Q ∆T Q dT αA → = −kA ∆t ∆x ∆t dx sendo k a condutividade térmica do material. Convecção Transferência de calor através do movimento de massas de ar aquecidas. Transferência de calor por radiação electromagnética. Sendo a potência irradiada dada por: ( P = σAe T 4 − T04 ) σ = 5.6696x10 −8W / m 2 K 4 , A - área irradiante, e - emissividade do objecto, T - temperatura absoluta do objecto e T0 - temperatura da vizinhança. 17 TEORIA CINÉTICA DOS GASES Estabelece uma relação entre as grandezas microscópicas e macroscópicas TEORIA CINÉTICA DOS GASES Aplicação das leis de Newton a uma colecção de partículas efeitos estatísticos. MODELO MOLECULAR DE UM GÁS IDEAL • O modelo utilizado nesta abordagem pressupõe que: (i) O nº de moléculas é muito elevado, ou seja, é possível aplicar estatística dos grandes números. (ii) O volume ocupado pelas moléculas é negligível quando comparado com o volume total ocupado, ou seja, a separação média entre as moléculas é muito grande quando comparada com as suas dimensões. (iii) As moléculas obedecem às leis de Newton, podendo-se mover em qualquer direcção. (iv) A distribuição de velocidades não depende do tempo. (v) As moléculas colidem elasticamente entre si e com as paredes do recipiente. (vi) As forças de interacção entre as moléculas são desprezáveis, a não ser durante a colisão. (vii) O gás considerado é uma substância pura, ou seja, todas as moléculas são idênticas. 18 • Para derivar a expressão da pressão atender aos seguintes passos: (i) Calcular a quantidade de movimento da colisão com a parede: ∆p x = −2 mv x (ii) Considerar a variação de momento linear da parede. (iii) Usar o teorema do impulso (com ∆t tempo entre duas colisões): ∆p = F∆t = 2mv x (iv) Perceber que ∆t = 2 d / v x (v) Derivar a força e somar para todas as partículas: Fx = (vi) ( ) m 2 Nm 2 Nm 2 v x ,1 + v x2,2 + ... = v = v d d x 3d E pela definição de pressão: P= Nm 2 2 N 1 2N 2 v = EC ,T mv = 3V 3 V 2 3 V (vii) Ou: PV = 2 1 2 1 2 N mv 2 ⇔ NkbT = N mv 2 ⇔ T = 3 2 3 2 3kb 1 2 mv 2 A temperatura de um gás ideal vem dependente apenas da energia cinética média das partículas. • A v dá-se o nome de velocidade média quadrática e é calculada através da expressão: v = v2 = 3kbT 3 RT = , onde M é a massa molar da substância em kg / mol m M CALOR ESPECÍFICO DE UM GÁS IDEAL • Reparar, uma vez mais, que o calor necessário para elevar a temperatura de n moles de um gás depende do processo utilizado e, por isso, nos gases, se define um calor específico a pressão constante e outro a volume constante: 19 Q = nCV ∆T (Volume constante) e Q = nCP ∆T (Pressão constante) • Num gás monoatómico, a sua energia interna é apenas a energia cinética translaccional, uma vez que não existem vibrações ou rotações. Considere-se um processo a volume constante: ∆V = 0 ⇒ W = 0 ⇔ ∆U = Q ⇔ 3 3 nR∆T = nCV ∆T ⇔ CV = R 2 2 • Considere-se agora um processo a pressão constante: Q = ∆U + W ⇔ nCP ∆T = nCV ∆T + P∆V ⇔ ⇔ nCP ∆T = nCV ∆T + nR∆T ⇔ CP − CV = R • E, portanto: CP = 5 R 2 • A razão entre os calores específicos, no caso dos gases monoatómicos, toma o valor: γ = CP 5 = CV 3 • Observe-se que CP > CV, pois no primeiro caso o calor é também utilizado para realizar trabalho. • Nos sólidos e líquidos, CP e CV são muito semelhantes, uma vez que os processos a pressão constante, dão-se, também, praticamente, a volume constante. PROCESSOS ADIABÁTICOS EM GASES IDEAIS • Pretende-se provar que num processo adiabático com gases ideais, se cumpre: PV γ = c te (i) Usar a 1ª Lei da Termodinâmica, o facto de o processo ser adiabático e a variação de energia só depender da variação de temperatura e, portanto, poder ser dada pelo produto nCVdT: nCV dT = − PdV (ii) Derivando a equação dos gases ideais e aplicando-a à expressão anterior: CV (PdV + VdP) = −RPdV ... γ ln V + ln P = c te ⇔ PV γ = c te 20 • Observar a diferença entre as curvas isotérmicas e as adiabáticas. • Reparar que numa expansão adiabática a temperatura final é menor do que a temperatura inicial. Similarmente, numa compressão adiabática a temperatura final é maior do que a inicial. EQUIPARTIÇÃO DA ENERGIA • Verificou-se que a energia cinética de translacção era igualmente distribuída pelas três direcções do espaço. Uma generalização deste resultado é o teorema da equipartição da energia: “A energia de um sistema em equilíbrio térmico é igualmente dividido por todos os graus de liberdade”. • No caso de moléculas diatómicas a sua energia interna não depende apenas da energia cinética de translacção do centro de massa, mas também dos movimentos de rotação da molécula e de vibração dos átomos em torno da posição de equilíbrio. • Assim, considerando também a rotação das moléculas, devemos considerar 5 graus de liberdade (3 de translacção e 2 de rotação 3). Como para cada grau de liberdade temos uma quantidade de energia dada por 0.5NkBT: U= 5 5 7 7 Nk B T ⇒ CV = R ⇒ C P = ⇒ γ = 2 2 2 5 • E quando se considera o movimento de vibração, dever-se-á adicionar dois graus de liberdade (o modelo sugere uma ligação entre os átomos tipo mola um termo de energia cinética e outro de energia potencial. E nesse caso: U= 7 7 9 9 Nk B T ⇒ CV = R ⇒ C P = ⇒ γ = 2 2 2 7 • Deve ou não considerar-se o movimento de vibração dos átomos dependendo da temperatura considerada e das próprias moléculas. 3 Se os átomos forem considerados pontuais, numa das direcções do espaço a rotação não se efectua (no caso da figura será segundo y). 21 MÁQUINAS TÉRMICAS, ENTROPIA E 2ª LEI DA TERMODINÂMICA Restringe o tipo de conversões energéticas nos processos termodinâmicos 2ª Lei da Termodinâmica Formaliza os conceitos de processos reversíveis e irreversíveis MÁQUINAS TÉRMICAS E 2ª LEI DA TERMODINÂMICA • Uma máquina térmica converte energia térmica em energia mecânica através dos seguintes passos: (viii) absorve energia térmica de um reservatório de temperatura mais elevada; (ix) realiza trabalho; (x) expele energia térmica para um reservatório de mais baixa temperatura. • Como estas máquinas trabalham em ciclos ∆U = 0 e, portanto, pela 1ª lei: Q − W = 0 ⇔ Qq − Q f = W • Sendo W o integral do diagrama PV no interior da linha fechada que representa o dito ciclo • O rendimento de uma máquina térmica vem dado por: η= Q W Qq − Q f = = 1− f Qq Qq Qq • A situação ideal em que Qf é zero e, portanto o rendimento é 1 nunca se verifica. Ou seja, numa máquina térmica não é possível transformar todo o calor recebido em trabalho. (2ª lei da termodinâmica). • As máquinas frigoríficas são dispositivos que operam no modo inverso à da máquina térmica. (i) é realizado trabalho sobre ela; 22 (ii) retira energia térmica de um reservatório de temperatura mais baixa; (iii) expele energia térmica para um reservatório de mais baixa elevada. • Da mesma forma a 2ª lei impede que todo o calor retirado do reservatório frio seja transferido para o reservatório quente, sem o recurso a trabalho exterior. • Um sistema sofre um processo reversível quando tanto o sistema como a sua vizinhança poderão regressar ao estado inicial. MÁQUINA DE CARNOT • O teorema de Carnot diz que: “Nenhuma máquina térmica real que opere entre dois reservatórios de calor pode ser mais efeiciente do que a máquina de Carnot que opera com os mesmos reservatórios” • Para compreender o Ciclo de Carnot considere-se a figura seguinte, admita-se que o gás no interior do pistão é ideal e que este é termicamente isolado. 23 Com base neste processo, demonstre-se que o rendimento de uma máquina deste tipo é dado por: η =1 − Tf Tq (i) Calcula-se Qq (ii) Calcula-se Qf (iii) Calcula-se o quociente entre os dois. (iv) Atende-se a que os processos B → C e D → A são isobáricos e, portanto, que se cumpre: PVγ Qf (v) Fica então provado que Qq = Tf Tq … • Sabendo que a eficiência de uma máquina frigorífica é definida através da razão: ε= Qf W • Ao inverter-se o ciclo num máquina de Carnot, facilmente se verifica que a eficiência virá dada por, sendo esta a maior eficiência possível de uma máquina frigorífica: ε= Tf Tq − T f 24 ENTROPIA • A 2ª Lei da Termodinâmica envolve uma interessante função de estado à qual se dá o nome de Entropia, definida a partir da seguinte situação: Considere-se um sistema que fica sujeito a um processo infinitesimal entre dois estados de equilíbrio. Se dQr for a quantidade de energia térmica envolvida nesse processo, sendo este reversível, a variação de entropia dS será dada por: dQr T dS = onde T é a temperatura absoluta. • Do ponto de vista estatístico a entropia está associada à desordem. • Uma outra forma de enunciar a 2ª Lei da Termodinâmica é: “A entropia de um sistema isolado nunca diminui: num processo reversível mantém-se constante, num processo irreverssível, aumenta”. O que significa que para aumentar a ordem de um sistema é necessário aumentar a entropia da vizinhança. • Para calcular a variação de entropia num processo, utiliza-se a equação: f ∆S = ∫ i dQr T • Calcule-se, por exemplo, a entropia associada a um ciclo da máquina de Carnot: f ∆S = ∫ i dQq dQ f Qq Q f dQr =∫ −∫ = − = ... = 0 T Tq Tf Tq T f • Na verdade, como a entropia é uma função de estado, num processo cíclico a sua variação será nula. • Além disso, repare-se que em processos reversíveis , a variação de entropia total é nula. (ou seja, quando se considera a entropia do sistema e da sua vizinhança). • Calcule-se a variação de entropia de um gás que realiza um processo reversível de uma temperatura Ti e de um volume Vi, para uma estado com temperatura Tf e de um volume Vf: ∆S = nCV ln Tf Ti + nR ln Vf Vi 25 • Num processo irreversível, a variação de entropia é calculada tendo em conta um processo reversível cujos estados finais e iniciais sejam iguais (repare-se, uma vez mais, que a entropia é uma equação de estado). • Demonstre-se que numa situação de condução térmica entre dois reservatórios a variação de entropia dos dois corpos envolvidos é: ∆S = Q Q − T f Tq • Finalmente, calcule-se a variação de entropia de dois corpos que são colocados em contacto térmico: ∆S = m1C1 ln Tf T1 + m2 C 2 ln Tf Tf = T2 , sendo m1c1T1 + m2 c 2T2 m1c1 + m2 c 2 • Sendo a entropia uma medida de desordem, repare-se que ela aumenta porque a desordem é sempre mais provável… 26
Download