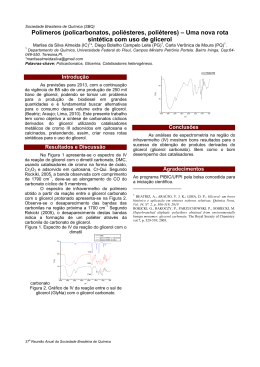
Caracterização e preparação de matrizes de alginato/polifosfato/glicerol visando a bioencapsulação Danilo Augusto Coêlho* (IC), Gabriel Franco dos Santos (PQ), Gabriel Olivo Locatelli (PQ), Vanessa da Silva Santos (IC) e Luciano Avallone Bueno (PQ) Departamento de Física, Universidade Federal Rural de Pernambuco, Recife, Brasil *([email protected]) INTRODUÇÃO E OBJETIVO Nos últimos anos, a pesquisa tem focado na microencapsulação buscando uma melhoria na sobrevivência dos probióticos, por conta de um processo tecnológico que visa proteger micro-organismos, ofertando um grande potencial na entrega de células viáveis. Para desenvolver tais cápsulas ou esferas é necessário usar um material que não seja tóxico e que não tenha reações adversas com os microorganismos encapsulados. (JIMÉNEZ-PRANTEDA 2012). A maioria dos processos fermentativos industriais tradicionais aplica células livres em suspensão, entretanto, produtos com micro-organismos encapsulados exibem elevada concentração de células, o que permite aumento da produtividade e resistencia a condiçoes adversas (JACKSON, 1991). Os mecanismos para liberação do material ativo encapsulado variam de acordo com a natureza do agente ativo a ser encapsulado, e usualmente ocorrem devido a: variação de temperatura e pH, solubilidade do meio, biodegradação, difusão, rompimento mecânico, permeabilidade seletiva e gradientes de concentração existem na relação de meios para liberação. (BRANNON-PEPPAS, 1993). Muitos materiais podem ser usados no encapsulamento de agentes ativos, entre os quais são: ágar, alginato, carragenanas, dextrinas, sacarose, carboximetilcelulose, gelatina, albumina, quitosana e vários outros materiais. (ABBAS 2012). Este estudo investigou matrizes compostas por alginato contendo polifosfato e glicerol como aditivo, buscando uma matriz resistente e que retenha água para aumentar a viabilidade de microorganismos, com aplicação no biocontrole. MATERIAIS E MÉTODOS Por meio da ferramenta experimental de planejamento foram avaliadas proporções de alginato (Hansen ®), polifosfato (Nuclear ®) e glicerol (Vetec ®), usando um planejamento fatorial completo 22 com três pontos centrais (nível 0) e quatro axiais (levels ± α, onde α = 1,4142), totalizando 11 testes. As proporções de polifosfato variaram de 0 a 50% dependendo da concentração de alginato, para um total de 2% de polímeros. A concentração de glicerol variou de 0 a 2,0% (Tabela 1). Isso foi avaliado de acordo com a variabilidade de resposta da atividade de água, aW (do inglês water active), das cápsulas secas. A síntese das esferas foi implementada pelo método de gelificação simples, onde as soluções eram extrusadas com o auxílio de uma seringa numa solução de CaCl2 2M. As cápsulas formadas de forma esférica foram mantidas sob agitação em um agitador magnético por 10 min (Figura 1). Depois disso, foram peneiradas e lavadas com água destilada para remover o excesso de íons cálcio. As cápsulas foram secadas em um forno com circulação de ar à 40°C, e foram pesados a cada hora, até que houvesse a estabilização do peso. Tabela 1. Valores codificados e reais níveis das variáveis estudadas Variáveis -α* -1 0 +1 +α* Concentração 50,0 57,3 75 92,7 100 Alginato (%) Glicerol (%) 0 0,3 1 1,7 2 *α = ± 1,4142 As análises de caracterização foram realizadas com as microesferas de Alginato (2,0% m/v); Alginato / Glicerol (2,0% / 1,0% m/v); Alginato / Polifosfato (1,0% / 1,0% m/v); Alginato / Polifosfato / Glicerol (1,0% / 1,0% / 1,0% m/v). As amostras foram submetidas às análises de FT-IR em modo ATR usando um espectrofotômetro FTIR (Varian). RESULTADOS E DISCUSSÃO As cápsulas formadas apresentaram aparência esférica e coloração branca com transparência. As amostras formadas foram secas sendo verificado a atividade de água de hora em hora. Após 12 horas de secagem, não houve variação da atividade de água. O estudo de FTIR revelou os grupos funcionais das cápsulas Ca-alginato-glicerol, Ca-alginatopolifosfato e Ca-alginato-glicerol-polifosfato (Figura 1). O pico largo observado em 3371 cm-1 deve-se pelo alongamento da ligação O-H presente em todas as amostras, já que todas possuem grupos hidroxila. Os picos que aparecem entre 1595 e 1604 com-1 referem-se, respectivamente, à vibrações de alongamento assimétrico e simétrico de grupos carboxila livres. O pico observado em 1030 com-1 foi atribuído ao alongamento da ligação C-O e encontra-se principalmente em cápsulas de glicerol. Os picos observados em 952, 1109 e 1229 cm-1 são característicos de peletes com polifosfato. Assim, os espectros de FTIR das cápsulas de alginato-Ca-glicerol-polifosfato confirmou a interação entre o glicerol, alginato e o polifosfato. Esta interação nos mostra que a parte de polifosfato e de glicerol da estrutura de esferas e não é liberado no processo de encapsulamento e secagem. As amostras foram avaliadas pela atividade de água (aW) que foram variadas, dependendo da composição das esferas, como pode ser visto no gráfico de superfície (Figura 2). No diagrama de Pareto, foi possível observar que apenas a concentração variável de polifosfato foi significativa na variável de resposta aW. Figura 1. Espectro de Infravermelho de três peletes com matrizes de diferentes composições. Figura 2. Superfície de resposta para a variável de atividade de água. A atividade de água aumenta com o aumento da porcentagem de polifosfato e, consequentemente, com a diminuição de alginato, para um total de polímero de 2,0%. Apesar das variáveis de glicerol não mostrarem resultado estatístico significante na resposta variável em concentrações mais elevadas de polifosfato, maiores concentrações de glicerol tendem a afetar positivamente a atividade de água. CONCLUSÕES Devido à habilidade para formar ligações de hidrogênio com moléculas de água, as cápsulas com altas concentrações de polifosfato e glicerol tendem a manter uma alta atividade de água mesmo depois de secas, o que favorece a manutenção da viabilidade da célula. Assim, concentrações em torno de 50% de polifosfato e 50% de alginato para um total de 2,0% de polímeros, adicionando 1,0% de glicerol pode ser estudada para a imobilização de esporos de fungos, assegurando a viabilidade dos esporos a um longo período de estocagem. REFERÊNCIAS Abbas S. et al (2012) Ascorbic Acid: Microencapsulation Techniques and Trends-A Review. Foods Review International, 28, 343-374. Brannon - Peppas, L. (1993) Controlled release in the food and cosmetics industries. In: Polymeric delivery systems: properties and applications. Oxford: Oxford University Press. chapter 3 42-52. Cassidy M.B. et al (1996) Environmental applications of immobilized microbial cells: a review. J. Ind. Microbiol. 16, 79-101. Jackson, L. S. et al. (1991) Microencapsulation and Food Industry. LWT - Food Science and Technology, London, 24 (4) 289-297. Jiménez-Pranteda, M. L. et al. (2012) Stability of lactobacilli encapsulated in various microbial polymers. Journal of Bioscience and Bioengineering 113(2), 179–184. AGRADECIMENTOS Ao suporte financeiro e técnico para essa pesquisa pela FACEPE, CETENE, FINEP e CNPQ .
Download