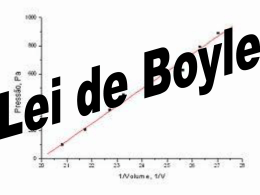
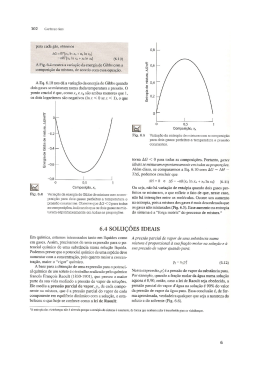
I – GASES Universidade Federal do Espírito Santo Centro Universitário Norte do Espírito Santo Departamento de Ciências Naturais Profa. Gilmene Bianco Vocês sabem de onde vem o gás que enche o Airbag em caso de colisão? Que gás é este? Sob uma mesma pressão e temperatura, gases diferentes possuem densidades diferentes. O gás hélio, por exemplo, tem uma densidade de 161 mg/L nas CATP. Já o mesmo volume, nas mesmas condições, o gás nitrogênio tem uma densidade de 1,129 g/L, nas CATP. E é justamente esta propriedade (diferenças nas densidades) que permite-nos voar em um balão de gás. Isto é possível pois o balão contém um gás de densidade menor do que a densidade da troposfera - tal como gás hélio, hidrogênio ou mesmo o ar atmosférico aquecido. Boyle foi o primeiro cientista a conduzir experimentos físico-químicos controlados e a publicar seus resultados com detalhes experimentais elaborados, observações criteriosas e conclusões fundamentadas, tal como nos papers atuais! Deduza uma equação da pressão na base de uma coluna de líquido de densidade (massa específica) ρ e altura h na superfície da Terra. P x V = constante A lei de Boyle prevê que a densidade de um gás seja diretamente proporcional à pressão, exercida sobre este. A isoterma acima ilustra outra observação de Boyle: o volume de um gás tende ao infinito quando a pressão tende a zero; e o volume tende a zero quando a pressão tende ao infinito. Um gás real tem comportamento próximo ao do gás ideal nas regiões onde a pressão tende a zero. Lei de Boyle Quando você suga na extremidade do canudo, você provoca uma redução na pressão do ar no interior do canudo. A pressão atmosférica, atuando na superfície do líquido, faz com que ele suba no canudinho. Algumas bombas, para elevação de água, têm seu funcionamento baseado neste mesmo princípio. Lei de Boyle Lei de Boyle Lei de Boyle Lei de Charles O que impressiona nas curvas isobáricas de Charles, é o que acontece quando se extrapola as curvas para temperaturas menores: todas, independentemente da pressão, culminam no mesmo valor de T para o volume zero: -273,15 °C. O que foram confirmados e publicados por outro francês, o Joseph-Louis Gay-Lussac, um gás teria um volume nulo (zero) se a temperatura for de -273,15 °C. O volume é diretamente proporcional ao número de partículas de gás, ou seja, quanto maior for o número de moles do gás, maior será o seu volume, nas mesmas T e p. Massa molar do ar=28,6 g/mol A pressão parcial pode ser obtida pela fração molar (X) do gás na mistura. Então, p(N2) = X(N2).p(total) Pressão de Vapor e Umidade Relativa Domingo, 01/03, manhã poucas nuvens Temperatura: 21 °C Umidade relativa: 74% A umidade relativa do ar, que neste dia era de 74%. O que significa este número? Este número indica a relação entre a quantidade de água (g) que existe atualmente no ar e a máxima quantidade possível de água (g) para esta temperatura. Esta quantidade máxima é fruto da pressão de vapor da água, que é uma função de Temperatura. Pressão de Vapor e Umidade Relativa umidade relativa = pvapor(H2O)/p°vapor(H2O) Se a umidade relativa é de 74%, então a pressão real de vapor da água em São Mateus no dia 07 de agosto era de (0,74 x 18,65) mmHg. P = 13,80 mmHg Este valor é, na verdade, a pressão de vapor de equilíbrio da água a uma temperatura menor: 17°C. Qualquer temperatura abaixo deste valor irá forçar a uma parcela das moléculas de água dispersas no ar a se condensar em um líquido - o orvalho. R: 0,102 atm Efusão e Difusão de Gases A observação feita por Graham: que a velocidade de difusão ou efusão de um gás era inversamente proporcional ao quadrado de sua massa molar. Ou seja, quanto mais pesado for o gás, menor sua velocidade de efusão. Isto é uma consequência da lei de Graham: ocorre porque o gás do balão azul é o hélio, de menor massa molar que o gás do balão vermelho, o nitrogênio. Logo, a velocidade de efusão do gás do balão azul através da válvula é maior do que a do gás do balão vermelho. Exercícios 1- Qual seria a pressão total de uma mistura preparada adicionando-se 20,0 cm3 de N2, a 0 °C e 98,7 kPa, a 30,0 cm3 de O2, a 0°C e 85,3 kPa, em um recipiente de 50,0 cm3 a 0°C? 2- Determine a massa em gramas de : (a) 1,00L de gás Oxigênio nas CNTP, (b) 636 mL de N2 a 3,55 atm e 68 C. 3- Um certo gás, X, efunde através de um orifício de agulha, a velocidade de 2,43 mL min.-1. Se metano, CH4, efunde através de um orifício de agulha sob condições comparáveis à velocidade de 6,68 mL min.-1, qual a massa molecular de X? R1= 90,7 kPa; R2=1,43 e 2,26g e R3=121 g/mol
Download