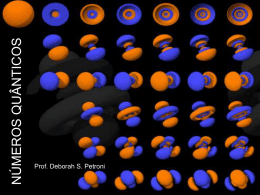
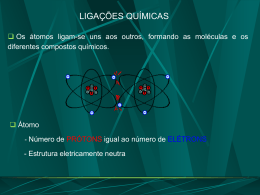
Um modelo é uma idéia que nos possibilita imaginar algo a que não temos acesso direto e o seu comportamento sob diferentes situações 1ª série Prof. Márcia P. Fiuza DEMÓCRITOS REPRESENTAÇÃO DA MATÉRIA O filósofo grego que viveu no século IV a.c, sustentou que toda matéria é constituída por partículas pequenas e indivisíveis às quais chamou de átomos e na sua ausência temos o espaço vazio (vácuo), essa idéia entretanto, não prevaleceu e ficou, de certa forma, marginalizada durante mil anos. Hoje em dia grande parte dessas idéias ainda prevalecem e são usadas. LEIS PONDERAIS CONSERVAÇÃO DA MASSA (LAVOISIER): Lavoisier verificou que a massa total dos reagentes era igual à massa total dos produtos, essa idéia geralmente é resumida com o seguinte enunciado; Na natureza nada se cria, nada se perde tudo se transforma em um sistema fechado. Curiosidade: Lavoisier pertencia à nobreza, graças a um título adquirido por seu pai. Foi um dos principais liberais e racionalistas do Iluminismo. Por estar associado a cobrança de impostos, foi decapitado em 8 de maio de 1794 durante a revolução francesa. PROPORÇÕES FIXAS (PROUST): Proust havia determinado que uma substância sempre apresenta composição constante. 1C + 2 H2 CH4 Se aumentarmos a quantidade de reagente continuaremos a ter o mesmo produto Obs: Se a proporção natural existente entre os reagentes não for respeitada, a reação ocorrerá, entretanto a parte em excesso não será consumida. MODELO ATÔMICO DE JOHN DLTON Quem primeiro apresentou a essa pergunta uma resposta baseada em experiências foi o cientista inglês JOHN DALTON em 1808: Ele propôs que qualquer matéria seria constituída de pequeníssimas partículas esféricas chamadas átomos. Esses átomos seriam maciços, ou seja, completamente cheios, sem nenhum espaço vazio no seu interior Átomos de um mesmo elemento tal como imaginados por Dalton Átomos de elementos diferentes segundo Dalton Segundo Dalton todas as reações químicas consistem na separação, combinação ou rearranjo de átomos, mas nunca na destruição ou criação desses: + uma molécula de nitrogênio três moléculas de hidrogênio duas moléculas de amônia Observando essa figura podemos tirar três conclusões: Os átomos que estão no primeiro membro são os mesmos que estão no segundo membro O número de átomos de cada elemento do primeiro membro é igual ao número de átomos desse elemento no segundo membro, ou seja, dois átomos de nitrogênio e seis átomos de hidrogênio No primeiro membro os átomos estão agrupados de um certo modo e,no segundo, estão agrupados de um modo diferente O modelo atômico proposto por DALTON foi aceito pelos cientistas por cerca de 90 anos. Porém, novas descobertas, no final do sec. XIX, levaram à conclusão de que o átomo não era indivisível, mas possuia uma estrutura interna: O átomo era, então, constituído por partículas ainda menores do que ele próprio e que foram denominadas partículas subatômicas DESCOBERTA DO ELÉTRON A descoberta dos elétrons aconteceu com a invenção do tubo de raios catódicos, um precursor do tubo atualmente usado nos televisores. Partículas carregadas negativamente, os elétrons, são emitidos pelo cátodo e atraídos, para uma placa com carga positiva. a) um raio catódico produzido num tubo de descarga b) um raio é defletido por um campo magnético OBS: O raio em si é invisível, sendo a cor verde devido à luminescência do sulfeto de zinco que cobre a parte interior do tubo e é produzida pelo impacto dos raios neste TUBO DE TV CONVENCIONAL 1: Canhões de elétrons e lentes eletrônicas de focalização 2: Bobinas defletoras (deflexão eletromagnética) 3: Anodo de alta tensão 4: Máscara de sombra 5: Detalhe da matriz de pontos coloridos RGB (vermelho, verde, azul) Modelo atômico de Thomson Diante da existência dos protons e dos elétrons THOMSON propôs um modelo que sugeria que a massa total do átomo seria devida, quase que totalmente às cargas positivas. Essas estariam espalhadas, uniformemente, por toda uma esfera formando uma massa compacta. Os elétrons estariam aderidos a essa massa, espaçados de um modo uniforme, como um “pudim de passas”: o pudim seria a massa carregada positivamente e as passas, seriam os elétrons. O modelo atômico de THOMSON foi aceito até 1911, quando uma interessante experiência feita por RUTHERFORD conseguiu descartar de vez o modelo atômico de esfera rígida EXPERIÊNCIA DE RUTHERFORD Seu objetivo era verificar se os átomos eram realmente maciços como afirmou THOMSON OBSERVAÇÕES FEITAS POR RUTHERFORD: a) A grande maioria das partículas atravessava a lâmina sem sofrer desvios ou sofrendo desvios muito pequenos em relação à trajetória inicial. b) Algumas partículas conseguem atravessar a lâmina, porém sofrendo desvios muito fortes na sua trajetória c) Uma quantidade muito pequena de partículas não consegue atravessar a lâmina e volta para o mesmo lado de onde são lançadas CONCLUSÕES TIRADAS POR RUTHERFORD A maior parte do átomo deveria ser vazia, onde se localizavam os elétrons (massa desprezível), por isso as partículas podiam atravessar. Os desvios significativos de poucas partículas (carga positiva) o fez concluir que o núcleo é pequeno e positivo, devido à repulsão de cargas iguais. No átomo existiria uma região maciça (o núcleo), por isso algumas partículas voltavam. Descoberta do nêutron Existe um terceiro tipo de partícula no átomo, o nêutron, sem carga elétrica e com massa praticamente igual à do próton. Os nêutrons foram previstos por RUTHERFORD em 1911 mas, comprovados experimentalmente, somente em 1932, pelo inglês CHADWICK. Descoberta do próton Experiências comprovaram que quando o átomo perde elétron, ele adquire carga positiva e que essa carga positiva fazia parte do próprio átomo. A ela foi dado o nome de próton Modelo atômico de RUTHERFORD O átomo seria semelhante ao sistema solar e constituído por duas regiões distintas: O NÚCLEO - região central de carga positiva contendo praticamente toda a massa do átomo. Era constituído pelos prótons. A ELETROSFERA - região quase sem massa envolvendo o núcleo e contendo os elétrons (carga negativa) CRÍTICAS AO MODELO DE RUTHERFORD O modelo de Rutherford sofreu muitas críticas na época em que foi elaborado. Uma delas foi a de que partículas com carga negativa (os elétrons), em movimento, perdiam energia. Dessa maneira, as órbitas desses elétrons iam diminuindo gradualmente até eles se chocarem com o núcleo,o que não ocorre, evidentemente. Em 1913, NIELS BOHR conseguiu adaptar o modelo de Rutherford, resolvendo as principais críticas levantadas a ele. Para entender esse novo modelo é necessário entender o que é um espectro eletromagnético. No nosso dia-a-dia, nos deparamos com vários tipos de ondas eletromagnéticas. Algumas percebidas pelos nossos sentidos, como a visão, outras não, mas todas exercem influência sobre os seres vivos. ESPECTRO ELETROMAGNÉTICO É O CONJUNTO DE TODAS AS ONDAS ELETROMAGNÉTICAS EXISTENTES ESPECTRO CONTÍNUO É o espectro produzido tanto pela luz do sol como pela luz emitida pelo filamento incandescente de uma lâmpada comum. ESPECTRO DESCONTÍNUO Quando um tubo contendo gás a baixa pressão, recebe uma descarga elétrica, ele emite luz. O espectro produzido por essa luz é descontínuo e formado por uma série de linhas chamadas raias. Compare os dois espectros contínuo descontínuo Os físicos daquela época chegaram à conclusão de que o espectro descontínuo de cada elemento é característico e serve para identificá-lo: 07z01an1 Uma das maiores contribuições de Bohr à ciência foi explicar porque os gases emitem ou absorvem radiação com determinados comprimentos de onda, isto é, descontinuamente, e não numa faixa contínua. BOHR RELACIONOU AS LINHAS DO ESPECTRO DESCONTÍNUO COM AS VARIAÇÕES DE ENERGIA DOS ELÉTRONS CONTIDOS NOS ÁTOMOS DESSES GASES. MODELO ATÔMICO DE RUTHERFORD-BOHR Após relacionar as linhas espectrais com os níveis de energia das eletrosferas dos átomos, Bohr propôs um modelo atômico que mantinha as principais características do modelo de Rutherford : Em um átomo os elétrons existem em algumas órbitas circulares e de energia constante. Um elétron, na sua órbita, não perde e nem ganha energia espontaneamente. Um elétron pode receber energia de uma fonte externa somente em unidades discretas. Quando o elétron retorna à sua órbita de origem ele perde energia na forma de onda eletromagnética. Essa energia corresponde à diferença de energia entre as órbitas envolvidas e é uma linha no espectro de emissão. 07m07an2 07m15an1 TESTANDO SEUS CONHECIMENTOS UFMG 2004 - O teste de chama é uma técnica utilizada para a identificação de certos átomos ou íons presentes em substâncias. Nesse teste, um fio metálico é impregnado com a substância a ser analisada e, em seguida, é colocado numa chama pouco luminosa, que pode assumir a cor característica de algum elemento presente nessa substância. Este quadro indica os resultados de testes de chama, realizados num laboratório, com quatro substâncias: 1. INDIQUE, em cada caso, o elemento responsável pela cor observada. 2. Utilizando um modelo atômico em que os elétrons estão em níveis quantizados de energia, EXPLIQUE como um átomo emite luz no teste de chama. (Deixe claro, em sua resposta, o motivo pelo qual átomos de elementos diferentes emitem luz de cor diferente .) Modelo Atual ou Orbital Princípio da incerteza de Heisenberg: é impossível determinar com precisão a posição e a velocidade de um elétron num mesmo instante. Orbital é a região onde é mais provável encontrar um életron O elétron gira em torno do núcleo em região denominada orbital, que comporta no máximo 2 elétrons s = sharp = 2 elétrons (1 orbital) p = principal = 6 elétrons (3 orbitais) d = diffuse = 10 elétrons (5 orbitais) f = fundamental = 14 elétrons (7 orbitais) Os números quânticos Para designar a camada, a subcamada e o orbital de um elétron podemos utilizar os números quânticos . Esses números identificam cada elétron do átomo, porém, não existem dois elétrons com o mesmo conjunto de números quânticos (princípio da exclusão de Pauli). Número quântico principal (n) - O número quântico principal, representado por n, indica a camada em o elétron se encontra, e só pode assumir valores inteiros e positivos. Número quântico secundário ou azimutal ( l ) (letra L)- O número quântico azimutal, representado por l , especifica a subcamada e, assim, a forma do orbital. Pode assumir os valores 0, 1, 2 e 3, correspondentes às subcamadas s , p , d , f Número quântico magnético (m l ) - O número quântico magnético, representado por ml , fornece informações sobre a orientação de um orbital no espaço. Pode assumir valores inteiros de + l a - l (letra L). Por exemplo, para uma subcamada d ( l = 2), m pode ser igual a -2, -1, 0, +1 ou +2, cinco valores que correspondem aos cinco orbitais da subcamada d. Número quântico spin ( m s ) - O número quântico spin, representado por ms , especifica o spin do elétron e possui valor + 1/2 ou - 1/2. Teoria da Mecânica Ondulatória Em 1926, Erwin Shröringer formulou uma teoria chamada de "Teoria da Mecânica Ondulatória" que determinou o conceito de "orbital" . Orbital é a região do espaço ao redor do núcleo onde existe a máxima probalidade de se encontrar o elétron. O orbital s possui forma esférica ... ................ e os orbitais p possuem forma de halteres...... Diagrama de Linus Pauling A distribuição eletrônica segue uma ordem crescente de energia em relação aos subníveis. As configurações eletrônicas Até hoje são conhecidas sete camadas eletrônicas, e suas subcamadas. Os elétrons são distribuídos em um átomo segundo uma regra conhecida como regra de Hund : Ao ser preenchida uma subcamada, cada orbital dessa subcamada recebe inicialmente apenas um elétron; somente depois de o último orbital dessa subcamada ter recebido seu primeiro elétron começa o preenchimento de cada orbital semicheio com o segundo elétron. Por exemplo: para o átomo de potássio (19K): 1s2 2s2 2p6 3s2 3p6 3s1 Os números sobrescritos na letra correspondem ao número de elétrons existentes na subcamada. Fazendo a distribuição eletrônica nos orbitais para o potássio, teremos: Cada seta indica um elétron. Perceba que, em cada orbital, quando existem dois elétrons, são sempre de spins opostos. Geralmente, os átomos se ligam uns aos outros, de modo a ter emparelhados todos os seus elétrons. Nesse caso, o potássio pode perder seu elétron 3s, ficando assim com 5 subcamadas completas. O elétron de maior energia, chamado elétron de diferenciação, é o último elétron distribuído no preenchimento dos orbitais, de acordo com a regra de Hund. REFERÊNCIA BIBLIOGRAFICA CANTO, Eduardo Leite, TITO, Francisco Miragaia Peruzzo. Química na Abordagem do Cotidiano, 4 ª Edição – São Paulo: Moderna, 2006. ALVARENGA, Beatriz, MÁXIMO, Antonio. Curso de Física, Vol. 1 e 2, Editora: Scipione, 2006.
Download