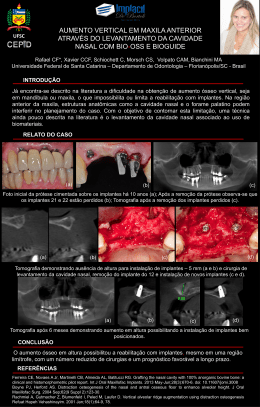
DEPARTMENT OF HEALTH & HUMAN SERVICES Public Health Service Food and Drug Administration 9200 Corporate Boulevard Rockville MD 20850 June 27, 1995 UPDATE: STUDY OF TODA RELESED FROM POLYURETHANE FOAM-COVERED BREAST IMPLANTS Bristol-Myers Squibb Co. of New York, N.Y., has completed an FDA-required study of the release of the chemical 2,4-toluenediamine (also called “TDA”) from the polyurethane foam the covers some silicone gel-filled breast implants. TDA has been shown to be a carcinogen in animals. Based on the results of the Britol-Myers Squibb study, it appears unlikely that any woman with polyurethane foam-covered breast implants will get cancer a result of exposure to TDA. Background In 1991, FDA scientists demonstrated that it was possible for polyurethane to break down under laboratory conditions to form TDA at body temperature; it had formerly been thought that the chemical breakdown could only occur at very high temperatures and extremes of pH. Because of concern about the potential for TDA to be released into women’s bodies, BristolMyers Squibb’s subsidiary, Surgitek, Inc (Medical Engineering Corp.), stopped sales of the polyurethane foam covered implants, MemeTM and RepliconTM, in April 1991. About 110,000 women had the polyurethane foam-covered breast implants at that time. The products never returned to the market. In response to FDA’s concern that it is possible for the polyurethane foam to break down in the body, Surgitek and Bristol-Myers Squibb agreed to conduct a study to clarify whether this actually happens and, if so, to measure the quantities of TDA produced. This was done by looking for TDA in the urine and blood serum of women with MemeTM and RepliconTM implants. Preliminary results became public in September 1993. Results of the Study Final results from the Bristol-Myers Squibb study show that small amounts of TDA. were present in the urine of the majority of women in the study who had polyurethane foam-covered breast implants. The company tested the urine and blood serum of 61 women with the polyurethane foamcovered implants and 61 women without implants (controls).Using a highly sensitive test method, very small amounts (parts per trillion) of “free” TDA were detected in the urine of about 80 percent of the women with the foam-covered implants. Free TDA in even smaller amounts was occasionally found in the urine of about 13 percent of the women without the implants. This suggests that the environment may also be a source of TDA exposure. No free TDA was found in the blood serum of the women with foam-covered implants in Bristol-Myers Squibb’s study; however, there is concern that some loss of TDA may have occurred during the separation of serum form the blood. Consequently, the data on the levels of TDA found in urine were used to assess the potential risk of cancer from exposure to TDA. Based on the very small amounts of TDA found in urine, the potential cancer risk, if any, is likely to be negligible. FDA’s estimate of excess cancer risk from exposure to TDA is about 1 in 1 million over a woman’s lifetime. It is unlikely that even one of the estimated 110,000 women with polyurethane foam-covered implants will get cancer as a result of exposure to the TDA. This value is consistent with Bristol-Myers Squibb’s estimate of the excess cancer risk from exposure to TDA. The results of Bristol-Myers Squibb’s study support FDA’s recommendation that women wit polyurethane foam-covered breast implants should not have the removed based solely on concerns about cancer form exposure to TDA. Based on the estimates discussed above, the health risk of surgical removal of the implants would be far greater than the risk of developing cancer. FDA recommends that women who are not experiencing problems with their implants should no consider explantation. DEPARTAMENTO DE SAUDE E SERVIÇOS HUMANOS Public Health Service Food and Drug Administration 9200 Corporate Boulevard Rockville MD 20850 June 27, 1995 COMUNICADO: ESTUDO DE TDA LIBERADO DE IMPLANTES MAMÁRIOS REVESTIDOS DE ESPUMA DE POLIURETANO A companhia BRISTOL-MYERS SQUIBB de Nova York, estado de Nova York, concluiu um estudo sobre a liberação do produto químico toluenediamina 2,4 (também chamado TDA) da espuma de poliuretano que veste alguns implantes mamário cheios de gel de silicone. Tem se comprovado que TDA é cancerígeno em animais. Baseado nos resultados do estudo da Bristol-Squibbs, parece improvável que qualquer mulher com implantes mamários revestidos de espuma de poliuretano contraia câncer decorrente de exposição ao TDA . Histórico Em 1991, cientista da FDA demonstraram que era possível que o poliuretano se descompusesse sob condições de laboratório para formar o TDA à temperatura do corpo. Antes, acreditava-se que a decomposição química só podia ocorre a altíssimas temperaturas e extremos do pH. Dada a preocupação sobre o potencial de o TDA ser liberado no corpo das mulheres, a subsidiária da Bristol-Myers Squibb, Surgitek Inc. (Medical Engineering Corp) suspendeu as vendas dos implantes revestidos de espuma de poliuretano MemeTM em abril de 1991. Cerca de 110.000 mulheres tinham os implantes mamários revestidos de espuma de poliuretano na época. Os produtos nunca regressaram ao mercado. Em resposta à preocupação da FDA sobre a possibilidade de a espuma de poliuretano se decompor dentro do corpo, a Surgitek e a Bristol-Myers Squibb concordaram em empreender um estudo para esclarecer se isto de fato ocorria e caso afirmativo, para medir as quantidade da TDA produzido. Isto foi realizado buscando o TDA na urina e soro sanguíneo de mulheres com implantes MemeTM e RepliconTM. Os estudo preliminares se tornaram públicos em setembro de 1993. Resultado do Estudo Os resultados finais do estudo de Bristol-Myers Squibb acusam que pequenas quantidades de TDA estavam presentes na urina da maioria das mulheres pesquisadas com implantes mamário revestidos de espuma de poliuretano. A empresa testou a urina e soro sanguíneo de 61 mulheres com os implantes revestidos de espuma de poliuretano e 61 sem implantes (controles). Usando um método de testagem altamente sensível, quantidades muito pequenas (partes de trilhão) de TDA livre foram detectadas na urina de cerca de 80% das mulheres com os implantes revestidos de espuma. Quantidades até mesmo menores de TDA livre forma ocasionalmente encontradas na urina de cerca de 13% das mulheres sem implantes. Isto sugere que o meio-ambiente também pode ser fonte de exposição ao TDA. Nenhum TDA livre foi achado no soro sanguíneo das mulheres com implantes revestido de espuma de poliuretano no estudo da Bristol-Myers Squibb; no entanto, existe preocupação de que alguma perda de TDA possa ter ocorrido durante a separação do sangue. Conseqüentemente, os dados sobre os níveis de TDA achado na urina foram usados para avaliar o risco potencial de câncer decorrente da exposição ao TDA. Baseando-se nas quantidades muito pequenas de TDA achado na urina, o risco potencial de câncer, se existe, é provavelmente desprezível. A FDA calcula que o risco excessivo de câncer decorrente da exposição ao TDA é de cerca de 1 em 1 milhão no curso da vida de uma mulher. É improvável que até mesmo uma das 110.000 mulheres estimadas como portadoras de implantes revestidos de espuma de poliuretano contraia câncer em decorrência da exposição ao TDA. Este valor é consistente com a estimativa da Bristol-Myers Squibb do risco excessivo de câncer decorrente da exposição ao TDA. Os resultados do estudo da Bristol-Myers Squibb apóiam a recomendação da FDA no sentido de que as mulheres com implantes revestidos de espuma de poliuretano não devem tirálos unicamente baseados em preocupações sobre câncer decorrentes de exposição ao TDA. Baseado nas estimativas apresentadas acima, o risco à saúde da remoção cirúrgica dos implantes seria muito maior que o risco de contrair câncer.A FDA recomenda que as mulheres que não estejam experimentado problemas com seu implantes não devem cogitar a explantação.
Download