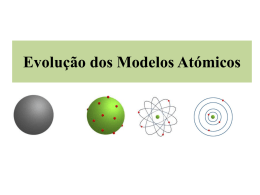
“Eurivaldo” Euri (p/os amigos) Val (p/ os inimigos) Do (p/ todo mundo) Minha formação Universidade alemã de Waiz Futherr Oi, eu sou o Bisquit . E,eu sou o Panetone A química estuda a matéria e suas transformações Matéria é tudo que tem massa e ocupa determinado volume (tudo - som e luz ) Matéria Objeto Corpo Toda matéria que o homem conhece é feita por átomos... (tabela periódica) Mas afinal , o que são os átomos??? “Não divisível” “Unidade formadora da matéria” (Quebra cabeça do criador) História dos átomos Parte 1 Modelos atômicos não quânticos A história do átomo (e seus teorizadores) A evolução do modelo atômico se deu paralelamente ao avanço tecnológico e se ainda hoje nós não chegamos ao “modelo atômico perfeito” com certeza estamos bem a frente das teorias de Lêucipo e Demócrito , ou da “bola de bilhar” de Dalton ... 1° modelo atômico (1808) Átomo contínuo,maciço, descargado, indivisível. “Átomos do mesmo elemento têm a mesma massa.” William Crooques (1886) Criou o tubo de raios catódicos (tubo c/ gás em baixas pressões e voltagem elevadíssima) que deu um impulso ao estudo atômico e possibilitou a descoberta do ELÉTRON (e-) Óia Euri,isso aí parece uma televisão... Thomson (1897) Propôs (a partir de Crookes)que a massa do átomo seria devido,quase que totalmente,às cargas (+) ,estas espalhadas uniformemente , por toda uma esfera formando uma massa compacta e uniforme . Na sua superfície estariam os elétrons. Pudim de passas átomo cargado , maciço e indivisível Eugene Goldstein(1900) Descobriu os prótons , partículas 2000 vezes mais pesadas que os elétrons , nucleares , e cargadas positivamente. Rutherford (1908) Bombardeou uma finíssima folha de ouro com partículas alfa (+), liberadas em processos radioativos e verificou que a maioria das partículas atravessava a folha de ouro sem se desviar, enquanto algumas poucas eram desviadas ou violentamente rebatidas.Propôs um novo modelo atômico. Rutherford(1908) Átomo = sistema solar , formado por duas regiões ,núcleo(+) e eletrosfera(-) ,descontínuo . A matéria é descontínua(vazio). Chadwich (1932) Descobriu os nêutrons ,partículas sem carga , nucleares,aos quais foram atribuídos a estabilidade do núcleo. Os átomos são feitos de 3 partículas subatômicas •Próton (carga +1, massa =1) •Nêutrons (carga 0 , massa = 1) •Elétron(e-) (carga-1,massa=1/2000) Nota: Os valores citados são relativos. Na verdade me=9.10-27g mP=1,6.10-23g Qe,P=1,6.10-19C O núcleo possui raio de 10.000 a 100.000 vezes menor que a eletrosfera Ciranda dos átomos Dalton ficou sem carga Com sua bola de bilhar Thomson com pudim de passas Fez Dalton se carregar Rutherford ficou vazio Como sistema solar Hoje tem dualidade Órbitas para quântizar Vejamos agora algumas informações importantes • Admite-se que a estabilidade nuclear esteja ligada a relação N/P • O “H” é o único átomo estável sem nêutrons • Do 2He ao 20Ca a relação N /P = 1 • Quanto maior N/P de um átomo , + instável ele será • O n° de prótons de um átomo , determina quem ele é ,também é chamado de n° atômico (representado pela letra Z na tabela). Z=N°prótons=n°atômico(Rg atômico) N = N° de nêutrons A=N°de massa = prótons + nêutrons A=Z+N ( azno ) “A” representa ,numericamente,a massa aproximada do átomo • O n° atômico é representado abaixo e a esquerda do elemento,e seu n° de massa acima a esquerda ou a direita do elemento , Ex: 11H ou 1H1 . Elemento - É o conjunto de átomos c/ o mesmo n° atômico. •Os e- não participam do n° de massa pois são o “pum” do átomo ( massa). • Durante as reações químicas ,o núcleo não se altera , somente os elétrons. Isótopos (“mesmo lugar” na tabela)átomos c/ o mesmo N°de prótons ( mesmo elemento ),e n° massa .A maioria dos elementos tem 2 ou+ isótopos.Ex: 11H , 21H , 31H . (leve,deutério,trítio)(As 12 H2O) 21 elementos possuem isótopo único Isótonos–átomos c/ n° de nêutrons =. Isóbaros – átomos c/ n° de massa =. Isoeletrônicos-átomos c/ = n° de e-. Na tabela periódica os átomos são demonstrados em sua forma neutra (mesmo número de e- e de prótons) , porém , em muitas situações os átomos ganham ou perdem e-, tornando-se íons. Como o e- é negativo, ao perder e- o átomo torna-se positivo , e ao ganhar etorna-se negativo. (Ex : Fe2+, H1+...) Íon positivo (Cátion) Íon negativo ( Ânion) Íons importantes H0 , H+ • Fe2+ e o Fe3+ • Cu0 , Cu2+ 0 3+ 6+ • O Cr , Cr , Cr Obs1:Quando o átomo perde 1e= íon monovalente , 2e- bi ,etc... Obs2:Há íons simples e compostos Você sabia ... Que os caminhões , aviões , carros de fórmula 1 possuem “fio terra” p/ descarga de eacumulados? Os relâmpagos são gerados à partir de moléculas de ar ionizadas. Átomo quantizado •Elétron como partícula/onda (dualidade); •Elaborado por uma cúpula de cientistas; •Elétrons situados em regiões prováveis da eletrosfera (orbitais) (Heisenberg/incerteza); •Importante é a energia dos e-; •Quantizado. Niels Bohr (1913) • Elétrons em órbitas constantes (Camadas ou níveis e subníveis) • Cada nível tem um valor de energia (quanto+afastado do núcleo>a energia e-) • Elétrons s/ alteração espontânea de níveis; • Um e- só muda de camada por aumento (excitação) ou diminuição de energia do mesmo (emissão de luz ou UV); • A diminuição de energia de um e- se dá de forma descontínua(Quântun/fóton); •Elevada estabilidade nuclear. Em 1916 , Linus Pauling elaborou um diagrama representativo da ordem crescente de energia dos níveis e subníveis de energia dos elétrons de um átomo. Diagrama de Linnus Pauling 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 6s2 5p6 6p6 5d10 6d10 (P/ conhecermos a energia dos e- dos átomos ) 4f14 Os nºs grandes são a camada 5f14 (1,2,3,4,5,6,7 ou K,L,M,N,O,P,K) As letras são os subníveis (s,p,d,f ou 0,1,2,3) 7s2 Os nºs pequenos são nºs de enos subníveis. • P/ fazer a distribuição eletrônica de um íon , retira-se ou acrescenta-se os elétrons na última camada / nível, também chamada de camada de valência. Se a”CV” tiver subníveis,retira-se e- do + energético. • Átomos no “estado fundamental” têm os e- com menor energia.(configuração normal) • Átomos excitados possuem configuração do estado fundamental. • Íons têm sobra ou falta de e- em relação ao átomo neutro. Propriedades químicas dos elementos dependem Configuração eletrônica na “CV” A partir da configuração pode-se perguntar muitas coisas no vestibular. Cuidado com a configuração “em camadas” • Configuração e orbitais e- buscam orbitais vazios c/spin = (Hund) • Configuração e n° magnético • Orbitais e spin Num átomo 2e- nunca terão os 4 n°s quÂnticos iguais (Pauli) • Configurações irregulares O que são? Número Quântico Beleza Enquanto o “n” de 1 a 7 me dizer O número quântico principal Mostrando o nível legal O “L” me mostra com s,p,d,f, O subnível orbitário Do número quântico secundário Estudando coisa pra chuchu O “m” é o número magneticú Vou mostrar , Que com o Spin –1/2 O orbital não está cheio Outros colaboradores p/ o desenvolvimento do modelo atômico •1924 – Luis de Broglie –”O e- se comporta como partícula e onda (dualidade). •1926 –Schrodinger,princípio da incerteza; •1931 – Dirac confirmou existência das anti partículas abrindo caminho p/ estudos no campo do teletransporte , holografia , computadores quânticos , supercondutores , e outros ... •1937 – Confirmação de mais 8 partículas subatômicas . Fórmulas importantes • Cavendish relacionou a frequência (f) de onda emitida por um átomo excitado e o seu tamanho (Z). f=3/4R (Z-1)2 • Relação entre comprimento de onda (), (f) , e velocidade de propagação () = . f • Relação entre massa de uma partícula, sua e (comportando-se como onda). = h / m. • Energia de um e- emitido (fóton) E = h.f Dalton Rutherford 1% 0% % em massa dos elementos no universo 1% % em massa dos elementos na atmosfera Hidrogênio 1% Hélio 37% 3,00% 18,60% Nitrogênio Oxigênio 60% Oxigênio Neônio outros Carbôno 78,40% outros % em massa dos elementos no planeta 13,00% 7,00% 15,00% Silício Oxigênio Ferro 30,00% 35,00% % em massa dos elementos no corpo humano 7,00% 18,00% 10,00% Oxigênio Magnésio outros Carbono Hidrogênio 65,00% outros Thomson Crookes Geometria dos orbitais moleculares py s px pz Hoje se sabe que matéria nada mais é que energia acumulada
Download