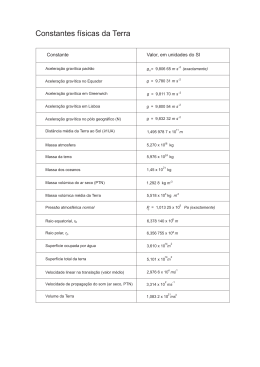
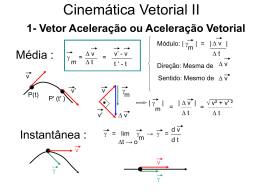
Exame de Ingresso para Estudantes Internacionais Matriz da prova de Física e Química A Duração da prova: 120min. Tolerância: 30 minutos Competências O aluno deverá ser capaz de: Conteúdos Cotação (pontos) Química 10º ano – Conhecimento e compreensão de Unidade 1: Das estrelas ao átomo 1.1. Arquitetura do Universo conceitos; 1.2. Espectros, radiações e energia – Compreensão das relações existentes 1.3. Átomo de H e estrutura atómica 1.4. Tabela Periódica – organização dos entre aqueles conceitos e que elementos químicos permitiram estabelecer princípios, leis e Unidade 2: Na atmosfera da Terra: radiação, matéria e estrutura teorias; 2.1. Evolução da atmosfera breve história – Aplicação dos conceitos e das relações 2.2. Atmosfera: temperatura, pressão e densidade em função da altitude entre eles a situações e a contextos 2.3. Interação radiação-matéria diversificados; 2.4. O ozono na estratosfera 2.5. Moléculas na troposfera - espécies – Seleção, análise, interpretação e maioritárias (N2, O2, H2O, CO2) e avaliação críticas de informação espécies vestigiais (H2, CH4, NH3) apresentada sob a forma de textos, de Estrutura Física 10º ano gráficos, de tabelas, entre outros Unidade 1: Do Sol ao aquecimento 1. Energia – do Sol para a Terra 2. A energia no aquecimento/arrefecimento de natureza diversa; sistemas. – Produção e comunicação de Unidade 2: Energia em movimentos 1. Transferências e transformações de energia raciocínios demonstrativos em situações em sistemas complexos – aproximação ao e em contextos diversificados; modelo da partícula material 2. A energia de sistemas em movimento de – Comunicação de ideias por escrito translação suportes, sobre situações concretas de -Itens de escolha múltipla -Itens de resposta curta -Itens de resposta restrita 40 a 60 As respostas aos itens de resposta curta podem envolver, por exemplo, a apresentação de uma palavra, de uma expressão, de uma frase, de um número, de uma equação ou de uma fórmula. Critérios de Classificação Nos itens de escolha múltipla, a cotação do item só é atribuída às respostas que apresentem de forma inequívoca a opção correta. Todas as outras respostas são classificadas com zero pontos. Nos itens de resposta curta, a cotação do item só é atribuída às respostas totalmente corretas. Poderão ser atribuídas pontuações às respostas parcialmente corretas, de acordo com os critérios específicos de classificação. As respostas aos itens de resposta restrita podem envolver a produção de um texto com apresentação de uma explicação, de uma previsão, de uma justificação 40 a 60 ou de uma conclusão; ou podem envolver a realização de cálculos e a apresentação de justificações ou de conclusões; ou podem requerer a utilização das potencialidades gráficas da calculadora, solicitando, por exemplo, a reprodução de gráficos visualizados na mesma. Química 11º ano Unidade 1: Química e indústria: equilíbrios e desequilíbrios 1.1. O amoníaco como matéria-prima 2015 40 a 60 Nos itens que envolvam a produção de um texto, a classificação das respostas tem em conta a organização dos conteúdos e a utilização de linguagem científica adequada. Nos itens que envolvam a realização de cálculos, a classificação das respostas tem em conta a apresentação das etapas necessárias à resolução do item. Serão penalizados os erros de cálculo (numéricos ou analíticos), a ausência de unidades ou a apresentação de unidades incorretas no resultado final, a ausência de conversão ou a conversão incorreta de unidades, a transcrição incorreta de dados, entre outros fatores de penalização. 1.2. O amoníaco, a saúde e o ambiente 1.3. Síntese do amoníaco e balanço energético 1.4. Produção industrial do amoníaco 1.5. Controlo da produção industrial Unidade 2: Da atmosfera ao oceano: soluções na Terra e para a Terra 2.1. Água da chuva, água destilada e água pura. 2.2. Águas minerais e de abastecimento público: a acidez e a basicidade das águas. 2.3. Chuva ácida 2.3.1. Acidificação da chuva 2.3.2. Impacto em alguns materiais 2.4.Mineralização e desmineralização de águas 2.4.1. A solubilidade e o controlo da mineralização das águas 2.4.2. A desmineralização da água do mar Física 11º ano Unidade 1: Movimentos na Terra e no Espaço 40 a 60 1.1. Viagens com GPS 1.2. Da Terra à Lua Unidade 2:Comunicações 2.1. Comunicação de informação a curtas distâncias 2.2. Comunicação de informação a longas distâncias A prova inclui uma tabela de constantes, um formulário e uma tabela periódica. Ver anexo I. O examinando apenas pode usar, como material de escrita, caneta ou esferográfica de tinta indelével, azul ou preta. O examinando deve ser portador de material de desenho e de medida (lápis, borracha, régua graduada, esquadro e transferidor), assim como de uma calculadora gráfica permitida pela Direção-Geral de Educação*. Não é permitido o uso de corretor. *ver anexo II Os conteúdos pormenorizados podem ser consultados em: file:///C:/Users/Gabriela/Downloads/fisica_quimica_a_10.pdf file:///C:/Users/Gabriela/Downloads/fisica_quimica_a_11.pdf Anexo I- Tabela de Constante, Formulário e Tabela periódica TABELA DE CONSTANTES Velocidade de propagação da luz no vácuo Módulo da aceleração gravítica de um corpo junto à superfície da Terra Constante de Gravitação Universal Constante de Avogadro Constante de Stefan-Boltzmann Produto iónico da água (a 25 °C) Volume molar de um gás (PTN) 8 –1 c = 3,00 × 10 m s -2 g = 10 m s –11 2 –2 G = 6,67 × 10 N m kg 23 -1 NA= 6,02x10 mol σ= 5,67 x 10-8 W m-2 k-4 -14 Kw = 1,00 × 10 3 -1 Vm = 22,4 dm mol FORMULÁRIO • Conversão de temperatura (de grau Celsius para Kelvin)……………………….....................................................………………...… T=θ + 273,15 T- temperatura absoluta (temperatura em Kelvin) θ- temperatura em grau Celsius 𝑚 •Densidade (massa volúmica).................................................................................................................................................... ρ = 𝑉 m – massa V – volume • Efeito fotoelétrico .....................................................................................................................................................................Erad = Erem + Ec Erad – energia de um fotão da radiação incidente no metal Erem – energia de remoção de um eletrão do metal Ec – energia cinética do eletrão removido 𝑛 • Concentração de solução .........................................................................................................................................................c = 𝑉 n – quantidade de substância (soluto) V – volume de solução • Relação entre pH e concentração de H3O+ ................................................................................................................................pH=- log [H3O+] • 1.ª Lei da Termodinâmica......................................................................................................................................................... ∆U = W + Q + R ∆U- variação da energia interna do sistema (também representada por DEi) W – energia transferida, entre o sistema e o exterior, sob a forma de trabalho Q – energia transferida, entre o sistema e o exterior, sob a forma de calor R – energia transferida, entre o sistema e o exterior, sob a forma de radiação • Lei de Stefan-Boltzmann ……………………….……………...............................................................................................................… P = eσ AT4 P- potência total irradiada pela superfície de um corpo e- emissividade da superfície do corpo σ - constante de Stefan-Boltzmann A-área da superfície do corpo T- temperatura absoluta da superfície do corpo Energia ganha ou perdida por um corpo devido à variação da sua temperatura…………………………..………………………………....E=m c ∆ T m – massa do corpo c – capacidade térmica mássica do material de que é constituído o corpo ∆T – variação da temperatura do corpo 𝑄 𝐴 Taxa temporal de transferência de energia sob a forma de calor, por condução ………………………………………………..………….- =k ∆T ∆𝑡 𝑙 Q – energia transferida, sob a forma de calor, por condução, através de uma barra, no intervalo de tempo ∆t k – condutividade térmica do material de que é constituída a barra A – área da secção da barra, perpendicular à direção de transferência de energia l – comprimento da barra ∆T – diferença de temperatura entre as extremidades da barra • Trabalho realizado por uma força constante, 𝑭 que atua sobre um corpo em movimento retilíneo....................................W = Fd cosα d – módulo do deslocamento do ponto de aplicação da força α – ângulo definido pela força e pelo deslocamento • Energia cinética de translação .. ……………………………………………………………………………………………………………………………………..…Ec = 1/2mv2 m – massa do corpo v – módulo da velocidade • Energia potencial gravítica em relação a um nível de referência ...........................................................……………………….……..Ep = m g h m – massa g – módulo da aceleração gravítica junto à superfície da Terra h – altura em relação ao nível de referência considerado • Teorema da energia cinética.......................................................................................................................................................W = ΔEc W– soma dos trabalhos realizados pelas forças que atuam num corpo, num determinado intervalo de tempo ΔEc – variação da energia cinética do centro de massa do corpo, no mesmo intervalo de tempo • Lei da Gravitação Universal ...................................................................................................................................................Fg = Gm1m2/r2 Fg – módulo da força gravítica exercida pela massa pontual m1 (m2) sobre a massa pontual m2 (m1) G – constante de gravitação universal r – distância entre as duas massas • 2.ª Lei de Newton ................................................................................................................................................................ F= ma F– intensidade da resultante das forças que atuam num corpo de massa m . a– módulo da aceleração do centro de massa do corpo • Equações do movimento unidimensional com aceleração constante ................................................................................x =x0 +v0 t + 1/2a t 2 x – valor (componente escalar) da posição v = v0 + at v – valor (componente escalar) da velocidade a – valor (componente escalar) da aceleração t – tempo • Equações do movimento circular com aceleração de módulo constante……………………………………………………………………...ac =v2/r ac – módulo da aceleração centrípeta v – módulo da velocidade linear v=2π.r/T r – raio da trajetória T – período do movimento ω – módulo da velocidade angular ω=2π/T • Comprimento de onda.......................................................................................................................................................... λ = v/f f – frequência do movimento ondulatório v – módulo da velocidade de propagação da onda • Função que descreve um sinal harmónico ou sinusoidal .................................................................................................... y =A sin (ω t ) A – amplitude do sinal ω – frequência angular t – tempo • Fluxo magnético que atravessa uma superfície de área A em que existe um campo magnético uniforme B…………………Φm = BA cosα α – ângulo entre a direção do campo e a direção perpendicular à superfície • Força eletromotriz induzida numa espira metálica................................................................................................................|εi| = |∆Φm|/∆t ΔΦm – variação do fluxo magnético que atravessa a superfície delimitada pela espira, no intervalo de tempo Δt • Lei de Snell-Descartes para a refração ................................................................................................................................... n1 sinα1 = n2 sinα2 n1, n2 – índices de refração dos meios 1 e 2, respetivamente α1, α2 – ângulos entre as direções de propagação da onda e da normal à superfície separadora no ponto de incidência, nos meios 1 e 2, respetivamente Anexo II-Calculadoras gráficas permitidas:
Download