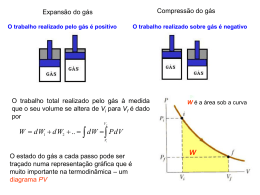
Termodinâmica Calor e a Primeira Lei da termodinâmica Introdução Calor Se pegarmos uma lata de refrigerante e colocarmos sobre a mesa da cozinha, sua temperatura aumentará até que o equilíbrio térmico seja alcançado. Por sua vez se pegarmos uma panela quente e a colocarmos sobre a mesa a sua temperatura diminuirá até que o equilíbrio térmico também seja alcançado. Temos a seguinte situção: a) a cozinha será considerada o ambiente. b) A lata de refrigerante ou a panela quente o sistema. Observação: se 𝑇𝐴 ≠ 𝑇𝑆 , A temperatura do sistema irá mudar até que o equilíbrio térmico seja alcançado. A mudança de temperatura deve-se à troca de energia entre o ambiente e o sistema. Esta energia é a energia interna (ou energia térmica). A energia térmica corresponde à soma das energias cinética e potencial, associadas aos movimentos aleatórios dos átomos, moléculas e outros corpos que fazem parte do sistema. A energia interna transferida é chamada de calor. Seu simbolo é Q. Convenção: a) O calor é positivo quando a energia interna é transferida do ambiente (A) para para o sistema (S). b) O calor é negativo quando a energia intena é transferida do sistema (S) para o ambiente (A). 𝑇𝐴 > 𝑇𝑆 𝑇𝑆 > 𝑇𝐴 𝑸(−) A S 𝑸 (+) A S Medindo o calor Antes da descoberta de que o calor é energia transferida, ele era medido em função da sua capacidade de aumentar a temperatura da água., ou seja, uma “caloria’’ é a quantidade de ccalor necessário para elevar a temperatura de 1g da água de 14,5 ˚C para 15,5 ˚C. Obs: Uma BTU, british thermal unit, é a quantidade calor necessária para elevar 1 libra de água de 63˚F para 64 ˚F Em 1948, a comunidade científica definiu que o calor deveria ser expresso em unidades de energia. Assim 1 cal= 4,1860 J exatamente e sem referência ao aquecimento da água. 1 𝐽 = 0,2389 𝑐𝑎𝑙 = 9,481 × 10−4 𝐵𝑡𝑢 Capacidade Calorífica A capacidade calorífica de um corpo ou objeto é uma constante de proporcionalidade entre o calor e a variação de temperatura que esta mesma quantidade de calor produzida no corpo. 𝑄 = 𝐶 ∆𝑇 = 𝐶(𝑇𝑓 − 𝑇𝑖 ) Calor específico A capacidade calorífica de um corpo, C, depende da quantidade de nassa do corpo. Portanto é conveniente usarmos uma quantidade calorífica específica ou C/m, que é referida a uma unidade de massa do corpo. 𝑄 = 𝑐𝑚 ∆𝑇 ∴ 𝑐 = 𝐶/𝑚 Calores Específicos de algumas substâncias à Temperatura Ambiente Substância Sólido Calor específico cal/g.˚C Calor específico molar J/Kg.K J/mol.K Chumbo 0,0305 128 26,5 Prata 0,0564 236 24,8 Cobre 0,0564 386 24,5 Água doce 1,00 4,190 Água salgada 0,93 3,900 Latão 0,092 380 Vidro 0,20 840 Líquido Outros materiais Calor de transformação Quando o calor é absorvido ou cedido por um sólido, líquido ou gás a temperatura do corpo não necessariamente varia. Neste caso temos uma transição de fase. O corpo muda o seu estado físico de uma fase para outra. Por exemplo o gelo ao derreter absorvendo calor, e a água ferver sem mudança de temperatura. Neste caso temos o calor de transformação L. 𝑸 = 𝑳𝒎 Calores de transformação T(fusão) Calor de Fusão T(ebulição) Calor de Vaporização Substância (K) (kJ/kg) (K) (kJ/kg) Água 273 333 373 2256 Prata 1235 105 2323 2336 Mercúrio 234 11,4 630 296 A primeira Lei da Termodinâmica O fluxo de calor é uma das maneiras pela qual um sistema pode ganhar ou perder energia para o ambiente ou vizinhança. Mas existe também uma outra maneira que é quando o sistema realiza trabalho sobre a vizinhança mas não há fluxo de calor. Quando o sistema realiza trabalho sobre a vizinhança dizemos que este trabalho é positivo. Quando a vizinhança realiza trabalho sobre o sistema dizemos que este trabalho é negativo. Assim: a) ∆𝑈 = 𝑊 + → 𝑈𝑓 > 𝑈𝑖 b) ∆𝑈 = 𝑊 − → 𝑈𝑓 < 𝑈𝑖 Se considerarmos que simultaneamente nestes processos há troca de calor entre a vizinhança e o sistema e trabalho pode ser realizado temos: ∆𝑈 = 𝑄 − 𝑊 Obs: a variação de energia interna não depende do tipo de processo que ocorre entre o sistema e a vizinhança Exemplos de Processos casos especiais Primeira Lei da Termodinâmica: casos especiais ∆𝐸 = 𝑄 − 𝑊 Processo Restrição Resultado Adiabático 𝑄=0 ∆𝐸 = −𝑊 Volume constante 𝑊=0 ∆𝐸 = 𝑄 Ciclo fechado ∆𝐸 = 0 𝑄=𝑊 Expansão livre Q=𝑊 ∆𝐸 = 0 Processo Adiabático Iso Volumétrico Expansão livre Tranferência de calor Convecção É o processo no qual o calor é levado de um lugar para outro através do movimento de camadas de um fluido. Condução de calor No proceso de condução de calor não há movimento de material tomando parte no processo de tranferência. Radiação
Download