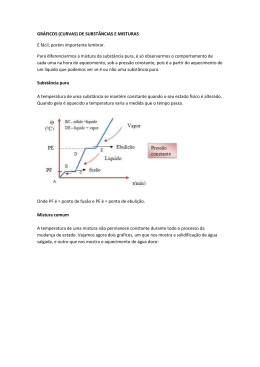
DISCIPLINA: QUÍMICA Professoras: Camila e Ayla MATÉRIA Matéria é tudo o que tem massa e ocupa lugar no espaço. Exemplos: a Terra, os mares, o Sol, a Lua, o vento, o barro, as plantas, ou seja, tudo o que forma o Universo é matéria. A matéria pode se apresentar nos estados sólido, líquido ou gasoso. O seu aquecimento ou resfriamento pode levar a uma mudança de estado físico. MUDANÇAS DE ESTADO FÍSICO As mudanças de estado físico recebem nomes conforme mostra o esquema abaixo: fonte:www.sobiologia.com.br CURVA DE AQUECIMENTO E CURVA DE RESFRIAMENTO Curva de aquecimento e resfriamento é o gráfico que mostra a variação de temperatura de uma amostra,em função do tempo, quando aquecida ou resfriada, incluindo-se as mudanças de estado físico. fonte:www.gsmfans.com.br fonte:www.gsmfans.com.br PONTOS DE FUSÃO E EBULIÇÃO Temperatura de fusão é a temperatura constante na qual uma substância passa do estado sólido para o estado líquido. Qualquer amostra de uma substância se funde à mesma temperatura. Temperatura de ebulição é a temperatura na qual uma substância líquida, ao receber calor, passa para o estado gasoso. DENSIDADE Relação entre massa e volume; informa qual a massa de um material por unidade de volume. d= m/v SUBSTÂNCIAS QUÍMICAS Uma substância é uma porção de matéria que tem propriedades bem definidas e que lhe são características. Dentre essas propriedades, estão o ponto de fusão, o ponto de ebulição, a densidade, a cor, o odor etc. Duas substâncias diferentes podem, eventualmente, possuir algumas propriedades iguais, mas nunca todas elas. Caso aconteça de todas as propriedades de duas substância serem iguais, então elas são, na verdade, a mesma substância. SUBSTÂNCIAS PURAS E MISTURAS Uma substância pura, como o próprio nome diz, está pura, não está misturada com outra substância ou com outras substâncias. Já uma mistura é uma porção de matéria que corresponde à adição de duas ou mais substâncias puras. A partir do momento em que elas são adicionadas, deixam obviamente de ser consideradas substâncias puras. Elas passam a ser as substâncias componentes da mistura. MISTURAS HOMOGÊNEAS E MISTURAS HETEROGÊNEAS Uma mistura heterogênea é uma mistura que não possui as mesmas propriedades em toda a sua extensão. Uma mistura homogênea é uma mistura que tem as mesmas propriedades em todos os seus pontos. Uma mistura homogênea apresenta uma só fase e uma mistura heterogênea apresenta duas ou mais fases. PROCESSOS DE SEPARAÇÃO DE MISTURAS 1) Decantação Mistura heterogênea sólido-líquido; Diferença de densidades; Exemplo: água e areia. 2) Centrifugação Mistura heterogênea sólido-líquido; Diferença de densidades; Caso a separação sob a ação da gravidade seja muito lenta, ela pode ser apressada submetendo a mistura a uma intensa rotação, técnica conhecida como centrifugação, realizada em aparelhos denominados centrífugas. fonte: www.brasilescola.com 3) Filtração simples Misturas heterogêneas sólido/líquido; Exemplo: água e areia. Fonte: www.infoescola.com 4) Funil de separação Misturas heterogêneas líquido/líquido; Os líquidos são imiscíveis (não se misturam); Diferença de densidade; Exemplo: água e óleo. Fonte: fisicoqui.blogs.sapo.pt 5) Dissolução fracionada Misturas heterogêneas de dois ou mais sólidos; Diferença de solubilidade num dado solvente (apenas um dos componentes se dissolve em um dado solvente). Fonte: www.flogao.com.br 6) Evaporação Mistura de líquidos e sólidos, O líquido da mistura se evapora com facilidade; Exemplos: processo utilizado nas salinas brasileiras para retirar o sal da água do mar; na secagem de roupa no varal. Fonte:http://www.brasilescola.com/quimica/separaca o-destilacao-e-evaporacao.htm Fonte: http://www.brasilescola.com/quimica/separacaodestilacao-e-evaporacao.htm 7) Destilação simples Mistura homogênea sólido/líquido; É importante que os pontos de ebulição das duas substâncias sejam bastante diferentes; Exemplo: água e sal. Fonte: www.infoescola.com REFERÊNCIAS BIBLIOGRÁFICAS PERUZZO, F.M.; CANTO, E.L. Química na abordagem do cotidiano. São Paulo, Moderna,4ª ed., vol. 1, 2010. NÓBREGA, O.S; SILVA, E.R; SILVA, R.H. Química. São Paulo, Ática, 1ª ed., vol. Único, 2007.
Download