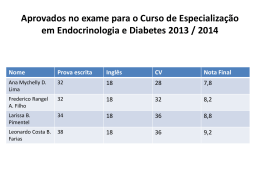
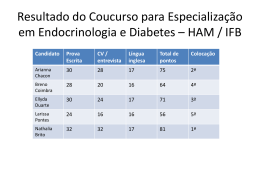
Química Geral AULA 5 – TABELA PERIÓDICA E PROPRIEDADES PERIÓDICAS PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 1 Tópicos Introdução Construção da tabela moderna Incrementos Volume atômico Densidade absoluta Potencial de Ionização Eletronegatividade A tabela periódica Períodos Famílias Divisão dos metais Propriedades da tabela Raio atômico PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 2 Introdução Com o crescente número de elementos químicos no início do século XIX, houve a necessidade de se criar uma organização para esses elementos. Algumas tentativas: Johannes Dobereiner, séc. XVIII – elementos organizados em tríades. John Newlands, séc. XVIV – elementos organizados em ordem de massa crescent em oitavas. PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 3 Construção da tabela periódica moderna Julius Meyer e Dmitri Mendeleev, séc. XIV, organizaram os elementos de acordo com a massa atômica e algumas outras propriedades dos elementos químicos, como o volume molar. Fonte: Averill, 2011 PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 4 Alguns incrementos… William Ramsay, 20 anos depois da descoberta de Mendeleev, incrementou a tabela com os gases nobres, como o argônio. Moseley através de experimentos descobriu que a ordem correta seria por número atômico (Z). PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 5 A tabela! (finalmente) Famílias, grupos ou colunas Períodos ou níveis PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 6 Períodos Fonte: Feltre, 2004 PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 7 Famílias Observação: o hidrogênio (H) não faz parte do família dos metais alcalinos (1 ou 1A). PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 8 Divisão dos metais Fonte: Feltre, 2004 PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 9 Divisão quanto aos subníveis A figura mostra os elementos quanto aos subníveis de valência. Fonte: Feltre, 2004 PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 10 Propriedades da tabela periódica Periódicas: aumentam quando se aumenta o número atômico. Ex.: raio atômico, volume, densidade absoluta, temperatura de fusão e ebulição, energia de ionização. Aperiódicas: diminuem quando se aumenta o número atômico. Ex.: calor específico PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 11 1. Raio atômico É medido através dividindo-se a distância entre dois núcleos do mesmo átomo por dois. Fonte: Feltre, 2004. PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 12 2. Volume atômico Referente a 1 mol (6.022 x 1023 moléculas) do elemento do estado sólido. Fonte: Feltre, 2004. PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 13 3. Densidade absoluta Relação entre a massa e volume de um elemento. Fonte: Feltre, 2004. PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 14 4. Ponto de fusão e ebulição Carbono é uma exceção, possui ponto de fusão de 3800 oC. Tungestênio (W) tem o maior PF (3400 oC). Fonte: Feltre, 2004. PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 15 5. Potencial de ionização Força para retirar um elétron de um átomo. Referente ao elétron de valência. Fonte: Feltre, 2004. PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 16 6. Eletronegatividade É definida como a tendência de um átomo para atrair elétrons. Observem que é proporcionalmente inverso ao raio atômico PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 17 Questão 1 PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 18 Questão 2 PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 19 Questão 3 PROF. LARISSA ROCHA ALMEIDA - CURSINHO VITORIANO 20
Download