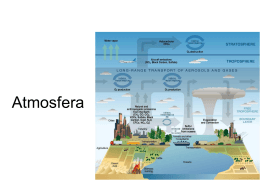
A QUIMICA DO AMBIENTE Lucas Ribeiro Fortes Rômulo de Paiva e Silva Sumário • • • • • • • • Introdução A atmosfera terrestre Regiões externas da atmosfera O ozônio na atmosfera superior A química na troposfera O oceano do mundo A água doce Química verde Introdução O desenvolvimento econômico depende criticamente dos processos químicos, alguns dos quais bastante prejudiciais ao ambiente. Analisaremos a natureza da atmosfera e hidrosfera terrestres a fim de indicar as alterações no respectivo comportamento químico provocadas por nossas ações. A atmosfera terrestre Dividida em quatro regiões: • Com o aumento de altitude a temperatura diminui na troposfera e aumenta na estratosfera. • Sua composição não é uniforme. • 99% da atmosfera é constituída de N2 e O2. • O O2 é muito mais reativo que o N2. Troposfera e Estratosfera • Possuem 99,9% da massa total da atmosfera. • Em toda a atmosfera ocorre a diminuição da pressão de acordo com o aumento de altitude. • Na troposfera ocorrem os fenômenos associados ao “tempo”. Nuvens Chuvas Vento Regiões externas da atmosfera A região superior à estratosfera constitui uma defesa contra a radiação e as partículas de grande energia que incidem continuamente sobre o planeta. Nessa interação, as moléculas e os átomos na atmosfera superior sofrem transformações químicas. Fotodissociação Ruptura de uma ligação química provocada pela absorção de um fóton por uma molécula. O2 ( g ) h 2 O( g ) • A energia dos fótons deve ser suficiente para desencadear o processo químico. • As moléculas devem absorver estes fótons. • O O2 absorve boa parte da radiação proveniente do sol, antes que possa atingir o solo. oxigênio atômico mais abundante que O2 400km 50% de oxigênio atômico e 50% de O2 130km O2 mais abundante que oxigênio atômico • A energia de dissociação do N2 é muito alta. • O N2 não absorve facilmente os fótons. • Pouco nitrogênio atômico é formado na atmosfera externa. Fotoionização • Os elétrons existentes na atmosfera superior provêm da fotoionização das moléculas provocadas pela radiação solar. • Para que ocorra, a molécula tem que absorver um fóton com energia suficiente para remover um elétron. N2 h N e 2 Os comprimentos de onda desses fótons estão na região do ultravioleta e eles são completamente filtrados da radiação que atinge o solo, em virtude desses processos de absorção. O ozônio na atmosfera superior • Entre 30 e 90 km de altitude os átomos de O colidem frequentemente com as moléculas de O2, provocando a formação do O3. O( g ) O2 ( g ) O ( g ) * 3 • O asterisco indica que a molécula de O3 está com excesso de energia, que deve ser afastada rapidamente da molécula, senão o ozônio se decompõe em O e O2, num processo inverso. • A molécula pode perder esse excesso de energia nas colisões com outros átomos ou moléculas. O ( g ) M( g ) O3 ( g ) M ( g ) * 3 * A velocidade de formação do O3 depende de dois fatores: • Presença de átomos de O (grandes altitudes). • Grande concentração de moléculas para favorecer os choques entre O e O2 e entre O3 e M (baixas altitudes). • Em virtude dessa dependência de fatores, a velocidade de formação do O3 tem um máximo numa camada a uma altura da ordem de 50 km, perto da estratopausa. • O ozônio pode absorver radiação solar, decompondo-se em O e O2. • Se não fosse pela camada de ozônio na estratosfera, fótons de alta energia atingiriam a superfície da Terra e a vida animal e vegetal não poderia sobreviver na presença dessa radiação de alta energia. Destruição da camada de ozônio Clorofluorcarbonos • Utilizado em latas de spray, como gases refrigerantes, condicionamento de ar e como agentes espumantes para plásticos. • Praticamente não reativos na atmosfera mais baixa. • Relativamente insolúveis em água, por isso não são removidos da atmosfera através da chuva. • A falta de reatividade permite que eles sobrevivam na atmosfera e difundam-se eventualmente para a estratosfera. • Na estratosfera, devido à radiação, as ligações C – Cl são quebradas, formando átomos de cloro livres com facilidade. • Os átomos de cloro reagem rapidamente com o ozônio para dar monóxido de cloro e oxigênio molecular. Cl( g ) O3 ( g ) ClO( g ) O2 ( g ) • Em certas condições as moléculas de ClO podem regenerar os átomos de Cl livres, que podem assim reagir com mais O3. O buraco na camada de ozônio Que susbstâncias podem substuituir os CFCs? • Até o momento os hidrofluorcarbonetos são as principais alternativas. • Mudar dos CFCs para alternativas como os HFCs é caro. • Os substitutos do CFC atual são menos eficientes em relação à refrigeração, necessitando de um pouco mais de energia para igualá-los. Química na troposfera Compostos de enxofre • Concentração natural muito pequena diante das concentrações acumuladas em ambientes urbanos e industriais. • A combustão de carvão e de óleo é responsável por mais de 80% do total de SO2 presente na atmosfera. • O SO2 pode ser oxidado a SO3, que quando se dissolve na água, forma ácido sulfúrico. SO3 ( g ) H2O( l ) H2SO4 ( aq ) • É principalmente a presença de SO2 e de H2SO4, na atmosfera que provoca o fenômeno da chuva ácida. • Óxidos de nitrogênio, que formam o ácido nítrico, também contribuem para a chuva ácida. • A acidez afeta muitas formações lacustres, reduzindo a população de peixes e afetando toda a comunidade ecológica das florestas vizinhas ao lago. • A chuva ácida reage com metais e com carbonatos e ataca, por isso, os materiais metálicos e muitos materiais de construção civil. • Remoção do SO2 dos gases da combustão através da injeção de calcário. CaCO3 ( s ) CaO( s ) CO2 ( g ) • O CaO reage com o SO2 e forma sulfito de cálcio. CaO( s ) SO2 ( g ) CaSO3 ( s ) • As partículas sólidas de CaSO3 e boa parte do SO2 inalterados são removidos do gás da combustão por uma suspensão aquosa de cal. Monóxido de carbono • É o mais abundante dos gases poluentes. • É incolor e inodoro. • Oferece risco à saúde humana, pois tem uma afinidade 210 vezes maior com a hemoglobina do que o O2. • Quantidades relativamente pequenas de CO podem inativar frações significativas de hemoglobina no sangue e prejudicar o transporte de oxigênio, podendo levar à morte. Óxidos de nitrogênio e névoa fotoquímica • O NO forma-se nos motores de combustão interna. N2 ( g ) O2 ( g ) 2NO( g ) • Os óxidos de nitrogênio são os componentes principais das névoas urbanas. • No ar, o NO é oxidado a NO2, que inicia as reações associadas com a névoa fotoquímica. • O ozônio é componente chave da névoa fotoquímica. • É um poluente indesejável na troposfera. • Também é extremamente reativo e tóxico. • Problema: diminuição na estratosfera e aumento na troposfera. • A redução da névoa exige que os ingredientes essenciais para sua formação sejam removidos das descargas dos automóveis. • Os conversores catalíticos são desenvolvidos para reduzir drasticamente os níveis desses ingredientes. Vapor de água, dióxido de carbono e clima • A atmosfera é essencial para manter a temperatura da Terra. • O dióxido de carbono e o vapor de água são os componentes atmosféricos mais importantes na manutenção da temperatura. • O planeta está em equilíbrio térmico, isto quer dizer que a Terra irradia energia para o espaço numa taxa igual à que absorve. • Esses gases atmosféricos absorvem muito da radiação que sai da superfície da Terra. • A influência dos gases atmosféricos na temperatura da Terra é chamada efeito estufa. • A queima mundial de combustíveis fósseis tem aumentado visivelmente o nível de CO2. • Esse aumento, de acordo com alguns cientistas, já está interferindo no clima da Terra. Metano como gás de efeito estufa • Cada molécula de CH4 tem aproximadamente 25 vezes o efeito estufa de uma molécula de CO2. • O CH4 é formado em ambientes com pouco oxigênio. • Bactérias anaeróbicas que florescem nos pântanos, aterros sanitários, próximas das raízes do arroz e no sistema digestivo dos animais ruminantes, produzem metano. • Também escapa na extração e transporte de gás natural. • Na troposfera o metano é atacado por espécies reativas como radicais OH, ou óxidos de nitrogênio, eventualmente produzindo outros gases de efeito estufa, como o O3. • Reduções importantes do efeito estufa poderiam ser atingidas pela redução das emissões do metano ou capturando-se as emissões para uso como um combustível. O oceano do mundo • • • • Água do mar 97,2% da água está no oceano do mundo. A salinidade da água do mar é em média 35 g/L. Existem muitas substâncias dissolvidas no oceano, mas ele não é usado como fonte de matéria prima, pois o custo de extração é muito alto. Somente 3 substâncias são retiradas em quantidades significativas da água do mar: cloreto de sódio, bromo e magnésio. Dessalinização • A água do mar é imprópria para o consumo humano devido ao seu alto teor de sal. • O processo para remover o sal da água e tornála própria para o consumo é chamado de dessalinização. • Pode ser feita por destilação ou por osmose invertida. Água doce • Um adulto precisa beber aproximadamente 2 litros de água por dia, mas consumimos uma média de 300 litros por dia. • Quando usamos água, ela se torna carregada com materiais adicionais dissolvidos, inclusive dejetos da sociedade humana. • Se a população e a produção de poluentes ambientais aumentam, verificamos que devemos gastar quantidades cada vez maiores de recursos financeiros para garantir o fornecimento de água doce. Oxigênio dissolvido e qualidade da água • A quantidade de O2 na água é um importante indicador de sua qualidade. • As bactérias aeróbicas consomem oxigênio para oxidar os materiais biodegradáveis. • Quantidades excessivas de materiais biodegradáveis prejudicam a vida animal. • Sem oxigênio, bactérias anaeróbicas prosperam e produzem substâncias que causam mal cheiro. • O nitrogênio e o fósforo estimulam o crescimento desmesurado de plantas, o que contribui para a proliferação de algas e a turvação das águas. • À medida que se desenvolvem as plantas, aumenta também a quantidade de matéria vegetal morta e em decomposição, o que é chamado de eutroficação. • Os vegetais decadentes consomem O2, por serem biodegradáveis, levando à exaustão do O2 na água. O que torna insustentável a manutenção da vida animal. • As fontes mais importantes de nitrogênio e fósforo são: esgotos domésticos, agricultura e pecuária. Tratamento de fontes de água municipais • Boa parte da água da rede de abastecimento é água “usada”, isto é, a água que já circulou por um ou mais de um sistema de esgotos ou de processos industriais. • Essa água deve receber tratamento apropriado antes de ser consumida. • Etapas: filtração grossa, sedimentação, filtração em areia, aeração e esterilização. • • • • Abrandamento da água 2 2 Ca Mg A água com íons e e outros cátions divalentes é chamada água dura. Embora a presença desses íons não seja prejudicial à saúde, eles tornam a água imprópria para o uso doméstico e industrial. A água com os íons cálcio e bicarbonato perde dióxido de carbono ao ser aquecida, liberando CaCO3, que reveste a superfície de sistemas de água quente e chaleiras, reduzindo a eficiência de aquecimento. Esses depósitos são chamados de crostas ou incrustações. • A remoção desses íons é chamada abrandamento da água. • O processo calcário-barrilha é bastante adotado no processo de abrandamento. A água é tratada com calcário, CaO e cinzas de barrilha, Na2CO3. • Existe também o processo da troca iônica, em que a água dura passa por um leito de resina de troca iônica. • Nesse processo, um íon é trocado por outro. • A água amaciada dessa forma contém maior Na concentração de íons . • Não é recomendado que pessoas que sofram de hipertensão bebam desta água. • Para regenerar a resina, ela é limpada com jatos de solução de NaCl concentrada. Abrandamento por troca iônica Química verde • Promove o desenvolvimento e aplicação de produtos e processos químicos compatíveis com a saúde humana que preservam o meio ambiente. • É melhor evitar os rejeitos do que tratá-los. • As substâncias geradas devem possuir pouca ou nenhuma toxidade à saúde humana e ao ambiente. • Substâncias tóxicas devem ser transformadas em inócuas quando possível. Solventes e reagentes • O uso de compostos orgânicos voláteis, como solvente para reações, é motivo de preocupação nos processos químicos. • O solvente não é consumido na reação, mas existem liberações inevitáveis para a atmosfera. • Ele pode ser tóxico ou se decompor durante a reação, criando rejeitos. • O uso de fluidos supercríticos representa uma maneira de substituir o solvente convencional por CO2. Outros processos • A lavagem a seco de roupas usa solventes que podem provocar câncer. O uso desses solventes tem contaminado a água do subsolo. Há um método alternativo que usa CO2 supercrítico. • As carrocerias metálicas são revestidas para prevenir a corrosão. Uma das etapas-chave é a eletrodeposição de uma camada de íons. No passado era usado o chumbo, mas por ele ser altamente tóxico, seu uso tem sido eliminado. Purificação da água • A desinfecção da água é uma das maiores inovações em saúde pública. • Tem diminuído drasticamente os índices de doenças causadas por bactérias provenientes da água. • A cloração da água produz um grupo de produtos secundários que são chamados de trialometanos (THMs). • Alguns THMs são cancerinógenos e outros interferem no sistema endócrino. • Apesar disso, é viável o uso dos THMs pois há uma incidência muito maior de cólera e tifo do que câncer causado por eles. Referências bibliográficas • QUÍMICA: A Ciência Central – 7ª. edição • QUÍMICA: A Ciência Central – 9ª. edição • www.google.com
Download