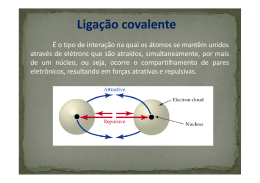
Disciplina de Física e Química - 10º Ano Preparação 2º Miniteste Sumativo (Módulo Q1+ EQ1) 1. Para cada uma das afirmações selecione a opção correta: 1.1. Os átomos numa molécula de cloreto de hidrogénio (HCl) estão ligados por uma ligação: A - covalente apolar; B - covalente polar; C - iónica; D - covalente dupla. 1.2. Numa molécula de dióxido de carbono, o número total de eletrões ligantes é: A- 2 B- 4 C- 8 D - 10 1.3. Numa molécula de água, o número total de eletrões não ligantes é: A– 4 B–2 C–6 D- 8 1.4. A ligação que apresenta menor polaridade é: A - N-H B - C-H C - O-H D - C-F 1.5. Quando a diferença de eletronegatividade entre dois átomos diminui, a tendência para formar ligações covalentes: A – diminui B – aumenta C – mantêm-se D – diminui acentuadamente 1 1.6. O comprimento de ligação: A – é menor quanto menor for a energia de ligação B – não se relaciona com a energia de ligação C – é menor quanto maior for a energia de ligação D – não se altera com o aumento da energia de ligação 2. Para cada uma das espécies químicas representadas pelas respetivas fórmulas químicas indique a geometria da molécula: a – NH3 piramidal Trigonal b – CH4 tetraédrica c – H2O a n g u l a r d– CS2 angular e – BF3 Tetraédrica f - H2S a n g u l a r g - CCl4 t e t r a é d r i c a h – H2 L i n e a r 3. Classifique as seguintes afirmações em verdadeiras (V) ou falsas (F): A - O comprimento de ligação corresponde à distância entre os núcleos de dois átomos, em que há equilíbrio entre forças de atração e forças de repulsão. V B - Uma ligação covalente baseia-se na partilha de eletrões entre os átomos envolvidos. F C - Uma ligação covalente entre dois átomos iguais é polar quer seja simples, dupla ou tripla. F D – Todas as moléculas com geometria linear plana são apolares. F E – As moléculas com geometria piramidal são sempre apolares. F F – Nas moléculas diatómicas, homonucleares, a diferença de eletronegatividades é nula. V G – O ângulo de ligação numa geometria triangular plana é de 90º. F H - A molécula de F2 é apolar, mas a molécula de HF é polar. V 4. A fórmula química da molécula de metano é CH4. 4.1. Represente, em notação de Lewis, a molécula 4.2. Escreva a fórmula de estrutura da molécula. 2 5. Estabeleça a associação correta entre as duas colunas: Coluna I Coluna II A - H2S 1- Apresenta uma ligação covalente dupla apolar B - O2 2 - Apresenta uma ligação covalente simples apolar C - N2 3 - Apresenta duas ligações covalentes simples polares D - H2 4 - Apresenta uma ligação covalente tripla apolar E – CO2 5 – Apresenta duas ligações covalentes duplas polares 6. Em relação à ligação iónica complete as frases seguintes de modo a obter afirmações cientificamente corretas. A – Entre as unidades estruturais de um sal há troca de eletrões. B– Nos sais, a ligação química estabelece-se à custa de uma atração eletrostática entre partículas com cargas de sinal contrário. C – Na rede cristalina, a carga elétrica total dos catiões anula a carga elétrica total dos aniões. D - Num composto iónico existe sempre um elemento de baixa energia de ionização e outro de elevada eletronegatividade. DADOS: 3 Elemento H N O Na Mg Cl Si F C Número atómico 1 7 8 11 12 17 14 9 6 Eletronegatividade 2,1 3,0 3,5 0,9 1,2 3,0 1,9 4,0 2,5
Download