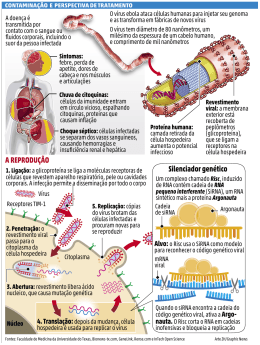
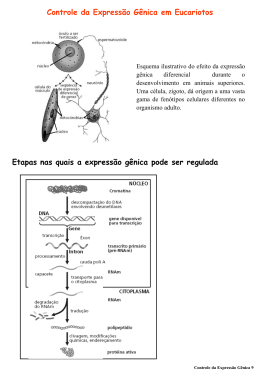
Antes da descoberta dos siRNAs oligonucleotídeos antisenso (ASO) eram usados para silenciar genes Zamecnik PC and Stephenson ML, 1978: oligonucleotídeos como agentes antisenso para inibir replicação viral. 1 – Oligonucleotídeo antisenso (tipicamente 20 nts) (não há um mecanismo biológico de reconhecimento da fita antisenso) Mecanismo de silenciamento: Clivagem RNase H CAP AAAA mRNA DNA ou Ribossomo Bloqueio da tradução CAP AAAA DNA mRNA O que precisamos para usar RNAi? •A seqüência de uma porção do gene alvo •Sintetizar a molécula de dsRNA correspondente •Introduzir o RNA na célula ou organismo Atualmente, siRNA é o instrumento mais poderoso para estudos de genética reversa. Como pode ser produzido o siRNA? - Síntese química: . dsRNA com 21 nt, sendo 2 nt 3’ overhang - Transcrição in vitro a partir de DNA seguida de digestão enzimática e purificação. - Em vetor de expressão (plasmídeo ou vírus): Transcrição e processamento são feitos dentro das células Regras empíricas para desenho de siRNAs (Tuschl) • siRNs devem ter 21-nt senso e 21-nt anti-senso, pareados de tal modo que resulte em 2-nt 3’ dTdT overhang • A região alvo é selecionada no cDNA a partir de 50 a 100 nt à frente do sítio de início de transcrição; 3’UTR também pode ser um bom alvo. • Os nucleotídeos 1-19 do siRNA senso correspondem à posição 3-21 dos 23 nt do alvo. • O alvo selecionado não deve ter mais que 50% de GC • siRNA não deve ser complementar a outros mRNAS. • Propriedades termodinâmicas do siRNA: A estabilidade relativa das extremidades do siRNA é um parâmetro essencial na escolha da fita que será incorporada no complexo RISC 5’ 3’ 5’ 3’ Kurreck J (2.006) A variabilidade na eficácia do siRNA pode ser devida à variabilidade na escolha da fita guia e à inacessibilidade do alvo: A estrutura da fita guia do siRNA também é importante Kurreck J (2.006) Estruturas secundárias no mRNA ou interação com outras proteínas também podem impedir a interação do complexo RISC com o mRNA alvo. Previsão de estruturas secundárias no mRNA: http://www.bioinfo.rpi.edu/applications/mfold http://sfold.wardsworth.org/index.pl Experiência acumulada com oligos antisense (ASO) foi muito útil para siRNAs Modificações para aumentar a estabilidade: Meia-vida em humanos: ~ 9 – 10 h (não modificado: 1 h) Forma pareamento usual Watson-Crick Menos tóxicos e com afinidade levemente maior que PS-ASO Ativa RNase H Terceira Geração de ASO A maioria não ativa RNase H siRNA sintéticos Transcrição in vitro do dsRNA Transcrição in vitro do dsRNA Transcrição in vitro do shRNA Uso de vetores para expressão do shRNA Yang Shi (PNAS 99:5515-5520,2002), Construiu um vetor para expressão de shRNA: plasmídeo Blue Script modificado pela inserção do promotor U6, que controla a transcrição do siRNA Término de transcrição U6 TTTTT A seqüência codificante para sintetizar o siRNA é escolhida dentro da seqüência codificante do gene que se quer silenciar. pBS/U6 Kim DH e Rossi JJ, 2007 Promotores para RNA polimerase II: expressão condicional em tempo e local específicos Eletroporação Lipofecção Retrovirus Transfecção em células que fazem o empacotamento Vetores Virais Kim DH e Rossi JJ, 2007 Quando usar siRNA sintético? Duração necessária do silenciamento não passa de 5 a 7 dias. Efeito adequado em 2 a 3 dias. Silenciamento mais longo: expressar shRNA Silenciamento de 1 semana ou menos: Células imortalizadas aderentes à placa de cultura: - siRNA sintetizado quimicamente - Transfecção Cultura primária e células em suspensão: - siRNA sintético - Eletroporação Células muito diferenciadas: - Vetor viral expressando shRNA - Infecção Silenciamento de 1 semana ou mais: Células imortalizadas aderentes: - Vetor (plasmídeo) expressando shRNA com gene de resistência a antibiótico para deleção de expressão estável - Transfecção Cultura primária, células em suspensão ou muito diferenciadas: - Vetor Viral - Infecção Direcionamento do siRNA para a célula alvo Métodos não seletivos: - siRNA modificados conjugados a colesterol - partículas lipossomais (Stable Nucleic Acids Lipid Particles – SNALPs) Kim DH e Rossi JJ, 2007 Métodos seletivos - siRNAs ligados a haptâmeros reconhecidos receptores em células específicas Kim DH e Rossi JJ, 2007 Métodos seletivos - siRNAs ligados a fragmento da cadeia pesada de anticorpos (Fab) - Nanopartículas Kim DH e Rossi JJ, 2007 Detecção do silenciamento: - Análise da quantidade de mRNA específico (24 a 48 horas) RT-PCR em tempo real - Análise da presença da proteína (48 a 72 h, dependendo da meia vida da proteína) Western blot, imunohistoquímica, imunocitoquímica, imunoensaio … Alguns problemas identificados: – O siRNA pode não ser seletivo e pode ligar-se a outros mRNA na célula (off-target effects). - Resposta imune (ativação de Toll like receptors – TRLs) - O alto nível de expressão de shRNA pode competir pela interação com os complexos que processam miRNA endógenos. - shRNA transcritos pela RNA polimerase III tem trifosfato na extremidade 5’ e esse pode ativar RIG (retinoic acid-inducible protein). Isso pode ser evitado se é usada RNA polimerase II. Controles experimentais ao usar siRNA: - Células não transfectadas - Células transfectadas com siRNA sem alvo - Controles positivos: siRNAs para genes constitutivamente expressos siRNA já testado para gene que participa da via metabólica analisada Testar mais de um siRNA para o gene alvo (em geral 3) Não é conveniente usar pool de siRNAs Outros controle: Eficiência de incorporação do siRNA pela célula siRNA marcado - Cy3, FAM Ao quantificar o mRNA e a proteína na célula tratada com siRNA, avaliar também um gene de expressão constitutiva (GAPDH, b-actina ...) Normalizar a quantidade de proteína pelo número de células viáveis. O processo não deve reduzir a viabilidade celular em mais que 30%. siRNA é considerado eficiente se reduz o mRNA em no mínimo 70% e a proteína em no mínimo 50% Kim DH e Rossi JJ, 2007 miRNAs Pelo menos 1/3 dos genes humanos parecem ser alvos de regulação por miRNAs. A combinação única de miRNAs em cada tipo de célula determina o uso dos milhares de mRNAs. Identificação de alvos: Alvos de miRNA tendem a ser preservados entre as espécies Friedman RC et al, 2009 Xiao F at al, 2009 Método mais usado para identificar alvos de miRNAs: . Vetores contendo gene repórter (Ex. Luciferase) . O 3´UTR do suposto mRNA alvo é clonado na frente do gene repórter . Vetor recombinante é transfectado na célula de interesse com ou sem o miRNA . Localização da sequência alvo no 3´UTR (MRE - miR responsive element) através de mutação sítio-dirigida. . Quantificação da Luciferase . Quantificação do mRNA alvo por RT-PCR Karginov FV et al, 2007 . Expressão do miRNA (pre ou pri-miRNA em vetores) e análise dos mRNAs . Imunoprecipitação da Ago2 carregada com miRNAs Purificação do miRNA Amplificação com oligo- específico (PCR) Marcação fluorescente Hibridização de micro-array Para identificação de alvos, o miRNA pode ser também "down regulated" utilizando oligonucleotídeos complementares quimicamente modificados (antagomir) ou siRNA dirigido ao miRNA. Extração de pequenos RNAs - (Ambion) RNAs pequenos PCR com primer com estrutura hairpin para detectar e quantificar miRNAs
Download